Окись этилена
Содержание
Введение
. Физико-химические основы процесса
.1 Характеристика основного продукта
.2 Характеристика реакционного
процесса
.3 Термодинамический анализ процесса
.4 Сведения о механизме и кинетике
протекающих реакций
.5 Анализ промышленных технологий
синтеза оксида этилена
. Обоснование выбора оптимальных
условий процесса
.1 Связь селективности с кинетикой
. Программа на языке QBASIC
. Результаты программы
Заключение
Список литературы
ВВЕДЕНИЕ
Окись этилена является в настоящее время
крупнейшим по масштабу производства продуктом нефтехимического синтеза. Окись
этилена - важнейшее сырьё, используемое в производстве крупнотоннажной
химической продукции, являющейся основой для большого числа разнообразных
товаров народного потребления во всех промышленно развитых странах. Основные
направления использования окиси этилена:
этиленгликоли - используются в качестве
антифризов, в производстве полиэстера, полиэтилентерефталата (ПЭТ - сырьё для
пластиковых бутылок), агентов для осушения газов, жидких теплоносителей,
растворителей и пр.;
полиэтиленгликоли - используются в производстве
парфюмерии и косметики, фармацевтических препаратов, любрикантов, растворителей
для красок и пластификаторов;
эфиры этиленгликоля - входят в состав тормозных
жидкостей, моющих средств, растворителей лаков и красок;
этаноламины - применяются в производстве мыла и
моющих средств, очистки природного газа и аппретирования тканей;
этоксилаты - используют в производстве моющих
средств, в качестве сурфактантов, эмульгаторов и диспергаторов.
Крупнейшим направлением использования окиси
этилена является производство этиленгликолей, однако процент его применения в
этом виде сильно варьирует в зависимости от региона: от 44 % в Западной Европе,
63 % Японии и 73 % в Северной Америке до 90 % в остальной части Азии и 99 % в
Африке.
Поэтому оптимизация условий получения оксида
этилена является актуальной задачей.
1. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
.1 Характеристика основного продукта
синтез
оксид этилен
О́кись
этиле́на
(этиленокси́д, оксира́н,
1,2-эпоксиэтан) - органическое вещество, имеющее формулу C2H4O. Этот бесцветный
газ со сладковатым запахом является производным этилена и представляет собой
простейший эпоксид - трёхчленный гетероцикл с одним атомом кислорода и двумя
метиленовыми группами.
Благодаря особенностям молекулярной структуры,
окись этилена вступает в реакции присоединения с раскрытием цикла, и таким
образом легко подвергается полимеризации.
Вещество является чрезвычайно огне- и
взрывоопасным. Окись этилена обладает дезинфицирующими свойствами, а также
является сильным ядом для человека, проявляя канцерогенное, мутагенное,
раздражающее и наркотическое действие.
Окись этилена является одним из важных объектов
основного органического синтеза и широко используется для получения многих
химических веществ и полупродуктов, в частности этиленгликолей, этаноламинов,
простых и сложных гликолевых и полигликолевых эфиров и прочих соединений.
Основные термодинамические характеристики[7]:
температура кипения…………………………………….. 10,7 °C;
температура плавления………………………………….. −111,3
°C;
стандартная молярная теплоёмкость вещества С0p =
48,19Дж/(моль•K);
стандартная энтальпия образования……. ΔH0298
= −51,037
кДж/моль;
стандартная энтропия…………………… So298 =
243,4 Дж/(моль
 K);
K);
стандартная энергия Гиббса
образования…ΔG0298
= −11,68
кДж/моль;
теплота сгорания………………………….ΔH0сгор.= −1306
кДж/моль[4].
температура кипения при давлении
пара выше 101,3 кПа, °С:
,203 МПа (2
атм.)…………………………………………57,7
,507 МПа (5
атм.)…………………………………………83,6
,013 МПа (10
атм.)……………………………………….114,0
вязкость, η*10³ Па*с:
−49,8
°C…………………………………………………….0,577
−38,2
°C…………………………………………………….0,488
−21,0
°C…………………………………………………….0,394
,0 °C……………………………………………………….0,320
.2 Характеристика реакционного
процесса
С2H4 + 1/2 O2
= C2H4O (1)
С2H4 + 3 O2
=2 CO2 + 2 H2O (2)
Реакция (1) является основной,
реакции (2) - побочная. Все реакции необратимые, катализатором служит серебро
на носителе.
.3 Термодинамический анализ
вероятности протекания процесса
Для определения термодинамической возможности
протекания основной и побочных реакций при указанных температурах (в
соответствии с заданием на работу) рассчитываем энергию Гиббса для каждой
реакции на границах температурного интервала.
Расчет энергии Гиббса  ведем по
формуле Темкина-Шварцмана [5]:
ведем по
формуле Темкина-Шварцмана [5]:
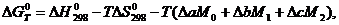 (1.1)
(1.1)
где 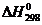 - стандартная теплота реакции при
298°С, кДж/моль
- стандартная теплота реакции при
298°С, кДж/моль
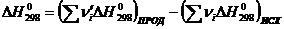 ; (1.2)
; (1.2)
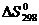 - разность стандартных абсолютных
энтропий продуктов реакции и исходных веществ, кДж/моль
- разность стандартных абсолютных
энтропий продуктов реакции и исходных веществ, кДж/моль
 ; (1.3)
; (1.3)
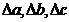 - алгебраические суммы
коэффициентов температурного ряда теплоёмкостей
- алгебраические суммы
коэффициентов температурного ряда теплоёмкостей
 ; (1.4)
; (1.4)
 ; (1.5)
; (1.5)
 ; (1.6)
; (1.6)
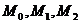 - константы уравнения (интегралы
Тёмкина-Шварцмана), зависящие от температуры. Определяем интерполяцией
табличных значений;
- константы уравнения (интегралы
Тёмкина-Шварцмана), зависящие от температуры. Определяем интерполяцией
табличных значений;
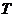 - абсолютная температура, К. В
соответствии с заданием
- абсолютная температура, К. В
соответствии с заданием 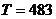 К и
К и 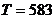 К
К
Необходимые для расчёта данные
приводятся в таблицах 1.1 и 1.2.
Таблица 1.1 - Термодинамические
параметры веществ [3], [5], [8]
Вещество 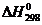 ,
,
кДж/моль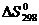 ,
,
|
Дж/(моль×К)Коэффициенты
уравнения  , Дж/(моль×К) , Дж/(моль×К)
|
b·103
|
c·106
|
|
Вода
|
-
68,317
|
16,716
|
17,996
|
-
|
-
|
|
Оксид
этилена
|
-
12,190
|
58,1
|
-
|
-
|
-
|
|
Этилен
|
12,496
|
52,45
|
1,003
|
36,948
|
-19,381
|
|
Кислород
|
0
|
49,003
|
7,52
|
0,81
|
-
|
|
Диоксид
углерода
|
-
94,052
|
51,06
|
10,55
|
2,16
|
-
|
Таблица 1.2 - Интегралы Тёмкина-Шварцмана для
заданных температур [5]
|
Температура,
К
|
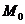 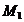 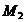
|
|
|
|
483
|
0,1007
|
0,0359·103
|
0,0131·106
|
|
583
|
0,1821
|
0,0699·103
|
0,0277·106
|
Определяем термодинамическую вероятность
протекания реакции (1). По формулам (1.2), (1.3), (1.4), (1.5), (1.6) определяем
необходимые величины:
 кДж/моль
кДж/моль
 Дж/(моль×К)
Дж/(моль×К)
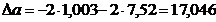
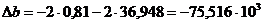

По формуле (1.1) определяем энергию
Гиббса для реакции (1) при температурах 433 и 493К:






Поскольку энергия Гиббса для реакции
(1) при температурах 483 и 583 К принимает отрицательное значение, то в
интервале температур от 483 до 583 К реакция (1) термодинамически возможна.
Определяем термодинамическую
вероятность протекания реакции (2). По формулам (1.2), (1.3), (1.4), (1.5),
(1.6) определяем необходимые величины:
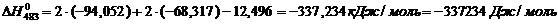
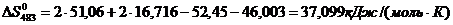
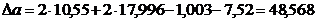

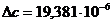
По формуле (1.1) определяем энергию
Гиббса для реакции (2) при температурах 433 и 493К:
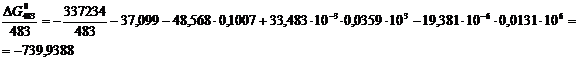


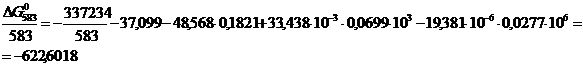
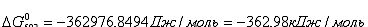
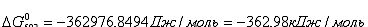
Поскольку энергия Гиббса для реакции
(2) при температурах 483 и 583 К принимает отрицательное значение, то в
интервале температур от 483 до 583 К реакция (2) термодинамически возможна.
Таким образом, в интервале
температур от 483 до 583 К все две реакции термодинамически возможны.
.4 Сведения о механизме и кинетике
протекающих реакций
Особое значение при выборе
оптимальных условий окисления этилена в промышленности, при расчете контактных
аппаратов и математическом моделировании процесса имеют кинетические
закономерности, которые определяют зависимость скорости реакции окисления
этилена от температуры, давления, а также от концентрации реагентов и продуктов
реакции.
При изучении кинетики
гетерогенно-каталитического окисления этилена в оксид этилена нередко
получаются различные результаты. Можно, однако, сделать общий вывод, что в
кинетической области реакция окисления подчиняется уравнению
Лэнгмюра-Хиншельвуда
Эту модель часто аппроксимируют
степенными функциями. Так, для окисления этилена в оксид этилена найдено
уравнение
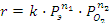
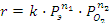 (1.7)
(1.7)
где кажущиеся порядки по реагентам составляют
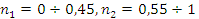
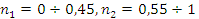
Это различие во многом обусловлено
условиями осуществления реакции (при избытке этилена).
Выбор пути повышения селективности
серебряного катализатора, а следовательно рентабельности каталитического
окисления этилена, определяется тем, какой механизм реакции реализуется. Если
считать правильной последовательную схему, необходимо быстро отводить продукты
неполного окисления этилена из зоны реакции, быстро охлаждать реакционную
смесь. Если же исходить из параллельной или последовательно-параллельной схемы
окисления, то необходимо обращать особое внимание на подбор катализатора и
возможности изменения его свойств.
Кинетика окисления этилена на
серебряном катализаторе исследовалась в изотермическом режиме при 218 °С в
безградиентном реакторе в широком интервале концентраций этилена, кислорода,
оксида этилена, воды и двуокиси углерода. При выводе кинетических уравнений
было учтено стационарное течение процесса,
использованы представления теории
адсорбции Лэнгмюра и сделано несколько предположений относительно механизма
процесса. Считается, что адсорбированый молекулярный кислород быстро
распадается на атомы, покрывающие большую часть поверхности катализатора. Затем
атомарный кислород взаимодействует с этиленом, образуя одновременно оксид
этилена, диоксид углерода и воду. Эти продукты адсорбируются на поверхности
катализатора и уменьшают каталитический эффект серебра.
Схема механизма окисления такова
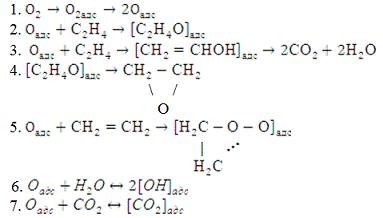
В уравнении скорости образования
окиси этилена, соответствующем предполагаемой схеме, скорость образования
оксида этилена равна:
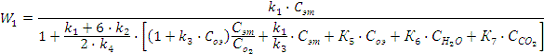
где 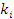
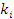 - константы скоростей;
- константы скоростей;
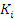
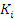 - константы равновесия отдельных
стадий процесса, зависящие от температуры;
- константы равновесия отдельных
стадий процесса, зависящие от температуры;
i-стадия
процесса.
Уравнение скорости образования
диоксида углерода W2 имеет такой же вид с той лишь
разницей, что в числителе вместо 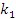
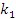 стоит
стоит 
 .
.
При рассмотрении закономерностей
окисления этилена на серебряном катализаторе необходимо учитывать, что с
изменением химического состава катализатора могут заметно меняться вид кинетических
уравнений и различаться значения энергии активации.
Одной из причин многообразия
кинетических уравнений процесса окисления этилена является незнание состояния
поверхности катализатора и истинного (точного) механизма протекающих реакций,
следовательно, необходимость в упрощающих
предположениях при выводе
кинетических зависимостей процесса. На скорость процесса окисления оказывают
серьезное влияние макроскопические факторы, например, скорость подачи исходных
веществ к поверхности катализатора и отвода от нее тепла. При несоблюдении,
например, условий теплового баланса катализатор может перегреться, вследствие
этого его избирательность и производительность уменьшаться. Особо важное
значение приобретают соотношение скоростей химической реакции, массо- и теплопередача
при проектировании контактных аппаратов.
Приведем общие закономерности
процесса окисления этилена в оксид этилена на сереб-ряном катализаторе:
1. Характерной особенностью каталитического
окисления этилена в оксид этилена является высокая избирательность
катализатора.
. Причина избирательности заключается в
активации молекул реагентов на поверхности катализатор и образования активных
промежуточных комплексов и веществ. Можно считать установленным, что на
поверхности катализатора адсорбируются одновременно и кислород и этилен, причем
кислород образует с катализатор супероксид серебра АgО2,
то есть связь кисло-род -кислород сохраняется. Вероятным переходным активным
компонентом является комплекс, объединяющий этилен и супероксид серебра, а
первым промежуточным cоедине-нием
перекись этилена. В целом окисление этилена идет по перекисному механизму, что
согласуется перекисной теорией Баха-Энглера.
. Благодаря перекисному механизму при окислении
этилена возможны параллельные
процессы образования оксида этилена, двуокиси углерода и воды в зависимости от
хими-ческой природы катализатора, макрокинетических факторов, температуры,
давления и так далее. Последовательное окисление этилена в оксид этилена, а
затем окиси этилена в двуокись углеро-да и воду может протекать лишь при
повышенных температурах.
. В настоящее время механизм окисления этилена
нельзя считать полностью выяснен-ным. Не изучены многие элементарные акты и
состав промежуточных веществ, не совсем ясен механизм торможения процесса
образующимися продуктами. Это осложняет выведение общих законов и делает
кинетические уравнения в значительной степени формальными.
. Первостепенное значение при каталитическом
окислении этилена имеют макроскопические факторы, и особенно процессы
теплопереноса, поскольку при чрезмерном разогреве катализатора может начаться
горение, что резко сокращает выход оксида этилена и ухудшает свойства
катализатора.
В промышленных условиях температура
контактирования составляет 230-315 С. Степень конверсии этилена с ростом
температуры повышается. При оптимальных условиях конверсия этилена составляет
за проход 30-50%. Окисление этилена обычно проводится под давлением 8-20 атм, а
иногда и под более высоким.
.5 Анализ промышленных технологий синтеза оксида
этилена
Во всех промышленных технологических схемах
производства оксида этилена принят процесс в неподвижном слое катализатора с
рециркуляцией продуктов реакции. Технологические схемы получения оксида этилена
каталитическим окислением этилена очень разнообразны. Они отличаются составом
газа, поступающего на окисление, окисляющим агентом (воздух или кислород),
направлением потока газа в реакторе (ввод сверху или снизу), способе съема
тепла (циркулирующим или кипящим теплоносителем может быть кипящая вода),
давлением при окислении и т.д.
Все технологические схемы производства оксида
этилена каталитическим окислением этилена, осуществляемые в промышленности,
протекают на неподвижном слое катализатора в трубчатых аппаратах
2. ОБОСНОВАНИЕ ВЫБОРА ОПТИМАЛЬНЫХ УСЛОВИЙ
ПРОЦЕССА
.1 Связь селективности с кинетикой
Свяжем селективность процесса с его кинетикой.
Обозначим вещества, участвующие в реакциях буквами:
А - этилен,
Y - кислород,
B - оксид этилена,
С - диоксид углерода,
D - вода.
Тогда реакции, протекающие в системе можно
записать в буквенном виде:

Концентрации веществ участников
реакции:

 ;
;
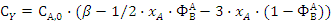
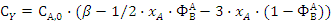 ;
;
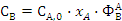
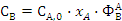 ;
;
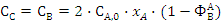
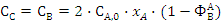 ,
,
где 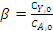
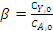 - мольное соотношение исходных
реагентов;
- мольное соотношение исходных
реагентов;
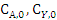
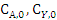 - начальные концентрации
компонентов А и Y, моль/л;
- начальные концентрации
компонентов А и Y, моль/л;
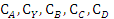
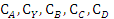 - текущие концентрации компонентов A, Y, B, C, D, моль/л;
- текущие концентрации компонентов A, Y, B, C, D, моль/л;
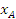
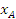 - степень превращения компонента А;
- степень превращения компонента А;
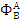
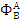 - интегральная селективность
целевого продукта В по ключевому реагенту А.
- интегральная селективность
целевого продукта В по ключевому реагенту А.
Определим дифференциальную
селективность целевого продукта В по ключевому реагенту А:

 (2.1)
(2.1)
где 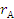
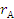 ,
, 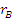
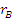 - скорость образования
(расходования) компонентов А и В;
- скорость образования
(расходования) компонентов А и В;

 ,
, 
 - стехиометрические компоненты А и
В;
- стехиометрические компоненты А и
В;
r1, r2 - скорость
прямой и побочной реакции;
k1, k2 -
константы скорости прямой и побочной реакции;
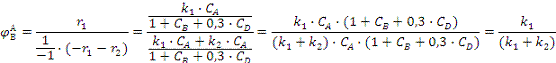
Определим интегральную селективность
целевого продукта В по ключевому реагенту А для различных типов реакторов.

 (2.2)
(2.2)
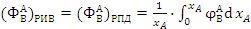
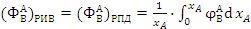 (2.3)
(2.3)

 ;
;
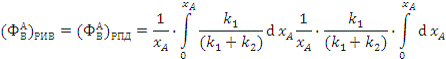

Значит, интегральная селективность
целевого продукта В по ключевому реагенту А не зависит от типа реактора.
Определим удельную
производительность по целевому продукту В для всех типов реакторов:

 =
=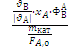
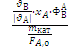 , (2.4)
, (2.4)
где FA,0 -
начальные мольный поток вещества А, моль/с;
FВ - мольный
поток вещества В, моль/с;
mкат - масса
гетерогенного катализатора, г.

 (2.5)
(2.5)

 (2.6)
(2.6)
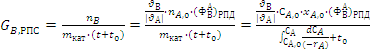
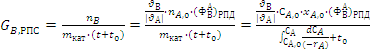 , (2.7)
, (2.7)
t- время
реакции, с;
t0 - время
непроизводительных затрат, с;
t=
 (2.8)
(2.8)
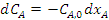
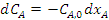 (2.9)
(2.9)

 (2.10)
(2.10)
где 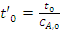
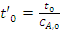
Определим скорость расходования
ключевого реагента А.
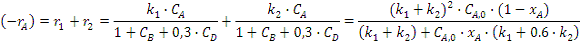
Вычислим значение определенного
интеграла:

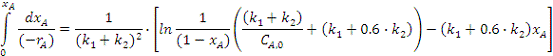
Подставляя полученные значения в
выражения для удельных производительностей, получим:
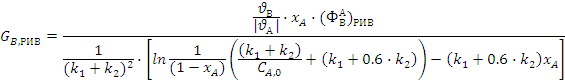
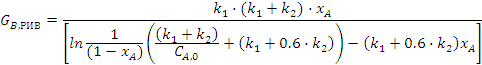

Подставляем полученные выражения в
программу, изучаем результаты программы, а затем строим график зависимости
интегральной селективности реактора от температуры, а также строим графики
зависимости удельной производительности от конверсии и интегральной
селективности от конверсии
Согласно литературным данным
концентрационный предел взрываемости газов в смеси с воздухом при температуре
окружающей среды 200С и 0,1013 МПа:
нижний 2,5;
верхний 34.
3.
Программа на языке QBASIC
CLS
OPEN
"c:\PROGRAMM.BAS" FOR OUTPUT AS #1= 8.31#1, "T,OC",
"INT.SEL.PROC."TO = 210 TO 310 STEP 10= TO + 273.15= EXP(9.05 -
63800/ (R * Т))=
EXP(13 - 83000 / (R * Т))=
(Kl / (Kl + K2) * 100#1, TO, FOTOTO = 210 TO 230 STEP 10#1, "T="; TO;
"ОС"=
TO + 273.15= 28.5= 32
Pa = Ma * 273.15 * 100000 / (22.4 *T
* 101325)
Py = My * 273.15 * 100000 / (22.4*T
* 101325)b = .1 TO 0.5 STEP .001= 1 / (Ma / Pa + (b * My / Py) / .21)% = C *
22.4 * T / T0#1, "b="; b, "CAO="; CAO, "CAO%=";
CAO%#1, "Xa,proc.", "GbRIV,mol/(g*s)", "GbRPS,
mol/(g*s)", "tRIV, min", "tRPS, min"Xyl = .1 TO 85
STEP 21= Xyl / 100= CAO * b
= EXPO.05 - 63800 / (R * T))= EXP(13
- 83000 / (R * T))
К = Kl + K2
КО = Kl + .6 * K2= Kl
/ К=
Xy * Су
/ (CAO * (.5 * F + 3 *(1 - F)))= Xa * 100
rl = Kl * CAO * (1 - Xa) / (1 + CAO
* Xa * F + .6 * CAO * Xa * (1 - F))= K2 * CAO * (1 - Xa) / (1 + CAO * Xa * F +
.6 * CAO * Xa * (1 - F))
rA = rl + r2= Kl * К
* Xa / (LOG(1/(1 - Xa)) * (K / CAO + КО)
- КО
* Xa)#1, Xa, Xyl, GbRIV= Kl * К
* (1 - Xa)/ (K + CA0 * Xa + K0)= CA0 * 1 / (K1 + K2)^ 2 * (LOG(1/(1 - Xa)) * ((
K1 + K2 )/ CA0 + (K1 + .6 * K2 )- (K1 + .6 * K2) * Xa=( Xa*(( K1 + K2) + CA0 *
Xa * (K1 + .6 * K2))) / (( K1 + K2 )^ 2* (1 - Xa))XylXyl = 85 TO 100 STEP 3,75=
Xyl / 100= CAO * b= EXP(9.05 - 63800 / (R * T ))= EXP(13 - 83000 / (R * T ))
К = Kl + K2
КО = Kl + .6 * K2= Kl
/ К=
Xy * CyO / (CAO * (.5*F+3* (1 - F)= Xa * 100= Kl * CAO * (1 - Xa) / (1 + CAO *
Xa * F + .6 * CAO * Xa* (1 - F))= K2 * CAO *(1 - Xa) / (1 + CAO * Xa * F + .6 *
CAO * Xa* (1 - F))= r1 + r2= Kl * К
* Xa / (LOG(1/(1 - Xa)) * (K / CAO + КО)
- КО
* Xa)= Kl * К * (1 - Xa)/ (K +
CA0 * Xa + K0)= CA0 * 1 / (K1 + K2)^ 2 * (LOG(1/(1 - Xa)) * (( K1 + K2 )/ CA0 +
(K1 + .6 * K2 )- (K1 + .6 * K2) * Xa=( Xa*(( K1 + K2) + CA0 * Xa * (K1 + .6 *
K2))) / (( K1 + K2 )^ 2* (1 - Xa))#1, Xal, Xyl, GbRIV, GbRPC, tRIV, tRPCXylbTO
#1
END
4. Результаты программы
T,0C INT.SEL.PROC.
210 69.67978
67.59289
65.52074
63.47205
61.45447
59.47458
57.53792
55.64904
53.81159
52.02832
50.30124
T= 210 0C
b= .35 CA0=
9.340839E-03 CA0%=
37.0177
_____________________________________________________________
| Xa
| Xy | GbRIV,mol/(g*s)
| Gbrps,mol/(g*s)
| tRIV,c
| tRPS,c
|
======================================================
| 0.027822 | 0.10 | 0.9989E-05
| 0.5312E-05 | 0.4528E+00
| 0.1813E+00
| 5.870403 | 21.10 | 0.9692E-05
| 0.4206E-05 | 0.4672E+01
| 0.4065E+02
| 11.712984 | 42.10 | 0.9389E-05
| 0.3404E-05 | 0.4775E+01
| 0.8651E+02
| 17.555567 | 63.10 | 0.9079E-05
| 0.2795E-05 | 0.4866E+01
| 0.1389E+03
| 23.398146 | 84.10 | 0.8761E-05
| 0.2317E-05 | 0.5047E+01
| 0.1994E+03
| 23.648544 | 85.00 | 0.8747E-05
| 0.7613E-05 | 0.5269E+01
| 0.1179E+03
| 24.691862 | 88.75 | 0.8690E-05
| 0.7509E-05 | 0.5459E+01
| 0.1214E+03
| 25.735182 | 92.50 | 0.8632E-05
| 0.7404E-05 | 0.5550E+01
| 0.1248E+03
| 26.778498 | 96.25 | 0.8574E-05
| 0.7299E-05 | 0.5643E+01
| 0.1280E+03
| 27.821815 | 100.00| 0.8515E-05
| 0.7195E-05 | 0.5837E+01
| 0.1311E+03
b= .36 CA0=
9.176964E-03 CA0%=
36.3683
_____________________________________________________________
| Xa
| Xy | GbRIV,mol/(g*s)
| Gbrps,mol/(g*s)
| tRIV,c
| tRPS,c
|
+=====================================================
| 0.028617 | 0.10 | 0.9814E-05
| 0.5218E-05 | 0.4980E+00
| 0.1865E+00
| 6.038129 | 21.10 | 0.9514E-05
| 0.4118E-05 | 0.5188E+02
| 0.4189E+02
| 12.047640 | 42.10 | 0.9207E-05
| 0.3322E-05 | 0.5223E+02
| 0.8933E+02
| 18.057152 | 63.10 | 0.8893E-05
| 0.2719E-05 | 0.5306E+03
| 0.1438E+03
| 24.066664 | 84.10 | 0.8571E-05
| 0.2247E-05 | 0.5405E+03
| 0.2069E+03
| 24.324217 | 85.00 | 0.8557E-05
| 0.7413E-05 | 0.5527E+03
| 0.1202E+03
| 26.470470 | 92.50 | 0.8440E-05
| 0.7202E-05 | 0.5815E+03
| 0.1271E+03
| 27.543598 | 96.25 | 0.8381E-05
| 0.7096E-05 | 0.5911E+03
| 0.1303E+03
| 28.616726 | 100.00| 0.8322E-05
| 0.6990E-05 | 0.6009E+03
| 0.1334E+03
b= .37 CA0=
9.018741E-03 CA0%=
35.7413
_____________________________________________________________
| Xa
| Xy | GbRIV,mol/(g*s)
| Gbrps,mol/(g*s)
| tRIV,c
| tRPS,c
|
+=====================================================
| 0.029412 | 0.10 | 0.9645E-05
| 0.5128E-05 | 0.5032E+00
| 0.1917E+00
| 6.205855 | 21.10 | 0.9341E-05
| 0.4033E-05 | 0.5105E+02
| 0.4313E+02
| 12.382298 | 42.10 | 0.9031E-05
| 0.3243E-05 | 0.5271E+02
| 0.9216E+02
| 18.558741 | 63.10 | 0.8714E-05
| 0.2646E-05 | 0.5346E+03
| 0.1487E+03
| 24.735184 | 84.10 | 0.8388E-05
| 0.2179E-05 | 0.5562E+03
| 0.2145E+03
| 24.999889 | 85.00 | 0.8374E-05
| 0.7220E-05 | 0.5685E+03
| 0.1224E+03
| 26.102825 | 88.75 | 0.8315E-05
| 0.7114E-05 | 0.5882E+03
| 0.1259E+03
| 27.205763 | 92.50 | 0.8255E-05
| 0.7007E-05 | 0.5981E+03
| 0.1293E+03
| 28.308699 | 96.25 | 0.8195E-05
| 0.6900E-05 | 0.6080E+03
| 0.1325E+03
| 29.411634 | 100.00| 0.8135E-05
| 0.6793E-05 | 0.6182E+03
| 0.1356E+03
b= .38 CA0=
8.865881E-03 CA0%=
35.1355
_____________________________________________________________
| Xa
| Xy | GbRIV,mol/(g*s)
| Gbrps,mol/(g*s)
| tRIV,c
| tRPS,c
|
======================================================
| 0.030207 | 0.10 | 0.9481E-05 | 0.5041E-05 |
0.5084E+00 | 0.1968E+00
| 6.373580 | 21.10 | 0.9175E-05 | 0.3951E-05 |
0.5122E+01 | 0.4437E+02
| 12.716953 | 42.10 | 0.8862E-05 | 0.3167E-05 |
0.5221E+01 | 0.9501E+02
| 19.060329 | 63.10 | 0.8541E-05 | 0.2576E-05 |
0.5386E+01 | 0.1536E+03
| 25.403702 | 84.10 | 0.8211E-05 | 0.2114E-05 |
0.5420E+01 | 0.2223E+03
| 25.675562 | 85.00 | 0.8197E-05 | 0.7034E-05 |
0.5644E+01 | 0.1246E+03
| 26.808306 | 88.75 | 0.8137E-05 | 0.6926E-05 |
0.5745E+01 | 0.1281E+03
| 27.941051 | 92.50 | 0.8076E-05 | 0.6818E-05 |
0.5947E+01 | 0.1315E+03
| 29.073795 | 96.25 | 0.8016E-05 | 0.6710E-05 |
0.6150E+01 | 0.1346E+03
| 30.206543 | 100.00| 0.7955E-05 | 0.6603E-05 |
0.6283E+01 | 0.1377E+03= .39 CA0= 8.718116E-03 CA0%=
34.5499
_____________________________________________________________
| Xa | Xy | GbRIV,mol/(g*s) | Gbrps,mol/(g*s) |
tRIV,c | tRPS,c |
======================================================
| 0.031001 | 0.10 | 0.9323E-05 | 0.4957E-05 |
0.4935E+00 | 0.2020E+00
| 6.541306 | 21.10 | 0.9014E-05 | 0.3873E-05 |
0.5239E+01 | 0.4562E+02
| 13.051610 | 42.10 | 0.8697E-05 | 0.3094E-05 |
0.5372E+01 | 0.9789E+02
| 19.561914 | 63.10 | 0.8373E-05 | 0.2509E-05 |
0.5427E+01 | 0.1587E+03
| 26.072220 | 84.10 | 0.8039E-05 | 0.2052E-05 |
0.5679E+01 | 0.2302E+03
| 26.351234 | 85.00 | 0.8025E-05 | 0.6854E-05 |
0.5804E+01 | 0.1267E+03
| 27.513786 | 88.75 | 0.7964E-05 | 0.6745E-05 |
0.5908E+01 | 0.1302E+03
| 28.676342 | 92.50 | 0.7903E-05 | 0.6636E-05 |
0.6114E+01 | 0.1335E+03
| 29.838896 | 96.25 | 0.7842E-05 | 0.6527E-05 |
0.6281E+01 | 0.1367E+03
| 31.001451 | 100.00| 0.7780E-05 | 0.6419E-05 |
0.6330E+01 | 0.1397E+03= .3999999 CA0= 8.575196E-03 CA0%=
33.9835
_____________________________________________________________
| Xa | Xy | GbRIV,mol/(g*s) | Gbrps,mol/(g*s) |
tRIV,c | tRPS,c |
======================================================
| 0.031796 | 0.10 | 0.9170E-05 | 0.4876E-05 |
0.5387E+00 | 0.2072E+00
| 6.709032 | 21.10 | 0.8858E-05 | 0.3797E-05 |
0.5556E+02 | 0.4687E+02
| 13.386266 | 42.10 | 0.8539E-05 | 0.3024E-05 |
0.5724E+02 | 0.1008E+03
| 20.063501 | 63.10 | 0.8211E-05 | 0.2444E-05 |
0.5868E+03 | 0.1638E+03
| 26.740736 | 84.10 | 0.7874E-05 | 0.1992E-05 |
0.5938E+03 | 0.2383E+03
| 27.026903 | 85.00 | 0.7859E-05 | 0.6679E-05 |
0.6164E+03 | 0.1287E+03
| 28.219267 | 88.75 | 0.7798E-05 | 0.6570E-05 |
0.6272E+03 | 0.1322E+03
| 29.411633 | 92.50 | 0.7736E-05 | 0.6460E-05 |
0.6381E+03 | 0.1356E+03
| 30.603992 | 96.25 | 0.7674E-05 | 0.6350E-05 |
0.6493E+03 | 0.1387E+03
| 31.796356 | 100.00| 0.7611E-05 | 0.6241E-05 |
0.6506E+03 | 0.1416E+03= .4099999 CA0= 8.436887E-03 CA0%=
33.4354 o
_____________________________________________________________
| Xa | Xy | GbRIV,mol/(g*s) | Gbrps,mol/(g*s) |
tRIV,c | tRPS,c |
+=====================================================
| 0.032591 | 0.10 | 0.9022E-05 | 0.4797E-05 |
0.5539E+00 | 0.2124E+00
| 6.876758 | 21.10 | 0.8708E-05 | 0.3724E-05 |
0.5674E+02 | 0.4813E+02
| 13.720922 | 42.10 | 0.8385E-05 | 0.2957E-05 |
0.5776E+02 | 0.1037E+03
| 20.565088 | 63.10 | 0.8054E-05 | 0.2382E-05 |
0.5809E+03 | 0.1689E+03
| 27.409252 | 84.10 | 0.7713E-05 | 0.1935E-05 |
0.6098E+03 | 0.2465E+03
| 27.702576 | 85.00 | 0.7698E-05 | 0.6511E-05 |
0.6125E+03 | 0.1307E+03
| 28.924747 | 88.75 | 0.7636E-05 | 0.6400E-05 |
0.6236E+03 | 0.1342E+03
| 30.146921 | 92.50 | 0.7573E-05 | 0.6289E-05 |
0.6349E+03 | 0.1375E+03
| 31.369093 | 96.25 | 0.7511E-05 | 0.6179E-05 |
0.6565E+03 | 0.1406E+03
| 32.591267 | 100.00| 0.7447E-05 | 0.6068E-05 | 0.6682E+03
| 0.1435E+03
Оптимальные условия процесса для РИВ:
Температура Tопт
= 2100С=483К
Коэффициент избытка кислорода 𝛽=0,35
Интегральная селективность этилена в
целевой продукт 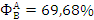
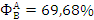
Степень превращения кислорода Xy = 100%
Степень превращения этилена Xa =
27,821815%
Начальная концентрация этилена СА0,
опт = 9,340839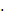
 10-3 моль/(л
10-3 моль/(л 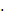
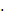 с)
с)
Удельная производительность РИВ GbRIV= 0,8515 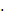
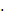 10-5 моль/(л
10-5 моль/(л 
 с)
с)
Время пребывания tRIV = 5,83 с
Заключение
Удельная производительность в реакторе
идеального вытеснения больше, чем в реакторе полного смешения, время пребывание
в реакторе идеального вытеснения меньше, чем в реакторе полного смешения.
Поэтому целесообразно проводить процесс в реакторе идеального вытеснения.
Список использованной
литературы
1 Методические
указания к выполнению выпускной квалификационной работы бакалавра (комплексного
курсового проекта) для студентов направления подготовки бакалавров 240100
«Химическая технология и биотехнология» специальности 240401 «Химическая
технология органических веществ» / НГТУ; Сост. Р.А. Наволокина. Н. Новгород,
2006. - 33с.
2 Данов
С.М., Колесников В.А. Примеры и задачи по курсу «Основы проектирования и
оборудования заводов отрасли»: Учеб. пособие. Горьков. политехн. ин-т. Горький,
1989. - 68 с.
3 Дымент
О.Н., Казанский К.С., Мирошников А.М. Гликоли и другие производные окисей
этилена и пропилена. Под общей ред. О.Н. Дымента. М., «Химия», 1976.
4 Лебедев
Н.Н., Манаков М.Н., Швец В.Ф. Теория химических процессов основного
органического и нефтехимического синтеза / Под ред. Н.Н. Лебедева. 2-е изд.
перераб. - М.: Химия, 1984. - 376 с., ил
5 Казанская
А.С., Скобло В.А. Расчёты химических равновесий. Сборник примеров и задач. Под
ред. Г.М. Панченкова. М., «Высш. школа», 1974.
6 Стал
Д., Вестрам Э., Зинке Г., Химическая термодинамика органических соединений. -
М.: «Мир», 1971, 807 с.
7 Справочник
нефтехимика: В 2 т. Т.2. / Под ред. С.К. Огородникова. - Л.: Химия, 1978. - 592
с.
8 Павлов
К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и
аппаратов химической технологии. Учебное пособие для вузов/Под ред. чл.-корр.
АН СССР П.Г. Романкова. - 10-е изд. - Л.: Химия, 1987. - 567 с.
9 Лебедев
Н.Н. Химия и технология основного органического и нефтехимического синтеза. -
М. Химия, 1988. - 592 с.