Окислительно-восстановительное титрование, его применение в фармации
Кафедра фундаментальной и клинической
биохимии
Курсовая работа
по аналитической химии на тему
"Окислительно-восстановительное
титрование, его применение в фармации".
Краснодар-2012
Содержание
Введение
Сущность метода ОВ титрования
Окислительно-восстановительный потенциал
Классификация редокс-методов
Требования к реакциям, применяемым в окислительно-восстановительном
титровании
Константа равновесия окислительно-восстановительной реакции
Виды окислительно-восстановительного титрования
Индикаторы окислительно-восстановительного титрования
Кривые окислительно-восстановительного титрования
Перманганатометрическое титрование
Дихроматометрическое титрование
Йодометрия
Приготовление и стандартизация раствора тиосульфата натрия
Йодиметрия
Броматометрия
Нитритометрия
Цериметрия
Заключение
Список литературы
Введение
ТИТРИМЕТРИЯ (от франц. titre -
качество, характеристика и греч. metreo-измеряю) - совокупность методов
количественного анализа, основанных на измерении кол-ва реагента, необходимого
для взаимодействия с определяемым компонентом в р-ре или газовой фазе в
соответствии со стехиометрией химических реакций между ними.
Титриметрические методы, в которых в качестве титрантов
используют растворы окислителей или восстановителей, называют окислительно-восстановительными
методами титрования.
Методы редоксометрии основаны на реакциях
окисления-восстановления. Разработано очень много методов. Их классифицируют в
соответствии с применяемым стандартным (рабочим, титрантом) раствором. Наиболее
часто применяются следующие методы:
Перманганатометрия - метод, который основан на
окислительной способности рабочего раствора перманганата калия KМnO4.
Титрование ведется без индикатора. Применяется для определения только
восстановителей при прямом титровании.
Йодометрия - метод, в котором рабочим титрованным раствором
служит раствор свободного иода в КI. Метод позволяет определять как окислители,
так и восстановители. Индикатором служит крахмал.
Дихроматометрия основана на использовании в качестве
рабочего раствора дихромата калия K2Cr2O7.
Метод может применяться как для прямых так и косвенных определений
восстановителей.
Броматометрия основана на использовании в качестве
титранта бромата калия KBrO3 при определении восстановителей.
Йодатометрия применяет в качестве титранта раствор
иодата калия KIO3 при определении восстановителей.
Ванадатометрия дает возможность использовать
окислительную способность ванадата аммония NH4VO3.
Нитритометрия - метод объемного анализа, при котором в
качестве реактива для титрования используется раствор нитрита натрия.
Применяется для количественного определения соединений,
содержащих первичную или вторичную ароматическую аминогруппу, для определения
гидразидов, а также ароматических нитросоединений после предварительного
восстановления нитрогруппы до аминогруппы.
Цериметрия - титриметрический метод определения
восстановителей, основанный на применении стандартных растворов соединений Ce
(IV), например (NH4) 2 [Ce (SO4) 3].
окислительное восстановительное титрование раствор
Сущность
метода ОВ титрования
Методы окислительно-восстановительного титрования, или
редокс-методы, основаны на использовании реакций с переносом электронов -
окислительно-восстановительных реакций.
Окислительно-восстановительное титрование, или редоксиметрия,
- это титрование, сопровождаемое переходом одного или большего числа электронов
от иона-донора или молекулы (восстановителя) Red1 к акцептору (окислителю)
Ox2:
Red1+Ox2=Ox1+Red2
Восстановленная форма одного вещества Red1,
отдавая электроны, переходит в окисленную форму Ox1 того же вещества. Обе эти
формы образуют одну редокс-пару Ox1|Red1.
Окисленная форма Ox2 второго вещества, участвующего в
окислительно-восстановительной реакции, принимая электроны, переходит в
восстановленную форму Red2 того же вещества. обе эти формы образуют
редокс-пару Ox2|Red2.
В любой окислительно-восстановительной реакции участвуют, по
крайней мере, две редокс-пары.
Чем выше окислительно-восстановительный потенциал редокс пары
Ox2|Red2, окилсенная форма
которой играет роль окислителя в данной реакции, тем большее число
восстановителей Red1 можно оттитровать и определить с помощью данного окислителя Ox2. Поэтому в редоксиметрии
в качестве титрантов чаще всего применяют окислители, стандартные
окислително-восстановительные потенциалы редокс-пар которых имеют как можно
более высокие значения, например (при комнатной температуре):
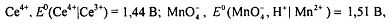
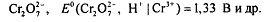
Напротив, если определяемые вещества - окислители Ox2, то для их титрования
целесообразно применять восстановители, стандартный
окислительно-восстановительный потенциал редокс-пар которых имеет по
возможности минимальное значение, например:
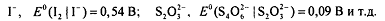
Редокс-методы - важнейшие фармакопейные методы
количественного анализа.
В качестве стандартных (титрованных) растворов в методах
окисления-восстановления применяют различные растворы окислителей и
восстановителей:
ü Окислители: перманганат калия,
растворы элементарного йода, бихромат калия, гексанитратоцерат (lV) аммония (NH4) 2 [Ce (NO3) 6], бромат
калия, иодат калия, иодная кислота H5IO6, периодат калия KIO4, ванадат аммония NH4VO3, перкупраты (соединения  , например,
, например, 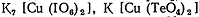 ), соединения свинца (lV) и многие другие.
), соединения свинца (lV) и многие другие.
ü Восстановители: соль Мора 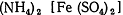 , сульфат железа (ll),
хлорид титана (lll), хлорид олова (ll), сульфат хрома (ll), аскорбиновая
кислота
, сульфат железа (ll),
хлорид титана (lll), хлорид олова (ll), сульфат хрома (ll), аскорбиновая
кислота 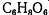 , соединения мышьяка
(lll), хлорид меди (l), гидрохинон
, соединения мышьяка
(lll), хлорид меди (l), гидрохинон  , тиосульфат натрия
, тиосульфат натрия 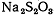 , щавелевая кислота,
перекись водорода и многие другие.
, щавелевая кислота,
перекись водорода и многие другие.
Окислительно-восстановительный
потенциал
Эффективность окислительных и восстановительных свойств
данного вещества зависит от его природы, от условий протекания
окислительно-восстановительной реакции и определяется величиной
окислительно-восстановительного потенциала редокс-пары. Этот потециал
экспериментально определяют с помощью окислительно-восстановительного
электрода.
Окислительно-восстановительный электрод - это электрод,
состоящий из инертного материала (металлическая платина, золото, вольфрам,
титан, графит), погруженного в водный раствор, в котором имеются окисленная и
восстановленная формы данного вещества.
Условный (относительный)
окислительно-восстановительный потенциал редокс - пары - это электродвижущая
сила (ЭДС) гальванической цепи, составленной из данного
окислительно-восстановительного электрода и стандартного водородного электрода.
Стандартный окислительно-восстановительный
потенциал Ео редокс-пары - это такой потенциал редокс-пары, когда все
учасники окислительно-восстановительной реакции находятся в стандартных
состояниях, т.е. их активности равны единице.
Окислительно-восстановительные потенциалы редокс-пары зависят
от природы участников окислительно-восстановительной реакции и растворителя,
температуры, давления, присутствия посторонних электролитов и других веществ.
Чем больше окислительно-восстановительный потенциал данной
редокс-пары, тем более сильным окислителем является окисленная форма этой
редокс-пары. Чем меньше окислительно-восстановительный потенциал данной
редокс-пары, тем более сильным восстановителем является восстановленная форма
этой редокс-пары.
Влияние рН среды.
Влияние температуры.
Рассмотрим уравнение Нернста, например, для потенциала
окислительно-восстановительной реакции в общем виде:
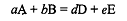 .
.
Уравнение для потенциала реакции будет иметь вид:
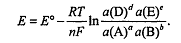
В этом уравнении от температуры существенно зависят
стандартный потенциал Ео и множитель 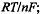 активности реагентов
обычно мало изменяются при изменении температуры.
активности реагентов
обычно мало изменяются при изменении температуры.
Следовательно, потенциал Е также зависит от температуры. Если
известна температурная зависимость стандартного потенциала 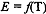 , то потенциал реакции
можно рассчитать по уравнению
, то потенциал реакции
можно рассчитать по уравнению 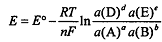 для любой температуры.
для любой температуры.
Влияние давления.
Если при протекании окислительно-восстановительной реакции не
выделяются и не поглощаются газообразные вещества, то потенциал реакции
практически не зависит от внешнего давления. Если же в
окислительно-восстановительной реакции непосредственно участвуют газообразные
вещества, то потенциал такой реакции может зависеть от давления, поскольку в
этом случае в уравнение Нернста вместо активностей включаются парциальные
давления газообразных реагентов.
Классификация
редокс-методов
Известно несколько десятков различных методов
окислительно-восстановительного титрования. Обычно их классифицируют следующим
образом.
Классификация по характеру титранта. Методы титрования
разделяются на две группы:
· Оксидиметрия-методы определения
восстановителей с применением титранта-окислителя.
· Редуктометрия - методы определения
окислителей с применением титранта-восстановителя.
Классификация по природе реагента, взаимодействующего с
определяемым веществом:
ü Броматометрия (бромат калия KBrO3)
ü Дихроматометрия (дихромат калия К2Сr2O7)
ü Иодатометрия (иодат калия KIO3)
ü Бромометрия (бром Br2)
ü Иодиметрия (иод I2)
ü Иодометия (иодид калия KI, тиосульфат натрия Na2S2O3)
ü Нитритометрия (нитрит натрия NaNO2)
ü Перманганатометрия (перманганат калия KMnO4)
ü Хлориодиметрия (хлорид иода ICl)
ü Цериметрия (сульфат церия (lV)).
Реже применяются аскорбинометрия (аскорбиновая
кислота), титанометрия (соли титана (lll)), ванадатометрия
(ванадат аммония NH4VO3) и т.д.
Требования к
реакциям, применяемым в окислительно-восстановительном титровании
Реакции, применяемые в методах
окислительно-восстановительного титрования, должны отвечать следующим
требованиям:
1) Реакции должны практически протекать до
конца.
Окислительно-восстановительная реакция идет тем полнее, чем
больше константа равновесия К, которая определяется соотношением:
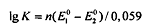
при комнатной температуре, где 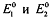 - соответственно
стандартные окислительно-восстановительные потенциалы редокс-пар, участвующих в
данной окислительно-восстановительной рекации, n - число электронов,
отдаваемых восстановителем окислителю. Чем больше разность
- соответственно
стандартные окислительно-восстановительные потенциалы редокс-пар, участвующих в
данной окислительно-восстановительной рекации, n - число электронов,
отдаваемых восстановителем окислителю. Чем больше разность 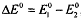 , тем выше константа
равновесия, тем полнее протекает реакция.
, тем выше константа
равновесия, тем полнее протекает реакция.
2) Реакция должна протекать достаточно
быстро,
чтобы равновесие, при котором реальные окислительно-восстановительные
потенциалы обеих редокс-пар равны, устанавливалось практически мгновенно.
3) Реакция должна протекать стехиометрически, побочные процессы
должны быть исключены.
4) Конечная точка титрования должна
определяться точно и однозначно либо с индикаторами, либо без индикаторов.
Константа
равновесия окислительно-восстановительной реакции
Реакции окисления-восстановления обратимы. Равновесие
наступает в момент, когда Еокисл становится равным Евосст.
В тех случаях, когда реакции обратимы, к ним можно применять закон действия
масс и вычислить изменения молярных концентраций реагирующих ионов, что имеет
особо важное значение в количественном анализе.
Например, для реакции 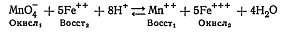 выражение закона
действия масс имеет вид:
выражение закона
действия масс имеет вид:
 ,
,
где
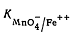 - константа равновесия указанной реакции.
- константа равновесия указанной реакции.
Связь между константами равновесия ОВ реакций со
стандартными потенциалами окислительно-восстановительных пар.
Общее уравнение, выражающее константу равновесия
ОВ реакций.
Для реакции
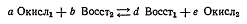
константу равновесия представляют формулой:
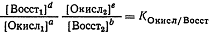 (1)
(1)
Если коэффициенты а=d и b=e, то можно написать:
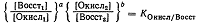 (2)
(2)
Значение 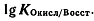 .
.
Рассмотрим следующие реакции:
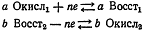
Для реакции а:
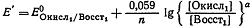
Для реакции б:
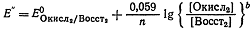
При установившемся равновесии окислительные потенциалы обеих
систем равны  или
или
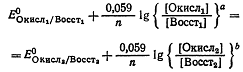
Откуда
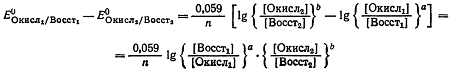
На основании уравнения (2):
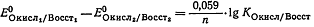
Или 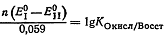
Виды
окислительно-восстановительного титрования
В ОВ титровании применяют прямое, обратное и заместительное
титрование. Наиболее точные результаты, при прочих равных условиях, применяют
при прямом титровании.
Прямое ОВ титрование проводят тогда, когда ОВ
реакция удовлетворяет требования, предъявленные к ней.
Например, определение железа (ll) прямым
перманганатометрическим титрованием по схеме: 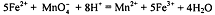 .
.
Аликвоту анализируемого раствора, содержащего железо (ll),
титруют стандартным раствором перманганата калия. Полуреакции:
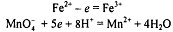
В ОВ реакции участвуют 5 электронов. В соответствии с законом
эквивалентов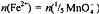
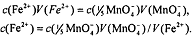
Массу m железа (ll) во всем объеме V исходного анализируемого
раствора рассчитывают по формуле: 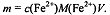
Обратное титрование проводят тогда, когда
применение прямого титрования нецелесообразно по каким-либо причинам.
К аликвоте анализируемого раствора, содержащего определяемый
компонент Х, прибавляют точно известное количество вещества А, взятого в
избытке по сравнению с его стехиометрическим количеством, и выдерживают раствор
некоторое время для обеспечения полноты протекания реакции между Х и А.
Непрореагировавший избыток вещества А оттитровывают стандартным раствором
титранта Т. Например, иодометрически определяют сульфид-ионы, прибавив к
аликвоте анализируемого раствора в избытке известное количество раствора иода: 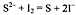 . Непрореагировавший
избыток иода оттитровывают стандартным раствором тиосульфата натрия:
. Непрореагировавший
избыток иода оттитровывают стандартным раствором тиосульфата натрия: 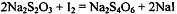 .
.
Расчеты:
Заместительное ОВ титрование применяют для
определения веществ как вступающих, так и не вступающих в ОВ реакции. Так, при
иодометрическом определении пероксида водорода к аликвоте анализируемого
раствора, содержащего определяемый пероксид водорода в серно-кислой среде,
прибавляют избыточное количество иодида калия: 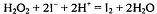 . Выделившийся иод
(заместитель) в количестве, эквивалентном количеству пероксида водорода в
аликвоте, оттитровывают стандартным раствором тиосульфата натрия:
. Выделившийся иод
(заместитель) в количестве, эквивалентном количеству пероксида водорода в
аликвоте, оттитровывают стандартным раствором тиосульфата натрия: 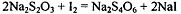 . Рассчеты проводят так
же, как и при прямом титровании.
. Рассчеты проводят так
же, как и при прямом титровании.
Индикаторы
окислительно-восстановительного титрования
Индикатор - вещество, которое при определенном потенциале
раствора раствора окисляется или восстанавливается с изменением цвета.
Индикатор - вещество, вступающее в специфическое
взаимодействие с окислителем или восстановителем с образованием окрашеных
соединений.
ОВ индикаторы представляют собой органические соединения,
окисленная и восстановленная форма которых имеет различные окраски. Изменение
цвета редокс-индикатора обуславливается окислением восстановленной формы индикатора
и превращением ее в окисленную форму или восстановлением окисленной формы и
переходом ее в восстановленную форму при определенном значении потенциала:
 или
или 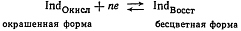
Индикатор дает правильное показание, если момент изменения
его окраски совпадает с точкой эквивалентности.
Применяемые в ОВ титровании индикаторы должны
удовлетворять следующим требованиям:
1) Индикатор должен быть чувствителен, т.е. реагировать
в точке эквивалентности с минимальным избытком окислителя или восстановителя.
2) Окраски окисленной и восстановленной форм индикатора
должны резко отличаться друг от друга.
) Изменение окраски должно быть отчетливо заметно при
применении небольшого количества индикатора.
) Интервал индикатора должен быть невелик.
) Индикатор должен быть устойчив к кислороду воздуха,
свету, углекислому газу воздуха.
Индикаторы ОВ титрования могут быть обратимыми и
необратимыми.
Обратимые индикаторы меняют окраску обратимо
при потенциале раствора в ТЭ или вблизи ее при этом не разрушаются:
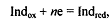
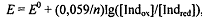 .
.
Дифениламин 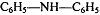 - один из обратимых
индикаторов. Полуреакция:
- один из обратимых
индикаторов. Полуреакция:
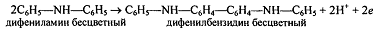
Эта стадия необратима. Образовавщийся бесцветный
дифенилбензидин обратимо окисляется:
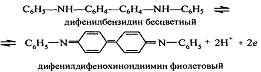
В качестве редокс-индикатора применяют также N-фенилантрониловую
кислоту
(2-дифениламинкарбоновую кислоту), окисленная форма которой имеет
фиолетово-красную окраску:
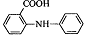
Индикатор ферроин представляет собой комплекс железа (ll) с ортофенантролином
состава 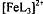 , где L-молекула
ортофенантролина (1,10-фенантролина):
, где L-молекула
ортофенантролина (1,10-фенантролина):
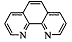

Необратимые индикаторы изменяют окраску при
достижении определенного значения потенциала в ТЭ или вблизи ее и при этом
необратимо разрушаются. К ним относятся: метиловый оранжевый, метиловый
красный, нейтральный красный.
Кривые
окислительно-восстановительного титрования
Кривая ОВ титрования - это графическое
представление изменения потенциала раствора в зависимости от объема
прибавленного раствора. Обычно кривые ОВ титрования строят в координатах E-V (T), где Е-равновесный ОВ
потенциал раствора в данный момент титрования, V (T) - объем прибавленного
титранта, или же в координатах Е-f, где f-степень оттитровнанности раствора.
Расчетные кривые ОВТ строят для того, чтобы определить скачек
титрования с целью подбора соответствующего редокс-индикатора, потенциал
изменения окраски попадал бы внутрь скачка на кривой ОВ титрования.
Если же при титровании не используется редокс-индикатор,
например, в перманганатометрии, то построение кривой титрования не имеет
практического значения и представляет лишь теоретический интерес.
В ОВ реакции 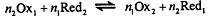 участвуют две редокс-системы - определяемого
вещества и титранта, каждая из которых описывается уравнением Нернста:
участвуют две редокс-системы - определяемого
вещества и титранта, каждая из которых описывается уравнением Нернста:

Титрант (или определяемое вещество) может быть как окислителем, так и
восстановителем. После добавления каждой порции титранта устанавливается
равновесие и Е1=Е2.
До точки эквивалентности весь добавленный титрант превращается
в сопряженную форму, поэтому, чтобы вычислить потенциал Е по полуреакции
титранта, нужно сначала найти его равновесную концентрацию, а для этого следует
рассчитать константу равновесия реакции.
Если определяемое вещество - восстановитель, то до ТЭ
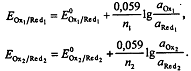 ,
,
После ТЭ
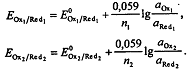
Если определяемое вещество - окислитель, то до ТЭ
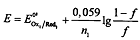
После ТЭ
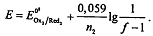
В ТЭ концентрации сопряженных форм полуреакции определяемого
вещества и полуреакции титранта ничтожно малы, поэтому для расчета Етэ
используют формальный прием. Складывают уравнения обеих полурекаций,
предварительно умножив на n1 и n2 для уравнивания числа электронов:
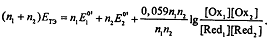
В начале титрования, когда в титруемом растворе находится
значительное количество восстановителя, кривая изменяется плавно, даже при
добавлении значительных количеств величина Е изменяется медленно.
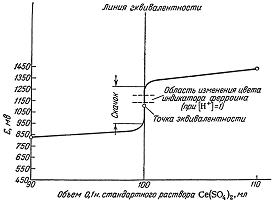
Вблизи ТЭ наблюдается резкое изменение потенциала даже при
добавлении малых количеств реактива. По резкому скачку кривой титрования
устанавливают ТЭ, которая не всегда лежит на середине скачка. Характер кривых в
методах ОВ не зависит от разбавления раствора, если стехиометрические
коэффициенты у окислителя и восстановителя одинаковы.
Перманганатометрическое
титрование
Перманганатометрическое титрование или
перманганатометрия-метод количественного определения веществ (восстановителей,
реже-окислителей и соединений, не обладающих ОВ свойствами) с применением
титранта-раствора перманганата калия 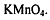 . Метод - фармакопейный,
включен во все известные Фармакопеи.
. Метод - фармакопейный,
включен во все известные Фармакопеи.
Сущность метода.
Перманганат калия - сильный окислитель, обладающий
интенсивной фиолетово-малиновой окраской. В зависимости от кислотности
титруемого раствора окислительные свойства перманганат-иона проявляются
по-разному.
В сильнокислой среде 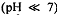 перманганат-ион
восстанавливается до катионов марганца (ll)
перманганат-ион
восстанавливается до катионов марганца (ll) 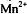 , которые обладают очень
слабой розоватой окраской (практически бесцветны):
, которые обладают очень
слабой розоватой окраской (практически бесцветны): 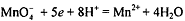 .
.
В нейтральной среде перманганат-ион восстанавливается до
диоксида марганца: 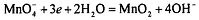 ,
, 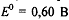 . В нейтральной среде эффективность перманганата
калия как окислителя значиельно ниже, чем в сильнокислых растворах из-за
небольшого ОВ потенциала редокс-пары
. В нейтральной среде эффективность перманганата
калия как окислителя значиельно ниже, чем в сильнокислых растворах из-за
небольшого ОВ потенциала редокс-пары 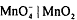 и образующегося в
результате ОВР бурого осадка диоксида марганца затрудняет фиксацию КТТ, осадок
может адсорбировать определяемое вещество, что увеличивает ошибку анализа.
и образующегося в
результате ОВР бурого осадка диоксида марганца затрудняет фиксацию КТТ, осадок
может адсорбировать определяемое вещество, что увеличивает ошибку анализа.
В сильнощелочной среде перманганат-ион восстанавливается до
манганат-иона: 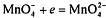 . Образующийся манганат-ион обладает зеленой
окраской умеренной интенсивност, окрашивает раствор в зеленый цвет, что
затрудняет обнаружение изменения окраски раствора и фиксацию КТТ. Манганат-ион
вступаает в реакцию с водой с образованием бурого осадка диоксида марганца и
перманганат-иона, что искажает результаты анализа:
. Образующийся манганат-ион обладает зеленой
окраской умеренной интенсивност, окрашивает раствор в зеленый цвет, что
затрудняет обнаружение изменения окраски раствора и фиксацию КТТ. Манганат-ион
вступаает в реакцию с водой с образованием бурого осадка диоксида марганца и
перманганат-иона, что искажает результаты анализа:  . Стандартный ОВ
потенциал пары
. Стандартный ОВ
потенциал пары 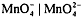 невелик,
невелик,  , Т.о. в щелчных средах
перманганат калия как окислитель менее эффективен.
, Т.о. в щелчных средах
перманганат калия как окислитель менее эффективен.
Вывод: перманганатометрическое титрование
целесообразно проводить в сильнокислых средах.
Условия проведения перманганатометрического
титрования.
1) Влияние рН среды: перманганатометрическое титрование
проводят в сильнокислой среде, что создается введением серной кислоты. Азотную
кислоту применять нельзя, т.к. она является сильным окислителем, может окислять
определяемое вещество. Хлороводородную кислоту также не используют, т.к.
хлорид-ионы окисляются до хлора: 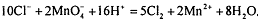 .
.
2) Влияние температуры: проводят при комнатной
температуре. Исключением является реакция перманганат-иона с щавелевой кислотой
и оксалатами, которую проводят при нагревании титруемого раствора.
) Фиксация КТТ: при перманганатометрическом титровании
индикатор не применяется, т.к. сам титрант - раствор перманганата калия -
обладает интенсивной малиново-фиолетовой окраской. Прибавление одной избыточной
капли титтранта в ТЭ приводит к окрашиванию титруемого раствора в розовый цвет.
Окраска КТТ неустойчива, раствор постепенно обесцвечивается из-за того, что
перманганат-ионы взаимодействуют с 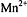 :
: 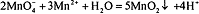 .
.
) Ход титрования: титрование ведут медленно, по каплям
прибавляют раствор титранта. Для титрования применяют бюретки со стеклянными
кранами, использовать резиновые трубки запрещено, т.к. резина взаимодействует с
перманганатом калия.
Титрант метода.
Титрантом является водный раствор перманганата калия с
молярной концентрацией эквивалента 0,1 моль/л. Водные растворы перманганата
калия неустойчивы из-за склонности перманганат-ионов окислять воду: 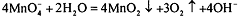 . Разложение
перманганат-ионов ускоряется на свету, при нагревании, под действием кислот и
оснований, в присутствии катионов марганца (ll), диоксида марганца,
который осаждается на стенках сосуда, образуя темный налет.
. Разложение
перманганат-ионов ускоряется на свету, при нагревании, под действием кислот и
оснований, в присутствии катионов марганца (ll), диоксида марганца,
который осаждается на стенках сосуда, образуя темный налет.
В силу указанных обстоятельств стандартный раствор
перманганата калия нельзя готовить по точной навеске. Для получения титранта
вначале готовят раствор перманганата калия с приблизительной концентрацией,
разбавляя водой более концентрированный раствор. Поскольку дистиллированная
вода всегда содержит следы различных веществ, при окислении которых
перманганатом калия образуется диоксид марганца, то приготовленный
первоначальный раствор перманганата калия следует либо прокипятить, охладить и
профильтровать через стеклянный фильтр, либо выдержать длительное время в
темном месте и затем также профильтровать через стеклянный фильтр. Затем
раствор стандартизируют.
Стандартизацию раствора перманганата калия проводят по
различным установочным веществам: 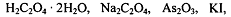
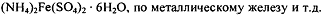 . Часто стандартизацию проводят по стандартному
раствору щавелевой кислоты:
. Часто стандартизацию проводят по стандартному
раствору щавелевой кислоты: 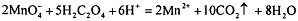 . При комнатной температуре реакция идет
медленно. Она ускоряется по мере накопления катализатора - катионов марганца
. При комнатной температуре реакция идет
медленно. Она ускоряется по мере накопления катализатора - катионов марганца 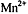 . Поэтому исходный
раствор щавелевой кислоты нагревают до 60-80
. Поэтому исходный
раствор щавелевой кислоты нагревают до 60-80  Вначале титрования
раствор обесцвечивается медленно, при достижении определенной концентрации
катионов марганца реакция протекает быстро.
Вначале титрования
раствор обесцвечивается медленно, при достижении определенной концентрации
катионов марганца реакция протекает быстро.
Стандартизированный раствор перманганата калия хранят в
темной склянке в темном месте.
Применение перманганатометрии.
Перманганатометрическое титрование применяют для определения
веществ: восстановителей 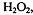
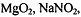 металлическое железо, карбоновые кислоты,
соединения с гидразогруппами
металлическое железо, карбоновые кислоты,
соединения с гидразогруппами 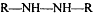 , для определения общей окисляемости почвы.
, для определения общей окисляемости почвы.
Для определения окислителей: дихромат-ионы (к аликвоте
анализируемого дихромата калия прибавляют известное количество раствора 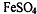 . При этом протекает
реакция:
. При этом протекает
реакция:  ).
).
Дихроматометрическое
титрование
Дихроматометрическое титрование или
дихроматометрия - метод определения веществ, основанный на реакции окисления
дихромат-ионами. Метод фармакопейный.
Сущность метода.
В основе метода лежит полуреакция:
Стандартный ОВ потенциал редокс-пары 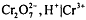 равен при комнатной
температуре
равен при комнатной
температуре 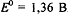 , т.е. имеет довольно высокое значение, поэтому
дихромат-ионы способны окислять в кислой среде целый ряд
веществ-восстановителей. Кислую среду можно создавать, прибавляя серную,
ортофосфорную, хлороводородную кислоту.
, т.е. имеет довольно высокое значение, поэтому
дихромат-ионы способны окислять в кислой среде целый ряд
веществ-восстановителей. Кислую среду можно создавать, прибавляя серную,
ортофосфорную, хлороводородную кислоту.
Титрант метода.
Титрантом метода является водный раствор дихромата калия 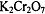 с молярной концентрацией
0,1 моль/л. Титрант готовят по точной навеске дихромата калия высокой степени
чистоты, предварительно дважды перекристаллизованного из воды и высушенного при
150-200
с молярной концентрацией
0,1 моль/л. Титрант готовят по точной навеске дихромата калия высокой степени
чистоты, предварительно дважды перекристаллизованного из воды и высушенного при
150-200  .
.
Кристаллический препарат K2Cr2O7
легко приготовить достаточно чистым, он устойчив при хранении на воздухе,
поэтому титрованные растворы дихромата калия готовят по точной навеске
кристаллической соли. Раствор дихромата калия сохраняет неизменный титр
длительное, неопределенно долгое время, его можно кипятить без разложения.
Железо (II) титруется дихроматом в солянокислой среде без каких-либо побочных
процессов и осложнений. Недостатком реактива является образование в результате
реакции окрашенных ионов Cr3+, затрудняющих своей окраской
фиксирование точки эквивалентности. Поэтому часто возникает необходимость в
применении индикаторов. В качестве индикаторов используют дифениламин, а также
дифениламинсульфоновую кислоту, фенилантраниловую кислоту и др.
Дихроматометрическое титрование применяют для определения Fe (II), Te
(IV), W (III), Mo (III), Sn (II), Ti (III), V (IV), SO32-,
Fe (CN) 64-, органических веществ (гидрохинона, аскорбиновой
кислоты и др.). Дихроматометрию используют также для определения необратимо
восстанавливающихся окислителей (например, хлоратов, нитратов), которые
предварительно восстанавливают известным объемом стандартного раствора Fe (II).
Избыток Fe (II) оттитровывают дихроматом с индикаторами дифениламином,
дифениламиносульфокислотой (в присутствии Н3РО4) или
N-фенилантраниловой кислотой. Этот вариант дихроматометрического титрования
иногда называют обратным феррометрическим титрованием. Дихроматометрическое определение
катионов таких металлов, как Ag (I), Ba, Pb (II), основано на их взаимодействии
с К2Сr2О7 с образованием малорастворимых в
воде хроматов (осадительное титрование). Конечную точку устанавливают с помощью
внеш. индикатора AgNO3. При обратном титровании избыток ионов Сr2О72
- после осаждения хроматов оттитровывают р-ром соли Fe (II) с ферроином в
качестве индикатора или р-ром Na2S2O3 с KI и
крахмалом.
Йодометрия
Йодометрические методы основаны на применении
стандартного раствора тиосульфата натрия для титрования йода, выделившегося при
взаимодействии определяемого окислителя с избытком иодида калия (при титровании
по замещению) или оставшегося в избытке при медленном взаимодействии
определяемого восстановителя с фиксированным объемом стандартного раствора йода
(в случае обратного титрования).
Основы метода
Иодид-ион является восстановителем умеренной силы, его
применяют для определения большого числа окислителей. Прямое титрование
стандартным раствором KI не используют из-за трудностей индикации конечной
точки титрования: прекращение образования свободного йода с помощью крахмала
заметить нельзя. Поэтому для определения окислителей йодометрическим методом
применяют способ титрования по замещению. Прямое титрование окислителей
стандартным раствором тиосульфата натрия невозможно в связи с тем, что только I2
в нейтральной среде окисляет ион S2O32 - быстро
в соответствии со стехиометрией реакции: I2 + 2S2O32-→
2I - + S4O62-. При титровании йода
раствором тиосульфата наиболее благоприятна нейтральная либо слабокислая среда.
Высокая кислотность раствора приводит к разложению тиосульфата: S2O32
- + 2H+→ H2SO3 + S. В щелочной
среде йодометрическое определение также не следует проводить из-за реакции
диспропорционирования йода: I2 + 2OH - → IO - +
I - +H2O.
Приготовление
и стандартизация раствора тиосульфата натрия
Растворы тиосульфата обычно готовят из кристаллического Na2S2О3*5Н2О,
который при хранении постепенно теряет часть кристаллизационной воды.
Свежеприготовленные растворы первое время медленно изменяют свои характеристики
вследствие разложения тиосульфата натрия. По этим причинам готовят обычно
раствор приблизительно необходимой концентрации и стандартизируют его по
другому исходному веществу.
Важнейшими факторами, определяющими устойчивость раствора тиосульфата,
являются значение рН, присутствие микроорганизмов и примесей, концентрация
раствора, присутствие атмосферного кислорода и воздействие прямого солнечного
света. Для приготовления растворов тиосульфата следует применять
дистиллированную воду, не содержащую примесей ионов тяжелых металлов.
В качестве первичного стандарта для растворов Na2S2O3
могут быть окислители КВrО3, КIO3, выделяющие при
взаимодействии с избытком иодид-ионов эквивалентное количество йода, который
титруют стандартизируемым раствором тиосульфата.
Чаще используют бихромат калия К2Сr2О7,
который можно легко получить в химически чистом состоянии перекристаллизацией;
он негигроскопичен и не содержит кристаллизационной воды; растворы его
устойчивы при продолжительном хранении. Способ стандартизации основан на
реакциях:
Сr2О72 - + 6I - +
14Н+ → 2Сr3+ + 3I2 + 7Н2О,2
+ 2S2O32 - → 2I - + S4О62-
Определение восстановителей: растворами йода можно
непосредственно титровать соединения As (III), Sb (III), Sn (II), сульфиты,
сероводород и некоторые другие восстановители.
Йодометрические методы широко применяют для определения многих
органических веществ: формальдегида, сахаров, ацетона, спиртов, азот - и
серосодержащих соединений (семикарбазид, тиомочевина и т.д.).
Йодометрическое определение окислителей:
) реакция иодида с дихроматом: Сr2О72
- + 6I - + 14Н+ → 2Сr3+ + 3I2
+ 7Н2О, определение меди, железа, пероксида водорода.
Винную, лимонную и некоторые другие оксикислоты можно
оттитровывать иодометрическим методом в присутствии ионов кальция, бария,
магния или других катионов, образующих с оксикислотами устойчивые комплексные
соединения. В таких условиях оксикислоты титруют так же, как обычные сильные
кислоты.
Йодиметрия
Йодиметрия - титриметрический метод определения
окислителей и восстановителей, основанный на реакции:
3-+2е =3I - (Е0=0,5355 В).
Ион I3 - образуется при растворении I2
в воде в присутствии KI. Восстановители определяют прямым титрованием раствором
I2 в присутствии избытка KI, окислители - косвенным методом по
количеству йода, образовавшегося при их взаимодействии с KI.
Йодометрией называют также метод установления концентрации
ионов Н+ по кол-ву йода, выделившегося в реакции:
3 - + 5I - + 6Н+ = 3I2
+ 3Н2О.
Йод оттитровывают, как правило, р-ром Na2S2O3.
Конечную точку титрования обнаруживают визуально по появлению или исчезновению
окраски йода (иногда в слое орг. растворителя), с помощью индикаторов, а также
потенциометрически, амперометрически или др. методами. В качестве индикаторов
используют обычно крахмал, реже - кумарин, производные a-пирона и др. Основные
источники погрешностей в иодометрии - летучесть йода, окисление ионов I - кислородом
воздуха с образованием I2, разложение Na2S2O3
в сильнокислой среде, нарушение стехиометрии реакции I3 - с
Na2S2O3 в щелочной среде. Прямая иодометрия
применяется для определения As (III), Sn (II), Sb (III), сульфидов, сульфитов,
тиосульфатов, аскорбиновой к-ты и др., косвенная - для определения Сu (II), О2,
Н2О2, Вr2, броматов, иодатов, гипохлоритов и
др. Иодометрия лежит в основе метода определения воды с помощью Фишера
реактива, т.е. по реакции I2 с SO2 в смеси пиридина и
метанола.
Броматометрия
БРОМАТОМЕТРИЯ - титриметрический метод
определения восстановителей, а также органических соединений, вступающих с
бромом в реакции присоединения или замещения. Основана на применении
солянокислого раствора КВrО3 с известным титром. При титровании
восстановителей бромат превращается в бромид по схеме:
3-+6Н++6е=Вr-+ЗН2О
(Е0=1,45 В).
Для ускорения процесса анализируемые растворы иногда
нагревают до 40-70°С или добавляют к ним катализаторы, например, соли Hg (II),
Mn (II). Конечную точку титрования устанавливают с помощью ОВ индикаторов
(метилового оранжевого, метилового красного, нафтофлавона, хинолинового желтого
и др.), по появлению желтой окраски брома, образующегося при взаимодействии
избытка ВrО3 - с Вr-, а также
потенциометрически или фотометрически.
Метод применяют для определения восстановителей: As (III), Sb
(III), Sn (II), Cu (I), Fe (II), H2O2, гидразина,
гидроксиламина, тиомочевины, аскорбиновой и щавелевой кислот и др. Нитрование
органических соединений ведут при избытке КВr, который предварительно добавляют
в раствор титранта (бромид-броматная смесь) или в анализируемый раствор. При
этом с определяемым веществом взаимодействует бром, образующийся из ВrO3
- и Вг - по уравнению: BrO3-+ 5Вr-+6Н+=
ЗВr2 + ЗН2О. Поэтому этот вариант броматометрии (наз.
также бромид-броматометрией) иногда относят к бромометрии, т.е. к методу,
основанному на применении стандартного раствора Вг2.
Если органическое вещество медленно взаимодействует с
выделяющимся Вr2, к анализируемому раствору прибавляют избыток
бромид-броматной смеси и подкисляют; после завершения бромироваия избыток Вr2
оттитровывают раствором Na2S2O3 в присутствии
KI и крахмала в качестве индикатора или определяют обратным арсенитометрическим
методом. Последний основан на окислении AsO2 - по схеме: AsO2-+ЗН2О
- 2е= AsO43 - + 4H+ (Е0= 0,56 В). В
этом случае к анализируемому раствору, содержащему свободный бром, добавляют
стандартный р-р NaAsO2, избыток которого оттитровывают броматом в
присутствии метилового оранжевого или метилового красного. Иногда для
определения избытка брома к раствору добавляют избыток KI и оттитровывают
выделившийся йод раствором Na2S2O3.
Бромид-броматометрию применяют для определения
фенола, крезола, анилина, резорцина, салициловой кислоты, 8-гидроксихинолина,
ненасыщенных соединений, для косвенного определения катионов Al, Mg, Mn (II),
Ca, Ni, Co, Cu (II), Cd, Fe (III), La (III) и др., образующих с
8-гидроксихинолином нерастворимые в воде комплексные соединения, которые
отделяют, растворяют в кислоте и оттитровывают выделившийся 8-гидроксихинолин.
Нитритометрия
Нитритометрия или нитритометрическое титрование-метод количественного
определения веществ с использованием титранта - раствора нитрита натрия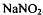 . Метод фармакопейный,
применяется в анализе фармацевтических препаратов.
. Метод фармакопейный,
применяется в анализе фармацевтических препаратов.
Сущность метода.
Метод основан на реакции, протекающей в кислой среде: 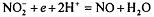 (Е0=0,98).
(Е0=0,98).
Титантом метода является водный раствор нитрита
натрия с молярной концентрацией 0,5 или 0,1 моль/л. Раствор готовят вначале с
приблизительно требуемой концентрацией, а затем стандартизируют по стандартному
раствору сульфаниловой кислоты 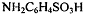 или перманганата калия. Реакция сульфаниловой
кислоты с нитритом натрия в соляно-кислой среде с образованием соли диазония:
или перманганата калия. Реакция сульфаниловой
кислоты с нитритом натрия в соляно-кислой среде с образованием соли диазония:
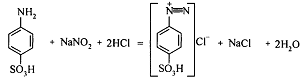
Протекает медленно, поэтому раствор нитрита натрия прибавляют
при интенсивном перемешивании в начале титрования со скоростью  в минуту, а в конце
титрования-0,05 мл в минуту.
в минуту, а в конце
титрования-0,05 мл в минуту.
Конец титрования определяют либо потенциометрически,
либо визуально индикаторным методом в присутствии индикатора - смеси тропеолина
00 (окраска переходит из красной в желтую) с метиловым синим (из малиновой в
синюю) или нейтрального красного (окраска из красно-фиолетовой переходит в
синюю).
Стандартизованный раствор нитрита натрия хранят в темном месте в сосудах
из темного стекла с притертыми пробками.
Применение нитритометрии.
Нитритометрическое титрование применяется для определения
олова (ll), 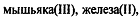 гидразина и его производных, органических
соединений, содержащих первичную или вторичную ароматическую аминогруппу,
ароматических нитропроизводных, гидразидов, включая определение таких
фармацевтических препаратов, как анестезин, дикаин, левомицетин, наганин,
новокаин, новокаинамид, норсульфазол, парацетамол, стрептоцид, сульгин,
сульфацил-натрий, уротропин, этазол и др.
гидразина и его производных, органических
соединений, содержащих первичную или вторичную ароматическую аминогруппу,
ароматических нитропроизводных, гидразидов, включая определение таких
фармацевтических препаратов, как анестезин, дикаин, левомицетин, наганин,
новокаин, новокаинамид, норсульфазол, парацетамол, стрептоцид, сульгин,
сульфацил-натрий, уротропин, этазол и др.
Белый стрептоцид определяют на основе
реакции:
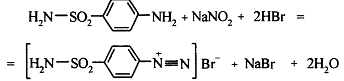
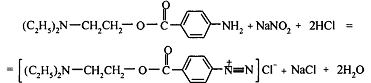
Новокаин:
Левомицетин:
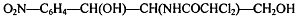 .
.
Цериметрия
Цериметрия или цериметрическое титрование - метод анализа,
основанный на титровании определяемого вещества раствором сульфата церия (lV). Метод фармакопейный. В
основе метода лежит полуреакция:
 .
.
Церий (lV) - сильный окислитель, в растворах присутствует в
форме комплексных соединений. Цериметрическое титрование проводят в кислой
среде. В качестве титранта метода применяют сернокислые растворы сульфата
церия (lV) 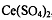 с молярной концентрацией 0,01 или 0,1 моль/л.
Растворы титранта обычно вначале готовят с приблизительной концентрацией, затем
стандартизируют. Стандартизацию сернокислого раствора церия (lV) проводят
йодометрический:
с молярной концентрацией 0,01 или 0,1 моль/л.
Растворы титранта обычно вначале готовят с приблизительной концентрацией, затем
стандартизируют. Стандартизацию сернокислого раствора церия (lV) проводят
йодометрический:
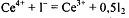
Образовавшийся йод оттитровывают стандартным 0,1 моль/л
раствором тиосульфата натрия в присутствии индикатора-крахмала.
Применение.
Методом цериметрического титрования можно определять многие
вещества - восстановители:  иодиды, нитриты, тиосульфаты,
иодиды, нитриты, тиосульфаты,  пероксид водорода,
щавелевую кислоту и оксалаты, аскорбиновую кислоту, амины, аминокислоты,
фенолы, углеводы, такие фармацевтические препараты, как аминазин, токоферола
ацетат (витамин Е), викасол, этамзилат
пероксид водорода,
щавелевую кислоту и оксалаты, аскорбиновую кислоту, амины, аминокислоты,
фенолы, углеводы, такие фармацевтические препараты, как аминазин, токоферола
ацетат (витамин Е), викасол, этамзилат  .
.
Заключение
Методами окисления-восстановления может быть определено
количественное содержание многих лекарственных средств, которые в достаточной
степени проявляют окислительные или восстановительные свойства; применение
косвенных методов позволяет проводить количественное определение лекарственных
средств, не обладающих окислительно - восстановительными свойствами.
В фармацевтическом анализе применяется большое количество
методов ОВ титрования: иодометрия, броматометрия, перманганатометрия,
цериметрия и др.
Методы окислительно-восстановительного титрования являются
фармакопейными, широко используются в заводской и аптечной технологии лекарств,
практической деятельности провизора. С их помощью определяют многие
лекарственные вещества: йод, новокаин, стрептоцид, перекись водорода,
фурацилин, анальгин, аскорбиновую кислоту, норсульфазол, новокаинамид,
парацетамол, наганин, левомицетин, анестезин, дикаин, сульгин, сульфадимезин,
сульфацил-натрий, уротропин, этазол, аминазин, витамин Е, викасол, этамзилат и
т.д.
Список
литературы
1)
Харитонов Ю.Я. Аналитическая химия, книга 1. Общие теоретические основы.
Качественный анализ. Москва "Высшая школа" 2003.
)
Харитонов Ю.Я. Аналитическая химия. Книга 2. Количественный анализ.
Физико-химические (инструментальные) методы анализа. Москва "Высшая
школа" 2003.
)
Васильев В.П. Аналитическая химия. Книга 1. Гравиметрический и титриметрический
анализ. Москва "Высшая школа" 1989.
)
Крешков А.П. Основы аналитической химии. Книга 2. Теоретические основы.
Количественный анализ. Издательство "Химия" Москва 1971.
)
Золтов Ю.А. Основы аналитической химии. Книга 2. Методы химического анализа.
Москва "Высшая школа" 2004.
)
Золтов Ю.А. Основы аналитической химии. Книга 1. Общие вопросы. Методы
разделения. Москва "Высшая школа" 2000.
7) ХиМиК.ru-сайт
о химии. <http://www.xumuk.ru/>
) Государственная
Фармакопея. Издание 12-ое.