Окисление металлов
Введение
В последние годы интерес к проблемам окисления
металлов значительно возрос. Реакции окисления имеют очень большое практическое
значение. К традиционным проблемам изыскания жаростойких металлических
материалов, предназначенных для изготовления нагревателей, печей,
теплообменников, в настоящее время добавился ряд задач, появившихся в связи с
развитием новых отраслей техники, таких как ракетостроение, производство
полупроводниковых материалов, спекание металлических порошков и др.
Развитие современной техники предъявляет все
новые и более жесткие требования к конструкционным материалам. От них требуется
длительная и надежная работа в условиях высоких температур и давлений,
агрессивных сред и высоких нагрузок. Наиболее широко используемыми в различных сочетаниях
таких экстремальных условиях были и остаются металлы.
Так как чистые металлы редко используются в
качестве конструкционных материалов, вопросы окисления сплавов, особенно методы
повышения их сопротивления окислению, являются с прикладной точки зрения
наиболее важными аспектами высокотемпературного окисления металлов, сплавов и
соединений.
Окисление металлов и сплавов изучают в связи с
тем, что они играют важную роль в различных областях техники, тем не менее
информации подобного рода недостаточно.
1. Литературная часть
.1 Механизмы окисления металлов
В гетерогенных процессах реагирующие компоненты
системы находятся в разных фазах и, естественно, реакции протекают на границе
раздела. В общем случае начало окисления металлов до образования защитной
пленки можно разделить на несколько стадий. К ним относятся перенос молекул из
объема газовой фазы из поверхности металла, адсорбция газа и химическая реакция
на границе раздела фаз, перенос с поверхности металла в объем,
перераспределение кислорода [3].
Понимание поведения металла при окислении
требует знания кинетики и скоростей реакции, их зависимости от температуры и
давления кислорода, а также состава и структуры продуктов реакции.
Наиболее распространенные уравнения скорости
окисления подразделяются на логарифмические, параболические и линейные. Однако
они выражают лишь предельные и идеальные случаи окисления. На практике часто
встречаются отклонения от этих уравнений скорости.
Важное предположение, на котором базируются
почти все теории, заключаются в том, что толщина пленки считается
пропорциональной привесу.
1.1.1 Логарифмические уравнения
скорости окисления
Характер окисления многих металлов при низких
температурах (при температурах ниже 573-673 К) можно описать логарифмическими
уравнениями, содержащими прямые и обратные логарифмические функции, например,
логарифмическим уравнением
x = kлогlog(τ+τ0)
+ A (1)
и обратно логарифмическим уравнением
/x
= B - kоб.логlogτ
(2)
Здесь х может выражать количество кислорода,
расходуемого на единичную площадь поверхности окисляемого металла, количество
металла, перешедшего в оксид, или толщину оксидной пленки при условии, что
пленка однородна и плоскопараллельна поверхности металла; τ
- продолжительность взаимодействия; kлог
и
kоб.лог
- константы логарифмической и обратно логарифмической скоростей; А и В -
постоянные. На рисунке 1 графически представлены примеры двух таких уравнений.
1.1.2 Параболические уравнения
скорости окисления
Установлено, что при высоких температурах многие
металлы следуют параболической временной зависимости окисления (рисунок 1)
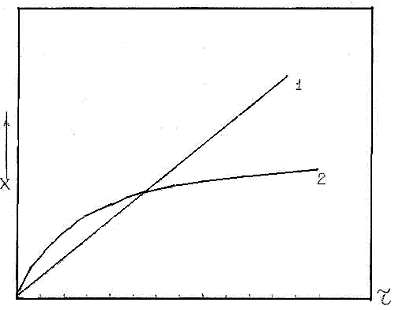
Рисунок 1 - Линейный (1) и параболический (2)
законы окисления
Параболическое уравнение записывается в
дифференциальном и интегральном виде[3]:
dx/dτ=k'пар/х,
(3)
х2=kпарτ
+ Спар, (4)
где k'пар
и kпар -
константы параболической скорости, а Спар - постоянная
интегрирования. Параболический закон высокотемпературного окисления означает,
что скорость окисления лимитируется скоростью термодиффузии [1,2].
.1.3 Линейное уравнение скорости
окисления
Окисление, подчиняющееся линейной
закономерности, можно охарактеризовать в виде [3]:
dx/dτ
= k (5)
х = kлинτ
+ С, (6)
где k
- константа линейной скорости, а С - постоянная интегрирования.
Скорость линейного окисления постоянна во
времени и, таким образом, не зависит от количества уже прореагировавшего газа
или металла. Если зависимость линейна, скорость окисления лимитируется
процессом или реакцией на поверхности или фазовой границе. К ним могут,
например, относиться установившаяся реакция, скорость которой лимитируется
подводом (адсорбцией) кислорода к поверхности, или реакция, управляемая
образованием оксида с установившейся скоростью на границе раздела металл -
оксид.
1.1.4 Сочетание уравнений скорости
окисления
Часто скорость реакций окисления подчиняется
совокупности закономерностей. Это может означать, например, что окисление
происходит одновременно по двум механизмам, один из которых преобладает на
начальных стадиях, а другой - после продолжительного окисления. Это может означать
также, что механизм, определяющий скорость окисления, меняется вследствие
изменения природы окалины и т.п. [7].
Реакции окисления, промежуточные между
логарифмическими и параболическими, приближенно характеризуются уравнением
xm = kmτ
+ Cm. (7)
Если m
= 3 или 4, то такие уравнения называются соответственно кубическими или
четвертой степени. Такие уравнения приложимы, например, тогда, когда общее
окисление охватывает два процесса, один из которых подчиняется логарифмической,
а другой - параболической закономерностям. При высоких температурах
параболическое окисление часто сочетается с линейным.
Скорость реакций на начальной стадии может
лимитироваться процессами, протекающими на поверхностях раздела (линейная
закономерность), а после продолжительного окисления преобладающим механизмом
может стать диффузия (параболическая закономерность). Такой характер окисления
описывается соотношением
х2 = kлинx
= kпарτ
+ С. (8)
Это уравнение называют также общим
параболическим уравнением скорости.
В некоторых системах можно наблюдать, что
окисление вначале идет по параболическому закону, а затем скорость реакции
постепенно становится линейной [3]. Такая ситуация возникает тогда, когда
плотная окалина, растущая с параболической скоростью, превращается с линейной скоростью
в наружный пористый оксидный слой, не обладающий защитными свойствами. Это
сочетание параболического окисления с линейным называют «паралинейным»
окислением. Его можно выразить следующим соотношением:
х = (kпар/kлин)ln(kпар/kпар-
kлин(x-
kлинτ)),
(9)
где x
- количество металла, окислившегося за время τ.
При выводе рассматривавшихся уравнений скорости
предполагалось, что площадь поверхности образца остается постоянной во времени,
но данное предположение нельзя считать корректным, поскольку по молярному
объему оксид отличается от металла.
металлический печь
окисление
1.2 Теории окисления металлов
.2.1 Теория Вагнера
Окисление металлов при высоких температурах
приводит в большинстве случаев к образованию на поверхности металла оксидной
пленки, или окалины. Механизм окисления зависит от природы окалины, т.е. от
того, в твердом или жидком состоянии образуется оксид, и не испаряется ли он
частично при этом. Если образуется твердая окалина, то характер окисления
зависит еще и от ее плотности или пористости.
Плотная окалина служит преградой, разделяющей
металл и газообразный кислород. Если на поверхности оксида находится
достаточное количество кислорода, то скорость окисления при высоких
температурах определяется диффузией в твердом состоянии через плотную окалину,
например, объемной диффузией. Плотная окалина обладает наилучшими защитными
свойствами и с практической точки зрения представляет собой самую важную
особенность окисления металлов [8].
Теория Вагнера применима к плотной окалине,
образованной продуктами реакции. Предполагается, что объемная диффузия
реагирующих ионов или перенос электронов через растущую окалину определяют
скорость всей реакции. Считается, что электроны и ионы мигрируют независимо
друг от друга. Поскольку диффузия через окалину определяет скорость окисления,
предполагается, что реакции на границах фаз протекают быстро, и что
термодинамическое равновесие между оксидом и газообразным кислородом
устанавливается на поверхности раздела оксид - кислород, а между металлом и
оксидом - на фазовой границе между ними. Движущей силой реакции служит
изменение свободной энергии, связанное с образованием оксида МО из металла М и
газообразного кислорода, в результате чего в оксиде возникают градиенты
концентрации компонентов [1-3].
1.2.2 Теория Мота и Кабрера
Согласно этой теории [1], оксидный слой
возникает при таких низких температурах, что диффузия ионов через пленку
затруднена. В этом случае электроны металла могут проходить тонкий еще слой
оксида вследствие туннельного эффекта либо в результате термоионной эмиссии и
на внешней поверхности пленки реагировать с кислородом. В таком случае очень
быстро возникает слой хемисорбированного кислорода, и в то же время в оксиде
формируется значительное электрическое поле. Это поле способствует миграции положительных
ионов к поверхности раздела оксид - газ. В противоположность тому, что
происходит при наличии толстых слоев, где градиент концентрации играет основную
роль, для тонкой пленки основную роль будет играть градиент потенциала, т.е.
причиной переноса вещества через пленку является электрическое поле. Эта теория
позволяет, прежде всего, определить критическую толщину Хо, выше
которой применима теория Вагнера, а ниже которой необходимо использовать теорию
для тонких пленок. Сделан вывод, что если слой достигает толщины 2 -10-4
см за несколько часов (104 с), то он растет по механизму толстых
пленок; при меньших скоростях образуется тонкая пленка.
1.2.3 Теория Фромхолда
В своих работах Фромхолд описывает кинетику
роста оксидных пленок на металлических системах. Основные положения
кинетической модели Фромхолда состоят в следующем [4]:
1. Предположено,
что кинетика окисления металлов в общем случае определяется процессом переноса
заряженных частиц через гомогенную оксидную пленку и может быть описана системой
обычных макроскопических уравнений диффузии, объединенных по электрическому
полю в оксиде.
2. Граничные
условия для такой системы диффузионных уравнений непосредственно связаны с
граничными концентрациями диффундирующих частиц, которые, в свою очередь,
определяются соотношением скоростей процессов, протекающих на обеих
поверхностях раздела газ - оксид и оксид - металл.
3. Для
роста оксидных пленок во всех случаях, когда концентрация дефектов не
превосходит 10% от общей концентрации атомов, справедливо так называемое
«равновесное приближение», согласно которому dIi/dx=0
(I - величина ионного
тока) [10].
2.
Экспериментальная часть
.1 Методика эксперимента
Исследование кинетики окисления сплавов на
основе меди проводили методом высокотемпературной гравиметрии [2,5]. Схема
экспериментальной установки представлена на рисунке 2.
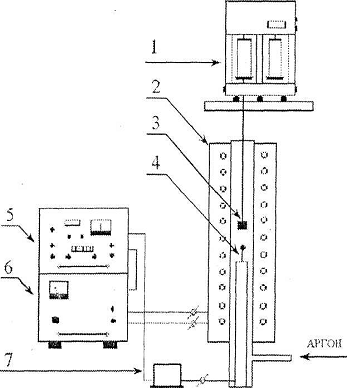
Рисунок 2 - Схема экспериментальной установки. 1
- аналитические весы ВЛР-200; 2 - печь сопротивления; 3 - тигель с исследуемым
образцом; 4 - термопара; 5 - регулирующий блок РИФ-101; 6 - силовой блок
РИФ-101; 7 - термостат
Исследовались сплавы состава 93,22Cu-6,78Sn
и 86,85Cu-13,15Sn
при значениях температуры 773 К, 973 К и 1073 К.
Эксперимент проводили следующим образом. Печь
нагревали до требуемой температуры. Затем опускали тигель с исследуемым
образцом. Окисление твердых сплавов проводили на воздухе в течение трех часов,
измеряли увеличение массы вследствие роста оксидной пленки во времени при
данной температуре. Изменение массы образца фиксировали на весах ВЛР-200,
температуру в печи сопротивления поддерживали и регулировали с помощью
регулятора РИФ-101.
Оценку относительной ошибки эксперимента провели
по соотношению
δКот = √(Δm/Δm1)2
+ (Δτ/τ)2
+ (Δl/l)2
+ (ΔKT/K)2
. (10)
С учетом чувствительности Δm1,
измерения веса навески Δm
за время τ, площади образца S
и влияния погрешности поддержания температуры ΔKT,
значение δКот =
1,98%.
2.2 Результаты опытов и их
обсуждение
Основные характеристики исследуемых образцов
представлены в таблице - 1. Статистическую обработку экспериментальных
результатов проводили по стандартной компьютерной программе «Sigma
Plot2000».
Таблица - 1. Основные характеристики исследуемых
образцов
|
Т,
К
|
Состав
образца
|
|
773
|
0,6080
|
93,22Cu-6,78Sn
|
|
773
|
0,7070
|
86,85Cu-13,15Sn
|
|
973
|
0,6058
|
93,22Cu-6,78Sn
|
|
973
|
0,7050
|
86,85Cu-13,15Sn
|
|
1073
|
0,6034
|
93,22Cu-6,78Sn
|
|
1073
|
0,7040
|
86,85Cu-13,15Sn
|
Изучение кинетики окисления сплавов проводилось
при температурах 773 К, 973 К и 1073 К. Данные окисления этих сплавов представлены
на рисунке 3.
Как видно, окисление рассмотренных сплавов
характеризуется параболической зависимостью: экспериментальные точки
укладываются на прямые в координатах (Δm/S)2
~ τ.
Это свидетельствует о том, что лимитирующей стадией процесса является диффузия
ионов металла и кислорода через растущую оксидную пленку. Исключение составляет
окисление сплава 93,22Cu-6,78Sn
при Т = 773 К, экспериментальные точки укладываются на прямую в координатах Δm/S
~ τ.
Следовательно, этот процесс лимитируется реакцией на поверхности или фазовой
границе.
С наибольшей скоростью корродировал сплав 93,22Cu-6,78Sn
при Т = 1073 К. Его окисление характеризуется параболической зависимостью
(рисунок 3,б): экспериментальные точки укладываются на прямую (в параболических
координатах) с коэффициентом корреляции r
= 0,9902.
С несколько меньшей скоростью корродировал сплав
состава 86,85Cu-13,15Sn
при Т = 1073 К. Его окисление характеризуется параболической зависимостью
(рисунок 3,б): экспериментальные точки укладываются на прямую (в параболических
координатах) с коэффициентом корреляции r
= 0,9883.
Окисление сплава 86,85Cu-13,15Sn
при Т = 973 К также описывается параболическим законом (рисунок 3,б):
экспериментальные точки укладываются на прямую (в параболических координатах) с
коэффициентом корреляции r
= 0,9895. Скорость коррозии в этом случае еще ниже.
Далее по убыванию скорости коррозии - окисление
сплава 93,22Cu-6,78Sn
при Т = 973 К. Экспериментальные точки укладываются на прямую (в параболических
координатах) с коэффициентом корреляции r
= 0,9393 (рисунок 3,б).
Еще ниже скорость коррозии при окислении сплава
состава 93,22Cu-6,78Sn
при Т = 773 К. Экспериментальные точки укладываются на прямую (в линейных
координатах) с коэффициентом корреляции r
= 0,992 (рисунок 3,а).
Самая низкая скорость коррозии - при окислении
сплава 86,85Cu-13,15Sn
при Т = 773 К. Экспериментальные точки укладываются на прямую (в параболических
координатах) с коэффициентом корреляции r
= 0,949 (рисунок 3,б).

Рис. а)

Рис. б) Кинетика окисления: а) Δm/S=f(τ);
б)
(Δm/S)2=
f(τ)
1 - сплав 86,85Cu
- 13,15 Sn, T
= 773 K; 2 - сплав 93,22Cu
- 6,78Sn, T
= 773 K; 3 - сплав 86,85Cu
- 13,15 Sn, Т = 973 К;
4 - сплав 93,22Cu
- 6,78Sn, Т = 973 К;
5 - сплав 86,85Cu
- 13,15 Sn, Т = 1073
К; 6 - сплав 93,22Cu
- 6,78Sn, Т = 1073 К
Можно сделать вывод, что с увеличением
концентрации олова скорость коррозии уменьшается и, следовательно, коррозионная
стойкость увеличивается.
Исходя из того, коррозия проходит по параболическому
закону, то есть лимитирующая стадия - это диффузия ионов металла и кислорода
через растущую оксидную пленку, можно предположить, что образующийся оксид
олова обладает малой диффузионной проницаемостью и поэтому замедляет процесс
окисления.
Кроме того, по оценкам [11-12], легирующие
компоненты образуют оксиды с разной растворимостью в меди. По олову авторы
данных не приводят, но возможно оксид олова малорастворим в меди и выделяется
на границе МО-О, что препятствует дальнейшему окислению сплава.
Термодинамические расчеты показывают, что
образование оксида олова(IV)
термодинамически более выгодно, чем образование оксидов меди, поэтому,
вероятно, концентрация олова в значительной степени определяет коррозионную
стойкость сплава на основе меди. Также и по данным [13-14] медь, легированная
оловом превосходит чистую медь по антикоррозионным свойствам и прочности.
Выводы
1. Методом высокотемпературной гравиметрии
проведено исследование процессов окисления кислородом воздуха сплавов на основе
меди следующего состава: 93,22Cu-6,78Sn
и 86,85Cu-13,15Sn
при температурах 773 К, 973 К и 1073 К.
2. Установлены закономерности окисления
твердых сплавов на основе меди при данных температурах. Окисление рассмотренных
сплавов идет по параболическому закону во всех случаях, кроме процесса
окисления сплава 93,22Cu-6,78Sn
при Т = 773 К, который идет по линейному закону.
3. Показано, что образцы с большим
содержанием меди окисляются значительно быстрее. Исключение составило окисление
при температуре 973 К. Возможно, это связано с тем, что образовавшая пленка в
этом случае очень легко отслаивалась.
4. Показано, что повышение температуры
увеличивает скорость окисления двух исследуемых сплавов.
Список литературы
1. Бенар
Ж. Окисление металлов. Теоретические основы / Ж. Бенар. - М.: Металлургия,
1968. - 499 с.
2. Талашманова,
Ю.С. Окисление сплавов системы Cu-Sn-Pb/ Ю.С.Талашманова, Л.Т.Антонова,
В.М.Денисов, Н.В.Белоусова, С.Д.Кирик, Н.В.Мазняк // Вестник Красноярского
государственного университета. - 2004. - №2. - С. 52-55.
. Кофстад,
П.Н. Высокотемпературное окисление металлов /П.Н. Кофстад. - М.: Мир, 1969. -
392 с.
. Лепинских,
Б.М. Окисление жидких металлов и сплавов / Б.М. Лепинских, А.А. Киташев, А.А.
Белоусов. - М.: Наука, 1979. - 116 с.
. Лепинских,
Б.М. Об окислении металлов и сплавов кислородом из газовой фазы / Б.М.
Лепинских, В.И. Киселев// Металлы. - 1974. - № 5. - С. 51 - 54.
. Кубашевский,
О. В. Окисление металлов и сплавов / О.В. Кубашевский, Б.А. Гопкинс. - М.:
Металлургия, 1968. - 428 с.
. Введение
в высокотемпературное окисление металлов/ Н. Биркс, Дж. Майер, Пер. с англ. /
Под ред. Е. А. Ульянина. - М.: Металлургия, 1987. - 184 с.
. Жук,
Н.П. Курс теории коррозии и защиты металлов / Н.П.Жук. - М.: Металлургия, 1976.
- 472 с.
. Баре,
П. Кинетика гетерогенных процессов / П. Баре. - М.: Мир, 1976. - 276 с.
. Жуков,
А.П. Основы металловедения и теории коррозии / А.П. Жуков, А.И. Малахов - М.:
Высш. шк., 1991. - 186 с.
. Данелия,
Е.П. Внутреннеокисленные сплавы / Е.П. Данелия, В.М. Розенберг - М.:
Металлургия, 1978. - 232 с.
. Данелия,
Е.П. Рост гетерофазной зоны при диффузионном насыщении бинарных сплавов
кислородом / Е.П. Данелия, А.С. Штейнберг//ФММ. - 1985. - вып.1. - С. 120 -
129.
. Смирягин,
А.П. Промышленные цветные металлы и сплавы / А.П. Смирягин, Н.А. Смирягина -
М.: Металлургия, 1974. - 312 с.
. Колачев,
Б.А. Металловедение и термическая обработка цветных металлов и сплавов / Б. А.
Колачев, В. Л. Ливанов, В.И. Елагин - М.: Высш.шк, 1981. - 246 с.
15.