Мягкие методы получения енаминов
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
БЕЛОРУССКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ХИМИЧЕСКИЙ
ФАКУЛЬТЕТ
Кафедра
органической химии
КУРСОВАЯ
РАБОТА
Мягкие
методы получения енаминов
Исполнитель:
студент 2 курса 7 группы
Рылко Р.В.
Руководитель: Ильина Н.А.
Минск 2014
Введение
Енамины важные органические соединения, которые
участвуют в различных важных превращениях, таких как алкилирование,
ацилирование, сопряжённого присоединения, образование гетероциклов и
циклоприсоеденения. Енамины могут по средствам ассиметричного гидрирования
давать хиральные амины, которые являются важными соединениями для
фармацевтической промышленности, а также применяемые как органические
катализаторы или ассиметричные лиганды.
Енамины выступают в качестве нуклеофильных регентов в
реакциях сопряжённого присоединения по Михаэлю. Примером данного превращения
является реакция Сторка, включающая в себя три стадии: 1) образование енамина;
2) присоединение енамина к α, β-кетону; 3) гидролиз продукта
присоединения до 1,5-дикетона. [1]


Общие методы синтеза енаминов
Основным способом получения енаминов является
конденсация альдегидов и кетонов с вторичными аминами под действием кислот
Брёнстеда или Льюиса в качестве катализатора.
Процесс начинается с присоединения амина к
карбонильной группе, к наиболее электродефицитному атому (атому углерода
карбонильной группы). Однако отщепление воды (стадия г) не может привести к
образованию нейтрального продукта. Образуется соль иммония. [2]
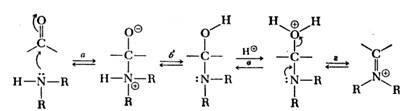
Если у атома углерода, связанного с карбонильной
группой, имеется атом водорода, то на стадии образования иона иммония он
отщепляется, что приводит к образованию нейтральной частицы - енамина (алкен
+ амин).
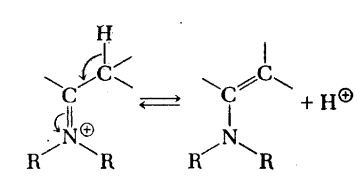
Однако для проведения такой реакции обычно требуется
высокая температура, водоотнимающие вещества или азеотропная перегонка, которая
исключает возможность использования термочувствительных субстратов и
ограничивает использование некоторых функциональных групп.
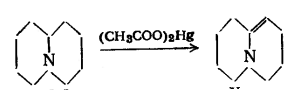
Также енамины можно получать путём окисления
циклических третичных аминов ацетатом ртути в присутствии 5%-ной уксусной
кислоты при кипячении с обратным холодильником с выходом в 60%. [3]
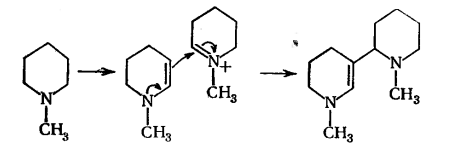
Из алкилзамещённых 1-алкилпиперидинов (ряд
моноциклических третичных аминов) получены соответствующие Δ2-тетрагидропиридины. На промежуточной стадии реакции
енамин реагирует с иминиевой формой. [3]
Мягкие методы получения енаминов
енамин конденсация альдегид катализатор
Известны мягкие методы получения енаминов из
альдегидов. Реакцию проводят при низкой температуре (0°С) в присутствии
большого количества молекулярных сит.
Также разработана мягкая двустадийная процедура по
образованию енаминов при участии бензотриазола. Кроме того, в реакции
образования енаминов большое количество переходных металлов могут быть
использованы в реакциях кросс-сочетания, подобных реакции аминирования
Бухвальда-Хартвига с палладиевым или медным катализатором. Например,
используется Rh(CO)2(acac)
с NAPHOS в реакции гидроаминометилирования
различных алкенов, действием на них CO/H2 при высоком давлении, получаются
енамины с высокими выходами и селективностью. [4]
Палладий катализируемая реакция аминирования
Бухвальда-Хартвига является отличным методом для образования ароматических C - N-связей в синтетически полезных ариламинах. [5] Также данный
метод применим для аминирования винилгалидов, которое приводит к образованию
енаминов. Примером данного превращения является синтез N-винилазолов: [6]
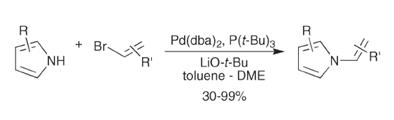
Для кросс-сочетания индола и транс-β-стирина оптимальным является
сочетание Pd(dba)2 и P(t-Bu)3 в смеси толуола и DME. Интересно, что природа основания
играет ведущую роль. Если использовать оба сильных основания, то это ведёт к
снижению выхода из-за конкурирующей реакции β-элиминирования. При проведении
реакции наиболее эффективными лигандами являются ацетат, dba, бифенилмонофосфин, BINAP (Pd(OAc)2, Pd2(dba)3).
Примечательно, что на протяжении всего процесса стерео- и региохимия
винилгалида сохраняется. Температура проведения реакции колеблется от 40°С до
90°С, в зависимости от субстратов. [6]
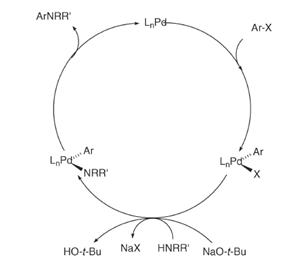
Механизм реакции включает в себя окисление комплекса
палладия(0) под действием винил(арил)галида. В присутствии амина и основания
комплекс палладия превращается в соответствующий винил(арил)палладий амид.
Далее восстановительное элиминирование даёт енамин (ариламин) и регенерирует
комплекс палладия (0), замыкая каталитический цикл. [6]
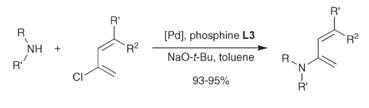
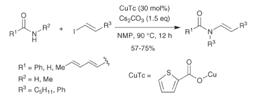
Также в реакциях кросс-сочетания для получения аминов
в качестве катализатора можно использовать медь. Огромное разнообразие
недорогих солей меди доступно в большом количестве. Однако, для проведения
реакции нужны жёсткие условия (высокая температура, использование сильных
оснований, стехиометрические количества меди или соли меди, большая
продолжительность реакции) и выходы получались низкие. Но были найдены решения
данной проблемы, которые позволили использовать каталитические количества меди,
при умеренной температуре. Одним из таких решений является использование аминов
в качестве лигандов: [6]

Каталитическое восстановление амидов с гидросиланами
хорошо известны в литературе, и это преобразование обычно приводит к
образованию аминов. Прямое образование енаминов из амидов в условиях
гидросилирования является реакцией гораздо менее изученой. Разработан метод
гидросилирования восстановления амидов до альдегидов, где промежуточный продукт
был охарактеризован как енамин. Гидросилированию способствовало
стехиометрическое количество Ti(Oi-Pr)4 в сочетании с Ph2SiH2.
Известны некоторые каталитические методики
восстановления амидов с использованием гидросилилов, и в некоторых случаях было
замечено, что в качестве нежелательных продуктов образуются енамины. Исходя из
этого наблюдения, стали исследоваться методы прямого превращения амидов в
енамины. Успешным оказался метод, где IrCl(CO)(PPh3)2
использовали вместе с 1,1,3,3-тетраметилдисилоксан (TMDS) или
полиметилгидросилоксан (PMHS) как источник водорода для восстановления
алифатических и бензильных третичных амидов в енамины при комнатной
температуре. [4]
Недавно разработали эффективную каталитическую систему
на основе NHC/Fe для восстановления третичных бензамидов до соответствующим им
аминам в условиях гидросилирования. В этом методе, бензиловый третичный амид оказалось
трудно восстановить. Вместо ожидаемого амина отмечается формирование енамина в
следовых количествах, остальное непрореагировавший исходный реагент. [4]
Схема 1. Прямое каталитическое превращение амида в
енамин
В попытке облегчить восстановление третичного амида,
температуру реакции повысили с 65°С до 120°С. Тем не менее, данные изменения не
повысили выход амина, вместо этого наблюдалось селективное превращение в енамин
с 87%-ым выходом. На основе полученных данных можно подобрать наиболее
благоприятные условия реакции для увеличения выхода енамина. Изменяя NHC (N-гетероциклический карбен) лиганд, наблюдается повышение
выхода енамина до 95%. Однако высокие температурные условия реакции всё ещё
необходимы. [4] Исследования с различными добавками показали, что 20 М хлорид
лития может катализировать реакцию без добавления железа. Что более важно,
обыкновенный бутил лития может быть использован как катализатор для
восстановления третичных аминов до енаминов при температуре реакции 65°С.
Анализ различных оснований, которые могут выступать катализаторами данной
реакции, показал, что трет-бутоксид калия оказался наиболее активным и привёл к
высоким выходам. Замена растворителя на CH2Cl2 или MeCN не приводит к превращению исходного амида, в то время
как в толуоле степень превращения амида несколько ниже по сравнению с
протекающей реакцией в THF. В
качестве восстанавливающих агентов сравнивались различные силаны (PMHS,TMDS, Ph2SiH2,
(EtO)2MeSiH), и было установлено, что только триэтокси- и
триметоксисиланы были достаточно активны для протекания реакции. Чтобы избежать
потенциального влияния примесей переходных металлов в основании, применяется
очень чистый трет-бутоксид калия (99,99%) во всех дальнейших восстановительных реакциях.
Использование более чистого трет-бутоксида калии приводит к увеличению выхода
енаминов. Так же были установлены оптимальные концентрации растворителя и
эквивалента силана. [4]
Исследуя применимость реакции, различные третичные
амиды восстанавливали до енаминов при оптимальных условиях реакции.
Ароматические, гетероароматические и алифатические енамины образуются из
соответствующих третичных аминов с хорошей селективностью и выходом.
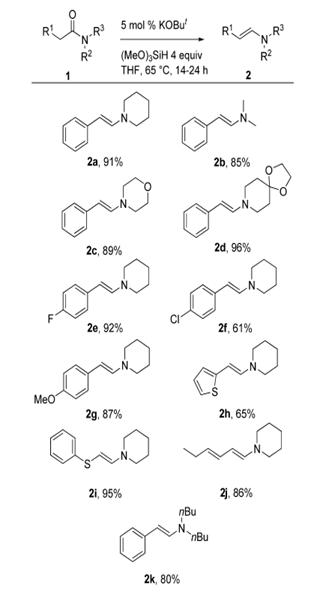
Схема 2. Применимость каталитического восстановления
амидов до енаминов
Реакцию для получения субстрата 2а также проводили в
2-метилтетрагидрофуране как в более благоприятном растворителе без уменьшения
выхода продукта. Синтетически важные ароматические галиды, которые
чувствительны к реакции восстановления, остаются неизменными в условиях
протекающей реакции (2e и 2f). Кроме того, енамин 2i, получаемый из тиофенолзамещённого
амида, может иметь огромную важность в синтезе, так как из него можно получить
более замещённое соединение. [4]
Механизм получения енаминов
Вероятный механизм реакции превращения третичного
амида в енамин [4]:
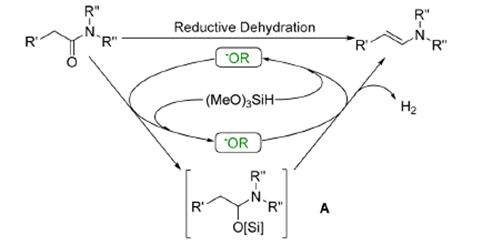
Схема 3. Вероятный механизм реакции превращения
третичного амида в енамин
Вероятно, основание активирует силан через образование
пятикоординационного промежуточного состояния, которое облегчает перенос
гидрид-иона к карбонильной группе амида, образуя тетраэдрический интермедиат А
(схема 3). По-видимому, промежуточный алкоголят немедленно захватывается
силаном. В отличие от реакциия восстановления амидов до аминов, в данном случае
α-водород отрывается с последующим
устранением силилового эфира, который приводит к образованию енамина. Также
существует возможность для депротонирования изначально образующегося иминиевого
промежуточного состояния, однако это маловероятно из-за высокой активности
солей имминия по отношению к восстанавливающим реагентам. Выделение
значительного количества газа, наблюдаемое в течение реакции, предполагает
возможность, где гидрид-ион выступает как основание на стадии депротонирования.
Последнее может также объяснить необходимость избытка силилового реагента. [4]

Схема 4. Побочные продукты при образовании енаминов
При восстановлении соединения 1I (схема 4), образуется бипродукт,
характеризуемый как аминоамид (3). Очевидно, что изначально после образования
енамина, эти нуклеофильные частицы атакуют непрореагировавший исходный амид, и
после отщепления стабильного аниона образуется интермедиат в виде имина В
(схема 4). Тот факт, что выделяют дифенилметан с выходом 78% также поддерживает
предложенный механизм. Последующее восстановление имина даёт аминоамид (3).
Протекание такой реакции возможно, так как амид в конечном продукте остаётся
нетронутым благодаря значительным стерическим затруднениям вокруг этой группы.
Интересно, что если триметоксисилан заменить на более стерически затруднённый
триэтоксисилан, соединение 3 становится мажорным продуктом с изолированным
выходом в 77%. [4]
Описанная методика для синтеза различных енаминов
может быть успешно расширена для синтеза более сложных соединений.
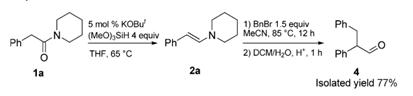
Схема 5. Получение енаминов и дальнейшее
региоселективное алкилирование
Альдегид 4 был успешно синтезирован из амида 1а через
региоселективное алкилирование промежуточного енамина 2а и дальнейшего
гидролиза. Выход альдегида составил 77% (схема 5). [4]
Алифатические енамины оказалось трудно выделить из-за
их высокой реакционной способности, однако оказалось возможным использовать
енамин 2m напрямую, без очистки, для синтеза β-аминоспирта 5 по средствам
гидроборирования и последующего окислительного расщепления (схема 6). [4]

Схема 5. Синтез аминоспирта гидроборированием енамина
Список литературы
Органическая химия/ О.А. Реутов. В 4-х томах. - Т.3. - Москва: БИНОМ.
Лаборатория знаний, 2010. - 544 с.
Современная органическая химия/ А. Терней. В 2-х томах. - Т.2. - Москва:
Мир, 1981. - 678с.
Успехи органической химии/ Под ред. И. Л. Кнунянца. Т. 4. - Москва: Мир,
1966. - 346 с.
Volkov, A. Catalytic Reductive Dehydration of Tertiary Amides
to Enamines under Hydrosilylation Conditions/ A. Volkov, F. Tinnis, H.
Addolfsson// Organic Letters. 2014. V. 16. №3. P. 652-655., C. A Highly
Effective Catalyst System for the Pd-Catalyzed Amination of Vinyl Bromides and
Chlorides/ C. Reddy, V. Reddy, S. Urgaonkar, J.G. Verkade// Org. Lett. 2005.
V.7. №20. P. 4427-4430., J.R. Synthesis of enamines, enol ethers and related
compounds by cross-coupling reactions/ J.R. Dehli, J. Legros, C. Bolm//
ChemComm. 2005. №8. P. 973-986., J. Stoichiometric Enamine Chemistry/ J. Lockner//
Baran Group Meeting. 2007. P. 1-5.