Кинетические теории в контексте химического знания
Министерство
образования и науки РФ
Федеральное
государственное бюджетное образовательное учреждение высшего профессионального
образования
Ивановский
государственный химико-технологический университет
Гуманитарный
факультет
Кафедра
философии
РЕФЕРАТ
по курсу
«Физическая химия»
«Кинетические
теории в контексте химического знания»
Выполнил:
Ивлев П.А.
Иваново
Содержание
Введение
. История становления кинетических
теорий
. Кинетические теории, как способ
познания химических систем. Третья концептуальная система химии
Заключение
Список использованной литературы
Введение
Одним из основных направлений физической химии
является химическая кинетика, которая занимается изучением скоростей химических
реакций. Важность кинетики для химиков трудно переоценить. Именно знание
скорости, с которой образуется продукт реакции; механизма реакции, понимание
кинетических теорий в целом, и определение их границ «физикализации» и
«биологизации» химии позволит рационально сочетать теоретические и
экспериментальные исследования, оптимальным образом организовать его
производство.
Таким образом, целью данной работы является
анализ истории и причин возникновение кинетических теорий, их место в
философских проблемах химии.
1. История становления кинетических теорий
Фундаментальный шаг для развития современных
кинетических теорий, и для химической кинетики в целом, произошел во времена
(60-ые года XIX в.)
широкого признания химической статики, когда К.М. Гульдбергом и П. Вааге был
открыт закон действующих масс и создана количественная теория химического
равновесия. Позднее Я.Г. Вант-Гофф вводит термин «концентрация» и выражает
уравнение для закона действующих масс (уравнение 2), которое становится
основным уравнением химической кинетики.
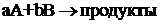
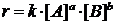
химия кинетический термодинамика
энергия
Открытие этого закона позволило посредством
изменения концентрации реагирующих веществ управлять ходом процесса.
В 1877 г. Г. Гельмгольц заявил о «термодинамике
химических процессов» и ввел представление о свободной энергии (впоследствии
энергии Гиббса, G), выразив
ее через уравнение (3), благодаря которому показал, что эта термодинамическая
функция является критерием термодинамического процесса.
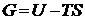
Выделение Гельмгольцем химической
термодинамики в самостоятельное направление учения о химическом процессе,
позволило Я.Г. Вант-Гоффу подвести термодинамический фундамент под закон
действующих масс, выразив его через предложенные им понятия и термины -
константу равновесия K и концентрации c1 и c2 начальных и
конечных веществ:
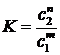
где n и m -
стехиометрические коэффициенты прямой и обратной реакции и вывел уравнение
изобары реакции (уравнение 5), которое позволило установить зависимость
константы равновесия от изменения температуры и теплового эффекта реакции.
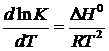
В 1884 г. Ле Шателье сформулировал
принцип подвижного равновесия, вооружив химиков методами сознательного
управления смещения равновесия в сторону образования целевых продуктов [I, с.16-18 и
3, с.111-113].
Следует отметить, что первые
исследования в области кинетики химических реакций носили феноменологический
характер, т.е. устанавливали зависимость между макроскопическими переменными
кинетической системы - температурой, давлением, концентрацией реагирующих
веществ и т.д. В этих исследованиях широко использовались методы термодинамики,
при помощи которых удавалось получать характеристические константы, указывающие
на направленность химического процесса. Однако для определения их скорости она
непригодна, т.к. термодинамика не оперирует понятием времени. Функции изучения
химических реакций в их временном аспекте взяла на себя химическая кинетика, начало
которой положено работами Вант-Гоффа по термодинамике («Очерки по химической
динамике», 1884 г), где им предложена естественная классификация химических
процессов: классифицировал реакции на моно-, би- и тримолекулярные в
зависимости от числа молекул, при взаимодействии которых происходит превращение
[3, с.112-114].
Таким образом, термодинамику смело
можно назвать «большим братом» химической кинетики. В 1884 г. Вант-Гофф
предложил использовать в качестве меры реакционной способности вещества
константу скорости реакции - количество вещества, превращающееся за одну минуту
при концентрации, равной единице. В уже упоминавшейся работе «Очерки по
химической динамике» приведена общая формула скорости «нормальной» химической
реакции, ставшая основным постулатом химической кинетики - скорость реакции
прямо пропорциональна произведению концентраций реагентов:
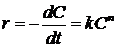
где k - константа
скорости реакции; n - порядок реакции;
Важно отметить тот факт, что именно
в работах Вант-Гоффа феноменологический анализ связывается с молекулярным
механизмом реакции.
Настоящего рассвета химическая
кинетика приобретает благодаря таким именитым ученым, как С.А. Аррениус, В.
Оствальд, которые, совместно с Вант-Гоффом, являются основателями химической кинетики,
а в дальнейшем и первых кинетических теорий.
Так Аррениусом, в сотрудничестве с
Оствальдом, в 1889 г. при изучении инверсии тростникового сахара с кислотами
создается теория о влиянии температуры на константу скорости химической реакции
(теория Аррениуса) [6, с.1], которая выражается уравнением (7).
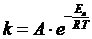
Ea -
своеобразная структурно-кинетическая характеристика реагирующих веществ, одно
из основных понятий химической кинетики - энергия активации.
Для объяснения физического смысла A и Ea Аррениус
высказал идею о том, что элементарные реакции протекают через образование
«активных» молекул (активированных комплексов), которые переходят в продукты
реакции, и принял, что реакции протекают по схеме [3, с.115 и 1, с.134-136]:
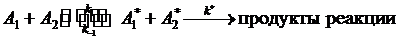
где A*1
и A*2
- активированные комплексы.
Таким образом, согласно теории
Аррениуса: 1) энергия активации, Ea - это
избыток внутренней энергии активированных молекул по сравнению с нормальными,
или та энергия, которую должны накопить нормальные молекулы, чтобы перейти в
активное состояние и иметь возможность прореагировать; 2) предэкспонента, A - фактор
частоты соударений реагирующих молекул. Следует отметить, что понятием «энергия
активации», «активированный комплекс» или «активное состояние» оперируют все
современные кинетические теории.
Вант-Гофф, Аррениус и Оствальд
положили основу для систематизации формальной химической кинетики, но не
добились совместной теории. Одна термодинамика способна объяснить реакции с
макроскопической точки зрения, однако, результаты являются неполными для
полного истолкования микроскопических процессов. Чтобы получить полную картину
о механизмах на атомном или молекулярном уровне нам необходимо применение
статистической механики и развитие квантовой физики, т.е. молекулярной модели
химической кинетики.
Однако именно теория Аррениуса стала
своеобразным мостом от феноменологической модели кинетики к модели
молекулярной, цель которой состоит в том, чтобы истолковать макроскопические
свойства системы реагирующих веществ на основе их молекулярной структуры и
выразить, таким образом, специфические характеристики динамической системы
через молекулярные константы.
Исторически первым направлением в
развитии взглядов Аррениуса была теория активных соударений, предложенная
независимо М. Траутзом в 1916 г. и У. Льюисом в 1918 г.
Теория активных соударений (ТАС) [9,
с.1-28] утверждает, что при наличии соответствующих частицы молекулы реагентов
соударяются друг с другом, однако только определенный процент столкновений
вызвать какое-нибудь заметное или значительное химическое изменение; эти
изменения называются активными столкновениями. При активном столкновении
молекулы обладают достаточной энергии, известной также как энергия активации
<#"821671.files/image009.gif">
Где Z
- частота столкновений;
p - стерический
фактор;
Ea
- энергия активации;
R - газовая
постоянная;
а предэкспонентциальный множитель:

ТАС показала, что элементарная
химическая реакция протекает через стадию активации реагирующих молекул, а
константа скорости реакции частотным (числом столкновений) и энергетическим
(энергия активации Ea) факторами. Но теория, опирающаяся
только на законы классической механики и молекулярно-кинетические
представления, не могла раскрыть природу активного состояния, а, следовательно,
и определить пути теоретического расчета или оценки таких факторов, как энергия
и энтропия активации. ТАС установила связь между скоростью химической реакции,
размером молекул, энергией их поступательного движения, частотой столкновений,
но не объясняет, почему энергия активации, обычно намного меньше энергии
химической связи, которую нужно разорвать, для того чтобы реакция произошла. В
дальнейшем эта теория развивалась на базе законов классической и квантовой
механики [1, с.137-141].
В попытках устранить недостатки ТАС
ученые предложили новую теорию химической кинетики - теорию активированного
комплекса (ТАК), известную также как теория переходного состояния и теория
абсолютных скоростей [7, с.875-893 и 8 с.107-115]. Эта теория была разработана
в 1935 г., более чем через полвека после открытий Аррениуса Г. Эйрингом с одной
стороны, а также М.Г. Эванс и М. Поляни с другой. Они предположили, что
химическая реакция протекает через некое «переходное состояние», как его
назвали Эванс и Поляни, при котором образуется неустойчивый «активированный
комплекс» (термин Эйринга), и когда в реагирующей системе исчезают отдельные
связи в исходных молекулах и возникают новые связи, характерные для продуктов
реакции. Схематично химическую реакцию, протекающую через переходное состояние
можно представить следующим образом:

Однако время существования
активированного комплекса равно периоду колебания одной молекулы (10-13с),
поэтому он не может быть обнаружен экспериментально и, соответственно, его
нельзя выделить и изучить. Следовательно, доказать истинность теории
переходного состояния можно только с помощью расчетов. И для этой цели ученые
задействовали самую передовую на тот момент методику, которая тогда переживала
бурный расцвет - квантовую химию. При этом константа скорости химической
реакции согласно ТАК в упрощенном варианте будет равна:
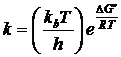
Рис. 1. Концептуальные системы
химии.
Каждый треугольник этой системы
символизирует построение новой концептуальной системы. Нижний треугольник
показывает, как возникала структурная химия в русле развития о химических
элементах. Горизонтальная линия «СОСТАВ - СВОЙСТВА» - это квинтэссенция того, к
чему пришло учение о химических элементах в первой половине XIX в.
Объяснение свойств, исходя из состава, стало центральной проблемой химии того
времени: как объяснить свойства вещества исходя из его состава? Ответ на этот
вопрос дало понятие «СТРУКТУРА», которое сформировалось в трудах Ф.А. Кекуле,
А.С. Купера и А.М. Бутлерова [2, с.48 и 4, с.193-194].
С появлением структурных
представлений произошло немало преобразований в химии, которая превращается из
науки аналитической в науку синтетическую. Однако достижения в области синтеза
показали, что знание одной лишь структуры вещества отнюдь не гарантирует
успешного решения получения вещества с заданными свойствами. Подобно тому, как
состав вещества не всегда может объяснить его свойства (и для этого объяснения
требуется понятие структуры), структура вещества не всегда может объяснить его
«ФУНКЦИЮ», реакционную способность. Поэтому химики приступили к детальному
исследованию процессов превращения, включив в химические исследования задачи
кинетического характера. Бутлеров отмечал, что «мир состоит не из готовых,
законченных предметов, а представляет собой совокупность процессов, в которых
предметы, кажущиеся неизменными… находятся в беспрерывном изменении» [2, с.49].
Следует отметить, что под свойствами
вещества подразумеваются характеристики, «закрепленные» за данным веществом,
его цвет, запах, кислотность, горючесть, канцерогенность и т.д. Разумеется, что
свойства проявляются во взаимодействии с другими объектами. Но это
«стандартные» взаимодействия, которые неявно входят в содержание понятия
«СВОЙСТВО». Реакционная способность - более содержательная характеристика
вещества, которая характеризуется не только структурными параметрами, перечнем
свойств вещества, но и способами его реагирования, скоростью реакции, конечными
и промежуточными продуктами, энергией активации, одним словом - кинетическими
параметрами.
Средний треугольник приведенной выше
схемы (рис. 1) символизирует формирование химической кинетики, которая стала
изучаться с целью объяснения «ФУНКЦИИ» химической системы, ее реакционной
способности. Чтобы объяснить реакционную способность, необходимо вникнуть в
природу соответствующего химического процесса, раскрыть «ОРГАНИЗАЦИЮ»
реакционной системы, в которой протекает данный процесс, т.е. изучить ход
реакции, его зависимость от характеристик сореагента, от условий реакции, от
показателей того сосуда, в котором происходит реакция, от скорости
перемешивания и т.д. Другими словами реакционную систему рассматривают как
некий кинетический континуум (единая система реагирующих веществ), куда также
входит понятие структуры. Таким образом, химическая структура в системе
реагирующих веществ рассматривается лишь в качестве одного из кинетических
параметров/факторов [2, 49-50 и 4, с.193].
Познание кинетических систем
приводит к понятию химической «ОРГАНИЗАЦИИ». В настоящее время химическую
кинетику определяют как учение о протекании химического процесса во времени и о
механизме реакции. Это определение включает два аспекта: феноменологический и
молекулярный. Понятие химической организации, в сущности, объединяет оба этих
подхода к химическим системам: с одной стороны оно отражает упорядоченность
этих систем, их механизм; с другой подчеркивает, что эта упорядоченность
является подвижной неустойчивой, т.к. максимальная устойчивость свойственна
равновесным системам, а кинетика работает с неравновесными. В то же время это
понятие стимулирует развитие как молекулярного, так и феноменологического
подхода. В виду того, что понятие химической организации предполагает описание
системы как целостности, его функции важны в замене аддитивного подхода
квантовомеханическим способом оценки взаимосвязей элементов и подсистем, в
определении соотношения сильных и слабых взаимодействий - межатомных,
межмолекулярных, хемосорбционных и иных связей. Феноменологический же подход
при этом стимулируется требованием отражения всего механизма взаимодействия
элементов кинетического континуума в макропоказателях «ПОВЕДЕНИЯ» системы. В
связи с этим понятие «ФУНКЦИИ» раскрывается через понятие «ПОВЕДЕНИЕ» [3,
с.53-54].
Что же такое «ОРГАНИЗАЦИЯ»? В виду
того, что структура системы - это совокупность ее элементов и порядок связей
между ними, организация системы - более емкая ее характеристика (своего рода
это гомолог категории структуры), уместная, когда эта система «одарена»
внутренней динамикой. Раскрыть организацию химической системы, значит раскрыть,
кроме структуры этой системы, ее «программу» - механизм реакции, т.е. выяснить
схему ее реагирования в ответ на изменение ее граничных условий.
Таким образом, мы подошли понятию
механизма реакции. Примечательно, что свои первые теоретические шаги химическая
кинетика делала на основе разработок структурных представлений химии. Лишь
позднее стало осознаваться, что концептуальные ресурсы структурной химии
ограничены и требуются принципиально новые идеи. Так, одним из первых и
основных кинетических понятий стало понятие «механизма реакции». Механизм
реакции - это своего рода развертка структуры реагирующих веществ во времени.
Выяснить механизм, значит раскрыть совокупность элементарных стадий,
составляющих реакцию, а также закон, выражающийся через кинетическое уравнение,
связывающий эти стадии между собой. Механизм реакции - это итог кинетических
теорий, ключевой момент, ради которого они и создавались.
Однако, понятие «механизм реакции»
оказалось понятием составным, которое можно толковать в узком и широком
значении. В узком значении «механизм» - это в первую очередь совокупность
элементарных стадий, составляющих реакцию. В широком же значении «механизм» -
это содержательная интерпретация опытных данных, являющаяся квинтэссенцией всех
накопленных сведений о протекании сложной реакции. В таком механизме должны
быть вычленены отдельные этапы и стадии реакции, приведены характеристики
промежуточных продуктов, описаны переходные состояния отдельных стадий, даны
энергетические уровни веществ. "Хочу все знать" о химической реакции
- так следует понимать химика, когда он говорит о своем намерении исследовать
«механизм».
Ограниченность понятия «механизм»
привела к формулированию новых понятий, выражающих природу реакционных систем,
таких, как «динамика» химического превращения, «внутренняя кибернетика
химической системы». Фактически эти понятия выражают то, что было описано выше
как «ОРГАНИЗАЦИЯ» химической системы [3, с.55-56 и 4, с.194-195].
Заключение
Вклад кинетических теорий для
химического знания в целом сложно оценить. Они стали своего рода «ключом от
химической реакции»: позволили истолковать микроскопические процессы, путем
перехода от «СТРУКТУРЫ» к «ОРГАНИЗАЦИИ», для получения полной картины о
химическом процессе. С уверенностью можно утверждать, что в современном мире ни
одно исследование химической реакции не проходит без применения кинетических
теорий. Без расчетов по молекулярной модели химической кинетики и их
сопоставления с экспериментальными данными, картина о механизме исследуемой
реакции будет не полной.
Следует отметить, что кинетические
теории стали своеобразным фундаментом для новой химии - химии «САМООРГАНИЗАЦИИ»
- химии новых открытий, химии будущего.
Список использованной литературы
1. Краснов К.С. Физическая химия. В
2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ: Учеб. для вузов /
К.С. Краснов, Н.К. Воробьев, И.Н. Годнев [и др]; под ред. К.С. Краснова - 3-е
изд., испр. - М.: Высш. шк., 2001. - С.133-166.
2. Кузнецов В.И. Концептуальные
системы химии. Структурные и кинетические теории / В.И. Кузнецов, А.А. Печенкин
// Вопросы философии. - № 1. - С.46-56.
. Кузнецов В.И. Общая химия:
Тенденции развития: [Науч.-попул.].- М.: Высш. шк., 1989. - С.111-120.
. Миронов В.В. Современные
философские проблемы естественных, технических и социально-гуманитарных наук:
учебник для аспирантов и соискателей ученой степени кандидата наук / В.В.
Миронов, В.Я. Перминов, С.Н. Бычков [и др]; под ред. В.В. Миронов - М.:
Гардарики., 2006. - С.191-207.
. Семенов Н.Н. О некоторых
проблемах химической кинетики и реакционной способности. - М.: Изд-во АН СССР.,
1958. - С.686.
6. Arrhenius S.A. Uber die
Reaktionsgeschwindigkeit bei der Inversion von
Rohrzucker durch Säuren / S.A. Arrhenius
// Z. Phys. Chem. - Vol. 4. - 1889. - P. 226-248.
. Eyring H. (1935). The
Activated Complex in Chemical Reactions / H. Eyring // J. Chem. Phys.
- Vol. 3. - 1935.
-
P.107-115.