Эффективность применения генно-инженерных биологических препаратов
СПИСОК СОКРАЩЕНИЙ
. Анкилозирующий спондилит (АС)
. Генно-инженерная биологическая терапия (ГИБТ)
. Инфликсимаб (ИНФ)
. Галимумаб (ГМБ)
. Тоцилизумаб (ТЦЗ)
. Число болезненных суставов (ЧБС)
. Число воспаленных суставов (ЧВС)
. Фактор некроза опухоли (ФНО)
. Нестероидные противовоспалительные средства
(НПВС)
. Глюкокортикостероиды (ГК)
. Нежелательные явления (НЯ)
. Суммарные нежелательные явления (СНЯ)
. Базисные противовоспалительные препараты
(БПВП)
. Ревматоидный артрит (РА)
. Ревматические заболевания (РЗ)
Реферат
препарат биологический ревматический
спондилит
Для научно-практической ревматологии проблемы
лечения анкилозирующего спондилита трудно переоценить, поскольку данное
заболевание является вторым, после ревматоидного артрита, и одним из самым распространенным
среди иммуновоспалительных ревматических болезней. В течение длительного
времени АС считался практически не поддающимся терапии заболеванием, поскольку,
несмотря на достижение улучшения с помощью терапии глюкокортикоидами (ГК) и
базисными противовоспалительными препаратами (БПВП) в том числе
иммуносупрессорами, такими как метотрексат, у большинства пациентов оно
сменялось обострением, а деструкция суставов прогрессировала, приводя к
инвалидности. В последние годы появилась новая группа препаратов ГИБТ и взгляд
на АС как на неизлечимое заболевание пересматривается. Таким образом, появление
ГИБП ознаменовало собой новую эпоху в лечении АС и других воспалительных РЗ.
Практические наблюдения для эпохи ГИБП позволили сформулировать новые цели лечения
- ремиссия или как минимум стойкая низкая активность болезни. За последние два
десятилетия оптимизация использования синтетических базисных
противовоспалительных препаратов (БПВП) и появление генно-инженерных
биологических препаратов (ГИБП) сделали возможными эффективное подавление
воспаления, торможение деструкции суставов и улучшение результатов лечения в
целом. Цели лечения, изменились от контроля симптоматики воспаления и
достижения низкого уровня активности заболевания до достижения и поддержания клинической
ремиссии у значительного числа пациентов. Наконец, с помощью современных
методов медикаментозной терапии возможны сохранение и восстановление
функциональных возможностей, снижение вероятности развития сопутствующей
патологии, восстановление качества жизни пациентов, а также сохранение их
социальной активности. Результаты лечения обнадеживают, однако до сих пор еще
не до конца изучены влияния препаратов этой группы, возможность контроля
механизмов заболевания и прогноза эффективности терапии ГИБП, которые позволят
индивидуализировать лечение пациентов, нет единого мнения о частоте побочных
явлений и токсичности препаратов ГИБТ. Несмотря на высокую эффективность
комбинированной терапии БПВТ и ГИБП при ревматических заболеваниях, остается
немало пациентов с тяжелым агрессивным течением заболевания, резистентным ко
всем стандартным схемам лечения.
ЦЕЛЬ ИССЛЕДОВАНИЯ: Изучить эффективность
применения генно-инженерных биологических препаратов на клиническое течение
некоторых ревматических воспалительных заболеваний.
ЗАДАЧИ:
. Изучить: достигли ли клинической ремиссии или
как минимум низкой активности болезни пациенты получавшие препараты ГИБТ.
. Определить: купировались ли симптомы
заболевания при лечении ГИБТ.
. Рассмотреть: возможность достижения торможения
прогрессирования деструкции суставов и нормализацию функции суставов, при
лечении пациентов препаратами ГИБТ.
. Сравнить частоту побочных эффектов у больных,
получавщих традиционную базисную терапию и генно-инженерные биологические
препараты.
1. МАТЕРИАЛ
ИССЛЕДОВАНИЯ:
Пациенты - 20 человек были распределены на 2
группы: 1. Пациенты, имевшие достоверный диагноз в соответствии с критериями и
не имеющие противопоказаний для назначения препаратов генно-инженерной
биологической терапии. 2. Пациенты, находившиеся на лечении традиционными
базисными препаратами. По принимаемым ГБИТ пациенты 1 группы разделены на три
подгруппы: получавшие ремикейд - 6 человек, хумиру - 2 человека, актемру - 2
человека. Во вторую группу вошло 10 человек. Из пациентов находившихся на
базисной терапии, все 10 были с анкилозирующим спондилитом. Из обследуемой
группы 8 пациентов с анкилозирующим спондилитом, 1 с ревматоидным артритом,
с псориатическим артритом.
ОСНОВНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ: наряду с рутинным
обследованием терапевтического больного проводился расчет индексов активности
болезни ASDAS, ВАSDAI,
оценены функциональные нарушения с помощью индекса ВАСFI
и функциональные способности пациента по индексу ВАSMI,
исследованы данные пациентов по шкале ВАШ, DAS
28. Изучены данные АКР 20, АКР40. Всем пациентам проведено общетерапевтическое
обследование, изучены данные лабораторных исследований, проведены клинические
функциональные пробы: симптомы для выявления сакроилеита, диагностические пробы
для выявления болевого синдрома и ограничения подвижности позвоночника,
рентгенологическая диагностика.
ОСНОВНЫЕ ВЫВОДЫ:
1. Применение ГИБП у больных с анкилозирующим
спондилитом является высокоэффективный в подавлении воспалительной активности
заболевания и в ряде случаев позволяет достичь ремиссии заболевания.
. Отмечается лучшая переносимость препаратов
ГИБТ по сравнению с традиционными базисными препаратами.
. Из 10 пациентов находящихся на ГИБТ у 2-х
наступила клиническая ремиссия, у 5-ти наблюдаемых в ходе лечения наступила
минимальная активность болезни, у 3-х -умеренная активность болезни.
. У двух пациентов симптомы заболевания
купировались полностью, у 5-ти на 70%, у 3-х на 50%.
. При лечении пациентов препаратами ГИБТ
нормализуется функция суставов (увеличивается объем движений в суставах,
уменьшается ЧВС и ЧБС, снижается оценка боли по ВАШ), торможение
прогрессирования деструкции суставов увидеть не удалось, у всех пациентов
находящихся на ГИБТ Rg
картина была без отрицательной динамики, МРТ проводилась только 5-ти пациентам
до назначения базисной терапии, для верификации диагноза
. У пациентов получавших генно-инженерные
биологические препараты побочных эффектов наблюдалось меньше чем у лиц
получавших препараты базисной терапии.
Материалы работы изложены на 38 страницах
машинописного текста, иллюстрированы 6 таблицами. Использовано 45 публикаций.
Автор самостоятельно собрал, проанализировал,
обобщил клинический материал и результаты обследования больных.
Введение
Актуальность проблемы
Для научно-практической ревматологии проблемы
лечения анкилозирующего спондилита трудно переоценить, поскольку данное
заболевание является вторым, после ревматоидного артрита, и одним из самым
распространенным среди иммуновоспалительных ревматических болезней. В
Российской Федерации по данным министерства здравоохранения рапространенность
АС составляет от 0,5%-1,5%. У большинства пациентов АС приводит к стойкой
потере трудоспособности и сокращению продолжительности жизни. В течение
длительного времени АС считался практически не поддающимся терапии заболеванием,
поскольку, несмотря на достижение улучшения с помощью терапии глюкокортикоидами
(ГК) и базисными противовоспалительными препаратами (БПВП) в том числе
иммуносупрессорами, такими как метотрексат, у большинства пациентов оно
сменялось обострением, а деструкция суставов прогрессировала, приводя к
инвалидности. В последние годы появилась новая группа препаратов ГИБТ и взгляд
на АС как на неизлечимое заболевание пересматривается.
Множество проведенных в последние годы
клинических исследований продемонстрировали, что для всей группы ГИБП
характерной чертой является значительно большая частота и глубина ремиссии,
достигаемой на фоне терапии, по сравнению со стандартной терапией БПВП. Помимо
клинических признаков ремиссии (купирование субъективной симптоматики,
отсутствие активного АС, нормализация лабораторных показателей воспалительной
активности) индуцированная биологическими препаратами ремиссия закономерно
сопровождается иммунологическим ответом, подавлением синовита, торможением
развития эрозивного процесса и значительной стойкостью, которая позволяет
отменять вызвавший ремиссию препарат с сохранением достигнутого эффекта. Это
позволяет рассчитывать на сохранение достигнутого улучшения у 70% больных,
получавших ингибиторы ФНО-альфа течение как минимум 1 года после их отмены. В
целом можно заключить, что у больных АС, хорошо отвечающих на терапию
ингибиторами ФНО-альфа, особенно при рано начатой терапии, есть хороший шанс на
развитие «идеальной» ремиссии, близкой к выздоровлению [6]. Таким образом, появление
ГИБП ознаменовало собой новую эпоху в лечении АС и других воспалительных РЗ.
Практические наблюдения для эпохи ГИБП позволили сформулировать новые цели
лечения - ремиссия или как минимум стойкая низкая активность болезни. За
последние два десятилетия оптимизация использования синтетических базисных
противовоспалительных препаратов (БПВП) и появление генно-инженерных
биологических препаратов (ГИБП) сделали возможными эффективное подавление
воспаления, торможение деструкции суставов и улучшение результатов лечения в
целом. Цели лечения изменились от контроля симптоматики воспаления и достижения
низкого уровня активности заболевания до достижения и поддержания клинической
ремиссии у значительного числа пациентов. Наконец, с помощью современных методов
медикаментозной терапии возможны сохранение и восстановление функциональных
возможностей, снижение вероятности развития сопутствующей патологии,
восстановление качества жизни пациентов, а также сохранение их социальной
активности [11, 20]. Результаты лечения обнадеживают, однако до сих пор еще не
до конца изучены влияния препаратов этой группы, возможность контроля
механизмов заболевания, и нет единого мнения о частоте побочных явлений. Важной
проблемой является отсутствие прямых сравнительных контролируемых исследований
эффективности и токсичности различных ГИБП. Изучаются клинические и
лабораторные показатели позволяющие прогнозировать эффективность терапии БПВП и
ГИБП решение которой в перспективе позволит индивидуализировать терапию
пациентов. Несмотря на высокую эффективность комбинированной терапии БПВТ и
ГИБП при ревматических заболеваниях , остается немало пациентов с тяжелым
агрессивным течением заболевания, резистентным ко всем стандартным схемам
лечения. Однако, несмотря на достигнутый прогресс, терапия ГИБП по-прежнему не
способна вызвать полное излечение.
ГЛАВА I.
ПРЕПАРАТЫ ГЕННО-ИНЖЕНЕРНОЙ БИОЛОГИЧЕСКОЙ ТЕРАПИИ В ЛЕЧЕНИИ АНКИЛОЗИРУЮЩЕГО
СПОНДИЛИТА (ОБЗОР ЛИТЕРАТУРЫ)
Анкилозирующий спондилит (АС) - хроническое
воспалительное заболевание позвоночника (спондилит) и крестцово-подвздошных
суставов (сакроилеит), а также периферических суставов (артрит), энтезисов
(энтезит), в ряде случаев глаз (увеит) и корня аорты (аортит), которым
заболевают, как правило, до 40 лет и при котором более чем в 90% случаев
выявляется генетический маркер HLA-B27 [2,6].
Современный уровень знаний ограничен пониманием
предрасполагающих факторов и отдельных звеньев патогенеза. В происхождении
данного заболевания имеет значение сочетание генетической предрасположенности и
средовых факторов. В числе последних наиболее важную роль играют инфекции, в
первую очередь некоторые штаммы клебсиеллы, других энтеробактерий, а также их
ассоциаций, взаимодействующих с антигенными структурами макроорганизма,
например, НLА-В27-антигеном.
Предлагали несколько теорий, объясняющих участие
HLA-B27 в патогенезе анкилозирующих спондилоартритов. «Теория двух генов»,
указывающая на наличие гипотетического «гена анкилозирующего спондилоартрита»,
расположенного вблизи HLA-B27 на хромосоме 6. «Теория одного гена», основанная
на наличии структурного сходства HLA-В27 с рядом инфекционных патогенов,
представленная несколькими вариантами: рецепторная теория гипотеза перекрёстной
толерантности или простой молекулярной мимикрии; плазмидная гипотеза; теория изменённого
иммунного ответа. Вместе с тем, до сих пор не найдено более или менее логичного
объяснения развитию анкилозирующего спондилоартрита у В27-негативных лиц, и
попытки поиска других антигенов, перекрёстно реагирующих с HLA-B27, так
называемых B7-CREG («cross reactive group») антигенов, также не внесли
ясности в данный вопрос.
Взаимодействие генетических и средовых факторов
запускает сложный каскад иммунологических реакций, особенностью которых служит
преобладание активности CD4+-лимфоцитов и дисбаланс СD8+-клеток,
ответственных за элиминацию бактериальных антигенов. Это приводит к выработке
множества провоспалительных цитокинов, спектр которых при юношеском
спондилоартрите TNF-альфа, TNF-бета включает интерферон у, ИЛ-4, ИЛ-6, ИЛ-2.
Повышенная выработка ИЛ-4, служащая по некоторым данным стимулятором
фибропластических процессов, по-видимому, служит одной из причин
фиброзообразования, обусловливающего развитие анкилоза.
Основной морфологический субстрат патологических
изменений при анкилозирующем спондилоартрите (также как и при спондилоартритах
в целом) - развитие воспаления в области энтезисов (местах прикрепления
суставных капсул, связок и сухожилий, фиброзных частей межпозвонковых дисков к
костям), тогда как синовит, в отличие от ревматоидного артрита, рассматривают
как вторичный процесс. Патологические изменения затрагивают в основном хрящ и
фиброзную ткань сухожилий и межпозвоночных дисков, в меньшей степени -
суставных капсул межпозвоночных дисков, а также прилегающие к этим тканям
надкостницу, костную ткань, сухожилия. Реже поражается синовиальная оболочка,
преимущественно плечевых и тазобедренных суставов. В первую очередь поражаются
крестцово-подвздошное сочленение и нижние отделы позвоночника, затем поражение
распространяется вверх, захватывая межпозвоночные и реберно-позвоночные
сочленения, тела позвонков, межпозвоночные диски, периферические суставы.
Наиболее ранними гистологическими изменениями
служат инфильтрация макрофагами и лимфоцитами. Затем наступает пролиферативный
фибропластический ответ, возникает плотный фиброзный рубец, который
впоследствии кальцифицируется и оссифицируется. Характерно воспалительное
поражение хряща, особенно фиброзного, часто наблюдается острый остеит
прилежащей подхрящевой ткани. Поражаются также фиброзные ткани капсулы сустава,
фиброзное кольцо межпозвоночного диска, периартикулярная ткань,
связочно-костное соединение, а также надкостница. Постепенно суставной хрящ
крестцово-подвздошного сочленения и мелких суставов позвоночника разрушается,
развивается анкилоз с эрозиями и склерозом субхондральной кости. Деструктивные
и фибропластические процессы наблюдаются и во внутренних органах: нарушается
предсердно-желудочковая проводимость при поражении ткани межжелудочковой
перегородки, развивается дилатация аортального клапана, фиброзное поражение
верхней доли легкого.
За последние 20 лет в лечении ревматических
заболеваний достигнуты огромные успехи. Это связано как с совершенствованием
стратегии фармакотерапии (концепция - лечение до достижения цели)[2] , так и с
разработкой широкого спектра лекарственных препаратов (так называемые
генно-инженерные биологические препараты - ГИБП). Инфликсимаб (Ремикейд):
представляет собой химерные моноклональные антитела, состоящие из вариабельной
(Fv) области высокоаффинных нейтрализующих мышиных моноклональных антител к
ФНО-α,
соединенных
с фрагментом молекулы IgG1k человека,
в целом занимающей 2/3 молекулы антитела и
обеспечивающей ее эффекторные функции. [7,13]. Инфликсимаб связывается с ФНО-α
с
высокой специфичностью, аффинностью и авидностью, образует стабильные комплексы
с ФНО-α,
подавляет
биологическую активность свободного и мембранно-ассоциированного ФНО-α.
Специфичность
инфликсимаба по отношению к ФНО-α подтверждена
его неспособностью нейтрализовать цитотоксический эффект лимфотоксина альфа
(ЛТ- α
или
ФНО-β)
- цитокина,
который может присоединяться к тем же рецепторам, что и ФНО-α[23].
По данным фармакокинетических исследований, максимальная концентрация
инфликсимаба в плазме пропорциональна вводимой дозе, объем распределения соответствует
внутрисосудистому, а период полужизни составляет 8-12 дней. При повторном
введении инфликсимаб не накапливается в организме, его концентрация в крови
соответствует вводимой дозе [15]. Инфликсимаб вводится внутривенно в дозе 5
мг/кг как в режиме монотерапии, так и в сочетании с метотрексатом. Длительность
инфузии около двух часов. Вливания повторяют через 2 недели, через 6 недель,
далее - каждые 8 недель [23]. Инфликсимаб стал первым анти-ФНО препаратом,
который стал рутинно применяться в клинической практике. Самым крупным
длительным многоцентровым двойным слепым исследованием инфликсимаба является
РКИ АТТАСТ (Аnti -TNF
Trial in
Rheumatoid
Arthritis
with Concominant
Therapy) [24]. В
клиническом исследовании 3 фазы ATTRACT
пациенты с неадекватном ответом на метотрексат продолжали терапию метотрексатом
и путем рандомизации были распределены в группы, либо получавшие плацебо, либо
проходившие лечение по одной из 4-х схем терапии инфликсимабом: 3мг/кг каждые 4
недели или 8 недель 8 недель или 10 мг/кг каждые 4 недели или 8 недель. На 30
неделе у пациентов из групп, получавших настоящие препараты, ответ на АСR
20 был достигнут в 50-58% случаев по сравнению с 20% в группе плацебо [7]. В
небольшом исследовании -РКИ 27, наиболее тяжелым больным была проведена либо
внутривенная пульс-терапия метил-преднизолоном, либо терапия инфликсимабом
[27]. Показатели SF-36
(боль, физическое функционирование, общее здоровье, социальное
функционирование) существенно улучшилось у пациентов, получивших инфликсимаб,
по сравнению с группой, которой проводилась пуль-терапия метил преднизолоном.
Таким образом, присоединение инфликсимаба к ранее недостаточному метотрексату
привело к очевидному клиническому улучшению, и к значительному повышению
функциональных способностей пациентов.
Голимумаб (Хумира) представляет из себя препарат
человеческих моноклональных антител Ig
Gl, также
лицензированный для применения в комбинации с метотрексатом. Уже в первом
исследовании ГМБ было показано, что его яркий лечебный эффект при ревматологических
болезнях достигается у большинства больных достаточно быстро (у 24% пациентов
после первой инъекции [28] и длительно сохраняется при продолжающемся лечении
(до 4 и более лет). Препарат даже в качестве монотерапии оказался эффективным
при лечении больных с тяжелым активным АС, которые ранее были резистентны к
назначению многих БПВП, включая МТ [39]. В то же время исследование PREMIER
[40] на основании проведенного анализа большей группы больных, лечившихся
голимумабом в течении 2-х лет, показало что комбинация голимумаба с
метотрексатом оказалась более эффективной по сравнению с монотерапией каждым из
этих препаратов. В клиническом исследовании 3 фазы GO-FORWARD
пациентов с неадекватным ответом на терапию метотрексатом путем рандомизации
разделили на 4 группы, получавшие метотрексат с инъекциями плацебо, 100 мг
голимумаба с капсулами плацебо, 50 мг голимумаба с метотрексатом и 100 мг
голимумаба с метотрексатом. Все инъекции проводились 1 раз в месяц. На 14
неделе доля пациентов, у которых был достигнут ответ АСR
20, составила 33,1 %, 44,4%, 55,1%, и 56,2%, соответственно [14]. Для
голимумаба не доказано подавление рентгенологического повреждения на 24 неделе,
однако не в одной из групп (включая группы плацебо) за это период не
зарегистрировано значительного прогрессирования: изменения оценки по
модифицированной шкале Sharр
составили 0,6 ± 2,4, 0,3 ± 1,6, 0,6 ± 2,7 и 0,2 ± 1,3 соответственно[15],
голимумаб вводился подкожно в дозе 50 мг каждый месяц. Период полувыведения
этого препарата составляет 12 ± 3 дней [16]. Исследование GO-ВЕFORE
многоцентровое в котором изучалась эффективность комбинации терапии голимумабом
и метотрексатом у пациентов, не получавших ранее метотрексат [29]. Было
показано, что комбинированная терапия голимумабом и метотрексатом чаще индуцирует
развитие ремиссии, чем монотерапия метотрексатом. Частота ремиссии в группе
монотерапии МТ составила 1,5 и 2.3%, а в группе комбинированной терапии ГЛМ и
МТ 11,2 и 12,9% [30].
Тоцилизумаб (Актемра) - рекомбинантное
гуманизированное моноклональное антитело к человеческому рецептору
интерлейкина-6 (ИЛ-6) из подкласса иммуноглобулинов IgG1. Тоцилизумаб
селективно связывается и подавляет как растворимые, так и мембранные рецепторы
ИЛ-6 (sIL-6R и mIL-6R). ИЛ-6 является многофункциональным цитокином, вырабатываемым
различными типами клеток, участвующих в паракринной регуляции, системных
физиологических и патологических процессах, таких как стимуляция секреции Ig,
активация Т-клеток, стимуляция выработки белков острой фазы в печени и
стимуляция гемопоэза. ИЛ-6 вовлечен в патогенез различных заболеваний, в том
числе воспалительных заболеваний, остеопороза и новообразований
[31].Эффективность тоцилизумаба, как в монотерапии, так и в комбинации с
метотрексатом (МТ) или базисными противовоспалительными препаратами (БПВП)) в
отношении уменьшения субъективных и объективных признаков ревматоидного артрита
оценивалась в 5 рандомизированных, в двойных слепых, и многоцентровых
клинических исследованиях. Во всех исследованиях клинический эффект 20%, 50% и
70% по критериям Американской Коллегии Ревматологов (АКР) через 6 месяцев
отмечался статистически значимо чаще при терапии тоцилизумабом в дозе 8 мг/кг,
чем при терапии препаратами сравнения, независимо от наличия или отсутствия
ревматоидного фактора, возраста, пола, расовой принадлежности, числа
предшествующих курсов лечения или стадии заболевания. Ответ на терапию возникал
быстро (уже на второй неделе), усиливался в течение всего курса лечения и
сохранялся более 3 лет в продолжающихся открытых расширенных исследованиях
[4,5]. У пациентов, получавших тоцилизумаб в дозе 8 мг/кг, значительные
улучшения отмечались в отношении всех критериев АКР (число болезненных и
припухших суставов, улучшение общей оценки эффективности лечения, по мнению
врача и пациента, степень функциональных нарушений по данным опросника HAQ,
оценка выраженности болевого синдрома, показатели С- реактивного белка) по
сравнению с пациентами, получавшими плацебо + МТ/ БПВП. У пациентов, получавших
тоцилизумаб в дозе 8 мг/кг, существенно снижался индекс активности заболевания
по шкале DAS28 по сравнению с пациентами, получавшими плацебо + БПВП. Число
пациентов, достигших клинической ремиссии на 24 неделе, было значительно больше
в группе терапии тоцилизумабом (28-34%) по сравнению с контрольной группой (1-12%).
К 52 неделе терапии число пациентов, достигших DAS28, увеличивается до 47% по
сравнению с 33% на 24 неделе терапии [3,8].Хороший или удовлетворительный ответ
по критериям EULAR отмечался у значительно большего числа пациентов, получавших
тоцилизумаб, чем получавших плацебо + БПВП. Через 2 года терапии
тоцилизумабом/МТ у 14% пациентов наблюдался значительный клинический ответ
(АКР70 сохранялся на протяжении 24 недель и более) [5,8].Рентгенологическая
оценка: у пациентов с неадекватным ответом на лечение МТ проводилась
рентгенологическая оценка торможения деструкции суставов. У 83% пациентов,
получавших терапию тоцилизумабом/МТ в течение года, не зарегистрировано
прогрессирования деструкции суставов (изменение общего индекса Sharp равное
нулю или менее) по сравнению с 67% пациентами, получавшими плацебо/МТ. Данный
результат сохранялся на протяжении 2 лет терапии (83%). У 93% пациентов
отсутствовало прогрессирование деструкции суставов между 52 и 104 неделями
терапии. Показатели качества жизни: у пациентов, получавших тоцилизумаб в дозе
8 мг/кг (монотерапия или в сочетании с БПВП), по сравнению с теми, кто получал
MT/БПВП, наблюдалось клинически значимое улучшение физической функции (по
индексу HAQ-DI), снижение утомляемости (по шкале функциональной оценки терапии
хронических заболеваний по показателю утомляемости FACIT-Fatigue), а также
улучшение как показателей физического, так и показателей психического здоровья
по опроснику SF-36.Лабораторные показатели: тоцилизумаб в дозе 8 мг/кг как в
монотерапии, так и в комбинации с БПВП/MT, статистически значимо приводит к
увеличению показателя гемоглобина к 24 неделе. Наибольшее увеличение было
отмечено у пациентов с хронической анемией, связанной с РА. Средний показатель
гемоглобина увеличился ко 2 неделе и оставался в пределах нормы в течение всех
24 недель. После введения тоцилизумаба происходило быстрое снижение средних
значений острофазовых показателей, C-реактивного белка, СОЭ и сывороточного
амилоида А, а также снижение числа тромбоцитов в пределах нормальных значений
[4,8]. Мишени (точки воздействия) ГИБП
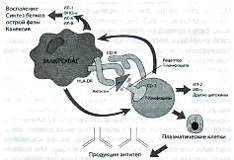
Классификация ГИБП в зависимости от мишеней
(точек воздействия)
|
Зарегистрированные
в России для лечения РА генно-инженерные биологические препараты (ГИБП)
|
|
Мишень
|
Препараты
|
|
ФНО-α
|
Инфликсимаб
Адалимумаб Этанерцепт Цертолизумаба пэгол Голимумаб
|
|
β-лимфоциты
(СD20)
|
Ритуксимаб
|
|
Костимуляция
(СD80, CD86, CD28)
|
Абатацепт
|
|
ИЛ-6
(рецептор)
|
Тоцилизумаб
|
Генно-инженерные биологические препараты (ГИБП)
заняли прочное место в лечении РА и АС. Отбор больных для такого лечения
проводится в соответствии с международными и отечественными рекомендациями.
Вопрос о присоединении ГИБП к терапии базисными противовоспалительными
препаратами (БПВП) ставится после неадекватного ответа на терапию двумя
базисными препаратами, одним из которых должен быть метотрексат. Назначение
ингибиторов ФНО - α в качестве
первого лечебного средства показано только при высокой активности РА. Четких
предикторов эффективности ГИБП мало. Отмечено, что в соответствии с принципами
программы «Treatment to Target» лечение пациентов проводится под контролем
количественных показателей, оцениваемых у больных с высокой/умеренной
активностью ежемесячно, при отсутствии ремиссии (или альтернативной цели -
низкой активности) через 3 мес. решается вопрос о коррекции терапии. В рутинной
практике при появлении эффекта ГИБП, который у многих больных наблюдается в
первые недели лечения, нередко начинают отменять симптоматические препараты, а
подчас и снижать дозу или отменять БПВП, что может привести к нарастанию
симптомов артрита и ошибочно интерпретируется как недостаточная эффективность
или отсутствие эффекта ГИБП. Существуют объективные причины возможной
неэффективности ГИБП. Достоверным предиктором ответа на ингибиторы ФНО α
является
исходная экспрессия ФНО α клетками
синовиальной оболочки. Важно также учитывать характер предшествующей назначению
ГИБП терапии. Отмечена высокая эффективность всех ГИБП при взвешенном подходе к
отбору и ведению больных, при этом нужно избегать быстрой отмены
симптоматической терапии [24]. Необходимо раннее начало активной терапии после
установления диагноза; • активное ведение больного, тщательный контроль его
состояния; • подбор новой схемы терапии при недостаточной эффективности
предыдущей.
Основная цель при лечении больного АС -
обеспечить максимально продолжительное сохранение высокого качества жизни,
связанного с состоянием здоровья, путем контроля над симптоматикой,
предотвращения структурного поражения суставов, нормализации функции и увеличения
социальных возможностей пациента.
Подавление воспаления - важнейший способ
достижения этой цели. Лечение до достижения цели с помощью оценки активности
заболевания и соответствующего подбора терапии способствует оптимизации исходов
при АС и РА. На основании общих принципов международным комитетом разработаны
10 рекомендаций по лечению АС до достижения цели, основанных на научных
доказательствах и мнениях экспертов.
. Первичная цель лечения АС - достижение
состояния клинической ремиссии. 2. Клиническая ремиссия определяется как
отсутствие признаков значимой воспалительной активности.
. До тех пор, пока не будет достигнута цель
лечения, пересмотр лекарственной терапии необходимо осуществлять не реже 1 раза
в 3 мес.
. Необходимо регулярно оценивать и документировать
данные об активности заболевания: у пациентов с умеренной/высокой степенью
активности - ежемесячно, у пациентов со стойко низкой активностью или в
состоянии ремиссии - реже (1 раз в 3-6 мес). 6. В каждодневной клинической
практике для принятия решений о лечении необходимо использовать валидированные
комплексные показатели активности заболевания, включающие оценку состояния
суставов.
. Помимо использования комплексных показателей
активности заболевания при принятии клинических решений необходимо учитывать
структурные изменения и нарушения функции.
. К желаемой цели лечения необходимо стремиться
в течение всего периода заболевания.
. На выбор (комплексного) показателя активности
заболевания и целевых параметров могут повлиять сопутствующие заболевания,
индивидуальные особенности пациента и риски, связанные с приемом лекарственных
препаратов.
. Пациент должен быть в достаточной степени
информирован о цели лечения и запланированной стратегии для достижения этой
цели под наблюдением ревматолога.
Побочное действие: наиболее частые нежелательные
явления (НЯ), возникающие при использовании ГИБП - инфекции, инфузионные
реакции, реакции гиперчувствительности; на фоне лечения этими препаратами
выявлялись злокачественные новообразования и лимфопролиферативные заболевания.
У ряда препаратов имеются НЯ, связанные с их фармакодинамическими
особенностями.
Инфузионные реакции: в качестве инфузионных
реакций расцениваются любые НЯ, возникающие во время инфузии или в течение 1-2
ч после нее. Обычно они слабо или умеренно выражены и проявляются в основном
артериальной гипертензией, ознобом, небольшим повышением температуры, редко
одышкой. В таких случаях следует либо уменьшить скорость инфузии препарата,
либо прекратить ее. Учитывая, что все ГИБП представляют собой крупные молекулы,
возможна сенсибилизация к ним, что чаще всего наблюдается после 3-4-й инфузии.
При наличии факторов риска можно провести премедикацию в виде внутривенного
введения небольших доз ГК, если это не предусмотрено протоколом введения
препарата. Меньше всего инфузионных реакций отмечено при лечении тоцилизумабом.
В реальной клинической практике сообщения о частоте инфузионных реакций сильно
разнятся: так, в нидерландском регистре частота инфузионных реакций при
введении инфликсимаба составила 3,7% [14], а в исследовании Г.В. Лукиной и
соавт. - 45% [15].
Если препарат вводится подкожно (адалимумаб,
этанерцепт), то возможно развитие реакции в месте инъекции (эритема и/или зуд,
геморрагии, боль, припухлость). Эти реакции, как правило, выражены слабо и
редко требуют лечения.
Инфекции: обращено внимание повышение риска
развития или активации туберкулеза, который может давать атипичную клиническую
картину, в связи с чем подтверждена необходимость проведения у каждого пациента
до назначения блокатора ФНО-α скринингового
обследования, включающего в себя сбор анамнеза, физикальное исследование,
рентгенографию органов грудной клетки и туберкулиновую пробу. Наиболее часто
очаги серьезных бактериальных инфекций локализуются на коже, в мягких тканях и
суставах. Возможно развитие оппортунистических инфекций, но частота их очень
низка. Указывается, что лечение блокаторами ФНО-α не
начинают или прекращают в случае возникновения серьезных бактериальных и/или
оппортунистических инфекций, после адекватного лечения инфекции терапия может
быть продолжена. В отношении вирусных инфекций консенсус по биологической
терапии Европейской антиревматической лиги указывает, что блокаторы ФНО - α
не
назначают пациентам, инфицированным вирусом гепатита В, но они не ухудшают
состояние пациентов и вирусную нагрузку при гепатите С. По поводу риска
развития злокачественных новообразований имеющиеся сведения противоречивы, что
в определенной степени объясняется повышенным риском новообразований (особенно
лимфом) при АС вообще. Именно развитие инфекций и злокачественных
новообразований на фоне терапии ингибиторами ФНО - α
находится
в центре внимания исследователей. За последние годы проведено значительное
количество клинических исследований и метаанализов в этой области. Больше всего
данных имеется в отношении РА и АС [6].
Метаанализ, проведенный на материале 9
рандомизированных плацебоконтролируемых клинических исследований (РКИ) и
включивший 3493 больных, получавших ИНФ или АДА, и 1512 пациентов контрольных
групп [21], показал, что риск развития серьезных инфекций повышен в 2, а
злокачественных опухолей - в 3,3 раза на фоне терапии ГИБП. В то же время
авторы выявили четкую зависимость частоты СНЯ от дозы ингибиторов ФНО - α;
в
группе больных, получавших невысокие дозы ГИБП, относительные риски составили
1,8 и 1,4 соответственно [28].
Таким образом, суммируя данные метаанализов РКИ
и наблюдательных исследований, включавших материалы многолетнего наблюдения за
пациентами с РА, АС и другими воспалительными РЗ, в отношении безопасности
терапии ингибиторами ФНО - α можно
сделать следующие выводы: 1) терапия антагонистами ФНО - α
в
целом не ассоциируется с повышением риска летального исхода и СНЯ; 2) требуется
настороженность в отношении туберкулеза, серьезных бактериальных инфекций и
лимфом (при РА, АС), хотя в целом частота этих СНЯ невелика; 3) риск развития
СНЯ повышается при увеличении дозы ингибиторов ФНО-α
и
не повышается (по некоторым данным, снижается) при увеличении продолжительности
лечения.
В целом при близкой клинической эффективности всех
известных на сегодня ГИБП тема прогнозирования нежелательных явлений и контроля
их развития выходит на первый план. Опыт 10-летнего использования ингибиторов
ФНО-α
показывает,
что эта группа препаратов характеризуется в целом удовлетворительным профилем
безопасности. Утвердившиеся за это время методы профилактики и настороженность
врачей в отношении конкретных побочных эффектов помогают сегодня избежать
многих нежелательных явлений; например, внедрение обязательного скрининга на
туберкулез более чем наполовину снизило риск его возникновения. Длительный опыт
применения и предсказуемость нежелательных явлений можно рассматривать как один
из важнейших аргументов в пользу того, что ингибиторы ФНО-α
еще
долгое время будут оставаться препаратами первого ряда биологической терапии
воспалительных РЗ [31,38].
Цель работы: Изучить эффективность применения
генно-инженерных биологических препаратов на клиническое течение некоторых
ревматических воспалительных заболеваний.
Задачи исследования:
. Изучить: достигли ли клинической
ремиссии или как минимум низкой активности болезни пациенты получающие
препараты ГИБТ.
. Определить: купировались ли симптомы
заболевания при лечении ГИБТ.
. Рассмотреть: возможно ли достичь
торможение прогрессирования деструкции суставов и нормализацию функции
суставов, при лечении пациентов препаратами ГИБТ.
. Сравнить частоту побочных эффектов у
больных, получающих традиционную базисную терапию и генно-инженерные
биологические препараты.
Научная новизна: проведено исследование влияния
лечения ГИБП на клинико-лабораторные показатели у ревматологических больных.
Практическая значимость: наши
выводы в первую очередь адресованы ревматологам для использования в их
клинической практике лечения ревматологических пациентов блокаторами ФНО. Но мы
надеемся, что они будут учитываться и другими специалистами, участвующими в
лечении ревматологических больных. Всё это позволит пациентам с очень активным
или тяжёлым заболеванием получить правильное лечение, назначенное врачами с
большим опытом применения таких препаратов. Прекращение приёма блокаторов ФНО
после многих месяцев непрерывного лечения часто приводит к клиническому
рецидиву болезни.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводилось на базе клиники
факультетской терапии Военно-медицинской академии.
.1 Характеристика обследованных лиц
На промежуточном этапе работы обследовано: 20
человек, из них 6 больных получали ремикейд, 2 хумиру, 2 актемру, 10 пациентов
находились на традиционной базисной терапии. Из пациентов находившихся на базисной
терапии, все 10 были с анкилозирующим спондилитом. Из обследуемой группы 8
пациентов с анкилозирующим спондилитом, 1 с ревматоидным артритом, 1 с
псориатическим артритом.
· Диагноз был подтвержден данными
анамнеза, клинической картины, рентгенологическими, функциональными методами
диагностики, соответствовал Римским и Нью-Йоркским критериям.
Критерия включения больных в
исследование в основную группу:
1. Пациенты, имевшие достоверный диагноз в
соответствии с критериями и не имеющие противопоказаний для назначения
препаратов генно-инженерной биологической терапии.
. Пациенты, находившиеся на лечении
традиционными базисными препаратами.
Критерии исключения из исследования:
1. Наличие
не санированных очагов инфекций: инфекции верхних и нижних дыхательных путей,
пневмонии, синуситы, фарингиты, генерализованные инфекции (включая сепсис,
кандидоз и грипп), туберкулез, инфекции ЖКТ (включая вирусный гастроэнтерит),
инфекции кожи и мягких тканей (включая паронихий, импетиго, некротизирующий
фасциит и опоясывающий лишай), инфекции уха, инфекции полости рта (включая
простой герпес, оральный герпес и поражения зубов), инфекции половой сферы,
инфекции мочевыделительного тракта (включая пиелонефрит).
2. Пациенты
с нестабильной артериальной гипертензией.
3. Пациенты
с повышением уровня печеночных трансаминаз, диспепсией, гастроэзофагальным
рефлюксом, желудочно-кишечными кровотечениями.
4. Пациенты
с повышением уровня липидов, с гипокалиемией, с повышенным уровнем мочевой
кислоты, гипокальциемией, гипергликемией, дегидратацией.
5. Пациенты
с лейкопенией (включая нейтропению и агранулоцитоз), анемией, тромбоцитопенией,
лейкоцитозом.
6. С дерматологическими реакциями: сыпь (в т.ч.
эксфолиативная), зуд, крапивница, кровоизлияния (в т.ч. пурпура), дерматит (в
т.ч. экзема), ломкость ногтей, гипергидроз.
.2 Методы исследования
Всем пациентам проведено общетерапевтическое
обследование, изучены данные лабораторных исследований, проведены клинические
функциональные пробы: симптомы для выявления сакроилеита, диагностические пробы
для выявления болевого синдрома и ограничения подвижности позвоночника,
рентгенологическая диагностика, исследованы данные пациентов по шкале ВАШ,
изучены индексы активности болезни ВАSDAI,
ASDAS и оценены
функциональные нарушения с помощью индекса ВАСFI
и функциональные способности пациента по индексу ВАSMI.
1. Проба
Томайера (оценка общей подвижности позвоночника). Проводится путем измерения в
см. расстояния от среднего пальца вытянутых рук до пола при максимальном
наклоне вперед. Это расстояние в норме равно 0, а при ограничении сгибания
позвоночника оно значительно увеличивается.
2. Позвоночный
индекс (ПИ). Определяется путем складывания показателей (в см.): расстояние
подбородок- яремная вырезка грудины при максимальном отклонении головы назад, проба
Отта, проба Шобера и дыхательной экскурсии грудной клетки и вычитания из них
показателей пробы Томайера. В норме ПИ составляет в среднем 27-30 см и
оценивается в динамике. Снижение ПИ свидетельствует о прогрессировании
ограничения подвижности позвоночника.
3. Индекс BASDAI
(Bath Ankylosing
Spondylitis
Disease Activity
Index) позволяет оценить
выраженность основных клинических проявлений заболевания по визуальной
аналоговой шкале (ВАШ) от 0 до 10 за последнюю неделю. Он основывается на
оценке утомляемости, боли в шее, спине, тазобедренных суставах, болезненности и
припухлости других суставов, локальной болезненности, общего уровня утренней
скованности, длительности и интенсивности утренней скованности.
. Степень воспалительной активности - индекс ASDAS
(Ankylosing
Spondylitis
Disease Activity
Score) включает оценку
боли в шее, спине или тазобедренных суставах за последнюю неделю;
боли/припухлости периферических суставов; продолжительности утренней
скованности; общую оценку активности заболевания пациентом и уровень
С-реактивного белка (СРБ). С помощью индекса можно определить эффективность
лечения. Индекс оценивался по следующим градациям: очень высокая степень
активности заболевания - ASDAS
>3,5; высокая 2,1 до 3,5 умеренная более 1,3 но менее 2,1,
низкая менее 1,3 [4].5. Оценка функциональных
нарушений с помощью суммарного индекса ВАSFI
(Bath Ankylosis
Spondilitis
Functional
Index) содержит 10
аналоговых шкал, связанных с оценкой повседневной активности.
. Для совокупной оценки функциональной
способности рекомендован индекс ВАSMI
(Вath Ankylosing
Spondylitis
Metrology
Index), который отражает
подвижность позвоночника и тазобедренных суставов.
. DAS28
комбинированный индекс активности заболевания, включает упрошенный счет, из 28
суставов и является наиболее удобным в повседневной практике. DAS-28:
высокая активность более 5,1, умеренная менее 3.2, но менее 5.1, низкая: менее
3,2, ремиссия менее 2,6.
.3 Статистическая обработка результатов
Вся статистическая обработка результатов
проведена при помощи пакета прикладных программ Statistica
for Windows,
Release 6.0 StatSoft,
Inc. Данные
представлены в виде М где М - среднее арифметическое. При статистической
обработке показателей невозможно применить параметрический Т-критерий
Стьюдента, так как распределение признаков на определение нормальности
оказалось далеко от нормального, то в дальнейшем был применен непараметрический
метод Манна-Уитни. (Определяется как число пар как х, у таких что они не равны
между собой, х больше у, иными словами что мала зона перекрещивающихся значений
между двумя рядами данных и чем меньше область перекрещивающихся значений, тем
более вероятно, что различия достоверны.) В случае сравнения более двух групп
достоверность определялась с помощью критерия Kruskal-Wallis.
Корреляционную зависимость рассчитывали по методу Спирмена. Различия считались
статистически достоверными при р < 0,05.
ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
.1 Оценка клинического статуса пациентов
находящихся на лечении ГИБТ и основными базисными препаратами
В нашем исследовании результаты лабораторных,
инструментальных исследований сравнивались с двумя группам. Первая группа:
пациенты лечившиеся препаратами ГИБТ
(3 подгруппы) и вторая - контрольная группа
которую составили пациенты с аналогичными заболеваниями не получавшие ГИБТ, а
получавшие (метотрексат, араву, циклоспорин, циклофосфан, сульфасалазин,
азатиоприн, НПВС (целекоксиб, мелоксикам), преднизолон. Условиями для начала
анти-ФНО терапии являлись: наличие окончательного диагноза, наличие активного
заболевания на протяжении минимум 4 недель, оцениваемого с помощью индекса
BASDAI ≥4 по шкале 0-10, по клинической картине; заболевание, стойкое к
лечению, о чём свидетельствует отсутствие ответа на терапию минимум двумя
нестероидными противовоспалительными средствами на протяжении трёх месяцев,
отсутствие ответа на пульс терапию, отсутствие ответа на внутрисуставное
введение стероидов (по показаниям) соблюдение обычных мер предосторожности и
противопоказаний к лечению биологическими препаратами. Мониторинг анти-ФНО терапии
осуществлялся с применением базовых рекомендаций АSAS для клинической практики
и индекса BASDAI. Через 6-12 недель при условии отсутствия ответа следует
рассмотреть необходимость прекращения лечения блокаторами ФНО. Ответом
считается улучшение минимум на 50% или на 2 балла (по шкале 0-10) индекса
BASDAI. Отмены препарата из-за неэффективности или плохой переносимости не
было. Двое пациентов выбыли из исследования в связи с увольнением из рядов ВС
до 20 лет календарного исчисления.
Таблица 1. Общая клиническая характеристика всех
групп больных
|
характеристика
|
Группы
пациентов находившихся на лечении в зависимости от препарата
|
|
Ремикейд
( инфликсимаб)
|
Хумира
(галлимумаб)
|
Актемра
(тоцилизумаб)
|
Лечение
базисной терапией
|
|
Количество
больных
|
6
|
2
|
2
|
10
|
|
Возраст,
лет
|
41,6
|
40.5
|
45.4
|
39.8
|
|
Длительность
заболевания, лет
|
9.5
|
8.2
|
7,
9
|
|
Диагностика
заболевания , с момента дебюта /лет
|
7,6
|
6,1
|
3.8
|
5,8
|
|
Наличие
НLA-В27
|
У
всех
|
У
всех
|
У
всех
|
У
всех
|
|
Длительность
лечения, лет
|
2,2
|
1,
4
|
1,1
|
5,8
|
|
Дозировки
препаратов
|
В/в,
0,2, 6 и каждую 8 недели
|
П/к,
каждые 4 нед.
|
П/к,
каждые 4 нед.
|
Согласно
инструкции по препаратам
|
|
Пол
|
Все
мужчины
|
Все
мужчины
|
1-женщина,
1 мужчина
|
2
женщины, 8 мужчин
|
|
Выход
из исследования
|
Не
было
|
1-в
связи с увольнением из рядов ВС до 20 лет календарного исчисления
|
1-в
связи с увольнением из рядов ВС до 20 лет календарного исчисления
|
Не
было
|
Таблица 2. Общая клиническая характеристика всех
групп больных продолжение
|
Характеристика
|
Группы
пациентов находившихся на лечении в зависимости от препарата
|
|
Ремикейд
(инфликсимаб)
|
Хумира(галлимумаб)
|
Актемра(тоцилизумаб)
|
Лечение
базисной терапией
|
|
Rg| cтадии сакроилеита
1 2 3 4
|
1 3 2 -
|
- 2 - -
|
-
2 - -
|
3
3 4 -
|
|
Системные
проявления болезни: Поражение 1)глаз Ссс Легких Почек Нервной системы
|
3 2 1
|
1
|
1
|
4
1
1
|
|
Течение
болезни: .медленн о прог. Медл.прог.с пер.обострен.
Быстро прог.
|
5 1
|
2
|
1 1
|
10
|
|
Степень
активности: 1-миним. 2-умерен. 3-выраж.
|
4 2
|
2
|
1 1
|
2
7
1
|
|
Rg изменения на
фоне лечения
|
Нет
прогрессирования деструкции
|
Нет
прогрессирования деструкции
|
Нет
прогрессирования деструкции
|
Нет
прогрессиров деструкции
|
3.2 Динамика основных клинико-лабораторных
показателей активности заболевания
Таблица 3. Динамика основных клинико-лабораторных
показателей активности заболевания
|
Показатели
|
Группы
пациентов находившихся на лечении в зависимости от препаратов
|
|
I(1)
|
I(2)
|
II
|
|
До
лечения ремикей-дом
|
После
лечения ремикей-дом
|
До
лечения хумирой
|
После
лечения хумирой
|
До
лечения актемрой
|
После
лечения актемрой
|
До
лечения базисной терапией
|
После
лечения базисной терапией
|
|
Проба
Томайера
|
14.3
|
6.1
|
29
|
23
|
11,7
|
32
|
10.2
|
8.3
|
|
Позвоночн
индекс
|
16
|
22.9
|
27.5
|
35.1
|
8,4
|
23,5
|
16.5
|
19.8
|
|
ВАШ
|
6.6
|
3.5
|
6
|
3
|
4,9
|
2,3
|
5.9
|
3.1
|
|
BASDAl
|
5.07
|
1.6
|
3
|
1.25
|
5,07
|
1.6
|
7.01
|
4.9
|
|
ASDAS
|
3.4
|
2.1
|
3.3
|
1.8
|
3.4
|
2,3
|
5.2
|
4.7
|
|
CОЭ
|
45.8
|
6.8
|
27.5
|
10.5
|
23.5
|
4,5
|
29.9
|
9.7
|
|
Болезненн
суставы
|
9,3
|
3,2
|
6,1
|
2,1
|
6,3
|
1,8
|
11,3
|
|
Припухш
суставы
|
4,1
|
1,6
|
2,3
|
1
|
2,1
|
1
|
7,4
|
4,8
|
|
Утренняя
скованн мин
|
249
|
30
|
65
|
35
|
45
|
20
|
456
|
286
|
|
DAS 28
|
5,3
|
3,2
|
4,8
|
2.9
|
4,2
|
2,7
|
5,6
|
4,1
|
|
Гемоглобин
|
109.5
|
150.1
|
120.2
|
141.5
|
120.3
|
139,4
|
101.1
|
116.4
|
3.3 Динамика оценки функциональных способностей
и нарушений у пациентов находящихся на лечении ГИБП и на лечении основными
базисными препаратами
Таблица 4. Динамика оценки функциональных
способностей и нарушений у пациентов находящихся на лечении ГИБП и на лечении
основными базисными препаратами и оценка активности заболевания
|
Показатели
|
Группы
пациентов находящихся на лечении в зависимости от препарата
|
|
I(1)
|
I(2)
|
I(3)
|
II
|
|
До
лечения ремикейдом
|
После
лечения ремикей-дом
|
До
лечения хумирой
|
После
лечения хумирой
|
До
лечения актемрой
|
После
лечения актемрой
|
До
лечения базисной терапией
|
После
лечения базисной терапией
|
|
BASFI
|
5.2
|
3,7
|
3,2
|
1,9
|
3,6
|
1,85
|
4,7
|
3,1
|
|
ВАSMI
|
28
|
19
|
9
|
4
|
9
|
3
|
35
|
|
ВASDAI
|
5.07
|
1.6
|
3
|
1.25
|
5,07
|
1.6
|
7.01
|
4.9
|
|
АКР
20
|
3.4
|
2.1
|
3.1
|
1.8
|
3.4
|
1.6
|
3.9
|
2.9
|
|
АКР
40
|
3.4
|
1.8
|
3.1
|
1.5
|
3.4
|
1.3
|
3.9
|
2.9
|
.4 Обсуждение результатов
Оценка клинического статуса:
В первую группу вошло 3 подгруппы пациентов
Первую подгруппу составили 6 больных: средний
возраст 41.6 года, длительность заболевания - в среднем 9.5 года. К моменту
начала исследования больные получали метотрексат в дозе от 7-10 мг/нед.
Пациенты получали ИНФ в дозе 3-5 мг/кг массы тела (300-400 мг) на 0, 2, 6-й
неделях, далее каждые 8 нед. Из системных проявлений у 3 пациентов наблюдалась
у иридоциклиты, у 6-х анемия, у 4-х лимфоаденопатия, пневмофиброз у 1-го,
миокардиодистрофия у 2-х.
Во вторую подгруппу вошли 2-ое больных; средний
возраст -40.5 года, длительность заболевания - 7.4 года. К моменту исследования
пациенты получали метотрексат в дозе 10 мг/нед. Пациенты получали ГМБ - 40 мг 1
раз в 4 нед. п/к. Из системных проявлений заболевания у 1-го лимфаденопатия, у
2 -х - анемия, у 1-го иридоциклит.
В третью подгруппу включены 2 больных; средний
возраст - 45.4 года, длительность заболевания - 8,2года. К началу исследования
пациенты получали метотрексат в дозе 8-10 мг/нед. Все пациенты получали ТЦБ -40
мг 1 раз в месяц п/к.Из системных проявлений у 1- го лимфаденопатия, у 2-х -
анемия, у 1-го -иридоциклит
Вторая группа (контрольная) составила 10
больных; средний возраст - 39.8 года, длительность заболевания - 7,9 года. Все
пациенты получали базисную терапию. Из системных проявлений РА у 2-х больных наблюдалась
лихорадка, у одного - снижение массы тела, у 4-х - лимфаденопатия, у 10-ти -
анемия, у 4-х - ириты, у одного- миокардиодистрофия и пневмофиброз наблюдался у
одного больного.
Среди обследованных преобладали мужчины (94%). У
всех пациентов был положителен HLA
- В 27. Все пациенты были со 2-3 ей степенью активности заболевания. У всех
пациентов диагностирована II-III рентгенологическая стадия заболевания. Течение
заболевания медленно - прогрессирующее, у 2-х пациентов быстро прогрессирующее.

При исследовании эффективности и переносимости
ремикейда (пациенты 1 подгруппы): после первого введения ремикейда у
большинства пациентов отмечался быстрый положительный эффект, достоверно
улучшились все исследуемые клинико-лабораторные показатели (ЧВС, ЧБС, утренняя
скованность, показатели СОЭ, уменьшение интенсивности болей по ВАШ). У
пациентов отмечена достоверная положительная динамика по функциональным тестам,
индексу DAS 28и ответу
по критериям АКР. Через 24 недель (6 месяцев) лечения ИНФ снижение индекса
активности BASDAI на 50% установлено у 1-го пациента, через 48 недель лечения
ИНФ снижение индекса активности BASDAI на 50% установлено у 5-ти пациентов.
После 3-й инъекции по критериям АКР 20% улучшение наблюдалось у 1-го больного,
после 6-й инъекции по критериям АКР 20% улучшение наблюдалось у 5-ти больных.
Уменьшилась активность заболевания, определяемая по индексу ASDAS: у всех 6-ти
стала умеренной. Установлено достоверное увеличение объема движений в
позвоночнике после 24 недель терапии. К концу исследования достоверно
улучшилась проба Томайера по сравнению с исходными значениями: с 14,3 до 6,1.
Улучшились значения позвоночного индекс: с 16 до 22.9. Отмечена выраженная положительная
лабораторная динамика. В 1 группе ИНФ зафиксированы снижение СОЭ с 45,8 до 6,8,
повышение гемоглобина с 109,5 до150,1. Переносимость препарата была
удовлетворительной у всех пациентов. Клиническая ремиссия была достигнута у
1-го пациента, у 5-ти активность болезни стала умеренной. Применение ремикейда
у больных с анкилозирующим спондилитом, оказывают быстрый положительный
клинико-лабораторный эффект, и позволяет добиться снижению активности
заболевания. Побочным явлением было повышение уровней печеночных ферментов - у
2-х пациентов в группе. Rg
картина осталась без динамики.
Исследовании эффективности и переносимости
Хумира (пациенты 2 группы). К 14 неделе исследования у пациентов отмечался
хороший положительный эффект, достоверно улучшились все исследуемые
клинико-лабораторные показатели (ЧВС, ЧБС, утренняя скованность, показатели
СОЭ). Через 6 месяцев лечения ГМБ снижение индекса активности BASDAI на 50%
установлено у всех пациентов. После 5-й инъекции по критериям АКР 20% улучшение
наблюдалось у обоих больных. Уменьшилась активность заболевания, определяемая
по индексу ASDAS: стала низкой во 2-ой группе. Установлено достоверное
увеличение объема движений в позвоночнике после 14 недель терапии. К концу
исследования достоверно улучшилась проба Томайера по сравнению с исходными
значениями: с 11,7 до 3,2. Улучшились значения Позвоночного индекс: с 8,4 до
23,5. Отмечена выраженная положительная лабораторная динамика. В 2 группе ГМБ
зафиксированы снижение СОЭ с 23,5 до 4,5 повышение гемоглобина с 102,3 до
139,4. Переносимость препарата была удовлетворительной у всех пациентов.
Активность болезни снизилась у 2-х пациентов. Применение хумиры у больных
оказывают положительный клинико-лабораторный эффект, и позволяет добиться
снижению активности заболевания. Наиболее частым побочным явлением отмечалось
повышение уровней АЛТ, АСТ - у 2-х пациентов, у 1-го пациента была инфекция
верхних дыхательных путей. Rg
картина осталась без динамики по сравнению с Rg
картиной до лечения ГИБТ. При исследовании эффективности и переносимости
Актемра (пациенты 3 группы): у больных с ранним АС (длительность заболевания до
2-х лет, в исследовании принимал участие один больной.) После второго введения
ТЦЗ у 1-го пациента отмечался быстрый положительный эффект, достоверно
улучшились все исследуемые клинико-лабораторные показатели (ЧВС, ЧБС, утренняя
скованность, показатели СОЭ). Через 3 месяца лечения ИНФ снижение индекса
активности BASDAI на 50% установлено у 2-х пациентов. После 5-ой инъекции по
критериям АКР 20% улучшение наблюдалось у 2-х больных. Уменьшилась активность
заболевания, определяемая по индексу ASDAS: у 1го стала низкой и у 1-го
умеренной. Установлено достоверное увеличение объема движений в позвоночнике
после 6 месяцев терапии. К концу исследования достоверно улучшилась проба
Томайера по сравнению с исходными значениями: с 11,7 до 3,2. Улучшились
значения позвоночного индекс: с 8,4 до 23,5. Отмечена выраженная положительная
лабораторная динамика. В 3 группе ТЦЗ зафиксировано снижение СОЭ с 23,5 до 4,5,
повышение гемоглобина с 123,3 до 139,4. Переносимость препарата была
удовлетворительной у всех пациентов. Клиническая ремиссия была достигнута у 1
пациента, у 2-го активность болезни стала умеренной. Применение актемры у
больных ранним АС оказывают быстрый положительный клинико-лабораторный эффект,
и позволяет добиться снижению активности заболевания. Побочным явлением на фоне
лечения актемрой не наблюдалось. Rg
картина осталась без динамики, сравнению с Rg
картиной до применения ГИБТ. Препараты базисной терапии (пациенты 2 группы). В
качестве базисной терапии применялись следующие препараты: сульфасалазин,
метотрексат, азатиоприн, проводилась, пульс терапия солу-медролом, метипредом,
применялись ГКС. При лечении препаратами базисной терапии у большинства
пациентов отмечался умеренный положительный эффект, незначительно улучшились
исследуемые клинико-лабораторные показатели (ЧВС, ЧБС, утренняя скованность,
показатели СОЭ, гемоглобин). Через 24 недели лечения снижение индекса
активности BASDAI на 50% установлено у 2-х пациентов. Активность заболевания,
определяемая по индексу ASDAS: у 8-ми стала умеренной, 1-го оставалась высокой,
и у 1-го низкой. Установлено небольшие увеличение объема движений в
позвоночнике после 24 недели терапии. К концу исследования улучшилась проба Томайера
по сравнению с исходными значениями: с 10,2 до 8,3. Улучшились значения
Позвоночного индекс: с 11,5 до 19,8. Отмечена положительная лабораторная
динамика. В 2 группе зафиксированы снижение СОЭ с 29,9 до 9,7 повышение
гемоглобина с 101,1 до 113,3. Переносимость препарата была удовлетвори- тельной
у всех пациентов. Клинической ремиссии достигнута не было ни у одного пациента,
у 1 пациента активность болезни осталась высокой, у 1-го стала низкой, у 8-ти
активность болезни стала умеренной. На Rg-ой
картине у 4 пациентов прогрессирование заболевания, у 6-ти без динамики. Рано
назначенная патогенетическая терапия позволяет в той или иной степени
контролировать активность АС, включая возможность развития стойкой низкой
активности болезни и клинической ремиссии.
Выводы
1. Применение
ГИБП у больных с анкилозирующим спондилитом является высокоэффективным в
подавлении воспалительной активности заболевания и в ряде случаев позволяет
достичь ремиссии заболевания.
2. Отмечается
лучшая переносимость препаратов ГИБТ по сравнению с традиционными базисными
препаратами.
3. Из 10 пациентов находящихся на ГИБТ у 2-х
наступила клиническая ремиссия, у 5-ти наблюдаемых в ходе лечения наступила
минимальная активность болезни, у 3-х умеренная активность болезни.
. У 2-х пациентов симптомы заболевания
купировались полностью, у 5-ти на 70%, у 3-х на 50%.
. При лечении пациентов препаратами ГИБТ
нормализуется функция суставов
(увеличивается объем движений в суставах,
уменьшается ЧВС и ЧБС, снижается оценка боли по ВАШ), Rg
торможение прогрессирования деструкции суставов увидеть не удалось, у всех
пациентов находящихся на ГИБТ Rg
картина была без отрицательной динамики, МРТ проводилась лишь 5-ти пациентам до
назначения базисной терапии, для верификации диагноза.
1. У
пациентов получавших генно-инженерные биологические препараты побочных эффектов
наблюдалось меньше чем у лиц получавших препараты базисной терапии.
Список литературы
1. Александрова Е.Н., Панасюк Е.Ю.,
Авдеева А.С., Новикова А.А., Лукина Г.В., Черкасова М.В., Климова Н.В., Насонов
Е.Л. Динамика лабораторных биомаркеров у больных ревматоидным артиритом на фоне
терапии тоцилизумабом // Научно-практическая ревматология. 2011. №3. С.14-19.
. Бадокин В.В., Корсакова Ю.Л.,
Барскова В.Г., Елисеев М.С., Кудаева Ф.М. Терапия псориатического артрита
инфликсимабом // Современная ревматология. 2009. №1. С.29-35.
. Бадокин В.В., Трошкина И.А.,
Корсакова Ю.Л. Ингибиторы фактора некроза опухоли α
в
терапии псориатического артрита // Современная ревматология. 2010. №4. С.72-76.
. Балабанова Р.М. Проблемы
ревматологии в материалах XVII Российского национального конгресса «Человек и
лекарство» // Современная ревматология. 2010. №3. С.85-88.
. Балабанова Р.М., Амирджанова В.Н.,
Насонов Е.Л. Применение генно-инженерных биологических препаратов при
ревматоидном артрите в Российской Федерации // Научно-практическая
ревматология. 2012. №6. С.10-14.
. Бочкова А.Г. Рекомендации по
ведению больных анкилозирующим спондилитом . По материалам Международной
рабочей группы по изучению анкилозирующего спондилита (ASAS - ASSESMENT
ANKYLOSING SPONDYLITIS WORK GROUP) // Современная ревматология. 2009. №4.
С.5-10.
. Бочкова А.Г., Румяннцева О.А.,
Дубинина Т.В., Левшакова А.В., Вакуленко О.Ю., Красненко С.О., Эрдес Ш.Ф.
Первый опыт применения Адалимумаба у больных анкилозирующим спондилитом:
клиническое и МРТ-сопоставление результатов терапии // Научно-практическая
ревматология. 2010. №1. С.67-74.
. Дорошкевич И.А., Муравьев Ю.В.
Лейкоцито классический васкулит, связанный с лечением адалимумабом больного
анкилозирующим спондилитом // Научно-практическая ревматология. 2010. №3.
С.88-91.
. Каратаев Д.Е. Современные
европейские рекомендации (КОНСЕНСУС EULAR) по применению биологических
генно-инженерных препаратов при ревматоидном артиритеАРТРИТЕ // Современная ревматология.
2008. №2. С.4-8.
. Каратаев Д.Е., Насонов Е.Л.,
Денисов Л.Н., Станислав М.Л., Панасюк Е. Ю., Андрианова И. А., Мазуров В. И.,
Жугрова Е.С., Успенский Ю. П., Белоусова Л. Н., Иливанова Е. П., Мациевская Г.
К., Арутюнов Г.П., Лыткина К. А., Сайковский Р. С., Ардашев В. Н., Жиляев Е.
В., Коршунов Н. И. Новые возможности терапииревматоидного артрита: Российский
опыт применения цертолизумаба пэгола // Научно-практическая ревматология. 2012.
№2. С.14-19.
. Корсакова Ю. Л. Лечение больных
псориатическим артритом. Рекомендации Европейской Антиревматической Лиги //
Современная ревматология. 2012. №1. С.5-10.
. Лапшина С. А., Мясогутова Л. И.,
Протопопов М. С., Мухина Р. Г., Афанасьева М. А. Опыт применения абатацента в
терапии ревматоидного артрита в Республике Татарстан // Научно-практическая
ревматология. 2012. №6. С.99-102.
. Лукина Г. В., Лучихина Е. Л.,
Сигидин Я. А., Каратаев Д. Е., Александрова Е. Н., Новикова А. А., Насонов Е.
Л. Ремикейд в терапии раннего ревматоидного артрита // Научно-практическая
ревматология. 2006. №2. С.94-95.
. Мезенова Т. В., Тюрин В. П.,
Давидьян С. Ю., Кирюхина Н. А., Елонаков А. В. Сравнительная эффективность
инфликсимаба и адалимумаба у пациентов с анкилозирующим спондилитом //
Научно-практическая ревматология. 2012. №2. С.25-30.
. Насонов Е. Л., Амирджанова В. Н.
Новые аспекты фармакотерапии ревматоидного артрита: фокус на цертолизумаба
пэгол // Научно-практическая ревматология. 2011. №1. С.40-49.
. Насонов Е.Л. Перспективы
фармакотерапии воспалительных ревматических заболеваний: моноклональные
антитела к фактору некроза опухоли а. Рус мед журн 2001;9(7-8):280-4.
. Нероев В. В., Катаргина Л. А.,
Денисова Е. В., Старикова А. В., Любимова Н. В. Эффективность генно-инженерных
биологических препаратов в лечении увеитов, ассоциированных с ревматическими
заболеваниями у детей // Научно-практическая ревматология. 2012. №4. С.91-95.
. Попкова Т. В., Лисыцына Т. А.
Рекомендации по ведению больных системной красной волчанкой в клинической
практике (По материалам рекомендаций Европейской Антиревматической Лиги -
EULAR) // Современная ревматология. 2011. №1. С.4-12.
. Румянцева О. А., Бочкова А. Г.,
Кузикянц К. Х., Левшакова А. В., Эрдес Ш. Ф., Насонов Е. Л. Опыт длительной
терапии инфликсимабом у больных анкилозирующим спондилитом //
Научно-практическая ревматология. 2010. №6. С.16-22.
. Салихов И. Г., Мясоутова Л. И.,
Лапшина С. А., Васильев А. Г., Нигматуллина З. Н., Мухина Р. Г., Абдракипов Р.
З., Юнусова Э. Л. Эффективность и переносимость адалимубаба (Хумира) у
пациентов с активным ревматоидным артритом // Современная ревматология. 2010.
№4. С.44-50.
. Сигидин Я.А., Лукина Г.В.
Биологическая терапия в ревматологии. М.: Практическая медицина, 2009;5-7.
. Трофимов Е. А., Мазуров В. И.,
Уваров С. Ю. Влияние некоторых базисных и генно-инженерных биологических
препаратов на клиническое течение ревматоидного артрита // СМЖ (Томск). 2010.
№4-1. С.80-84.
.Чичасова Н. В. Возможные причины
неэффективности генно-инженерных биологических препаратов при ревматоидном
артирите и пути ее предотвращения // Современная ревматология. 2012. №2.
С.31-41.
.Чичасова Н. В., Насонов Е. Л.
Безопасность применения генно-инженерных биологических препаратов при
ревматоидном артрите // Современная ревматология. 2010. №1. С.46-58.
.Эрдес Ш. Ф. Эффективность
адалимумаба при увеитах у больных анкилозирующим спондилитом // Современная
ревматология. 2012. №1. С.65-68.
.Эрдес Ш. Ф., Фоломеева О. М.,
Тельных М. Ю., Галушко Е. А. Результаты одномоментного эпидемиологического
исследования по определению потребности в генно-инженерных биологических
препаратах для терапии больных ревматоидным артритом в реальной клинической
практике России (ИРАКЛ). Сообщение 2. Определение потребности в ГИБП //
Научно-практическая ревматология. 2010. №4. С.40-48.
.Насонов Е.Л. Нестероидные
противоспалительные препараты (Перспективы применения в медицине). Москва,
Издательство
“Анко”,2000;
142 стр.,
Brooks P.M., Day R.O. Non-steroidal anti-inflammatory drugs: differences and
similarities. N. Engl.
J. Med.
1993;324:1716-1725.
.Насонов Е.Л, Нестероидные
противовоспалительные препараты при ревматических заболеваниях: стандарт
лечения, Российский медицинский журнал, 2001, №7-8
30.Anderrson J.J., Baron G.,
van der Heijde D. et al. Ankylosing
spondylitis assessment group preliminary definition of shortterm improvement in
ankylosing spondylitis. Arthr Rheum
2001;44:1876-86.
.Baraliakos X., Listing J.,
Brandt J. et al. Magnetic resonance imaging
examinations of the spine in patients with ankylosing spondylitis before and
after therapy with tumor necrosis factor alpha receptor fusion protein
etanercept. Artr Rheum 2005;52:1216-23.
.Braun J., Bollow M., Remlinger
G. et al. Prevalence of spondylarthropathies in HLA-B27 positive and negative
blood donors. Arthritis Rheum 1998; 41:58-67.
.Breban M., Vignon E.,
Claudepierre P. Et al. Efficacy of infliximab in refractory ankylosing
spondylitis: results of a six-month open-label study. Rheumatology (Oxford)
2002; 41:1280-5.
34.Davis J.C., van der Heijde
D., Braun J. et al. Recombinant Human Tumor
Necrosis Factor Receptor (Etanercept) for Treating Ankylosing Spondylitis. A
Randomized, Controlled Trial. Arthr & Rheum 2003; 48:3230-6.
. Feldman M., Brennan F., Maini
R.N. Role of cytokines in rheumatoid arthritis. Ann Rev Immunol
1996;14:397-440.
. Fox D.A. The role of T cells
in the immunopathogenesis of rheumatoid arthritis - New perspectives. Arthr
Rheum 1997;40:598-609.
. Haibel H., Rudwaleit M.,
Heldmann F. et al. Efficacy of adalimumab in the
treatment of preradiographic axial spondyloarthritis results of a 12-week
randomized controlled trial. Arthritis Rheum 2008; 58(7):1981-91.
. Kempeni J. Preliminary
results of early clinical trials with the fully human anti-TNF а
monoclonal antibody D2E7. Ann Rheum Dis
1999;58(l.1):170-2.
. Kiltz U., van der Heijde D.,
Mielants H. et al. ASAS/EULAR recommendations for
the management of ankylosing spondylitis: the patient version. Ann
Rheum Dis 2009 Sep;68(9): 1381-1386.
. Sieper J. et al. RHAPSODY.
Poster report, EULAR 2008, SAT 0267.
. Van der Heijde D., Dijkmans
B., Geusens P. et al. Efficacy and safety
of infliximab in patients with ankylosing spondilitis. Results of a randomized,
placebo controlled trial (ASSERT). Arthritis Rhum 2005; 52:582-91.
42.Van der Heijde D., Kivitz
A., Schiff M.H. et al. Efficacy and safety
of adalimumab in patients with ankylosing spondylitis. Results of a
multicenter, randomized, double-blind, placebo-controlled trial. Arthritis
Rheum 2006; 54,2136-46.
. Van der Heijde D., Lie E.,
Kvien T.K. et al. ASDAS, a highly discriminatory
ASAS-endorsed disease activity score in patients with ankylosing spondylitis. Ann
Rheum Dis 2009;68:1811-8.
. Van der Heijde D., Landewe
R., Baraliakos X. et al. Ankylosing
spondylitis study for the Evalution of Recombinant infliximab therapy study
group. Radiographic findings 2 years of infliximab therapy in patients with
ankylosing spondylitis. Arthritis Rheum
2008;58:3063-70.
. Van der Heijde D., Landewe
R.,Einstein S. et al. Radiographic
progression of ankylosing spondylitis after up to two years of treatment
etanercept. Arthritis Rheum 2008;58: 1324-31.