Основные положения биофармацевтического анализа
Министерство
здравоохранения ПМР
Министерство
просвещения ПМР
НУОВППО
«Тираспольский межрегиональный Университет»
Медицинский
факультет
Кафедра
«Фармация»
Специальность:
060108.65 «Фармация»
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ РАБОТА
Тема:
«Основные
положения биофармацевтического анализа»
Тирасполь
2014 г
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
ГЛАВА
I. Основные положения биофармацевтического анализа
.1
Предмет и задачи биофармацевтического анализа
.2
Способы установления биологической доступности лекарственных средств
.3
Основные фармакокинетические параметры и способы их расчета
.4
Влияние различных факторов, на фармакокинетические параметры
.5
Метаболизм и его роль в механизме действия лекарственных веществ
ГЛАВА
II. Методы, используемые в биофармацевтическом анализе
.1
Хроматографические методы анализа
.2
Фотометрические методы анализа
.3
Методы, основанные на использовании магнитного поля
.4
Люминисцентные
методы анализа. Флуориметрия
ЗАКЛЮЧЕНИЕ
СПИСОК
ЛИТЕРАТУРЫ
биофармацевтический
лекарственный метаболизм
ВВЕДЕНИЕ
Последние три десятилетия связаны с
возникновением и бурным развитием биофармации - науки, изучающей действие
лекарств в организме в зависимости от физических, химических, биологических и
других свойств ингредиентов, а также лекарственной формы, в виде которой
вводится вещество.
Выделение биофармации в самостоятельную отрасль
науки следует отнести к концу 50-х - началу 60-х годов XX века, когда было
обращено внимание на зависимость фармакологической активности от таких
факторов, как степень измельчения и явление полиморфизма, а также от
технологических процессов получения лекарств. Возникло своеобразное
противоречие между существовавшими нормами оценки качества и фактическим
действием лекарств. Последние по результатам аналитического контроля соответствовали
в одинаковой степени требованиям фармакопеи, но различались по
фармакологическому эффекту. Так возникло понятие о терапевтической
неэквивалентности лекарств. Оно означает, что одни и те же лекарственные формы,
содержащие одинаковые количества лекарственного вещества, но изготовленные
разными способами, производят неодинаковый терапевтический эффект. Установить
причину такого явления можно только проведением биофармацевтических и
фармакокинетических исследований. Они включают выяснение влияния различных
биофармацевтических факторов на терапевтическую эффективность лекарств;
изучение биологической доступности лекарств и разработку методов ее
определения; создание способов определения лекарственных веществ и их
метаболитов в биологических жидкостях.
Изучение механизма качественных и количественных
изменений лекарственных веществ в органах и биологических жидкостях организма
входит в задачу фармакокинетики.
Основным фармакокинетическим параметром является
продолжительность достижения и сохранение максимального уровня концентрации
лекарственного вещества в крови, а также скорость и характер ее снижения.
Это обусловлено наличием корреляции между
терапевтическим эффектом и длительностью циркуляции лекарственного вещества в
плазме крови.
Проведение фармакокинетических исследований
возможно только на основе применения современных методов, позволяющих
проследить процесс всасывания и распределения лекарственного вещества в органах
и тканях.
Целью работы, является обобщение и
систематизирование полученного ранее материала с целью более глубокого и
четкого понимания данного вопроса, а так же теоретическое обоснование создания
новых лекарственных препаратов и совершенствование имеющихся с учетом повышения
их терапевтического эффекта и уменьшения побочного действия на организм.
Задачи:
.Теоретическое изучение основных задач и
особенностей биофармацевтического анализа;
. Рассмотреть основные фармакокинетические
параметры и изучить основные факторы влияния на них
. Изучить этапы метаболизма лекарственных
веществ в организме человека
. Рассмотреть методы анализа лекарственных
веществ, используемых для анализа биологических жидкостей
ГЛАВА I. ОСНОВНЫЕ ПОЛОЖЕНИЯ БИОФАРМАЦЕВТИЧЕСКОГО
АНАЛИЗА
.1 Предмет и задачи биофармацевтического анализа
Биофармацевтический анализ-раздел клинической
фармации, биофармации и клинической фармакокинетики. Основоположником метода в
России является доктор фармацевтических наук, заслуженный деятель науки РФ,
профессор В.Г.Беликов, им предложен и сам термин «биофармацевтический анализ».
Биофармацевтический анализ используется в
следующих случаях:
при исследовании фармакокинетики нового
препарата или новой лекарственной формы;
в клинико-фармакологических исследованиях (для
расчета оптимальных схем дозирования, проведения терапевтического мониторинга);
в судебно-медицинских и
клинико-токсикологических исследованиях (для определения препарата, вызвавшего
отравление, и для контроля за детоксикационными мероприятиями).
Основной задачей биофармацевтического анализа
является разработка способов выделения, очистки, идентификации и
количественного определения ЛВ и их метаболитов в таких биологических
жидкостях, как моча, слюна, кровь, плазма или сыворотка крови и др. с целью
фармакокинетической оптимизации процессов фармакотерапии.
Цели биофармацевтического анализа:
Определение концентрации лекарственных веществ и
их метаболитов в биологических жидкостях организма человека;
Изучение фармакокинетики лекарственных средств;
Изучение биологической доступности лекарственных
средств;
Изучение биотрансформации лекарственных средств;
Установление диапазона минимального
терапевтического и токсического уровней препаратов в организме;
Выявление зависимости фармакокинетических
параметров и концентрации лекарственного вещества от состояния организма
человека;
Расчет индивидуальных схем дозирования
лекарственных средств на основе их количественного определения в биожидкостях.
Фармакокинетические исследования проводятся
специалистами в области аналитической химии, провизорами, биологами, но
результаты таких исследований могут быть очень полезны для врачей. На основании
данных о фармакокинетике того или иного препарата определяют дозы, оптимальный
путь введения, режим дозирования и продолжительность лечения. Знания основных
принципов фармакокинетики особенно нужны в случаях, когда неясны причины
неэффективного лечения или плохой переносимости препарата, при лечении больных
с заболеваниями печени и почек, при одновременном применении нескольких
лекарственных средств. Фармакокинетические исследования необходимы при разработке
новых препаратов, новых лекарственных форм, а также при экспериментальных и
клинических испытаниях лекарственных средств.
Составные части фармакокинетических процессов -
всасывание, распределение, биотрансформация и выведение.
Особенно важно определять в биологических
жидкостях концентрацию ЛВ, когда они наряду с терапевтическим эффектом
проявляют токсичность. Необходимо также контролировать содержание ЛВ в
биологических жидкостях больных, страдающих желудочно-кишечными заболеваниями и
заболеваниями печени и почек. При таких заболеваниях изменяются процессы
всасывания, нарушаются метаболические процессы, замедляется выведение ЛВ из
организма.
Биологические жидкости - очень сложные объекты
для выполнения анализа. Они представляют собой многокомпонентные смеси,
включающие большое число неорганических и органических соединений различной
химической структуры: микроэлементы, аминокислоты, полипептиды, белки, ферменты
и др. Их концентрация колеблется от 10 мг/мл до нескольких нанограммов. Даже в
такой относительно простой физиологической жидкости, как моча, идентифицировано
несколько сотен органических соединений. Всякий биологический объект - очень
динамичная система. Ее состояние и химический состав зависят от индивидуальных
особенностей организма, воздействия факторов внешней среды (состав пищи,
физическая и психическая нагрузка и т.д.). Все это еще в большей степени
усложняет выполнение биофармацевтического анализа, так как на фоне столь
большого количества сложных по химическому строению органических веществ нужно
определять нередко очень малые концентрации лекарственных веществ. Вводимые в
биологические жидкости лекарственные вещества в процессе биологической
трансформации образуют метаболиты, количество которых нередко исчисляется
несколькими десятками. Выделение этих веществ из сложных смесей, разделение на
индивидуальные компоненты и установление химического состава - задача
необычайно трудная.
Таким образом, можно выделить следующие
особенности биофармацевтического анализа:
. Объекты анализа представляют собой
многокомпонентные смеси веществ, сходных по химическому строению, поэтому можно
использовать только высокоселективные методы анализа.
. В пробах находятся малые количества
определяемых веществ, поэтому метод анализа должен быть высокочувствительным.
. Лекарственные вещества могут быть связаны в
биологической пробе с белками, гормонами и другими компонентами пробы, что
затрудняет их определение.
. Условия подготовки пробы зависят от вида
биожидкости.
Помимо теоретического значения, которое имеют
исследования в области биофармацевтического анализа для изучения вновь
создаваемых лекарственных веществ, несомненна и практическая роль этой отрасли
знаний.
Следовательно, биофармацевтический анализ
представляет собой своеобразный инструмент, необходимый для проведения не
только биофармацевтических, но и фармакокинетических исследований. [6]
.2 Способы установления биологической
доступности лекарственных средств
Терапевтический эффект лекарственных препаратов
зависит от того, какая часть введенного лекарственного вещества попадет в
системный кровоток и затем будет доставлена в те ткани или органы, в которых
осуществляется его специфическое действие. Этот показатель характеризует
биологическую доступность.
Биологическая доступность (БД)- это степень
всасывания лекарственного вещества из места введения в системный кровоток и
скорость, с которой этот процесс происходит.
В клинической практике уже давно отмечено, что
препараты, содержащие одни и те же лекарственные вещества, но выпускаемые
различными фармацевтическими фирмами, существенно различаются как по
терапевтической эффективности, так и по частоте возникновения и выраженности
побочных эффектов. В большинстве случаев различия в терапевтической
эффективности препаратов, содержащих одни и те же активные вещества,
обусловлены изменением их биодоступности - количества лекарственного вещества,
которое попадает в системный кровоток, и скорости, с которой этот процесс
происходит. В связи с этим возникло новое понятие - биоэквивалентность.
Лекарственные препараты называют биоэквивалентными в тех случаях, когда они
обеспечивают одинаковую концентрацию действующего вещества в крови и тканях
организма. [12,25]
Биоэквивалентность устанавливают по таким трем
параметрам, как максимум концентрации лекарственных веществ в крови, время
достижения максимальной концентрации и площадь под кривой изменения
концентрации лекарственных веществ в плазме или сыворотке крови, измеренная во
времени. Нередки случаи, когда аналогичные лекарственные вещества биологически
неэквивалентны, так как имеют различную биодоступность. Поэтому при оценке
биоэквивалентности следует учитывать важнейшие параметры биодоступности
лекарственных веществ. Биологическую доступность лекарственных средств можно
установить тремя различными путями: методами in vitro с помощью приборов;
методами in vivo на животных или у здоровых людей-добровольцев. Установление
биологической доступности методами in vitro основано на корреляционной
зависимости между скоростью всасывания и скоростью растворения лекарственных
веществ. Поэтому для растворимых веществ метод определения скорости растворения
служит основным методом определения эффективности высвобождения лекарственных
веществ из лекарственной формы. [10]
Принцип действия созданных для этого многочисленных
приборов заключается в механическом разрушении лекарственной формы и диффузии
лекарственных веществ в воду или другую растворяющую среду, имитирующую
биологическую жидкость. По мере высвобождения или после полного высвобождения
лекарственного вещества растворяющую жидкость удаляют из прибора. Полученные
пробы подвергают анализу, используя химические или физико-химические методы.
Лекарственная форма признается соответствующей требованиям скорости
высвобождения, если в течение установленного интервала времени из нее переходит
в растворяющую жидкость оптимальное количество лекарственных веществ. Следует
отметить, что изучение кинетики высвобождения лекарственного вещества in vitro
в модельных условиях не может заменить исследования in vivo. Вызвано это
различием в механизмах протекающих процессов. Так, при всасывании in vivo вслед
за стадией растворения лекарственных веществ следует стадия проникновения через
стенки желудка и кишечника. Биологическая доступность методами in vivo
устанавливается на лабораторных животных (кроликах, собаках и др.). При этом
либо определяют содержание лекарственного вещества (метаболитов) в крови, либо
устанавливают скорость их выведения с мочой через определенные промежутки
времени. Важнейший этап этих испытаний - количественный анализ. Он усложняется
по сравнению с методами in vitro, поскольку приходится анализировать сложную
смесь, включающую не только лекарственные вещества или их метаболиты, но и
различные соединения, входящие в состав биологических жидкостей.
Для характеристики биодоступности широко
применяют способ, основанный на оценке максимальной концентрации лекарственных
веществ в крови после введения внутрь изучаемой лекарственной формы. Такой
способ является весьма приблизительным, так как биодоступность зависит не
только от степени и скорости всасывания, но и от распределения и элиминации
лекарственных веществ в организме.
Для определения биологической доступности у
здоровых людей подбирают группы добровольцев определенного возраста и
соответствующим образом их готовят: стандартизируются диета, количество выпитой
воды, физическая активность, исключается прием других лекарств, возможность
стрессовых состояний и т.д. Сущность испытаний заключается в установлении
скорости выведения лекарственных веществ с мочой через определенные промежутки
времени после введения лекарственного средства. Концентрацию лекарственных
веществ или их метаболитов устанавливают с помощью методик биофармацевтического
анализа.
Таким образом, одним из основных этапов любого
исследования биологической доступности лекарственных средств является
использование биофармацевтического анализа для определения концентрации
лекарсвенных веществ (метаболита) в биологических жидкостях.[6,12]
.3 Фармакокинетические параметры и способы их
расчета
Фармакокинетические исследования обычно
выполняются с целью дачи рекомендаций по оптимальному режиму дозирования
препаратов, обеспечивающему быстрое достижение и поддержание терапевтического
эффекта при минимальном риске побочных явлений, либо с целью оценки влияния
особенностей организма или внешних факторов на фармакокинетику. Основные
фармакокинетические параметры позволяют количественно охарактеризовать
процессы, которые происходят с лекарственным веществом в организме, они
позволяют увидеть связь между концентрацией лекарственного вещества в
биологических жидкостях и его фармакологическим действием.[12,15]
Количественно биодоступность оценивают для одной
дозы по максимальному уровню концентрации лекарственных веществ в крови или
плазме, времени наступления максимума концентрации и площади под кривой
зависимости «концентрация лекарственного вещества - время». Изменение
концентрации лекарственного вещества выражают уравнением;
/dt =-keC ,
или в интегральном виде:
С = С0е-ket ,
где С - концентрация в данный момент времени, С0
- введенная доза, ke - константа скорости элиминирования, t-время. Чаще
используют логарифмическую форму:
(C0/C) = ket
В графическом виде изменение концентрации
лекарственного вещества от времени представлено на рис. 1.1.
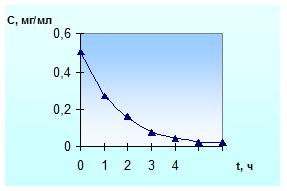
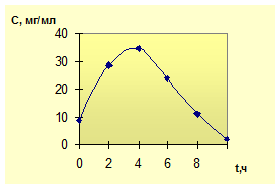
а
б
Рис. 1.1. Зависимость убывания
концентрации ЛВ от времени: а - внутривенное введение; б - пероральное введение
При этом график «а» соответствует
простейшей однокамерной модели, а график «б» - однокамерной модели с
всасыванием.
В фармакокинетических расчетах
используют значение АUС (аrеа under the curve) - суммарной площади под кривой
концентрации лекарственного вещества от момента его попадания в организм до
полного удаления из него.
Математически АUС представляет собой
интеграл:
АUС =∞∫0Сdt.
Во многих случаях рассчитывают не
полную площадь под кривой, а ее часть за определенный промежуток времени, как
правило, равный интервалам между двумя последовательными введениями
лекарственных средств.
Еще один важный параметр - среднее
время удержания ЛВ в организме МRТ (mean residence time) - представляет собой
отношение:
МRТ = АUMС / АUС,
где АUMС (аrеа undеr the moment
curve) математически выражается как интеграл от произведения времени на
концентрацию АUMС = ∫tCdt.
При внутривенном введении среднее
время удержания лекарственного вещества обратно пропорционально константе
скорости элиминирования:
МRТ = 1/ke .
Если вещество в значительном количестве
в неизмененном виде экскретируется с мочой, то эти данные также можно
использовать для оценки степени биодоступности. При этом, оперируя параметрами
АUС, абсолютную биодоступность определяют как:
Fabc=(( АUСper
os/АUСiv)·(Civ/Cper
os)) · 100% ,относительную
- как:=((
АUСper
os(test)/АUСres
os(stand))·(Cper os (stand)/Cper os(test))) · 100% .
АUС устанавливают интегрированием
или любым методом определения площади криволинейной трапеции.[25]
Количественно характеризуют
процессы, происходящие с лекарственным веществом в организме, следующие
основные фармакокинетические параметры.
Константа скорости элиминации (ч-1,
мин-1) характеризует скорость удаления (элиминации) лекарственного вещества из
организма путем экскреции или биотрансформации.
Константа скорости всасывания-
параметр, отражающий скорость поступления (ч-1, мин-1) лекарственного вещества
из места введения в системный кровоток. Используют этот параметр при всех путях
введения, кроме внутривенного и внутриартериального.
Константа скорости экскреции
характеризует скорость выделения лекарственного вещества (ч-1, мин-1) с мочой,
слюной, калом, молоком или другими экскретами.
Важным фактором, влияющим на
терапевтический эффект, является содержание лекарственного вещества в
организме. Оно зависит от продолжительности выведения или элиминации из
организма. Показателем элиминации является клиренс (мл/мин). Общий клиренс -
это объем плазмы или крови, из которого за единицу времени лекарственное
вещество выводится почками, печенью, легкими или биотрансформируется в
организме. Параметр, определяющий скорость очищения организма от лекарственного
вещества почками, носит название почечный клиренс, а другими путями - вне
почечный клиренс.[6]
Объемраспределениялекарственного
вещества - это гипотетический объем жидкостей организма, который необходим для
равномерного распределения всего количества лекарственного вещества в той же
концентрации, в которой он содержится в плазме крови. Этот показатель находится
в зависимости от пола, возраста, общей массы жиров в организме больного.
Распределение лекарственного вещества зависит от таких его физико-химических
свойств, как растворимость в воде и в липидах, молекулярная масса, полярность,
уровень ионизации. Объем распределения используют для расчета дозы
лекарственного вещества, необходимой для достижения нужной концентрации его в
крови.
О выведении лекарственного вещества
из организма судят по периоду полувыведения, или полуэлиминации. Под ним
понимают время, в течение которого происходит снижение на 50% концентрации лекарственного
вещества по сравнению с введенным количеством. За один период полуэлиминации из
организма выводится 50%, за два периода - 75%, за три периода - 90%
лекарственного вещества.
Равновесная концентрация - это
состояние, при котором количества вводимого и адсорбирующегося лекарственного
вещества равны между собой. Поэтому при равновесной концентрации содержание
лекарственного вещества в организме колеблется между максимальными и
минимальными его значениями. Это соответствует оптимальному проявлению клинического
эффекта.
Период полуабсорбции
(полувсасывания) - время (ч, мин), необходимое для всасывания лекарственного
вещества из места введения (кроме внутрисосудистого) в системный кровоток
половины введенной дозы.
Период полураспределения (ч, мин) -
условный параметр, характеризующий распределение лекарственного вещества между
центральной камерой (плазма крови) и периферической камерой (органы, ткани).
Площадь под фармакокинетической
кривой- площадь фигуры, ограниченной на графике фармакокинетической кривой и
осями координат, одна из которых обозначает концентрацию лекарственного
вещества в плазме крови (мкг/мл), а другая - время после введения
лекарственного вещества (мин).[2,25]
1.4 Влияние различных факторов, на
фармакокинетические параметры
Основные группы факторов, влияющих на
фармакокинетику лекарственных средств:
Биохимические особенности организма
(ферментопатии, различия в скорости метаболизма).
Физиологические особенности - пол, возраст,
масса тела, циркадные ритмы.
Беременность, родовой и послеродовой периоды.
Образ жизни (прием алкоголя, курение, режим
питания, режим физической нагрузки, экология окружающей среды).
Патологические процессы.[12]
. Влияние биохимических особенностей организма.
Изучение генетически обусловленных различий в
чувствительности к лекарственным средствам составляет предмет фармакогенетики.
Наследственные факторы, определяющие необычные
реакции на лекарственное средство, чаще всего представляют собой дефект
ферментов, принимающих участие в метаболизме лекарств, но могут встречаться и
наследственные анатомические дефекты. Лица, страдающие ферментопатиями
генетического характера, как правило, выглядят вполне здоровыми до введения им
лекарства, которое их организм не способен метаболизировать. На аномальную
реакцию указывают необычные побочные явления, симптомы отравления, устойчивость
к лекарству или ослабление его действия. В таких случаях
"токсичность" вызывается терапевтическими дозами препарата В основе
так называемой лекарственной идиосинкразии, т.е. атипичной реакции организма на
медикаментозное воздействие, лежит полиморфизм белков и ферментных систем.
Нарушения обмена, ведущие к изменению чувствительности к данному
фармакологическому агенту, могут быть связаны как с недостаточностью
определенного фермента (в большинстве случаев), так и с избыточным содержанием
его в организме. Оба вида нарушений возникают вследствие генных мутаций.[3,18]
. Влияние физиологических особенностей.
Влияние возраста на фармакокинетику
лекарственных препаратов проявляется, в основном, в крайних возрастных группах:
у новорожденных и детей до 1 -го года жизни,
у пожилых людей старше 60 лет.
У новорожденных изменяется всасывание
лекарственных препаратов за счет следующих факторов: изменение рН желудочного
сока (рН на высоте секреции соляной кислоты составляет у детей месячного
возраста 5,8; в возрасте 3-7 месяцев - около 5; 8-9 месяцев - 4,5 и только к 3
годам становится, как у взрослых - 1,5-2,5), поэтому замедляется всасывание
лекарственных препаратов кислотного характера; у детей более интенсивно
происходит всасывание через кожу, что связано с малой толщиной рогового слоя
кожи и с увеличенной гидратацией кожи. В результате могут наблюдаться системные
проявления при наружном применении мазей, присыпок.
Распределение лекарственных веществ в организме
ребенка существенно отличается от взрослого за счет следующих факторов:
у новорожденных значительно больше объем
внеклеточной жидкости (примерно 40-50% от общей массы тела), и только у детей
старше 1 года составляет 20-25%, то есть не отличается от объема у взрослых
людей;
у новорожденных снижено количество жировой
ткани;
значительно снижено связывание лекарственных
веществ с белками, так как альбумин у новорожденных обладает пониженной
способностью связывать лекарственные вещества и кроме этого в крови
новорожденных высокие концентрации свободных жирных кислот и билирубина,
которые занимают участки связывания на белке.
У детей снижена активность ферментов,
участвующих в биотрансформации лекарственных средств. Экскреция с мочой
происходит медленнее, так как выделительная функция почек у новорожденных
составляет 30-40% (на единицу поверхности тела) от таковой у взрослых. Поэтому
периоды полуэлиминации лекарственных препаратов в несколько раз больше, чем у
взрослых. Учитывая все эти особенности, необходимо уменьшать дозы лекарственных
препаратов при назначении в детском возрасте. Как правило, у детей старше
5-летнего возраста основные клинико-фармакологические параметры уже мало
отличаются от тех же параметров взрослых людей. [12]
У лиц пожилого возраста для большинства
препаратов замедленно протекают все фармакокинетические процессы - всасывание,
распределение, биотрансформация и экскреция.
Снижение всасывания при пероральном приеме
препаратов связано с уменьшением кровотока в кишечнике, снижением желудочной
секреции; при внутримышечном и подкожном введениях также уменьшается всасывание
в результате замещения хорошо перфузированных тканей соединительной и жировой
тканями. Изменение распределения связано с уменьшением тканевой проницаемости,
снижением уровня альбуминов в крови (на 15-20 % меньше, чем у молодых),
увеличением процента жировой ткани. Скорость биотрансформации снижается из-за
уменьшения активности ферментов печени, особенно оксидаз, и уменьшения
печеночного кровотока; кроме этого, снижается интенсивность пресистемного
метаболизма, вследствие этого может несколько увеличиться биодоступность
лекарственных препаратов с высоким эффектом "первичного прохождения".
Снижается скорость экскреции в почках в результате уменьшения размеров почки
примерно на 20% и уменьшения количества нефронов на 35%. Таким образом, дозы
препаратов, назначаемых в старческом возрасте, необходимо также уменьшать.
В процессе старения изменяются размеры и состав
тела, влияющие на распределение. С уменьшением размеров тела уменьшается объем
распределения лекарственных веществ и, следовательно, увеличивается их
концентрация. Эти возрастные особенности могут обусловить самое различное
распределение лекарственных препаратов и их взаимодействие в организме при
старении. Становится понятным, что тканевая проницаемость для лекарственных
веществ, которые больше растворимы в воде, чем в жирах, может быть уменьшена и
их концентрация в крови будет более высокой. Если лекарственные препараты
жирорастворимы, то их кумуляция в жировых тканях может приводить к
пролонгированию фармакологической и терапевтической активности. Всосавшись из
пищеварительного канала или попав в кровь иным путем, лекарственное вещество
транспортируется к различным органам и получает возможность действовать на
клеточные рецепторы. С возрастом уменьшаются число и связывающая способность
многих рецепторов.
Изменения чувствительности к лекарственным
препаратам у лиц старческого возраста исследовать трудно в связи с нарушениями
нормальных гомеостатических механизмов и наличием множественной патологии.
У людей, страдающих ожирением, наблюдается
значительное увеличение, как общего, так и удельного объема распределения для
липофильных препаратов, которые в значительной мере могут захватываться жировой
тканью и кумулировать в ней.
У истощенных больных (например, мужчины с массой
тела 44 кг) обнаружено двукратное ускорение элиминации, что связано в основном
с уменьшением удельного объема распределения.
Влияние пола на кинетику лекарственных средств у
людей изучено мало, имеющиеся отдельные данные свидетельствуют о том, что такие
различия характерцы для некоторых препаратов. У женщин, как правило,
наблюдается более высокое удельное содержание жировой ткани, чем у мужчин,
поэтому некоторые лекарственные средства липофильного характера имеют у женщин
больший объем распределения. Обнаружены различая и в связывании лекарственных
средств у жрнщин, которые принимают контрацептивы. Различия обусловлены и
разным гормональным статусом мужчин и женщин.
Биологические ритмы влияют на многие физиологические
параметры человека. Специальный раздел фармакологии - хронофармакология -
изучает различия в действии лекарственных средств в зависимости от времени
введения в течение суток, а также влияние сезонных ритмов года на
фармакологические эффекты.
Проблема влияния биоритмов на фармакокинетику и
фармакодинамику различных лекарственных веществ еще недостаточно изучена и
нуждается в дальнейшей экспериментальной разработке и клинической
проверке.[3,11,18]
. Применение лекарственных средств во время
беременности требует особой осторожности, т.к. многие лекарственные средства
через плаценту попадают в плод и могут оказать токсическое действие.
Беременность с самого начала вызывает глубокие
изменения в функционировании различных систем организма и составе жидкой и
тканевой сред. Всасывание препаратов из желудочно-кишечного тракта снижено, так
как замедлена эвакуация из желудка. Распределение препаратов также изменяется
при беременности: в организме женщины накапливается жидкость, объем крови
увеличивается примерно на 1/3. Эти изменения сопровождают уменьшение
концентрации гемоглобина в крови, соответственно в ней уменьшается концентрация
лекарственных веществ, используемых в обычных терапевтических дозах. При
беременности снижается способность белков плазмы связывать многие препараты и
уровень альбуминов также снижается, таким образом увеличивается концентрация
несвязанных лекарственных веществ. Количество жировой ткани увеличивается на
4-5 кг, и, следовательно, увеличивается резервуар для поглощения растворимых в
жирах лекарственных веществ. Элиминация ЛС может изменяться по мере роста
сроков беременности. Клиренс креатинина повышается приблизительно на 50%,
поэтому препараты, в основном элиминируемые почками (ампициллин, дигоксин),
быстрее выводятся из организма.
По риску развития эмбриотоксического и
тератогенного действия лекарственных средств подразделяются на следующие
группы:
а)лекарства высокого риска, требующие прерывания
беременности: цитостатики, антимикотические и противоопухолевые антибиотики,
иммунодепрессанты. Действие указанных препаратов сохраняется до 3 месяцев у
мужчин (влияние на сперматогенез) и до 6-12 месяцев у женщин;
б)лекарства значительного риска, применение
которых впервые 3-10 недель беременности может вызвать гибель эмбриона или
самопроизвольный выкидыш: аминогликозиды, тетрациклины, рифампицины,
антипротозойные, противосудорожные, антипаркинсонические, стероидные и
нестероидные противовоспалительные средства, пероральные антидиабетические
препараты, антикоагулянты;
в)лекарства умеренного риска: сульфаниламиды,
эстрогены.[20]
. Влияние образа жизни.
Влияние курения на кинетику лекарственных
средств связано с индукцией ферментов печени и ускорением процессов элиминации.
Курильщикам нужны большие дозы лекарственных препаратов, таких как
антидепрессанты (азафен, имизин), так как из-за увеличения активности
микросомальных ферментов печени содержание этих лекарств у них в крови ниже,
чем у некурящих. Транквилизаторы (элениум, седуксен) быстрее выводятся из
организме курящего человека, поэтому их успокаивающий эффект значительно снижается.
Для достижения обезболивающего эффекта курильщикам нужны большие дозы
парацетамола или фенацитина. Особенно разрушительно действуют компоненты
табачного дыма на бета-адреноблокаторы - группу очень мощных сердечных
препаратов, в которую входят анаприлин, обзидан, пропранолол. Резко
увеличивается скорость их выведения из организма и резко снижается лечебное
действие. Курение, к тому же, ухудшает кровоток в капиллярах, питающих
сердечную мышцу. Это, в конечном счете, может сводить на нет благоприятное
воздействие бета-адреноблокаторов при ишемической болезни сердца. При лечении
ревматических заболеваниях лекарства выводятся в два раза быстрее из организма,
однако увеличивать их дозу нельзя, поскольку сразу проявляются многочисленные
побочные эффекты и осложнения. В настоящее время установлено неблагоприятное
воздействие табачного дыма более чем на 30 групп лекарств.
Влияние алкоголя при умеренном потреблении также
связанно с индукцией микросомальных ферментов. В результате период
полуэлиминации препаратов снижается, и лекарственные средства быстрее выводятся
из организма. При длительном хроническом алкоголизме с органическим поражением
печени, наоборот, резко снижается скорость метаболизма лекарственных средств.
Влияние пищи - скорость окислительного метаболизма
ЛС зависит от содержания в диете белков и углеводов. Диета с большим
содержанием в пище углеводов ведет к снижению скорости метаболизма ЛС (у
вегетарианцев, например), что, по некоторым гипотезам, замедляет процессы
старения и ведет к увеличению продолжительности жизни; при высоком содержании
белков скорость биотрансформации увеличивается.
Режим и физическая нагрузка. Обычно у
амбулаторных больных препарат быстрее всасывается, как при приеме внутрь, так и
при парентеральном введении, чем у больных с постельным режимом. В то же время,
параметры функции почек у людей в положении лежа выше, чем при вертикальном
положении, в результате экскреция препарата с мочой у лежачих больных больше.
При активной физической нагрузке повышается всасывание препаратов из-за
ускорения кровообращения, а также повышается экскреция препаратов с
мочой.[15,21]
. Влияние патологических процессов.
При заболевании почек чаще всего:
а) снижается экскреция препаратов с мочой, в
результате чего концентрация препаратов в крови увеличивается, что может
привести к проявлению токсического эффекта. Это справедливо для препаратов,
которые выводятся преимущественно с участием почечной фильтрации (антибиотики,
аминогликозиды);
б)если же снижается обратная реабсорбция
лекарственных средств в кровь из почечных канальцев, то препарат, наоборот,
будет быстрее выводиться из организма (такой эффект наблюдают для
сульфаниламидов длительного действия). [20]
При заболеваниях печени изменяется
фармакокинетика препаратов по нескольким причинам:
а) метаболизирующая функция печени снижена, так
как происходит либо уменьшение количества гепатоцитов, либо снижение их
функциональной способности;
б) при циррозе нарушается снабжение печени
кровью;
в) наблюдается снижение количества белков крови,
что снижает связывание лекарственных веществ.
Изменения фармакокинетики препаратов при
заболеваниях печени зависят от особенности биотрансформации препарата, а
именно, лекарственные вещества, быстро метаболизирующие в печени, с высоким
печеночным клиренсом, из-за снижения функции гепатоцитов, увеличат свою
биодоступность и, соответственно, эффект. В связи с этим необходимо уменьшить
начальные дозы таких препаратов (пропранолол, лабеталол, пентазоцин, петидин).
Для препаратов, медленно метаболизирующих в печени, с низким печеночным
клиренсом уменьшается скорость биотрансформации лекарств и, соответственно,
увеличивается период полуэлиминации таких препаратов (фенобарбитал, теофиллин,
диазепам).[8,9]
Заболевания сердечно-сосудистой системы изменяют
все процессы фармакокинетики. При сердечной недостаточности уменьшается
кровоснабжение желудочно-кишечного тракта и, соответственно, замедляется
всасывание препаратов после приема внутрь. При застойной сердечной
недостаточности, вследствие снижения сердечного выброса уменьшается
кровоснабжение органов и тканей: ухудшение перфузии тканей приводит к
уменьшению объема распределения лекарственных веществ, при уменьшении
кровоснабжения печени и почек замедляется биотрансформация и выведение
препаратов.
Как правило, лечение пациентов проводится не
одним, а несколькими препаратами. В связи с этим на первое место выступает
проблема взаимодействия лекарственных веществ в организме. При сочетанном
применении лекарственных веществ между ними может наблюдаться фармацевтическое,
фармакокинетическое и фармакодинамическое взаимодействие. Фармацевтическое
взаимодействие - это физико-химические или химические реакции между
лекарственными средствами при их комбинировании до введения в организм.
Фармакодинамическое взаимодействие - это взаимодействие, которое приводит к
изменению эффектов препаратов. [1,2]
.5 Метаболизм и его роль в механизме действия
лекарственных веществ
Метаболизму (биотрансформации) подвергаются все
вещества, в том числе и лекарственные, независимо от путей введения их в организм.
Образовавшиеся продукты превращения называются метаболитами.
Метаболизм - это комплекс происходящих в
организме физико-химических и биохимических процессов, способствующих
превращению в более полярные водорастворимые компоненты, которые легче
выводятся из организма. Изучение метаболизма позволяет установить механизм
действия лекарственных веществ, фармакологическую активность или токсичность
метаболитов, скорость их накопления или выведения из организма и другие явления
биотрансформации.[19]
Фазы метаболизма лекарственных средств
Выделяют две фазы метаболизма лекарственных
средств (рис.1.2).

Рис.1.2. Фазы метаболизма лекарственных средств
В ходе I фазы к молекуле лекарственного средства
присоединяется функциональная группа (либо эта группа становится доступной в
результате химических превращений). Продукты I фазы обычно неактивны, но
некоторые из них обладают столь, же выраженным или более мощным действием, а
изредка даже приобретают новые фармакологические свойства. Иногда лекарственное
средство вводят в виде неактивного предшественника, который в организме быстро
превращается в активный метаболит (как правило, путем гидролиза эфирных или
амидных связей). Это позволяет обеспечить более полную доставку препарата к ткани-мишени.
Продукты I фазы метаболизма выводятся с мочой или взаимодействуют с эндогенными
соединениями, образуя водорастворимые метаболиты. В ходе II фазы образуется
ковалентная связь между функциональной группой лекарственного средства или его
метаболита и эндогенными соединениями (глюкуроновая кислота, сульфат, ацетат,
глутатион, аминокислоты). Продукты II фазы - полярные и, как правило,
неактивные соединения, которые быстро выводятся с мочой или калом. [13,19]
Принято разделять лекарственные вещества на
свойственные организму и чужеродные ему. Свойственные организму вещества, такие
как гормоны, витамины, аминокислоты, сахара, жирные кислоты, нуклеозиды,
полинуклеотиды, метаболизируются специфическими ферментными системами,
обеспечивающими функцию организма.
Большинство синтетических органических и
неорганических соединений, а также природные вещества растительного
происхождения являются чужеродными организму. Их называют также ксенобиотиками.
Они метаболизируются главным образом в микросомах клеток с участием различных
неспецифических ферментов (оксидаз, трансфераз и др.). Ксенобиотики,
растворимые в липидах, медленнее выводятся из организма и медленнее
метаболизируются, а поэтому накапливаются в нем. Металлы (ртуть, мышьяк,
свинец, серебро и др.) образуют с белком прочную ковалентную связь и также
накапливаются в организме. Ксенобиотики, принятые перорально, последовательно
метаболизируются вначале в слизистых оболочках желудочно-кишечного тракта, а
затем в печени, куда поступают после всасывания.
Метаболиты лекарственных веществ могут быть
фармакологически активными, а также совершенно неактивными в фармакологическом
отношении. Более высокая активность метаболитов по сравнению с их
предшественниками, лекарственными веществами, обусловлена такими факторами, как
превращение более полярной молекулы в менее полярную (это приводит к увеличению
ее липофильности и облегчению транспорта через биомембраны), усиление
внутрипеченочной циркуляции, изменение скорости выведения вещества из
организма, перераспределение метаболитов между органами и тканями.
Значительно реже метаболизм приводит к
образованию токсических для организма веществ. Так, например, токсичность
метилового спирта обусловлена происходящим в организме окислением его молекулы
до формальдегида и муравьиной кислоты.
Таким образом, в организме могут происходить как
процессы синтеза, так и разрушения (деградации) молекул ЛВ. При синтезе
образуются более сложные молекулы новых соединений, менее токсичные для
организма и более полярные, что улучшает их растворимость в воде и ускоряет
выведение из организма. Такой процесс носит название конъюгации, а продукты
синтеза - конъюгатов.
Процесс превращения ЛВ в метаболиты происходит
по-разному. Одни практически полностью превращаются в метаболиты, другие -
только на несколько процентов от введенной дозы. Из одного лекарственного
вещества может образоваться несколько метаболитов, иногда десятки.
Образовавшиеся метаболиты либо выводятся из организма, либо подвергаются
дальнейшим превращениям. [3]
В соответствии с современными представлениями
метаболические процессы условно делят на две фазы. В первой фазе в результате
процессов окисления, восстановления или гидролиза изменяется молекула ЛВ с
образованием функциональных групп, имеющих активные атомы водорода (оксигруппы,
карбоксигруппа, первичные и вторичные аминогруппы и др.). Во второй фазе
происходит процесс конъюгации образовавшихся функциональных групп с
высокополярными кислотными остатками глюкуроновой, серной кислот, некоторыми
аминокислотами и др. В результате этого процесса гидрофильность молекул
метаболитов возрастает настолько, что они легко выводятся с мочой. Не все ЛВ
метаболизируются по указанной двухфазной системе. Некоторые из них образуют
конъюгаты, минуя первую фазу, другие после первой фазы выводятся почками без
последующей конъюгации.
На биотрансформацию ЛВ влияют пол, возраст,
условия жизни, характер питания, заболевания и т.д. Кроме влияния различных
заболеваний, возможны также индивидуальная вариабельность кинетики метаболизма,
индукция и угнетение метаболизирующих ферментов. Все это свидетельствует о том,
что биотрансформация ЛВ является чрезвычайно сложным процессом, зависящим от
многих экзогенных и эндогенных факторов. Исследование механизма процессов
метаболизма - проблема, которая входит в круг задач различных областей
химических, биологических, фармацевтических наук, в том числе фармацевтической
химии.[6,19,21]
ГЛАВА II. МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ В
БИОФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕ
В процессе проведения биофармацевтического
анализа необходимо проводить идентификацию и количественное определение
лекарственных веществ и их метаболитов в биологических жидкостях таких, как
моча, слюна, кровь и др. Только применение высокочувствительных и
недеструктивных методов позволяет провести биофармацевтические исследования. К
таким методам в первую очередь относятся физико-химические методы анализа.
Правильный выбор метода определения концентрации
во многом определяет успешное решение всей задачи исследования. Требованиям,
предъявляемым к биофармацевтическому анализу, отвечают только чувствительные
физико-химические методы. Классические химические методы анализа
(гравиметрические и титриметрические) из-за низкой чувствительности для этой
цели непригодны. Существуют различные классификации физико-химических
методов.[14]
По одной из них (Беликов В.Г., 1987) все эти
методы подразделяются на следующие группы:
Оптические методы (рефрактометрия,
интерферометрия, поляриметрия).
Методы, основанные на поглощении излучения
(абсорбционные методы) - ультрафиолетовая спектрофотометрия, фотометрия,
фотоколориметрия, колориметрия, фототурбидиметрия, фотонефелометрия,
инфракрасная спектроскопия, спектроскопия комбинационного рассеяния,
атомно-адсорбционная спектрофотометрия, рентгеновская абсорбционная
спектроскопия.
Методы, основанные на испускании излучения -
люминесцентные методы (флуориметрия, хемилюминометрия), атомно-эмиссионная
спектроскопия, радиохимические (радиоизотопные) методы, рентгеновская
флуоресценция, экстракционно-флуоресцентный анализ.
Методы, основанные на использовании магнитного
поля - ЯМР-спектроскопия (ядерного магнитного резонанса), масс - спектрометрия.
Электрохимические методы - потенциометрия,
полярография, кулонометрия, кондуктометрия.
Термические методы - термография,
термофрактография, калориметрия.
Методы разделения - экстракция,
хроматографические методы, электрофорез.
Процесс выполнения биофармацевтического анализа
включает несколько последовательно выполняемых стадий:
экстракцию из биологической жидкости;
разделение;
идентификацию;
количественное определение лекарственного
вещества или его метаболитов.
ЭКСТРАКЦИЯ - процесс распределения вещества
между двумя несмешивающими жидкими фазами (органический растворитель - вода).
Для проведения экстракции к воде добавляют экстрагент - органический
растворитель, малорастворимый или нерастворимый в воде, и смесь взбалтывают для
ускорения распределения растворенных веществ между двумя жидкостями. Перед
экстракцией необходимо осадить белки (сульфатом аммония, раствором
трихлоруксусной или хлорной кислоты). Надосадочную жидкость декантируют и
экстрагируют из нее испытуемые вещества. При необходимости кровь перед
экстракцией подвергают консервированию гепарином или гемолизации раствороми
сапонинов.
Процессы экстракции анализируемых лекарственных
веществ и их метаболитов из биологических объектов осуществляют с помощью таких
органических растворителей, как диэтиловый эфир, хлороформ, бензол и др.
Нередко сочетают в экстрагенте два растворителя,
например хлороформ и гексан, циклогексан и н-бутанол и др. Такой способ называют
двухфазным экстрагированием.
Наилучшая полнота разделения достигается, если
последовательно извлекают из биологической жидкости лекарственное вещество или
его метаболиты несколькими растворителями, например эфиром, этилацетатом,
хлороформом, ацетоном, водой.
Экстракцию проводят в присутствии кислот,
щелочей или буферных растворов, создавая рН среды, оптимальное для извлечения
лекарственного вещества или его метаболита. Иногда сочетают экстракцию
органическим растворителем с последующей реэкстракцией (растворами едких
щелочей или кислот).[17,19]
Вещества, содержащиеся в полученных экстрактах
(реэкстрактах), определяют с помощью физико-химических методов анализа.
.1 Хроматографические методы анализа
Хроматографией называется процесс разделения
смесей веществ, основанных на количественных различиях компонентов при их
непрерывном перераспределении между контактирующими фазами, одна из которых
неподвижна, а другая имеет постоянное направление движения.
В основу классификации многочисленных
хроматографических методов положены следующие признаки:
агрегатное состояние фаз;
механизм взаимодействия сорбент - сорбат;
способы проведения хроматографического анализа;
аппаратурное оформление (техника выполнения)
процесса хроматографирования;
цель хроматографирования
По агрегатному состоянию фаз хроматографию
разделяют на газовую и жидкостную. Газовая хроматография включает
газожидкостную и газотвердофазную, жидкостная - жидкостно-жидкостную и
жидкостно-твердофазную. Первое слово в названии метода характеризует агрегатное
состояние подвижной фазы, второе - неподвижной.
адсорбционная основана на различии в
адсорбируемости веществ твердым сорбентом
распределительная основана на различной
растворимости разделяемых веществ в неподвижной фазе или на различной
растворимости веществ в подвижной и неподвижной фазах
ионообменная хроматография - на разной
способности веществ к ионному обмену
эксклюзионная хроматография - на различии в размерах
и формах молекул разделяемых веществ;
аффинная хроматография - на специфических
взаимодействиях, характерных для некоторых биологических и биохимических
процессов (например, антитело и антиген, гормон и рецептор и др.)
Существует осадочная хроматография, основанная
на образовании отличающихся по растворимости осадков разделяемых веществ с
сорбентом, адсорбционно-комплексообразовательная, основанная на образовании
координационных соединений разной устойчивости в фазе или на поверхности
сорбента, и др. Следует помнить, что классификация по механизму взаимодействия
весьма условна: ее используют в том случае, если известен доминирующий
механизм.
По технике выполнения выделяют колоночную
хроматографию, когда разделение проводится в специальных колонках, и плоскостную
хроматографию, когда разделение проводится на специальной бумаге (бумажная
хроматография) или в тонком слое сорбента (тонкослойная хроматография).
В колоночной хроматографии используют насадочные
или капиллярные колонки. Насадочную колонку заполняют сорбентом (насадкой), а
внутреннюю стенку капиллярной колонки покрывают пленкой жидкости или пылью
адсорбента.
В зависимости от цели проведения
хроматографического процесса различают:
- аналитическую хроматографию (качественный и
количественный анализ); - препаративную хроматографию (для получения веществ в
чистом виде, для концентрирования и выделения микропримесей);
промышленную (производственную) хроматографию
для автоматического управления процессом (при этом целевой продукт из колонки
поступает в датчик).[4,17]
Классификация по способам проведения анализа
подразделяет хроматографию на три вида:
) фронтальный;
) проявительный;
) вытеснительный
Тонкослойная хроматография (ТСХ) широко
применяется в биофармацевтическом анализе, ввиду высокой разрешающей
способности и чувствительности (рис.2.1).
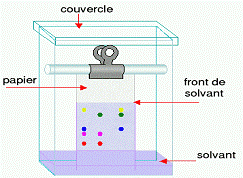
Рис.2.1. Тонкослойная хроматография
Повысить разрешающую способность тонкослойная
хроматография можно, используя метод двумерной хроматографии. Тонкослойная
хроматография отличается простотой выполнения, однако при анализе сложных
смесей, содержащих большое число компонентов, этот метод не всегда позволяет
достигнуть нужного эффекта. Биофармацевтический анализ методом ТСХ чаще всего
сочетают с УФ-спектрофотометрией и флуоресцентным методом
(хроматоспектрофотометрия, хроматофлуоресценция).[4]
Газовая хроматография (ГФ) и широко применяемый
ее вариант - газожидкостная хроматография (ГЖХ) - ввиду высокой
чувствительности, хорошей воспроизводимости и точности стоят на одном из первых
мест среди физико-химических методов, используемых для анализа лекарственных
веществ и их метаболитов в биологических жидкостях. Главным прибором для этого
метода исследований является газовый хроматограф (рис.2.2.).
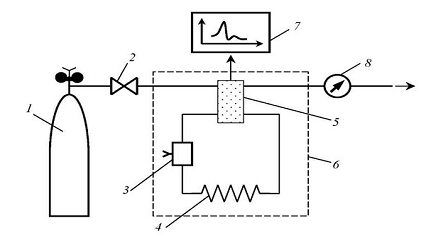
Рис.2.2. Принципиальная схема газового
хроматографа:
- система подготовки газов; 2 - система
дозирования;
- устройство для ввода пробы; 4 -
хроматографическая колонка; 5 - система детектирования; 6 - блок питания
детектора; 7 -регистратор; 8 - измеритель скорости потока газа-носителя
Газовая хроматография позволяет определить
микрограммовые и нанограммовые количества этих веществ. Непосредственное
введение биологической жидкости в хроматографическую колонку, как правило, не
дает положительных результатов. До выполнения анализа методом газовой
хроматографии необходимо осуществлять многократную экстракцию (чаще эфиром,
хлороформом или этилацетатом) лекарственного вещества или его метаболитов.[5]
Высокоэффективная или высокоскоростная
жидкостная хроматография (ВЭЖХ) отличается от газовой хроматографии тем, что
позволяет испытывать соединения, обладающие термической неустойчивостью и
молекулярной массой более 400. Для этих соединений исключается фаза перевода в
летучие производные. Для идентификации лекарственного препарата исследуются в
первую очередь экстракты из мочи и желчи, поскольку, как правило, в этих
объектах лекарственные препараты присутствуют в высоких концентрациях. Для
количественного определения исследуем экстракты из крови, поскольку только для
крови имеются данные по терапевтическим, токсическим и летальным дозам.
Жидкость-жидкостная экстракция в делительных воронках, применяемая в настоящее
время, имеет ряд недостатков: необходим большой объем биожидкости (до 100 мл),
большой расход реактивов, многостадийность, длительность (кровь при подкислении
и подщелачивании образует с экстрагентами стойкую суспензию), неточность.
Поскольку для исследования методом ВЭЖХ необходимо всего 5-10 мкл пробы, нами
исследована возможность проведения однократной экстракции лекарственных
препаратов из одной пробы крови (мочи и желчи) объемом 0,6 мл в пробирках
«Эппендорф». Предлагаемый метод имеет ряд преимуществ: значительно снижает
трудоемкость анализа, снижает стоимость анализа за счет уменьшения объемов используемых
реактивов, сокращает случайные и систематические ошибки в процессе подготовки
проб, избирателен и чувствителен. По сравнению с тонкослойной хроматографией
метод ВЭЖХ требует меньших затрат времени на выполнение анализа. Это обусловило
широкое внедрение метода в практику биофармацевтического анализа.[14,16]
.2 Фотометрические методы анализа
Наиболее часто в биофармацевтическом анализе
используют фотометрические методы анализа. Фотометрические методы анализа
основаны на избирательном поглощении электромагнитного излучения анализируемым
веществом и служат для исследования строения, идентификации и количественного
анализа светопоглощающих соединений.

В зависимости от используемой аппаратуры в
фотометрическом анализе различают спектрофотометрические методы - анализ по
поглощению веществами монохроматического излучения (спектрофотометрия, в УФ-,
видимой и ИК-областях спектра); фотоколориметрические - анализ по поглощению
веществами немонохроматического излучения (фотоколориметрия, экстракционная
фотоколориметрия).
Сравнительно редко в биофармацевтическом анализе
используют фотоколориметрию. Этот метод применяют главным образом тогда, когда
нужно определить большие концентрации лекарственного вещества или сумму лекарственного
вещества и метаболитов, содержащихся в биологической жидкости. Недостаток
использования фотоколориметрических методик заключается в сравнительно
невысокой их точности.
Весьма перспективен более чувствительный
экстракционно-фотометрический метод, основанный на экстракции лекарственного
вещества из биологической жидкости с последующим взаимодействием с кислотными
или основными красителями (бромтимоловым синим, метиловым оранжевым,
бромкрезоловым зеленым и др.). Образующиеся окрашенные продукты (ионные
ассоциаты) нередко специфичны для лекарственного вещества и количественно
экстрагируются органическим растворителем (хлороформом, бензолом,
дихлорэтаном).
Наиболее часто в биофармацевтическом анализе
используют спектрофотометрию в УФ- и видимой областях спектра. Этот метод
отличается простотой выполнения и достаточной точностью, не требует большого
количества операций при подготовке к анализу испытуемого образца. [6,17]
Сравнительно невысокая чувствительность
спектрофотометрических методик (от 1 мкг/мл до 1 мг/мл) ограничивает применение
данного метода для тех групп лекарственных веществ, суточная доза которых
составляет около 1 г.
Масс-спектроскопия - метод, позволяющий
определить массу ионов, ионизированных молекул или фрагментов молекул по
отклонению в магнитных и электрических полях или по кинетической энергии.
Следовательно, первое, что надо сделать для того, чтобы получить масс-спектр,
превратить нейтральные молекулы и атомы, составляющие любое органическое или
неорганическое вещество, в заряженные частицы - ионы, этот процесс называется
ионизацией. На разработку способов ионизации органических соединений были
затрачены значительные усилия, однако из всего их многообразия только два
реально обеспечили возможность анализа жидкостей и используются в современных
масс-спектрометрических комплексах:
образование ионов при распылении раствора
анализируемого соединения в электрическом поле (электроспрей) (рис.2.3);
десорбция ионов из органической матрицы лазерным
излучением (МАЛДИ)

Рис.2.3. Схема ионизации способом электроспрей:
МС - масс-спектрометрический; М - анализируемая
молекула; Н+- протон
Естественно, приборы, которые используются в
этом методе, называются масс-спектрометры или масс-спектрометрические детекторы
(рис.2.4).
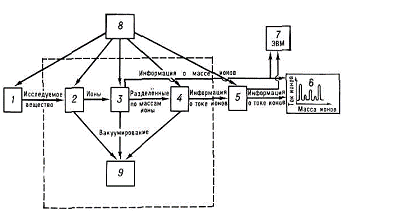
Рис.2.4. Схема масс-спектрометра
- система подготовки и введения исследуемого
вещества; 2 - ионный источник; 3 - масс-анализатор; 4 - приемник ионов; 5 -
усилитель; 6 - регистрирующее устройство; 7 - ЭВМ; 8 - система электрического
питания; 9 - откачные устройства.
Метод отличается очень высокой разрешающей
способностью, в десятки раз превышающей другие методы. Это позволяет проводить,
например, анализ примесей при их относительном содержании менее 10-9,
определять элементный и изотопный состав пробы с большой точностью. Известны
также различные варианты масс-спектрометрии. [22]
Особенно хорошие результаты в
биофармацевтическом анализе были достигнуты при комбинированном применении
газожидкостного хроматографа и масс-спектрометра в одном приборе
(хромато-масс-спектрометрия). На основе такого сочетания был создан
принципиально новый метод анализа трудноразделяемых смесей -
масс-фрагментография. Суть метода заключается в том, что масс-спектрометр
используется как высокочувствительный детектор к газовому хроматографу.
Основное достоинство масс-фрагментографии - чрезвычайно большая
чувствительность, достигающая нескольких пикограммов (1 пг = 10-12г). Это в
1000-10000 раз выше, чем у ГЖХ. Высокая специфичность позволяет анализировать
неразделенные компоненты этих смесей, а высокая чувствительность дает
возможность определять метаболиты лекарственных веществ, применяемых в очень
малых терапевтических дозах. [7,22]
.3 Методы, основанные на использовании
магнитного поля
Спектроскопия ядерного магнитного резонанса
(ЯМР) - метод, основанный на регистрации индуцированных радиочастотным полем
переходов между ядерными магнитными энергетическими уровнями молекул вещества,
помещенного в магнитное поле. Метод позволяет изучать магнитные переходы ядер
со спиновыми квантовыми числами больше нуля (ядра 'Н, 13С, 19Р, 31Р).
Совокупность сигналов переходов между энергетическими уровнями ядер молекул
составляет спектр ЯМР. Каждый спектр ЯМР регистрируется для одного типа ядер и
специфичен для каждого вещества. Чаще всего используют спектроскопию на
протонах (ПМР) и ЯМР. Спектры регистрируют при помощи ЯМР-спектрометров
(рис.2.5).
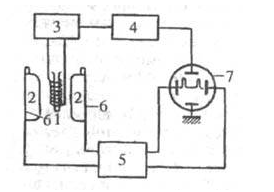
Рис.2.5. Схема спектрометра ЯМР:
- катушка с образцом; 2 - полюса магнита; 3 -генератор
радиочастотного поля; 4 -усилитель и детектор; 5 - генератор модулирующего
напряжения; 6 - катушки модуляции поля В0; 7 - осциллограф.
Спектр представляет собой совокупность пиков с
различной шириной, площадью и интенсивностью сигналов. По характеру протонных
сигналов можно сделать заключение о наличии в молекуле тех или иных групп
атомов. Величина химического сдвига имеет порядок 10~6 или млн~! (миллионная
доля). Метод ЯМР-спектроскопии используют для объективной идентификации
органических лекарственных веществ и для количественного определения
относительного содержания вещества или примеси. Подлинность может быть
подтверждена либо путем сравнения со стандартным образцом, либо по наиболее
характерным сигналам спектра, либо по полному набору спектральных параметров.
[24,23]
.4 Люминисцентные методы анализа. Флуориметрия
Люминесценция, как явление известно, давно, но
её практическое применение началось только в конце 19 века, когда были
сформулированы основные понятия и разработаны некоторые её теоретические
положения. Под люминесценцией понимают свечение вещества, которое возникает
после поглощения им энергии возбуждения. Существует несколько способов
классификации люминесценции:
По способу возбуждения различают следующие виды
люминесценции:
фотолюминесценция - возбуждение электромагнитным
излучением оптических частот;
хемилюминесценция - возбуждение за счет энергии
химических реакций;
радиолюминесценция - возбуждение под действием
различных видов радиоактивного излучения;
рентгенолюминесценция - возбуждение за счет
энергии рентгеновских лучей;
сонолюминесценция - возбуждение при воздействии
интенсивных звуковых волн на жидкость;
триболюминесценция - возбуждение за счет
превращения механической энергии в световую.
При комнатной температуре большинство молекул
вещества находятся на самом низком колебательном уровне основного электронного
состояния (т.е. в нормальном невозбужденном состоянии). Для большинства
соединений это состояние является синглетным. Поглощение молекулой световой
энергии приводит к переходу электронов на колебательные уровни одного из
возбужденных состояний. Это состояние неустойчиво, система стремится отдать
избыток энергии, при этом электроны молекулы переходят с высшего колебательного
уровня синглетного возбужденного состояния на более низкий энергетический
уровень синглетного состояния или в триплетное возбужденное состояние, эти
переходы будут происходить без излучения энергии (процессы внутренней или
интеркомбинационной конверсии). Люминесценцию характеризуют спектрами поглощения
и люминесценции, энергетическим выходом, квантовым выходом. Знание величины
выхода люминесценции и влияния различных факторов на эту величину имеет очень
большое значение для люминесцентного анализа. Чем больше выход люминесценции
для какого-то определенного вещества, тем чувствительнее аналитическая реакция,
основанная на излучении этого вещества.[2]
Спектры поглощения и люминесценции у многих
веществ тесно связаны между собой и подчиняются ряду важных закономерностей или
правил. Согласно правилу Стокса - Ломмеля спектр излучения в целом и его
максимум по сравнению со спектром поглощения и его максимумом всегда сдвинут в
сторону длинных волн. Это можно объяснить тем, что в результате различных
безызлучательных процессов возбуждённая молекула теряет часть поглощённой
энергии - поэтому энергия флуоресценции оказывается меньше поглощённой, с
максимум сдвинутым в сторону длинных волн (рис.2.6).
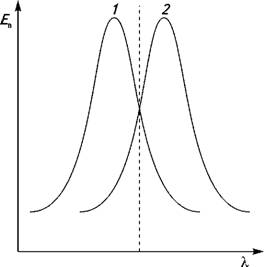
Рис.2.6.Зеркальная симметрия спектров
флуоресцирующих веществ: 1 - спектр поглощения; 2 - спектр излучения
флуоресцирующего вещества
Установлено зеркальное подобие спектров
поглощения и излучения для обширного ряда веществ - правило Левшина. Его можно
сформулировать следующим образом: спектры поглощения и излучения, изображенные
в функции, оказываются зеркально-симметричными относительно прямой, проходящей
перпендикулярно к оси частот через точку пересечения обоих спектров. Спектры
поглощения и флуоресценции пересекаются в точке, которая соответствует
возбуждению электрона и излучению кванта без потерь на безызлучательные
переходы. Во многих случаях спектральные характеристики флуоресценции
органических веществ позволяют идентифицировать эти соединения по их спектрам.
В простейшем случае качественное определение веществ может быть проведено по
цвету флуоресцентного излучения.
В свою очередь количественный люминесцентный
анализ основан на зависимости интенсивности флуоресценции растворов от
концентрации. Количественный флуоресцентный анализ необходимо проводить при
невысоких температурах и определенных значениях рН.
На интенсивность флуоресценции существенным
образом влияет:
природа вещества;
температура (в большинстве случаев с повышением
температуры выход и интенсивность флуоресценции уменьшаются, то есть происходит
температурное гашение флуоресценции);
Особый интерес для аналитической химии имеет
метод объемного титрования с использованием люминесцентных индикаторов. Сочетание
люминесцентного и хроматографического методов используется в люминесцентной
хроматографии.
При анализе растворов, содержащих мешающие
определению примеси, исследуемое вещество экстрагируют органическим
растворителем. Этот способ используют и в том случае, когда в результате
фотометрической реакции получают малорастворимые в воде, но хорошо растворимые
в органических растворителях комплексные соединения. Исследуемое вещество,
способное к флуоресценции, выделяют экстракцией и определяют обычным способом.
Этот метод анализа называется экстракционно-люмжесцентным. Использование
комбинированных методов флуориметрии и концентрирования позволяет существенным
образом повысить чувствительность анализа.[2,6]

Флуориметрия - метод фотометрического анализа,
основанный на измерении интенсивности флюоресценции испытуемых веществ.
Принцип метода флуориметрии заключается в
пропорциональности между интенсивностью фотолюминесценции анализируемого
образца и количеством определяемого вещества.
Флуориметрия находит применение в таких направлениях, как:
Идентификация. Характер спектра флуоресценции, а
также цвет излучаемого света специфичны для любого флуоресцирующего вещества.
Количественный анализ. При количественных
определениях интенсивность флуоресценции испытуемого образца сравнивают с
интенсивностью флуоресценции стандартного образца вещества с известной
концентрацией, измеренной в идентичных условиях на одном и том же приборе.
Методика. Согласно фармакопейной статье
испытуемый образец растворяют в растворителе или в смеси растворителей.
Переносят раствор в кювету флуориметра и освещают лучом возбуждающего света с
указанной в методике длиной волны.
Интенсивность флюоресценции в разбавленных
растворах определяется следующим уравнением:
F = I0 ×2,3 ×e
×
c ×
b ×
j,
где F - общая интенсивность флюоресценции,
квант/c;- интенсивность возбуждающего света, квант/c;
e - молярный коэффициент поглощения;-
концентрация раствора моль/л;- толщина флюоресцирующего слоя, см;
j - квантовый выход флюоресценции, зависящий от
природы вещества.
Чувствительность флуоретического анализа около
0,01 мкг/мл. По сравнению с УФ-спектрофотометрией она выше в 10-100 раз.
Поэтому с помощью флуориметрических методик можно подвергать
биофармацевтическому анализу лекарственные вещества, суточные дозы которых
составляют несколько миллиграммов. Особенно высокой чувствительностью
отличаются спектрофлуориметрические определения. Недостатком метода является
необходимость тщательной очистки испытуемых веществ многократным повторением
процессов экстракции или разделения. Это вызвано тем, что в биологических
жидкостях организма нередко содержатся вещества, обладающие флуоресценцией.
Флуоресцировать могут и метаболиты лекарственного вещества. [2,6,16]
ЗАКЛЮЧЕНИЕ
Биофармацевтический анализ играет важную роль в
оценке эффективности, обеспечении безопасности и индивидуальной переносимости
организмом человека лекарственных веществ (ЛВ). При этом современные методы
анализа ЛВ в биологических объектах представляют собой в своей совокупности
своеобразный инструмент для проведения биофармацевтических исследований на
различных этапах создания и клинического применения лекарственных средств. Они
включают определение фармако - и токсикокинетических параметров ЛВ, оценку и
контроль состояния метаболических систем организма и целенаправленную регуляцию
их ферментативной активности для достижения оптимального фармакологического
эффекта. Все выше сказанное обуславливает необходимость разработки более
совершенных методов биофармацевтического анализа для установления
фармакокинетических параметров тест-препаратов процессов метаболизма в
биологических жидкостях. Последнее служит основой индивидуализации дозирования
ЛВ, учета биохимических фенотипов при терапии различных патологических состояний
и проведения мониторинга лекарственных препаратов. При этом сложный
многокомпонентный состав биологических жидкостей особенно при низких
содержаниях анализируемых веществ требует использования избирательных и
чувствительных методов определения ЛВ. В то же время не менее значимым является
требование высокой производительности, надежности и возможности получения
большого объема аналитической информации при проведении биофармацевтического
анализа в клинических условиях. Таким требованиям удовлетворяют хроматографические
и оптические методы, которые все более интенсивно используются в контроле
генетически детерминированных биохимических процессов метаболизма ЛВ в
организме человека. Биофармацевтические и фармакокинетические исследования
позволяют решить ряд практических задач, например, дать рекомендации по
изменению физических или химических свойств лекарственных веществ для повышения
их фармакологической активности; обосновать оптимальный выбор
биофармацевтических факторов при производстве тех или иных лекарственных форм.
Практическое значение имеют и такие рекомендации, как уточнение показаний и
противопоказаний, установление рациональных терапевтических доз и периодичности
их приема в течение суток, определение оптимальных путей введения лекарственных
средств в организм, разработка научно обоснованных схем лечения тех или иных
заболеваний.
СПИСОК ЛИТЕРАТУРЫ
.
Антонова М.И., Прокопов А.А., Ахапкина В.И. Количественный анализ фенотропила в
биологических объектах методом газожидкостной хроматографии // Химико.-фарм.
журн. - 2003.- Т. 37, № 10. - С. 46-47.
.
Беликов В.Г. Фармацевтическая химия. Учебное пособие для фарм. факультетов и
фак. мед. ин-тов. - М.: МЕДпресс-информ, 2008. - 624 с.
.
Буркин А.А. Имуноферментный анализ веществ и их метаболитов. Сообщение 2.
Лизиноприл и эналаприл // Химико-фарм. журн. - 2004. - Т. 38, № 6. - С. 54-56.
.
Буланова А.В., Полюкова Ю.Л. «Хроматография в биологии и медицине»: учебное
пособие, 2-е изд.- Самара: Издательство «Самарский университет», 2006.-116 с.
.
Винарский В.А. Хроматография: Курс лекций: В 2 ч. Ч. 1. Газовая хроматография.
- Минск: БГУ, 2002. - 192с
.
Григорьев О.А. «Введение в биофармацевтический анализ».-Курск: КГМУ,2002.-132
с.
.
Евгеньев М. И., Гармонов С. Ю. Спектрофотометрическое определение фосфабензида
в биологических жидкостях // Химико-фарм. журн. - 2005. - Т. 29, № 8. - С.
59-61.
.
Иванов А.В., Родионова Г.М., Байкова В.Н., Арзамасцев А.П. «Сравнительная
оценка методов количественного определения концентрации метотрексата в
биологических жидкостях» Вопросы биологической медицины и фарм. химии. - 2004.-
№ 3. - С. 49-52.
.
Каркищенко Н.Н., Хоронько В.В., Сергеева С.А., «Фармакокинетика».- Ростов на
Дону: издательство Феникс, 2001.-383 с.
.
Киселёва Г.С. «Биоэквивалентность и качество лекарственных средств»
Издательство «Основа», 1998.-448 с.
.
Краснов Е.А., Кадырова Т.В. Стандартизация лекарственных средств: Учебное
пособие. - Томск, 2005. - 125 с.
.
Кондратенко С.Н. «Фармакокинетика и относительная биодоступность ранитидина»
Химико-фарм. журн. - 2003. - Т. 37, № 6. - С. 14-15.
.
Кокорина Н.О. «Скрининг лекарственных препаратов в крови методом
высокоэффективной жидкостной хроматографии», Москва - Тюмень, 2005. С. 146-147.
.
Крупина Н.А., Краснова Р.Р., Пашовкина Р.Н. «Химико-токсикологический анализ
лекарственных веществ в крови (плазме, сыворотке) методом высокоэффективной
жидкостной хроматографии», Москва - Тюмень, 2005. С. 173-175.
.
Лакин К.М., Крылов Ю.Ф. «Биотрансформация лекарственных веществ». - М.:
Медицина, 2001. - 342 с.
.
Мирошниченко И.И., Юрченко Н.И. Определение омепразола и лансопразола в плазме
крови методом ВЭЖХ // Химико-фарм. журн. - 2002. - Т. 36, № 7. - С. 48-49.
.
Мельникова Н.Б., Пожидаев В.М. и др. Введение в хроматографический анализ:
методические разработки для студентов V курса фармацевтического факультета. -
Нижний Новгород: НижГМА, 2005. - 32 с.
.
Перцев И.М., Зупанец И.А. Шевченко Л.Д. и др. «Фармацевтические и
медико-биологические аспекты лекарств» -Т.1, издательство УкрФа,1999.-464с.
.
Раменская В.Г. ВЭЖХ-анализ верапамила и его метаболитов в плазме крови //
Фармация. - 2003. - Т. 37, № 2. - С. 3-8.
.
Соколова Л.И., Черняев А.П. Определение антибиотиков цефалоспоринового ряда в
биологических объектах методом обращённо-фазовой ВЭЖХ // Химико-фарм. журн. -
2002. - Т. 36, № 6.- С. 39-45.
.
Тихонов А.И, Ярных Т.Г., Зупанец И.А.; Под ред. Тихонова А.И.
«Биотрансформация»: Учебник для студ. фармацевтических вузов и факультетов.
Издательство НФаУ;
Харьков,
2003.-240с.
.
Maurer H.H. Liquid chromatography-mass spectrometry in forensic and clinical
toxicology // J.сhromatography
B. Biomed. Sci. Appl. - 2005.- V. 713, № 1. - Р. 3-25.
23.
Масс-спектроскопия в биофармацевтическом анализе. Режим доступа:
<http://www.xumuk.ru/encyklopedia/2448.html> (посещение 21.05.2014)
.
Спектроскопия ядерного магнитного резонанса. Режим доступа:
<http://www.xumuk.ru/encyklopedia/2/5462.html> (посещение 19.05.2014)
.
Основные положения биологической доступности лекарств. Режим
доступа:<http://tought.ucoz.ru/news/osnovnye_polozhenija_biologicheskoj_dostupnosti_le/2013-06-20-28>
(посещение 25.05.2014)