Исследование кинетики реакции алкилирования изобутана изобутиленом до изооктана методом математического моделирования
Министерство
культуры российской федерации
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«САНКТ-ПЕТЕРБУРГСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
КИНО
И ТЕЛЕВИДЕНИЯ»
Кафедра
технологии полимеров и композитов
Курсовая
работа
по
дисциплине:
«Моделирование
химико - технологических процессов»
на
тему:
«Исследование
кинетики реакции алкилирования изобутана изобутиленом до изооктана методом
математического моделирования»
Выполнил:
Седова Ирина
студент 133 гр.
Проверил: Жданова
А.В. ,
Санкт-Петербург
г
Оглавление
Введение
Глава
1. Описание объекта моделирования
1.1 Общие
сведения об изооктане
1.2 Физиxеcкие свойства
1.3
Химические свойства
Глава
2. Описание технологического процесса производства изооктана
2.1 Основные
промышленные способы производства изооктана
2.2
Применение изооктана
2.3
Технологическая схема и краткое описание процесса производства
2.3.1
Требования к серной кислоте, используемой в качестве катализатора
2.3.2
Аппараты пригодные для процесса
2.3.3
Технологическая схема
2.3.4 Принцип
работы установки для алкилирования изобутана изобутиленом
Глава
3.Описание математической модели производства
3.1
Изучение кинетики реакции
3.2 Математическая
модель
3.3 Расчет
параметров
Заключение
Список
используемой литературы
Введение
алкилирование изобутан катализатор
Данная
курсовая работа посвящена изучению кинетики реакции алкилирования изобутана
изобутиленом до изооктана методом математического моделирования. Так как под
математическим моделированием понимают изучение свойств объекта на
математической модели. Математическая модель - это приближенное описание
какого-либо процесса, выраженное с помощью математической символики. То целью
математического моделирования является определение оптимальных условий
протекания реакции, управление данной реакцией на основе математической модели
и перенос результатов на объект, то есть в реальное производство. И от того
насколько правильно построена математическая модель и определены оптимальные
условия протекания процесса, будет зависеть эффективное функционирование
системы управления и регулирование процессом при наличии возмущений.
Целью
данной курсовой работы является изучение кинетики химической реакции. Изучением
закономерностей протекания химических реакция или химических превращений во
времени, зависимостью этих закономерностей от внешних условий, а так же
механизмами химических реакций, занимается химическая кинетика.
В
процессе исследования кинетики реакции, важно изучить скорость химической
реакции. Скорость химической реакции - это количество вещества, вступившего в
реакцию или образующегося в ходе реакции за единицу времени в единице объема
системы. Количество вещества выражают в молях, а объем в литрах. В этом случае
мы получаем удобную для работы величину - концентрацию вещества в моль/л,
которая изменяется в ходе реакции. Таким образом, скоростью реакции называют
изменение концентрации какого-нибудь вещества, участвующего в реакции, за
единицу времени (например, за секунду или за минуту).
За
скоростью реакции можно следить по расходованию одного из реагентов, либо по
накоплению продукта. Но тогда можно столкнуться с серьезной проблемой: скорость
реакции может постоянно меняться. Действительно, в начале реакции, когда
молекул реагирующих веществ еще много, столкновения между ними происходят
гораздо чаще, чем в конце реакции, когда молекул исходных веществ уже намного
меньше. А столкновения молекул в реакционной смеси являются поводом для реакции
между ними.
Следовательно,
для увеличения скорости химической реакции, необходимо либо увеличивать
концентрацию исходных компонентов, либо повышать температуру процесса, так же
для ускорения движения и сталкивания молекул, можно добавлять катализаторы в
реакционную смесь.
В
данной курсовой работе объектом исследования является реакции алкилирования
изобутана изобутиленом до изооктана, а точнее изучение кинетики этой реакции.
Тогда предметом исследования является сам изооктан, который широко применяется
в различных сферах жизни, начиная от бытовых и заканчивая производственными.
Глава
1. Описание объекта моделирования
.1
Общие сведения об изооктане
В
процессе исследования кинетики реакции получения изооктана, за основу берется
реакция алкилирования изобутана изобутиленом. Так как получение изооктанов
данным способом, является самым распространенным и удобным.
Н3С-С(СН3)=СН2
+ Н3С-СН(СН3)-СН3 → Н3С-СН(СН3)-СН2-С(СН3)2СН3 + Q
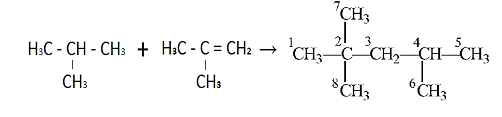
Рисунок
1 Реакция получения изооктана.
При
прохождении данной реакции конечным продуктом является изооктан, по
систематической номенклатуре он называется 2,2,4-триметилпентан,
СН3С(СН3)2СН2СН(СН3)СН3, структурная формула которого представляет вид:
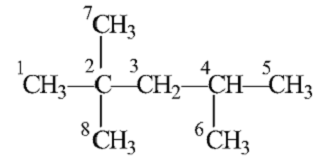
Рисунок
2 Структурная формула изооктана.
Изооктан
- один из 9 изомеров октана. Октан относится к предельным (метановым)
углеводородам (алканы, парафины). В переводе с латыни
«
parum » - означает « мало », а « affinus » - « имеющий сродство ». Название
указывает на химическую инертность метановых углеводородов.
Предельными
насыщенными углеводородами называют такие соединения углерода с водородом, в
молекулах которых каждый атом углерода затрачивает на соединение с любым
соседним углеродным атомом не более одной валентности, причем все свободные (не
затраченные на соседние с углеродными атомами), его валентности насыщены
водородом. Все атомы углерода находятся в sp3 - гибридном состоянии.
Изооктан
имеет форму многоугольников, цепи закрыты и не свободны. Благодаря такой форме
он мало поддается детонации. Детонация - это режим горения, в котором по
веществу распространяется ударная волна, инициирующая химические реакции
горения , в свою очередь поддерживающие движение ударной волны за счёт
выделяющегося в экзотермических реакциях тепла. Комплекс, состоящий из ударной
волны <#"821522.files/image003.gif">
Рисунок 3 Протонирование
изобутилена.
Триметилкарбониевый ион на второй
стадии реакции при-
соединяется к изобутилену с
образованием димерного катиона.
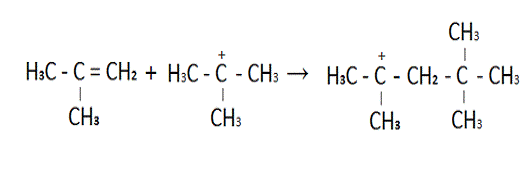
Рисунок 4 Образованием димерного
катиона.
Димерный катион реагирует с
изобутаном, в результате чего получаются изооктан.
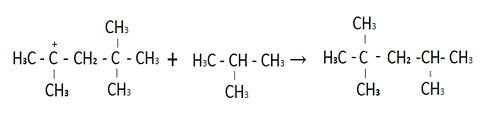
Рисунок 5 Получение изооктана.
И промежуточный ион (CH3)3C + [3]
Алкилирование парафинов олефинами
является равновесным экзотермическим процессом, обратным крекингу
углеводородов.
Механизм реакции осложнен процессами
изомеризации, вследствие чего происходит быстрый обмен гидридиона с
изопарафином причем образующийся трет-бутилкатион взаимодействует далее с
исходным олефином.
Получившийся ион карбония склонен к
внутримолекулярным перегруппировкам, сопровождающимся миграцией водорода и
метильных групп.
Эти ионы карбония взаимодействуют с
изобутаном, в результате чего получаются углеводороды С8Н18 и трет-бутилкатион
обеспечивающий протекание ионно-цепного процесса.
Очевидно, что промежуточно образующиеся
изооктилкатионы также способны к реакции с олефинами:
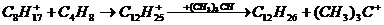 [3]
[3]
Но так как это каталитическая
реакция, либо если реакция прожодит без катализатора, то является
высокотемпературным процессом, то есть нагревание идет до 5000С - 5700С. Все
побочные реакции проходят мгновенно. И в исследовании кинетики не учитываются,
так как даже сама вероятность их протекания ничтожно мала. А в том случае если
они проходят, то никак не влияют на чистоту выхода и сам выход продукта.
Так происходят
последовательно-параллельные реакции алкилирования.
В получаемых алкилатах обнаружены
низшие и высшие парафины с числом углеродных атомов, не кратным исходным
реагентам. При алкилировании изобутана бутиленами алкилат содержит 6-10% углеводородов
С5 - С7 и 5-10% углеводородов С9 и высших. С учетом этого можно сделать вывод,
что они могут появиться только в результате деструктивных процессов(процессов,
протекающих с разрывом химической связей в макромолекулах
<#"821522.files/image007.gif">
Рисунок 6 Технологическая схема
алкилирования изобутана изобутиленом.
- компрессор; 2 - емкость; 3 -
конденсатор; 4 - реактор (алкилатор);
- дроссельные вентили; 6 - депропанизатор;
7, 9 - сепараторы;
8 - нейтрализатор; 10 - дебутанизатор; 11 - теплообменники.
.3.4 Принцип работы установки для
алкилирования изобутана изобутиленом
В алкилатор 4 (в первую секцию
слева) поступают жидкий изобутан, оборотная и свежая серная кислота; в каждую
секцию подают жидкий изобутилен. За счет выделяющегося тепла часть избыточного
изобутана испаряется; его пары попадают в емкость 2, служащую одновременно
ресивером и сепаратором. Газ из этой емкости непрерывна забирается компрессором
1, сжимается до 0,6 МПа и при этом давлении конденсируется в водяном
холодильнике 3. В дроссельном вентиле 5 снижают давление до рабочего (около 0,2
МПа), причем часть изобутана при дросселировании испаряется и разделяется в
емкости 2. Оттуда жидкий изобутан снова направляется в алкилатор, завершая
холодильный цикл. При непрерывной работе установки в изобутане накапливается
пропан, образующийся в результате деструкции углеводородов и присутствующий в
небольшом количестве в исходных углеводородных фракциях. Поэтому в изобутановый
холодильный цикл включен депропанизатор - ректификационная колонна 6. В нее
отводят часть циркулирующего изобутана после холодильника 3, а изобутан,
очищенный от пропана, возвращают после дросселирования в емкость 2.
Смесь, выходящая из последней секции
алкилатора 4, содержит избыточный изобутан, октаны, изобутилен и другие
углеводороды С5 - С7 и высшие. Ее подают в сепаратор 7 для отделения остатков
серной кислоты. Кислоту возвращают в алкилатор, но часть ее отводят из системы
и вместо нее подают свежую. Углеводородный слой из сепаратора 7 нейтрализуют
10%-ным раствором щелочи в аппарате 8 и разделяют полученную эмульсию в
сепараторе 9. Нейтрализованная смесь углеводородов направляется на отгонку
избыточного изобутана в ректификационную колонну 10. Чтобы для конденсации
изобутана можно было использовать дешевый хладоагент - воду, в колонне
поддерживают давление около 0,6 МПа. В нее же подают свежую изобутановую
фракцию. Часть изобутана возвращается на орошение колонны 10, а остальное количество
после дросселирования поступает в емкость 2 и оттуда снова на реакцию. Таким
образом совершается циркуляция изобутана. Из куба колонны 10 отбирают товарный
алкилат[1,4].
Глава 3.Описание математической
модели производства
.1 Изучение кинетики реакции
Кинетика реакции - это, раздел химии
изучающий скорость химической реакции и её зависимость от различных факторов.
Если реакция протекает в однородной
среде, а в реакции алкилирование изобутана изобутиленом до изооктана процесс
происходит в растворе, следовательно, взаимодействие реагентов происходит во
всем объеме. То такие реакции называются гомогенными. Скорость такой реакции
определяется как отношение изменения концентрации одного из реагирующих веществ
или продуктов реакции ∆С к интервалу времени ∆τ, за которое
это изменение происходит. Определяемая таким образом скорость, является
средней.
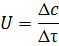
Концентрация, то есть количество
вещества в единице объема, выражается как число молей вещества, содержащихся в
1 литре раствора. Либо как молей вещества, содержащихся в 1 килограмме
раствора. Тогда учитывая, что время выражается в секундах, то размерность
скорости химической реакции [моль/литр •секунду]. Чем меньше изменение
концентрации и промежутка времени, тем сильнее средняя скорость будет
приближенна к истинной, мгновенной скорости химической реакции в данный момент
времени. Скорость реакции можно определять по изменению концентрации одного из
реагирующих веществ (в этом случае перед выражением ставится знак минус), либо
по изменению концентрации одного из продуктов реакции (тогда перед выражением
скорости ставится знак плюс).
На скорость химической реакции
влияют следующие факторы:
Природа реагирующих веществ.
Концентрация реагентов
Чтобы произошла химическая реакция,
частицы реагирующих веществ в гомогенной системе должны столкнуться. Число
столкновений пропорционально числу частиц в объеме реактора, то есть их
молярным концентрациям. Так же зная из основной зависимости химической
кинетика, а именно из Закона действующих масс. Который гласит, что скорость
элементарной химической реакции пропорциональна произведению молярных
концентраций реагентов, взятых в степени, равной их стехиометрическим
коэффициентам в уравнении реакции.
В общем виде:
+ bB → dD
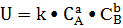
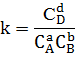
либо
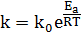
где k - коэффициент
пропорциональности, называемый константой скорости химической реакции (зависит
от температуры, природы реагирующих веществ, но не зависит от концентрации
раствора); 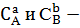 концентрации
веществ в степенях равных их стехиометрическим коэффициентам, по уравнению
реакции.
концентрации
веществ в степенях равных их стехиометрическим коэффициентам, по уравнению
реакции.
Температура
Увеличение скорости реакции с
повышением температуры объясняется тем, что для химической реакции необходимо
соударение активных молекул, то есть тех молекул, которые обладают энергией
достаточной для того, что бы преодолеть силы отталкивания отрицательно
заряженных электронных оболочек взаимодействующих молекул.
Шведский ученый С. Аррениус на
основании экспериментальных данных показал, что число активных частиц, а
следовательно скорость и константа скорости возрастает с температурой по
экспоненциальному закону. Он утверждал, что столкновения молекул будут
эффективны (то есть будут приводить к реакции) только в том случае, если
столкновение молекул обладает определенным запасом энергии активации. Энергия
активации - это минимальная энергия, которой должны обладать молекулы, что бы
их столкновение приводило к химическому взаимодействию. Выведенная им
зависимость константы скорости от температуры называется уравнением Аррениуса
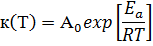
Где А0 - предэкспоненциальный
множитель (отвечает общему числу соударений реагирующих веществ в единице
объема за единицу времени); Еа - энергия активации (то есть та энергия которой
должны обладать соударяющиеся молекулы, что бы реакция произошла); R -
универсальная газовая постоянная; Т - абсолютная температура.
Еа и А0 - определяются природой
реакции и практически не зависят от температуры.
Катализаторы
Для ускорения медленно протекающих
химических реакций добавляют вещества - катализаторы, способные понижать
энергию активации молекул, ослабляя связи между атомами. При этом молекулы
становятся реакционно - способными при более низкой температуре, энергии для
разрыва связи требуется меньше. Следовательно, изменение скорости реакции путем
добавления катализаторов называется - катализом, а реакции, протекающие в
процессе катализа - каталитическими. При гомогенном катализе и катализатор и
реагирующие вещества находятся в одной фазе, и катализатор ускоряет реакцию
путем образования промежуточных веществ с каким либо из исходных компонентов. В
данной работе возможны два варианта протекания процесса, либо при высоких
температурах и без катализатора, либо при нормальной температуре, но в
присутствии катализатора. Но в обоих случаях побочные реакции протекают
настолько быстро, что при составлении модели и исследовании кинетики в целом не
учитываются.
.2 Математическая модель
В математической форме любую систему
уравнений модели химического процесса можно представить в виде:
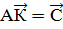
Где С - вектор измеренной
концентрации продуктов; К - вектор констант скоростей реакций; А - некоторый
алгебраический или дифференциальный оператор.
Реакция алкилирование изобутана
изобутиленом происходит в несколько стадий:
Протонирование изобутилена до
триметилкарбониевого иона.
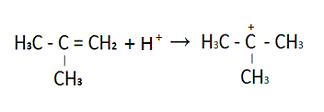
В общем виде эта реакция будет
выглядеть так
А + В = С (А1)
Присоединяется к изобутилену
триметилкарбониевого иона с образованием димерного катиона.
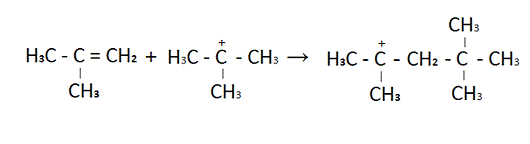
В общем виде данная формула выглядит
так
С + D = E (А2)
Димерный катион реагирует с
изобутаном с получением требуемого изооктан.
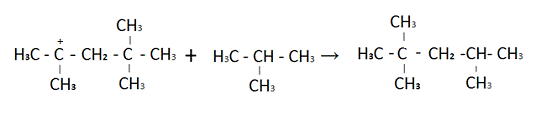
Общий вид данной реакции таков
+ F = G (А3)
Каждую из этих реакций можно
записать как
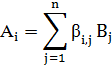
Где Ai - i-я соединение; Bj - j
элемент; βi
j - стехиометрический
коэффициент "элемента" Bj в "соединения" Ai.
Стехиометрические коэффициенты «элементов» - продуктов будем считать
положительным, а исходных веществ - отрицательными.
Если имеем набор из 3-ёх
"соединений", тогда сумму веществ можно записать в виде произведения
матриц n "элементов" и стехиометрических чисел:
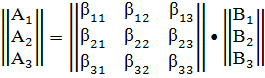
или
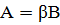
Где A и B - вектор - столбцы
"соединений" и "элементов"; β - атомная
матрица в случае, если B - химические элементы, матрица стехиометрических
коэффициентов соединений в реакциях или стехиометрических коэффициентов реакций
в маршрутах.
В качестве примера составления
матрицы рассмотрим довольно простую кинетическую схему:
k12 k23
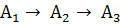
Где первым индексом у констант скоростей
записывают номер продукта, а вторым - номер исходного вещества.
Кинетические уравнения следующие:
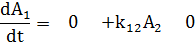
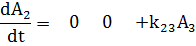
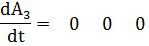
Или эту же систему в матричной форме:
Где Аi -концентрации.
В компактной форме можно записать: ri = ki j⋅Ai
Далее учитывая, что все стехиометрические
коэффициенты равны единице, необходимо перемножить две матрицы.
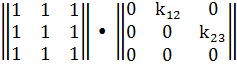
Проведя расчеты, получается матрица такого вида
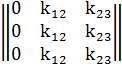
После этого на основе матрицы составляется
математическая модель:
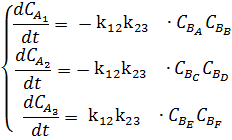
Далее с помощью ЭВМ вычисляется система
диффенциальных уравнений, используя численные методы.
.3 Расчет параметров
Алкилирование изобутана изобутиленом до до
2,2,4-триметилпентана (изооктана)
Исходные данные
В реактор поступает бутан-бутиленовая фракция,
100 т/ч
Таблица 2 - Исходные данные
|
Состав
бутан-бутиленовой фракции
|
ω
массовые
доли %
|
|
1
|
2
|
|
изобутан
|
40
|
|
изобутилен
|
40
|
|
пропан
|
5
|
|
н-бутан
|
8
|
|
бутен-1
|
4
|
|
бутен-2
|
3
|
Процесс переработки газов с целью изменения
состава исходной газовой смеси.
Конверсию применяют с целью
получения водорода
<http://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4>
или его смесей с СО. Эти смеси используют для синтеза органических
продуктов.[5]
Таблица 3 - Исходные данные при
конверсии
|
Конверсия
|
ωк
массовые доли %
|
|
1
|
2
|
|
изобутана
|
85
|
|
изобутилена
|
90
|
В реакторе алкилирования протекает реакция:
Н3С-С(СН3)=СН2 + Н3С-СН(СН3)-СН3 →
Н3С-СН(СН3)-СН2-С(СН3)2СН3 + Q
Расчеты и составление таблицы материального
баланса
Молекулярные массы веществ - ММ:
Расчитывается по таблице Менделеева.
ММ(изобутан)=56;
ММ(изобутилен)=58;
ММ(изооктан)=114.
Массы веществ в сырье - mвс
(кг/ч)вс(вещества)=100 000*ω
где: ω-массовая
доля вещества.
100 000 кг = 100 твс (изобутан)=100000*0,4=40
000 (кг/ч);вс (изобутилен)=100000*0,4=40 000 (кг/ч);вс (пропан)=100000*0,05=5
000 (кг/ч);вс (н-бутан)=100000*0,08=8 000 (кг/ч);вс (бутен-1)=100000*0,04=4 000
(кг/ч);вс (бутен-2)=100000*0,03=3 000 (кг/ч).
Масса вступившего в реакцию изобутана М (кг/ч)
М(изобутана) = mвс* ωк
где: mвс - масса изобутана в сырье
ωк -массовая доля
конверсии изобутана
*0,85=34 000 (кг/ч).
Масса непрореагировавшего изобутана Мнепр.
(кг/ч)
Мнепр. = mвс - М
где: mвс - масса изобутана в сырье
М - масса вступившего а реакцию изобутана
000-34 000=6000 (кг/ч).
Масса прореагировавшего изобутилена М (кг/ч)
Находим из пропорции.
000 - 56
М - 58
М = 34000*58/56=35214,286 (кг/ч);
Масса поданного изобутилена Мисх (кг/ч)
Мисх = М. *100/ ωк
где: М. - масса прореагировавшего изобутилена
,286*100/90=39126,984 (кг/ч).
Масса непрореагировавшего изобутилена Мнепр.
(кг/ч)
Мнепр. = Мисх - М
Мисх - масса поданного(исходного) изобутилена
М - масса прореагировавшего изобутилена
,984-35214,286=3912,698 (кг/ч).
Масса образовавшегося изооктана (кг/ч)
Находим из пропорции.
- 56
М - 114
М = 34000*114/56=69214,286 (кг/ч) [4,5].
Таблица 4 - Таблица материального баланса
|
№
|
Наименование
|
Кг/час
|
ω
%
|
№
|
Наименование
|
Кг/час
|
ω
%
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
1
|
Изобутан
|
40
000
|
28,75
|
1
|
Изобутан
|
6000
|
4,31
|
|
2
|
Изобутилен(1)
|
40
000
|
28,75
|
2
|
Изобутилен(1)
|
40000
|
28,75
|
|
3
|
Пропан
|
5000
|
3,59
|
3
|
Пропан
|
5000
|
3,59
|
|
4
|
Н-бутан
|
8000
|
5,75
|
4
|
Н-бутан
|
8000
|
5,75
|
|
5
|
Бутен-1
|
4000
|
2,87
|
5
|
Бутен-1
|
4000
|
2,87
|
|
6
|
Бутен-2
|
2,17
|
6
|
Бутен-2
|
3000
|
2,17
|
|
№
|
Наименование
|
Кг/час
|
ω
%
|
№
|
Наименование
|
Кг/час
|
ω
%
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
7
|
Изобутилен(2)
|
39126,984
|
28,12
|
7
|
Изобутилен(2)
|
3912,698
|
2,81
|
|
8
|
|
|
|
8
|
Изооктан
|
69214,286
|
49,75
|
|
Итого:
|
139126,98
|
100
|
|
Итого:
|
139126,984
|
100
|
Технологические показатели процесса
Выход изооктана по данному изобутану:
β=Gфакт/Gтеорфакт=69214,286;теор=?
000 - 56 теор - 114теор=40000*114/56=81428,571;
β= Gфакт/
Gтеор=69214,286/81428,571=0,85=85%;
. Расходные коэффициенты по изобутану:
Ктеор=М(изобутана)/М(изооктана)=56/114=0,49;
Ктеор=М(изобутана)/М(изооктана)=40000/69214,286=0,55.
[1,5].
После проведенных расчетов можно сделать вывод.
Выход изооктана составляет 85%, это означает что изобутилен выходит с хорошем
количестве, потери составляют 15%. Вероятнее всего выход не 100% из за того,
что в установке, в особенности в реакторе (алкилаторе) у мещалок была
недостаточная скорость, так же на начальном процессе алкилирования, из за
выделяющегося тепла, часть изобутана (исходного компонента) испаряется, так же
он испаряется при дроселировании смеси.
По таблице материального баланса можно сделать
вывод, что масса на приход и масса на расход после вычисления оказались
равными, с незначительным изменением. Это доказывает, что материальный баланс
являющихся конкретным выражением закона сохранения массы.
Расходные коэффициенты, которые были рассчитаны
по молекулярной массе изобутана и изооктана и по массе образовавшихся изобутана
и изооктана, составляют 0,49 и 0,55 это говорит о полноте протекания процесса,
так как они имеют приближенные значения.
Заключение
Данная курсовая работа была нацелена, на
изучение кинетики реакции. То есть на протекание реакции во времени,
определение её скоростях и механизма. С исследованиями кинетики химических
реакций связаны важные направления современной химии и химической
промышленности: разработка рациональных принципов управления химическими
процессами. В данном процессе удобнее использовать автоматические системы
управления, отвечающие более высоким требованиям. Так же стимулирование
полезных и подавление нежелательных химических реакций, либо добавлением
катализатора, либо нагреванием системы до 500 0С, либо увеличением концентрации
исходных компонентов на начальных стадиях процесса. Еще одним преимуществом
исследования кинетики реакции методом математического моделирования является
создание новых и усовершенствование существующих процессов и аппаратов в
химической технологии, и перенесение на реальные объекты.
Следовательно, мы можем сделать вывод об
условиях протекания процесса, и внести какие либо изменения в ход реакции. Так
же мы можем проанализировать протекание процесса после его окончания, и
подобрать новые параметры и провести реакцию повторно, до получения наилучшего
результата. Который будет перенесен на реальное производство.
Список используемой литературы
1.
Общая химическая технология / Под ред. А.Г.Амелина. М.: «Химия», 2007, 400 с.
.
Юкельсон И.И. Технология основного органического синтеза. М.: «Химия», 2008,
846 с.
.
Лебедев Н.Н. Химия и технология основного органического и нефтехимического
синтеза. Изд. 2-е, пер. М., «Химия», 2005, 736 с.
.
Общая химическая технология / Под ред. Проф. И.П. Мухленова. М.: «Высшая
школа», 1984, 518 с.
.
Введение в моделирование химико-технологических процессов / А.Ю. Закгейм. - 2-е
изд., перераб. и доп. - М. : 982. - 288 с.