Инфракрасная спектроскопия и ее практическое применение в фармацевтическом анализе
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
"ВОРОНЕЖСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ"
(ФГБОУ ВПО
"ВГУ")
Фармацевтический
факультет
Кафедра
фармацевтической химии и фармацевтической технологии
КУРСОВАЯ
РАБОТА
Инфракрасная
спектроскопия и ее практическое применение в фармацевтическом анализе
ВОРОНЕЖ 2014
Оглавление
Введение
. Сущность метода инфракрасной спектроскопии
. Ик-спектры поглощения органических соединений
2.1 Углеводороды
.1.1 Предельные углеводороды
.1.2 Алкены
.1.3 Сопряженные углеводороды
.2 Органические соединения с функциональными группами
.2.1 Органические соединения, содержащие кислород
.2.2 Фосфорорганические соединения
2.3 Инфракрасные спектры полимеров
3. Инфракрасное излучение и колебания молекул
. Характеристические частоты групп
4.1 Применение характеристических частот групп
5. Регистрация инфракрасных спектров
. Спектроскопия в ближней инфракрасной области (БИК)
. Cпектроскопия с преобразованием Фурье
. Методы и приемы подготовки проб в ИК спектроскопии
9. Аппаратура ИК-спектроскопии
10. Специфические особенности фармацевтического
анализа
Заключение
Список использованной литературы
инфракрасный спектроскопия проба фармацевтический
Введение
В связи с расширением фармацевтического рынка лекарственных препаратов
требуются все более точные и информативные методы анализа. Необходимость
применения физико-химических методов анализа, в частности спектральных,
обусловлена требованиями 12-й фармакопеи РФ. Одним из перспективных методов
анализа является ИК- спектроскопия [23].
Спектроскопия - раздел физики и аналитической химии, посвящённые изучению
спектров взаимодействия излучения (в том числе, электромагнитного излучения,
акустических волн и др.) с веществом. В физике спектроскопические методы
используются для изучения всевозможных свойств этих взаимодействий. В
аналитической химии - для обнаружения и определения веществ при помощи
измерения их характеристических спектров, т.е. методами спектрометрии.
Области применения спектроскопии разделяют по объектам исследования:
атомная спектроскопия, молекулярная спектроскопия, масс-спектроскопия, ядерная
спектроскопия, инфракрасная спектроскопия и другие.
Метод инфракрасной спектроскопии дает возможность получить сведения об относительных
положениях молекул в течение очень коротких промежутков времени, а также
оценить характер связи между ними, что является принципиально важным при
изучении структурно-информационных свойств различных веществ.
Инфракрасная (ИК) спектроскопия характеризуется широкой информативностью,
что создает возможность объективной оценки подлинности и количественного
определения лекарственных веществ. ИК-спектр однозначно характеризует всю
структуру молекулы. Различия в химическом строении меняют характер ИК-спектра.
Важные преимущества ИК-спектроскопии - специфичность, быстрота выполнения
анализа, высокая чувствительность, объективность получаемых результатов,
возможность анализа вещества в кристаллическом состоянии. Методом
ИК-спектроскопии можно проводить не только количественную оценку лекарственных
веществ, но и исследование таких химических превращений, как диссоциация,
сольволиз, метаболизм, полиморфизм и т.д. [11].
. Сущность метода инфракрасной спектроскопии
Инфракрасная спектроскопия- раздел молекулярной оптической спектроскопии,
изучающий спектры поглощения и отражения электромагнитного излучения в
инфракрасной области, т.е. в диапазоне длин волн от 10-6 до
инфракрасный спектр представляет собой сложную кривую с большим числом
максимумов и минимумов. Полосы поглощения появляются в результате переходов
между колебательными уровнями основного электронного состояния изучаемой
системы. Спектральные характеристики (положения максимумов полос, их
полуширина, интенсивность) индивидуальной молекулы зависят от масс составляющих
ее атомов, геометрии строения, особенностей межатомных сил, распределения
заряда и др., поэтому инфракрасные спектры отличаются большой
индивидуальностью, что и определяет их ценность при идентификации и изучении
строения соединений.
Количественная связь между интенсивностью I прошедшего через вещество
излучения, интенсивностью падающего излучения I0 и величинами,
характеризующими поглощающее вещество, основана на законе Бугера-Ламберта-
Бера: I = I0 e-ссl , т. е. на зависимости интенсивности полос поглощения
от концентрации вещества в пробе. При этом о количестве вещества судят не по
отдельным полосам поглощения, а по спектральным кривым в целом в широком
диапазоне длин волн. Если число компонентов невелико (4-5), то удается математически
выделить их спектры даже при значительном перекрывании последних. Погрешность
количественного анализа, как правило, составляет доли процента.
Метод инфракрасной спектроскопии является универсальным физико-химическим
методом, который применяется в исследовании структурных особенностей различных
органических и неорганических соединений. Метод основан на явлении поглощения
группами атомов испытуемого объекта электромагнитных излучений в инфракрасном
диапазоне. Поглощение связано с возбуждением молекулярных колебаний квантами
инфракрасного света. При облучении молекулы инфракрасным излучением поглощаются
только те кванты, частоты которых соответствуют частотам валентных,
деформационных и либрационных колебаний молекул.
Для регистрации спектров поверхности твердых тел применяют метод
нарушенного полного внутреннего отражения. Он основан на поглощении
поверхностным слоем вещества энергии электромагнитного излучения, выходящего из
призмы полного внутреннего отражения, которая находится в оптическом контакте с
изучаемой поверхностью. Инфракрасная спектроскопия широко применяют для анализа
смесей и идентификация чистых веществ.
Идентификация чистых веществ производится обычно с помощью
информационно-поисковых систем путем автоматического сравнения анализируемого
спектра со спектрами, хранящимися в памяти ЭВМ. Для идентификации новых веществ
(молекулы которых могут содержать до 100 атомов) применяют системы
искусственного интеллекта. В этих системах на основе спектроструктурных
корреляций генерируются молекулярные структуры, затем строятся их теоретические
спектры, которые сравниваются с экспериментальными данными. Исследование
строения молекул и др. объектов методами инфракрасной спектроскопии
подразумевает получение сведений о параметрах молекулярных моделей и математически
сводится к решению обратных спектральных задач. Решение таких задач
осуществляется последовательным приближением искомых параметров, рассчитанных с
помощью специальной теории спектральных кривых к экспериментальным.
Параметрами молекулярных моделей служат массы составляющих систему
атомов, длины связей, валентные и торсионные углы, характеристики потенциальной
поверхности (силовые постоянные и др.), дипольные моменты связей и их
производные по длинам связей и др. Инфракрасная спеткроскопия позволяет
идентифицировать пространственные и конформационные изомеры, изучать внутри- и
межмолекулярные взаимодействия, характер химических связей, распределение
зарядов в молекулах, фазовые превращения, кинетику химических реакции,
регистрировать короткоживущие (время жизни до 10-6 с) частицы,
уточнять отдельные геометрические параметры, получать данные для вычисления
термодинамических функций и др.
Необходимый этап таких исследований - интерпретация спектров, т.е.
установление формы нормальных колебаний, распределения колебательной энергии по
степеням свободы, выделение значимых параметров, определяющих положение полос в
спектрах и их интенсивности. Расчеты спектров молекул, содержащих до 100
атомов, в том числе полимеров, выполняются с помощью ЭВМ. При этом необходимо
знать характеристики молекулярных моделей (силовые постоянные,
электрооптические параметры и др.), которые находят решением соответствующих
обратных спектральных задач или квантово-химическими расчетами.
И в том, и в другом случае обычно удается получать данные для молекул,
содержащих атомы лишь первых четырех периодов периодической системы. Поэтому
инфракрасная спектроскопия как метод изучения строения молекул получил
наибольшее распространение в органической и элементоорганической химии. В
отдельных случаях для газов в инфракрасной области удается наблюдать
вращательную структуру колебательных полос. Это позволяет рассчитывать
дипольные моменты и геометрические параметры молекул, уточнять силовые
постоянные и т.д.
Инфракрасная спектроскопия имеет ряд преимуществ перед спектроскопией в
видимой и ультрафиолетовой областях, так как позволяет проследить изменение
всех основных типов связей в молекулах исследуемых веществ. При использовании
инфракрасной спектроскопии для определения качественного и количественного
состава природных смесей не происходит разрушение веществ, что позволяет
применять их для последующих исследований. Как известно, при инфракрасной
спектроскопии в диапазоне каждой химической группировке органической молекулы
соответствует определенный набор полос поглощения, которые хорошо изучены и
приведены в соответствующих справочниках. При этом следует отметить, что в
процессе снятия инфракрасного спектра создаются помехи на определенных длинах
волн, связанные с поглощением электромагнитного излучения связями растворителей
О-Н и С-Н [8].
Инфракрасный спектр биологического образца представляет собой суммарный
спектр, в котором происходит наложение полос поглощения различных
функциональных групп органических веществ а также воды. Это явление усложняется
в виду взаимодействия отдельных видов колебаний указанных групп, при этом
происходит искажение формы полос поглощения и смещение их максимумов. Поэтому
на инфракрасных спектрах наблюдается большое число широких полос поглощения с
неясными максимумами. Обычно расшифровка инфракрасных спектров биологических
образцов весьма затруднительна, поэтому, чтобы облегчить расшифровку суммарного
спектра, необходимо разделять биологический образец на более простые
компоненты. Это дает возможность получить большее число полос поглощения для
исследуемого вещества и более точно определить состав компонентов в образце.
Положительной особенностью метода инфракрасной спектроскопии является то,
что полосы поглощения одного и того же вида колебаний атомной группы различных
веществ располагаются в определенном диапазоне инфракрасного спектра (например,
3720-3550 см-1- диапазон валентных колебаний групп -ОН; 3050-2850 см-1
- групп -СН, -СН2, -СН3 органических веществ). Точное
положение максимума полосы поглощения атомной группы в пределах этого диапазона
указывает на природу вещества (так, максимум 3710 см-1
свидетельствует о наличии групп -ОН, а максимум 3030 см-1 - о
присутствии групп =С-Н ароматических структур).
Однако если исследуемый объект представляет собой не механические смеси,
а является сложным химическим соединением, то указанные особенности
инфракрасных спектров не обнаруживаются.
Число характеристических полос поглощения атомных групп, их интенсивность
и положение максимумов, наблюдаемых на инфракрасных спектрах, дают
представление о строении индивидуального соединения или о компонентном составе
сложных веществ. Интенсивность полосы поглощения определяется величиной,
численно равной энергии, которую поглощают атомные или функциональные группы
образца при прохождении через них инфракрасных лучей. Важным диагностическим
показателем полос поглощения является величина пропускания. Данный показатель и
концентрация вещества в снимаемом объекте связаны обратной пропорциональной
зависимостью, что используется для количественных определений содержания
отдельных компонентов.
Метод инфракрасной спектроскопии позволяет исследовать твердую, жидкую
фазы биологической массы. Этот метод позволяет изучать образец в целом, без его
расчленения и предварительных химических обработок, а также использовать малые
(до 10 мг) навески.
Поглощение органических веществ в различных участках инфракрасного
диапазона определяется входящими в состав молекулы химическими группировками, а
точнее образующими их связями, поэтому метод позволяет суммарно определить
родственные вещества, по характеристическим зонам поглощения. Инфракрасная
спектроскопия широко применяется для анализа биологических жидкостей, в
частности крови и ее фрагментов, а в последнее время для диагностики и
прогнозирования различных заболеваний все в возрастающей степени используется
ротовая жидкость или смешанная слюна, однако интерпретация полученных
результатов осложняется в связи с многокомпонентностью объектов исследования.
При инфракрасной спектроскопии крови и слюны возможен количественный
анализ только функциональных групп, входящих в основные компоненты в
аналитических количествах. Поэтому анализ образцов данных жидкостей вызывает
затруднения, т.к. по существу анализируется их водная основа
В медицине инфракрасной спектроскопии в последние годы используют для
определения некоторых веществ в биологических жидкостях: крови, моче, слюне,
слезной жидкости, желчи, молоке, для идентификации некоторых витаминов,
гормонов и других биологически активных веществ. Кроме того, в последнее время
метод находит все более широкое применение для характеристики конформационных и
структурных изменений белков, липидов, фосфолипидов биомембран клеток,
исследуемых в биоптатах, а также с помощью волоконно-оптических методик.
С помощью этого метода можно оценивать фармакокинетику различных
лекарственных препаратов. При сахарном диабете выявлены достоверно значимые
изменения инфракрасного спектра крови, доказана возможность использования
показателей инфракрасного спектра для ранней диагностики стоматологических
заболеваний и прогнозирования кариеса зубов у детей. Проведено исследование
быстрых изменений показателей инфракрасного спектра крови для прогнозирования,
диагностики и определения степени тяжести остеопороза и эффективности его
лечения. Доказана возможность использования инфракрасной спектроскопии для
изучения процессов регенерации. Инфракрасная спектроскопия применяется также и
в судебном анализе для изучения митохондриального генома при идентификации
личности и определении отцовства [16].
. Ик-спектры поглощения органических соединений
При исследовании органических соединений обычно используют поглощение
инфракрасного излучения в области 2-50 мкм (5000-200 см-1).
Для получения ИК-спектров используются оптические приборы, в которых
применяются тепловые источники и приемники излучения, а материалом призм служат
галоидные соли (LiF, CaF2, NaCl, KBr, Csl). В современных приборах солевая
оптика заменена дифракционными решетками.
При записи ИК-спектров поглощения параметром длины волны являются микроны
(мкм) или частоты в обратных сантиметрах (см-1). Интенсивность
выражается в процентах пропускания или поглощения и лишь в некоторых случаях в
оптической плотности.
Инфракрасные спектры можно измерить для газообразных, жидких и твердых
соединений. Для измерения спектров газообразных соединений используются
специальные газовые кюветы. Жидкие соединения наносят в виде пленки на
пластинки из материала, прозрачного в исследуемой области (например, КВr, NaCl,
Csl, KCl). Из твердых веществ приготовляют суспензию в вазелиновом масле,
которую помещают между солевыми пластинками. Нужно иметь в виду, что само
вазелиновое масло сильно поглощает при 3000-2800 см-1, 1460 и 1380
см-1. Поэтому для исследования поглощения веществ в этой области
вместо вазелинового масла используют пергалоидные углеводороды. Можно получить
спектры твердых веществ, запрессовывая их с бромистым калием и снимая спектр
полученной пластинки. Однако иногда вещество взаимодействует с бромистым
калием, что приводит к искажению спектра. Инфракрасные спектры могут быть
измерены и для растворов. Поскольку не имеется растворителей, прозрачных по
всей области спектра, то обычно измерения ИК-спектров растворов делаются только
для узких областей. Для исследования водных, кислых и щелочных растворов используют
кюветы из водонерастворимых материалов (флюорит, кремний, германий и другие
материалы, прозрачные в ИК-области). Зависимость частоты колебаний от силовой
постоянной и массы атомов позволяет оценить положение полос поглощения
отдельных групп.
Силовые постоянные деформационных колебаний существенно меньше силовых
постоянных валентных колебаний, поэтому полосы деформационных колебаний
располагаются в области меньших частот.
На рисунке 2 приведены области поглощения структурных элементов
органических соединений.

Рис. 1. Поглощение некоторых растворителей при толщине слоя 0,1 мм
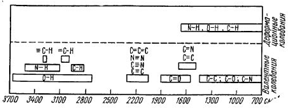
Рис. 2. Области поглощения некоторых структурных элементов
В область 1400-900 см-1 попадают полосы поглощения, отвечающие
колебаниям групп С-С, С-О, С-N, а также многие деформационные колебания. В
результате сильного взаимодействия этих колебаний отнесения полос поглощения к
отдельным связям невозможны, однако весь набор полос поглощения в этой области
является индивидуальной характеристикой соединений. Эта область поэтому
получила название области ≪отпечатков пальцев≫ .
Рис. 3. ИК-спектры поглощения изомерных гексанов: а - к-гексан; б -
2-метилпентан.
По ИК-спектрам в области ≪отпечатков пальцев≫ можно идентифицировать даже
изомерные углеводороды, определение которых другими путями вызывает большие
затруднения. Примером могут служить спектры двух изомеров гексана, приведенные
на рис. 3 [6].
.1 Углеводороды
.1.1
Предельные углеводороды
ИК-спектры углеводородов характеризуются появлением полос поглощения,
обязанных колебаниям связей С-С и С-Н.
Полосы углеводородов, связанные с характеристическими частотами С-Η
(метальные, метиленовые
и метановые группы), находятся в трех областях: 3000-2800, 1400-1300 и около
700 см-1.
Поглощение в области 3000-2800 см-1 обусловлено валентными
колебаниями С-Н. Оно проявляется в виде сложной полосы поглощения, в которой
пики при 2962 и 2872 см-1 принадлежат колебаниям метильной группы
(асимметричные νAS и симметричные - νS), а пики при 2926 и 2853 см-1
относятся к валентным колебаниям метиленовой группы (νAS
и νS).
Положение этих полос поглощения хорошо сохраняется у всех типов
алифатических углеводородов. Интенсивности полос зависят от числа метиленовых и
метильных групп в молекуле углеводорода. Метиловая группа С-Η
имеет относительно
слабую полосу поглощения. νCH около 2890 см-1 , которая
перекрывается интенсивными полосами поглощения групп СН2 и СН3.
Поглощение в области 1400-1300 см-1 и около 700 см-1
обусловлено деформационными колебаниями С-Н-связей. Метильная группа имеет как
симметричные, так и асимметричные деформационные колебания. Полоса при 1460 см-1
отвечает асимметричному деформационному колебанию метильных групп, полоса
1380см-1 - симметричному колебанию. Расщепление этой полосы в дублет
может служить признаком гемдиметильной группы. Для метиленовых групп характерны
четыре типа деформационных колебаний: ножничные, веерные, крутильные и
маятниковые. Полоса поглощения, отвечающая ножничным колебаниям метиленовых
групп, находится при 1467 см-1. Полосы 1467 см-1
метиленовой и 1460 см-1 метильной групп накладываются, и в спектрах
разветвленных углеводородов трудно различимы. В нормальных углеводородах при
n>5 полоса метильной группы при 1460 см-1 проявляется, в виде
плеча на полосе 1467 см-1. Маятниковые колебания метиленовых групп
находятся в области 790-720 см-1. Положение их определяется длиной углеродной
цепи. Так, для С2Н5 частота маятниковых колебаний 790-770 см-1, для
С3H7 она имеет значение 743-734 см-1. Для n=4
соответствующая полоса наблюдается при 725-720 см-1 (для твердых
образцов иногда в виде дублета). Маятниковые колебания СН2-групп
могут быть использованы для обнаружения полиметиленовых цепочек. Полосы,
отвечающие крутильным и веерным колебаниям метиленовых групп и деформационным
колебаниям метановых групп, располагаются в области 1300 см-1; для
идентификации используются редко вследствие своей недостаточной
характеристичности и малой интенсивности. Интенсивности полос поглощения
деформационных колебаний метиленовой группы возрастают линейно с увеличением
числа групп СН2. Полосы поглощения, отвечающие колебаниям скелета,
относительно мало интенсивны, проявляются в двух областях: 1100 - 700 см-1
и ниже 500 см-1. Первая область связана с валентными колебаниями
углеродного скелета, вторая - с деформационными. Экспериментальные исследования
большого числа углеводородов показали, что при наличии в молекуле изопропильной
группы в спектре появляются полосы при 1170 и 1145 см-1, трет-
бутильной - при 1255 и 1210 см-1, в присутствии четвертичного атома
углерода наблюдается поглощение при 1215 и 1195 см-1. Эти данные
могут быть приведены только как свидетельство в пользу присутствия указанных
групп, но не как однозначное доказательство.
Деформационные колебания углеродного скелета, находящиеся в области ниже
500 см-1, в ИК-спектрах практически не исследованы.
2.1.2 Алкены
Введение кратной связи в молекулу органического соединения приводит к
появлению полос поглощения, характеризующих эту связь, и изменяет положение
полос поглощения групп, непосредственно связанных с ней. В моноолефинах с
валентными колебаниями С = С связана полоса поглощения в области 1680-1640 см-1.
Это колебание не является строго валентным, поскольку наряду ρ
растяжением связи С = С
происходит изменение валентных углов Η-С = С. В центросимметричных
этиленовых соединениях колебание νС=С неактивно вследствие запрета по
симметрии (так как симметричные колебания происходят без изменения дипольного
момента), в несимметричных молекулах интенсивность полосы поглощения
увеличивается по мере смещения двойной связи наконец цепи. Положение полосы
валентного колебания С = С внутри интервала 1680-1640 см-1 зависит
от степени замещения у связи С = С и геометрии молекулы.
Положение полосы поглощения связи С = С в циклоалкенах зависит от того,
является она эндо- или экзоциклической. Для эндоциклической частота νС=С несколько возрастает по мере
увеличения угла в цикле, для экзоциклической связи С = С частота νС=С возрастает с увеличением напряженности
циклов.
Частота валентных колебаний =С-Η наблюдается при 3010-3095 см-1,
причем значение ν=C-H определяется степенью замещения: для
=CHR характерно колебание с ν=3040-3010 см-1, для группы =GH2
появляется колебание с частотой 3095-3075 см-1. Полосы плоских
деформационных колебаний связей =С-Η мало интенсивны, расположены в
области деформационных колебаний метиленовых и метальных групп и для целей
структурного анализа обычно не используются. Напротив, полосы неплоских
деформационных колебаний Η-С = С-Η в спектрах алкенов являются весьма
характерными, располагаются в области 1000-800 см-1 и достаточно
интенсивны. Поглощение при 970-965 см-1 характерно для трансизомера.
По поглощению в области 1000-800 см-1 можно с хорошей степенью
достоверности определить концевые винильную R-СН =СН2 и метиленовую
группы R2C = СН2. На колебание остальной части молекулы
алкена кратная связь не оказывает существенного влияния.
2.1.3 Сопряженные углеводороды
Сопряжение двух связей С=С приводит к появлению двух полос поглощения в
области 1650-1600 см-1. Расщепление объясняется механическим
взаимодействием и изменением форм нормальных колебаний. Интенсивность полос
повышена по сравнению с интенсивностью поглощения соответствующего
несопряженного соединения. У полиенов в этой области появляется несколько
полос, иногда сливающихся в одну широкую, причем с увеличением числа
сопряженных связей полосы поглощения смещаются в сторону меньших частот.

Рис.4. Спектр поглощения клотримазола
При сопряжении двойных связей с ароматическим кольцом смещение полосы С =
С обычно меньше, чем при сопряжении алифатических связей. Интенсивность полосы
сильно увеличивается наряду с увеличением интенсивности полос поглощения
скелетных колебаний ароматического кольца в области 1600-1500 см-1.
Особенно сильное взаимодействие колебаний происходит в случае
кумулированных связей; в колебании участвуют все три атома углерода алленовой
группировки, давая две полосы поглощения: интенсивную около 1950 см-1
(νAS) и слабую
вблизи 1050 см-1 (νS) [21].
2.2 Органические соединения с
функциональными группами
Введение функциональных групп приводит к существенному изменению
ИК-спектра соответствующего углеводорода. Так же как и для углеводородов, набор
полос в области 1400-700 см-1 является индивидуальной
характеристикой каждого вещества. Кроме того, в спектре появляются полосы,
специфичные для каждой функциональной группы.
2.2.1 Органические соединения, содержащие
кислород
Гидроксилсодержащие соединения. Введение гидроксильной группы в молекулу
органического соединения приводит к появлению полос поглощения, связанных с
колебаниями связей О-Η и С-О.
Наиболее характерные полосы поглощения появляются в областях 3600-3000 см-1
(валентные колебания О-Н-группы) и 1400-1000 см-1 (колебания,
связанные с группировкой С-О-Н). Валентные колебания О-Η
являются
характеристическими, поскольку в них принимает участие легкий атом водорода.
Они наблюдаются в широком интервале частот (3600-2500 см-1), что
связано со способностью гидроксильной группы образовывать водородные связи.
Образование водородной связи влияет на положение и форму полос валентных
колебаний ОН.
Свободная, неассоциированная гидроксильная группа спиртов и фенолов имеет
узкую полосу поглощения в области 3670-3580 см-1. Эта полоса обычно
наблюдается в разбавленных растворах гидроксилсодержащих соединений в инертных
растворителях. Идентификация полос свободной ОН-группы не вызывает затруднений,
так как другие основные колебания не дают полос в этой области, а интенсивность
обертонов намного ниже.
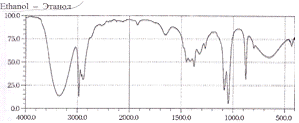
Рис.5. Спектр поглощения этанола
Участие гидроксильной группы в образовании межмолекулярных водородных
связей проявляется в смещении полосы поглощения в сторону меньших частот и
значительном увеличении ее интенсивности. Образование водородных связей между
молекулами спирта приводит к появлению димеров и полиассоциатов. Для димеров
характерно возникновение резкой полосы поглощения в области 3550-3450 см-1
в спектре полиассоциатов наблюдается широкая полоса в области 3400-3200 см-1.
Характерным признаком межмолекулярных водородных связей является изменение
характера спектра в области 3600-3200 см-1 при изменении
концентрации гидроксилсодержащего соединения в инертном растворителе (рис. 6):
при малых концентрациях вещества в спектре имеется узкая полоса поглощения,
отвечающая свободной гидроксильной группе (рис. 6,а). Увеличение концентрации
приводит к появлению димеров и полиассоциатов и в спектре, наряду с полосой
свободной ОН-группы появ-ляется поглощение в более длинноволновой области (рис.
6,б). Дальнейшее увеличение концентрации сопровождается возрастанием
интенсивности поглощения полосы связанной ОН-группы и уменьшением интенсивности
полосы свободной гидроксильной группы (рис. 6, в, г).
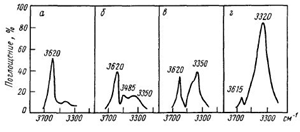
Рис. 6. ИК-спектры поглощения гидроксилсодержащего соединения при
концентрации спирта в CCl4: а- 0,01 М; б - 0,1 М; в - 0,2 М; г-1,0 Μ
Образование межмолекулярных водородных связей с полярными соединениями,
такими, как эфиры, кетоны, амины и др., сопровождается смещением полосы νOH
в область 3550-3450 см-1.
Одновременно наблюдается и небольшое смещение полос поглощения группы донора
электронов (10-20 см-1) в низкочастотную область. Участие ОН-группы
во внутримолекулярной водородной связи приводит к появлению узкой полосы
поглощения в области 3590-3420 см-1. Водородная связь хелатного типа
проявляется в виде очень широкой размытой полосы поглощения в области 3200-2500
см-1. В отличие от межмолекулярных водородных связей характер
поглощения соединений с внутримолекулярной водородной связью в инертных
растворителях не зависит от концентрации.
Таким образом, ИК- спектры в области 3600-3000 см-1 дают
возможность исследовать водородные связи в органических соединениях.
Исследование зависимости положения и интенсивности полос поглощения в этой
области от концентрации гидроксилсодержащего соединения позволяет определить
характер водородной связи. Наличие полярной связи С-О вызывает появление
интенсивной полосы поглощения в интервале 1200-1000 см-1 ,
обусловленной участием этой группы в скелетных колебаниях. Кроме того, в
области 1400-1250 см-1 появляются интенсивные полосы поглощения,
связанные с плоскими деформационными колебаниями ОН- группы. В литературе
имеются работы, согласно которым можно различать первичные, вторичные,
третичные спирты и фенолы по положению полос поглощения в области 1400-1000 см1.
Однако для целей структурного анализа эти данные надо использовать осторожно.
Простые эфиры. Колебания группы С-О-С простых эфиров не характеристичны. Однако
в области 1200-1000 см-1 у простых эфиров появляется интенсивная
полоса поглощения, связанная с участием в колебании полярной связи С-О-С.
Положение этой полосы непостоянно, зависит от структуры эфира: так, в
алициклических эфирах эта полоса расположена в области 1150-1060 см-1,
а у ароматических и непредельных эфиров она наблюдается в области 1270-1200 см-1.
Простая эфирная связь не может быть однозначно доказана по ИК- спектрам
поглощения. Введение кислорода сказывается на положении полос поглощения
метальных и метиленовых групп, непосредственно соединенных с атомами кислорода.
Так, полоса симметричных валентных колебаний метильной группы алифатических
эфиров (RОСН3) смещается до 2830-2815 см-1. В
ароматических эфирах (ArОСН3) полосы поглощения СН3-группы
наблюдаются при 2850 см-1. Валентные колебания С-Η-связей при эпоксидном кольце
проявляются при 3050-2990 см-1, колебания СН в α,β-непредельных эфирах - при 3150-3050
см-1.
.2.2
Фосфорорганические соединения
В спектрах фосфинов наблюдаются резкие полосы поглощения средней
интенсивности в области 2440-2350 см-1, обусловленные валентными
колебаниями связи Ρ-Η. Сам фосфин поглощает при 2327 и 2421
см-1. Группа Ρ-Η не участвует заметно в образовании
водородных связей. Группа Ρ-Аг характеризуется полосами
поглощения в интервалах 1450-1435 и 1005-995 см-1.Колебание,
связанное с группой Р = О, появляется в области 1350-1175 см-1. Эта
частота понижается на 50-80 см-1, если группа Р = О участвует в
образовании водородных связей. В фосфорных соединениях, содержащих группу РООН,
полоса поглощения νOH проявляется в области 2700-2560 см-1
(широкая и нерезкая). С группировкой Ρ-О-Аr связывают полосы поглощения в
области 1240-1190 см-1 и менее интенсивную полосу около 1030 см-1.
Группировка Ρ-О-Alk вызывает поглощение в интервале 1050-995 см-1.
В области 970-930 см-1 может проявиться полоса, обязанная колебанию
группы Ρ-О-Р. Связи P = S вызывают поглощение
в области 800-600 см-1. Для фосфорных соединений характерно
появление интенсивного поглощения при 980 см-1, природа которого не
выяснена.
Рис.7. Спектр поглощения тиамина гидрохлорида
2.3 Инфракрасные спектры полимеров
Полимер состоит из макромолекул, которые построены из целого числа
относительно небольших повторяющихся единиц. Молекулярный вес полимера, как
правило, составляет от 103 до 106 а.е. Содержание в
полимерной молекуле множества атомов приводит к значительному количеству
нормальных колебаний, поэтому следовало ожидать сложного вида ИК-спектра
полимера. Однако для большинства полимеров характерны сравнительно простые
спектры, что обусловлено следующими причинами. В реальных полимерах каждая
повторяющаяся структурная единица (элементарная ячейка) характеризуется
определенными нормальными колебаниями, которые могут изменяться в результате
взаимодействия между собой соседних структурных единиц. Если взаимодействие
мало или вообще отсутствует, их нормальные колебания имеют близкие частоты и
проявляются в спектре в виде одной полосы поглощения (вырожденные колебания).
Сильное взаимодействие приводит к изменению частот нормальных колебаний
структурных единиц, что выражается в расщеплении полосы поглощения в спектре. В
спектре полимерной цепи, состоящей из N связанных повторяющихся единиц, каждая полоса расщепится на N компонентов. Величина расщепления
полосы зависит от силы взаимодействия структурных единиц. Взаимодействие этих
единиц в случае характеристических колебаний отдельных функциональных групп
обычно невелико, но оказывается значительны для колебания скелета. В результате
усреднения близких частот колебаний отдельные пики в полосах поглощения
исчезают, и спектр становится более простым [1].
Другая причина, приводящая к упрощению спектров, заключается в
существовании строгих правил отбора, которые определяют активность молекулярных
колебаний. По правилам отбора в инфракрасной области активны только те
нормальные колебания, которые связаны с изменением электрического момента
системы, причем правила отбора зависят не от силовых постоянных, а только от
типа симметрии. В молекулах, не обладающих симметрией, все нормальные колебания
активны.
Задачей качественного анализа полимеров по ИК-спектрам является
определение хотя бы основных компонентов, когда их количество и концентрация в
смеси неизвестны.
Необходимое условие применимости метода - наличие взаимно
неперекрывающихся участков в спектрах веществ, образующих смесь. Для образца
полимера, не содержащего примесей, методом ИКС можно установить с высокой
степенью надежности не только основную структуру полимерной цепи, но даже
незначительные ее детали, обусловленные способом получения или переработки.
Например, индивидуальные спектры пластификаторов, антиоксидантов и других
добавок используют для исключения из спектра полос поглощения, не относящихся к
полимеру [4].
Наряду с качественным определением структуры молекул, ИК-спектроскопия
дает возможность получать количественные данные о содержании тех или иных групп
атомов, связей и их сочетание в молекуле. После определения количественного
содержания молекулярных структур, входящих в полимер, находят его состав.
Однако по сравнению с другими спектроскопическими методами (электронной и
радиоспектроскопией) ИКС обладает в ряде случаев меньшей чувствительностью и
точностью, что исключает возможность определения невысокого содержания
функциональных групп.
Количественный анализ состава полимеров основан на том, что каждая из
анализируемых мономерных групп имеет свое специфическое химическое строение, а
следовательно, и свои характерные только для него полосы поглощения. Все
вещества, кроме оптических изомеров, имеют различные ИК-спектры. Которые часто
называют "отпечатками пальцев" молекулы. Метод ИКС почти универсален
по своим возможностям; образцы могут быть жидкими, твердыми, газообразными,
бесцветными или окрашенными. Наиболее достоверная информация может быть
получена для высокомолекулярных образцов регулярной структуры с линейной
конфигурацией цепи, когда вклад концевых групп, аномальных звеньев и
нерегулярностей других типов минимален. В тех случаях когда не ставится задача
установления взаимного расположения атомов в молекуле, а требуется определить
лишь количественного содержании соответствующих групп, вопрос сводится к выбору
аналитической полосы поглощения, измерению ее интенсивности и сравнению
последней с интенсивностью той же полосы в эталонном соединении. В качестве
аналитической выбирается по возможности изолированная полоса поглощения,
наличие корой в спектре обусловлено присутствием в исследуемом образце искомого
сочетания атомов. При получении полимеров, переработке, прогнозировании их
работоспособности в изделиях необходим контроль за строением полимерных
молекул, который в большинстве случаев может быть решен методами спектроскопии.
Например, по ИК спектрам можно судить об относительном содержании того или иного
типа ненасыщенных групп в полиолефинах, полученных разными методами
полимеризации, о разветвленности их макромолекул, о строении полимерной цепи.
Так, различие в строении молекул 1,4 - транс- и 1,4 - цис-полибутадиенов
находит отражение в ИК спектре (рис. 5), и позволяет получить информацию о
структуре каучука [14].
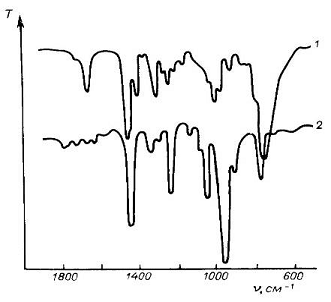
Рис. 8. ИК спектры поглощения полибутадиена с преобладанием 1,4 - цис -
(1) и 1,4 - транс-изомера (2)
3.
Инфракрасное излучение и колебания молекул
ИК-спектр поглощения - уникальное в своем роде физическое свойство. Не
существует двух соединений, за исключением оптических изомеров, с
различающимися структурами, но одинаковыми ИК-спектрами. В некоторых случаях,
таких как полимеры с близким молекулярным весом, различия могут быть
практически не заметны, но они всегда есть. В большинстве случаев ИК-спектр
является ″отпечатком пальцев" молекулы, который легко отличим от
спектров других молекул. Кроме того, что поглощение характеристично для
отдельных групп атомов, его интенсивность прямо пропорциональна их
концентрации. Таким образом, измерение интенсивности поглощения дает после
простых вычислений количество данного компонента в образце. По своим
возможностям метод почти универсален. Образцы могут быть жидкими, твердыми или
газообразными. Они могут быть органическими или неорганическими, хотя
неорганические вещества иногда не дают хорошо выраженных спектров. В обычных
условиях для ИК-излучения прозрачны только одноатомные газы и неполярные
молекулы (Ne, He, О2, N2, H2). Другое
ограничение заключается в том, что такой распространенный растворитель, как
вода, имеет в ИК-области очень сильное поглощение и, кроме того, растворяет
окна кювет, в качестве которых используют пластинки из кристаллов солей. Метод
ИК-спектроскопии обычно не очень чувствителен к примесям, если они не превышают
1%. Это, конечно, может быть как благом, так и бедствием, все зависит от точки
зрения и решаемой проблемы. Подобным же образом может огорчить и тот факт, что
положения характеристических полос поглощения для многих групп различны при
переходе от одной молекулы к другой, но это подтверждает индивидуальность
спектра поглощения и дает больше для понимания структуры молекулы, чем если бы
полосы были неизменны.
Инфракрасным излучением называют излучение с длинами волн от 0,5 до 1000
мкм. В ИК- диапазоне проявляются переходы между колебательными и вращательными
уровнями энергии молекул. Химические связи в молекулах испытывают колебательные
движения. Колебательная энергия молекул квантована, то есть поглощаемая энергия
изменяется не непрерывно, а скачкообразно. В результате колебательный
(инфракрасный) спектр молекулы представляет собой ряд пиков (полос поглощения),
отвечающих разным колебательным энергетическим переходам. Большинство колебательных
переходов в молекулах органических соединений реализуется в диапазоне длин волн
λ
от 2,5 до 25 мкм. В
единицах волновых чисел ν = 1/λ (cм-1), величин обратных
длинам волн, этот интервал составляет 4000-400cм-1. Именно в этом
диапазоне волновых чисел осуществляют регистрацию ИК-спектров органических и
природных соединений [5].
4. Характеристические частоты групп
Понятие "характеристической частоты группы" обобщает вкратце
эмпирические наблюдения о том, что некоторые группы атомов - функциональные
группы в органических соединениях - приводят к возникновению полос поглощения с
характеристическими частотами. Эти группы ведут себя как бы изолированно и
независимо от остальной части молекулы, так как их частоты поглощения мало
меняются при переходе от одного соединения к другому. В простой двухатомной
молекуле X-Y частота валентного колебания зависит от силы межъядерной связи и
от масс обоих атомов. Поэтому в многоатомных молекулах появление
характеристической частоты (X-Y) возможно при условии, что эта полоса относится
к колебательному движению, принадлежащему лишь этой группировке X-Y. Но это
условие не выполняется совершенно точно, так как при возбуждении основного
колебания все атомы должны находиться в движении, хотя бы и незначительном. В
действительности, остаток молекулы воздействует в небольшой степени (обычно
около 5%) на положение характеристической частоты группы, а направление и
величина сдвига частот имеют большое значение для структурного анализа,
поскольку часто позволяют отнести поглощение к какому-нибудь определенному
варианту функциональной группы. Так, карбонильная группа поглощает, как было
найдено, в области 1820-1620 см-1, но насыщенные и ненасыщенные
ациклические кетоны специфически поглощают около 1720 и 1680 см-1
соответственно. Этот вид эффекта "второго порядка", обусловленный
внутримолекулярными факторами, имеет близкое сходство с "химическим
сдвигом" ядерного магнитного резонанса, проявляемым метальными и
метиленовыми группами. Инфракрасный спектр соединения зависит также от физического
состояния. Эти влияния обычно невелики, но они могут стать большими, если
появляются значительные внутримолекулярные силы, такие как водородная связь; в
этом случае правильное отнесение частот групп требует повышенного внимания
[22].

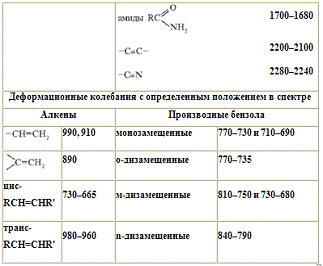
Характеристические частоты поглощения некоторых групп атомов.
4.1 Применение характеристических частот групп
В идеальном случае каждая функциональная группа должна иметь
характеристическую область частот и интенсивностей, и до некоторой степени это
происходит на самом деле. Например, основные колебания несвязанной
гидроксильной группы и вторичного амина (OH) и (NH) поглощают вполне отчетливо
при ~3610 и 3400 см-1 соответственно; группы с тройной связью могут
быть обнаружены по появлению их валентного поглощения в области 2100 см-1,
и хотя эти полосы являются иногда очень малоинтенсивными, они все же
рассматриваются как характеристические, поскольку большинство органических
веществ относительно прозрачно между 2700 и 1800 см-1. На практике
полосы выше 1500 см-1 очень легко приписываются функциональным
группам, таким, как ОН, NH, С=О и С=С, но ниже этой частоты спектр является
более сложным и определяет скорее индивидуальную молекулу, чем ее
функциональные группы. Поэтому при интерпретации инфракрасного спектра удобно
сначала рассматривать область "функциональных групп" (выше 1500 см-1)
и затем так называемую область "отпечатка пальцев" (ниже 1500 см-1).
Это разделение не имеет абсолютного значения, так как значительное число важных
характеристических частот на самом деле появляется ниже 1500 см-1,
оно просто служит первым приближением. Сложность области "отпечатка
пальцев" вытекает из интенсивного колебательного взаимодействия, которое
имеет место между смежными связями С-С, С-N и С-О в молекуле, причем в
результате эти многочисленные "скелетные" колебания представляют
движение всего молекулярного фрагмента и не могут быть приписаны специфическим
структурным единицам. С другой стороны, характеристическая природа частот функциональных
групп обусловлена отсутствием взаимодействия между колебаниями, локализованными
в данной частной группировке, и колебаниями остатка молекулы. Это значит, что
колебательное движение, ответственное за поглощение света с характеристической
частотой, относится главным образом к атомам рассматриваемой группы. Такое
положение может возникнуть в двух случаях: во-первых, всегда, когда легкий
атом, такой как водород или дейтерий присоединен к значительно более тяжелому
атому, такому, как углерод; во-вторых, всегда, когда одна связь в молекуле
намного сильнее, чем соседние связи [16].
5. Регистрация инфракрасных спектров
Современные спектрометры позволяют регистрировать ИК-спектры
газообразных, жидких и твердых образцов. Для получения ИК-спектра органического
или природного соединения необходимо всего от 1 до 10 мг вещества. Регистрация
ИК-спектров осуществляется в кюветах изготовленных из бромида калия KBr или
хлорида натрия NaCl - материалов, не поглощающих ИК-излучение в исследуемом
диапазоне. ИК-спектры принято записывать в виде зависимости пропускания
ИК-излучения (%) от волнового числа ν = 1/λ (см-1). Поэтому максимумы
пиков, отвечающие наибольшему поглощению ИК-излучения, обращены вниз. В
большинстве случаев ИК-спектры органических и природных соединений регистрируют
либо в виде растворов веществ в хлороформе CHCl3, четыреххлористом
углероде CCl4, сероуглероде CS2, либо в виде твердых
прозрачных таблеток, полученных прессованием под давлением мелко размолотой
смеси вещества с бромидом калия. Иногда используют метод съемки ИК-спектра
вещества в виде мелко растертой суспензии в вазелиновом или минеральном масле.
В случае регистрации ИК-спектров соединений в растворах или суспензиях
необходимо вычитать полосы поглощения растворителей или суспендирующей среды.
При интерпретации ИК-спектров веществ, полученных в растворах в CHCl3
и CCl4, нужно учитывать, что в зонах собственного поглощения этих
растворителей отнесение линий спектра может быть неоднозначным. При регистрации
ИК-спектров органических и природных соединений часто наблюдаются линии
поглощения примесей в образцах. Обычно это сигнал воды около 3450 см-1,
колебания диоксида углерода (как примеси из атмосферы) при 2360-2325 см-1.
Иногда образцы загрязнены силиконовыми смазками, имеющими полосы при 1625 см-1
и 1100-1000 см-1, или фталатами, проявляющимися в виде пика 1725 см-1.
Следует помнить, что кюветы для ИК-спектроскопии, изготовленные из KBr и NaCl,
чувствительны к воздействию следов воды и со временем мутнеют и выходят из
строя. Поэтому необходимо тщательно сушить образцы и растворители перед съёмкой
ИК-спектров [9].
6. Спектроскопия в ближней инфракрасной области (БИК)
Спектрометрия в ближней инфракрасной области (БИК спектрометрия, англ.
NIR) - метод, основанный на способности веществ поглощать электро-магнитное
излучение в диапазоне длин волн от 780 до 2500 нм (от 12500 до 4000 см-1).
Поглощение в БИК-диапазоне связано, как правило, с обертонами основных
колебательных частот связей C-H, N-H, O-H и S-H и их комбинациями. Наиболее
информативным диапазоном является область от 1700 до 2500нм (от 6000 до 4000 см-1)
[17].
Анализ информации, извлекаемой из БИК-спектров, проводится с применением
хемометрических алгоритмов, которые требуют создания первичного массива данных.
В рамках применимости метода, БИК-спектрометрия позволяет прямо или косвенно
проводить качественную и количественную оценку химических, физических и
физико-химических характеристик анализируемого объекта, в том числе оценивать
следующие характеристики:
содержание воды и органических растворителей;
гидроксильное и йодное число, степень гидроксилирования;
кристаллическую форму и степень кристалличности;
полиморфную форму или псевдополиморфную форму;
степень дисперсности частиц и другие.
БИК-спектрометрия обладает следующими возможностями:
простота подготовки проб или отсутствие подготовки;
быстрота измерений;
неразрушающий характер анализа;
возможность одновременной оценки нескольких параметров (показателей);
возможность проведения дистанционного контроля, в том числе в
технологических потоках в режиме реального времени.
Приборы. Используют как специализированные БИК-спектрофотометры, так и
другие спектрофотометры, способные работать в ближней ИК-области спектра.
БИК-спектрофотометры состоят из:
источника излучения, например, кварцевой лампы (лампы накаливания) или ее
аналога;
монохроматора (дифракционная решетка, призма, оптико-акустический фильтр)
или интерферометра (спектрофотометры с Фурье-преобразованием);
устройства размещения образца и/или дистанционного оптоволоконного
датчика.
Для размещения образцов используют стеклянные или кварцевые кюветы, флаконы,
стеклянные стаканы, держатели капсул или таблеток и другие приспособления.
Спектрофотометры могут быть оснащены кюветным отделением, интегрирующей сферой
(интегрирующая сфера представляет собой оптический компонент, состоящий из
сферической полости с покрытием из хорошо отражающего материала, сфера
предназначена для получения спектров неоднородных образцов), внешними модулями
для измерения пропускания сильно рассеивающих образцов, устройствами
автоматической подачи образцов, оптоволоконными зондами. Выбор того или иного
приспособления для анализа зависит от типа образца и выбранного способа
измерения. Поэтому рекомендованы к использованию приборы, реализующие несколько
подходов к измерению. Обработка данных и анализ полученных результатов
проводится с использованием специального программного обеспечения. Для каждого
режима измерения (пропускание, диффузное отражение и их комбинация) должна быть
предусмотрена своя методика поверки, включающая проверку правильности установки
длин волн и поверку фотометрического шума.
Проверка правильности установки длин волн. Для проверки правильности
установки длин волн регистрируют спектр стандартного образца, имеющего
характеристические максимумы и минимумы поглощения и сравнивают полученные
значения длин волн с заявленными характеристиками. Для режимов пропускания и
отражения для определения правильности установки длин волн наиболее
распространено в качестве стандартных образцов использовать оксиды
редкоземельных элементов, пары воды в атмосфере, метиленхлорид и другие. В
приборах с Фурье-преобразованием шкала волновых чисел линейна во всем рабочем
диапазоне и для проверки точности установки достаточно использования одного
стандартного образца с контролем заявленных характеристик по одной полосе
поглощения. Приборы других типов могут иметь нелинейный характер шкалы волновых
чисел и требуют проверки заявленных метрологических характеристик не менее чем
по трем пикам (один или несколько стандартных образцов) с охватом всего
рабочего диапазона. Погрешность при установке длин волн должна быть не более
±1нм (или эквивалентная ему величина волнового числа) в диапазоне длин волн до
1900 нм и не более ±1,5 нм для диапазона длин волн ≥1900 нм.
Воспроизводимость установки длины волны должна соответствовать
требованиям завода-изготовителя или требованиям нормативных документов,
действующих на территории Российской Федерации.
Проверка фотометрической линейности. Для проверки фотометрической
линейности регистрируют БИК-спектры стандартных образцов с известными
значениями пропускания/отражения и строят графическую зависимость полученных
значений пропускания/отражения от известных значений. Результатом построения
такой зависимости должна являться прямая линии с пересечением в центре
координат (0,00 ± 0,05) и тангенсом угла наклона прямой (1,00 ± 0,05). Для
проверки фотометрической линейности в режиме отражения в качестве стандартных
образцов используются полимеры, допированные углеродом или аналоги в количестве
не менее 4 образцов в диапазоне значений отражения 10-90 %. Для проверки фотометрической
линейности в режиме пропускания в качестве стандартных образцов используют
фильтры в количестве 3 образцов со значениями пропускания 10-90 % и линию 100 %
пропускания (регистрируют спектр пропускания пустого канала). Проверка
фотометрического шума. Для оценки фотометрического шума при измерении
пропускания записывают линию 100 % по воздуху; при измерении отражения
регистрируют линию 100 % с применением подходящих стандартных образцов с
отражающей способностью не менее 99 %. При этом под линией 100 %
подразумевается измерение, при котором стандартный образец является измеряемым
образцом и фоном одновременно. При высоких значениях поглощения проводят оценку
фотометрического шума с применением стандартных образцов со значениями
пропускания или отражения около 10 %. Фотометрический шум должен
соответствовать требованиям спецификации производителя.
Способы измерения. БИК-спектр представляет собой зависимость
соответствующей фотометрической величины (оптической плотности (А), пропускания
(Т), коэффициента отражения (R) и производных величин) от длины волны или
частоты излучения. При измерениях в БИК-области реализуются следующие способы:
измерение поглощения (или пропускания) при прохождении излучения через
образец;
измерение излучения, отраженного или рассеянного от образца;
комбинация вышеуказанных способов.
Измерения всегда проводят относительно фона.
Измерение пропускания. Пропускание является мерой снижения интенсивности
излучения при прохождении через образец. Этот принцип реализован в большинстве
используемых спектрофотометров, и результат может быть представлен
непосредственно в единицах пропускания (T) и/или оптической плотности (A). В
качестве фона используют спектр воздуха или среды сравнения. Способ применим
для твердых и жидких проб, в том числе для дисперсных систем. Специальной
подготовки проб при измерении пропускания, как правило, не требуется. Для
измерения спектра жидких образцов используют флаконы или кюветы с подходящей
длиной оптического пути (обычно 0,5-22 мм), а также оптоволоконные датчики на
пропускание. Диффузное отражение. В методе диффузного отражения измеряют
коэффициент отражения (R), представляющий отношение интенсивности света,
отраженного от образца (I), к интенсивности света, отраженного от фона, или
обратную логарифмическую величину этого отношения (АR).
В качестве фона используют поверхность с высокой величиной R: пластины из
золота, перфторированных насыщенных полимеров, керамические пластины и другие
подходящие материалы. Способ используется для анализа твердых образцов с
применением интегрирующей сферы или оптоволоконных датчиков, работающих в
режиме отражения. В последнем случае, для воспроизводимости получаемых
результатов, необходимо обеспечить стабильность условий проведения измерений, в
частности относительную неподвижность датчика, степень нажатия и другие
условия. Способ пропускания-отражения. Данный способ является комбинацией
пропускания и отражения благодаря специальной конструкции кювет и датчиков, в
которых излучение дважды проходит через образец, что позволяет анализировать
образцы с низкой поглощающей и рассеивающей способностью.
В качестве фона используют спектр воздуха или среды сравнения.
Способ применим для жидких, в том числе негомогенных проб.
Для регистрации спектра исследуемый образец помещают в кювету с зеркалом
или другим диффузным отражателем. Возможно использование оптоволоконного
датчика, который погружают в образец.
Факторы, влияющие на результаты измерений.
Температура образца. Температура образца может влиять как на его
пропускание, так и на его отражение. Контроль температуры важен при анализе
термически лабильных объектов, в случае которых разница в несколько градусов
может приводить к существенным спектральным изменениям: твердые образцы,
содержащие воду, дисперсные системы, аморфные объекты и прочее.
Влага и остаточные количества растворителей. Наличие воды и остаточных
количеств растворителей может оказать влияние на характер спектра и результаты
анализа. Необходимость и условия высушивания должны быть указаны в частных
фармакопейных статьях.
Толщина образца определяет степень пропускания. С увеличением толщины
слоя наблюдается увеличение поглощения. Поэтому при сравнительных измерениях
пропускания толщина образца должна быть одинаковой или учитываться. При
измерении отражения толщина слоя не имеет принципиального значения, но нужно
учитывать, что толщина слоя должна быть сопоставимой с глубиной проникновения
луча в образец. В случае недостаточной толщины, за образцом ставится
дополнительный рефлектирующий материал, например штамп с золотым покрытием.
Оптические свойства образца. При анализе твердых образцов необходимо
обеспечивать максимально возможную однородность пробы, так как различия в
плотности или размерах частиц сказываются на характере спектра. Спектры
физически, химически или оптически гетерогенных образцов следует регистрировать
либо с увеличенным размером пучка света, либо используя устройства, вращающие
образцы во время измерений. При этом желательно проводить измерения каждого
образца несколько раз с последующим усреднением спектров.
Полиморфизм. Разница в кристаллической структуре (полиморфизм) оказывают
влияние на спектр, что позволяет отличать друг от друга кристаллические или
аморфные формы на основании их БИК-спектра. При проведении анализа необходимо
учитывать, эталонный спектр, какой кристаллической структуры (модификации)
используется в методе анализа.
Возраст образцов. Свойства образцов могут изменяться во времени, и эти
изменения могут обуславливать спектральные различия для одних и тех же
образцов. Данные изменения должны быть учтены при построении калибровочных
моделей, как для целей идентификации, так и для целей количественного анализа.
Идентификация.
Идентификация в БИК-спектрометрии основана на принципе идентичности
спектров одного и того же вещества. Для проведения идентификации первоначально
создают библиотеку эталонных спектров (далее по тексту "библиотека"),
подбирают оптимальную математическую модель для обработки спектров и реализации
алгоритмов их сравнения, то есть создают метод идентификации. Далее проводят
валидацию библиотеки в совокупности с выбранной математической моделью (см.
раздел "Валидация метода идентификации"). Идентификацию проводят
путем сравнения спектра испытуемого образца со спектрами в библиотеке (см.
раздел "Анализ данных"). Создание библиотеки спектров. Библиотека
содержит совокупности спектров, несущие характеристическую информацию о каждом
объекте анализа. Для каждой совокупности спектров при помощи соответствующих
методов и алгоритмов определяют оптимальные параметры идентификации. Данные установки
действительны для всей библиотеки. Для близких объектов, неразличимых при
заданных установках, создаются подбиблиотеки, в которых могут быть использованы
другие методы предварительной обработки спектров и алгоритмы анализа.
Количество спектров в библиотеке не ограничивается, но при большом их
количестве идентификация химически сходных веществ затрудняется. В библиотеку
включают спектры веществ, соответствующих предъявляемым требованиям,
подлинность которых подтверждена иными фармакпейными методами. Для учета
возможных вариаций свойств каждого вида анализируемых объектов регистрируют
спектры нескольких партий (серий). Регистрацию спектров проводят при соблюдении
схожести условий измерений и первичной обработки, которые предварительно
оптимизированы для всех анализируемых объектов и сохраняются постоянными при
последующих измерениях. В библиотеку не включают спектры, являющиеся случайными
выбросами. Методы предварительной обработки спектров. Рекомендуется
предварительная обработка спектров с целью повышения информативности получаемых
результатов и уменьшения влияния спектральных вариаций. Обработка первичных
данных может включать вычисление первой или второй производной, векторную
нормализацию, мультипликативную коррекцию рассеивания и другие методы, включая
комбинированные. Следует учитывать, что математическая обработка может привести
к потере информации или появлению ошибок-артефактов. Выбор математической
модели и алгоритмов должен быть обоснован.
Анализ данных. Сравнение спектров испытуемых образцов при идентификации
проводится с индивидуальными или усредненными спектрами в библиотеке, например,
путем корреляционного анализа. Метод идентификации должен быть валидирован.
Валидация метода идентификации призвана продемонстрировать его пригодность для предусмотренного
анализа. Валидация метода предполагает проверку показателей специфичности и
устойчивости. Специфичность показывает, что каждый объект, спектр которого
содержится в библиотеке, будет положительно идентифицирован и будет отличаться
от других объектов, при этом объекты, не включенные в библиотеку,
идентифицируются отрицательно. Устойчивость показывает, что незначительные
изменения условий (например, температура, влажность воздуха, вибрации,
температура образца, степень уплотнения материала, глубина погружения зонда,
толщина слоя и т. д.) не влияют на результаты и надежность идентификации.
Количественный анализ.
Разработка методики (калибровка). При разработке методики для
количественного анализа (калибровки), изменения интенсивности поглощения или
отражения в спектре коррелируются с изменениями свойств и/или состава веществ.
При этом регистрируют спектры образцов с известными значениями их химического
состава и/или их свойств, подтвержденными иными фармакопейными методами. Так
как хемометрические алгоритмы не допускают экстраполяций, необходимо, чтобы
область калибровочных концентраций была больше, чем ожидаемый диапазон
анализируемых концентраций или свойств. Калибровочные образцы, по возможности,
должны быть равномерно распределены внутри диапазона рабочих концентраций.
Регистрацию спектров проводят при соблюдении параметров эксперимента, факторов,
влияющих на результаты измерений и первичной обработки, которые предварительно
оптимизированы для всех анализируемых объектов и сохраняются постоянными при
последующих измерениях. В библиотеку не включают спектры, являющиеся случайными
выбросами. Калибровочную модель оптимизируют при помощи подходящего способа
предварительной обработки спектров, выбора спектральной области и
математического алгоритма.
Методы предварительной обработки спектров. Проводят так же, как описано в
разделе "Идентификация". Выбор математической модели и алгоритмов
должен быть обоснован.
Анализ данных. Для калибровки может использоваться любой обоснованный
математический алгоритм. Так как в области ближнего ИК-диапазона наблюдается
сильное перекрывание полос поглощения, количественный анализ проводят с
реализацией преимущественно хемометрических алгоритмов, например таких, как
метод частных наименьших квадратов (МЧНК, англ. PLS), метода регрессии на
главные компоненты (МРГК, англ. PCR) и других.
Валидация калибровочной модели. Валидация модели калибровки предполагает
демонстрацию ее пригодности для решения поставленной задачи. При этом должны
быть оценены такие показатели, как специфичность (селективность), линейность,
рабочий диапазон концентраций (аналитическая область), правильность,
прецизионность и устойчивость.
Для демонстрации специфичности существуют следующие подходы:
выбранный спектральный диапазон или полоса поглощения связана с
анализируемым свойством объекта (например, концентрация, содержание влаги и т.
д.) и коррелирует с фотометрической величиной;
демонстрируется, что изменения в составе плацебо в пределах рабочего
диапазона концентраций не оказывают существенного влияния на результаты
количественного измерения определяемого образца;
допускаются другие обоснованные подходы.
При валидации линейности должно быть показано, что результаты, полученные
методом БИК с реализацией выбранного алгоритма обработки, сопоставимы с результатами,
полученными другим стандартным методом. В качестве критерия приемлемости может
быть выбран коэффициент детерминации (r2), коэффициент корреляции (r) или иной
критерий, определяющий пригодность калибровочного метода. Диапазон рабочих
концентраций определяет интервал, в котором соблюдаются заявленные
валидационные показатели. Результаты испытаний, выходящие за пределы данного
диапазона, являются неприемлемыми. Правильность методики должна доказывать
отсутствие значимой систематической погрешности или обоснованность поправочных
коэффициентов, вводимых в расчеты при ее наличии. Правильность оценивается
путем сопоставления результатов, полученных с использованием модели калибровки
и результатов, полученных стандартным методом. Прецизионность описывает степень
рассеивания результатов анализа. При этом должна быть оценена как
внутрилабораторная, так и межлабораторная прецизионность. Устойчивость методики
количественного анализа показывает, что незначительные изменения условий не
влияют на результаты количественного определения.
Выбросы. При анализе методом БИК следует учитывать, корректировать или
обоснованно исключать резко выделяющиеся результаты как внутри рабочего
диапазона, так и вне данного диапазона. Выбросы, находящиеся в пределах
рабочего диапазона, подлежат дальнейшему исследованию и, в случае их
информативной важности, могут быть включены в модель. Выбросы, находящиеся вне
калибровочного диапазона, также подлежат анализу. Если полученные результаты
подтверждены стандартным методом, спектры таких проб могут быть внесены в
калибровочную модель с последующей ревалидацией метода.
Ревалидация. Прошедший валидацию и признанный пригодным для применения
БИК-метод идентификации или количественного анализа нуждается в последующей
периодической валидации (ревалидации). При установлении отклонений необходима
корректировка метода. Необходимость ревалидации зависит от характера изменений.
БИК-метод нуждается в ревалидации, если:
в библиотеку добавляется новый объект (для качественного анализа);
есть предпосылки к изменению характеристик объектов, спектры которых уже
включены в библиотеку (изменение технологии производства
(синтеза), состава, качества исходного сырья упаковки и т. д.);
обнаружены иные изменения и/или несоответствия в свойствах анализируемых
объектов или методике.
Перенос методик. При переносе методик идентификации и количественного
анализа с одного прибора на другой должны учитываться спектральные
характеристики используемых спектрофотометров (разрешение, диапазон волновых
чисел и др.). Спектрофотометры с высокой фотометрической точностью и точностью
по волновому числу (например, Фурье-спектрофотометры), позволяют осуществить
прямой перенос методов как качественного, так и количественного анализа без
дополнительных манипуляций. Если прямой перенос невозможен, применимы различные
математические способы для переноса моделей. После перенесения методов
необходима их ревалидация.
Хранение данных. Хранение данных осуществляется в электронном виде в
соответствии с требованиями программного обеспечения. При этом необходимо
сохранять исходные спектры, не подвергшиеся математической обработке, с целью
их возможного дальнейшего использования при оптимизации библиотек или методов
[7].
Ряд исследований демонстрирует широкие возможности БИК-спектроскопии в
отношении установления подлинности фармацевтических субстанций и лекарственных
препаратов. Более того, в ряде случаев при соответствующей калибровке методик
возможно также и установление происхождения (производителя) ЛС. Одним из
основных преимуществ данного метода является практически отсутствующая
пробоподготовка. Более того, в ряде случаев субстанции и препараты можно
сканировать через упаковку. Диффузная отражательная спектроскопия в ближней
ИК-области спектра является уникальным физическим методом, позволяющим
осуществлять определение значительного числа показателей в продуктах сложного
химического строения. Приборы, основанные на этом методе (ИК-анализаторы) и
представляющие собой спектрометры нового поколения, являются наиболее
перспективными экологически безопасными приборами для экспрессного определения
широкого диапазона показателей качества пищевых и сельскохозяйственных
продуктов и материалов. Слабая абсорбция в ближней ИК-области и использование
диффузного отражения от анализируемой пробы делает возможным прямой анализ
продукта, что практически исключает сложную пробоподготовку и существенно
увеличивает измеряемые концентрации [10].
7. Cпектроскопия с преобразованием Фурье
Фурье-спектроскопия - метод оптической спектроскопии, позволяющий
получать спектр в результате обратного Фурье-преобразования интерферограммы
исследуемого излучения, зависящей от оптической разности хода двух лучей и
представляющей собой Фурье-образ спектра (функцию распределения энергии
излучения по частоте) [13].
Комплекс аппаратуры, выполняющий эти операции, называется
Фурье-спектрометром (ФС). В него, как правило, кроме двухлучевого
интерферометра входят осветитель, детектор излучения, усилитель,
аналогово-цифровой преобразователь и ЭВМ.
Интерферометр содержит два взаимно перпендикулярных зеркала - неподвижное
и подвижное, и полупрозрачную светоделительную пластину, расположенную в месте
пересечения падающих пучков излучения и пучков, отраженных от обоих зеркал.
Пучок излучения от источника, попадая на пластину, разделяется на два. Один из
них направляется на неподвижное зеркало, второй - на подвижное зеркало; затем
оба пучка, отразившись от зеркал, выходят через светоделитель из интерферометра
в одном и том же направлении. Далее излучение фокусируется на образце и
поступает на детектор излучения. Два пучка отличаются друг от друга оптической
разностью хода, величина которой меняется в зависимости от положения подвижного
зеркала. В результате интерференции пучков интенсивность результирующего
светового потока периодически меняется (модулируется). Частота модуляции
зависит от частоты падающего излучения и смещения подвижного зеркала [12].
Будучи значительно сложнее обычных спектрометров, Фурье-спектрометры
обладают рядом преимуществ над другими спектральными приборами.
С помощью ФС можно регистрировать одновременно весь спектр. Благодаря
тому, что в интерферометре допустимо входное отверстие больших размеров, чем
щель спектральных приборов с диспергирующим элементом такого же разрешения,
Фурье- спектрометры по сравнению с ними имеют выигрыш в светосиле, что
позволяет: уменьшить время регистрации спектров; увеличить отношение сигнал-шум
(так называемое "преимущество Фелгетта"); повысить разрешение;
уменьшить габариты прибора.
Все ИК - спектрофотометры независимо от конструкции имеют общие элементы:
источник излучения, оптическую систему, приемник, систему усиления сигнала.
Источники излучения. Идеальным источником для ИК - спектроскопии был бы
монохроматический излучатель высокой интенсивности, непрерывно перестраиваемый
в широком частотном интервале. Несмотря на то, что существуют лазеры с
перестраиваемой частотой, в настоящее время наиболее распространенными являются
нагреваемые до температуры 1200 - 1400 К источники с широкой областью
излучения: глобар (карбид кремния), штифт Нернста (оксиды циркония, тория,
иттрия), нихромовая спираль, платиновая проволока с керамическим покрытием. В
дальней ИК области используется излучение стенок ртутной лампы низкого
давления. Излучательная способность тепловых источников подчиняется закону
Планка для излучения абсолютно черного тела. Ведутся исследования по применению
терагерцового излучения (субмиллиметровый диапазон) в спектроскопии.
Оптические системы. Назначение оптической системы - направлять излучение
источника по нужному пути с минимальными потерями. Использование отражательных
зеркал с наружным покрытием (напыленный алюминий, просветляющие покрытия)
позволяет избежать хроматической аберрации. Отражательная оптика может иметь
плоские, сферические, параболические, эллиптические или тороидальные поверхности.
Разработано большое число типов оптических систем спектрофотометров.
Классические схемы спектральных приборов рассмотрены в специальной литературе
Приемники излучения. Приемники ИК излучения делятся на две группы:
тепловые и фотоэлектронные. Первая группа включает термоэлементы (термопары),
болометры (сопротивления с большим температурным коэффициентом), пневматические
приемники, пироэлектрические приёмники. Пироэлектрические детекторы (на основе
триглицинсульфата (NH2CH2COOH)3 H2SO4) используются в интерферометрах из-за их
высокой чувствительности в широкой ИК области. В основе работы фотоэлектронных
полупроводниковых приемников, к которым относятся фоторезисторы и фотодиоды,
лежит явление внутреннего фотоэффекта. В ближнем ИК диапазоне наиболее
распространены фотодиоды на основе германия и твёрдого раствора InGaAs. В
среднем ИК диапазоне применяются охлаждаемые жидким азотом фотодиоды на основе
твёрдого раствора HgCdTe (MCT Mercury-Cadmium-Tellurium). Полупроводниковые
детекторы для работы в низкочастотной области требуют охлаждения до низких
(азотных или гелиевых) температур. Ширина запрещённой зоны определяет
длинноволновую границу чувствительности фотоэлектронных приёмников.
Оптические материалы. Так как обычные оптические стёкла поглощают среднее
и длинноволновое ИК излучение, то в качестве материалов для изготовления окон
кювет и светоделителей используют монокристаллы различных солей. В
спектроскопии внутреннего отражения применяют материалы с высокими показателями
преломления. Некоторые особенности и преимущества спектроскопии с
преобразованием Фурье заключается в том, что в классических спектрофотометрах
регистрация спектра производится во времени при последовательном движении
выходящего из монохроматора спектра по выходной щели. Этот процесс называется
сканированием по волновым числам. Спектрометры с преобразованием Фурье
принадлежат к типу многоканальных приборов, что приводит к значительному
снижению энергетических потерь. Фелжетт и Жакино независимо друг от друга
показали, что восстановление спектра с помощью Фурье-преобразования
интерферограммы имеет большое преимущество перед последовательной, поэлементной
регистрацией того же самого спектра. Используя один приемник, можно исследовать
все спектральные элементы одновременно, подобно тому, как это делается в случае
фотографической регистрации спектров. В связи с этим Фелжетт и назвал метод
"мультиплексспектрометрией" [20].
8. Методы и приемы подготовки проб в ИК спектроскопии
Разнообразие приемов подготовки проб для съемки ИК-спектров почти
беспредельно, и исследователь должен выбрать один из них, наилучшим образом
подходящий для решения конкретной проблемы с учётом свойств исследуемого
объекта. Здесь представлены некоторые основные приёмы пробоподготовки.
В связи с тем что физическое состояние образца может сильно влиять на его
ИК-спектр, целесообразно заранее определить иерархию используемых приемов
Последовательность их применения определяется поставленными перед
исследователем задачами. Например, в лаборатории, проводящей химические работы
общего характера, спектры жидких нелетучих проб целесообразно снимать в виде
жидких плёнок или раздавленных между солевыми пластинками капель. ИК спектры
летучих жидкостей регистрируют в тонких кюветах или в виде растворов, если
вещество растворимо, при этом необходимо учитывать собственное поглощение
растворителя. Для органических порошкообразных веществ логична следующая
последовательность: 1) суспензия в вазелиновом масле (или другом разбавителе),
2) таблетка с КВr или спектр диффузного отражения, 3) раствор, 4) пиролизат.
Такие методы, как нарушенное полное внутреннее отражение (НПВО), обычно
оставляют для исследования специальных случаев (например, полимерных
материалов) [9].
Жидкие пробы. Одним из простейших приемов приготовления образцов является
метод жидкой пленки. Он применяется для получения качественных обзорных
спектров нелетучих, нереакционноспособных, нерастворимых жидкостей. Капля
вещества сжимается между двумя солевыми пластинками или помещается на плоскую
стеклянную поверхность, а затем "вытирается" солевой пластинкой.
Желательно, чтобы в пределах сечения светового луча спектрометра толщина
образца была более или менее одинаковой, без воздушных пузырьков. Очевидно, что
спектры, полученные таким путем, не очень воспроизводимы, и не пригодны для
количественной обработки (толщина поглощающего слоя неизвестна). Для получения
спектров растворимых в летучих растворителях смол или лаков тонкий слой
соответствующего раствора, нанесенного на солевое окно, аккуратно высушивают
под тепловой лампой, феном или в вакуумном эксикаторе, добиваясь полного
удаления растворителя. В некоторых случаях исследователи предпочитают
приготовление проб в виде растворов, хотя этот метод более трудоемок, чем
другие, его преимущество заключается в высокой воспроизводимости и в
возможности выполнять количественные измерения.
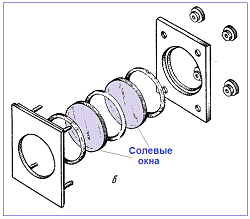
Рис.9. Разборная жидкостная кювета
Требования к растворителям. Выбор растворителя всегда является
результатом компромисса. Так как все стандартные органические растворители
имеют ИК спектры, то необходимо выбирать те из них, в которых вещество
достаточно хорошо растворимо и которые имеют окна прозрачности в аналитических
областях спектра. Растворитель должен быть химически инертным, поддаваться
очистке и осушке. В тех областях спектра, где пропускание растворителя падает
ниже 30%, чувствительность измерений будет понижена, а шумы и погрешности
измерений будут возрастать.
Выбор концентрации. Большинство органических веществ дает приемлемые
спектры в области 625 - 4000 см-1 в кювете толщиной 0,1 мм при
концентрациях около 1 г /10 мл. При работе ниже 600 см-1 могут
понадобиться более высокие концентрации. В случае сильнопоглощающих фтор- или
кремнийорганических соединений концентрация может быть снижена до 0,2 г /10 мл.
Для содержащих полярные группы соединений нужно иметь ввиду возможность
проявления в спектрах межмолекулярных взаимодействий (например, водородных
связей).
Толщина поглощающего слоя. На выбор толщины кюветы может влиять
количество имеющегося в распоряжении образца или его растворимость. Очень
тонкие кюветы (<0,05 мм) трудно изготавливать, заполнять и опорожнять, а в
кюветах толщиной более 0,2 мм поглощение растворителя может оказаться слишком
сильным. Удобными для работы являются кюветы толщиной 0,1 мм. В специальных
случаях для анализа следовых количеств в узких областях высокой прозрачности
растворителя могут использоваться кюветы с толщиной поглощающего слоя до 1см.
Перед приготовлением образца с большой толщиной поглощающего слоя, необходимо
проверить, пропускание растворителя и убедиться в его чистоте.
Определение толщины кювет основано на том, что в спектре пустой чистой
кюветы с плоско- параллельными окнами наблюдаются регулярные максимумы и
минимумы, обусловленные интерференцией
Водные растворы. Из-за очень сильного поглощения жидкой воды в ИК
области, применение водных растворов ограничено такими специальными областями,
как биологические исследования. Использование жидкостных кювет толщиной менее
10 мкм из водостойких материалов - Ge, Si, Zn, Se позволяет проводить
исследования в значительной части области "отпечатков пальцев". Так
как при дейтерировании частоты колебаний смещаются в область низких волновых
чисел, то иногда в качестве растворителя используют тяжёлую воду.
Твердые вещества.
Сложности приготовления образцов твердых веществ, которые нерастворимы в
обычных растворителях для ИК-спектроскопии, чаще всего возникают при их
растирании до мелкодисперсных порошков, образующих суспензии (взвеси - mulls) в
вазелиновом масле или КВr.
В обоих случаях цель состоит в создании однородного распределения частиц
в луче, снижении рассеяния и в улучшении пропускания света взвешенными
частицами в среде, имеющей близкий с образцом показатель преломления
(иммерсия).
Рис. 10. Прохождение света через рассеивающую среду: а) без иммерсионной
жидкости, б) в присутствии иммерсионной жидкости (например, вазелинового
масла).
Размер растертых частиц должен быть меньше длины волны ИК-излучения. Для
этого малое количество вещества (обычно не более 0,5 -2 мг) растирают в тонкий
порошок, смешивают с вазелиновым маслом, полученную однородную пасту аккуратно
наносят на солевое окно и раздавливают в тонкий слой вторым окном. При плохом
растирании спектры получаются неразрешенными и иногда искаженными из-за эффекта
Христиансена (влияет дисперсия показателя преломления в области полосы
поглощения).
Таблетки с КВr. Метод взвесей в КВr, называемый еще методом прессования
таблеток, впервые предложен в 1952 г. Он заключается в тщательном перемешивании
тонкоизмельченной пробы с порошком КВr (или другим галогенидом щелочного
металла) с последующим прессованием смеси в пресс-форме, в результате чего
получается прозрачная или полупрозрачная таблетка. Наилучшие результаты
достигаются при откачке пресс-формы, что позволяет избавиться от включений
воздуха в таблетки. Преимущества метода прессования таблеток следующие: 1)
отсутствие большинства мешающих полос поглощения, 2) возможность контроля за
концентрацией образца, 3) удобство хранения образцов. К недостаткам метода
относят: 1) возможность изменения кристаллической структуры полиморфных веществ
в процессе растирания и прессования, 2) проявление в спектрах адсорбированной
воды всегда имеющейся в некотором количестве в гигроскопичном КВr (1640 и 3450
см-1), 3) в некоторых случаях возможно химическое взаимодействие КВr с
веществом пробы (например, с металлоорганическими соединениями).
Диффузное отражение применяется для получения ИК спектров порошкообразных
веществ, особенно, в ближней области спектра. При использовании специальных
приставок для Фурье-спектрометров методика оказалась полезной для
количественного анализа, в частности, лекарственных препаратов.
· Пиролиз. Когда все попытки получить ИК спектр терпят неудачу,
трудные образцы подвергают пиролизу или сухой перегонке с последующим анализом
ИК спектров летучих продуктов. Во многих случаях спектры пиролизатов похожи на
спектры исходных соединений. Этим способом можно идентифицировать, например,
полиуретаны.
· Существуют приставки к Фурье-спектрометрам, позволяющие
регистрировать ИК спектры хроматографических фракций по мере их выхода из
газового хроматографа.
· Кюветы с алмазными окнами. Для исследования свойств твердых
тел и фазовых переходов в них требуется регистрация ИК спектров при высоких, до
10000 атм давлениях. В настоящее время не являются экзотикой кюветы с
прозрачными в ИК области окнами из природных алмазов типа IIa (алмазные
наковальни). Оптическое отверстие такой кюветы невелико и для ее использования
может понадобиться специальный микроосветитель - световой конденсор.
· Спектроскопия внутреннего отражения. Среди приемов
пробоподготовки особое место занимает спектроскопия нарушенного полного
внутреннего отражения. Этот метод широко применяется для получения спектров
поверхности "неудобных" объектов таких как наполненные смолы,
композиционные материалы, сырая резина или пищевые продукты. Он основан на
поглощении поверхностным слоем исследуемой пробы электромагнитного излучения,
выходящего из призмы полного внутреннего отражения, находящейся в оптическом
контакте с изучаемой поверхностью. Для регистрации спектров НПВО необходимы
специальные приставки, которые размещают в кюветном отделении стандартного
спектрометра. Спектры НПВО практически идентичны обычным спектрам поглощения
(рис. 11).
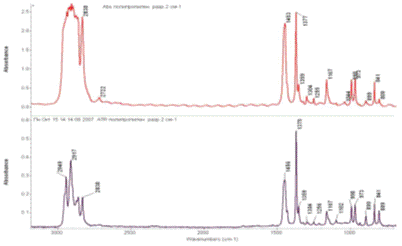
Рис.11. ИК спектры полипропиленовой плёнки - вверху спектр поглощения,
внизу спектр НПВО
Газы
В простейших случаях особых проблем при подготовке газообразных проб не
возникает. В случае агрессивных газов и паров для изготовления кюветы следует
использовать специальные материалы. В качестве окон можно использовать листовой
полиэтилен. Прокладки лучше использовать из таких инертных материалов, как
витон или тефлон, поскольку другие материалы могут загрязнять образцы из-за
адсорбции и десорбции.
Для уменьшения влияния уширения полос за счет соударений давление в
кюветах обычно доводят до атмосферного сухим азотом. Такая процедура
увеличивает чувствительность к следовым количествам составных частей, а также
позволяет проводить количественные измерения.
В тех случаях, когда требуется высокая чувствительность, как, например,
при исследованиях загрязнений атмосферы, очень полезны многоходовые газовые кюветы
с большой длиной оптического пути. Промышленность выпускает газовые кюветы с
длиной оптического пути до 120 м, а в литературе есть сообщения о специальных
кюветах с общей длиной пути до 1 км, что позволило достичь чувствительности 0,1
- 1 частей на миллиард. Следовые количества вредных и ядовитых паров,
содержащихся в атмосфере, можно адсорбировать на древесном угле в адсорбционных
трубках, а затем элюировать растворителем для идентификации по ИК-спектру.
Охлаждение угля до температуры жидкого азота повышает эффективность определения
до 80 - 100% [20].
9. Аппаратура
ИК-спектроскопии
Вся ИК-область условно делится на ближнюю в диапазоне волновых чисел
4000-12500 см-1, в которой наблюдается электронные и колебательные
переходы; основную и среднюю от 625 до 4000 см-1, связанную в
основном с колебаниями молекул; и дальнюю от 50 до 625 см-1, в
которой наблюдаются вращательные переходы, колебания в тяжелых молекулах, в
ионных и молекулярных кристаллах, некоторые электронные переходы в твердых
телах, крутильные и скелетно-деформационные колебания в сложных молекулах,
например, в биополимерах. В настоящее время наибольшее развитие получила
спектроскопия в средней ИК-области, в которой работает большинство серийных
приборов [15].
Общая конструкция ИК-спектрометра включает: источник излучения,
диспергирующую систему (монохроматор) и регистрирующий элемент (детектор).
Специфика ИК-излучения приводит к особенностям в устройстве каждого элемента.
|
Область спектра
|
ν, см-1
|
λ, мкм
|
Применение
|
|
Ближняя
|
12500-4000
|
0,8-2,5
|
Качественный и количественный анализ на Н-содержащие
функциональные группы, множество сорбентов основных частот из средней
ИК-области.
|
|
Средняя
|
4000-625
|
2,5-16,7
|
Колебательная или основная ИК-область. Типичные линии
поглощения функциональных групп, главным образом в диапазоне 1400-4000 см-1,
а диапазон 600-1400 называют область "отпечатков пальцев".
|
|
Дальняя
|
625-30
|
16,7-330
|
Область колебаний с малой энергией, в особенности у
неорганических и металлорганических соединений. Исследование скелетных и крутильных
колебаний, а также колебаний решетки твердых тел.
|
Источник излучения в ИК-спектрометре должны перекрывать большой интервал
длин волн. Из них наиболее распространены стержни из карбида кремния (глобар)
или из оксидов редкоземельных элементов (штифт Нернста), нагреваемые током до
1500 и 800 С. Кривая интенсивности излучения этих источников имеет вид кривой
излучения абсолютно черного тела. Они дают мощное ИК-излучение, но
преимущественно в ближней ИК-области и быстро падающее с увеличением длины волны
(это изменение мощности компенсируется программированным раскрытием входной
щели прибора). В длинноволновой части ИК-спектра применяют ртутно-кварцевые
лампы высокого давления.
Рис. 12. Стержень из карбида кремния (а) (глобар) и Штифт Нернст

Рис. 13. Ртутно-кварцевые лампы высокого давления
В монохроматоре диспергирующими элементами могут служить призмы в
ИК-области материалов с подходящей дисперсией или дифракционные решетки. Призмы
из стекла или кварца неприменимы, поскольку не пропускают ИК-излучение, и
обычно используют призмы, изготовленные из некоторых солей. От призм требуется
достаточно большая диспергирующая способность, но она падает с уменьшением
длины волны. Так призма из NaCl обеспечивает точность около 2 см-1 в
области 650 см-1 и около 30 см-1 в области 3000 см-1.
Поэтому обычно используют 3-4 сменных призмы из монокристаллов LiF, NaCl, KBr.
Дисперсия материала призмы обычно сильно меняется с температурой, поэтому необходимо
термостатирование прибора. Солевую оптику следует беречь от повышенной
влажности.
В настоящее время все чаще в качестве диспергирующих элементов применяют
дифракционные решетки. У них больше дисперсия, которая мало зависит от длины
волны и почти не зависит от температуры, но решетки могут давать наложение
спектров высших порядков, что требует использования в приборе хороших
спектральных фильтров.

Рис. 14. Дифракционная решетка
Детектирование ИК-излучения основано преимущественно на тепловом его
действии. Для средней ИК-области в качестве приемников излучения применяют
чувствительные термопары (термостолбики) и термометры сопротивления
(болометры), покрытые чернью. Используют также пневматические приемники (ячейка
Голея), в которых газ в зачерненной камере с гибкой стенкой меняет давление под
действием излучения. В длинноволновой области применяют также другую группу
приемников: фотонные приемники с фотопроводимостью.
Среди ИК-спектрометров наиболее распространены диспергирующие сканирующие
приборы, в которых спектры последовательно сканируются и регистрируются с
помощью одноканального приемника. По схеме освещения такие приборы бывают
однолучевыми и двулучевыми. В однолучевых спектрометрах для освещения щели используют
одно сферическое зеркало.
Теперь чаще используют двухлучевую систему, которая позволяет выравнивать
фон, то есть линию полного пропускания, и компенсировать как поглощение
атмосферными Н2О и СО2 так и ослабление пучков окнами
кюветы и растворителем. Упрощенная блок-схема двухлучевого сканирующего
ИК-спектрометра с дифракционной решеткой представлена на рис. 15.

Рис. 15. Схема инфракрасного двухлучевого спектрофотометра
ИК-излучение от источника 1 делится на два пучка системой зеркал 2.
Рабочий пучок проходит через кювету с образцом 3, а пучок сравнения - через
компенсатор фона 4. С помощью дискомодулятора 5 пучки попеременно направляются
на входную щель монохроматора 6 и через нее - на дифракционную решетку 7, которая
разлагает излучение в спектр и направляет его на выходную щель 8.
Монохроматическое изображение щели попадает на приемник - висмутовый болометр
9. В отсутствии исследуемого образца интенсивности рабочего пучка и пучка
сравнения одинаковы, в приемнике сигналы от этих пучков вычитаются; на выходе
сигнал отсутствует. При поглощении рабочего пучка исследуемым веществом на
приемник попадают лучи различной интенсивности, в результате чего в приемнике
возникает переменный сигнал. После усиления и преобразования сигнала приводится
в движение перо самописца 10. При медленном повороте решетки щель 8
последовательно вырезает узкие участки спектра, и на ленте самописца
вычерчивается кривая зависимости пропускания от длины волны.
Серийные одно- и двухлучевые спектрофотометры, используемые для изучения
низкомолекулярных соединений, имеют достаточную разрешающую способность для
исследования большинства полимеров. Однако для работы в дальней области
спектра, которая в исследовании полимеров играет очень важную роль, необходимы
специальные вакуумные спектрофотометры с дифракционными решетками.
Современные спектрометры позволяют регистрировать ИК-спектры
газообразных, жидких и твердых образцов. Для получения ИК-спектра полимера или
органического соединения необходимо всего от 1 до 10 мг вещества.
В большинстве случаев спектры соединений регистрируют либо в виде
растворов веществ в хлороформе, четыреххлористом углероде, сероуглероде, либо в
виде твердых прозрачных таблеток, полученных прессованием под давлением мелко
размолотой смеси вещества с бромидом калия. Иногда использую метод съемки
ИК-спектра вещества в виде мелко растертой суспензии в вазелиновом или
минеральном масле.
В случае регистрации ИК-спектра соединений в растворах или суспензиях
необходимо вычитать полосы поглощения растворителей или суспензионной среды
[19].
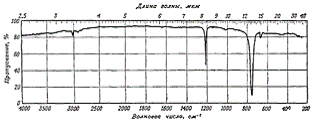
Рис. 16. ИК-спектр хлороформа
10. Специфические особенности фармацевтического анализа
Фармацевтический анализ - это наука о химической характеристике и
измерении биологически активных веществ на всех этапах производства: от
контроля сырья до оценки качества полученного ЛВ, изучения его стабильности,
установления сроков годности и стандартизации ЛФ. Фармацевтический анализ имеет
свои специфические особенности, отличающие его от других видов анализа. Эти
особенности заключаются в том, что анализу подвергают вещества различной
химической природы: неорганические, элементорганические, радиоактивные,
органические соединения от простых алифатических до сложных природных биологически
активных веществ. Чрезвычайно широк диапазон концентраций анализируемых
веществ. Объектами фармацевтического анализа являются не только индивидуальные
ЛВ (субстанции), но и смеси, содержащие различное число компонентов.
Способы фармацевтического анализа нуждаются в систематическом
совершенствовании в связи с созданием новых ЛС и непрерывным повышением
требований к их качеству. Причем растут требования как к степени чистоты ЛВ,
так и к количественному содержанию. Поэтому необходимо широкое использование
для оценки качества ЛС не только химических, но и более чувствительных
физико-химических методов.
К фармацевтическому анализу предъявляют высокие требования. Он должен
быть достаточно специфичен и чувствителен, точен по отношению к нормативам,
обусловленным ГФ, ФС и другой НД, выполняться в короткие промежутки времени с
использованием минимальных количеств испытуемых Л С и реактивов.
Фармацевтический анализ в зависимости от поставленных задач включает различные
формы контроля качества ЛС: фармакопейный анализ, постадийный контроль
производства ЛВ, анализ ЛФ индивидуального изготовления, экспресс- анализ в
условиях аптеки и биофармацевтический анализ.
Составной частью фармацевтического анализа является фармакопейный анализ.
Он представляет собой совокупность способов исследования ЛВ и ЛФ, изложенных в
Государственной фармакопее или другой нормативной документации. На основании
результатов, полученных при выполнении фармакопейного анализа, делается
заключение о соответствии ЛС требованиям ГФ (ФС, ФСП). При отклонении от этих
требований ЛС к применению не допускают [3].
Заключение о качестве ЛС можно сделать только на основании анализа пробы
(выборки). Порядок ее отбора указан либо в частной ФС, либо в общей статье ГФ
XI (вып. 2).
Выполнение фармакопейного анализа позволяет установить подлинность Л В,
его чистоту, определить количественное содержание фармакологически активного
вещества или ингредиентов, входящих в состав ЛФ. Несмотря на то что каждый из
этих этапов имеет свою конкретную цель, их нельзя рассматривать изолированно.
Они взаимосвязаны, взаимно дополняют друг друга и отражают комплексный характер
оценки качества ЛС. Так, например, температура плавления, растворимость, рН
среды водного раствора и т.д. являются критериями как подлинности, так и чистоты
ЛВ. Указанные особенности фармакопейного анализа существенно отличают его от
норм и требований к методам анализа, используемых в Государственных стандартах
(ГОСТ) и технических условиях (ТУ).
В ФС описаны методики соответствующих испытаний применительно к тому или
иному фармакопейному ЛС. Многие из этих методик идентичны. В целях унификации
способов анализа в ГФ включены общие фармакопейные статьи (ОФС), в которых
систематизированы сведения о выполнении испытаний на ряд ионов и функциональных
групп, а также единых методов количественного определения. Для обобщения
большого объема частных сведений по фармакопейному анализу будут рассмотрены
основные критерии фармацевтического анализа и общие принципы испытаний на
подлинность, чистоту и количественного определения ЛВ [18].
Для проверки качества препаратов испытательные центры или центры контроля
качества лекарственных средств (ЦККЛС) должны обладать необходимым арсеналом
аналитического оборудования. В статье даны рекомендации по выбору аппаратуры,
оцениваются сильные и слабые стороны представленных на рынке приборов и
лабораторных материалов, представлена основная номенклатура оборудования ЦККЛС.
Вопросы организации микробиологической лаборатории, оборудование для
испытания на бактериальные эндотоксины, организация деятельности ЦККЛС, система
менеджмента качества будут представлены в следующих публикациях.
Инфракрасная (ИК) спектроскопия в средней области (от 4000 до 400 см-1) в
настоящее время является методом номер один для установления подлинности
фармацевтических субстанций. Он может применяться и в отношении лекарственных
препаратов (т. е. дозированных лекарственных средств, готовых к применению),
однако современный фармакопейный анализ предполагает в таком случае
предварительное извлечение действующего вещества из лекарственной формы. (Есть
исследования, которые демонстрируют возможность прямого получения ИК-спектров
препаратов при относительно высоком содержании основного вещества в
препарате.)
Метод ИК-спектроскопии является фармакопейным. В Государственной
фармакопее (ГФ) XII (ч. 1, с. 62) имеется соответствующая общая фармакопейная
статья (ОФС) "Спектрометрия в инфракрасной области".
Современный ИК-спектрометр обычно работает по принципу преобразования
Фурье, т. е. использует интерферометр, что выгодно отличает его от
дисперсионных приборов.
Также следует отметить, что современный ИК-спектрометр - прибор с
большими возможностями, не все из которых требуются при проведении рутинного
контроля качества ЛС. Поэтому при приобретении такого прибора для ЦККЛС
необходимо выбирать набор приспособлений, приставок и программного обеспечения
к основному прибору, который будет реально востребован.
В подавляющем большинстве случаев для получения ИК-спектров используют
два способа:
• прессование таблеток с бромидом калия (основной вариант);
Для получения таблеток необходимы:
• специальный пресс с пресс-формами и другими приспособлениями;
• спектроскопически чистый бромид калия (KBr для ИК-спектроскопии);
• соответствующие держатели в кюветном отделении прибора.
Для получения суспензии в вазелиновом масле необходимы:
• ступка, не содержащая пор (например, агатовая) с таким же пестиком
(поры накапливают влагу, попадания которой в образец необходимо избегать);
• спектроскопически чистое минеральное (вазелиновое) масло (масло для
ИК-спектроскопии);
• стекла из бромида калия или другого материала, прозрачного в рабочем
диапазоне ИК-спектра (суспензия помещается между стеклами);
• соответствующие держатели в кюветном отделении прибора. При получении
ИК-спектров жидких веществ могут подойти стекла из бромида калия, которые
используются и для сканирования спектров суспензий.
Естественно, что различные фирмы-производители конструктивно могут
реализовывать получение спектров разными способами, о чем необходимо
консультироваться, приобретая прибор.
Следует также учесть, что могут оказаться востребованными и другие
варианты пробоподготовки, предусмотренные ОФС. Их также следует обсудить с
поставщиком при покупке прибора [2].
Заключение
Инфракрасная спектроскопия с каждым годом получает всё более широкое
распространение как весьма ценный физический метод исследования строения
молекул и мощный аналитический метод.
Внедрение спектроскопии в сферу фармацевтического анализа ЛС послужило мощным
толчком для её развития и совершенствования. Благодаря многообразию
возможностей применения, высокой точности результатов и чувствительности
обнаружения, существенном сокращении времени проведения анализа,
ИК-спектроскопия достигла высшей степени экономической эффективности [5].
Список
использованной литературы
1. Аверко-Антонович И.Ю. , Бикмуллин Р.Т.: Методы
исследования структуры и свойств полимеров. Учебное пособие / КГТУ. Казань. -
2002. - 604 с.
. Арзамасцев А.П., Дорофеев В.Л. Современные требования
к Стандартизации и контролю качества лекарственных средств. // Новая аптека.
Эффективное управление. 2007 - №4- С. 54-57.
. Арзамасцев А.П., Дорофеев В.Л. Стандартные образцы
для фармакопейного анализа. // Вопросы биологической медицинской и фармацевтической
химии. 2010 - №5С. 6-10.
. Беллами JI. Инфракрасные спектры сложных молекул
М.:1983, 432 с.
. Бёккер Ю. Мир химии. Спектроскопия. Перевод с
немецкого Л.Н.Казанцевой. Москва -2009. - 522с.
. Бранд Дж. Применение спектроскопии в органической химии.
М.: Мир. - 1967. - 280 с.
. Государственная фармакопея Российской Федерации XII издания 2 часть, Москва 2010
. Кеслер Н, Методы инфракрасной спектроскопии в
химическом анализе. М.: Мир, 1984,-287 с.
. Коптюг В.А. Атлас спектров для криминалистических подразделений
МВД СССР. Выпуск 8. Новосибирск- 1991г. -477с.
. Крищенко В.П. Ближняя инфракрасная спектроскопия.
М.: 1997. -638с.
. Кросс А.Д. Введение в практическую инфракрасную
спектроскопию Пер с англ. М.: Иностранная литература, 1981. - 110 с.
. Крылов А. С., Втюрин А. Н., Герасимова Ю. В.
Обработка данных инфракрасной Фурье-спектроскопии. Методическое пособие.
Красноярск, Институт физики СО РАН, 2005. - 48 с.
. Купцов А.Х., Жижин Г.Н. Фурье-КР и фурье-ИК-спектры
полимеров. М.: Физматлит,- 2001. -316 с.
. Наканиси К. " Инфракрасные спектры и строение
органических соединений" М.: Мир,- 1965. -216с.
. Норрис К.Х. Приборы для ближней инфракрасной
спектроскопии // Применение спектроскопии в ближней инфракрасной области для
контроля качества продукции (4-й сборник научных трудов по ИКС). М.:
Интерагротех, 1989.-С. 5-10.
. Пентин Ю.А. , Л.В. Вилков: Физические методы
исследования в химии. - М.: Мир. - 2003. - 367 с.
. Садчикова Н.П., Арзамасцев А.П., Титова A.B. Метод
ближней ИК-спектроскопии в системе контроля качества лекарственных средств
(обзор) // Вопросы биологической медицинской и фармацевтической химии.
-2010.-№1. С. 16-20.
. Садчикова Н.П., Арзамасцев А.П., Титова A.B.
Современное состояние проблемы применения ИК-спектроскопии в фармацевтическом
анализе лекарственных средств // Хим.-фарм.ж. 2008. - №.8. - С. 26-30.
. Тарасов К.И., Спектральные приборы,
"Машиностроение", Л., 1968.
. Тарасевич Б.Н. Основы ИК спектроскопии с
преобразованием Фурье. Подготовка проб в ИК спектроскопии. Москва- 2012. -22с.
. Тарасевич Б.Н. ИК спектры основных классов
органических соединений. Справочные материалы. Москва -2012. -52с.
. Тарутина Л.И., Позднякова Ф.О. Спектральный анализ
полимеров. - Л.: Химия. - 1986. - 248 с.
. Сливкин А.И. Атлас ИК-спектров лекарственных веществ.
А.И. Сливкин, О.В. Тринеева, Е.Е. Логвинова, А.С. Чистякова, Л.Ю. Яковлев, И.И.
Механтьев. Издательско-полиграфический центр Воронежского государственного
университета- 2013.- 172с.