Изучение закономерностей химического восстановления Ni(II) в аммиачно-пирофосфатных электролитах
Белорусский
Государственный
Университет
Химический
факультет
Кафедра
неорганической
химии
Курсовая
работа
Изучение
закономерностей химического восстановления Ni(II) в аммиачно-пирофосфатных
электролитах
Студента
4 курса
группы Саковича И.В.
Руководитель:
доцент кафедры неорг. химии,
к.х.н., доцент Врублевская О.Н.
Минск,
2013
Оглавление
Введение
Глава 1. Литературный отбор
.1 Химическое никелирование
.1.1 Гипофосфитные растворы
никелирования
.1.2. Свойства покрытий Ni-P
.1.3 Никелирование из растворов,
содержащих гидразин
.1.4 Борогидридные растворы
никелирования
.1.5 Аминобораны
.2. Химическое палладирование
.2.1 Гипофосфитные растворы
палладирования
.2.2 Гидразиновые растворы
палладирования
.2.3 Борогидридные растворы
палладирования
.3 Осаждение сплава Ni
- Pd из органических
электролитов
.3.1 Органические электролиты для
осаждения сплава Pd-Ni
.3.2 Этилендиаминовые растворы
Глава 2. Практическая часть
.1 Приготовление электролитов для
химического никелирования
.2 Приготовление электролитов для
химического палладирования
.3 Порядок операций для
безэлектролизного осаждения никелевых и палладиевых покрытий
.4. Методы исследования
.4.1 Гравиметрический анализ
.4.2 Рентгенофазовый анализ
.4.3 Изучение морфологии поверхности
.5 Техника безопасности
Глава 3. Результаты и их обсуждение
.1 Результаты химического
никелирования
.2 Результаты химического
палладирования
Заключение
Список литературы
гипофосфитный
раствор соль никель электролит
Введение
Палладий-никелевые сплавы характеризуются высокой
коррозионной устойчивостью, способностью к пайке, износостойкостью и
твердостью, малым переходным сопротивлением. Благодаря этим свойствам
палладий-никелевые покрытия наносят на электрические контакты вместо золота,
используют в качестве подслоя для тонких пленок золота, в качестве
диффузионного барьера, необходимого при сборке плат электронных и
оптоэлектронных приборов. Палладий-никелевый сплав может быть получен
химическим осаждением из растворов или путем электрохимического осаждения в
режимах постоянного или импульсного тока. Следует отметить, что
электрохимические ванны являются более стабильными по сравнению с химическими.
Электролиты для электрохимического и химического осаждения покрытий из сплава
Pd-Ni имеют весьма сходные составы. Стандартные электродные потенциалы E0Pd2+/Pd
=
0,98 В и E0Ni2+/Ni
=
-0,23 В сильно различаются, следовательно для обеспечения сплавообразования
требуется создание условий обеспечивающих сближение электродных потенциалов,
например, путем введения лигандов, обеспечивающих формирование комплексов
палладия(II) более прочных, чем комплексов никеля(II). В качестве лигандов
используют аммиак, этилендиамин, этилендиаминтетраацетат. В электролитах для
химического осаждения сплава Pd-Ni
в качестве восстановителей применяют гипофосфит натрия, гидразин, борогидрид
натрия.
В литературе имеется большое количество рецептур
электролитов для химического осаждения сплава Pd-Ni. Наиболее изученными
электролитами являются аммиачные и этилендиаминовые, известно, что их
устойчивость понижается с уменьшением рН, и именно от рН зависит соотношение
элементов в сплаве. С ростом рН увеличивается концентрация палладия в сплаве.
Наименее изученными электролитами являются аммиачно-пирофосфатные электролиты.
Ранее проведенные в НИИ ФХП БГУ исследования показали, что такие электролиты
характеризуются высокой стабильностью и высокой скоростью формирования сплава.
Однако нет данных характеризующих влияние рН, соотношения солей никеля(II) и
палладия(II) в электролите, рабочей температуры электролита на процесс
совместного восстановления Pd(II) и Ni(II). Наличие таких данных позволило бы
направленно подходить к получению сплава строго определенного состава.
Цель курсовой работы заключалась в изучении
закономерностей раздельного восстановления Ni(II) и Pd(II)
в аммиачно-пирофосфатных электролитах.
Глава
1. Литературный обзор
1.1
Химическое никелирование
Известен широкий спектр электролитов химического
никелирования, в которых использую хлориды, сульфаты, ацетаты и др. соли
никеля, а в качестве восстановителей гипофосфиты, борогидриды, гидразин и его
производные.
Использование в качестве восстановителя:
гипофосфит-ионов приводит к соосаждению в покрытия фосфора, использование
борогидридов - к соосаждению в покрытие бора. Только в случае гидразинсодержащих
электролитов формируются никелевые покрытия [1].
1.1.1
Гипофосфитные растворы никелирования
При использовании в качестве восстановителя
гипофосфит-ионов в электролитах никелирования возможно осуществление следующих
реакции:
Ni2+
+ 2H2PO2-
+ 2H2O
→
Ni + 2H2PO3-
+ H2
+2H+
(pH < 6) (1.1)
Ni2+
+ 2H2PO2-
+ 2H2O
→
Ni + 2HPO32-
+ H2
+2H+
(pH > 6) (1.2)
В сильнощелочных растворах осуществляется
следующая реакция:
Ni2+
+ H2PO2-
+ 3OН- →
Ni + HPO32-
+ H2О
(1.3)
Гипофосфит диспропорционирует с образованием фосфора,
включающегося в никелевое покрытие, и фосфитов:
4H2PO2-
+ 2Н+ → 2P
+ 2H2PO3-
+ Н2 + 2H2О
(1.4)
H2PO2-
+ 2Н+ + 2H2O
→
2P + 6H2PO3-
+ 5Н2 (1.5)
В сильнощелочных растворах осуществляется
реакция:
3H2PO2-
→ 2P + HPO32-
+ 2H2О
+ ОН- (1.6)
На практике применяют два типа растворов
химического никелирования - кислые (рН = 4 ÷ 7) и
щелочные рН = (8 ÷ 11). В
кислой среде никелирование может протекать из раствора, содержащего лишь Ni(II)
и гипофосфит. Однако для стабилизации процесса используют буферные добавки,
например, ацетаты, цитраты, гликоляты и др.
Так как ионы никеля (II)
могут образовать с продуктом реакции - фосфитом - малорастворимый при рН > 4
фосфит никеля, взвесь которого ухудшает покрытие и усложняет процесс, то в
растворы никелирования вводят лиганды, с которыми ионы никеля (II)
образуют достаточно прочные комплексы, оставаясь в растворе и при больших рН и
концентрациях фосфита. Это особенно важно при многократном использовании
раствора с его корректированием, когда фосфит в растворе накапливается. В
качестве лигандов ионов никеля (II)
в кислых растворах рекомендовано применяют кислоты (или их соли): молочную,
аминоуксусную (глицин), лимонную, гликолевую.
В щелочных растворах рН = (8 ÷
11)
никелирования необходимым компонентом является лиганд для связывания ионов
никеля, предотвращающий выпадение его гидроксида и фосфита. Часто в качестве
источника лигандов применяют смесь цитрата, соли аммония и аммиак. Известны
также растворы с сульфаматом, пирофосфатом, этилендиамином.
Растворы химического никелирования, содержащие
гипофосфит, сравнительно стабильны и при правильно подобранной технологии могут
работать долго без восстановления никеля в объёме раствора. Однако при
длительном использовании растворов для обеспечения надёжной их работы часто вводят
стабилизирующие добавки. Наиболее известными стабилизаторами для растворов
являются соединения свинца (II)
(1 - 5 мг/л) (PbS, PbCrO4).
Кроме того, в качестве стабилизаторов используют MoO3,
соли мышьяка, сурьмы, висмута, олова, различные тиосоединения, цианиды,
нитросоединения, малеиновый ангидрид, кислород, нитрит и др.
Примеры растворов приведены в таблице 1.1.
Таблица 1.1 - Составы растворов химического
никелирования
|
Компоненты
и режим осаждения
|
Концентрация,
моль/л
|
|
№1
|
№2
|
№3
|
№4
|
№5
|
№6
|
№7
|
№8
|
№9
|
|
NiCl2∙6H2O (хлорид
никеля)
|
-
|
0,025
|
0,109
|
0,126÷0,227
|
-
|
0,168÷0,210
|
0,126
|
0,189
|
-
|
|
NiSO4∙7H2O
(сульфат никеля)
|
0,107
|
-
|
-
|
-
|
0,078
|
-
|
-
|
-
|
0,089
|
|
NiH2PO2∙H2O
(гипофосфит никеля)
|
0,094
|
0,075
|
0,226
|
0,170÷0,660
|
0,189
|
0,283÷0,556
|
0,094
|
0,189
|
0,236
|
|
NiCH3COO∙3H2O
(ацетат никеля)
|
0,073
|
0,037
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Na3C6H5O7∙2H2O
(цитрат
натрия)
|
-
|
-
|
-
|
-
|
-
|
0,312÷0,469
|
0,437
|
0,234
|
-
|
|
C(CH2COOH)2(COOH)OH
(лимонная кислота)
|
-
|
-
|
-
|
0,260÷0,521
|
-
|
-
|
-
|
-
|
-
|
|
CH3CH(OH)COOH
(молочная кислота)
|
-
|
-
|
0,300
|
0÷0,333
|
-
|
-
|
-
|
-
|
-
|
|
CH3CH2COOH
(пропионовая кислота)
|
-
|
-
|
0,030
|
-
|
-
|
-
|
-
|
-
|
-
|
|
PbS (сульфид свинца)
|
-
|
-
|
8,4∙10-6
|
-
|
-
|
-
|
-
|
-
|
-
|
|
K+O-CH2-CH2O-K+
(гликолят калия)
|
-
|
-
|
-
|
0÷0,217
|
-
|
0,072÷0,217
|
-
|
-
|
-
|
|
C6H5COO-Na+
(бензоат натрия)
|
-
|
-
|
-
|
-
|
0,035
|
-
|
-
|
-
|
-
|
|
NH4Cl (хлорид
аммония)
|
-
|
-
|
-
|
-
|
-
|
0,935
|
0,935
|
-
|
-
|
|
Na4P2O7∙10H2O
(пирофосфат натрия)
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
0,112
|
|
pH
|
4÷6
|
4,5÷5,5
|
4,6
|
5÷6
|
4,3÷4,6
|
5÷6
|
8÷10
|
8÷8,5
|
10÷11
|
|
Температура,
°С
|
90
|
82÷84
|
90÷100
|
55÷65
|
60
|
60÷65
|
95
|
80÷85
|
65÷75
|
|
Скорость
осаждения, мкм/ч
|
25
|
|
20
|
|
1,5
|
|
6,5
|
10
|
15
|
Все приведенные в таблице растворы предназначены
для работы при температурах 60 ÷
90 °С. Они используются для никелирования пластмасс, кварца и керамики. Для
никелирования при комнатной температуре пригоден раствор №9, содержащий 23 мл/л
28% раствора NH3∙H2O
(рН=10), скорость никелирования - 2,5 мкм/ч при 25 °С.
Известны щелочные растворы (таблица 1.2) для
никелирования при температурах, близких к комнатной, основанные на
использовании аммиака в качестве лиганда. Никелирование при невысоких
температурах можно проводить и из щелочных цитратно-аммиачных растворов
(раствор №4).
Таблица 1.2 - Составы рекомендуемых растворов
|
Компоненты
и режим осаждения
|
Концентрация,
моль/л
|
|
№1
|
№2
|
№3
|
№4
|
|
NiCl2∙6H2O
(хлорид
никеля)
|
0,101
|
0,202
|
-
|
0,5
|
|
NiSO4 (сульфат
никеля)
|
-
|
-
|
0,194
|
-
|
|
NaH2PO2∙H2O
(гипофосфит натрия)
|
0,302÷0,396
|
0,189
|
0,094
|
1,0
|
|
NH4Cl (хлорид
аммония)
|
0,505
|
0,505
|
-
|
-
|
|
(NH4)2SO4
(сульфат аммония)
|
-
|
-
|
0,227
|
-
|
|
NH3∙H2О
(25%-ный раствор), мл/л
|
30-35
|
65
|
-
|
-
|
|
NaNO2 (нитрит
натрия)
|
(2,9÷14,5)∙10-4
|
-
|
-
|
-
|
|
C(CH2COONH4)2(COONH4)OH
(цитрат аммония)
|
-
|
-
|
-
|
0,4
|
|
NaOH
|
-
|
-
|
-
|
До
рН = 10
|
|
рН
|
9,0
|
8,9
|
8,2÷8,5
|
-
|
|
Температура,
°С
|
30
|
30
|
30
|
|
|
Скорость
осаждения, мкм/ч
|
1,8
|
1,6
|
2
|
3
|
В аммиачных электролитах скорость никелирования
достигает максимума при рН 8 ÷ 8,5 (рисунок
1.1). Снижение скорости восстановления никеля (II)
связано с затруднением восстановления комплексов Ni(NH3)n2+,
а также с тормозящим воздействием NH3
на окисление гипофосфита.

Рисунок 1.1 - Зависимость средней скорости
осаждения покрытии от рН аммиачного раствора никелирования. Продолжительность
опыта: 1- 30 мин, 2 - 1 ч, 3 - 6 ч; температура, °С: 1 - 20, 2,3 - 30.
Скорость никелирования из раствора №4 при 30 °С
равна 3 мкм/ч, а при 50 °С - 11 мкм/ч.
Указывается [2], что анионы неорганических
соединений (хлорид, сульфат) при концентрациях 0,1÷0,3
моль/л тормозят восстановление никеля [1].
1.1.2
Свойства покрытий Ni-P
Никелевые покрытия, полученные при
восстановлении гипофосфит-ионами, всегда содержат фосфор. Количество фосфора в
покрытии зависит от многих факторов, в том числе от рН растворов. Покрытия,
полученные из кислых растворов, обычно содержат 6 ÷
15 масс. % Р, из щелочных - 3 ÷
7 масс. %. Фосфор в покрытиях распределён неравномерно - этим объясняется часто
наблюдаемая слоистость покрытий.
Свежеосаждённые покрытия представляют собой
перенасыщенный твёрдый раствор фосфора в никеле; при содержании фосфора до 7%
покрытия являются кристаллическими, при большем содержании Р структура
формируется либо аморфная, либо кристаллическая с высокой степенью дефектности
решётки. При обработке покрытий выше 200 °С образуется устойчивый фосфид Ni3P.
Плотность покрытий несколько ниже, чем чистого Ni
и равна 7,9 ÷ 8,25 г/см3.
Покрытия отличаются высокой твёрдостью - (5 ÷
6)∙109 Па (по Виккерсу), что соответствует очень твёрдым электрохимическим
покрытиям Ni или
покрытиям мягкого хрома. При термообработке (400 °С) твёрдость увеличивается и
достигает максимального значения: (9 ÷
10)∙109 Па.
Модуль упругости покрытия при 400 °С - 1,9∙1011
Па. Прочность на растяжение составляет (4 ÷ 8)∙108
Па.
Пластичность химически осаждённого никеля
невелика; относительное удлинение при разрыве покрытия в интервале 1÷
6%.
Коэффициент термического расширения равен (13 ÷
14,5)∙10-6 °С-1. Покрытия в зависимости от условий
получения могут иметь различные значения остаточных внутренних напряжений.
Электропроводность химически осаждённых
никелевых покрытий значительно меньше, чем чистого никеля. Удельное объёмное
сопротивление покрытий Ni
- P равно (3 ÷
6)∙10-7 Ом∙м (для чистого никеля -
6,9∙10-8 Ом∙м). Это различие объясняется присутствием
фосфора. Большое влияние оказывают другие факторы, которые могут изменять
структуру покрытия, - состав раствора, температура восстановления.
Тонкие никелевые покрытия имеют значительно
более высокое удельное сопротивление (таблица 1.3).
Таблица 1.3 - Электрическое сопротивление
покрытий Ni - P
на стекле, полученных из кислых растворов
|
Толщина
покрытия, мкм
|
Температура
термообработки, °С
|
Поверхностное
сопротивление, Ом
|
ρ∙106,
Ом∙м
|
|
0,024
|
-
|
5∙104
|
1200
|
|
100
|
8∙103
|
192
|
|
200
|
1∙103
|
24
|
|
300
|
7∙102
|
16,8
|
|
0,03
|
-
|
~1∙104
|
~300
|
|
100
|
~1∙103
|
~30
|
|
200
|
2∙102
|
6
|
|
300
|
1∙102
|
3
|
|
0,08
|
-
|
8
- 10
|
|
0,6
|
-
|
3
|
1,8
|
Термообработка уменьшает электрическое
сопротивление покрытий, особенно при малой их толщине.
Обычно считают, что химически осаждённые
покрытия Ni - P
более устойчивы к коррозии, чем стандартные гальванические покрытия Ni.
Это объясняется их меньшей пористостью и присутствием фосфора. Однако имеются
данные, что покрытия с 4,5 % Р, полученные из щелочного раствора, корродируют
значительно быстрее, чем гальванические покрытия, что вызывает шелушение
покрытия на металлизированных пластмассах [1].
1.1.3
Никелирование из растворов, содержащих гидразин
Реакция, происходящая при восстановлении никеля
(II) гидразином
следующая:
2Ni2+ + N2H4
+ 4OH- = 2Ni + N2 +4H2O (1.7)
Получение покрытий никеля из растворов,
содержащих гидразин, впервые подробно описал Леви. Он получил тонкие никелевые
плёнки (10 ÷ 500 нм) в щелочных
растворов, содержащих в качестве лиганда ионы тартрата, малоната, цитрата
(таблица 1.4).
Таблица 1.4 - Составы растворов никелирования с
гидразином
|
Компоненты
и режим осаждения
|
Концентрация,
моль/л
|
|
|
№1
|
№2
|
№3
|
№4
|
|
NiCl2∙6H2O
(хлорид никеля)
|
0,021
|
-
|
-
|
-
|
|
Ni(CH3COO)2∙4H2O
(ацетат никеля)
|
-
|
0,241
|
-
|
-
|
|
NiSO4∙7H2O
(сульфат никеля)
|
-
|
-
|
0,103
|
0,107
|
|
N2H4∙H2O
(гидрат гидразина)
|
0,999
|
1,998
|
-
|
0,150
|
|
N2H4∙H2SO4
(сульфат
гидразина)
|
-
|
-
|
0,100
|
-
|
|
NaKC4H4O6·4H2O
(сегнетова соль)
|
0,021
|
-
|
-
|
-
|
|
NH2CH2CH2OH (моноэтаноламин)
|
-
|
-
|
-
|
1,965
|
|
CH2OHCOOH (гликолевая
кислота)
|
-
|
0,788
|
-
|
-
|
|
(CH2N(CH2COONa)2)2
(Na4ЭДТА)
|
-
|
0,066
|
-
|
-
|
|
рН
|
10
|
11
|
8÷10
|
-
|
|
Температура,
°С
|
95
|
90
|
85÷90
|
120÷150
|
|
Скорость
осаждения, мкм/ч
|
3,6
*
|
12,5
|
~2
|
До
30*
|
*Рассчитано
по скорости за 1 мин.
Восстановление никеля с заметной скоростью
начинается при температурах выше 60 °С.
Из раствора № 2 можно получить толстые покрытия
- до 70 мкм - в случае одноразового использования раствора. Значительное
ускорение никелирования достигается при температурах выше 100 °С; процесс
проводят в автоклаве. Покрытия, полученные при восстановлении никеля
гидразином, на 97 ÷ 99% состоят
из никеля. Их электропроводность, магнитные свойства близки к свойствам чистого
никеля, поэтому эти покрытия могут найти функциональное применение; известно их
использование для металлизации кристаллов Al2O3,
SiO2,
углеродных волокон. Отмечается, что некоторые физические свойства покрытий не
столь широки, как слоёв Ni
- P; например, они
хрупки, имеют высокие внутренние напряжения, их коррозионная стойкость невысока
[1].
1.1.4
Борогидридные растворы никелирования
Плёнки сплава никель-бор широко применяются в
различных областях техники - приборостроении, радиотехнике и микроэлектронике,
точном машиностроении, так как обладают уникальным сочетанием физико-химических
и коррозионно-химических свойств. Для их получения используют методы
химического и электрохимического осаждения; поставщиками бора служат такие
борсодержащие соединения, как диметиламин- и триметиламинборан, борогидрид
натрия и др. Развитие химии органических соединений бора и бороводородов
позволяет расширить круг возможных источников бора [3].
Борогидрид при повышенной температуре легко
восстанавливает Ni(II)
до металла. Способы никелирования с использованием борогидрида и его
производных, например, Нибодур, по технологическим показателям и свойствам
получаемых покрытий могут конкурировать с никелированием при помощи
гипофосфита. В настоящее время их применяют на практике для никелирования, как
металлов, так и диэлектриков, особенно керамики, стекла. Для металлизации
пластмасс больше подходят варианты процессов с применением в качестве некоторых
органических производных борогидрида, например, аминоборанов, при помощи
которых никелирование можно проводить и при более низких температурах (30 ÷
60 °С).
Реакции, протекающие во время образования Ni-B
покрытия, отображаются схемой, которая согласуется со стехиометрией процесса и
с данными опытов с дейтерием:
BH4- + 4H2O
= B(OH)4- + 4H+ + 2H2 +4e
(1.8)
Ni2+ + 4e = 2Ni
(1.9)
BH4- + 2H+
→ 2BH3 + 2H2 → 2B + 5H2 (1.10)
2H2O
+ 2e
→
H2
+ 2OH-
(1.11)
Сложением уравнений (1.8) и (1.9) получаем
суммарное уравнение восстановления никеля:
BH4- + 4H2O
+ 2Ni2+ = B(OH)4- + 4H+ + 2H2
+ 2Ni (1.12)
а сложением уравнений (1.8) и (1.11) - реакцию
гидролиза BH4-:
BH4-
+ 4H2O
= B(OH)4-
+ 4H2
(1.13)
Металлический никель катализирует реакцию
(1.13), поэтому в ходе никелирования часть борогидрида неизбежно разлагается и
лишь 20 ÷
30% его реагирует по реакции (1.12), восстанавливая никель. Использование
борогидрида можно повысить добавлением стабилизаторов, которые в данном случае
замедляют каталитическое разложение борогидрида по реакции (1.13) и уменьшают
возможность восстановления никеля в объёме раствора. Составы борогидридных
растворов никелирования приведены в таблицах 1.5, 1.6.
Таблица 1.5 - Составы борогидридных растворов
никелирования
|
Компоненты
и режим осаждения
|
Концентрация,
моль/л
|
|
Соль
никеля
|
0,02÷0,2
|
|
NaBH4
|
0,002÷0,015
|
|
NaOH
|
0,1÷1
|
|
Донор
лиганда
|
0,2÷5
|
|
Стабилизаторы
и другие добавки
|
|
Наиболее известный раствор (раствор №1) процесса
Нибодур содержит (таблица 1.6).
Таблица 1.6 - Составы раствора процесса Нибодур
|
Компоненты
и режим осаждения
|
Концентрация,
моль/л
|
|
№1
|
№2
|
|
NiCl2∙6H2O
(хлорид никеля)
|
0,126
|
0,126
|
|
NaBH4
(борогидрид
натрия)
|
0,016
|
0,027
|
|
NaOH (гидроксид
натрия)
|
0,1
|
0,1
|
|
H2NCH2CH2NH2
(этилендиамин)
|
1
|
0,25
|
|
K2S2O5
(стабилизатор)
|
|
0,009
|
|
NaKC4H4O6·4H2O
(сегнетова соль)
|
|
0,190
|
|
Стабилизаторы
|
|
|
|
Температура,
°С
|
90
÷ 95
|
60
|
|
Скорость
осаждения, мкм/ч
|
До
10
|
4
|
Вместо этилендиамина можно применять другие
амины или тартраты.
В качестве стабилизаторов применяют соединения серы
(II) или некоторых
металлов. В патентах создателей процесса Нибодур названо около 30
серусодержащих органических стабилизаторов: алифатические кислоты, спирты, их
производные, ароматические кислоты, ацетиленовые соединения, ароматические
сульфиды, тиофены, тиазолы, дитиогликолевая кислота.
Использование борогидрида в ванных типа Нибодур
повышают до 30 ÷ 40% добавки
(от миллиграммов до сотен миллиграмм) соединений Tl,
Sn, As,
Sb, Pb,
Se,Te,
Cd и др. В ряде
патентов предложена добавка PdCl2
(10 ÷ 40 мг/л), иногда в сочетании с добавкой
дитиогликолевой кислоты. Следует отметить, что соединения металлов могут
восстанавливаться и включаться в покрытия, образуя сплавы Ni
- Ме - В.
Более высокая скорость никелирования и
возможность работы при низких температурах (вплоть до комнатной) достигается
при замене части этилендиамина в растворе процесса Нибодур тартратом (раствор
№2) (таблица 1.6). При 60 °С достигается скорость того же порядка (примерно 4
мкм/ч), что и в этилендиаминовом растворе при 90 °С. Наряду с метабисульфитом в
качестве стабилизатора можно использовать тиосульфат, однако последний сильнее
уменьшает скорость никелирования.
Процесс Нибодур проводят непрерывно, корректируя
состав раствора и периодически удаляя накапливающийся борат. Никелевые покрытия,
полученные способом Нибодур, содержат бор (обычно 4 ÷
7 масс. %) и отличаются высокой твёрдостью: (5 ÷ 7,5)∙109
Па после осаждения и (10 ÷ 12,5)∙109
Па после термообработки при 400 °С. Их удельное электрическое сопротивление
равно 8,9∙10-7 Ом∙м и уменьшается до 4,3∙10-7
Ом∙м после термообоаботки. Эти покрытия представляют собой пересыщенный
твёрдый раствор бора в β-Ni,
из которого при нагревании образуются бориды Ni3B
и Ni2B
[1].
1.1.5
Аминобораны
Восстановление с помощью аминоборана обычно
проводят в слабокислой или нейтральной среде. При использовании растворимых в
воде аминоборанов, например, диметиламиноборана (ДМАБ или диметилборазаном) (CH3)2NHBH3,
пиридиноборана C5H5NBH3,
изопропиламиноборана (C3H7)H2NBH3,
в состав раствора кроме соли никеля ещё вводят буферные вещества, доноры
лигандов (различные амины, кислоты), стабилизаторы (соли свинца, соединения
серы), смачиватели. Составы растворов могут быть аналогичны растворам,
содержащим гипофосфит [1].
Примерами могут служить также следующие растворы
(таблица 1.7) [1].
Таблица 1.7 - Составы аминоборановых растворов
никелирования
|
Компонент
и режим осаждения
|
Концентрация,
моль/л
|
|
№1
|
№2
|
№3
|
|
NiCl2∙6H2O
(хлорид никеля)
|
0,101
|
-
|
0,063÷0,084
|
|
NiSO4∙6H2O
(сульфат никеля)
|
-
|
0,114
|
-
|
|
(CH3)2NHBH3
(ДМАБ)
|
0,170
|
0,059
|
-
|
|
BH3∙N2H4
(гидразинборан)
|
-
|
-
|
0,011÷0,033
|
|
Nа(CH3COO)2∙3H2O
(ацетат натрия)
|
0,268
|
-
|
-
|
|
CH2(COONa)2∙H2O
(малонат натрия)
|
-
|
0,230
|
-
|
|
Этилендиамин
(50%)
|
-
|
-
|
10÷25
(в
г/л)
|
|
CH3COOK
(ацетат калия)
|
-
|
-
|
0,357÷0,612
|
|
рН
|
5,5
|
5,5
|
8,5÷10,5
|
|
Температура,
°С
|
60
|
77
|
20÷50
|
|
Скорость
осаждения, мкм/ч
|
14
|
21
|
0,6÷3,0*
|
*Рассчитано
по скорости за 30 мин.
Применяют также аминобораны, не растворимые в
воде, например диэтиламиноборан (диэтилборазан) (C2H5)2NHBH3
(ДЭАБ) [1]. Осаждение никеля аминобораном R2NHBH3,
растворённым в этаноле, протекает в результате восстановительных реакций:
R2NHBH3
+3 NiCl2
+ 3H2O
→
3Ni↓ + R2NH2Cl
+ H3BO3
+ 5HCl (1.14)
R2NHBH3
+ 8NiCl2
+ 6H2O
→
2Ni2B↓
+ 4Ni↓ +4R2NH2Cl
+ H2
+ 5HCl (1.15)
Существует опасность разложения аминоборана под
воздействием выделяющейся кислоты:
R2NBH3
+ HCl + 3H2O
→
R2NH2Cl
+H3BO3
+3H2
(1.16)
Разложение можно предотвратить с помощью
буферных веществ [2].
Количество бора в покрытиях, осаждаемых с
помощью аминоборанов, уменьшается при повышении рН раствора, и может быть меньше
1 масс. %.
Покрытия из практически чистого никеля (99,5 ÷
99,7%) получают при восстановлении этилендиаминдибораном (СН2∙NH2)2∙2BH3;
их твёрдость в свежеосаждённом состоянии достигает 12∙109 Па.
Осаждение ведут при 50 °С из раствора, содержащего этилендиаминовый комплекс Ni(II),
pH ≈
13, скорость никелирования около 2 мкм/ч.
Для металлизации пластмасс пригоден раствор №3
(табл. 1.7.), содержащий в качестве восстановителя гидразинборан BH3∙N2H4,
получаемый из гидразина и борогидрида. При рН = 8,5 ÷
10,5 и
20 ÷
50 °С
скорость осаждения составляет 0,3 - 1,5 мкм за 30 мин, а при перемешивании -
примерно в 2 раза выше. Покрытия содержат 1,6 ÷
2,5 % В [1].
1.2
Химическое палладирование
Палладиевые покрытия применяются для придания
изделиям высокой коррозионной стойкости, электропроводности, термостойкости,
износостойкости, а также в качестве замены золотых покрытий в радиоэлектронике
и других отраслях промышленности. Так как электролитический способ
палладирования не обеспечивает получения равномерных покрытий для изделий
сложного профиля, в таких случаях используется химическое палладирование.
Осаждение палладия химическим способом возможно
на стали, никеле, алюминии. Процесс имеет автокаталитический характер. Первые
же порции палладия, осевшие на поверхности указанных металлов, действуют как
катализаторы, и процесс в дальнейшем развивается без осложнений. Для
палладирования таких некаталитических металлов, как медь и её сплавы, на
поверхности изделий осаждают слой серебра или никеля (химическим или электрохимическим
способом) [4].
В работе [5] изучалось безэлектролизное
формирование плёнок палладия на 304 нержавеющей стали и их коррозионную
устойчивость. Эти покрытия толщиной около 1 мкм имеют хорошую адгезию к
подложке, превосходную коррозионную устойчивость: скорость коррозии на 3 ÷
4 порядка
меньше, чем в случае образцов стали, где нет плёнки палладия. Также они не
корродируют в растворах с концентрацией менее 0,1% NaCl.
Палладий вследствие своих каталитических свойств
способен восстанавливаться многими восстановителями, но наиболее часто для его
восстановления используют гипофосфит, борогидрид, гидразин [1].
1.2.1
Гипофосфитные растворы палладирования
Восстановление палладия происходит согласно
схеме реакции [6]:
Pd2+
+ H2PO2-
+ 3OH-
→ Pd + HPO32-
+ H2O
(1.17)
При использовании в качестве восстановителя
гипофосфита лигандами для связывания Pd(II)
являются аммиак, этилендиамин, смесь этилендиамина и ЭДТА, смесь аммиака и
пирофосфата [4]. Химическое палладирование осуществляют из растворов, составы
которых приведены в таблице 1.8.
Таблица 1.8 - Гипофосфитные растворы
палладирования
|
Компоненты
и режим осаждения
|
Концентрация,
моль/л
|
|
№1
|
№2
|
№3
|
№4
|
№5
|
|
PdCl2
(хлорид палладия)
|
0,05
|
0,011
|
0,011
|
0,010
|
0,05
|
|
NaH2PO2∙H2O
(гипофосфит натрия)
|
0,05
|
0,094
|
0,094
|
0,069
|
0,05
|
|
Na4P2O7∙10H2O
(пирофосфат натрия)
|
0,11
|
-
|
-
|
-
|
0,115
|
|
NH4F
(фторид аммония)
|
0,3
|
-
|
-
|
-
|
0,4
|
|
NH4Cl
(хлорид аммония)
|
-
|
0,505
|
0,505
|
-
|
-
|
|
NH3∙H2О
(25%-ный раствор), мл/л
|
8
|
160
|
179
|
-
|
8
|
|
HCl (соляная
кислота; плотность 1,19), мл/л
|
-
|
4
|
4
|
-
|
-
|
|
H2NCH2CH2NH2
(этилендиамин)
|
-
|
-
|
-
|
0,083
|
-
|
|
рН
|
10
|
9,8
|
9,8
|
4÷10
|
10
|
|
Температура,
°С
|
45÷55
|
30÷80
|
30÷80
|
60
|
22÷70
|
|
Скорость
осаждения, мкм/ч
|
3÷4
|
1,0÷10
|
1,2÷10
|
1,7
|
(0,3÷0,4)
÷
8
|
Из раствора №1 получаются светлые,
гладкие палладиевые покрытия толщиной до 10 мкм на меди и на медных сплавах, на
никеле, кобальте и их сплавах, серебре и платине.
Скорость осаждения покрытий из раствора №2 при
30 °С (рН = 9,8) равна примерно 1,0 мкм/ч, а при 80 °С (рН = 9,8) ~ 10 мкм/ч
[4].
Покрытия, получающиеся из раствора №3, содержат
около 1,5% Р, твёрдость - 1,6∙109 Па. Для увеличения
стабильности раствора предложено вводить Na2S2O3
(1,5∙10-4 моль/л; скорость палладирования при 40 °С равна 2 ÷
3 мкм/ч).
Покрытия, получающиеся из раствора №4 включают 4
÷
8 % Р, малопористы, твёрдость - (1,7 ÷ 2,8)∙109
Па. В растворах такого состава при соотношении концентраций H2PO2-
и этилендиамина, равном 1, осаждение Pd
не сопровождается выделением водорода.
Максимальное количество покрытия в период
стабильности раствора №5 осаждается при 50 °С. Покрытия содержат 1 ÷
1,5 % Р [1].
1.2.2
Гидразиновые растворы палладирования
Процесс восстановления Pd(II)
можно представить в виде:
2Pd(NH3)22+
+ N2H4
+ 4OH-
→ 2Pd + 3H2
+ 2N2
+ 4H2O
+ 2NH3
(1.18)
Гидразиновые растворы палладирования основаны на
использовании аммиачных комплексов палладия (таблица 1.9).
Таблица 1.9 - Гидразиновые растворы
палладирования
|
Компоненты
и режим осаждения
|
Концентрация,
моль /л
|
|
№1
|
№2
|
|
PdCl2 (хлорид
палладия)
|
0,023
|
0,024
|
|
N2H4∙H2O
(гидрат гидразина)
|
0,033
|
0,006
|
|
NH3∙H2О
(25%-ный раствор), мл/л
|
300÷350
|
350
|
|
Трилон
Б2
|
|
|
|
Na2ЭДТА
|
-
|
0,101
|
|
Температура,
°С
|
50÷55
|
80
|
|
Скорость
осаждения, мкм/ч
|
2÷3
|
25
|
Для приготовления раствора хлористый палладий
растворяют при нагревании в 25%-ном растворе аммиака, затем добавляют трилон Б,
после чего раствор фильтруется. Гидразингидрат в виде 5%-ного раствора
добавляют непосредственно перед началом процесса. Через каждые 30 мин добавляют
половину первоначального количества гидразингидрата. Для ускорения процесса
палладирования применяется встряхивание покрываемых изделий или покрытие в
барабанах. Раствор палладирования не отличается устойчивостью, поэтому
необходимо тщательно следить за тем, чтобы в раствор не попадали механические
загрязнения и химические примеси.
Раствор палладирования можно регенерировать
одним из следующих способов.
Первый способ заключается в том, что раствор
упаривают до небольшого объёма и палладий осаждают диметилглиоксимом: осадок
отделяют из раствора и прокаливают при температуре 700 °С; полученную окись
палладия растворяют в царской водке, удаляют из раствора азотную кислоту и
используют для приготовления растворов палладирования, предварительно
проанализировав на содержание иона палладия.
По второму способу отработанный раствор
химического палладирования подкисляют концентрированной соляной кислотой в
присутствии индикатора - метилоранжа; при этом выпадает осадок диаминохлорида
палладия, который отфильтровывают и сразу же промывают несколько раз холодной
дистиллированной водой (8 - 10 °С) до отсутствия ионов хлора. Отмытый осадок
растворяют в 25%-ном растворе аммиака и используют (после определения
концентрации палладия) для приготовления раствора палладирования. Толщина
палладиевого покрытия определяется по образцу-«свидетелю» взвешиванием до и
после нанесения покрытия или методом снятия покрытия в азотной кислоте (1:1) с
последующим определением палладия весовым методом [2].
1.2.3
Борогидридные растворы палладирования
При восстановлении Pd
(II) борогидридом
автокаталитический процесс осуществлён лишь в цианидных растворах при
температуре выше 85 °С; скорость палладирования составляет около 1 мкм/ч.
Осаждаются покрытия Pd
- B, содержащие (2,4
÷ 2,8)% В. В процессе палладирования наблюдается
явление пассивирования покрытия. Стабильность раствора можно повысить введением
ЭДТА и тиомочевины; тогда скорость осаждения покрытия при 95 °С достигает 2 ÷
3 мкм/ч.
Из аммиачных растворов палладирования можно
осадить сплавы Pd
- Ni - P
(6% Ni), Pd
- Co - P
(9% Co), Pd
- Zn - P
(36% Zn), а из
цианидных растворов - Pd
- Ni - B
(20%), Pd - Cu
- B (9% Cu)
[1].
1.3
Осаждение сплава Ni
- Pd
из органических электролитов
Палладиевые покрытия всё больше и больше
становятся важными, потому что они применяются в различных областях.
Покрытия из никеля, палладия используют в
производстве соединительных устройств (электроконтактов, выводов и др.) для
обеспечения электропроводности, пайки, сварки, защитных свойств и сохранности
этих качеств в течение длительного времени [7]. Палладиевые покрытия применяют
в электронных устройствах как функциональные покрытия печатных плат [8-10] и
кремниевых элементов [11], в производстве мембран для получения водорода
высокой чистоты [12], в качестве катализаторов многочисленных реакции [13], как
активаторы медных подложек для нанесения на них полиимидных плёнок [14].
Известно, что электрохимически осаждённые покрытия из сплава палладий - никель
характеризуются значительно большей износостойкостью, микротвёрдостью, меньшими
внутренними напряжениями, меньшей склонностью к наводораживанию, чем чистый
палладий. Благодаря вышеперечисленным свойствам и низкому переходному
сопротивлению покрытия из сплава палладий-никель рекомендуется использовать в
качестве финишных при сборке печатных плат, а также как подслой для химического
осаждения тонких плёнок золота. Сплав Pd-Ni-P
(70-85 % Pd) может
заменить золото [7].
Развитие различных технологии получения
нанокристаллических покрытий палладия включены во многие
научно-исследовательские программы (США, Европа), которые нацелены на улучшение
функциональных свойств покрытий [15-16].
«Сухие» процессы получения плёнок (например,
ионно-плазменное напыление и вакуумное напыление) являются относительно
дорогими и в промышленности не используются.
Метод электроосаждения покрытий из водных
электролитов непригоден для осаждения функциональных покрытий палладия и его
сплавов на высокоплотную печатную плату и на каталитические элементы со сложной
геометрией и внутренними каналами [12].
Взамен ему приходит химический метод
(автокаталитическое безэлектролизное осаждение плёнок). Он используется не
только в традиционных областях нанесения защитно-декоративных покрытий,
металлизации пластмасс, получения токопроводящих промежуточных слоёв, но и в
электронной технике. Поскольку этот метод требует меньших энергозатрат и
значительно более дешёвого нанесения металлов, а также с электрохимическим
осаждением из растворов, он всё чаще используется для обеспечения сборки
печатных плат и интегральных микросхем [7]. Он позволяет получать равномерно
распределённые покрытия на любых поверхностях независимо от их проводящей или непроводящей
природы и геометрических характеристик, например на волокнистых материалах,
пудрах и т.д. [13].
1.3.1
Органические электролиты для осаждения сплава Pd-Ni
Современные исследования направлены на развитие
новых безэлектролизных технологии осаждения. Одним из них является
безэлектролизное осаждение из органических электролитов тонких плёнок палладия
и его сплавов. Отличительная черта метода: способность апротонных-диполярных
органических растворителей связывать переходные металлы в комплексы (происходит
их координация). В результате существенно изменяется структура полученного
покрытия. Достоинства этого метода: простой и воспроизводимый процесс,
значительно расширился состав осаждаемых сплавов [12].
Металлическую подложку погружают в раствор, состоящий
из галогенидов металлов, хлорида аммония и апротонно-диполярного органического
растворителя с донорно-акцепторной способностью.
Процесс проводят при температуре 50÷90
°С в термостатируемой ячейке. На образец, помещённый в раствор, воздействуют
ультразвуком.
Состав и толщина покрытий контролируются
изменением состава органического раствора, изменением температуры
(50÷90 °С), длительности обработки (0,5÷15
мин), продолжительностью воздействия ультразвука.
Осаждение металла происходит согласно схеме, представленной
на рисунке 1.2:
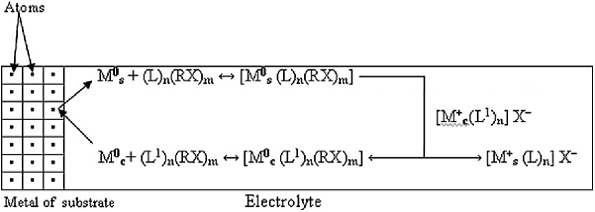
Рисунок 1.2 - Схематическое представление
взаимодействия подложки и органического растворителя. Ms
- атом подложки, Mc
- атом покрытия, RX
- галогенид, L,L1
-органические лиганды, (L)n(RX)m
- молекулярные ассоциаты.
Схема отражает цепочку превращений:
. Атом подложки M0s
экстрагируется (извлекается) в раствор.
. В растворе он взаимодействует с молекулярными
ассоциатами (L)n(RX)m,
образуя комплекс нуль-валентного металла (он окружён ионными комплексами
осаждаемого металла [M+c(L1)n]X-):
M0s + (L)n(RX)m
↔ [M0s(L)n(RX)m] (1.19)
3. Происходит следующая реакция:
[M0s(L)n(RX)m]
+ [M+c(L1)n]X- ↔
[M+s(L)n]X- + [M0c(L1)n(RX)m]
(1.20)
4. Комплекс [M0c(L1)n(RX)m]
распадается на атом металла M0c
и органические лиганды (L1)n(RX)m,
которые вновь участвуют в процессе:
[M0c(L1)n(RX)m]
↔ M0c + (L1)n(RX)m
(1.21)
Процесс повторяется снова.
В результате, атомы подложки (металла)
замещаются на атомы осаждаемого металла, формируя эпитаксиальное
ориентированное покрытие с хорошей адгезией.
Образование сплошной плёнки сопровождается
изоляцией подложки от раствора и, следовательно, постепенным затруднением
участвовать в химической реакции. В итоге, на подложке формируется плёнка
толщиной 0,1-0,3 мкм [12].
Химическое осаждение сплава
палладий - никель
проводили из этилендиаминовых растворов.
1.3.2
Этилендиаминовые растворы
Раствор № 1.
Состав раствора № 1 следующий (таблица 1.10).
Существуют, наверное, и другие растворы для получения сплава Pd-Ni.
Таблица 1.10 - Состав раствора №1
|
Компонент
и режим осаждения
|
Содержание,
моль/л
|
|
PdCl2
(хлорид палладия)
|
0,01
|
|
NiCl2
(хлорид никеля)
|
0,01
÷ 0,17
|
|
NH4Cl
(хлорид аммония)
|
0,05
|
|
NaH2PO2∙H2O(гипофосфит
натрия)
|
0,12
|
|
EDA
|
0,4
|
|
рН
|
7,1
÷ 12,0
|
|
Температура,
°С
|
60
± 2
|
рН раствора изменяли в пределах 7,1 ÷
12,0 путём добавления 34,5 % раствора соляной кислоты (HCl)
или 25 % раствора NH3
в воде. Осаждение проводили при температуре 60±2 °С. В качестве подложки
использовали медную фольгу (99,9 ат.% Cu),
активированную в 0,01 М растворе PdCl2.
В работе [7] изучали влияние рН на соотношение
элементов в сплаве (таблица 1.11).
Таблица 1.11 - Состав плёнок сплава Pd
- Ni толщиной 1 мкм, в
зависимости от рН раствора при концентраций NiCl2
0,08 моль/л
|
рН
|
Состав
сплава, ат.%
|
|
Pd
|
Ni
|
P
|
|
11,2
|
94,9
|
0,3
|
4,8
|
|
10,6
|
94,2
|
1,0
|
4,8
|
|
9,8
|
91,8
|
3,8
|
4,4
|
|
8,5
|
57,2
|
36,0
|
6,8
|
|
7,6
|
10,7
|
81,8
|
7,5
|
Установлено, что:
. Уменьшение рН раствора вызывает увеличение
содержания никеля в сплаве, причём при изменении рН от 9,8 до 7,6 наблюдается
скачкообразный рост содержания никеля от 3,8 до 81,8 %. Относительно малое
содержание никеля в сплаве в интервале значений рН 9,5 ÷
11,2 может
быть обусловлено пониженной именно в этом интервале скоростью восстановления из
этилендиаминовых растворов.
. Содержание фосфора в сплаве увеличивается от
4,4 (рН = 9,8) до 7,5 ат.% (рН = 7,5).
Изучен фазовый состав покрытий Pd-Ni
в зависимости от содержания в нём Pd
и Ni. Установлено, что:
. При содержании никеля в сплаве менее 7 ат. %
осаждаемые покрытия рентгеноаморфны.
. Плёнки Pd-Ni-P
с содержанием никеля в сплаве от 7 ÷
12 ат. % [7] включают кристаллическую фазу - твёрдый раствор палладия в
никеле[17] с концентрацией палладия 20 ат.% (acub
= 3,612 Å) [7] и аморфный палладий [13].
. При содержании никеля 36 ÷
82 ат.% [7] сплав содержит помимо аморфного палладия кристаллическую фазу Ni3P
[17].
СЭМ исследование показало, что морфология
поверхности плёнок существенным образом зависит от условий осаждения сплава
(концентрации соли никеля, рН электролита). Установлено, что:
. Из растворов с концентрации соли никеля 0,01
моль/л формируются пористые покрытия с размерами пор 0,05 ÷
0,20 мкм и размерами зёрен 0,5 ÷
2,5 мкм (рисунок 1.5).
. При концентрации Ni(II)
0,08 моль/л происходит формирование очень малопористых покрытий с единичными
порами диаметром менее 0,03 мкм. Размеры зёрен находятся в пределах 0,7 ÷
2,0 мкм
(основная масса зёрен 1 мкм). На поверхности зёрен имеются многочисленные
зародыши с размерами 0,07 ÷ 0,20 мкм
(рисунок 1.5).
. Из раствора с концентраций Ni(II)
0,17 моль/л осаждаются покрытия с размерами зёрен 1 ÷
2 мкм,
характеризующиеся высокими внутренними напряжениями, о чём свидетельствует
наличие множества трещин (рисунок 1.3) [7].

Рисунок 1.3 - СЭМ фотографии поверхности плёнок Pd-Ni
толщиной 1 мкм, осаждённых из растворов с концентрацией NiCl2,
моль/л: а - 0,01, б - 0,08, с - 0,017.
Раствор №2.
Состав раствора №2 следующий (таблица 1.12).
Таблица 1.14 - Состав раствора №2.
|
Компонент
и режим осаждения
|
Содержание,
моль/л
|
|
PdCl2
(хлорид палладия)
|
0,011
|
|
NiCl2∙6H2O
(хлорид никеля)
|
0,021
|
|
NH4Cl
(хлорид аммония)
|
0,505
|
|
NaH2PO2∙H2O
(гипофосфит натрия)
|
0,104
|
|
EDA
|
0,499
|
|
HCl (соляная
кислота, 1N)
|
16
мл/л
|
|
NH3∙H2О
(25%-ный раствор)
|
160
мл/л
|
|
рН
|
9,5
÷ 10,5
|
|
Температура,
°С
|
45
÷ 55
|
Этилендиамин использовался в качестве
стабилизатора (в процессе осаждения раствор самопроизвольно разлагается). Сплав
осаждали на стальные подложки, которые предварительно обезжиривали в растворе Na3PO4
(50 °C) и для снятия
оксидного слоя обрабатывали в 20 масс. % HCl,
при температуре 45 ÷ 55 °С.
В работе [13] изучено влияние различных факторов
на скорость осаждения. Скорость осаждения возрастает:
. с повышением температуры: 0,7 мкм/ч при 35 °C
и 5,6 мкм/ч при 65 °C
. с повышением рН: 0,8 мкм/ч при рН = 8,5, 2,5
мкм/ч при рН = 11,5
. с уменьшением концентрации EDA:
4,8 мкм/ч при 0,1 М EDA
и 1,2 мкм/ч при 0,5 М EDA
. С увеличением отношения [[PdCl2∙2H2O]+[NiCl2∙6H2O]]/[NaH2PO2∙H2O]:
2,1 мкм/ч и 3,6 мкм/ч при отношении 0,3 и 2,4 соответственно.
Изучен элементный состав покрытий Pd-Ni
в зависимости от рН раствора (таблица 1.15).
Таблица 1.15 - Состав сплава покрытий Pd-Ni
в зависимости от рН раствора №2
|
рН
|
Состав
сплава, ат.%
|
|
Pd
|
Ni
|
P
|
|
11,5
|
70
|
18
|
12
|
|
10,5
|
73
|
16
|
9
|
|
10
|
75
|
16
|
9
|
|
9,5
|
79
|
14
|
7
|
|
8,5
|
85
|
8
|
7
|
Обнаружено, что с уменьшением рН раствора №2
содержание Ni и P
в покрытий Pd-Ni
уменьшается.
Также установлено, что микротвёрдость покрытий
сплава Pd - Ni
увеличивается с увеличением содержания Ni
и P. После
термообработки (500 °С) покрытий микротвёрдость увеличивается (таблица 1.13).
Таблица 1.13 - Состав сплава и соответствующие
им значения микротвёрдости свежеосаждённых и термообработанных покрытий сплава Pd
- Ni
|
Состав
сплава, %
|
Микротвёрдость,
109
Па
|
|
Pd
|
Ni
|
P
|
Свежеосаждённый
|
Термообработанный
(500 °С)
|
|
85
|
8
|
7
|
4,61
|
5,10
|
|
75
|
16
|
9
|
4,71
|
5,10
|
|
70
|
18
|
12
|
4,90
|
5,59
|
Микротвёрдость покрытий близка к
электроосаждённому Pd-Ni
сплаву. Паяемость покрытий толщиной 3 мкм приблизительно такая же, как у
электроосаждённых покрытий золота [13].
Глава
2. Практическая часть
2.1
Приготовление электролитов для химического никелирования
Плёнки никель-фосфор (Ni-Р)
осаждали на медные (99,9%) подложки из гипофосфитных электролитов (таблица
2.1).
Таблица 2.1 - Составы растворов химического
осаждения плёнок Ni-Р
|
Компонент
и режим осаждения
|
Концентрация,
моль/л
|
|
№1
|
№2
|
№3
|
|
NiCl2∙6H2О
(хлорид никеля)
|
0,034
|
0,068
|
0,102
|
|
NaF (фторид натрия)
|
0,01
|
0,02
|
0,03
|
|
Na4P2O7∙10H2O
(пирофосфат натрия)
|
0,001
|
0,002
|
0,003
|
|
NaH2PO2∙H2О
(гипофосфит
натрия)
|
0,086
|
0,172
|
0,258
|
|
NH3∙H2О
(25%-ный раствор), мл/л
|
100
|
200
|
300
|
|
рН
|
12,03
|
12,07
|
12,11
|
|
Температура,
°С
|
60
|
60
|
60
|
|
Время,
мин
|
10÷60
|
15÷60
|
15÷60
|
|
Скорость
осаждения, мкм/ч
|
5,9
|
9,7
|
12,4
|
Для приготовления раствора химического
никелирования навеску соли никеля растворить в небольшом количестве воды. В
приготовленный раствор последовательно добавить растворы NaF,
Na4P2O7∙10H2O
и в последнюю очередь NaH2PO2∙H2O.
После добавления новой порции раствора вновь полученный раствор размешивать до
тех пор, пока он не станет прозрачным. После чего добавить 25%-ный водный
раствор аммиака NH3∙H2O
и размешать. Получившийся раствор вылить в мерную колбу. Довести раствор до
метки путём добавления в него определённого количества воды. Измерить рН.
Варьировать рН путём добавления некоторого количества соляной кислоты HCl
(уменьшение рН) или 25%-ного водного раствора NH3∙H2О
(увеличение рН).
2.2
Приготовление электролитов для химического палладирования
Плёнки палладий-фосфор (Pd-Р)
осаждали на медные (99,9%) подложки из электролитов, приведенных в таблице 2.2.
Таблица 2.2 - Составы растворов химического
осаждения плёнок Pd-P
|
Компонент
и режим осаждения
|
Концентрация,
моль/л
|
|
№1
|
№2
|
№3
|
№4
|
|
PdCl2 (хлорид
палладия)
|
0,01410
|
0,00564
|
0,00564
|
0,00564
|
|
NH3∙H2О
(25%-ный раствор), мл/л
|
100
|
100
|
100
|
100
|
|
Na4P2O7∙10H2O
(пирофосфат натрия)
|
0,001
|
0,001
|
0,001
|
0,001
|
|
NaF (фторид натрия)
|
0,01
|
0,01
|
0,01
|
0,01
|
|
NaH2PO2∙H2О
(гипофосфит
натрия)
|
0,043
|
0,043
|
0,043
|
-
|
|
рН
|
|
|
|
9,90
|
|
Температура,
°С
|
62
|
56
|
16
|
60
|
|
Время,
мин
|
15
|
15
|
15
|
15÷60
|
Для того чтобы приготовить раствор химического
палладирования, нужно:
. Взвесить 2,5 г/л PdCl2
(раствор №1) и 1 г/л (соответственно растворы №2, №3, №4).
. Внести PdCl2
в химический стакан, который был предварительно вымыт (царская водка, хромовая
смесь) и высушен.
. Добавить в стакан несколько капель соляной
кислоты HCl, для того
чтобы хлорид палладия PdCl2
растворился.
. В стакан добавить 100 мл/л 25%-ного водного
раствора NH3∙H2О.
В стакане появляются хлопья. Раствор окрашивается в розовый цвет.
. Подогреть раствор на электрической плитке, для
того чтобы хлопья растворились и раствор стал прозрачным (чтобы стакан не
треснул, необходимо подлить определённое количество воды).
. После того как раствор стал прозрачным,
охладить его.
. Взвесить 0,45 г/л Na4P2O7∙10H2O
и растворить в небольшом количестве воды.
. Взвесить 0,42 г/л NaF
и растворить в небольшом количестве воды.
. Взвесить 4,56 г/л NaH2PO2∙H2О
(соответственно растворы №1, №2, №3) и растворить в небольшом количестве воды.
. В раствор PdCl2
влить последовательно растворы Na4P2O7∙10H2O,
NaF, NaH2PO2∙H2О.
После каждого вливания, получившийся раствор размешать до тех пор, пока он не
станет прозрачным.
. Получившийся раствор вылить в мерную колбу.
. Довести раствор до метки путём добавления в
него определённого количества воды.
. Измерить рН.
. Варьировать рН путём добавления некоторого
количества соляной кислоты HCl
(уменьшение рН) или 25%-ного водного раствора NH3∙H2О
(увеличение рН).
2.3
Порядок операций для безэлектролизного осаждения никелевых и палладиевых
покрытий
Порядок операций для безэлектролизного осаждения
никелевых и палладиевых покрытий приведён ниже (действия 2 - 7 представляют
собой подготовку подложек к осаждению покрытий из никеля и палладия):
. Взвешивание подложек.
. Обезжиривание подложек в течение 10 ÷
15 мин при температуре 60 ± 2°С.
. Промывка подложек дистиллированной водой.
. Для снятия оксидного слоя подложки
обрабатывают в 10% водном растворе соляной кислоты HCl
в течение 30 ÷ 40 с при
температуре 18 ± 2 °С (декапирование).
. Промывание подложек дистиллированной водой.
. Активирование подложек в солянокислом растворе
PdCl2
в течение 30 ÷ 40 с при
температуре 18 ± 2 °С.
. Промывание подложек дистиллированной водой.
. Внесение подложек в растворы никелирования или
палладирования. Рабочая температура 60 ± 1 °С. Длительность обработки: 10 ÷
60 мин.
. Промывка подложек с покрытием дистиллированной
водой.
. Высушивание подложек.
. Взвешивание подложек.
2.4
Методы исследования
2.4.1
Гравиметрический анализ
Гравиметрические измерения проводили на
аналитических весах (точность измерения 10-4), взвешивали образцы до
и после осаждения покрытий.
Толщину рассчитывали по формуле:
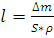 ,
,
где  -
разность массы образца после и до взвешивания образца;
-
разность массы образца после и до взвешивания образца;
 -площадь подложки;
-площадь подложки;
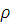 -плотность никеля
или палладия.
-плотность никеля
или палладия.
2.4.2
Рентгенофазовый анализ
Исследования фазового состава плёнок проводили с
помощью рентгеновского дифрактометра ДРОН- 3.0. Съёмку рентгенограмм выполняли
на медном излучении CuKα
со скоростью 1град/мин. Идентификацию линий на ренгенограммах проводили с
использованием данных картотеки PCPDF
WIN. Подложки с
покрытием перед снятием рентгенограмм не подвергали термической обработке.
2.4.3
Изучение морфологии поверхности
Морфологию поверхности покрытий изучали методами
сканирующей (микроскоп LEO
1420) и просвечивающей электронной спектроскопии на микроскопе ЭМ-125. Для
просвечивающей электронной микроскопии подложки готовили методом углеродных
реплик.
2.5
Техника безопасности
При работе в химической лаборатории необходимо
соблюдать порядок, чистоту и правила техники безопасности, так как в противном
случае могут возникнуть несчастные случаи с тяжёлыми последствиями. Все
химические реактивы следует хранить только в соответствующей посуде с
этикетками. Надо обязательно понимать, что все химические вещества ядовиты.
Запрещается в лаборатории пить воду, принимать пищу, курить.
По окончании пользования, водой и
электроприборами необходимо немедленно закрывать краны и отключать
элктроприборы. Уходя из лаборатории проверять окончание химических процессов,
выключен ли газ, электрические приборы (тяга, рН-метр, различные устройства).
При выполнении курсовой велась работа со
следующими реактивами: соль никеля (NiCl2∙6H2O),
водный раствор аммиака, соляная кислота.
При работе с солями никеля следует избегать
попадания соли на кожные покровы, поскольку соли никеля являются аллергенами. В
случае попадания на кожу смыть большим количеством воды [18].
Водный раствор аммиака представляет собой
прозрачную (иногда с желтоватым оттенком) жидкость с резким запахом. Жидкий
аммиак вызывает сильные ожоги кожи. При содержании в воздухе 0,5 об.% аммиака
сильно раздражает слизистые оболочки. При остром отравлении поражаются глаза и
дыхательные пути, при хронических отравлениях наблюдются расстройство
пищеварения, катар верхних дыхательных путей, ослабление слуха. Предельно-допустимая
концентрация (ПДК) составляет 20 мг/м3. Смесь аммиаки с воздухом
взрывоопасна, для воздушно-аммиачных смесей, содержащих 9
÷ 57 об.% аммиака температура вспышки около 1000 °С
[19].
Соляная кислота сильно раздражает слизистые
оболочки дыхательных путей. В лёгких случаях - першение в горле, жжение,
чувство сжатия и стеснения в груди, сухой кашель, охриплость, чиханье, насморк,
затруднённое дыхание. При тяжёлых отравлениях - тяжёлое общее состояние, резкая
синюшность лица, который может перейти в клокочущее дыхание с обильным
отделением пенистой жидкости. При поражении глаз - слезотечение, покраснение
конъюнктивы, спазм век. При приёме внутрь - тошнота, рвота, боль в желудке
[20].
При работе с электроприборами возможны короткие
замыкания, приводящие к пожарам. Они возникают при соприкосновении между собой
оголённых проводов, трёхфазных проводов с землёй. Таже они появляются во
внутренних проводах вследствие повреждения изоляции: механические повреждения,
химические воздействия, естественное старение, сырость, высокая температура. Но
короткие замыкания могут возникать, не только в этих случаях, а также в
результате прохождения тока между проводами, не соприкасающимися друг с другом,
но электрически соединёнными между собой, благодаря соприкосновению их с
металлическими предметами. Короткие замыкания могут возникнуть не только в
проводах, а в других частях электрических устройств.
Вместе с тем пожарную опасность представляют
всевозможные неплотные контакты (присоединения контактов к приборам или при
сращивании их между собой). Неплотные контакты окисляются и создают большое
сопротивление. Они чрезмерно нагреваются и вызывают воспламенение изоляции
проводов, а также могут искриться [18].
Глава
3. Результаты и их обсуждение
3.1
Результаты химического никелирования
Для изучения закономерностей восстановления
никеля(II) в щелочных
пирофосфатных электролитах, что необходимо для последующего выбора условий для
совместного восстановления Pd(II)
и Ni(II)
в пирофосфатных электролитах для получения сплава, использовались электролиты
составов 1 - 3, приведенные в таблице 2.1. Использование
аммиачно-пирофосфатных электролитов с рН ~ 12,07 позволяет получать равномерные
по окраске никелевые покрытия. Скорость формирования покрытий существенно
зависит от концентрации Ni(II).
С ростом концентрации Ni(II)
скорость формирования покрытий растет. С максимальной скоростью 12,2 мкм/час
осаждение происходит из электролита, содержащего 0,102 моль/л Ni(II),
с минимальной - 5,6 мкм/час из электролита с С(Ni(II))
= 0,034 моль/л. Таким образом очевидно, что увеличение концентраций Ni(II)
в 3 раза приводит к увеличению скорости роста покрытия в 2,1 раза. Необходимо
отметить, что все изученные в работе аммиачно-пирофосфатные электролиты
никелирования являются устойчивыми как при хранении, так и при эксплуатации.
Рисунок 3.1 - Зависимость толщины
плёнок никель-фосфор (Ni-Р) от времени осаждения из
растворов №1, №2, №3

Рисунок 3.2 - Зависимость толщины
плёнок Ni-Р
концентрации NiCl2∙6H2O (время
осаждения: 60 мин)
Результаты рентгенофазового анализа покрытий Ni-P
приведены в таблицах 3.1 - 3.6.
Установлено, что покрытия, осаждающиеся из
раствора №1, являются кристаллическими, состоящими из одной фазы Ni5P2
(таблица 3.1).
Таблица 3.1 - Результаты рентгенофазового
анализа покрытия Ni-P,
полученного из раствора №1 в течение 20 мин.
|
Теорет.
|
Практ.
|
Вещество
|
|
2θ
|
I,%
|
2θ
|
I,%
|
|
|
44,900
|
4
|
44,70
|
100
|
Ni5P2
|
|
50,431
|
46
|
50,40
|
13
|
Cu
|
|
74,127
|
16;
20
|
74,12
|
97
|
Ni5P2, Cu
|
|
89,826
|
17
|
89,87
|
6
|
Cu
|
При увеличении длительности осаждения до 60 мин
на рентгенограмме, кроме Ni5P2,
фиксируются пики NiO,
что свидетельствует о пассивации поверхности и объясняет уменьшение
эффективности восстановления Ni(II)
из раствора №1 (таблица 3.2).
Таблица 3.2 - Результаты рентгенофазового
анализа покрытия Ni-P,
полученного из раствора №1 в течение 60 мин.
|
Теорет.
|
Практ.
|
Вещество
|
|
2θ
|
I,%
|
2θ
|
I,%
|
|
|
37,249
|
60
|
37,52
|
3
|
NiO
|
|
43,287
|
100
|
43,40
|
8
|
NiO
|
|
44,900
|
4
|
44,80
|
69
|
Ni5P2
|
|
50,431
|
50,45
|
11
|
Cu
|
|
74,127
|
16;
20
|
74,04
|
100
|
Ni5P2, Cu
|
|
75,509
|
16
|
75,50
|
4
|
Ni5P2
|
|
76,584
|
16
|
76,58
|
3
|
Ni5P2
|
|
77,394
|
16
|
77,35
|
2
|
Ni5P2
|
|
89,826
|
17
|
89,87
|
8
|
Cu
|
По результатам рентгенофазового анализа покрытия
Ni-P,
полученного из электролита №2, установлено, что осаждаемое покрытие является
кристаллическим, состоящим из одной кристаллической фазы Ni5P4.
В сравнении с покрытиями, полученного из
раствора №1 возрастает доля фосфора в покрытии, что обуславливает формирование
фазы, обогащённой фосфором Ni5P4
вместо Ni5P2
(таблицы 3.3, 3.4).
Таблица 3.3 - Результаты рентгенофазового
анализа покрытия Ni-P,
полученного из раствора №2 в течение 15 мин.
|
Теорет.
|
Практ.
|
Вещество
|
|
2θ
|
I,%
|
2θ
|
I,%
|
|
|
47,573
|
60
|
47,25
|
1
|
Ni5P4
|
|
52,453
|
60
|
52,65
|
100
|
Ni5P4
|
|
88,829
|
20
|
88,85
|
5
|
P
|
Таблица 3.4 - Результаты рентгенофазового
анализа покрытия Ni-P,
полученного из раствора №2 в течение 60 мин.
|
Теорет.
|
Практ.
|
Вещество
|
|
2θ
|
I,%
|
2θ
|
I,%
|
|
|
37,249
|
60
|
37,42
|
2
|
NiO
|
|
43,287
|
100
|
43,33
|
8
|
NiO
|
|
44,900
|
4
|
44,83
|
96
|
Ni5P2
|
|
50,431
|
46
|
50,43
|
19
|
Cu
|
|
74,127
|
16;
20
|
74,13
|
100
|
Ni5P2, Cu
|
|
75,509
|
16
|
75,58
|
2
|
Ni5P2
|
|
76,584
|
16
|
76,57
|
4
|
Ni5P2
|
|
77,394
|
16
|
77,35
|
2
|
Ni5P2
|
|
89,826
|
17
|
89,83
|
10
|
Cu
|
Из раствора №3 формируется Ni-P
покрытие, состоящее из кристаллической фазы Ni5P4
независимо от времени осаждения, что свидетельствует об отсутствии пассивации
поверхности подложки с увеличением времени обработки (таблицы 3.5, 3.6).
Таблица 3.5 - Результаты рентгенофазового
анализа покрытия Ni-P,
полученного из раствора №3 в течение 15 мин.
|
Теорет.
|
Практ.
|
Вещество
|
|
2θ
|
I,%
|
2θ
|
I,%
|
|
|
47,573
|
60
|
47,40
|
1
|
Ni5P4
|
|
52,453
|
60
|
52,60
|
100
|
Ni5P4
|
|
88,829
|
20
|
88,90
|
5
|
P
|
Таблица 3.6 - Результаты рентгенофазового
анализа Ni-P
покрытии, полученного из раствора №3 в течение 60 мин.
|
Теорет.
|
Практ.
|
Вещество
|
|
2θ
|
I,%
|
2θ
|
I,%
|
|
|
47,573
|
60
|
47,35
|
1
|
Ni5P4
|
|
52,453
|
60
|
52,68
|
100
|
Ni5P4
|
|
88,829
|
20
|
88,95
|
3
|
P
|
На рисунках 3.3-3.6 приведены микрофотографии
поверхности никеля. При изучении морфологии поверхности Ni-P
покрытий установлено, что в начале осаждения (10 мин обработки) на поверхности
покрытия присутствуют плотноупакованные сферические зёрна с размерами от 0,07
до 0,14 мкм (рисунок 3.3а). С увеличением длительности обработки (60
мин) зёрна на поверхности покрытия увеличиваются: от 0,07 до 2,27 мкм (рисунок
3.3б). Поверхность покрытия Ni-P
является практически беспористой: 0,3 пор/мкм2 (рисунок 3.3а),
0,0001 пор/мкм2 (рисунок 3.3б).


а б
Рисунок 3.3 - СЭМ снимки образцов, полученных из
раствора №1 при времени осаждения, мин: а - 10, б - 60.
Исследовали морфологию поверхности покрытий Ni-P
толщиной ~ 6,54 мкм, полученных из растворов №1, №2, №3 с помощью
просвечивающей электронной микроскопии (ПЭМ) с использованием метода углеродных
реплик. На снимках можно увидеть большое количество частиц, которые расположены
на исследуемой поверхности равномерно. Форма частиц - сферическая (рисунок 3.4а,
3.4б, 3.4в).
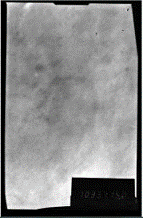


а б в
Рисунок 3.4 - ПЭМ снимки поверхности покрытия Ni-P
толщиной ~ 6,54 мкм, полученного из раствора: а - №1; б - №2; в
- №3.
На основании анализа ПЭМ снимков были построены
гистограммы - столбчатые диаграммы, которые показывают распределение числа
частиц в зависимости от их размера. Из гистограмм (рисунок 3.5а, 3.5б,
3.5в) видно, что размер частиц не превышает 200 нм. Доминирующий размер
частиц покрытий Ni-P,
осаждённых из растворов №1, №2, №3 составляет 0 ÷
50 нм. С увеличением концентрации Ni(II)
в электролите возрастает доля частиц, чьи размеры находятся в пределах до 50
нм: при С(Ni(II))
= 0,034 моль/л - 59% (рисунок 3.5а), а при С(Ni(II))
= 0,102 моль/л - 98% (рисунок 3.5в). В отличие от покрытий, осаждающихся
из растворов №2 и №3, покрытия, осаждающихся из раствора №1, имеют частицы
размерами 150 ÷ 200 нм, но их
содержание крайне мало и составляет 0,88%.

а

б

в
Рисунок 3.5 -Распределение размеров
частиц, расположенных на поверхности покрытия Ni-P толщиной ~
6,54 мкм, полученного из раствора: а - №1; б - №2; в - №3,
в зависимости от их размера
Также исследовали морфологию поверхности
покрытий Ni-P
толщиной ~ 11,56 мкм, полученных из растворов №2, №3 (из раствора №1 для того
чтобы осадить плёнку таких размеров требуется более 1 часа) с помощью просвечивающей
электронной микроскопии (ПЭМ) с использованием метода углеродных реплик. На
снимках можно увидеть большое количество частиц, которые расположены на
поверхности покрытия Ni-P
равномерно. Форма частиц - сферическая (рисунок 3.6а, 3.6б, 3.6в).

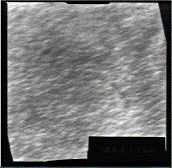
а б
Рисунок 3.6 - ПЭМ снимки поверхности покрытия Ni-P
толщиной ~ 11,56 мкм, полученного из раствора: а - №2; б - №3.
Из ПЭМ снимков были построены гистограммы.
Анализируя гистограммы (рисунок 3.7а, 3.7б), можно сделать вывод
о том, что размер частиц не превышает 150 нм. Доминирующий размер частиц
покрытий Ni-P,
осаждённых из растворов №2, №3, составляет 0 ÷ 50 нм.
С увеличением концентрации Ni(II)
в электролите возрастает доля частиц, чьи размеры находятся в пределах 50 ÷100
нм:
при С(Ni(II))
= 0,068 моль/л - 3% (рисунок 3.7а), а при С(Ni(II))
= 0,102 моль/л - 17% (рисунок 3.7б).


а б
Рисунок 3.7 - Распределение размеров
частиц, расположенных на поверхности покрытия Ni-P толщиной ~
11,56 мкм, полученного из раствора: а - №2; б - №3.
3.2
Результаты химического палладирования
Изучали возможность формирования покрытий Pd-P
из пирофосфатных электролитов палладирования. Установлено, что при соотношении
палладий:восстановитель 1:8 раствор является неустойчивым. Для увеличения
устойчивости электролита варьировали его рН: от 8 до 10,4, однако проведённый
эксперимент не привёл к сколь-нибудь заметному увеличению устойчивости
электролита. Электролит разлагается после 40 ÷ 60
минут после приготовления и после 20÷ 30
минут при эксплуатации. Уменьшение рабочей температуры электролита до 18±2 °С
также не увеличивает длительность его работы.
Заключение
1. Показана возможность получения покрытий Ni-P
из пирофосфатных электролитов при рН ~ 12.
. Установлено, что толщина покрытия Ni-P
зависит от концентрации Ni(II)
в растворе. Возможно, получение покрытий Ni-P
толщиной 12 мкм и более при использовании 0,1 М раствора соли Ni(II).
. Показано, что увеличение концентрации соли Ni(II)
не только интенсифицирует процесс осаждения, но и препятствует пассивации
поверхности, связанной с образованием NiO.
. Показано, что формирующееся покрытие является
практически беспористым и плотноупакованным.
. Использование пирофосфато-гипофосфитного
раствора палладирования, сходного по составу раствору никелирования, для
получения покрытий Pd-P
невозможно из-за неустойчивости электролита.
Список
литературы
1. Шалкаускас, М. Химическая
металлизация пластмасс/ М. Шалкаускас, А. Вашкялис. - Л.: Химия, 1985. - 144с.
. Иванов-Есипович, Н. К.
Физико-химические основы производства радиоэлектронной аппаратуры/ Н.К.
Иванов-Есипович. - М.: Высш. шк., 1979. - 205с.
. Бекиш Ю.Н. Электрохимическое
осаждение плёнок никель-бор в присутствии амин-боранов и бороводородов. Вестник
БГУ. Сер. 2. №3./ Ю.Н. Бекиш, Л.С. Цыбульская, Т.В. Гаевская. - Мн.: БГУ, 2008.
- 134с.
. Вансовская, К.М. Металлические покрытия,
нанесённые химическим способом/ К.М. Вансовская. - Л.: Машиностроение, Ленингр.
отделение, 1985. - 103с.
5. Yu Zuo. An electroless
plating film of pallagium on 304 stainless stell and its excellent corrosion
resistance. / Yu Zuo [и др.].
- Beijing.: Beijing Universitety of Chemical Technology, 2008. - Thin Solid
Films. Vol. 516. P.
7565 - 7570.
. Свиридов, В.В. Химическое
осаждение металлов из водных растворов/ В.В. Свиридов, Т.Н.Воробьёва, Т.В.
Гаевская, Л.И. Степанова. - Мн.: Университетское, 1987. - 270с.
. Врублевская, О.Н. Химическое
осаждение сплава палладий-никель из этилендиаминовых растворов. / О.Н.
Врублевская, Т.Н. Воробьёва. - Мн.: БГУ, 2009. - Свиридовские чтения: сборник
статей, Вып . 5, 326с.
8. К.Н.
Yim, S.W. Chun, D.G. Yang, D.G. An, C.M. Lee, M.J. Han, Metod for plating
printed circuit board and printed circuit board manufactured therefrom, US
Patent, Appl. No.: 10,070,104,929, May 10 (2007)
. J.G. Gaudiello, J.D. Herard,
J.J. Konrad, J. Mc Keveny, T.L. Wells, Process for manufacturing a printed
wiring board, US Patent No. 7,007,378, March 7 (2006)
. A. Gross, A. Niefenbacher,
Method for depositing palladium layers and palladium bath therefore, European
Patent, Public. Number WO2006074902, July 20 (2006).
. X.R. Ye, C.M. Wai, Y.Lin,
J.S. Yong, M.H. Engelhard, Super critical fluid immersion deposition: a new
process for selective deposition of metal fims on silicon substrates, Suft.
Coat. Technol. 190 (2005) 25 - 31.
. Strukova, G.K. Studies of
nanocrystalline Pd alloy films coated by electroless deposition/ G.K. Strukova
[и
др.].
- Russian.: Instityte of Solid State Physics, Russian Academy of Science, 2010.
- Materials Chemistry and Physics. Vol. 119. P. 377 - 383.
. Kruglikov, S.S. Electroless
Depositions of Palladium-Nickel-Phosphorous Alloy/ S.S. Kruglikov, D.Y.
Sinyakov, R.G. Golovchanskaya, S.S. Kruglikov. - M.:
. K.Kordas, S. Leppaavuori, A.
Uusimaki, M.H. T.F. Georfe, L. Nanai, R. Vajtai, K. Bali, J. Bekesi, Palladium
thun deposition on poliimide by CW Ar+ laser radiation for
electroless copper plating, Thin Solid Fims 384 (1001) 185 - 188.
. M.C. Roco, R.S. Williams,
A.P. Alivisatos (Eds.), Nanotechnology Research Directions: IWGN Workshop
Report. Vision for Nanotechnology R&D in the Next Decade, Kluwer Academic
Publishers, Dordrecht-Boston-London, 2000.
. S.C. Tjong, H. Chen,
Nanocrystalline materials and coatings, Mater. Sci. Eng., R: Rep. 45 (2004)
1-88.
. Vrublevskaya O.N. Electoless
Pd-Ni-P alloy plating from ammoniym-ethylenediamine solution/ O.N.
Vrublevskaya, T.N. Vorobyova. - Мн.:
Research Institute of Physical-Chemical Problems, Belarusian State University,
2012. - Thin Solid Films. Vol. 524. P.
197 - 204.
. Захаров, Л.Н. Техника безопасности
в химических лабораториях/ Л.Н. Захаров. - Л.: Химия, 1991. - 336с.
. Химическая энциклопедия: В 5 т.:
т.4: А - Дарзана/Редкол.: И.Л. Кнунянц (гл. ред.) [и др.] - М.: Сов. Энцикл.,
1988. - 623с.
. Справочник химика. Дополнительный
том./Б.П. Никольский (гл.ред.). - Л.: Химия, Ленингр. Отделение, 1988. - 507с.