Дослідження біохімічних ефектів дії концентрату природного поліфенольного комплексу з виноградного вина
Зміст
Вступ
Розділ 1. Огляд літератури
1.1. Вплив іонізуючого випромінювання на живі
організми
.1.1. Шляхи реалізації ушкоджень, індукованих дією
малих доз іонізуючого випромінювання.
.2. Радіоіндукований оксидативно-нітративний стрес
.2.1. Надпродукція АФО та АФН після дії малих доз
іонізуючого випромінювання.
.2.2. Роль
оксиду нітрогену в розвитку радіоіндукованих порушень
1.3. Протекторна дія
поліфенольних сполук з виноградних вин у разі розвитку радіоіндукованих
уражень.
Розділ 2. Матерали та методи досліджень
2.1. Умови проведення досліджень
.2. Характеристика об’єкту досліджень
2.3. Отримання концентрату природного поліфенольного
комплексу з виноградного вина
.4. Опромінення піддослідних тварин
.5. Забір крові та зразків тканин
2.6. Виділення
лейкоцитів [15]
2.7. Підрахунок кількості лейкоцитів у камері
Горяєва [25]
2.8.
Отримання лізатів лейкоцитів та зразків тканин
2.9. Визначення концентрації протеїну за методом
Лоурі
2.10. Методи дослідження стану системи L-аргінін/оксид нітрогену
2.10.1. Визначення сумарної активності NO-cинтази.
2.10.2. Визначення вмісту нітрит-аніонів.
2.10.3. Визначення вмісту нітрат-аніонів.
2.11. Визначення вмісту 3’-нітротирозину
2.11.1. Лізис лейкоцитів та зразків тканин
для електрофоретичного 33
розділення протеїнів.
.11.2. Електрофорез
протеїнів у поліакриламідному гелі [77,127].
2.11.3. Імоноблотинг протеїнів.
2.12. Статистична обробка
результатів
Розділ 3. Результати досліджень
3.1. дослідження ефекту
введення концентрату природного поліфенольного комплексу з виноградного вина на
стан системи L-аргінін / оксид нітрогену за дії
малих доз іонізуючого випромінювання
3.1.1. Вплив концентрату природного
поліфенольного комплексу з виноградного вина на активність NO-синтази та вміст
стабільних метаболітів оксиду нітрогену у периферичній крові щурів за
опромінення у дозах 10 та 30 сГр.
3.1.2. Активність NO-синтази та вміст
стабільних метаболітів оксиду нітрогену у лейкоцитах щурів за споживання
концентрату природного поліфенольного комплексу та дії випромінювання у дозах
10 та 30 сГр.
3.2. Вплив поліфенолів з виноградного вина
на рівень 3’-нітротирозин-модифікованих
протеїнів за дії малих доз іонізуючого випромінювання
.2.1. Накопичення
3’-нітротирозин-модифікованих протеїнів у лейкоцитах щурів за дії іонізуючого
випромінювання у дозах 10 та 30 сГр та за умов споживання концентрату
поліфенольного комплексу з виноградного вина.
4. Охорона праці та безпека в надзвичайних ситуаціях
4.1. Аналіз стану виробничих умов
4.1.1. Характеристика лабораторії
4.1.2. Аналіз методів дослідження та характеристика
обладнання
.1.3. Характеристика об’єкта дослідження, речовин,
їхніх небезпечних властивостей
4.2. Організаційно-технічні заходи
4.2.1. Організація робочого місця і роботи
.2.2. Санітарно-гігієнічні вимоги до умов праці
.2.3. Заходи щодо безпеки під час роботи з
обладнанням, об’єктом дослідження і речовинами
.3. Безпека в надзвичайних ситуаціях
.3.1. Протипожежні та проти вибухові заходи
4.3.2. Організація евакуації працівників
Висновки
Список використаних джерел
Вступ
Після опромінення у клітинах інтенсифікується утворення
оксиду нітрогену (NO) та
активних форм нітрогену (АФН) [42,72]. Відомо, що NO бере участь у регуляції
радіочутливості клітин, оскільки може індукувати зупинку клітинного циклу після
дії радіації, що в подальшому призведе до пригнічення росту та смерті клітини
Крім цього, за умов опромінення NO вступає в реакцію з супероксид-аніон радикалом (О2•-),
у результаті якої утворюється пероксинітрит (ONOO-). ONOO- є потужним
прооксидантом та цитотоксином, адже значно посилює деструкцію клітинних
структур шляхом модифікації протеїнів, зокрема за залишками тирозину,
ушкодження ДНК, індукцію пероксидного окиснення ліпідів, порушення у
внутрішньоклітинній сигналізації, призводячи до поглиблення
оксидативно-нітративного стресу [32, 72, 86, 93, 97,].
Найбільш інтенсивне підвищення утворення АФН після дії
радіації характернe для
таких органів як печінка, легені, нирки, кишківник, серце, головний та
кістковий мозок [56]. Крім того, після дії малих доз іонізуючого випромінювання
вже через кілька годин змінюється популяційний склад імунокомпетентних клітин
та розвивається запальна реакція, що характеризується активацією лейкоцитів у
судинах організму. Опромінені лейкоцити синтезують великі кількості не лише
АФН, але і молекул міжклітинного сигналювання (зокрема, цитокінів) [93].
Виникнення запальних процесів значно ускладнює перебіг оксидативно-нітративного
стресу, і, тим самим, посилює ушкодження організму. Зважаючи на все це, надзвичайно
актуальним є пошук нових сполук і препаратів, здатних запобігти розвитку
радіоіндукованого оксидативно-нітративного стресу.
Протягом останніх років зростає інтерес науковців та громадськості до впливу на
організм вина. Виноградне вино містить велику кількість біологічно активних
речовин, необхідних для організму людини, зокрема полі фенольні сполуки. Для
отримання вина розчавлені грона винограду поміщають у чани та зброджують. При
бродінні майже всі фенольні речовини кісточок і шкірки ягід екстрагуються із
сировини. Важливим є
також те, що фенольні сполуки у процесі виготовлення вина зазнають структурних змін, утворюють комплекси. Кахетинські вина, збагачені
фенольними комплексними сполуками, зокрема танінами, зброджують у присутності
гребенів винограду [5]. Це забезпечує появу унікального
набору поживних фенольних сполук, представлених у винах, отриманих за
кахетинською технологією, в тому числі червоного вина марки Каберне-Совіньйон,
виготовленого в Національному інституті винограду і вина «Магарач».
Особливість хімічної будови фенольних груп обумовлює здатність
нейтралізувати електрон вільних радикалів і формувати відносно стабільні
феноксильні радикали, що дозволяє віднести поліфеноли до потужних
радіопротекторів, оскільки таким чином ці сполуки припиняють радіоіндуковані
ланцюгові окиснювальні реакції у клітинах . Найпотужнішими антиоксидантами
вважаються катехіни, епікатехіни, кверцитин та ресвератрол із виноградного вина
[86]. Хоча протизапальна, імуномодулююча, антиоксидантна та детоксикаційна дії
поліфенолів червоного вина виявлена як in vitro, так і in vivo , проте вплив поліфенолів
виноградного вина на розвиток оксидативно-нітративного стресу за дії малих доз
радіації є вивчений недостатньо.
Мета та завдання досліджень
Метою роботи було дослідження біохімічних ефектів дії
концентрату природного поліфенольного комплексу з виноградного вина за умов
оксидативно-нітративного стресу, спричиненого малими дозами іонізуючого
випромінювання.
Для досягнення поставленої мети необхідно було вирішити
наступні завдання:
. Дослідити вплив концентрату природного поліфенольного
комплексу з виноградного вина (концентрат ПК) на систему L-аргінін/NO,
визначивши активність NO-синтази (NOS) і вміст стабільних метаболітів оксиду
нітрогену - нітритів (NO2-) та нітратів (NO3-), - у периферичній крові, лейкоцитах, аорті і нирці у
нормі та за умов опромінення;
.Проаналізувати здатність концентрату ПК впливати на процес
посттрансляційного утворення 3’-нітротирозин-модифікованих протеїнів у
імунокомпетентних клітинах периферичної крові, тканинах аорти та нирки щурів у
нормі та за впливу іонізуючого випромінювання;
. З’ясувати динаміку змін досліджуваних показників на 24, 48,
72 та 168 години після дії рентгенівського випромінювання у дозах 10 та 30 сГр.
Розділ
1. Огляд літератури
.1
Вплив іонізуючого випромінювання на живі організми
Іонізуюче випромінювання - найкраще вивчена область широкого
спектру електромагнітних випромінювань, які зустрічаються в природі чи генеруються штучними
джерелами, створеними в результаті діяльності людини [12]. До
іонізуючого відносять альфа-, бета-, гамма- та рентгенівське випромінювання. Характерною особливістю цих
видів випромінювань є здатність утворення іонів внаслідок взаємодії з
речовиною, або, у
випадку, якщо енергія кванта випромінювання, яка передається атому чи молекулі,
менша від потенціалу іонізації речовини, що опромінюється, то має місце лише
їхнє збудження [32, 84,95].
Після впливу іонізуючого випромінювання завдяки абсорбції
енергії та руйнування хімічних зв’язків у молекулах у надмірних кількостях
утворюються високо реактивні вільні радикали. Саме вільні радикали відіграють
головну роль у розвитку та проявах радіаційних ефектів як у окремих тканинах,
так і в організмі в цілому, адже реагують з багатьма молекулами та продукують
вторинні ДНК і ліпідні радикали. Ланцюгові реакції зі залученням молекул
ліпідів відіграють ключову роль в ушкодженнях клітинної мембрани [12,84].
Випромінювання хвильової та корпускулярної природи впливачи
на клітину призводять до продукування вільних радикалів двома шляхами: через
пряму та опосередковану дії [12, 84, 95,102]. Коли енергія іонізуючого
випромінювання передається макромолекулам, то такий механізм носить назву
«прямий ефект» радіації. [12,84]. Умовно процес реалізації прямих
ефектів опромінення можна поділити на три стадії. На першій (фізичній) стадії енергія
випромінювання передається речовині, її молекули збуджуються та іонізуються.
Наступна, фізико-хімічна,
стадія складається з каскаду реакцій,
наслідком яких є перерозподіл надлишкової енергії між збудженими молекулами.
Опромінені молекули, які є у збудженому
стані, мають велику кількість можливостей для подальших перетворень, в
результаті яких утворюються різноманітні продукти: іони, радикали. Тому навіть
у речовині, що складається лише з одного типу молекул, після опромінення
генеруються іони і радикали з широким спектром хімічних властивостей. На
третій, або хімічній, стадії іони
та радикали взаємодіють один з одним та зі сусідніми молекулами, спричиняючи різноманітні структурні пошкодження [12].
У випадку, коли біомолекула була уражена активними реакційноздатними
продуктами, які з’явилися після поглинання енергії випромінювання
мікрооточенням цієї молекули (наприклад, полярними та неполярними
розчинниками), то говорять про опосередковану (непряму) дію радіації [12,102].
Оскільки вода є домінуючою молекулою в складі живих організмів, вона абсорбує
більшу частину енергії іонізуючого випромінювання. Після опромінення молекула
води піддається серії хімічних змін, які об’єднують у процес «радіолізу».
Продуктами цих перетворень є гідратований електрон (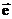 aq), атом гідрогену (H•) і гідроксил-радикал (OH•), які також залучаються у пошкодження біологічних систем [14].
aq), атом гідрогену (H•) і гідроксил-радикал (OH•), які також залучаються у пошкодження біологічних систем [14].
Гідроксильний радикал має неспарений електрон, завдяки чому є сильним
окисником. Він здатний дифундувати на короткі відстані та реагувати з
критичними молекулами-мішенями, внаслідок чого утворюються інші радикали та
вторинний електрон, який взаємодіє з молекулою води, і далі генерувати радикали
OH• та H•. Внаслідок таких послідовних реакцій
вивільняються електрони з багатьох молекул води (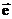 aq), які за умов
високої оксигенації середовища перетворюються у іони сильного окисника,
попередника пероксиду гідрогену, О2•- [14]:
aq), які за умов
високої оксигенації середовища перетворюються у іони сильного окисника,
попередника пероксиду гідрогену, О2•- [14]:
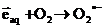
Кількість та спектр вільних радикалів, які утворюються внаслідок
радіолізу води, залежить від значення pH середовища та величини
показника лінійної передачі енергії (ЛПЕ) випромінювання [84]. Ці радикали
ініціюють реакції за участю біомолекул, зокрема, дисоціацію, відщеплення атома
гідрогену та ряд інших, в результаті яких утворюються розчинні органічні
радикали. Вільні радикали органічних молекул піддаються внутрішньомолекулярним
перебудовам реагуючи між собою та з іншими молекулами, що стає причиною
формування у клітині стабільних структурних пошкоджень [12]. Відомо, що за дії
випромінювання з низьким значенням ЛПЕ (рентгенівське випромінювання та
гамма-промені) пошкодження макромолекул розвиваються шляхом непрямого ураження
з утворенням вільних радикалів. АФО, зокрема О2•- та OH• мають широкий спектр ефектів, адже вони здатні окиснювати компоненти
біологічних мембран й активувати внутрішньоклітинні сигнальні шляхи [11,72].
1.1.1
Шляхи реалізації ушкоджень, індукованих дією малих доз іонізуючого
випромінювання
Протягом багатьох десятиліть дослідники у сфері радіобіології
працюють над дослідженням ризику для здоров'я людини малих доз радіації.
Свідченням цього є факт, що шість доповідей комітету BEIR (Biological Effects of Ionizing Radiation, Біологічні ефекти іонізуючої
радіації) присвячені висвітленню цієї проблеми. Сьогодні існує дві гіпотези
щодо потенційних ушкоджень малими дозами іонізуючого випромінювання. Згідно з
першою гіпотезою, яку підтримують більшість радіобіологів і генетиків, не існує
дози опромінення, яку можна вважати повністю безпечною, а вплив випромінювання
завжди супроводжується певним рівнем ризику. Прихильники другої гіпотези
припускають, що ушкодження внаслідок опромінення в діагностичних цілях, тобто в
дозах приблизно 10 сГр, не можуть бути виявлені та, імовірно, не виникають [58,
65, 81, 136].
Вченими досі чітко не визначено, які дози слід вважати малими. Найчастіше під
малими розуміють дози, які на один-два
порядки перевищують значення дози опромінення, що зумовлені природним радіаційним фоном. Оскільки природний радіаційний фон характеризується потужностями доз близько 0,1-0,4 сГр/рік, то малі
дози за умов
одноразового опромінення становлять
1-40 сГр. Це відповідає рекомендаціям
Наукового комітету з дії атомної радіації (WNA) [89]. За визначенням Наукового комітету
ООН з дії атомної радіації (UNSCEAR)
малі дози опромінення становлять 0,2 Гр для іонізуючого випромінювання з
низьким значенням ЛПЕ й 0,05 Гр - із високим ЛПЕ.
Існують також підходи до визначення малих доз, які базуються
на мікродозиметричних дослідженнях. Згідно з такою класифікацією малою можна
вважати дозу, при якій у мішені (ядрі чи клітині) відбувається не більше однієї
радіаційної події, тобто одноразовий прохід іонізуючого випромінювання через
мішень [2,8]. Загалом, малою можна вважати величину дози, за умови дії якої починає проявлятися радіобіологічний ефект нелетального
характеру. поліфенольний радіоіндукований протеїн лейкоцит
Цитотоксичність малих доз випромінювання найчастіше
пов’язують із надпродукцією АФО та АФН [101]. За 10-13 с після опромінення у
клітинах спостерігається сплеск утворення О2•-, який
ушкоджує ДНК та протеїни, в тому числі, дихального ланцюга мітохондрій.
Теоретичні розрахунки свідчать, що АФО, зокрема О2•- та
продукт його дисмутації пероксид гідрогену (H2O2),
утворюються навіть при опроміненні 1-2 Грей у цілях медичної діагностики, однак
їхні кількості є незначними. Існує велика кількість робіт, в яких описано зміни
метаболізму мітохондрій, порушення синтезу АТФ [51] та показано тимчасове
нерегульоване відкриття пор мітохондріальної мембрани. Зміни проникності
мембрани мітохондрій є причиною транспорту Ca2+ у матрикс та подальшої активації
мітохондріальної NOS.
Надсинтезований оксид нітрогену інгібує дихальний ланцюг та опосередковує
генерування великих кількостей О2•- та, в подальшому, -
утворення високореакційно здатного ONOО-. Власне ONOО-
вважається оксидантом номер один та є ключовим ефектором у формуванні
радіоіндукованих пошкоджень, адже призводить до розвитку
оксидативно-нітративного стресу.
1.2
Радіоіндукований оксидативно-нітративний стрес
В патогенезі ушкодження іонізуючим випромінюванням важливу
роль відіграє NO. При радіаційному ураженні NO виконує подвійну роль: радіозахисну
і радіотоксичну. Радіопротекторна роль NO забезпечується антиоксидантними властивостями цієї молекули [92], а в
основі радіоіндукованого ушкодження лежить біологічна деградація NO до цитотоксичного пероксинітриту в
умовах радіоіндукованого оксидативного стресу [23].
1.2.1
Надпродукція АФО та АФН після дії малих доз іонізуючого випромінювання
Біологічні системи часто піддаються впливу АФО та АФН, які
утворюються екзогенно як полютанти у атмосфері (фотохімічний смог, озон,
пестициди, ксенобіотики), при дії ультрафіолетового, рентгенівського чи γ-випромінювання, та
ендогенно, як побічні продукти реакцій мітохондріального ланцюга транспорту
електронів, оксидазних метал-каталізованих реакцій; як продукти метаболізму
аргініну чи продукуються нейтрофілами або макрофагами за умов запалення,
фагоцитарних оксидативних сплесків та пероксисомального витоку [56, 80, 98].
У ендогенних метаболічних реакціях аеробні клітини продукують
такі АФО, як супероксидний аніон-радикал (О2▪-),
гідроксил- (OH•) і гідропероксил-радикали (HO2•), пероксид гідрогену (H2O2), синглетний кисень (O2•) та органічні пероксиди як нормальні
продукти процесів біологічного відновлення молекулярного кисню [87]. За умов
гіпоксії мітохондріальний дихальний ланцюг також продукує NO, з якого утворюються інші АФН [56].
Завдяки своїй високій реакційній здатності АФО та АФН
формують каскад реакцій перетворень однієї активої форми у іншу, а також можуть
генерувати інші активні метаболіти, в тому числі, альдегіди - малоновий
диальдегід та 4-гідроксиноненал, індукуючи надмірну пероксидацію ліпідів.
Протеїни, ліпіди, вуглеводи та нуклеїнові кислоти є мішенями оксидативної
атаки, відомо, що модифікація цих молекул поглиблює радіоіндукований
оксидативно-нітративний стрес [56, 60].
Утворення вільних радикалів залежить від типу випромінювання
і хоча спектр АФО та АФН, які синтезуються після дії радіації, аналогічний до
того, який характерний для звичайних метаболічних процесів, існують відмінності
в їхньому розподілі у клітині. За фізіологічних умов АФО та АФН виконують роль
сигнальних молекул, які регулюють біохімічні клітинні процеси, тоді як їхній
надлишок, характерний у післярадіаційний період, є токсичним [57].
Цікаво, що математичні моделі, розроблені для вимірювання
здатності випромінювання індукувати оксидативний стрес, в області величин доз
забруднення виявленого у Чорнобилі, вказують, що малі дози іонізуючого
випромінювання індукують продукування лише невеликих кількостей АФО, які не
впливають на концентрації антиоксидантів у клітинах. Тим не менш, за останні 15
років показано, що невелика локальна модифікація спектру АФО може викликати зміну
внутрішньоклітинних сигнальних каскадів [82,90].
1.2.2 Роль оксиду нітрогену в розвитку
радіоіндукованих порушень
1. Внутрішньоклітинний синтез та метаболізм оксиду нітрогену.
Монооксид
нітрогену (NO) - вільнорадикальний газ з
часом напівжиття в біологічних об’єктах 5-10 с, безперервно утворюється в
різних клітинах людини і тварин. Через низьку молекулярну масу і високу
ліпофільність NО володіє високою дифузійною
спроможністю, що дає цій молекулі змогу виступати як внутрішньоклітинний та
міжклітинний месенджер або як цитотоксична молекула [93,97, 140]. NO бере
участь у реалізації багатьох фізіологічних функцій, в тому числі вазодилатації,
регулюванні судинного тонусу, процесів агрегації та адгезії тромбоцитів,
передачі сигналу у нейронах, за регулювання імунного захисту та регулювання
клітинного дихання [14].
In vivo NO синтезується з амінокислоти L-аргініну та молекулярного кисню в реакції, що каталізується ензимами
родини NO-синтаз (NOS; L-аргінін, NADPH: кисень оксидоредуктаза; EC 1.14.13.39) [125,140]. Для
функціонування цих ензимів необхідна ціла низка кофакторів -
нікотинамідаденіндинуклеотидфосфат (НАДФН), флавінаденіндинуклеотид (ФАД),
флавінмононуклеотид (ФМН), (6R)-5,6,7,8-тетрагідро-L-біоптерин (BH4), протопорфірин IX (гем) та кальмодулін (CaM) [14,34,97].
Всі ензими родини NOS є гомодомерами, у їх структурі розрізняють окисгеназний та
редуктазний домени. Молекулярна маса мономера коливається в межах від 110 до
160 кДа, залежно від особливостей ізоформ. N-кінцевий оксигеназний домен
кожного мономера містить сайти зв'язування простетичної гемової групи, BH4
і L-аргініну. Через сайт розпізнавання CaM оксигеназний домен зв’язаний з
редуктазним, який на С-кінці містить сайти зв'язування ФАД, ФМН і НАДФН (рис.
1.1) [34,97].
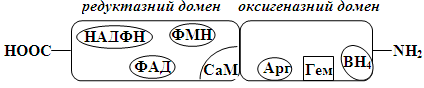
Рис. 1.1. Схематичне зображення структури мономера ензимів родини NO-синтаз [36].
каталізує двостадійне окиснення L-аргініну з перенесенням п'яти
електронів, через N-гідрокси-L-аргінін до цитруліну та NO. На першому етапі
відбувається дво-електронне окиснення L-аргініну до N-гідрокси-L-аргініну з використанням двох відновних
еквівалентів - НАДФН (рис. 1.2). При цьому BH4 перетворюється
на BH3,
виконуючи роль прямого донора електронів для гемової групи. Друга стадія
реакції, каталізованої NOS, полягає в трьо-електронному аеробному окисненні N-гідрокси-L-аргініну до NO і цитруліну, з використанням
лише одного НАДФН. Протягом каталітичного циклу електрони один за одним
переносяться на гемову групу. Електрони з НАДФН переносяться до окиснених форм
ФМН чи ФАД і тут «зберігаються» [97]. Для синтезу NO необхідне повторення
каталітичного циклу двічі [86].
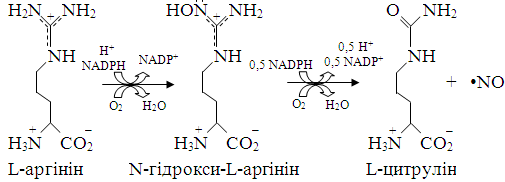
Рис. 1.2. Реакція окиснення L-аргініну до цитруліну та NO [97].
Продукування NO відбувається за наявності у клітинах L-аргініну, O2, НАДФН та BH4, проте у разі відсутності або нестачі L-аргініну
чи BH4 NOS генерує супероксид-аніон разом із NO [23,125, 140].
Таблиця 1.1
Гени ізоформ NOS людини [34]
|
Ізоформи NOS
|
Структура та розмір
гена
|
Хромосомна
локалізація
|
Кількість амінокислот
(АК) та молекулярна маса протеїну
|
|
nNOS
|
29 екзонів, 28 інтронів, комплексна структурна
організація, локус у регіоні з > 200 kbp
|
12q24.2-12q24.3,
12 хромосома
|
1535 АК, 161 кДа
|
|
iNOS
|
26 екзонів, 25
інтронів, 37 kbp
|
17сen-q11.2, 17 хромосома
|
1153АК, 131 кДа
|
|
eNOS
|
26 екзонів, 25
інтронів, 21-22 kbp
|
7q35-7q36,
7 хромосома
|
1203 АК, 133 кДа
|
Було ідентифіковано три абсолютно різні ізоформи NOS, які
кодуються різними генами
(табл. 1.1),
характеризуються різною локалізацією в клітині, регулюванням, каталітичними
властивостями та чутливістю до дії інгібіторів. Існує загальноприйнята
номенклатура ізоформ NOS: нейрональна NOS (nNOS, або NOSI), індуцибельна NOS (iNOS, або NOSII) та ендотеліальна NOS (eNOS, або NOSIII) [105]. Розрізнюють також
конститутивні (cNOS) та
індуцибельну NOS (iNOS). Ферменти першої групи (nNOS та eNOS) завжди наявні в організмі.
Зазначимо, тільки у нейрональних клітинах NOS є цитозольним білком, в інших
тканинах конститутивні ізоформи є мембранозв’язаними. У разі активації ці
ензими сприяють вивільненню невеликої кількості NO, що вимірюється пікомолями, у відповідь на рецепторну та
фізичну стимуляцію. Конститутивні ізоформи NOS функціонують у Ca2+-залежний спосіб. Ці ензими
активуються фосфорилюванням за кількома залишками серину, треоніну або
тирозину, наприклад, найбільше змін у функціонуванні eNOS відмічено у разі фосфорилювання
серину 1177 (активація), треоніну 495 (інгібування) [86].
Після впливу на будь-які клітини цілої низки факторів
(бактеріального ліпополісахариду, інтерферону γ, фактору некрозу пухлин α, інтерлейкіну-1β, ендотоксинів та інших)
активується цитозольна іNOS [14]. Не зважаючи на те, що молекула цієї ізоформи NOS містить нековалентно зв’язаний
кальмодулін, вона каталізує утворення NO у Ca2+-незалежний спосіб. ЇЇ активація
супроводжується підвищенням транскрипції генів. Кількість NO, що утворюється під впливом iNOS, може коливатися і досягає
наномолей, а продукція NO зберігається тривалий період часу [105, 120].
У клітинах існує кілька варіантів сплайсингу та посттрансляційних
модифікацій ізоформ NOS і, як
вважається, окремі модифікації спричиняють утворення ще однієї мітохондріальної
NOS (mtNOS) [37]. Цей ізозим експресується
конститутивно, його молекула заякорена у внутрішній мембрані мітохондрій та
каталізує реакцію аналогічно як iNOS [18].
2. NO-залежна відповідь клітин на дію іонізуючого випромінювання. Роль NO і АФН у радіаційній відповіді
залишається не до кінця зрозумілою. Існуюють повідомлення про підвищення
зростання активності NOS після впливу іонізуючого випромінювання
у печінці, легені, нирці, кишечнику, серці, головному та кістковому мозку після
опромінення [93,96]. Продукція NO інтенсифікується інтерфероном α (IFN-α)
або
ліпополісахаридами (ЛПС) у макрофагах, які були опромінені.здатний стимулювати
внутрішньоклітинні сигнали шляхом активації протеїнкіназ або реагуючи з АФО та
іонами металів. Основними мішенями NO у клітинах є протеїнкінази, фосфатази та фактори
транскрипції, які у активному чи алостеричному центрах містять SH-групи чи іони металів. Поряд із
модуляцією активності кіназ NO активує гуанілатциклазу, більш того він здатний регулювати активність
різних членів надродини мітоген-активуючі протеїнові кіназ (МАРК), зокрема р38
та JNK/SAPK [119].
NO може стимулювати пероксидне окиснення ліпідів, при цьому за певних умов
він є посередником захисних реакцій в мембранах, адже інгібує О2•--
та ООNO--індуковане ПОЛ. Механізми, залучені
в пригнічення ПОЛ оксидом нітрогену можуть бути наступні: вловлювання радикалів
пероксидів ліпідів, регулювання активності ензимів - циклооксигенази,
ліпоксигенази і цитохрому Р-450.
Однак, ключовим елементом формування контрастної ролі оксиду
нітрогену у разі фізіологічних та патологічних умов є пероксинітрит [49,52,
93]. Вважається, що сайти утворення ООNO- просторово пов'язані з джерелами О2•-
(наприклад, НАД(Ф)Н-оксидазами плазматичної мембрани, комплексами
мітохондріального дихання) оскільки NO є більш стабільним та здатним до дифузії вільним радикалом
порівняно з О2•-. У специфічних компартментах клітини in vivo продукується 50-100 мкМ ООNO- за хвилину. Зважаючи на короткий період напівжиття ООNO- за фізіологічних значень рН (приблизно
10-3 сек) та його здатність перетинати клітинну мембрану шляхом
транспорту аніонними каналами вважається, що утворений пероксинітрит
одразу ж реагує
зі сусідніми молекулами на відстані приблизно 5-20 мкм.При цьому з більшістю біомолекул він
реагує з доволі низькою швидкістю та високою селективністю [49].
Пероксинітрит здатний окиснювати аскорбінову кислоту, тіоли,
модифікувати протеїни (нітруванням), ліпіди (окисненням і нітруванням) та
нуклеїнові кислоти (окисненням та нітруванням), розкладати вуглеводи [93]. NO та ООNO- спричиняють швидке зниження
споживання кисню інгібуючи комплекси I та IV мітохондріального ланцюга транспорту електронів. NO зворотно інгібує мітохондріальне
дихання конкуруючи з киснем за сайт зв’язування в комплексі I, тоді як ООNO- пригнічує транспорт електронів на
комплексі I та, меншою мірою, на
комплексі IV шляхом незворотних окисних
модифікацій [52].
3. Нітрування протеїнів за залишками тирозину як індикатор
нітративного стресу. Залишки амінокислот тирозину та цистеїну є високо чутливими
до окиснення АФН. Нітрування протеїнів за залишками тирозину - ковалентна
модифікація, що виникає в результаті приєднання нітро-групи (•NO2),
до гідроксильної групи ароматичного кільця тирозину. Нітрування тирозину
призводить до зміни структури та функцій протеїнів, у результаті цієї
модифікації утворюються антигенні епітопи, змінюється каталітична активність
ензимів, організація цитоскелету, а також порушується клітинна сигнальна
трансдукція. У зв’язку з цим нітрування протеїнів розглядається як центральний
аспект пероксинітрит-опосередкованої цитотоксичності та вважається найкращим
маркером нітративного стресу [2].
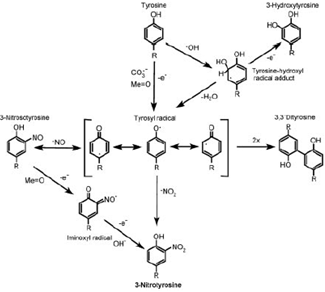
Рис. 1.3. Реакції нітрування тирозину.
Тирозин не реагує безпосередньо з пероксинітритом: радикали,
які беруть участь у реакції, можуть утворюватися після гомолізу ООNO- (•HO і •NO2) або в
результаті реакції між цією сполукою та CO2 (•CO3-
і •NO2) Нітрування також посилюється у разі присутності металів зі
змінною валентністю за рахунок утворення вторинних радикалів та •NO2.
Спочатку від залишку тирозину відщеплюється атом гідрогену з утворенням
тирозил-радикал, який швидко реагує з •NO2 та, як наслідок, продукує
3-нітро-L-тирозин (рис. 1.3) [48,50 ,
63,110, 122]. Далі може відбуватися вторинна реакція сполучення двох
тирозилових радикалів, продуктом якої є дитирозин [48,50, 110].
Нітрування протеїнів за нормальних умов відбувається у всіх
тканинах організму людини та тварин [37]. Роль нітрування протеїнів у
фізіології клітини є не до кінця зрозумілою. Причиною цього є невизначеність
долі таких модифікованих протеїнів. Вчені припускають, що нітровані протеїні
або деградують або можуть піддаватися ферментативному «денітруванню» [37,,
109,] хоча доказів наявності процесу "денітрації" в природних умовах
існує дуже мало [110]. Камісакі та співавтори показали, що нітрогрупа тирозину
може бути неензиматично відновлена до нітротирозину, ця реакція залежна від
гема і тіолових білків [114]. Відновлення до амінотирозину, імовірно, сприяє
подальшому видаленню модифікації нітроредуктазами, існування яких підтверджено in vitro.
1.3 Протекторна дія
поліфенольних сполук з виноградних вин у разі розвитку радіоіндукованих уражень
Фенольні сполуки - вторинні метаболіти рослин є ефективними
протекторними агентами. Вони знайдені в листяній частині та плодах, таких як
яблука, цитрусові, винограді, горіхах, овочах, у зернових, зеленому і чорному
чаї, зернах кави, прополісі. Більшість фенолів відповідають за колір листя,
плодів і квітів рослин [33,90, 106,132, 143].
В останні десятиліття фенольним сполукам науковці та
громадськість приділяють велику увагу. Причиною цього є відкриття «французького
парадоксу», найбільш популярне пояснення якого полягає у позитивному впливі
щоденного споживання червоних вин, багатих на фенольні сполуки [76,132]. Найкращі фахівці у результаті масштабних досліджень, які
охопили майже 300 тисяч осіб, дійшли однозначного висновку: при вживанні
щоденно 150-400 мл сухого червоного вина виникає достовірне зниження ризику
серцево-судинних та нейрологічних патологій, цукрового діабету, багатьох типів
онкологічних захворювань та порушень функціонування шлунково-кишкового тракту.
Ці позитивні ефекти пов’язують із дією поліфенолів виноградного вина. Крім
того, поліфенольні сполуки володіють протипроменевим ефектом - виводять
радіонукліди з організму [99].
Фармакологічні, медичні та біохімічні властивості фенолів
широко досліджуються. Показано їхні антиоксидантні, вазодилатуючі,
антионкологічні, протизапальні, імуностимулюючі, протиалергічні, противірусні й
естрогенні ефекти, вони інгібують фосфоліпазу А2, циклооксигеназу,
ліпоксигеназу, глутатіонредуктазу і ксантиноксидазу, хелатують іони металів
[33,44, 68, 90,132]. In vitro поліфеноли вина скавенджерують вільні радикали, зокрема
супероксидний аніон-радикал, гідроксил-радикал, а також інгібують реакції ПОЛ
[44,68, 76]. Дослідження проведені in vivo є менш переконливі, деякі з них свідчать про вплив вина на
антиоксидантну систему клітин крові та на процеси окиснення ліпопротеїнів
низької щільності (ЛПНЩ) [76,100]. У клітинах, інкубованих з фенолами,
індукується експресія генів, що кодують протеїни, які залучені в антиоксидантну
детоксикацію. Ці гени регулюються специфічним енхансером - елементом
антиоксидантної відповіді (antioxidant response
element, ARE). Поліфеноли червоного
вина можуть змінювати активність NOS через вплив на концентрацію Ca2+ в клітині та фосфорилювання ключових протеїнів шляху фосфатидилінозитил-3’
кінази/Akt за умов короткотривалої
інкубації з клітинами. У випадку довготривалої інкубації ці сполуки змінюють
активність NOS регулюючи експресію генів
конститутивних ізоформ цього ензиму NOS [35,44, 76].
В таблиці 1.3 наведено основні дані про метаболізм в
організмі людини та тварин поліфенолів, представлених у червоному виноградному
вині.
До фенольнів відносять більше 8000 природних сполук, молекула
яких містить фенол (ароматичне кільце з принаймні однією гідроксильною групою).
Класифікують їх на поліфеноли та прості феноли, залежно від кількості фенольних
кілець. До простих фенолів належать фенольні кислоти. Група поліфенолів, тобто
тих фенолів у складі яких є мінімум два фенольних кільця, включає флавоноїди,
стільбени та таніни (містять три або більше фенольних кілець) [33,9 ,132].
Таблиця 1.3
|
Максимальна
концентрація у плазмі, мкмоль/л
|
Час досягення
максимальної концентрації, год
|
Час напівжиття до
елімінації, год
|
|
Людини
|
Тварин
|
|
|
|
Флавоноїди
|
|
Флаван-3-оли:
(-)-епікатехіни, (+)-катехіни
|
0,02-0,08
|
0,15-35,0
|
0,5-2,5
|
1,1-4,1
|
|
Флавоноли:
кверцитин
|
0,51-3,8
|
0,18-0,24
|
0,5-2,9
|
10,9-28,0
|
|
Антоціаніни
|
0,01-0,05
|
|
0,7-4,0
|
|
|
Стільбени
|
|
ресвератрол
|
0,02-0,45
|
1,1-2,6
|
|
|
|
Фенольні кислоти
|
|
Гідрокисбензойні
кислоти: галова кислота
|
0,17-0,18
|
1,03-2,75
|
1,3-1,5
|
1,1-1,5
|
|
Гідроксицинамінові
кислоти: ферулова кислота, кофейна кислота
|
0,08-0,09
|
1,68
|
0,7-2,0
|
|
Дані про метаболізм фенолів виноградного вина [55]
При виробництві виноградного вина майже 63 % усіх фенольних
речовин виноградних кісточок і шкірки ягід переходять у вино, тому за умови
дотримання оптимальної дози споживання його можна вважати одним із
найефективніших природних ліків. Важливим є також той факт, що у процесі отримання сусла
(бродіння) та дозрівання вина фенольні сполуки
зазнають структурних змін, що визначає характеристики напою. Найбільш інтенсивно при
дозріванні вина протікають реакції полімеризації та окиснення катехінів.
Продукти цих реакцій надають приємного смаку і золотисто-коричневого
забарвлення різної інтенсивності, завдяки чому витримані вина легко відрізняти
від молодих. Ще одна група речовин,
які екстрагуються у вино під час бродіння - проціанідини, - містяться в основному у виноградних
кісточках, тому вони практично відсутні у виноградному соці. Спочатку в суслі міститься незначна
кількість проціанідинів, оскільки ці речовини починають екстрагуватися з
кісточок під час бродіння, коли вміст спирт становить 6 %. У міру того, як концентрація алкоголю
зростає впродовж бродіння, проціанідини екстрагуються у вино. Молоде вино, багате
проціанідинами має
терпкий смак. У процесі витримки проціанідини вступають в реакцію один з одним
і утворюють більш довгі полімери -
конденсовані таніни. Коли вино старіє, ці ланцюжки стають дуже довгими і важко
розчинними, тому випадають в осад [55]. Оскільки виноградна шкірка і
кісточки плавають на поверхні, тому чим частіше їх опускають у сусло, що
бродить, тим краще відбувається процес вилучення проціанідинів [55].
Завдяки особливостям виготовлення, червоні вина багатші на
поліфеноли, ніж білі, тому їхнє споживання викликає різні ефекти. Причиною цьго
є відмінності у кількості та якісному складі поліфенолів у різних сортах
виноградних вин. Також вирішальну роль відіграє біодоступність фенольних сполук
[44]. До прикладу, дані про абсорбцію кверцитину та кінетику його
диспропорціювання вказують, що келих червоного вина є значно біднішим джерелом
даної сполуки ніж чашка чорного чаю та цибуля [71]. Тому, доцільним є
концентрування фенольних сполук виноградного вина, оскільки це дозволить
отримати необхідну корисну кількість спожитих фенолів та зменшити вживання
вина.
Зважаючи на все вищесказане, дослідження впливу фенольних
сполук з виноградного вина, зокрема концентрованого його препарату, на ключові
біохімічні показники, які характеризують оксидативно-нітративний стрес,
індукований малими дозами іонізуючого випромінювання, є надзвичайно актуальним.
Такі дослідження можуть стати основою для отримання нових терапевтичних та
превентивних засобів, спрямованих на попередження, послаблення чи позитивного
коригування уражень організмів радіацією.
Розділ
2. Матерали та
методи досліджень
2.1 Умови проведення досліджень
Дослідження проводили на безпородних білих
щурах-самках масою 180-220 г. Тварини перебували у стаціонарних умовах віварію зі
забезпеченням вільного доступу до їжі та води. Всі процедури з піддослідними
тваринами проводилися згідно зі “Загальними принципами роботи на тваринах”,
затвердженими I Національним конгресом по біоетиці (Київ, Україна, 2001) та з
положеннями “Європейської конвенції по захисту хребетних тварин, які
використовуються в експериментальних та інших наукових цілях” (Страсбург,
Франція, 1986).
Піддослідні щурі були поділені на шість груп: перша -
контрольні тварини (далі - К); друга - тварини, які споживали з питною водою
концентрат ПК (далі - К+ПК); третя та четверта - щурі, яких піддавали
одноразовому опроміненню в дозах 10 та 30 сГр, відповідно (О); п’ята та шоста -
тварини, яких на фоні споживання концентрату ПК піддавали опроміненню у дозах
10 та 30 сГр, відповідно (О+ПК).
Тварини споживали концентрат ПК з питною водою з розрахунку
щодобової дози у перерахунку на вміст поліфенольних сполук - 12,5 мг на 1 кг
маси тіла, що відповідає теоретичній середній концентрації поліфенолів, яка
міститься у 300 мл червоного вина (добова норма для людини масою тіла 70 кг) за
10 діб до та впродовж семи діб експерименту після опромінення.
2.2 Характеристика об’єкту досліджень
Об’єктом досліджень були біохімічні показники, що
характеризують оксидативно-нітративний стрес у периферичній крові, лейкоцитах,
тканинах аорти та корковому шарі нирки при введенні концентрату ПК та за дії
малих доз іонізуючого випромінювання.
2.3
Отримання концентрату природного поліфенольного комплексу з виноградного вина
Червоне виноградне вино Каберне сорту “Совіньйон” було надане в рамках договору про співпрацю
Національним інститутом винограду і вина “Магарач” (Ялта, АР Крим).
Таблиця 2.1
Якісний склад і масова концентрація (мг/л) фенольних сполук у
зразках сухого червоного виноградного вина та його концентрованого препарату
|
Вино
|
концентрат ПК
|
|
галова кислота
|
42,0
|
641,5
|
|
(+)-D-катехін
|
10,4
|
117,6
|
|
(-)-епікатехін
|
16,5
|
200,2
|
|
бузкова кислота
|
9,9
|
133,1
|
|
кафтарова кислота
|
47,9
|
656,7
|
|
каутарова кислота
|
45,1
|
627,8
|
|
п-кумарова кислота
|
0,4
|
7,8
|
|
кверцитин-3-О-глікозид
|
16,9
|
291,7
|
|
Кверцитин
|
9,5
|
219,4
|
|
дельфінідин-3,5-О-диглікозид
|
0,3
|
0,8
|
|
ціанідин-3,5-О-диглікозид
|
0,6
|
4,2
|
|
петунідин-3,5-О-диглікозид
|
1,7
|
6,8
|
|
дельфінідин-3-О-глікозид
|
1,0
|
7,6
|
|
пеонідин-3,5-О-глікозид
|
3,6
|
11,8
|
|
мальвідин-3,5-О-диглікозид
|
9,0
|
40,9
|
|
ціанідин-3-О-глікозид
|
0,3
|
2,4
|
|
петунідин-3-О-глікозид
|
1,3
|
10,0
|
|
пеонідин-3-О-глікозид
|
0,9
|
5,9
|
|
мальвідин-3-О-глікозид
|
7,2
|
47,1
|
|
дельфінідин-3-О-(6’-ацетил-глікозид)
|
2,6
|
38,9
|
|
ціанідин-3-О-(6’-ацетил-глікозид)
|
0,3
|
4,3
|
|
петунідин-3-О-(6’-ацетил-глікозид)
|
0,2
|
3,5
|
|
дельфінідин-3-О-(6’-п-кумароїл-глікозид)
|
0,5
|
3,9
|
|
пеонідин-3-О-(6’-ацетил-глікозид)
|
0,5
|
8,9
|
|
мальвідин-3-О-(6’-ацетил-глікозид)
|
0,4
|
4,3
|
|
ціанідин-3-О-(6’-п-кумароїл-глікозид)
|
―
|
1,4
|
|
петунідин-3-О-(6’-п-кумароїл-глікозид)
|
0,3
|
6,6
|
|
пеонідин-3-О-(6’-п-кумароїл-глікозид)
|
0,1
|
1,1
|
|
мальвідин-3-О-(6’-п-кумароїл-глікозид)
|
0,8
|
11,7
|
Концентрат ПК отримували упарюванням 600 мл червоного вина на
роторному випарювачі Laborota 4001 («Heidolph», Німеччина) при температурі 40ºС та тиску 0,8-0,9 кг/см2.
Отриманий концентрат об’ємом 30 мл витримували протягом тижня
у холодильнику при температурі +4ºС для випадання в осад
нерозчиних у водному розчині поліфенольних сполук. Надосадову рідину відбирали
(розчин 1), а до осаду, який випав вносили 20 мл 70% водного розчину етилового
спирту (отриманого під час упарювання вина) для екстракції поліфенольних
сполук. Через 12 годин рідку фракцію збирали в окремий посуд (розчин 2), а
твердий залишок відкидали. Внаслідок об’єднання розчинів 1 і 2 одержали
препарат об’ємом 50 мл [19].
Загальний вміст поліфенолів був стандартизований у вині та
отриманому концентраті за галовою кислотою еквівалентно з використанням
реактиву Фоліна-Чокальтеу.
Масова концентрація фенольних сполук у
досліджуваному препараті становила 59 г/л, зокрема, полімерних сполук - 40 г/л, мономерів - 19
г/л. Якісний та кількісний склад концентрату ПК визначали методом високоефективної рідинної
хроматографії. Основні компоненти представлені кафтаровою, каутарова та галовою
кислотами, кверцитином та катехінами (табл. 2.1) [22].
2.4
Опромінення піддослідних тварин
Щурів піддавали загальному одноразовому опроміненню в дозах
10 та 30 сГр на установці РУМ-17 з такими параметрами: шкірно-фокусна відстань
95 см, напруга 130 кВ, сила струму 10 мА, фільтри Cu 0,5 мм та Al 1,0 мм, потужність дози - 8,3 мГр·с-1.
Дозу опромінення контролювали клінічним
дозиметром типу 27012 (Otto Shön, Німеччина).
2.5
Забір крові та зразків тканин
На 24, 48, 72 та 168 години після дії радіації щурів ефірним
наркозом вводили в хірургічну стадію. Забір зразків проводили після декапітації
тварин.
Відбирали висхідну, дугу аорти та її грудну частину, корковий
шар правої нирки. Виділені
тканини та лейкоцити одразу ж заморожували при -70° С.
Кров збирали у фарфорові чашки. Як антикоагулянт використовували гепарин (кінцеве розведення гепарин : цільна кров = 1:100).
2.6 Виділення лейкоцитів [15]
Готували розчин фікол-тріомбрасту змішуванням 9,677 г фіколу
(Picolle-400, "Farmacia", Швеція), 122,5 мл
дистильованої води та 20 мл 76% тріомбрасту ("Фармон", Україна) для
отримання суміші густиною 1,076-1,078 г/см3.
У центрифужну пробірку вносили суміш фікол-тріомбрасту, на яку обережно
нашаровували 5-7 мл крові, розведеної забуференим
фізіологічним розчином (ЗФР, рН 7,4, складом 8,5 г NaCl; 0,22 г KCl; 1,071 г Na2HPO4; 0,2 г KH2PO4). Центрифугували 30 хвилин при 1000
об./хв. Після центрифугування з пробірки віббирали лейкоцити, клітини двічі
відмивали у ЗФР впродовж 5 хв при 1500 об./хв. Надосадову рідину відбирали,
отримані лімфоцити розводили у ЗФР.
2.7 Підрахунок кількості лейкоцитів у камері Горяєва [25]
До 20 мкл розчину 0,05% метиленового зеленого, приготовленого
на 3% оцтовій кислоті (CH3COOH лізує
еритроцити, а метиленовий синій фарбує ядра лейкоцитів), додавали 20 мкл
суспензії лейкоцитів, суміш ретельно
перемішували. Заповнювали нею камеру
Горяєва, залишали її на 1-2 хв в горизонтальному положенні для осідання
лейкоцитів. Лейкоцити підраховували в двадцяти великих квадратах.
Розрахунок кількості лейкоцитів проводили за формулою:
хзаг = 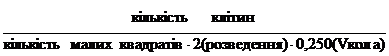 ,
,
де Х - концентрація клітин, млн./мл.
2.8 Отримання лізатів лейкоцитів та
зразків тканин
Гомогенізацію заморожених тканин аорти та коркового шару
нирки для визначення активності ензимів антиоксидантної системи проводили на льодяній бані при 4°C за допомогою ручного
гомогенізатора Поттера-Эльвейема у присутності гіпотонічного 50 мМ Na-K фосфатного буферу (pH 7,4) з
розрахунку 10 мг тканин нирки або 5 мг тканин аорти у 100 мкл буферу, 10 мкл
цільної периферичної крові лізували додаванням 90 мкл буферу та 10 млн
лейкоцитів - у 600 мкл буферу. Досліджувані показники визначали у супернатанті,
отриманому після центрифугування лізатів протягом 15 хв при 14 000 об./хв.
Активність NOS визначали у лізатах, приготованих за аналогічною схемою після додавання
до зразків буферу лізису, складом 0,05 М Трис-HCl (рН 7,4), 0,25 М сахароза, 0,001 М
ЕДТА, до якого безпосередньо перед додаванням вносили інгібітори протеїназ -
0,5 мкМ апротинін (A1153, Sigma, США), 0,5 мкМ пепстатин (P5318, Sigma, США) та 10 мкМ фенілметилсульфоніл
флуорид (PMSF, P7626, Sigma, США). Проводили інкубацію протягом
30 хвилин при 4ºС після чого центрифугували 30 хвилин
при 14000 об./хв [69].
2.9 Визначення концентрації протеїну за методом Лоурі
Концентрацію білка визначали згідно зі загальноприйнятим
методом Лоурі [137].
Результат виражали у мкг протеїну на 1 мкл.
2.10 Методи дослідження стану системи L-аргінін/оксид
нітрогену
2.10.1
Визначення сумарної активності NO-cинтази
Для визначення сумарної активності NOS до відібраного супернатанту з
лізатів додавали 10 мМ HEPES буфер, що містив 1 М MgCl2, 1 М СaCl2,
3 мМ L-аргінін та 250 мМ НАДФH+H+. Як контроль
використовували проби, що містили повну субстратну суміш та дистильовану воду. Після
30 хвилинної інкубації зразків при 37оС зупиняли реакцію додаванням
96% етилового спирту в пропорції 1:2. Центрифугували 20 хвилин при 3000 об./хв
для осадження протеїнів (20оС). В епендорфівські пробірки вносили по
100 мкл супернатанту та 100 мкл реактиву Гріса (який
складається з рівних частин 0,05 % розчину N-(1-Нафтил)етилендиамін
дигідрохлориду і 1% розчину сульфаніламіду в 5% HCl). Інкубували 30 хвилин при 37оС,
після чого переносили зразки у мікропланшети. Вимірювали світлопоглиняння при λ=540 нм на планшетному рідері
(Epoch, Biotek, США).
Сумарну активність ензиму визначали за різницею утворення
нітритів з мінімальною кількістю кофакторів для наближення активності ензиму до
вихідного рівня активності в досліджуваних зразках [69]. Активність NOS у пробі виражали в нмолях новоутвореного NО2-
за 1 хв на 1 мкг протеїну.
2.10.2
Визначення вмісту нітрит-аніонів
Вміст нітрит-аніону (NO2-)
визначали в зразках лізатів клітин з використанням реактиву Гріса. Метод
полягає у визначенні інтенсивності забарвлення комплексу солі діазонію,
утвореного у результаті реакції NO2- з
сульфаніламідом та N(1-нафтил)-етилендіаміном у кислому середовищі.
Депротеїнізацію проводили додаванням до зразків 96% етанолу з
наступним центрифугуванням при 3000 об./хв протягом 20 хвилин. У лунки планшети
вносили 100 мкл отриманого супернатанту та аналогічний об’єм реактиву Гріса.
Абсорбцію вимірювали при λ=540 нм на планшетному рідері
(Epoch, Biotek, США) після преінкубації при
температурі 37°С протягом 30 хв. Контролем слугували проби, які замість зразка містили 100 мкл дистильованої води. Результат розраховували
за калібрувальним графіком, який будували з використанням стандартних розчинів
нітриту натрію.
2.10.3
Визначення вмісту нітрат-аніонів
Концентрацію нітрат-аніону (NO3-)
визначали за різницею між сумарним вмістом стабільних метаболітів оксиду
нітрогену та вмістом NO2-.
Депротеїнізацію зразків проводили за схемою,
описаною у п. 2.10.2.
Для визначення сумарного вмісту метаболітів NO
проводили відновлення нітратів до нітритів, як відновник використовували
ванадій (ІІІ) хлорид (VCl3). У лунки планшети вносили 100 мкл
супернатанту, додавали
однаковий об’єм VCl3, а також швидко вносили 100 мкл
реактиву Гріса. Вміст
лунки інкубували 30 хв при температурі 37оС. Абсорбцію
вимірювали при λ=540 нм на планшетному рідері (Epoch, Biotek, США), у якості контролю
використовували проби, які замість зразка містили 100
мкл дистильованої води. Результат розраховували за калібрувальним графіком,
який будували із використанням стандартних розчинів нітрату натрію .
2.11 Визначення вмісту 3’-нітротирозину
.11.1 Лізис лейкоцитів та зразків тканин для електрофоретичного
розділення протеїнів
Для отримання лізатів 2,5 млн лейкоцитів або 10 мг тканин нирки або 5 мг
тканин аорти розсуспендовували у 100 мкл буферу RIPA (50 mM Tris-HCl (pH 7,2); 1% Triton X-100; 1% деоксихолат натрію; 0,1% SDS; 158 mM NaCl; 1 mM EГТА), який містив інгібітори протеаз/пептидаз: пепстатин (20 мкг/мл),
апротинін (20 мкг/мл) та PMSF (1 мМ). Суспензію витримували при температурі
4°С протягом 20 хв піля чого центрифугували 15 хв при 12 000 об./хв і
температурі 4°С. Супернатант відбирали та прогрівали при 95°С протягом 5 хв у буфері Леммлі (62,5 мМ трис-HCl (pH 6,8), 1 мМ ЕДТА, 2% SDS, 5% β-меркаптоетанол, 10% гліцерин, 0,4%
бромфеноловий синій).
2.11.2 Електрофорез протеїнів у
поліакриламідному гелі
Протеїни (50 мкг) розділяли електрофоретично у
блоках 10% поліакриламідного гелю у присутності додецилсульфату натрію (SDS) у буферній
системі Леммлі.
Для приготування гелю використовували такі реактиви:
. Розчин мономерів “АА”: 30% акриламід та 0,8% метиленбісакриламід;
. Буфер “А” для розділяючого гелю: 0,375 М трис-HCl, pH 8,8;
. Буфер “Б” для концентруючого гелю: 0,125 М трис-HCl, pH 6,8;
. 10% персульфат амонію (APS).
. 10% додецилсульфату натрію (SDS)
. Буфер
для електрофорезу
(0,025 М трис-HCl, pH 8,3, 0,192 М
гліцин, 0,1% SDS).
В установку для електрофорезу, у простір між двома
скляними пластинами вносили 10%-вий розділяючий (3,28 мл H2О; 2,64 мл «АА»; 2 мл «А»; 0,8 мл SDS; 0,4 мл APS; 0,04 мл ТЕМЕД) та 4%-вий концентруючий (1,83 мл H2О; 0,39 мл «АА»; 0,75 мл «Б»; 0,3 мл SDS; 0,3 мл APS; 0,03 мл
ТЕМЕД)
гелі. В
електрофоретичну установку заливали буфер для електрофорезу.
Електрофорез проводили протягом 2,5 год при силі струму 15 мА, напрузі 200 В та
потужності 50 Вт на одну пластину. При переході проб з концентруючого гелю у розділяючий, силу струму збільшували до 25 мА на одну пластину. Для
визначення молекулярної маси протеїнів, бенди яких проявилися, використовували
протеїнові стандарти (SDS7B2, «Sigma», США)
2.11.3 Імоноблотинг протеїнів
Отримані розділені протеїни переносили на нітроцелюлозну
мембрану під дією електричного поля з наступною обробкою отриманих блотів
антитілами Перенесення проводили протягом 2 год при силі струму 250 мА, в
буфері, що містив 25 мМ трис-HCl (pH 8,3), 20% метанол та 192 мМ гліцин.
Вільні центри зв’язування на мембрані блокували протягом 12 год при 4°С 2%
розчином BSA в ЗФР (137 мМ NaCl, 2,7 мМ KCl, 4,3 мМ Na2HPO4,
1,7 мМ KH2PO4, (pH 7,3)) з 0,05% твін-20.
Згідно до поставленої мети мембрану інкубували з першими
антитілами (моноклональні антитіла до 3-нітротирозину, N5538, Sigma, США), розведеними
у 10 000 раз у блокуючому буфері, протягом 2 год з наступним промиванням
буфером для блокування (5 разів по 3 хв). Як другі антитіла використовували
анти-мишачі IgG (AP308P, Millipore, США), кон’юговані з пероксидазою
хрону, в розведенні у 1000 у блокуючому буфері. Інкубацію з другими антитілами
проводили протягом 1 год, після чого мембрану відмивали ЗФР/0,1% твін-20 (5
разів по 3 хв). Імунореактивні смуги на блотах виявляли за допомогою набору
реактивів для посиленої хемілюмінесценції (Millipore, США). Час експонування мембран на
рентгенівській плівці залежав від інтенсивності хемілюмінесценції і тривав у
середньому 5-15 хв. Плівку проявляли у стандартному фенідон-гідрохіноновому
проявнику та фіксували кислим фіксажем.
Денситометричний аналіз результатів вестерн-блотингу здійснювали з
використанням програми GelPro 3.1.
Для контролю ідентичності вмісту протеїнів у всіх пробах,
мембрану відмивали від антитіл буфером для відмивки (ЗФР/0,1% твін-20) та, в
подальшому, блокуючим буфером. Після цього її інкубували з першими анти-β-актиновими антитілами (Sigma, США), другими антитілами та
проводили експозицію отриманих блотів на рентгенівську плівку.
2.12 Статистична обробка результатів
Статистична обробка результатів дослідження здійснювалася з
допомогою програми Microsoft Excel. Обчислення
основних статистичних показників проводили за безпосередніми кількісними
даними, отриманими в результаті досліджень (середнє арифметичне значення - М;
стандартна похибка середнього арифметичного - m).
Для оцінки вірогідності різниці між статистичними
характеристиками двох альтернативних сукупностей даних обчислювали коефіцієнт
Стьюдента. Вірогідною вважали різницю при показах вірогідності р≥0,95
(рівень значимості Р<0,05), знайдену після обчислення t за таблицею
t-розподілу Стьюдента.
Розділ 3.
Результати досліджень
3.1 дослідження ефекту
введення концентрату природного поліфенольного комплексу з виноградного вина на
стан системи L-аргінін / оксид нітрогену за дії
малих доз іонізуючого випромінювання
Ризики ушкоджуючої дії малих доз іонізуючого випромінювання
зазвичай оцінюють екстраполюючи дані про вплив високих доз радіації з
використанням лінійної безпорогової моделі «доза-ефект». Однак дедалі частіше
з’являються повідомлення про те, що такий спосіб оцінки не забезпечує
передбачення та пояснення відповіді живих організмів, в тому числі організму
людину, на дію малих доз випромінювання.
За низькоінтенсивного опромінення активуються специфічні
клітинні механізми, що забезпечують розвиток адаптивної відповіді,
радіоіндукованих опосередкованих ефектів, гіперчутливості до опромінення та
геномної нестабільності, які пов’язані зі залученням неопромінених молекул.
Причиною цього є швидка активація навіть малими дозами радіації
цитоплазматичних реакцій, наслідком протікання яких є надпродукція АФО та АФН.
Вважається, що АФО є вихідними агентами, утвореними внаслідок іонізаційних
подій, вони є ініціаторами, а АФН є ефекторами активації цитозольних шляхів
передачі сигналу у відповідь на опромінення. Адже внаслідок дії радіації
виникає внутрішньоклітинний сигнал, результатом якого є активація
полі(АДФ-рибозо)-полімерази для відновлення радіоіндукованих пошкодженнь ДНК
та, в подальшому, активація ядерного фактора NFκB. Внаслідок цього у клітині
активується експресія генів iндуцибельної NOS і,
відповідно, інтенсифікується синтез NO.
3.1.1 Вплив концентрату природного
поліфенольного комплексу з виноградного вина на активність NO-синтази та вміст
стабільних метаболітів оксиду нітрогену у периферичній крові щурів за
опромінення у дозах 10 та 30 сГр
Оксид нітрогену є важливим біологічним месенджером, наявним у
клітинах усіх ссавців, де залучений в низку внутрішньоклітинних та міжклітинних
сигнальних шляхів. NO виконує різноманітні
фізіологічні регуляторні функції в організмі, оскільки може підвищувати або
знижувати функціональну активність адренергічних синапсів, і, відповідно,
впливати на адренергічну іннервацію органів дихальної, сечостатевої, м’язової,
судинної й інших систем організму. Відомо, що NO активує гуанілатциклазу - ензим, який каталізує синтез
одного з вторинних месенджерів - цГМФ.
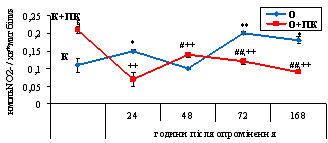
Рис. 3.1. Активність NO-синтази у
периферичній крові щурів за дії іонізуючого
випромінювання у
дозі 10 сГр та за введення концентрату природного поліфенольного комплексу з виноградного вина. (M ± m, n = 6-10). *, ** - відмінність
між показниками контрольної групи (К) та опроміненням (О) вірогідна (Р<0,05;
Р<0,01); § - відмінність між показниками контрольної групи (К) та
контрольної групи за введення концентрату ПК (К+ПК) вірогідна (Р<0,05); #,
## - відмінність між показниками групи опромінених тварин (О) та групи, якій
вводили концентрат ПК на фоні опромінення (О+ПК) вірогідна (Р<0,05;
Р<0,01); ++ - відмінність між показниками контрольної групи за введення
концентрату ПК (К+ПК) та групи, якій вводили концентрат ПК на фоні опромінення
(О+ПК) вірогідна (Р<0,01).
Цей посередник знижує рівень Ca2+ у клітині, що, у свою чергу, спричиняє пригнічення
активності кальційзалежних ізоформ NOS [12].
За умов споживання контрольними тваринами
концентрату ПК активність NO-синтази зростала в 1,75 раза порівняно з
контролем (рис. 3.1).
Нами встановлено зростання активності NOS в 1,4 раза на 24
годину, в 1,8 раза на 72 годину та в 1,6 раза на 168 годину після опромінення
тварин у дозі 10 сГр порівняно з контролем (рис. 3.1).
Введення досліджуваного концентрату тваринам,
яких піддавали дії іонізуючого випромінювання у дозі 10 сГр, спричиняло
зростання NO-синтазної активності в 1,4 рази на 48 годину, але викликало
зниження цього показника в 1,7 і 2 рази на 72 та 168 години, відповідно,
порівняно з показниками опромінених тварин (рис. 3.1).
Велика кількість досліджень свідчать про підвищене утворення
NO в різних органах після опромінення [6,20, 72, 93]. В організмі NO окиснюється до
нітрит- та нітрат-аніонів протягом дуже короткого періоду часу, що ускладнює
визначення концентрації NO та інших АФН. Тому, крім оцінки активності NOS, хорошим маркером вмісту NO є кількість його стабільних
метаболітів - NO2- та NO3-. У
периферичній крові NO2- і NO3-
продукуються з нітроген монооксиду, а зміни їхнього вмісту відображають
флуктуації продукції NO [42,72].
Споживання концентрату ПК викликало зниження
вмісту стабільних метаболітів NO у контрольних тварин на 8 % на 48 годину та на
20 % на 168 годину експерименту. При цьому вміст нітрит-аніону змін не
зазнавав, а вміст нітрат-аніону знижувався на 21 % на 168 годину порівняно з
контролем (табл. 3.1).
Опромінення піддослідних тварин у дозі 10 сГр
призводило до зростання сумарного вмісту стабільних метаболітів NO на 8 % на 24
годину та на 11 % на 168 годину порівняно з контролем. Вміст нітрит-аніону
знижувався на 48 % на 24 годину, на 25 % на 48 годину, на 41 % на 72 годину та
на 30 % на 168 годину, а вміст нітрат-аніону зростав на 13 % на 24 годину
порівняно з контролем (табл. 3.1).
За дії 10 сГр іонізуючого випромінювання на фоні
введення per os концентрату ПК нами було
відмічене зниження сумарного вмісту стабільних метаболітів NO на 9 % на 48
годину, та на 10 % на 168 годину, порівняно з показниками тварин, яких
піддавали лише дії радіації. На 24, 72 і 168 години після опромінення зростала
кількість нітритів у периферичній крові (на 48 %, на 62 % та на 44 %,
відповідно), а нітратів знижувалась на 24 та 168 години (на 18 % та на 13 %,
відповідно) (табл. 3.1).
Таблиця 3.1
Вміст стабільних метаболітів оксиду нітрогену у периферичній
крові щурів за дії іонізуючого випромінювання у дозі 10 сГр та за введення
концентрату природного поліфенольного комплексу з виноградного вина (M ± m, n = 6-10)
|
Досліджувані
показники Умови екперименту
|
Сумарний вміст
метаболітів оксиду нітрогену (нмоль / мкг протеїну)
|
Нітрит-аніон
(нмоль / мкг протеїну)
|
Нітрат-аніон
(нмоль / мкг протеїну)
|
|
24 год
|
|
К
|
798,78±31,82
|
63,52±6,74
|
|
К+ПК
|
751,27±30,09§
|
59,03±5,39
|
692,24±20,46
|
|
О
|
863,82±18,38*
|
32,75±3,03*
|
831,07±30,56*
|
|
О + ПК
|
730,28±30,27
|
48,41±2,32#
|
681,87±19,37#
|
|
48 год
|
|
К
|
780,95±18,46
|
58,86±6,82
|
722,09±20,93
|
|
К+ПК
|
717,49±20,71§
|
61,47±5,62
|
656,02±16,73
|
|
О
|
770,75±22,76
|
44,36±3,46*
|
726,39±20,62
|
|
О + ПК
|
699,36±10,16#,+
|
36,84±6,35++
|
662,52±15,83
|
|
72 год
|
|
К
|
784,02±37,85
|
61,29±8,53
|
722,73±9,68
|
|
К+ПК
|
769,40±32,08
|
63,41±6,82
|
705,99±18,28
|
|
О
|
787,58±12,82
|
36,46±4,86*
|
751,12±18,92
|
|
О + ПК
|
752,71±20,32
|
59,04±6,91#
|
693,67±25,89
|
|
168 год
|
|
К
|
802,93±17,40
|
58,93±8,05
|
744,00±18,60
|
|
К+ПК
|
643,16±15,38§
|
54,29±5,78
|
588,87±18,27§
|
|
О
|
894,28±13,68*
|
41,16±4,43*
|
853,12±22,12
|
|
О + ПК
|
800,47±31,81#,+
|
59,32±8,37#
|
741,15±20,79#,+
|
* - відмінність між показниками контрольної групи (К) та
опроміненням (О) вірогідна (Р<0,05); § - відмінність між показниками
контрольної групи (К) та контрольної групи за введення концентрату ПК (К+ПК)
вірогідна (Р<0,05); # - відмінність між показниками групи опромінених тварин
(О) та групи, якій вводили концентрат ПК на фоні опромінення (О+ПК) вірогідна
(Р<0,05); + - відмінність між показниками контрольної групи за введення
концентрату ПК (К+ПК) та групи, якій вводили концентрат ПК на фоні опромінення
(О+ПК) вірогідна (Р<0,05).
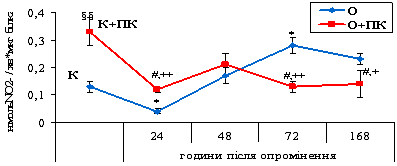
Рис. 3.2. Активність NO-синтази у периферичній крові щурів за дії іонізуючого випромінювання у
дозі 30 сГр та за введення
концентрату природного поліфенольного комплексу з виноградного вина. (M ± m, n = 6-10). * - відмінність між
показниками контрольної групи (К) та опроміненням (О) вірогідна (Р<0,05); §§
- відмінність між показниками контрольної групи (К) та контрольної групи за
введення концентрату ПК (К+ПК) вірогідна (Р<0,01); # - відмінність між
показниками групи опромінених тварин (О) та групи, якій вводили концентрат ПК
на фоні опромінення (О+ПК) вірогідна (Р<0,05); +, ++ - відмінність між
показниками контрольної групи за введення концентрату ПК (К+ПК) та групи, якій
вводили концентрат ПК на фоні опромінення (О+ПК) вірогідна (Р<0,05;
Р<0,01).
Споживання контрольними тваринами концентрату ПК спричиняє
зростання активності NOS в 2,5 раза порівняно з контролем (рис. 3.2).
Відмічено, що на 24 годину після впливу іонізуючого
випромінювання у дозі 30 сГр активність NOS знижується у 3,3 раза порівняно з
контролем. У подальші
терміни спостерігається поступове зростання цього показника і
на третю добу він є вищим від контрольних
значень у 2,2 раза (рис. 3.2).
Вплив іонізуючого випромінювання у дозі 30 сГр на фоні
споживання з питною водою концентрату ПК призводить до підвищення активності NOS на 24 годину після опромінення у 3
рази порівняно з тваринами, яких піддавали лише дії іонізуючого випромінювання.
У віддаленіші терміни досліджуваний показник знижується - у 2,2 і 1,6 рази на 72 та 168 години, у разі
введення концентрату на фоні опромінення порівняно з показниками тварин за дії
лише випромінювання (рис. 3.2).
Введення інтактним щурам концентрату ПК спричиняло
підвищення вмісту нітрит-аніона. Кількість нітрат-аніона, навпаки, знижується на 35 % на 24
та 48 години, на 31 % на 72 годину і на 32 % на 168 годину (табл.
3.2).
Таблиця 3.2
Вміст стабільних метаболітів оксиду нітрогену у периферичній
крові щурів за дії іонізуючого випромінювання у дозі 30 сГр та за введення
концентрату природного поліфенольного комплексу з виноградного вина (M ± m, n = 6-10)
|
Досліджувані
показники Умови екперименту
|
Сумарний вміст
метаболітів оксиду нітрогену (нмоль / мкг протеїну)
|
Нітрит-аніон
(нмоль / мкг протеїну)
|
Нітрат-аніон
(нмоль / мкг протеїну)
|
|
24 год
|
|
К
|
778,98±18,47
|
69,87±10,61
|
709,11±27,56
|
|
К+ПК
|
540,92±24,83§
|
83,71±3,92
|
457,49±16,83§§
|
|
О
|
1146,54±23,36*
|
18,50±0,79*
|
1128,03±22,98*
|
|
О + ПК
|
1041,09±22,46++
|
91,66±11,20#
|
949,43±33,54#,+
|
|
48 год
|
|
К
|
770,28±20,56
|
72,81±9,02
|
697,47±11,04
|
|
К+ПК
|
547,20±19,83§§
|
90,71±10,18
|
456,49±18,92§
|
|
О
|
765,34±42,64
|
32,06±6,83*
|
733,28±34,27
|
|
О + ПК
|
998,31±37,91#,+
|
78,16±9,26#
|
920,14±30,15#,++
|
|
72 год
|
|
К
|
761,82±14,82
|
68,72±13,17
|
693,10±17,29
|
|
К+ПК
|
561,80±20,73§
|
86,82±6,29§
|
474,98±14,02§
|
|
О
|
603,25±14,11*
|
94,41±10,40*
|
508,84±22,54*
|
|
О + ПК
|
1002,58±73,02#,+
|
83,86±3,98
|
918,72±73,09#,+
|
|
168 год
|
|
К
|
750,28±31,76
|
66,64±7,72
|
683,64±20,89
|
|
К+ПК
|
549,93±28,71§
|
85,78±9,18
|
464,15±22,38§
|
|
О
|
1167,83±24,82*
|
98,56±5,36*
|
1069,27±20,89**
|
|
О + ПК
|
1103,86±48,75+
|
80,46±6,47#
|
1023,4±31,57++
|
*, ** - відмінність між показниками контрольної групи (К) та
опроміненням (О) вірогідна (Р<0,05; Р<0,01); §, §§ - відмінність між
показниками контрольної групи (К) та контрольної групи за введення концентрату
ПК (К+ПК) вірогідна (Р<0,05; Р<0,01); # - відмінність між показниками
групи опромінених тварин (О) та групи, якій вводили концентрат ПК на фоні
опромінення (О+ПК) вірогідна (Р<0,05); +, ++ - відмінність між показниками
контрольної групи за введення концентрату ПК (К+ПК) та групи, якій вводили
концентрат ПК на фоні опромінення (О+ПК) вірогідна (Р<0,05; Р<0,01).
Тенденцію, аналогічну до зміни активності NOS, спостерігали у зміні вмісту
нітритів у периферичній крові щурів за умов дії іонізуючого випромінювання. На
24 годину після опромінення вміст цього метаболіту на 74 % рази нижчий
порівняно з контролем. На
48 годину після дії іонізуючої радіації
досліджуваний показник зростає і на 72
годину він є вищим від контрольних значень на 37 % та на 168 годину - на 48 % (табл. 3.2). Отже, однакові тенденції зміни
активності NOS та вмісту нітрит-аніона за
дії малих доз іонізуючого випромінювання свідчать про те, що пул NO та його метаболітів в умовах
експерименту є повністю залежним від функціонування цього ензиму. Вміст нітрат-аніона зростає більш ніж
на 59 % на 24 годину після опромінення. На 72 годину цей показник знижується на 27 % та зростає на 168 годину на 56 % порівняно з показниками групи
інтактних тварин (табл. 3.2).Зниження сумарного вмісту стабільних метаболітів NO на 72 годину експерименту після
опромінення (на 21 %) порівняно з контролем може свідчити про інтенсифікацію за
радіаційного впливу процесів утворення АФН з NO, який продукується у NO-синтазній реакції на ранніх етапах
експерименту (табл. 3.2).
Нами було відмічено, що вміст нітритів зростає на 24 та 48 години (на 395 % та 35 %, відповідно) і знижується на 18 % на 168 годину після опромінення за умов введення концентрату ПК, порівняно з показниками опромінених тварин
(табл. 3.2).
Споживання концентрату ПК спричиняє зниження рівня нітратів
на 16 % на 24 годину після дії рентгенівського випромінювання та підвищення
цього показника на 25 % та 81 % на 48 і 72 години, відповідно, порівняно зі
вмістом досліджуваного метаболіту у зазначені терміни за дії лише іонізуючої
радіації (табл. 3.2).
3.1.2 Активність NO-синтази та вміст
стабільних метаболітів оксиду нітрогену у лейкоцитах щурів за споживання
концентрату природного поліфенольного комплексу та дії випромінювання у дозах
10 та 30 сГр
Радіоіндуковані ефекти у клітинах імунної системи є об’єктом
досліджень радіобіологів вже протягом багатьох десятиліть. За дії середніх та
високих доз випромінювання розвивається явище імуносупресії, малі дози, в
більшості випадків, спричиняють імуностимуляцію у ранній пострадіаційний
період.Відомо, що запальний процес, який розвивається після дії іонізуючого
випромінювання, опосередокує ушкоджуючу дію радіації. Але малі та низькоінтенсивні дози
можуть мати протизапальні ефекти. Причиною такої різнонапрямленої дії малих та
великих доз радіації є різні ефекти на фагоцитоз, продукцію антигенів,
цитокінів та АФО і активність NOS, зокрема її індуцибельної ізоформи, та продукування NO.
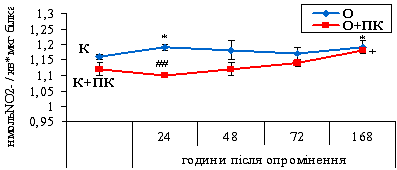
Рис. 3.3. Активність NO-синтази у лейкоцитах щурів за дії іонізуючого випромінювання у дозі 10
сГр та за введення концентрату природного поліфенольного комплексу з
виноградного вина. * - відмінність між показниками контрольної групи (К) та
опроміненням (О) вірогідна (Р<0,05); ## - відмінність між показниками групи
опромінених тварин (О) та групи, якій вводили концентрат ПК на фоні опромінення
(О+ПК) вірогідна (Р<0,01); + - відмінність між показниками контрольної групи
за введення концентрату ПК (К+ПК) та групи, якій вводили концентрат ПК на фоні
опромінення (О+ПК) вірогідна (Р<0,05).
Споживання концентрату ПК за впливу іонізуючого
випромінювання дозою 10 сГр спричиняло зниження активності NOS в лейкоцитах щурів, порівняно з
опроміненням (рис. 3.3).
Таблиця 3.3. Вміст стабільних метаболітів оксиду
нітрогену у лейкоцитах щурів за дії іонізуючого випромінювання у дозі 10 сГр та
за введення концентрату природного поліфенольного комплексу з виноградного вина
(M ± m, n = 6-10)
|
Досліджувані
показники Умови екперименту
|
Сумарний вміст
метаболітів оксиду нітрогену (нмоль / мкг протеїну)
|
Нітрит-аніон
(нмоль / мкг протеїну)
|
Нітрат-аніон (нмоль
/ мкг протеїну)
|
|
24 год
|
|
К
|
58,46±2,34
|
9,57±2,05
|
48,89±1,17
|
|
К+ПК
|
49,39±1,03§
|
11,82±1,62
|
37,57±0,94§§
|
|
О
|
67,41±2,38*
|
10,34±2,01
|
57,07±3,03*
|
|
О + ПК
|
59,47±1,28#,+
|
9,99±1,63
|
49,48±1,85#,++
|
|
48 год
|
|
К
|
62,01±1,83
|
10,31±1,54
|
51,70±1,28
|
|
К+ПК
|
51,69±1,58§
|
9,28±2,03
|
42,41±0,62
|
|
О
|
63,15±0,84
|
12,34±1,18
|
50,81±1,83
|
|
О + ПК
|
59,61±1,38#,+
|
10,13±0,89
|
49,68±1,82+
|
|
72 год
|
|
К
|
66,38±1,64
|
10,43±2,01
|
55,95±1,94
|
|
К+ПК
|
51,78±3,78§
|
9,85±0,75
|
41,93±0,94§
|
|
О
|
69,31±1,23
|
14,06±1,62*
|
55,25±2,17
|
|
О + ПК
|
61,64±2,31#,+
|
9,64±1,83#
|
51,75±1,74+
|
|
168 год
|
|
К
|
60,93±1,56
|
8,97±1,64
|
51,96±1,73
|
|
К+ПК
|
55,26±1,67
|
9,41±1,75
|
45,85±1,83§§
|
|
О
|
61,64±1,78
|
11,75±0,84*
|
49,89±2,03
|
|
О + ПК
|
60,27±0,72
|
9,02±1,89
|
51,25±1,52+
|
* - відмінність між показниками контрольної групи (К) та
опроміненням (О) вірогідна (Р<0,05); §, §§ - відмінність між показниками
контрольної групи (К) та контрольної групи за введення концентрат ПК (К+ПК)
вірогідна (Р<0,05; Р<0,01); # - відмінність між показниками групи
опромінених тварин (О) та групи, якій вводили концентрат ПК на фоні опромінення
(О+ПК) вірогідна (Р<0,05); +, ++ - відмінність між показниками контрольної
групи за введення концентрату ПК (К+ПК) та групи, якій вводили концентрат ПК на
фоні опромінення (О+ПК) вірогідна (Р<0,05; Р<0,01).
Також ми дослідили вміст стабільних метаболітів
оксиду нітрогену в лейкоцитах периферичної крові щурів. Введення концентрату ПК
інтактним тваринам спричиняло зниження сумарного вмісту метаболітів NO на перші три доби
експерименту та вмісту нітратів на 24 годину (на 23 %), 72 годину (25 %) та на
168 годину (12 %) порівняно з контрольними показниками (табл. 3.3). Було
відмічено, що після дії іонізуючого випромінювання дозою 10 сГр вміст
стабільних метаболітів NO зростав на 24 годину на 15 %, головно завдяки
зростанню вмісту нітрат-аніону (на 17 %), а на більш віддалені терміни
експерименту зростав вміст нітрит-аніону - на 35 % на 72 годину та на 30 % на
168 годину порівняно з контролем (табл. 3.3).
У разі споживання концентрату ПК опроміненими
щурами рівень нітрит-аніону знижувався на 31 % на 72 годину, а рівень
нітрат-аніону - на 13 % на 24 годину (табл. 3.3).
При введенні концентрату ПК контрольним тваринам активність NOS у лейкоцитах периферичної крові
знижувалася у 1,4 раза (рис. 3.4).
При дослідженні впливу іонізуючого випромінювання дозою 30
сГр на стан системи L-аргінін/NO у лейкоцитах було відмічено наступні
зміни: на 24 годину експерименту активність NOS знижувалася у 1,2 раза порівняно з
контролем. В подальші терміни спостерігалося зростання даного показника в 1,3
раза на 48 годину, в 1,7 раза на 72 годину та в 1,2 раза на 168 годину (рис.
3.4).
Відмічено зростання активності NOS у лейкоцитах щурів, яким на фоні дії
30 сГр іонізуючого випромінювання вводили поліфенольний комплекс, на 24 годину
в 1,3 рази та зниження в 1,1 рази на другу, в 2 рази на третю та в 1,3 раза на
сьому доби, порівняно з показниками групи опромінених тварин (рис. 3.4).
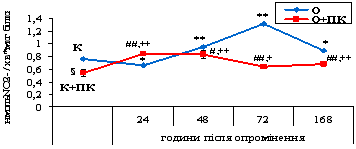
Рис. 3.4. Активність NO-синтази в лейкоцитах щурів за дії іонізуючого випромінювання у дозі 30
сГр та за введення концентрату природного поліфенольного комплексу з
виноградного вина.
*, ** - відмінність між показниками контрольної групи (К) та
опроміненням (О) вірогідна (Р<0,05; Р<0,01); § - відмінність між
показниками контрольної групи (К) та контрольної групи за введення концентрату
ПК (К+ПК) вірогідна (Р<0,05); #, ## - відмінність між показниками групи
опромінених тварин (О) та групи, якій вводили концентрат ПК на фоні опромінення
(О+ПК) вірогідна (Р<0,05; Р<0,01); +, ++ - відмінність між показниками
контрольної групи за введення концентрату ПК (К+ПК) та групи, якій вводили
концентрат ПК на фоні опромінення (О+ПК) вірогідна (Р<0,05; Р<0,01).
Споживання концентрату ПК контрольними тваринами викликало
зниження вмісту NO3- у лейкоцитах на 36 % як на 24, так і
на 72 години та зростання на 70
% на 168 годину експерименту. Сумарний вміст метаболітів NO знижувався на першу добу на 20 % та
зростав на 34 % на 168 годину порівняно з контролем (табл. 3.4).
Після опромінення у дозі 30 сГр показано зниження вмісту NO2- на 24 годину на 43 %, тоді як на 48 годину
досліджуваний показник зростав на 51 % та на 72 годину на 88 % порівняно з
контролем. Вміст NO3- після опромінення зростав на 29 % на
24 годину, на 57 % на 48 годину, на 65 % на 72 годину та на 36 % на 168 годину порівняно з контролем
(табл. 3.4). Також на другу та третю доби після опромінення зростав сумарний
вміст метаболітів NO на 55 %
та 70 %, відповідно (табл. 3.4).
Таблиця 3.4
Вміст стабільних метаболітів оксиду нітрогену у лейкоцитах
щурів за дії іонізуючого випромінювання у дозі 30 сГр та за введення
концентрату природного поліфенольного комплексу з виноградного вина (M ± m, n = 6-10)
|
Досліджувані
показники Умови екперименту
|
Сумарний вміст
метаболітів оксиду нітрогену (нмоль / мкг протеїну)
|
Нітрит-аніон
(нмоль / мкг протеїну)
|
Нітрат-аніон
(нмоль / мкг протеїну)
|
|
24 год
|
|
К
|
33,57±1,07
|
10,38±1,47
|
23,19±1,84
|
|
К+ПК
|
26,98±1,35§
|
12,26±1,05
|
14,72±1,82§§
|
|
О
|
35,75±1,18
|
5,92±1,08*
|
29,83±1,29*
|
|
О + ПК
|
41,51±1,85#,++
|
9,76±1,33#
|
31,75±2,23+
|
|
48 год
|
|
К
|
27,87±1,49
|
6,04±1,65
|
21,83±1,37
|
|
К+ПК
|
34,52±3,17
|
7,36±0,78
|
27,16±2,02
|
|
О
|
43,28±2,07**
|
9,10±0,96*
|
34,18±1,82**
|
|
О + ПК
|
51,19±1,67+
|
8,95±1,86
|
42,24±1,12##,++
|
|
72 год
|
|
К
|
32,24±2,31
|
7,37±1,92
|
24,87±3,28
|
|
К+ПК
|
25,27±2,94
|
9,36±2,30
|
15,90±1,73§
|
|
О
|
54,85±2,22**
|
13,83±1,13*
|
41,03±2,82**
|
|
О + ПК
|
53,42±1,65++
|
9,29±2,03
|
44,12±2,13++
|
|
168 год
|
|
К
|
28,16±4,56
|
11,32±2,74
|
16,84±1,61
|
|
К+ПК
|
37,72±1,67*
|
9,12±1,68
|
28,60±2,64§
|
|
О
|
32,04±0,99
|
9,17±1,18
|
22,87±1,73*
|
|
О + ПК
|
34,16±2,73
|
10,55±1,83
|
23,61±0,92
|
*, ** - відмінність між показниками контрольної групи (К) та
опроміненням (О) вірогідна (Р<0,05; Р<0,01); §, §§ - відмінність між
показниками контрольної групи (К) та контрольної групи за введення концентрату
ПК (К+ПК) вірогідна (Р<0,05; Р<0,01); #, ## - відмінність між показниками
групи опромінених тварин (О) та групи, якій вводили концентрат ПК на фоні
опромінення (О+ПК) вірогідна (Р<0,05; Р<0,01); +, ++ - відмінність між
показниками контрольної групи за введення концентрату ПК (К+ПК) та групи, якій
вводили концентрат ПК на фоні опромінення (О+ПК) вірогідна (Р<0,05;
Р<0,01).
За умов споживання концентрату ПК на 24 годину після
опромінення сумарний вміст стабільних метаболітів NO зростав на 17 %, тоді як вміст NO2- - на 37 %. Зростання вмісту NO3- на 37 % було виявлено лише на 48
годину в порівнянні з показниками опромінених тварин (табл. 3.4)
3.2 Вплив поліфенолів з виноградного вина на рівень 3’-нітротирозин-модифікованих
протеїнів за дії малих доз іонізуючого випромінювання
NOS є біфункціональним ензимом, адже здатна каталізувати утворення оксиду нітрогену
та супероксидного аніон-радикаду. Причиною цього є димерна природа молекули ферменту, в якому дві субодиниці
здатні функціонувати незалежно одна від одної. Продукувати оксид нітрогену NOS може лише за високої
внутрішньоклітинної концентрації BH4 та L-аргініну [36]
Зростання активності NOS за умов дії малих доз радіації може стати
причиною надмірної продукції як NO, так і О2▪-.
Продукти NO-синтазної реакції взаємодіють між собою та
продукують більш потужний прооксидант та цитотоксин - пероксинітрит. Ця
молекула взаємодіє з ліпідами, ДНК і протеїнами, спричиняє їхнє окиснення,
нітрування та нітрозилювання, а отже призводить до втрати їхніх функцій, що
провокує ушкодження клітин і клітинної смерті [113]. Оскільки АФН важко
детектувати in vivo
у зв’язку з їхньою високою реактивністю, нітротирозин вважають найкращим
біомаркером утворення ONOO- [48].
3.2.1 Накопичення 3’-нітротирозин-модифікованих протеїнів у
лейкоцитах щурів за дії іонізуючого випромінювання у дозах 10 та 30 сГр та за
умов споживання концентрату поліфенольного комплексу з виноградного вина
За умов споживання контрольними тваринами концентрату ПК на
всі терміни дослідження не відмічено достовірних змін вмісту
3’-нітротирозин-модифікованих протеїнів у лізатах лейкоцитів щурів порівняно з
контролем (рис. 3.9, рис. 3.10).
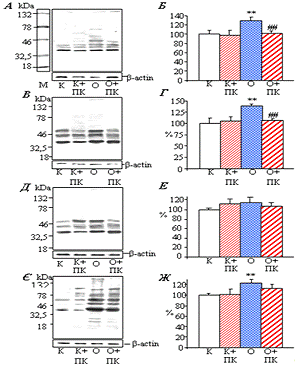
Рис. 3.9. Вестерн-блот аналіз
3’-нітротирозин-модифікованих протеїнів лізатів лейкоцитів на 24 (А), 48 (В),
72 (Д) години та на 7 добу (Є) після опромінення у дозі 10 сГр та за дії концентрату
природного полі фенольного комплексу з виноградного вина. Вміст
нітротирозин-модифікованих протеїнів у відсотках (контроль прийнято за 100%)
(Б), (Г), (Е), (Ж), відповідно. М - маркери молекулярної маси. ** - відмінність між показниками
контрольної групи (К) та опроміненням (О) вірогідна (Р<0,01); ## -
відмінність між показниками групи опромінених тварин (О) та групи, якій вводили
концентрат ПК на фоні опромінення (О+ПК) вірогідна (Р<0,01).
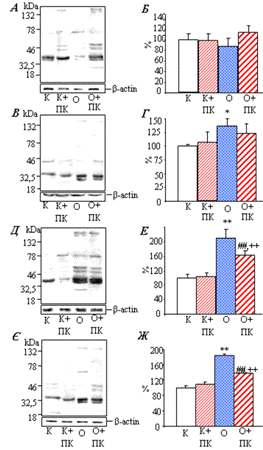
Рис. 3.10. Вестерн-блот аналіз 3’-нітротирозин-модифікованих протеїнів лізатів
лейкоцитів на 24 (А), 48 (В), 72 (Д) години та на 7 добу (Є) після опромінення
у дозі 30 сГр та за дії концентрату
природного поліфенольного комплексу з виноградного вина. Вміст нітротирозин-модифікованих
протеїнів у відсотках (контроль прийнято за 100%) (Б), (Г), (Е), (Ж),
відповідно. *, ** - відмінність між показниками контрольної групи (К) та
опроміненням (О) вірогідна (Р<0,05; Р<0,01); ## - відмінність між
показниками групи опромінених тварин (О) та групи, якій вводили концентрат ПК
на фоні опромінення (О+ПК) вірогідна (Р<0,01); ++ - відмінність між
показниками контрольної групи за введення концентрату ПК (К+ПК) та групи, якій
вводили концентрат ПК на фоні опромінення (О+ПК) вірогідна (Р<0,01).
Після опромінення в дозі 10 сГр досліджуваний показник
зростав на 29 % 24 годину, на 39 % на 48 годину та на 22 % на 168 годину
порівняно з контролем (рис. 3.9 А, Б, В, Г, Є, Ж), що, імовірно, є наслідком
ініціації надмірного продукування вмісту АФН та АФО після впливу радіації. Нами
виявлено достовірне зниження вмісту протеїнів, модифікованих нітруванням за
залишками тирозину, на 28 % на 24 годину та на 32 % на 48 годину після
радіаційного впливу у разі введення концентрату ПК порівняно з опроміненням,
тобто повернення досліджуваного показника до контрольних значень (рис. 3.9 А,
Б, В, Г). Таким чином, споживання тваринами концентрату ПК попереджає
наднормове утворення 3’-нітротирозин-модифікованих протеїнів у лейкоцитах
периферичної крові щурів після дії рентгенівського випромінювання у дозі 10
сГр.
Як за умов опромінення в дозі 10 сГр, вміст нітротирозину у
лізатах лейкоцитів щурів після опромінення в дозі 30 сГр зростав, однак цей
показник був значно вищий від контролю - на 37% на 48 годину, на 111% на 72 годину
та на 174 % на 168 годину (рис. 3.10 В, Г, Д, Е, Є, Ж). Після опромінення за
умов споживання тваринами концентрату ПК на другу добу експерименту відмічено
незначне зниження вмісту протеїнів, модифікованих нітруванням за залишками
тирозину, а на третю та сьому добу - на 49 % та на 46 %, відповідно, порівняно
з досліджуваним показником за опромінення (рис. 3.10 Д, Е, Є, Ж), однак цей
показник залишався вищим від контрольних значень.
У лейкоцитах периферичної крові всіх груп тварин було
відмічено наявність домінуючого протеїну з молекулярною масою приблизно 40 кДа.
Цікавим є те, що після опромінення у дозі 30 сГр з’являється два чітких бенди,
що відповідають протеїнам з молекулярною масою 40-45 кДа. Це свідчить про те,
що за умов впливу іонізуючого випромінювання модифікуються інші протеїни, ніж у
нормі, а концентрат ПК впливаючи на сумарний вміст нітрованих протеїнів не
здатний спричиняти зміну клітинних мішеней цієї посттрансляційної модифікації.
Отже, інгібуючи активність NOS, концентрат ПК
зумовлює зниження індукованої впливом малих доз іонізуючої радіації продукції
оксиду нітрогену у лейкоцитах. Це у свою чергу пригнічує утворення
пероксинітриту і, у подальшому, опосередковану ним модифікацію протеїнів. Таким
чином, пригнічення нітративного стресу в ранній пострадіаційний період є одним
із механізмів, що опосередковує позитивний коригуючий вплив поліфенолів
виноградного вина на клітини імунної системи за впливу малих доз радіації.
4.
Охорона праці та безпека в надзвичайних ситуаціях
Вступ. Охорона праці є наукою, в основу якої покладено дослідження
впливу виробничих небезпек і шкідливих умов на організм людини, всебічне
вивчення причин їх виникнення і розробка заходів профілактики професійних
захворювань та виробничого травматизму.
В умовах науково-технічного прогресу особливо актуальним стає
питання безпеки життєдіяльності на робочому місці. Сучасний розвиток будь-якої
галузі господарства країни пов’язаний з інтенсифікацією праці, використання
більш складної техніки, комп’ютеризації виробництва. Це в свою чергу вимагає
підвищення рівня профілактичної роботи по попередженню впливу небезпечних та
шкідливих факторів на працівників.
Розвиток біологічних наук в наш час був би неможливим без
відповідної матеріально-технічної бази. Тільки використання нових зразків
вимірювальної техніки забезпечує практичну перевірку наукової гіпотези.
Особливо важливу роль в процесі наукового пізнання істини відіграють
інформаційні технології. Робота в науково-дослідній лабораторії пов’язана з
певною небезпекою, оскільки кожен науковець в процесі роботи стикається зі
шкідливими та небезпечними для життя і здоров’я речовинами, а також
використовує різноманітну апаратуру. Тому основною умовою для безпечної роботи
в лабораторії повинно бути свідоме виконання кожним співробітником правил
техніки безпеки.
4.1 Аналіз стану виробничих
умов
.1.1
Характеристика лабораторії
Науково-дослідна лабораторія знаходиться у приміщенні
Львівського національного університету імені Івана Франка кафедри біохімії.
Лабораторія розміщена на першому поверсі і складається з однієї робочої кімнати
площею 40 м2. Лабораторне приміщення характеризується наявністю
електро-, газо-, водомережі. Приміщення забезпечене опаленням. В лабораторії є
два робочі столи ─ вздовж стіни та посередині кімнати, на них розміщені
робочі прилади та посуд, а на спеціальних поличках знаходяться реактиви.
Підлога в кімнаті в основному дерев’яна, і лише невелика частина покрита
плиткою.
В лабораторії застосовується природне та штучне (електролампи
─ КПО становить 2,5 %) освітлення - 200
лк.Запиленість лабораторії незначна, особливих джерел пилоутворення немає.
Джерелом шуму та вібрації у лабораторії є центрифуги.
В лабораторії обладнана витяжна шафа для роботи зі шкідливими
речовинами, також тут зберігають різні речовини, випари яких можуть бути
шкідливими. Відносна вологість повітря у лабораторії 50─60%, температура
18─220 С, швидкість руху повітря 0,3 м/с. В приміщенні
забезпечується належний мікроклімат вентиляцією та прибиранням. Вентиляцію
здійснюють механічним чином ─ регулярним провітрюванням кімнати, а
чистота ─ постійним вологим прибиранням.
За пожеженебезпечністю приміщення належить до В класу.
Для забезпечення індивідуального захисту використовуються
халати та гумові рукавиці, а колективного ─ витяжна шафа, захисні
окуляри, груші, фартухи.
В лабораторії укомплектована аптечка для забезпечення
долікарської допомоги.
4.1.2 Аналіз методів
дослідження та характеристика обладнання
При виконанні магістерської роботи використовували наступні
методи: виділення еритроцитів; отримання гемолізатів еритроцитів; визначення
концентрації білка за методом Лоурі; визначення активності аргінази; визначення
концентрації орнітину; визначення вмісту нітритів; визначення вмісту нітратів;
визначення активності різних ізомерів NOS.
Для здійснення роботи за даними методиками використовувалося
наступне обладнання:
Мікроскоп ─ необхідний для підрахунку кількості клітин.
Термостат ─ необхідний для підтримання сталої температури клітин.
рН-метр ─ застосовується для визначення рН розчинів.
Аналітична вага ─ застосовується для зважування речовин при
проведенні досліджень.
Холодильник ─ застосовується для зберігання хімічних реактивів.
Сушильна шафа ─ необхідна для сушіння посуду.
Витяжна шафа ─ використовується для роботи з небезпечними
речовинами.
Небезпека при роботі з цими приладами може виникнути при
пошкодження ізоляції електропроводів, в такому випадку можливі ураження
електричним струмом.
Небезпечним також є контакт тіла людини з частинами приладу,
які можуть опинитися під напругою.
Газовий пальник. Небезпека при роботі з газовим пальником виникає при
несправності сітки газопроводу, гумового шланга чи самого пальника. При погано
відрегульованому доступі кисню в пальник чи недостатній вентиляції виникає
небезпека отруєння чадним газом, що утворюється при неповному згоранні метану.
Безпосередня дія вогню на легкозаймисті предмети і речовини може призвести до
виникнення пожежі.
В роботі також використовувався скляний посуд: мірні
циліндри, піпетки, пробірки, мірні колби, стакани.
Набір тексту магістерської роботи виконаний на комп’ютері
Asus F3S.
4.1.3 Характеристика об’єкта
дослідження, речовин, їхніх небезпечних властивостей
Об’єктом досліджень є еритроцити з периферичної крові
здорових донорів та щурів, хворих цукровим діабетом 1 типу. При роботі з кров’ю
потрібно бути особливо уважним, працювати в рукавицях та недопускати
потрапляння крові на відкриті частини тіла.
Небезпеку для здоров’я людини несе робота з хімічними
реактивами. Вони можуть бути отруйними, викликати опіки, а також можуть бути
причиною пожежі при неправильному користуванні. При виконанні роботи
використовували наступні реактиви:
Gradisol-G ─ використовується для створення градієнту густини при
виділенні лейкоцитів;
Гепарин ─ використовується як антикоагулянт при заборі крові;
ЕДТА ─ використовується як хелатна сполука для зв’язування
іонів двовалентних металів у буферах;
PBS (рН 7,2) ─ використовується для відмивання еритроцитів.
Перелічені речовини зберігають у щільно закритому посуді в
холодильнику. При використанні не мають негативного впливу на здоров’я людини.
Для миття хімічного посуду використовували хромову суміш,
яка є сильним окисником і, при потраплянні на шкіру чи слизові оболонки може
викликати опіки, а при потраплянні на одяг ─ його пошкодження.
Приготування і використання хромової суміші вимагає особливої уваги і
обережності. Зберігають у фарфорових стаканах з корками. З хромовою сумішшю
працюють під витяжною шафою, в гумових рукавичках і захисних окулярах, одягають
маску і фартух.
4.2
Організаційно-технічні заходи
.2.1.
Організація робочого місця і роботи
В робочому приміщенні повинно знаходитись не менше двох
чоловік. До роботи допускаються особи, які пройшли інструктаж з техніки
безпеки.
Перед початком роботи в лабораторії необхідно перевірити:
наявність протипожежних засобів загального користування
(вогнегасник, пісок, ковдри) та засобів індивідуального користування (окуляри,
маски, фартух, рукавиці);
справність вентиляційної системи;
наявність аптечки, укомплектованої засобами першої медичної
допомоги;
наявність надійного електрозаземлення, справність ізоляції
При відсутності або несправності приладів працювати в
лабораторії заборонено. Не можна працювати на будь-яких приладах особам, які не
вивчили правил експлуатації цих приладів, та не одержали дозволу на роботу від
відповідального за прилад [11].
Кожен вид робіт обов’язково фіксують у відповідному журналі,
при цьому зазначають прізвище працюючого, об’єкт і час роботи та зауваження
щодо роботи приладів. Заборонено залишати увімкнені прилади без нагляду. Про
всі неполадки в роботі приладів необхідно негайно інформувати відповідальну
особу.
На робочому місці повинні знаходитись лише необхідні для
виконання конкретної роботи реактиви, прилади, обладнання.
Усі реактиви, які зберігаються в лабораторії, повинні бути
підписані, обов’язково вказується назва сполуки, її формула, концентрація, дата
приготування. Забороняється використовувати реактиви без етикеток або з
незрозумілими написами на них. На робочому місці кількість реактивів повинна
бути мінімальною, необхідною для даного досліду в межах добової необхідності,
але не більше 1─2 л.
Залишки речовин не можна висипати або виливати назад в
посудину з чистими реактивами. Потрібно використовувати чистий лабораторний
посуд. Забороняється виливати в раковину відходи хімічних реактивів, органічних
розчинників, азотні розчини хімічних речовин.
При виконанні досліду необхідно працювати стоячи. Сидячи
дозволяється проводити вибухо-, вогненебезпечні роботи та роботи, під час яких
неможливе розбризкування кислот.Потрібно працювати та утримувати робоче місце у
чистоті. Після закінчення роботи необхідно прибрати робоче місце, вимкнути
електричні прилади, перекрити газові лінії та воду.
4.2.2
Санітарно-гігієнічні вимоги до умов праці
До основних санітарно-гігієнічних вимог при роботі належить
забезпечення належної температури, вологості, освітлення, опалення, вентиляції
і чистоти в приміщенні.Світло має визначальне значення для роботи і збереження
здоров’я людини, оскільки діє на органи зору, а через них ─ на центральну
нервову систему. Раціональне освітлення виробничих приміщень відіграє суттєву
роль у створенні сприятливих та безпечних умов праці. Температура повітря в
лабораторії підтримується у межах 18-21°С.Вентиляція, поряд з освітленням, є
дуже важливим чинником працездатності. Вентиляція повинна забезпечити чистоту
повітря і необхідні кліматичні умови у виробничих приміщеннях. Вентиляцією
називається комплекс взаємозв’язаних пристроїв і процесів, призначених для
створення організованого повітрообміну, який полягає у виведенні з виробничого
приміщення забрудненого нагрітого (охолодженого) повітря з подачею замість
нього чистого охолодженого (нагрітого) повітря для створення в робочій зоні
сприятливих умов повітряного середовища.
Особливої уваги при роботі в лабораторії приділяють
запобіганню можливості проникнення хімічних речовин в організм через легені,
шкіру. Для цього роботу з рідкими летючими, або тими, що легко утворюють пил,
речовинами потрібно працювати під витяжною шафою із ввімкненою вентиляцією.
При виконанні дослідних робіт усі працівники повинні
працювати в халатах і гумових рукавицях. При попаданні будь-яких речовин на
поверхню шкіри чи слизові оболонки (особливо речовин, що викликають опіки)
необхідно негайно промити уражені місця великою кількістю води (при попаданні
кислоти чи лугу нейтралізувати їх розчином соди або лимонної кислоти). При
проведенні будь-яких робіт, пов’язаних з небезпекою пошкодження очей, працювати
без окулярів чи масок забороняється.
Забороняється вживати і зберігати їжу в лабораторії поряд з
хімічними речовинами.
Не можна всмоктувати хімічні речовини з піпетки ротом, для
цього потрібно використовувати гумові груші.
В кожній лабораторії у призначеному місці знаходиться аптечка
з набором медикаментів, перев’язувальних матеріалів [38].
4.2.3 Заходи щодо безпеки під
час роботи з обладнанням, об’єктом дослідження і речовинами
При роботі з кров’ю працюють у гумових рукавичках. При
підозрі на інфекцію звернутися до лікаря для попередження можливого
захворювання.
При роботі з електроприладами необхідно пам’ятати про вплив електричного
струму на організм людини. Перед вмиканням електроприладів у мережу необхідно
перевірити чи не пошкоджена ізоляція проводу та переконатися в справності
приладу. Усі прилади повинні бути заземлені. Біля кожного приладу повинна бути
інструкція, з якою необхідно ознайомитися перед початком роботи. Забороняється
залишати без нагляду електричні установки, включені електронагрівальні прилади,
газові пальники.
Під час роботи з центрифугою слід пам’ятати, що при обертанні
ротора на великих швидкостях в деталях виникає значна напруга, яка може
призвести до розриву барабана і розкидання уламків із величезною силою. У
випадку незрівноваження неминучою є вібрація, яка також може призвести до
аварії. Тому під час роботи слід дотримуватись наступних правил:Під час
обертання ротора кришка центрифуги повинна бути закритою.Не дозволяється
зупиняти центрифугу руками або стороннімипредметами.
Не можна відкривати кришку до повної зупинки ротора [28].
Під час миття скляного посуду потрібно пам’ятати, що скло
легко ламається і тріскається від ударів, різкої зміни температури.
При роботі з токсичними речовинами потрібно одягати гумові
рукавиці, бо ці речовини здатні проникати в організм через шкіру і викликати
алергічні реакції чи просто опіки шкіри.
Для взяття хімічних реактивів використовуються хімічні
шпателі, брати їх руками забороняється.
У випадку розлиття реактиву необхідно спочатку нейтралізувати
його, а потім змити водою і протерти насухо.
Легкозаймисті горючі речовини повинні зберігатись в товстих
банках з щільними корками місткістю до 3 л, окрім цього їх поміщають в
металевий ящик з кришкою, стінки якого вкриті азбестом.
Переливання рідин здійснюють на відстані не менше 3 м від
відкритого вогню.
Відпрацьовані реактиви забороняється виливати в каналізацію,
їх збирають у спеціальну закриту тару, яку в кінці робочого дня видаляють з
лабораторії для регенерації або знищення.
При хімічних опіках кислотами (сірчаною, соляною, оцтовою,
ТХО тощо) необхідно промити водою місце контакту з кислотою протягом 10-15
хвилин, потім промити 2-3% розчином питної соди або 2-3% розчином аміаку та
накласти асептичну пов’язку [12].
Правила роботи з ПК:
. Неправильне поводження з дисплеєм може призвести до важких
уражень електричним струмом, спричинити загоряння апаратури.
. Забороняється торкатися до екрану і тильного боку дисплея,
проводів живлення та пристроїв заземлення, з’єднувальних кабелів.
. Не можна вставляти різні предмети у вентиляційні канали
комп’ютера.
. Дотримуватись порядку ввімкнення та вимикання апаратурних
блоків.
. Самовільно не усувати виявлену несправність у роботі
апаратури.
. Не дозволяється класти сторонні предмети на апаратуру та
натискати на клавіатуру з великим зусиллям.
. Не працювати за комп’ютером у вологому одязі або з вологими
руками.
. Не проводити вологе прибирання при ввімкнених пристроях.
. При виникненні несправності або аварійної ситуації
необхідно негайно відключити комп’ютер від електромережі.
4.3
Безпека в надзвичайних ситуаціях
.3.1
Протипожежні та проти вибухові заходи
Виробничі приміщення мають підвищену пожежну небезпеку,
оскільки їх характеризують складність виробничого устаткування, значна
кількість горючих рідин, твердих горючих матеріалів, велика кількість
електричного устаткування.Пожежі можуть виникати через порушення технічного
режиму, несправність обладнання, самозаймання промасленого шмаття та інших
матеріалів; конструктивні недоліки обладнання, ремонт обладнання на ходу і
несправність каналізації та газопроводів тощо. У лабораторіях мають бути
розроблені інструкції про заходи протипожежної безпеки та план евакуації. З
даними інструкціями повинен бути ознайомлений персонал. Приміщення лабораторій
повинні бути обладнані засобами пожежогасіння у відповідності з діючими
нормами. Лабораторні меблі та обладнання слід розташовувати так, щоб вони не
перешкоджали евакуації людей, які знаходяться в приміщенні, через евакуаційні
виходи.
Успіх швидкої локалізації та ліквідації пожежі на її початку
залежить від наявних засобів вогнегасіння, вміння користуватись ними усіма
працівниками, а також засобів пожежного зв’язку та сигналізації для виклику
пожежної допомоги, та введення в дію первинних автоматичних засобів
вогнегасіння.
Важливо знати оцінку пожежо- та вибухонебезпечності усіх
речовин та матеріалів, які знаходяться в лабораторії. З негорючих речовин в
лабораторії наявні такі металоконструкції: 3 умивальники, стіл. В приміщені
наявні такі горючі речовини: деревина, папір, тканини, гас. З легкозаймистими і
горючими речовинами потрібно працювати у витяжній шафі з умови, що в
лабораторії немає джерела відкритого вогню. При роботі з цими речовинами
потрібно пам’ятати, що вони повинні бути чітко підписані.
За пожежонебезпечністю приміщення належить до категорії В.
Клас пожежі В, Е.
При необережному поводженні з електроприладами і
легкозаймистими речовинами може виникнути пожежа. Забороняється виливати
легкозаймисті та вибухонебезпечні речовини в каналізацію. Під час виконання
роботи суворо забороняється палити в лабораторії.
По закінченню роботи потрібно ретельно перевірити і вимкнути
усі прилади, газ та газові пальники.
У випадку необхідності потрібно викликати пожежну команду і
повідомити керівництво.
Приміщення лабораторії обладнане такими засобами
пожежогасіння: вода, пісок, ковдра, 1 порошковий вогнегасник місткістю 5 л
[25].
4.3.2
Організація евакуації працівників
Проведення організованої евакуації з виробничих та інших
приміщень і будівель, запобігання проявам паніки і недопущення загибелі людей
забезпечують шляхом складання плану евакуації з розробленням схеми евакуаційних
шляхів та виходів
Серед загальних вимог до евакуаційних шляхів та виходів
необхідно відмітити, що ними можуть бути дверні отвори, якщо вони ведуть з
приміщень:
− безпосередньо назовні;
− на сходовий майданчик з виходом назовні безпосередньо
або через вестибюль;
− у прохід або коридор з безпосереднім виходом назовні
або на сходовий майданчик;
− у сусідні приміщення того ж поверху, що не містять
виробництв, які належать за вибухопожежною та пожежною небезпекою до категорій
А, Б і В та мають безпосередній вихід назовні або на сходовий майданчик.
Для безпечної евакуації шляхи та виходи мають відповідати
таким вимогам:
− евакуаційні шляхи і виходи повинні утримуватися
вільними, не захаращуватися та у разі потреби забезпечувати евакуацію всіх
людей, які перебувають у приміщеннях;
− кількість та розміри евакуаційних виходів, їхні
конструктивні рішення, умови освітленості, забезпечення незадимленості,
протяжність шляхів евакуації, їхнє оздоблення повинні відповідати протипожежним
вимогам будівельних норм;
− у приміщенні, яке має один евакуаційний вихід,
дозволяється одночасно розміщувати не більше 50 осіб, а у разі перебування в
ньому понад 50 осіб повинно бути щонайменше два виходи, які відповідають
вимогам будівельних норм;
− двері на шляхах евакуації повинні відчинятися в
напрямку виходу з будівель (приміщень) і замикатися лише на внутрішні запори,
які легко відмикаються.
Висновки
Одержані результати розширюють уявлення про біохімічні
механізми прояву негативних наслідків ураження малими дозами іонізуючого
випромінювання та розширюють арсенал засобів, призначених для запобігання і
усунення таких змін. У
цій роботі показано коригуючий вплив концентрату природного поліфенольного
комплексу з червоного виноградного вина на процес розвитку радіоіндукованого нітративного стресу, що підтверджувалось зміною показників у лейкоцитах та периферичній крові
тварин після опромінення у дозі10 та
30 сГр.
. Розроблено метод отримання та стабілізації концентрату, збагаченого
поліфенольними сполуками з червоного виноградного вина та експериментально
доведено його радіопротекторні властивості.
. Встановлено, що за дії малих доз іонізуючого випромінювання зростає
активність NO-синтази і підвищується рівень
утворення NO. Про це свідчить зростання сумарного
вмісту стабільних метаболітів NO (NO2- та NO3-) як у периферичній крові, так і в імунокомпетентних
клітинах щурів.
3. Пероральне введення концентрату ПК пригнічує активність NOS та знижує вміст NO2- та NO3- у лейкоцитах щурів,
опромінених малими дозами іонізуючого випромінювання.
4. Показано, що після впливу рентгенівського випромінювання внаслідок
інтенсифікації реакцій нітрування тирозинових залишків протеїнів зростає вміст
3’-нітротирозину у лейкоцитах щурів, а споживання концентрату ПК опроміненими
тваринами призводить до зниження цього показника до меж норми.
5.
Концентрат поліфенольного комплексу, отриманий з червоного виноградного вина
рекомендується для запобігання чи корекції патологій, які супроводжуються
розвитком оксидативно-нітративного стресу, зокрема індукованих впливом малих
доз іонізуючого випромінювання.
6. Для створення необхідних умов праці в лабораторії було
дотримано санітарно-гігієнічні вимоги. Були здійснені заходи запобігання
пожежі. Дотримувались правила техніки безпеки при роботі з електроприладами,
нагрівальними приладами, органічними розчинниками та кислотами, скляним
посудом. Заходи були здійснені згідно з нормами.
Список використаних джерел
1. Барабой
В. А. Биоантиоксиданты / В. А. Барабой. - К.: Книга плюс, 2006. -
462 с.
2. Блюм
Я. Б. Нітрування тирозину як регуляторна посттрансляційна модифікація протеїнів
/ Я. Б. Блюм, Ю. А. Красиленко, А. І. Ємець // Укр. біохім. журн. - 2009. - Т.
81, № 5. - С. 5-15.
3. Богданов
И. М., Проблема оценки эффектов воздействия «малых» доз ионизирующего излучения
/ И. М. Богданов, М. А. Сорокина, А. И. Маслюк // Бюллетень сибирской медицины.
- 2005. - № 2. - С. 145-151.
4. Войціцький
В. М. Структурна організація мембран еритроцитів за дії іонізуючої радіації в
надмалих дозах / В. М. Войціцький, С. В. Хижняк, В. В. Жирнов, О. А. Лапоша // Фізика живого.
- 2008. - Т. 16, № 2. - С. 58-64.
5. Герасимов
М. А. Технология вина / М. А. Герасимов. - М.: Типография Московской картонажной ф-ки, 1959. - 637 с.
6. Дацюк
Л. Активність NO-синтази та вміст стабільних
метаболітів оксиду азоту у лейкоцитах периферичної крові щурів при введення L-аргініну за умов хронічного
рентгенівського опромінення / Л. Дацюк, Ю. Перетятко, У. Старанко, Н. Сибірна //
Вісник Львів. ун-ту. Серія біологічна. - 2009. - Вип. 51. - С. 37-42.
7. Дубинина
Е. Е. Окислительная модификация белков / Е. Е. Дубинина, И. В. Шугалей // Усп. совр.
биол. - 1993. - Т. 113, вып. 1. - С. 71-81.
8. Єфремова У. П. Роль NO-синтазної системи в організмі людини
при розвитку патологічних процесів / У. П. Єфремова, Н. Е. Личковська, Р. В. Фафула, З. Д. Воробець //
Експериментальна та клінічна фізіологія і біохімія. - 2012. - № 1. - С. 68-73.
9. Ивановский Ю. А. Радиационный
гормезис. Благоприятные ли малые дозы ионизирующей радиации? / Ю.А. Ивановский
// Вестник дальневосточного отделения Российской Академии Наук. - 2006, №6. -
C. 86-91.
10. Королюк
М. А. Метод определения
активности каталазы / М.
А. Королюк, И. Г. Иванова, И. Г. Майорова [и др.] // Лабораторное дело. - 1988. - № 1. - С. 16-18.
11. Кубашко А. В.
Антиоксидантні ензими в механізмах радіоіндукованого окисного стресу (ранній та
віддалений періоди після опромінення) / А. В. Кубашко, Л. М. Овсяннікова, А. А.
Чумак [та ін.] // Лабораторна діагностика. - 2011. - Т. 4, № 58. - С. 64-71.
12. Кудряшов Ю. Б. Радиационная
биофизика (ионизирующие излучения) / Ю. Б. Кудряшов. - М.: Физматлит, 2004. - 448 с.
13. Кудряшов
Ю. Б. Химическая защита
от лучевого поражения / Ю. Б. Кудряшов // Соросовский образовательный журнал. - 2000. - Т.
6, № 6. - С. 21-26.
14. Лановенко І. І. Оксид
азоту - універсальний регулятор клітинних функцій / І. І. Лановенко //
Гематологія і переливання крові. Вип. 34 : Матеріали V з'їзду гематологів та
трансфузіологів України з міжнародною участю "Підсумки та перспективи
розвитку гематології та трансфузіології в Україні", м. Вінниця: [у 2 т.].
- 2008. - Т. 1. - С. 227-234.
15. Лаповець Л. Є. Посібник з лабораторної імунології / Л. Є.
Лаповець, Б. Д. Луцик. - Львів. 2002. - 173 с.
16. Любимова Н. Е. Влияние облучения в малих дозах и возраста на
радиочувствительность лимфоцитов человека in vitro / Н. Е. Любимова, И. Е. Воробцова // Радиационная биология. -
2008. - Т. 48, № 2. - С. 153-159.
17. Моин В.
М. Простой и специфический метод определения активности глутатионпероксидазы в
эритроцитах / В. М. Моин // Лабораторное дело. -
1986. - № 12. - С.
124-126.
. Молекулярная
биология клетки / [Албертс Б., Брей Д., Льюис Дж. и др.]. Пер.с англ. - М.: Мир, 1994. - 521 с.
. Пат.
U201313977, Україна. Спосіб
одержання препарату природного поліфенольного комплексу з виноградного вина /
Сибірна Н. О., Дацюк Л. О., Дацюк У. В.; № 90347 (51) МПК. Опубл. 26.05.2014, Бюл. № 10.
20. Перетятко
Ю. В. Особливості аргіназного та NO-синтазного шляхів метаболізму L-аргініну в лейкоцитах периферичної крові щурів за хронічного
рентгенівського опромінення / Ю. В. Перетятко, Н. О. Сибірна // Укр. біохім.
журн. - 2009. - Т. 81, № 2. - С. 40-48.
21. Прохорова А. О. Вплив
іонізуючої радіації низької потужності поглиненої дози на систему
антиоксидантного захисту в організмі щурів / А. О. Прохорова, Л. І. Степанова, Є. А.
Грогуль [та ін.] // Ядерна фізика та енергетика. - 2011. - Т. 12, № 2. - С.
186-191.
22. Сабадашка М. Якісний
та кількісний склад поліфенолів у концентраті червоного виноградного вина / М.
Сабадашка, А. Гнатуш, Н. Сибірна // Вісник Львівського ун-ту. Серія біологічна.
- 2014. - Вип. 65. - С. 77-85.
. Сагач В. Ф.
Пригнічення оксидативного та нітрозативного стресу як механізм кардіо- і
вазопротекторної дії екдистерону за умов експериментального цукрового діабету I типу / В. Ф. Сагач, Ю. П. Коркач, А. В. Коцюруба, О. Д. Присяжна //
Фізіологічний журнал. - 2008. - Т. 54, № 5. - С. 46-54.
. Саралидзе М. Плаферон ЛБ, как регулятор
оксидативного стресса при радиационном облучении: автореф. дис. на соискание ученой степени канд. медиц. наук: спец. 14.00.36
«Аллергология и иммунология» / Майя Саралидзе - Тбилиси, 2006. - 19 с.
25. Сибірна
Н. О. Методи дослідження системи крові / Н. О. Сибірна, В. А. Бурда, Я. П.
Чайка. - Львів: Видавн. центр Львів. нац. ун-ту, 2006. - 100 с.
26. Сибірна Н. О. Молекулярні
механізми депонування оксиду азоту в еритроцитах / Н. О. Сибірна, М. Я. Люта,
Н. І. Климишин // Біологічні Студії. - 2010. - Т. 4, №1. - С. 143-160.
27. Тимирбулатов
Р. А. Метод повышения интенсивности свободнорадикального окисления
липидсодержащих компонентов крови и его диагностическое значение / Р. А.
Тимирбулатов, Е. И. Селезнев // Лабораторное дело. -
1981. - № 4. -
С. 209-211.
28. Ткаченко
М. М. Вплив малих доз радіації на судинну реактивність та окисний метаболізм
кисню і азоту в серцево-судинній системі / М. М. Ткаченко, В. Ф. Сагач, А. В. Коцюруба
[та ін.] // Журн. АМН України. - 2007. - Т. 13, № 1. - С. 20-32.
29. Флавоноиды:
биохимия, биофизика, медицина / [Тараховский
Ю. С., Ким Ю. А., Абдрасилов Б. С.,
Музафаров Е. Н.]. - Пущино: Sуnchrobook, 2013. - 310 с.
30. Хижняк
С. В. Активність ферментів антиоксидантного захисту за дії іонізуючого
випромінення та фосфоліпідвмісного препарату / Хижняк С. В., Грищенко В. А.,
Степанова Л. І. [та ін.] // Фізика живого. - 2008. - Т.
16, № 2. - С. 65-69.
31. Чевари
С. Определение антиоксидантных параметров крови и их диагностическое значение в
преклонном возрасте / С. Чевари, Т. Д. Андял, Д. Штиренгер // Лабораторное дело. - 1991. - № 10. - С. 9-13.
32. Ярмоленко
С. П. Радиобиология человека и животных / С. П. Ярмоленко
// Учеб. для биол. спец. вузов. 3-е изд., перераб. и доп. - М.: Высш. шк.,
1988. - 424 ст.
33. Afaq F. Polyphenols: Skin Photoprotection and Inhibition of Photocarcinogenesis / F. Afaq, S. K. Katiyar // Mini Rev. Med. Chem. - 2011. - Vol. 11, № 14. P. 1200-1215.
34. Alderton
W.K. Nitric oxide synthases : structure,
function and inhibition / W. K. Alderton, C. E. Cooper, R. G. Knowles // Biochem. J. - 2001. - Vol. 357. - 593-615.
35. Alhosin M. Redox-Sensitive Up-Regulation of eNOS by Purple Grape Juice in Endothelial Cells: Role of PI3-Kinase/Akt, p38 MAPK, JNK, FoxO1 and FoxO3a / M. Alhosin, E. Anselm, S. Rashid [et al.] // PLoS ONE. - 2013. - Vol. 8, № 3. - P. e57883.
36. Andrew P. J. Enzymatic function of nitric oxide synthases / P. J. Andrew, B. Mayer // Cardiovascular Research. - 1999. - Vol. 43. - P. 521-531.
37. Aulak K. S. Dynamics of protein nitration in cells and mitochondria / K. S. Aulak, T. Koeck, J. W. Crabb, D. J. Stuehr // Am. J. Physiol. Heart. Circ. Physiol. - 2004. - Vol. 286. - P. H30-H38.
38. Awad H. M. Peroxidase-catalyzed formation of quercetin quinone methide-glutathione adducts / H. M. Awad, M. G. Boersma, J. Vervoort, I. M. Rietjens // Arch. Biochem. Biophys. - 2000. - Vol. 378. - P. 224-233.
39. Awad
H. M. Quenching of quercetin quinone/quinone methides by different thiolate
scavengers: stability and
reversibility of conjugate formation / H. M. Awad, M. G. Boersma, S. Boeren [et al.] // Chem. Res.
Toxicol. - 2003. - Vol. 16. - P. 822-831.
40. Azzam E. I. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury / E. I. Azzam, J-P.l Jay-Gerin, D. Pain // Cancer Lett. - 2012. - Vol.
327. - P. 48-60.
. Azzam E. I. Oxidative metabolism modulates
signal transduction and
micronucleus formation in bystander cells from alpha-particle-irradiated normal human fibroblast cultures / E. I.
Azzam, S. M. de Toledo, D. R. Spitz, J. B. Little // Cancer Res. - 2002. - Vol.
62, № 19. - P. 5436-5442.
42. Babicova A. Early changes in
L-arginine-nitric oxide metabolic pathways in response to the whole-body gamma
irradiation of rats / A. Babicova, Z. Havlinova, J. Pejchal, A. Tichy, M.
Rezacova, J. Vavrova, J. Chladek // International Journal of Radiation
Biology. - 2011. - Vol. 87, № 10. - 1067-1073.
43. Baker
J. E. 10 Gy Total Body Irradiation Increases Risk of Coronary Sclerosis,
Degeneration of Heart Structure and Function in a Rat Model /J. E. Baker, B. L.
Fish, J. Su [et al.] // Int. J Radiat. Biol. - 2009. - Vol. 85, № 12. - P.
1089-1100.
44. Basli A. Wine Polyphenols: Potential Agents in Neuroprotection / A. Basli, S. Soulet, N. Chaher [et al.] // Oxidative Medicine and Cellular Longevity. - 2012. - Vol. 2012, Article ID 805762. - 14 p.
45. Battistuzzi G. Redox properties of heme peroxidases / G. Battistuzzi, M. Bellei, C. A. Bortolotti, M. Sola // Arch. Biochem. Biophys. - 2010. - Vol. 500, № 1. - P. 21-36.
46. Baud O. Glutathione peroxidase-catalase cooperativity is required for resistance to hydrogen peroxide by mature rat oligodendrocytes / O. Baud, A. E. Green, J. Li [et al.] // Neurosci. - 2004. - Vol. 24, № 7. - P. 1531-1540.
47. Beckman J. S. Apparent hydroxyl radical production
by peroxinitrite: implications for endothelial injury from nitric oxide and
superoxide / J. S. Beckman, J. W. Beckman, J. Chen [et al.] // Proc. Natl. Acad. Sci. USA. - 1990. - Vol. 87, № 7. - P. 1620-1624.
48. Beckman
J. S. Nitric oxide, superoxide, and peroxynitrite: the good, the bad, and ugly
/ J. S. Beckman, W. H. Koppenol // Am. J. Physiol. Cell. Physiol. - 1996. - Vol. 271, № 5, Pt 1. - P. C1424-C1437.
49. Beckman
J. S. -OONO: Rebounding From
Nitric Oxide / J. S.
Beckman // Circ. Res. -
2001. - Vol. 89. - P. 295-297.
50. Beckman J. S. Oxidative damage and tyrosine
nitration from peroxynitrite / J. S. Beckman // Chem. Res. Toxicol. - 1996. - Vol. 9, № 5 - P. 836-844.
51. Beckman
K. D. The free radical theory of aging
matures / K. D. Beckman, B. N. Ames // Physiol. Rev. - 1998. - Vol. 78. - P. 547-581.
52. Berg
R. M. G. Neuro-oxidative-nitrosative stress in sepsis / R. M. G. Berg, K.
Moller, D. M Bailey // Journal of Cerebral Blood Flow & Metabolism. - 2011. - Vol. 31. - P. 1532-1544.
53. Bergonie
J. De quelques resultats de la radiotherapie et essai de fixation d’une
technique rationnelle / J. Bergonie, L. Tribondeau // C. R. Acad. Sci. - 1906.
- Vol. 143. - P. 983-985.
54. Böger R. H. The pharmacodynamics of L-arginine
/ R.H. Böger // J. Nutr. - 2007. - Vol. 137, № 6 Suppl. 2. - P. 1650S-1655S.
55. Boto-Ordonez M. Prediction of the wine polyphenol
metabolic space: An application of the Phenol-Explorer database / M.
Boto-Ordonez, J. A. Rothwell, C. Andres-Lacueva [et al.] // Mol. Nutr. Food Res. - 2014. - Vol. 58. - P. 466-477.
56. Brieger
K. Reactive oxygen species: from health to disease / K. Brieger, S. Schiavone,
F. J. Miller Jr., K.-H. Krause // Swiss. Med. Wkly. - 2012. - Vol. 142. -
w13659.
57. Buonanno M. Long-term consequences of radiation-induced bystander effects depend on radiation quality and dose and correlate with oxidative stress / M. Buonanno, S. M. de Toledo, D. Pain, E. I. Azzam // Radiat. Res. - 2011. - Vol. 175. - P. 405-415.
58. Calabrese E. J. Radiation Hormesis: Origins, History,
Scientific Foundations / E. J. Calabrese, L. A. Baldwin // Hum Exp Toxicol. - 2000. - Vol. 19. - P. 41-75.
. Chang S.-S. Gallic Acid Attenuates Platelet Activation and Platelet-Leukocyte Aggregation: Involving Pathways of Akt and GSK3β / S.-S. Chang, V. S. Y. Lee, Y.-L. Tseng [et al.] // Evidence-Based Complementary and Alternative Medicine. - 2012. - Vol. 2012,
Article ID 683872. - 8 p.
60. Chapple
I. L. C. The role of reactive oxygen and antioxidant species in periodontal tissue destruction / I. L. C. Chapple, J. B.
Matthews // Periodontology 2000. - 2007. - Vol. 43. - P. 160-232.
61. Cimino
S. Polyphenols: Key Issues Involved in Chemoprevention of Prostate Cancer / S.
Cimino, G. Sortino, V. Favilla [et al.] // Oxidative Medicine and Cellular
Longevity. - 2012. - Vol. 2012, Article ID 632959. - 8 p.
62. Cohen S. R. Chronic oxidative stress after
irradiation: an unproven hypothesis / S. R. Cohen, E. P. Cohen // Med.
Hypotheses. - 2013. - Vol. 80, № 2. - P. 172-175.
63. Cook S. L.
Characterization of Tyrosine Nitration and Cysteine Nitrosylation Modifications
by Metastable Atom-Activation Dissociation Mass Spectrometry / S. L. Cook, G.
P. Jackson // J. Am. Soc. Mass Spectrom. - 2011. - Vol. 22. - P. 221-232.
64. Cruthirds
D. L. Mitochondrial targets of oxidative stress during renal
ischemia/reperfusion / D. L. Cruthirds, L. Novak, K. M. Akhi [et al.] // Arch.
Biochem. Biophys.
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Cruthirds%2C+D.+L.%2C+Novak%2C+L.%2C+Akhi%2C+K.+M.%2C+Sanders%2C+P.+W.%2C+Thompson%2C+J.+A.+%26+MacMillan-Crow%2C+L.+A.+%282003%29+Arch.+Biochem.+Biophys.+412%2C+27%E2%80%9333>
- 2003. - Vol. 412, № 1. - P.27-33.
65. Cuttler J. M. Health Effects of Low Level
Radiation: When Will We Acknowledge The Reality? / J. M. Cuttler //
Dose-Response. - 2007. - Vol. 5. - P. 292-298.
66. D’Alessandro T. Polyphenols,
Inflammatory Response, and Cancer Prevention: Chlorination of Isoflavones by
Human Neutrophils / T. Alessandro, J. Prasain, M. R. Benton [et al.] // J Nutr. - 2003. - Vol. 133, № 11, suppl 1. - P. 3773S-3777S.
67. ’DIschia M
<http://www.ncbi.nlm.nih.gov/pubmed?term=d'Ischia%20M%5BAuthor%5D&cauthor=true&cauthor_uid=21923154>.
Secondary targets of nitrite-derived reactive nitrogen species: nitrosation/nitration pathways,
antioxidant defense mechanisms and toxicological implications / M. D’Ischia, A.
Napolitano, P.
<http://www.ncbi.nlm.nih.gov/pubmed?term=Napolitano%20A%5BAuthor%5D&cauthor=true&cauthor_uid=21923154>Manini
<http://www.ncbi.nlm.nih.gov/pubmed?term=Manini%20P%5BAuthor%5D&cauthor=true&cauthor_uid=21923154>,
L. Panzella // <http://www.ncbi.nlm.nih.gov/pubmed?term=Panzella%20L%5BAuthor%5D&cauthor=true&cauthor_uid=21923154>--Chem. Res. Toxicol. 2001. Vol.
<http://www.ncbi.nlm.nih.gov/pubmed/21923154>24, № 12. - P. 2071-2092.
68. Das
S. Experimental evidence for the cardioprotective effects of red wine / S. Das, D. D Santani, N. S Dhalla //
Exp. Clin. Cardiol. - 2007. - Vol. 12, № 1. - P. 5-10.
69. Dawson
J. A Microtiter-Plate Assay of
Human NOS Isoforms / J. Dawson, R. G.
Knowles // Methods in Molecular biology. - 1998. - Vol. 100. - P. 237-242.
70. De Toledo S. M. Adaptive responses to low-dose/low-dose-rate γ rays in normal human
fibroblasts: the role of growth architecture and oxidative metabolism / S. M. de Toledo, N. Asaad, P. Venkatachalam [et al.] // Radiat. Res. - 2006. - Vol. 166, № 6.
- P. 849-857.
71. De Vries J. H. Wine is a poor source of
bioavailable flavonols in man / J. H. De Vries, P. C. Hollman, I. Van Amersfoort [et al.] // Journal of Nutrition. - 2001. - Vol. 131. - P. 745-748.
72. Dede S. Effects of X-Ray Radiation on Oxidation Products of Nitric Oxide in Rabbits Treated with Antioxidant Compounds / S. Dede, Y. Deger, T.
Kahraman, D. Kilicalp // Turk. J. Biochem. - 2009. - Vol. 34, № 1. - P. 15-18.
73. Dejam A. Erythrocytes are the Major
Intravascular Storage Sites of Nitrite in Human Blood / A. Dejam, C. J. Hunter,
M. M. Pelletier [et al.] // Blood. - 2005. - Vol. 106, № 2. - P. 734-739.
74. Devasagayam T. P.
A. Methods for estimating lipid peroxidation: An analysis of merits and
demerits / T. P. A. Devasagayam, K. K. Boloor, T. Ramasarma // Indian Journal
of Biochemistry and Biophysics. - 2003. - Vol. 40. - P. 300-308.
75. Devine
P. J. Roles of
Reactive Oxygen Species and Antioxidants in Ovarian Toxicity / P. J. Devine, S.
D. Perreault, U. Luderer // Biology of Roproduction. - 2012. - Vol. 86, № 2,
part 27. - P. 1-10.
76. Dohadwala
M. M. Grapes
and Cardiovascular Disease / M. M. Dohadwala, J. A. Vita // J. Nutr. - Vol. 2009. - Vol.
139. - P. 1788S-1793S.
77. Drel
V. R. Protective effects of polyphenolics in red wine on diabetes associated
oxidative/nitrative stress in streptozotocin-diabetic rats / V. R. Drel, N.
Sybirna // Cell. Biol. Int. - 2010. -
Vol. 34. - P. 1147-1153.
78. Dudzinski D. M. The regulation and pharmacology of
endothelial nitric oxide synthase / D. M. Dudzinski, J. Igarashi, D. Greif, T.
Michel // Annu. Rev. Pharmacol. Toxicol. - 2006. - Vol. 46. The regulation and
pharmacology of endothelial nitric oxide synthase P. 235-276.
79. Epperly M.
W. Antioxidant-chemoprevention
diet ameliorates late effects
of total-body irradiation and supplements radioprotection
by MnSOD-plasmid liposome administration / M. W. Epperly, H. Wang, J. A. Jones
[et al.] // Radiat. Res. - 2011. - Vol. 175, № 6. - P. 759-765.
80. Esnault
M. A. L. Ionizing radiation: Advances in plant
response / M. A. L. Esnault, C. Chenal // Environ.
Exp. Bot. - 2010. - Vol. 68. - P.
231-237.
81. Feinendegen
L. E. Evidence for Beneficial Low Level Radiation Effects and Radiation
Hormesis / L. E. Feinendegen // Br. J. Radiol. - 2005. - Vol. 78. - P. 3-7.
82. Finkel
T. Signal transduction by reactive oxygen species / T. Finkel // J. Cell. Biol.
-2011. - Vol. 194. - P. 7-55.
83. Focea
R. Low dose X
-ray effects on catalase activity in animal tissue / R. Focea, C. Nadejde, D.
Creanga, T. Luchian // Journal of Physics: Conference Series. - 2012. - Vol. 398 012032. - P. 1-6.
84. Folts
J. D. Potential health benefits
from the flavonoids in grape products on vascular disease // Adv. Exp. Med.
Biol. - 2002. - Vol. 505. - P. 95-111.
85. Förstermann U.
Nitric
oxide and oxidative stress in vascular disease / U. Förstermann // Pflugers Arch. - 2010. - Vol. 459, № 6. - P. 923-939.
86. Förstermann U. Therapeutic effect of
enhancing endothelial nitric oxide synthase (eNOS) expression and preventing
eNOS uncoupling / U. Forstermann, H. Li // British J. of Pharmacology. - 2011. - Vol. 164. - P. 213-223.
87. Fridovich I. The biology of oxygen radicals / I. Fridovich // Science. - 1978. -Vol. 201. - P. 875-880.
88. Galvano
F. Bioavailability,
antioxidant and biological properties of the natural free-radical scavengers
cyanidin and related glycosides / F. Galvano, L. La Fauci, P. Vitaglione [et
al.] // Ann. Ist. Super. Sanita. - 2007. -Vol. 43, № 4. - P. 382-393.
89. Geoffrey
L. Radiation: Doses, Effects, Risks / L. Geoffrey - Ed. United Nations Environment Programme, 1985 - 68 p.
90. Giardi M. T. Preventive or Potential
Therapeutic Value of Nutraceuticals against Ionizing Radiation-Induced
Oxidative Stress in Exposed Subjects and Frequent Fliers / M. T. Giardi, E. Touloupakis, D.
Bertolotto, G. Mascetti // Int. J. Mol. Sci. - 2013. - Vol. 14. - P. 17168-17192.
91. Gilchrist
M. Inorganic nitrate and nitrite and control of blood pressure / M. Gilchrist, A. C. Shore,
N. Benjamin // Cardiovascular Research. - 2011. - Vol. 89. - P. 492-498.
92. Gisone
P. Early neuroprotective effect of nitric oxide in developing rat brain
irradiated in utero / P. Gisone, A. D. Boveris, D. Dubner [et al.] //
Neurotoxicology. - 2003. - Vol. 24, № 2. - P. 245-253.
93. Gisone
P. The Role of Nitric Oxide in the Radiation-induced Effects in the Developing
Brain / P. Gisone, D. Dubner, D. L. Rosario
[et al.] // In vivo. - 2004.
- Vol. 18, № 3. - P. 281-292.
94. Goldberg D. M. Glutathione reductase / D. M. Goldberg, R. J. Spooner, H. U. Bergmeyer // Methods of Enzymatic Analysis, 3rd еd. - Weinheim: Verlag Chemie. - 1983. - Vol. III. - P. 258-265.
95. Goldman
M. Ionizing Radiation and Its Risks / M. Goldman // West J. Med. - 1982. - Vol. 137. - P. 540-547.
96. Gorbunov N. Activation of the nitric oxide synthase 2 pathway in the response of bone marrow stromal cells to high doses of ionizing radiation / N. Gorbunov, L. Pogue-Geile, M. W. Epperly [et al.] // Radiat. Res. - 2000. - Vol. 154, № 1. - P. 73-86.
97. Groves
J. T. Nitric oxide synthase:
models and mechanisms / J. T. Groves, C. C-Y.
Wang // Curr. Opin. Chem. Biol. - 2000. - Vol. 4. - P. 687-695.
98. Grune
T. Oxidative Stress and Protein Oxidation / T. Grune, B. Catalgol, T. Jung // Protein Oxidation
and Aging, First Ed. - John Wiley & Sons, Inc., 2013. - 214 p.
99. Guilford
J.M. Wine and Health: A Review / J. M. Guilford, J. M. Pezzuto // Am. J. Enol. Vitic. - 2011. - Vol.
62, № 4. - P. 471-486.
100. Habauzit V. Evidence for a protective effect of polyphenols-containing foods on cardiovascular health: an update for clinicians / V. Habauzit, C. Morand // Ther. Adv. Chronic Dis. - 2012. - Vol. 3, № 2. - P. 87-106.
101. Hall
E. J. Radiobiology for the Radiologist / E. J. Hall, A. J. Giaccia // 6th edn. - Philadelphia, Baltimore, New York: Lippincott Williams & Wilkins, 2006. - 546 p.
102. Hei T. K. Radiation Induced Non-targeted Response: Mechanism and Potential Clinical Implications / T. K. Hei, H. Zhou, Y. Chai [et al.] // Curr. Mol. Pharmacol. - 2011. - Vol. 4, № 2. - P. 96-105.
103. Heller A. Cells Respond Uniquely to Low-Dose
Ionizing Radiation / A. Heller // S&TR. -2003. - P. 13-19.
104. Hernansanz-Agustin P. Nitrosothiols in the Immune System: Signaling and Protection / P. Hernansanz-Agustin, A. Izquierdo-Alvarez, A. Garcia-Ortiz [et al.] // Antioxidants & Redox Signaling. - 2013. - Vol. 18, № 3. - P. 288-308.
105. Herrero P. Feasibility and Dosimetry Studies for 18F-NOS as a Potential PET Radiopharmaceutical for Inducible Nitric Oxide Synthase in Humans / P. Herrero, R. Laforest, K. Shoghi [et al.] // The Journal of Nuclear Medicine - 2012. - Vol. 53, № 6. - P. 994-1001.
106. Hertog
M. G. L. Content of potentially anticarcinogenic flavonoids of 28 vegetables
and 9 fruits commonly consumed in the Netherlands / M. G. L. Hertog, P. C. H.
Hollman, M. B. Katan // J. Agric. Food Chem. - 1992. - Vol. 40. - P. 2370-2383.
107. Huang
T.-T. Oxidative stress and adult neurogenesis - effects of radiation and
superoxide dismutase deficiency / T.-T.
Huang, Y. Zou, R. Corniola // Semin. Cell. Dev. Biol. - 2012. - Vol. 23, № 7. - P. 738-744.
108. Hybertson B. M. Oxidative stress in health and disease: the therapeutic
potential of Nrf2 activation / B. M. Hybertson, B. Gao, S. K. Bose, J. M. McCord // Molecular Aspects of Medicine. - 2011. - Vol. 32, № 4-6. - P. 234-246.
109. Irie Y. Histone H1.2. is a substrate for denitrase, an activity that reduces nitrotyrosine immunoreactivity in proteins / Y. Irie, M. Saeki, Y. Kamisaki [et al.] // Proc Natl Acad Sci USA. - 2003. - Vol. 100, № 10. - P. 5634-5639.
110. Ischiropoulos H. Biological selectivity and functional aspects of protein tyrosine nitration / H. Ischiropoulos // Biochem. Biophys. Res. Commun. - 2003. - Vol. 305, № 3. - P. 776-783.
. Jansson
E. A. A
mammalian functional nitrate reductase that regulates nitrite and nitric oxide
homeostasis / E. A Jansson, L. Huang, R. Malkey [et al.] // Nature Chemical
Biology. - 2008. - Vol. 4, № 7. - P. 411-417.
. Jelkmann
W. Regulation of erythropoietin
production /
W. Jelkmann // J. Physiol. - 2011. - Vol. 589. - P. 1251-1258.
113. Kagota S. Chronic Production of Peroxynitrite
in the Vascular Wall Impairs Vasorelaxation Function in SHR/NDmcr-cp Rats, an Animal Model of Metabolic
Syndrome / S. Kagota, Y. Tada, N. Nejime N. [et al.] // J. Pharmacol. Sci. - 2009. - Vol. 109, № 4. - P. 556-564.
. Kamisaki Y. An activity in rat tissues that modifies nitrotyrosine-containing proteins / Y. Kamisaki, K. Wada, K. Bian [et al.] // Proc. Natl. Acad. Sci. USA. - 1998. - Vol. 95, № 20. - P 11584-11589.
115. Kataoka
T. Study of
antioxidative effects and anti-inflammatory effects in mice due to low-dose
X-irradiation or radon inhalation / T. Kataoka // Journal of Radiation Research. - 2013. - Vol. 54. - P. 587-596.
116. Kelly
G. S. Quercetin / G. S. Kelly // Alternative Medicine Review. - 2011. - Vol. 16, № 2. - P. 172-194.
117. Kensuke O. Activation of antioxidative enzymes induced by low dose- rate whole body г irradiation: adaptive response in terms of initial DNA damage / O. Kensuke, K. Takao, T. Hiroshi // Radit. Res. - 2006. - Vol. 166, № 3. - P. 477-478.
118. Kerr S. Superoxide anion production is increased in a model of genetic hypertension: role of the endothelium / S. Kerr, M. J. Brosman, McIntyre M [et al.] //
Hypertension. - 1999. - Vol. 33. - P. 1353-1358.
119. Kim H. Nitric oxide modulated the c-Jun N-terminal kinase/stress activated protein kinase activity through activating c-Jun terminal kinase kinase / H. Kim, J. Shim, P. L. Han, E. J. Choi // J. Biochem. - 1997. - Vol. 36, № 44. - P. 13677-13681.
120. Knowles
R. G. Nitric
oxide synthases in mammals / R. G. Knowles, S. Moncada // Biochem. J. - 1994. - Vol. 298. - P. 249-258.
121. Koc M. Melatonin protects rat liver against irradiation-induces oxidative injury / M. Koc, S. Taysi, M. E. Buyukokuroglu, N. Bakan // J. Radiat. Res. - 2003. - Vol. 44, № 3. - P. 211-215.
122. Koeck T. Rapid and Selective Oxygen-regulated Protein Tyrosine Denitration and Nitration in Mitochondria / T. Koeck, X. Fu, S. L. Hazen [et al.] // The Journal of Biological Chemistry. - 2004. - Vol. 279, № 26. - P.
27257-27262.
. Kojima
S. Elevation of glutathione induced by low-dose gamma rays and its involvement in
increased natural killer activity / S. Kojima, H. Ishida, M. Takahashi, K.
Yamaoka // Radiat. Res. - 2002. - Vol. 157, № 3. - P. 275-280.
124. Kondrashov A. The Effects of New Alibernet Red Wine Extract on Nitric
Oxide and Reactive Oxygen Species Production in Spontaneously Hypertensive Rats
/ A.
Kondrashov, S. Vrankova, I. Dovinova [et al.] // Oxidative Medicine and Cellular
Longevity. - 2012. - Vol. 2012, Article ID 806285. - 8 p.
125. Kotsonis
P. Autoinhibition
of neuronal nitric oxide synthase : distinct effects of reactive nitrogen and
oxygen species on enzyme activity / P. Kotsonis, A. Frey, L. G. Frohlich [et
al.] // Biochem. J. - 1999. - Vol. 340. - P. 745-752.
126. Kulcitki V. Investigation of Grape Seed
Proanthocyanidins. Achievements and Perspectives / V. Kulcitki, P. F. Vlad, Gh. Duca [et al.] // Chem. J. of Moldova. General, Industrial and
Ecological Chem. - 2007. - Vol. 2, № 1. - P. 36-50.
127. Laemmli U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 / U. K. Laemmli // Nature. - 1970. - Vol. 227, № 5259. - P. 680-684.
128. Lakshmi S. V. Oxidative stress in cardiovascular disease / S. V. Lakshmi, G. Padmaja, P. Kuppusamy, V. K. Kutala // Ind. J. Biochem. Biophys. - 2009. - Vol. 46, № 6. - P. 421-440.
129. Leach J. K. Ionizing Radiation-induced, Mitochondria-dependent Generation of Reactive Oxygen/Nitrogen / J. K. Leach, G. Van Tuyle, P.-S. Lin [et al.] // Cancer. Res. - 2001. - Vol. 61, № 10. - P. 3894-3901.
130. Lee
C. I. Regulation of xanthine oxidase by nitric oxide and peroxynitrite / C. I. Lee, X. Lin, J. L. Zweier // J. Biol. Chem. - 2000. - Vol. 275, № 3. - P. 9369-9376.
131. Lee J. Autophagy, mitochondria
and oxidative stress: cross-talk and redox signalling / J. Lee, S. Giordano, J.
Zhang // Biochem. J. - 2012. - Vol. 441. - P. 523-540.
132. Leopoldini
M. The molecular basis of working mechanism of natural polyphenolic
antioxidants / M. Leopoldini, N. Russo, M. Toscano // Food Chemistry - 2011. -
Vol. 125. - P. 288-306.
133. Lessio
C. Cyclosporine A and NAC on the inducible nitric oxide synthase expression and
nitric oxide synthesis in rat renal artery cultured cells / C. Lessio, F. De
Assuncao Silva, M. A. Gloria [et al.] // Kidney International. - 2005. - Vol. 68. - P. 2508-2516.
134. Li H. Nitric Oxide
Production from Nitrite Occurs Primarily in Tissues Not in the Blood. Critical Role of Xanthine Oxidase and
Aldehyde Oxidase // H. Li, H. Cui, T. K. Kundu [et al.] // The Journal of
Biological Chemistry. - 2008. - Vol. 283, № 26. - P. 17855-17863.
135. Limon-Pacheco
J. The role of antioxidants and antioxidant-related enzymes in protective
responses to environmentally induced oxidative stress / J.
Limon-Pacheco,
M. E. Gonsebatt // Mutation Research. - 2009. - Vol. 674. - P. 137-147.
136. Liu
S-Z. Nonlinear Dose-Response Relationship in the Immune System
Following Exposure to Ionizing Radiation: Mechanisms and Implications / S-Z. Liu // Nonlinearity
in Biology, Toxicology and Medicine. - 2003. - Vol. 1. - P. 71-92.
. Lowri
O. H. Protein measurement with the Folin phenol reagent / O. H. Lowri, M. J. Rosenbraugh, A. L. Pori // Biol. Chem. - 1951. - Vol. 193, № 1. - P. 265-275.
138. Wu C. Thioredoxin 1-Mediated Post-Translational Modifications: Reduction, Transnitrosylation, Denitrosylation, and Related Proteomics Methodologies / C. Wu, A. M. Parrott, C. Fu // Antioxidants & Redox Signaling. - 2011. - Vol. 15, № 9. - P. 2565-2604.
139. Yeo W.-S. Nitrosative protein tyrosine modifications: biochemistry and functional significance / W.-S. Yeo, S. J. Lee, J. R. Lee, K. P. Kim / BMB rep. - 2008. - Vol. 41, № 3. - P. 194-203.
140. Zabbarova I. Targeted Delivery of Radioprotective Agents to Mitochondria / I. Zabbarova, A. Kanai // Mol. Interv. - 2008. - Vol. 8, № 6. - P. 294-302.
141. Zaka
R. Effects of low chronic doses of ionizing radiation on antioxidant enzymes and G6PDH
activities in Stipa capillata (Poaceae) / R. Zaka, C. M. Vandecasteele, M. T.
Misset // J. Exp. Bot. - 2002. - Vol. 53. P. 1979-1987.
142. Zang
L.-Y. Effect of antioxidant protection by p-coumaric acid on low-density lipoprotein cholesterol oxidation / L.-Y. Zang, G. Cosma, H.
Gardner [et al.] // Am. J. Physiol. Cell. Physiol. - 2000. - Vol. 279. - P. C954-C960.
143. Zavillova
I. Wine polyphenols increase NO synthase activity in both normotensive and hypertensive
rats / I. Zavillova, D. Capokova, O. Pechanova, I. Bernatova // Physiol. Res. - 2001. - Vol. 50. - 41 p.
144. Zenebe W. Red Wine Polyphenols Induce Vasorelaxation by Increased Nitric Oxide Bioactivity / W. Zenebe, O. Pechanova, R. Andriantsitohaina // Physiol. Res. - 2003. - Vol. 52. -
P. 425-432.
145. Zhang X. Intranuclear localization of
apoptosisinducing factor (AIF) and large scale DNA fragmentation after traumatic brain injury in rats and in neuronal cultures exposed to peroxynitrite / X. Zhang, J. Chen, S. H. Graham
[et al.] // J. Neurochem. -
2002. - Vol. 82, № 1. - P. 181-191.