Хроматин и его специфическая регуляция экспрессии генов
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО
ОБРАЗОВАНИЯ
«ВЯТСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Биологический
факультет
Кафедра
биотехнологии
Реферат
по дисциплине
«Основы
генетической инженерии»
Тема
реферата: «Хроматин и его специфическая регуляция экспрессии генов»
Разработал студент гр. БП-31
Горев А.Н.
Руководитель: Герасимов А.С.
Киров - 2014
Аннотация
Реферат на тему «Хроматин и его специфическая
регуляция экспрессии генов» посвящен молекулярной биологии. Основным источником
данного реферата послужила книга Разина Сергея Владимировича и Быстрицкого
Андрея Александровича «Хроматин: упакованный геном».
Основные термины и понятия: хроматин, гистон,
нуклеосомы, АТФ-зависимое ремоделирование хроматина, регуляция экспрессии,
активный и неактивный хроматин, ацетилирование гистонов, характер метилирования
ДНК, энхансеры.
Содержание
Введение
. Структура хроматина
.1 Гистоны и другие белки
.2 Уровни упаковки ДНК
.3 Комплексы ремоделирования
хроматина
. Хроматин и регуляция транскрипции
.1Активный и неактивный хроматин
.2 Транскрипция ДНК, организованной
в нуклеосомы
.3Доменная организация
.4 Регуляция транскрипции
Заключение
Список литературы
Приложение
Введение
В отличие от прокариот основная часть генома
эукариот находится в специальном клеточном компартменте (органелле), получившем
название ядра, а значительно меньшая часть - в митохондриях, хлоропластах и
других пластидах. Так же, как и у прокариот, информационной макромолекулой
генома эукариот является ДНК, которая неравномерно распределена по нескольким
хромосомам в виде комплексов с многочисленными белками. Эти ДНК-белковые
комплексы эукариот получили название хроматина.
Упаковка в хроматин обеспечивает многократное
сокращение линейных размеров ДНК, необходимое для размещения ее в ядре.
Упаковка происходит в несколько этапов; наиболее изученными являются
накручивание ДНК на нуклеосомы, компактизация нуклеосомной нити с образованием
так называемой 30-нм фибриллы и сворачивание последней в гигантские (50-200 т.
п. н.) петли, закрепленные на белковой скелетной структуре ядра - ядерном
матриксе (рис. 1).
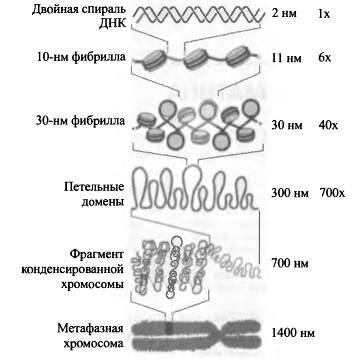
Рис.1 Уровни компактизации генома
Становится очевидным, что хроматин выполняет
множество различных функций, в том числе и регуляцию экспрессии генов.
Существуют различные механизмы регуляции
экспессии генов, на различных уровнях. Один из них - транскрипционный. В данной
работе будет рассмотрена структура хроматина как специфического регулятора
экспрессии генов на уровне транскрипции.
1. Организация хроматина
Основными компонентами хроматина являются ДНК,
гистоны и негистоновые белки, образующие высокоупорядоченные в пространстве
структуры. Соотношение ДНК и белка в хроматине составляет ~1:1. Рзличают три
уровня структурной организации хроматина у эукариот: 1) нуклеосомная фибрилла;
2) соленоид, или нуклеомер; 3) петельно-доменная структура, включающая
хромомеры.
.1 Гистоны и другие белки
Наибольшую часть ядерных белков составляют
гистоны. Выделяют пять основных типов гистонов: HI,
Н2А, Н2В, НЗ и H4. Гистоны
Н2А, Н2В, НЗ и Н4 входят в состав белковой глобулы минимальной нуклеосомы. Это
небольшие белки с молекулярными массами 10-15 кДа. Они чрезвычайно богаты
положительно заряженными аминокислотами (лизином и аргинином). Положительно
заряженные аминокислоты сосредоточены преимущественно в С-концевых и N-концевых
частях молекул нуклеосомных гистонов, тогда как центральный домен относительно
богат гидрофобными остатками. В денатурированном виде гистоны образуют самые
различные агрегаты. Нативные молекулы нуклеосомных гистонов образуют в растворе
два типа комплексов: тетрамер (Н3-Н4)2 и димер Н2А-Н2В.
Нуклеосомные гистоны относятся к числу наиболее
консервативных белков. Их аминокислотные последовательности имеют почти 100%-ю
гомологию у всех эукариот. В геноме позвоночных животных гены, кодирующие
каждый из нуклеосомных гистонов, представлены несколькими копиями. Так, в
геноме человека присутствует 15 генов, кодирующих Н2А, 17 генов, кодирующих
Н2В.
Наряду с каноническими гистонами существует
широкий спектр вариантных форм гистонов, которые кодируются отдельными генами и
выполняют специальные функции. Гистоны часто подвергаются различным
посттрансляционным модификациям. Основные мишени для модификаций сосредоточены
в N-концевых доменах
гистонов. Модификации нуклеосомных гистонов играют важную роль в установлении и
поддержании различных хроматиновых структур, в том числе активного и
неактивного хроматина.
Термин «негистоновые белки», вообще говоря,
следует признать устаревшим. Если понимать его в широком смысле, то наряду с
негистоновыми белками собственно хроматина в эту группу следует включить все
белки ядра, кроме гистонов. В узком смысле можно говорить о негистоновых
белках, непосредственно участвующих в формировании хроматиновых фибрилл. В этом
случае в данную группу попадут HMG-белки
и белки, участвующие в формировании компактных (неактивных) хроматиновых
структур, которые в последнее время часто называют архитектурными белками
хроматина. К числу архитектурных белков хроматина обычно относят НР1 (heterochromatin
protein 1), белки группы Polycomb,
белок MENT,
присутствующий в терминально дифференцированных клетках (эритроциты птиц,
лейкоциты млекопитающих), МеСР2 позвоночных животных и Sir-белки
дрожжей.
.2 Уровни упаковки ДНК
Открытие нуклеосом заложило основу современных
представлений о хроматине. Хроматин перестал быть аморфной массой и предстал
перед глазами исследователей в виде достаточно упорядоченной структуры,
построенной по иерархическому принципу.
Нуклеосома является базовой структурной единицей
первого уровня упаковки ДНК в хроматине. Она представляет собой белковую
глобулу или, точнее говоря, некое подобие диска, на который намотан фрагмент
ДНК протяженностью 146 п. н. Намотанная на нуклеосомную глобулу ДНК образует
1,65 супервитка. Глобула состоит из восьми молекул гистонов: тетрамера
(Н3-Н4)2и двух димеров Н2А-Н2В.
Нуклеосомы были обнаружены при электронной
микроскопии развернутых хроматиновых фибрилл (хроматина, полученного после
мягкой обработки ядер стафилококковой нуклеазой и экстракции 0,2 мМ ЭДТА). На
электронно-микроскопических снимках были выявлены единообразные глобулы,
регулярно расположенные на молекуле ДНК. Эти структуры (рис. 2) получили называние
«бусины на нити».
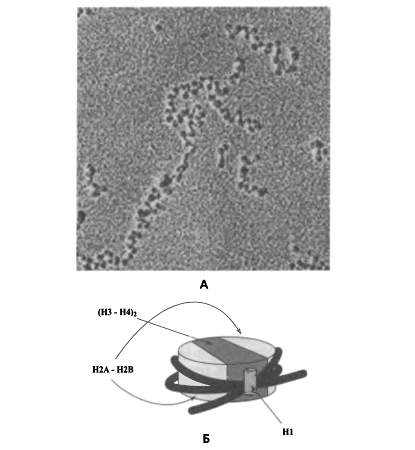
Рис.2 Устройство 10-нм фибриллы («бусины на
нити»).А - электронная микрофотография нескольких нуклеосом, Б - схема
пространственной организации хромотосомы-коровой нуклеосомы с молекулой гистона
Н1.
Упорядоченная организация нуклеосомных частиц
дала возможность их кристаллизации и последующего рентгеноструктурного анализа.
В настоящее время структура нуклео- сомной частицы разрешена с точностью до 1,9
А. Примерно с такой же точностью разрешена структура октамера гистонов без ДНК
(рис.3;приложение 1).Гистоны октамера уложены в левозакрученную суперспираль,
стерически соответствующую суперспирали фрагмента ДНК в составе минимальной
нуклеосомы.
При участии гистона Н1 организованная в
нуклеосомы ДНК образует фибриллу диаметром 30-нм. Такие фибриллы образуются
спонтанно из структур типа «бусинок на нити» при повышении ионной силы (до 60
мМ) либо при добавлении ионов Mg2+
до 0,3 мМ. Существуют две принципиально различающиеся модели 30-нм фибриллы (рис.
4).
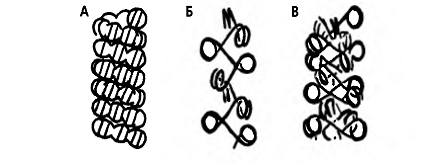
Рис.4. Схемы моделей 30-нм фибриллы
Показаны наиболее распространенные модели -
соленоида (А) и «зиг-зага» (Б и В). Видно, что в модели зиг-зага линкерная ДНК
пересекает центральную часть фибриллы, тогда как в соленоиде и нуклеосомы, и
линкерная ДНК продолжают спираль соленоида. Модель «зиг-заг» допускает
локальные изменения уровня компактизации при сохранении толщины фибриллы.
Согласно одной из этих моделей, нуклеосомная
нить, содержащая гистон Н1, сворачивается в соленоид диаметром 30-нм, в одном
витке которого (с шагом в 11 нм) содержится 6 нуклеосом. Данная модель,
предложенная Финчем и Клюгом, базируется на результатах электронной микроскопии
и анализа дифракции рентгеновских лучей при изучении частично ориентированных
хроматиновых фибрилл. Согласно данной модели, спейсерная ДНК продолжает
суперспираль, возникающую при закручивании ДНК на нуклеосомной глобуле. Другая
модель предполагает, что в составе 30-нм фибриллы нуклеосомы организованы в
зигзагообразную структуру, параметры которой могут варьировать в известных
пределах. Зигзагообразная модель предполагает, что спейсерная ДНК пересекает
ось фибриллы. Результаты последних исследований, в том числе электронная
микроскопия быстро замороженных образцов хроматина и анализ продуктов
расщепления ядерной ДНК в живых клетках, подвергнутых мягкой обработке
ионизирующим излучением, подтверждают зигзагообразную модель организации 30-нм
фибриллы. Зигзагообразная фибрилла является существенно более динамичной, чем
соленоид. Толщина этой фибриллы, отражающая плотность упаковки нуклеосом, может
варьировать при сохранении основного принципа зигзагообразной организации.
Динамичность 30-нм фибриллы хорошо укладывается
в современные представления об активной роли хроматина в регуляции работы
генома.
Расположение нуклеосом на молекуле ДНК.
Регулярное расположение нуклеосом, как правило, возникает в результате наличия
в определенном районе генома того или иного барьера для распространения
нуклеосом либо последовательности ДНК, на которой нуклеосома располагается с
гораздо большим предпочтением, чем на окружающих последовательностях.
Предпочтительными для расположения нуклеосом являются перманентно изогнутые
последовательности ДНК, накручивание которых на нуклеосомы является более выгодным
с энергетической точки зрения. С использованием метода селекции in
vitro было подобрано
несколько последовательностей ДНК, которые являются существенно более
предпочтительными местами посадки нуклеосом, чем любая из последовательностей
ДНК, присутствующих в геноме мыши. Это означает, что наиболее сильные сайты
посадки нуклеосом препятствуют нормальному фукционированию генома и удаляются в
процессе эволюции.
В геномной ДНК существуют участки, свободные от
нуклеосом. В подавляющем большинстве случаев это участки связывания одного или
нескольких регуляторных белков, узнающих определенные последовательности ДНК.
Свободные от нуклеосом участки предпочтительно атакуются ДНКазой I и некоторыми
другими нуклеазами при обработке ими пермеабилизированных клеток или
изолированных ядер. В связи с этим они получили название участков
гиперчувствительности к ДНКазе I или гиперчувствительных сайтов . Вероятность
расщепления в этих сайтах организованной в хроматин ДНК может превосходить
среднестатистическую в сотни и даже тысячи раз.
Вопрос о высших уровнях упаковки ДНК в ядре
остается дискуссионным. Некоторые авторы считают, что 30-нм фибрилла образует
малоупорядоченные конгломераты в результате латерального взаимодействия
отдельных фибрилл. При этом могут формироватся структуры типа жгута из многих
нитей. Другой точкой зрения является представление об иерархической спирали,
согласно которому 30-нм фибрилла - соленоид, и каждый последующий уровень
представлен соленоидной укладкой фибриллы предыдущего уровня. Наиболее обоснованной
является, однако, радиально-петлевая модель организации хромосомы в интерфазе и
метафазе. Согласно этой модели, 30-нм фибрилла образует гигантские петли,
закрепленные на белковом каркасе хромосомы. Последний называют хромосомным
остовом. В интерфазном ядре хромосомный остов составляет часть ядерного
матрикса. Ядерным матриксом называют скелетную структуру клеточного ядра,
которая сохраняет форму и некоторые особенности морфологии ядра после удаления
из него хроматина.
1.3 Комплексы ремоделирования хроматина
Статичная организация геномной ДНК в нуклеосомы
и далее в 30-нм фибриллу накладывает существенные ограничения на доступность
участков узнавания различных регуляторных белков. Кроме того, в результате
наматывания ДНК на нуклеосому сайты связывания ряда белков могут оказаться
ориентированными таким образом, что узнающие их белки не смогут
взаимодействовать друг с другом. Наконец, достаточно стабильные нуклеосомные
частицы должны a
priori существенно
затруднять осуществление репликации и транскрипции ДНК.
Проблемы, которые нуклеосомная организация
создает для осуществления различных функциональных процессов, преодолеваются с
привлечением ферментов (ферментных комплексов) ремоделирования хроматина.
Комплексы ремоделирования хроматина используют для своей работы энергию АТФ.
Различные комплексы ремоделирования хроматина могут выполнять следующие задачи:
(1) перемещение нуклеосом вдоль молекулы ДНК и размещение нуклеосомных глобул
на равных расстояниях друг от друга; (2) частичная декомпактизация нуклеосом,
сопряженная с изменением спектра контактов ДНК и гистонов; (3) перемещение
нуклеосомных глобул с одной молекулы ДНК на другую; (4) замена канонических
гистонов на вариантные формы.
Перемещение нуклеосом факторами ремоделирования
хроматина имеет ступенчатый характер. Большинство известных комплексов
ремоделирования хроматина затрачивает одну молекулу АТФ для перемещения
нуклеосомной глобулы на 10 п. н.(Рис.5)
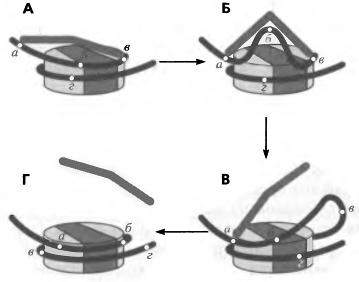
Рис. 5. Ремоделирование хроматина
На рисунке схематически изображен процесс
ремоделирования. Сначала комплекс ремоделирования связывается с участками ДНК а
и в (А); изменение конформации комплекса приводит к изгибанию ДНК, отрыву
участка б и связыванию участка а (Б), после чего комплекс ремоделирования отсоединяется
от участка в и возвращается в исходную конформацию, а волна деформации ДНК
продвигается по октамеру гистонов (В). В итоге нуклеосома оказывается смещена
на ДНК на расстояние а-б, при этом участок г переместился из нуклеосомной ДНК в
линкерную, а участок а, напротив, связался октамером (Г).
2. Хроматин и регуляция транскрипции
.1 Активный и неактивный хроматин
Ученые давно обратили внимание на то, что ДНК в
ядре упакована неоднородно. При окраске ядер красителями, специфически
связывающимися с ДНК, можно видеть области, где ДНК упакована более компактно
(иногда их еще называют хроматиновыми глыбками), и области, где локальная
концентрация ДНК существенно ниже. Эти области получили названия
гетерохроматина и эухроматина соответственно. Было весьма заманчивым связать
различия в степени компактизации ДНК с ее транскрипционным статусом. Из общих
соображений представлялось очевидным, что транскрипционно-активная ДНК должна
быть упакована менее компактно. Первые экспериментальные подтверждения этой
точки зрения были получены в опытах по обработке ядерной ДНК ДНКазой I.
Оказалось, что активные гены расщепляются ДНКазой быстрее, чем неактивные. В
дифференцированных клетках значительная часть генов не работает. Эти гены
оказались относительно устойчивыми к ДНКазе I. При сравнении клеток,
дифференцированных по разным путям, можно было видеть, что один и тот же ген
предпочтительно расщепляется ДНКазой I в тех клетках, где он активен, и относительно
устойчив к этому ферменту в клетках, где этот ген не транскрибируется. Феномен
предпочтительной чувствительности к ДНКазе I активных генов принято называть
общей ДНКазной чувствительностью. Его следует отличать от гиперчувствительности
к ДНКазе I, о которой говорилось выше.
Обнаружение предпочтительной чувствительности
транскрибирующейся фракции генома к ДНКазе I открыло принципиальную возможность
выделения и характеристики коротких фрагментов транскрипционно-активного
хроматина. Было продемонстрировано, что транскрипционно-активный хроматин
характеризуется повышенным уровнем ацетилирования гистонов нуклеосомной
частицы. Примерно в это же время в лаборатории Олфри был разработан метод
выделения фрагментов транскрипционно-активного хроматина посредством афинной
хроматографии на колонках с иммобилизованной ртутью. И в этом случае было
показано, что транскрипционно-активный хроматин характеризуется повышенным
уровнем ацетилирования гистонов. Другими отличительными признаками активного
хроматина явились обедненность гистоном Н1 и некоторое обогащение различными
типами HMG-белков. Еще
одной характерной чертой нуклеосом активного хроматина является частое
отсутствие одного из димеров Н2А-Н2В. Характерной особенностью
транскрипционно-активной фракции хроматина, является высокий уровень
ацетилирования гистонов. В экспериментах по сборке хроматина in
vitro
продемонстрировано, что хроматин, собранный с использованием
гиперацетилированных гистонов, обладает основными свойствами активного
хроматина, в частности повышенной чувствительностью к нуклеазам.
.2 Транскрипция ДНК, организованной в нуклеосомы
Нуклеосомные частицы должны являться серьезным
препятствием на пути транскрипции. Тем не менее четко продемонстрировано, что
все РНК-полимеразы, в том числе и прокариотические, способны транскрибировать
ДНК, организованную в нуклеосомы. Механизм транскрипции ДНК, организованной в
нуклеосомы, остается предметом научных дискуссий. Существует две основные
модели, объясняющие возможность транскрипции нуклеосомной нити. Одна из них
предполагает, что нуклеосомная глобула, находящаяся на пути транскрипционного
комплекса, временно удаляется, оставаясь при этом связанной с самим
транскрипционным комплексом, и далее вновь связывается с ДНК за
транскрипционным комплексом. Эта модель получила прямые подтверждения в
модельных экспериментах по транскрипции бактериальными РНК-полимеразами
организованного в нуклеосому фрагмента ДНК. Результаты этих экспериментов не
удалось, однако, воспроизвести при использовании эукариотической РНК-полимеразы
II. Другая модель транскрипции нуклеосомной нити предполагает, что
дестабилизированные нуклеосомы активной фракции хроматина частично
разворачиваются непосредственно в момент прохождения транскрипционного
комплекса, в результате чего РНК-полимера за может считывать ДНК, не удаляя
гистонов. Надо сказать, что в местах входа и выхода ДНК из нуклеосомы
ДНК-белковые контакты относительно малочисленны, что допускает возможность
постепенного разворачивания накрученной на нуклеосому петли ДНК. Работающий транскрипционный
комплекс разворачивает двойную спираль ДНК, что компенсируется возникновением
домена положительной суперспирализации перед транскрипционным комплексом. Витки
ДНК на нуклеосоме представляют собой негативную суперспираль, стабилизированную
взаимодействием с нуклеосомными гистонами. Понятно, что позитивная
суперспирализация будет способствовать разворачиванию накрученных на нуклеосому
петель ДНК.
В обеспечении возможности транскрипции
организованной в нуклеосомы ДНК важную роль играют факторы ремоделирования
хроматина.
Сравнительно недавно продемонстрировано, что
важную роль в транскрипции организованной в нуклеосомы ДНК играет белковый
комплекс, получивший название FACT
(facilitator
of chromatin
transcription). Этот белковый
комплекс способствует временному удалению из нуклеосомы одного или обоих
димеров Н2А-Н2В, облегчая разворачивание петель нуклеосомной ДНК в местах входа
и выхода ДНК из нуклеосомной частицы. Для осуществления своей функции FACT
должен быть посажен на активные промоторы. Это достигается при участии
вспомогательного комплекса ремоделирования хроматина CHD1,
который обладает сродством к FACT
и к нуклеосомам, содержащим гистон НЗ, триметилированный по позиции К4.Эта
модификация гистона НЗ характерна для активного хроматина. Нуклеосомы,
содержащие НЗ, триметилированный по позиции К4, локализуются преимущественно в
промоторных областях и в начале активных транскрипционных единиц. Для
оптимальной работы FACT
существенно еще и моноубиквитинилирование гистона Н2В по К120. Считается, что
эта модификация способствует ди- и три- метилированию НЗ по позиции К4.
Исследования, проведенные с использованием
метода иммунопреципитации хроматина, выявили неравномерное распределение
модифицированных и вариантных форм гистонов в границах транскрипционных единиц
. Это объясняется тем, что внесение некоторых модификаций прямо сопряжено с
осуществлением транскрипции. В дрожжевых клетках этот процесс происходит
следующим образом. Сразу после инициации транскрипции происходит
фосфорилирование серинового остатка 5 (Ser5)
в составе С-концевого домена (C-terminal
domain, CTD)
РНК-полимеразы II. Эта модификация способствует привлечению мультибелкового
комплекса, известного как фактор элонгации PAF.
Этот фактор способствует удержанию
в составе элонгирующего транскрипционного
комплекса гис-тонубиквитинлигазы, которая убиквитинилирует гистон Н2В.
Одновременно PAF привлекает
в состав элонгирующего транскрипционного комплекса НЗК4 гистонметилазу (Set
1 комплекс COMPASS).
Этот комплекс осуществляет ди- и триметилиро- вание НЗК4. Монометилирование
осуществляется обычной гистонметилазой Set
1 и не зависит от убиквитинилирования гистона Н2В. По мере продвижения
элонгирующего РНК-по- лимеразного комплекса вдоль транскрипционной единицы
происходит дефосфорилирование Ser5
и фосфорилирование Ser2
в составе CTD. Следствием
этого изменения в характере модификации CTD
является освобождение гистонметилазы COMPASS
и привлечение гистонметилазы Set2,
которая осуществляет триметилироване лизинового остатка 36 гистона НЗ.
Следствием этой сложной цепи процессов является накопление ди- и
триметилированного по К4 гистона НЗ в начале транскрипционной единицы и
триметилированного по К36 гистона НЗ в конце транскрипционной единицы. На
основании всего вышесказанного можно сделать один вывод, имеющий более общее
значение. Определенная группа модификаций гистонов необходима для привлечения
РНК-полимеразы II к промоторным областям. Распределение таких модифицированных
(и выполняющих ту же функцию вариантных) форм гистонов в границах транскрипционных
единиц и в целом в геноме не зависит от уровня транскрипции. Другие модификации
осуществляются в прямой связи с процессом транскрипции. Распределение таких
модифицированных гистонов прямо коррелирует с уровнем транскрипции
соответствующих областей генома.Сопряженная с транскрипцией смена характера
метилирования гистона НЗ имеет большое биологическое значение. Триметилирование
H3K36
в дрожжевых клетках способствует привлечению гистондезацетилазы Rpd3S,
которая снижает общий уровень ацетилирования гистонов на большей части
транскриционной единицы после каждого раунда транскрипции. Вероятно, это
необходимо для предотвращения возможности инициации транскрипции внутри гена.
Так называемые криптические промоторы, т. е. последовательности ДНК, которые в
принципе могли бы служить местами посадки РНК-полимеразы II, встречаются в
геноме эукариот достаточно часто. Организация ДНК в стабильную нуклеосомную
структуру препятствует активации этих промоторов.
В заключение данного раздела следует
подчеркнуть, что связанные с осуществлением транскрипции модификации гистонов
носят динамический характер. С помощью специальных экспериментальных подходов
можно наблюдать последовательное ацетилирование-дезацентилирование гистонов,
сопряженное с прохождением соответствующих раундов транскрипции.
.3 Доменная организация
Эксперименты по изучению предпочтительной
чувствительности к нуклеазам активных генов продемонстрировали, что область
предпочтительной чувствительности к нуклеазам, как правило, оказывается
существенно более протяженной, чем транскрибирующийся ген. В ряде случаев
предпочтительно чувствительными к нуклеазам оказывались достаточно протяженные
(100 т. п. н. и более) геномные домены, включающие как транскрибирующиеся, так
и молчащие гены, а также межгенные области. В качестве примеров можно указать
домены Р-глобиновых генов позвоночных и домен генов овальбумина кур (рис. 6).
Границы ДНКазо-чув- ствительных доменов являются достаточно четкими. Переход от
ДНКазо-чувствительной области к области, характеризующейся относительной
устойчивостью к ДНКазам, происходит в пределах фрагмента ДНК протяженностью в
несколько т. п. н. (рис. 6). Это позволяет предположить, что существуют
специальные элементы генома и соответствующие им структуры хроматина, которые
являются границами ДНКазо-чувствительных доменов. ДНКазо- чувствительные домены
генома привлекли особое внимание исследователей прежде всего потому, что
очевидна была определенная зависимость между статусом этих доменов и
транскрипционной активностью соответствующих генов.
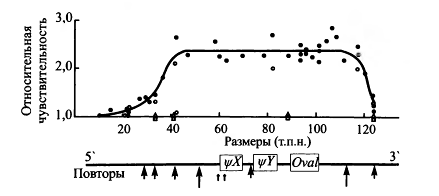
Рис. 6. Профиль чувствительности к ДНКазе I
домена гена овальбумина кур.В состав домена входит ген овальбумина (Oval)
и два псевдогена (\\fX
и у Y). Над схемой
домена приведен профиль относительной чувствительности домена и его
окрестностей к ДНКазе I в клетках яйцевода, где овальбуминовые гены
экспрессируются
Можно говорить о том, что ДНКазо-чувствительные
домены хроматина являются структурно-функциональными блоками генома, которые
могут находиться в активном либо неактивном состоянии в зависимости от типа
клеток, или, иными словами, в зависимости от неких дополнительных сигналов. Это
положение можно считать основой так называемой доменной гипотезы
структурнофункциональной организации эукариотического генома. Данная гипотеза
приобрела особую привлекательность после того, как были обнаружены области
контроля локуса (locus
control regions,
LCRs), которые, как
следовало из результатов первоначальных экспериментов, осуществляли контроль
над всеми параметрами (чувствительность к ДНКазам, транскрипционный статус и
время репликации) протяженных доменов генома. Однако все гены, расположенные в
активном хроматиновом домене, являются потенциально активными и могут быть
быстро вовлечены в транскрипцию. Вопрос о том, как возникает активный
хроматиновый домен, до конца не изучен. Понятно, что появление такого домена
является результатом сложной цепи событий, превращающей неактивный хроматин в
активный. Наиболее важным процессом, приводящим к активации хроматинового
домена, является осуществление комплекса сайт-специфических модификаций
гистонов. Хотя о доменной организации генома написаны сотни статей, количество
изученных модельных систем является весьма скромным.
В настоящее время процесс создания активных
геномных доменов прямо связывают с процессивным (т. е. распространяющимся)
ацетилированием гистонов в рамках всего домена. Прежде всего, этот процесс
должен инициироваться в каком-то определенном месте. Согласно современным
представлениям, таким местом может быть область контроля локуса, энхансер или
промотор. Связанные с этими регуляторными элементами транскрипционные факторы
способны привлекать гистонацетилазы. Эукариотические гистонацетилазы входят в
состав больших мультисубъединичных комплексов. Наряду с собственно
гистонацетилазой (например, GCN5
в клетках дрожжей) в состав этих комплексов входят субъединицы, способные
взаимодействовать с различными транскрипционными факторами и общими факторами
инициации транскрипции. Это способствует привлечению гистонацетилаз к
промоторам и энхансерам, где они осуществляют локальное аце- тилирование
гистонов. В состав гистонацетилазных комплексов входят и субъединицы,
содержащие так называемый бромодомен, который узнает ацетилированные остатки
лизина в молекулах гистонов. В связи с этим возникновение области локального
ацетилирования гистонов будет способствовать привлечению дополнительных
гистонацетилаз, которые будут ацетилировать гистоны в составе соседних
нуклеосом, перемещаться на эти нуклеосомы и продолжать процесс
распространяющегося ацетилирования (рис. 7). Этот механизм распространяющегося
ацетилирования не является единственным. Согласно гипотезе Траверса,
элонгирующий комплекс РНК-полимеразы II может сам являться тем транспортным
средством, которое используется для перемещения вдоль хроматинового домена
факторов ремоделирования хроматина, гистонацетилаз и других белков, необходимых
для активации хроматиновых доменов. Соответственно, низкоуровневая транскрипция
протяженных геномных доменов может быть необходима для их активации. Основное положение
гипотезы Траверса, а именно то, что распространяющийся процесс модификации
гистонов осуществляется в непосредственной связи с процессом транскрипции,
подтверждено в настоящее время экспериментально
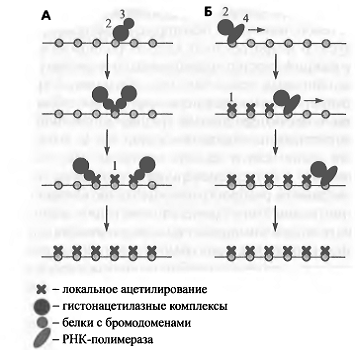
Рис. 7. Механизмы распространения ацетилирования
гистонов по хроматиновому домену
Схематически изображены две общепринятые модели.
Согласно модели расширяющегося домена (А), локальное ацетилирование привлекает
гистонацетилазные комплексы за счет белков с бромодоменами, которые связываются
с ацетилированными гистонами. Таким образом, действует положительная обратная
связь и происходит распространение ацетилирования. Модель Траверса (Б)
предполагает, что гистонацетилазные комплексы взаимодействуют с РНК-по-
лимеразой и ацетилируют гистоны по мере элонгации транскрипции.
С использованием метода ко-иммунопреципитации
продемонстрировано, что в живых клетках РНК-полимераза II образует комплексы с
гистонацетилазами и факторами ремоделирования хроматина. Протяженные (так
называемые «межгенные», а точнее говоря, «полнодоменные») транскрипты
обнаружены в целом ряде геномных областей, и выявлена корреляция между началом
синтеза этих транскриптов и активацией соответствующих доменов генома. Так,
продемонстрировано, что в незрелых эритробластах кур, т. е. еще до начала
активной транскрипции глобиновых генов, осуществляется транскрипция протяженной
геномной области, включающей кластер α-глобиновых
генов и 5'-концевые регуляторные элементы домена α-глобиновых
генов.
Вывод: предпочтительной чувствительностью к
ДНКазе обладают не только активные гены, но и более протяженные области генома,
включающие эти гены. Существуют особые регуляторные элементы, контролирующие
транскрипционный статус геномных доменов на уровне упаковки этих доменов в хроматиновый
структуры высших порядков. Активные хроматиновые домены формируются посредством
процессивного ацетилирования гистонов при участии гистонацетилаз, содержащих
бромодомен, который узнает гистон НЗ, ацетилированный по позиции К9.
Процессивное ацетилирование гистонов может быть сопряжено с низкоуровневой
транскрипцией. При этом гистонацетилазы и комплексы ремоделирования хроматина
перемещаются вдоль генномного домена в комплексе с РНК-полимеразой II. Каков бы
ни был механизм процессивного ацетилирования гистонов, он инициируется в
области контроля локуса, энхансере или промоторе, где собирается необходимый
для такой инициации комплекс транскрипционных факторов.
В течение многих лет было принято считать, что
нормальным («заданным по умолчанию») состоянием хроматина является полностью
неактивное состояние, исключающее возможность транскрипции. Соответственно,
предполагалось, что активный хроматин формируется в локальных областях в ответ
на действие специальных сигналов. В последние годы стало очевидным, что
«заданным по умолчанию» является некое промежуточное состояние хроматина и что
особая цепь процессов необходима для формирования как активного, так и
неактивного хроматина. Раскрытию механизмов формирования неактивного хроматина
во многом способствовало изучение мутаций, подавляющих так называемый эффект
положения (т. е. инактивацию гена, оказавшегося рядом с неактивным хроматиновым
доменом - гетерохроматином). Такая инактивация является следствием спонтанного
расширения гетерохроматинового домена. Соответственно, подавляющие эффект
положения мутации, как правило, затрагивают гены, кодирующие необходимые для
формирования гетерохроматина белки. Такими белками являются ДНК-метилазы,
гистонметилазы, гистондезацетилазы, белки, связывающиеся с метилированными
остатками цитозина в ДНК, и так называемые «структурные белки гетерохроматина»
(НР1 у высших эукариот и Sir
- белки у дрожжей).У позвоночных животных одним из основных инструментов
инактивации как протяженных геномных областей, так и отдельных генов или групп
генов является метилирование ДНК. Мишенью для работы эукариотических
ДНК-метилаз являются симметрично расположенные остатки цитозина в составе CpG-динуклеотидов.
В клетках существует поддерживающая ДНК-метилаза (Dnmtl
- DNA methyltransferase
1), которая восстанавливает симметричный характер метилирования после
репликации ДНК (рис. 8). В составе Dnmtl
присутствует особый домен, препятствующий осуществлению метилирования novo.
На определенном этапе эмбрионального развития вся ДНК деметилируется и потом избирательно
метилируется de
novo. Этот процесс
осуществляется особой группой ДНК-метилаз (Dnmt3a,
Dnmt3b).
Каким образом на этой стадии обеспечивается избирательный характер
метилирования определенных генов или фрагментов генома, в настоящий момент не
ясно. В клетке существует целый класс белков, которые связываются с
метилированными остатками цитозина. ДНК может инициировать процесс
дезацетилирования гистонов, результатом которого будет инактивация
хроматинового домена. С помощью метилирования ДНК инактивируется транскрипция
различных повторяющихся последовательностей, транспозонов и многих
тканеспецифичных генов.
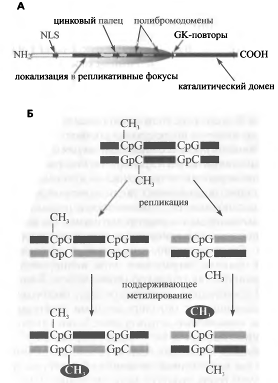
Рис. 8. Метилирование ДНК
За поддержание метилирования ДНК отвечает
фермент ДНК-метилтрансфераза 1 - Dnmtl.
Слева приведена схема структуры Dnmtl,
где отмечены различные функциональные домены белка. Серым выделена часть
фермента, препятствующая осуществлению метилирования de
novo. Схематически
изображен (Б) результат работы Dnmtl:
после репликации ДНК новосинтезированные молекулы содержат неметилированные и
полуметилированные CpG-ди-
нуклеотиды. Dnmtl превращает
полуметилированные CpG
в полностью метилированные, не затрагивая неметилированные.Некоторые из этих
белков, например МеСР2, содержат репрес- сорный домен и прямо подавляют
транскрипцию. Кроме того, МеСР2 способен привлекать Sin3-комплекс,
содержащий гистон- дезацетилазы HDAC1
и HDAC2. Соответственно,
метилирование
Специальным случаем инактивации протяженных
геномных областей, осуществляющейся при участии метилирования ДНК, является
импринтинг, т. е. избирательное выключение только одного из двух родительских
аллелей. Классическим примером импринтированного локуса является локус генов IGF2/H19
мыши. Ген Н19 активен только на материнских хромосомах, а ген IGF2
- только на отцовских хромосомах. В установлении и поддержании импринтинга
важную роль играют особые регуляторные последовательности, получившие название
«центры выбора импринтинга» (ICR
- Imprinting
choice regions).
Это небольшие фрагменты ДНК, которые по-разному метилируются в материнских и
отцовских хромосомах (DMR
- differentially
methylated
regions).
.4 Регуляция транскрипции
В эукариотических клетках разные группы генов
транскрибируются различными РНК-полимеразами. РНК-полимераза I транскрибирует
гены предшественника основных рибосомных РНК. РНК-полимераза III транскрибирует
гены, коротких - 5S рибосомных
и транспортных - РНК. Гены, кодирующие абсолютное большинство клеточных белков,
транскрибируются РНК-полимеразой II. Поэтому мы будем говорить в этом разделе
только о регуляции работы генов, транскрибируемых РНК-полимеразой II.
Основная особенность систем регуляции
транскрипции в эукариотической клетке связана с тем, что мишенью для
регуляторных сигналов является ДНК, организованная в хроматин. Это значительно
расширяет возможности избирательной активации генов. Регуляция транскрипции
осуществляется на двух основных уровнях: активация хроматинового домена и
активация собственно промотора, условием которой часто является удаление либо
перемещение расположенных на промоторе нуклеосом. Здесь обсуждается цепь
событий, приводящая к активации индивидуальных промоторов.Промотор является
ключевым элементом системы регуляции транскрипции у прокариот, в клетках
которых существуют конститутивные и индуцибельные промоторы. В последнем случае
активация промотора осуществляется с помощью регуляторных белков. Значение
промотора сохраняется и в эукариотических клетках. Важным отличием
эукариотических промоторов, однако, является то, что в определении их позиций
значительную роль играют эпигенетические факторы.
В составе большинства эукариотических промоторов
присутствуют ТАТА-бокс и инициаторная последовательность . ТАТА-бокс,
находящийся обычно на расстоянии 25-30 п. н. от старта транскрипции, у эукариот
имеет менее консервативный характер, чем у прокариот. Роль ТАТА-бокса может
играть почти любая АТ-богатая последовательность. Последовательность inr
представляет собой так называемый пиримидиновый бокс (YYANWYY1)
и находится непосредственно у точки старта транскрипции. Существует много
компьютерных программ, позволяющих предсказывать позиции эукариотических
промоторов. К сожалению, найденные с помощью этих программ промоторы далеко не
всегда работают в живых клетках. Основная проблема с предсказанием позиций
эукариотических промоторов заключается в том, что эти предсказания делаются на
основе анализа последовательности ДНК без учета эпигенетических факторов. Между
тем позиции активных промоторов в значительной мере определяются на уровне
организации ДНК в хроматиновую фибриллу. Инициаторный комплекс РНК-полимеразы
II является слишком большим для того, чтобы его можно было собрать на
межнуклеосомном спейсере. Для сборки этого комплекса промотор должен быть тем
или иным образом освобожден от нуклеосом. Это может быть обеспечено рядом
механизмов. Во многих случаях достаточно привлечения к промоторной области
фактора (факторов) ремоделирования хроматина. Этот процесс может осуществляться
при участии тканеспецифичных транскрипционных факторов. Важную роль играет
также локальное ацетилирование гистонов, в том числе гистона H2A.Z
в промоторных областях. Согласно последним данным, гистон H2A.Z
присутствует как в активных, так и в неактивных промоторах, и именно его
ацетилирование существенно для активации промотора. Показано, что для
поддержания свободного от нуклеосом участка в промоторной области он должен
быть фланкирован двумя нуклеосомами, содержащими гистон H2A.Z.
Следует особо отметить, что гистон H2A.Z
включается в нуклеосомы по независимому от репликации пути. Это обеспечивает
возможность избирательной активации промоторов сайт-специфичным включением
этого гистона в нуклеосомы в ходе клеточной дифференцировки или реакций на те
или иные внешние сигналы. Существуют и другие механизмы создания свободных от
нуклеосом участков (участков гиперчувствительности к ДНКазе I).
Свободный от нуклеосом промотор служит местом
сборки преинициаторного транскрипционного комплекса, включающего РНК-полимеразу
II и шесть консервативных неспецифических (general)
факторов транскрипции (обычно их называют общими транскрипционными факторами): TFI1A,
TFIIB, TFIID,
TFIIE, TFIIF,
TFIIH. Лишь один из этих
общих транскрипционных факторов (TFIID)
способен узнавать промотор. В состав этого фактора транскрипции, состоящего из
нескольких субъединиц, входит белок, способный связываться с ТАТА боксом (TATA-binding
protein, ТВР) и ряд
вспомогательных белков. В экспериментах in
vitro с использованием
сильного аденовирусного промотора, содержащего классический ТАТА-бокс, ТВР
способен замещать полноценный TFIID,
обеспечивая базальный уровень транскрипции. В этой системе не требуется также TFIIA.
Белки TAF способны
узнавать отличные от ТАТА-бокса домены промотора и абсолютно необходимы для
инициации транскрипции на широком классе промоторов, не содержащих ТАТА-бокса.
Кроме того, они являются мишенями для взаимодействия с тканеспецифичными
транскрипционными факторами, в силу чего являются необходимыми для
избирательной инициации транскрипции с определенных групп промоторов.
В несколько упрощенном виде современная модель
сборки преинициаторного комплекса при участии общих факторов транскрипции
выглядит так: TFIID узнает
минимальный промотор и, связываясь с ним, обозначает место сборки
транскрипционного комплекса. TFIIA
и TFIIB стабилизируют
взаимодействие ТВР с ДНК, контактируя одновременно с ДНК и ТВР. TFIIF
обеспечивает посадку РНК-полимеразы II на формирующийся комплекс. Далее к
комплексу присоединяются TFIIE
и TFIIH. Последний
представляет собой АТФ-зависимую ДНК-хеликазу, которая обеспечивает локальное
плавление ДНК в точке начала транскрипции.
Для сборки транскрипционного комплекса in
vivo на большинстве
промоторов, помимо общих транскрипционных факторов требуется целый ряд
дополнительных белков. Регуляторные белки, способствующие активации промотора,
как правило, называют транскрипционными факторами. Уже говорилось выше, что эти
факторы могут взаимодействовать с TAF-белками,
участвуя в определении места посадки на ДНК фактора TFIID.
Известно очень много транскрипционных факторов. Некоторые из них являются
универсальными, например фактор Spl.
Большинство характеризуется определенной специфичностью в отношении типа ткани.
Например, в эритроидных клетках существенную роль в инициации транскрипции
глобиновых генов играют транскрипционные факторы GATA-1
и NF-E2.
Наряду с промоторами важную роль в регуляции
транскрипции эукариотических генов играют энхансеры и сайленсеры, которые,
соответственно, стимулируют и подавляют активность промоторов. Так случилось,
что первыми были охарактеризованы энхансеры различных вирусов (вируса SV40,
цитомегаловируса и т. д.). Эти энхансеры не проявляют тканевой специфичности.
Они могут работать, находясь на значительном удалении от промотора и будучи
расположены в различных ориентациях. В геноме эукариотической клетки многие
энхансеры являются тканеспецифичными и могут работать только в тандеме с
промотором определенного класса. Механизм работы энхансеров/сайленсеров пока
еще не раскрыт и остается предметом дискуссий. Известно, что большинство
энхансеров содержит участки связывания для различных транскрипционных факторов.
Так, энхансер вируса SV-40
содержит несколько участков связывания транскрипционного фактора Spl.
Энхансеры α- и β-глобиновых
генов содержат участки связывания транскрипционных факторов GATA-1
и NF-E2.
В геноме дрожжей существуют так называемые UAS
(upstream
activating
sequences), которые играют
важную роль в процессе сборки инициаторного комплекса РНК-полимеразы II.
Последовательности UAS
расположены на небольшом (менее 1 т. п. н.) расстоянии от промоторов.
Считается, что комплекс связанных с UAS
транскрипционных факторов прямо взаимодействует с TAF-белками,
способствуя удержанию TFIID
на промоторе. При этом небольшой фрагмент ДНК, разделяющий UAS
и промотор, образует петлю. На этой петле могут находиться две или три
нуклеосомные глобулы. Энхансеры высших эукариот могут располагаться на
существенно большем расстоянии от контролируемых ими генов (иногда это
расстояние превышает 100 т. п. н.). Подобно UAS
дрожжей, энхансеры высших эукариот являются местами сборки тех или иных активаторных
комплексов. Именно по причине взаимодействия с комплексом транскрипционных
факторов активные энхансеры оказываются расположены в свободных от нуклеосом
участках (участках гиперчувствительности к ДНКазе I). Основной вопрос, который
возникает при попытке объяснить механизм действия эукариотических энхансеров,
состоит в том, как активаторный сигнал передается на значительные расстояния. В
современной литературе обсуждается несколько моделей, объясняющих передачу
активаторного сигнала от энхансера к промоторам (рис. 9). Все эти модели можно
разделить на две большие группы: модели, основанные на процессивном
распространении активирующего сигнала (tracking),
и модели, основанные на непосредственном взаимодействии энхансера и промотора с
выпетливанием разделяющего их фрагмента (looping).
Ясно, однако, что такой механизм не может действовать на очень больших
расстояниях. Действительно, между удаленными энхансерами и регулируемыми ими
генами часто располагаются гены, которые данным энхансером не активируются. Ацетилирование
же гистонов не обладает избирательностью и должно привести к активации всех
генов, расположенных в гиперацетилированном домене. Модель, предполагающая
прямое взаимодействие энхансера и промотора (с выпетливанием разделяющего их
фрагмента ДНК), эту проблему легко решает. В настоящее время получены
убедительные доказательства того, что удаленные энхансеры (а точнее говоря,
связанные с энхансерами регуляторные белки) прямо взаимодействуют с
промоторами, образуя сложный активаторный комплекс с транскрипционными
факторами, локализованными на промоторе. В англоязычной литературе этот
активаторный комплекс называют chromatin
hub. Сам факт
взаимодействия удаленных регуляторных элементов с контролируемыми ими
промоторами подтвердился в экспериментах по изучению трехмерной организации ДНК
в ядре. Используемый при этом экспериментальный подход, получивший название ЗС
(«три цэ» - chromosome
conformation
capture), заключается в
том, что из сшитых формальдегидом ядер удаляют гистоны, после чего ДНК
обрабатывается рестриктазами и лигируется по липким концам. Понятно, что
вероятность лигирования свободно диффундирующих в растворе фрагментов ДНК
крайне мала. В то же время вероятность лигирования фрагментов, связанных друг с
другом посредством белков, будет значительно выше.
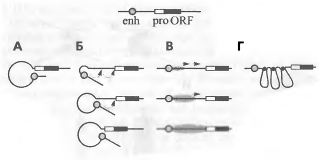
Рис 9. Модель действия энхансера
На рисунке показаны основные обсуждаемые в
настоящее время модели взаимодействия энхансера (enh)
и промотора (pro). А -
прямое взаимодействие при выпетливании района между энхансером и промотором; Б
- опосредованное, или сканирующее, выпетливание (в отличие от предыдущего
варианта, при котором взаимодействие промотора и энхансера происходит «сразу»);
В - распространение некоего активирующего сигнала; Г - приближение энхансера к
промотору каким-то дополнительным механизмом (например, белками, укладывающими
хроматин между энхансером и промотором в компактную структуру).
Соответствующие различия могут быть
зарегистрированы с использованием количественной или полуколичественной полимеразной
цепной реакции (рис. 10). С помощью этого экспериментального подхода было
продемонстрировано прямое взаимодействие LCR-домена
β-глобиновых
генов мыши с промоторами глобиновых генов. Было также показано, что структура
активирующих комплексов изменяется при переходе домена из потенциально активной
в активную форму (рис. 11). Аналогичные наблюдения были сделаны и при изучении
ряда других геномных локусов. Выявлены также случаи участия в образовании
сложного активаторного комплекса (chromatin
hub) регуляторных
элементов, расположенных на разных хромосомах. Такие межхромосомные
взаимодействия могут играть важную роль в координации экспрессии связанных в
функциональном отношении генов, которые располагаются на разных хромосомах.
Следует отметить, что модель образования прямого
активаторного комплекса с участием промоторов и удаленных энхансеров не
исключает возможности последующего ограниченного распространения активирующего
сигнала, т. е. создания активного хроматинового домена, характеризующегося повышенным
уровнем ацетилирования гистонов.
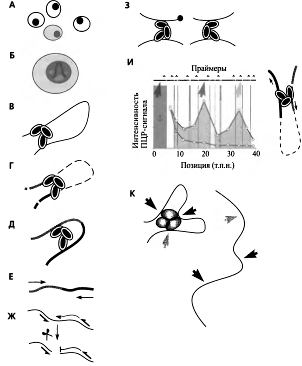
Рис. 10. Принцип метода ЗС
В основе метода лежит лигирование рестриктных
фрагментов, зафиксированных ДНК-белковыми сшивками, при низкой концентрации
ДНК. Клетки (А) обрабатывают формальдегидом, что приводит к образованию
белок-белковых и ДНК-бел- ковых сшивок (Б). Затем клетки лизируют, осаждают
хроматиновую фракцию и детергентом отмывают несвязанные белки. Полученные
ДНК-белковые препараты (В) обрабатывают рестриктазами (Г)- Полученный препарат
сильно разбавляют. Благодаря разбавлению фрагменты ДНК оказываются
изолированными друг от друга, кроме тех, которые остались объединены белковыми
сшивками. Очевидно, что это Moiyr
быть только участки ДНК, которые изначально in
vivo входили в состав
каких-либо крупных надмолекулярных комплексов. Затем в полученный разбавленный
препарат добавляют лигазу. В этих условиях лигироваться могут только
пространственно сближенные рестрикгные фрагменты - т. е. только фрагменты,
объединенные белковыми сшивками (Д) - иными словами, взаимодействовашие in
vivo. После лигирования
выделяют ДНК и детектируют продукты лигирования
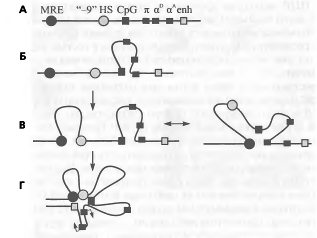
Рис. 11. Формирование единого активаторного
комплекса
На примере домена а-глобиновых генов кур
показано, как активация домена отражается на его пространственной организции.
Домен а-глобино- вых генов кур (А) включает три гена - эмбриональный п и
взрослые aD и аА.
Помимо генов, в состав домена входят регуляторные элементы: главный
регуляторный элемент (MRE
- main regulatory
element, аналог области
контроля локуса), участок гиперчувствительности к ДНКазе, расположенный на
расстоянии 9 т. п. н. перед геном п («-9» HS),
CpG-островок и
энхансер (enh),
расположенный после гена оР. В не-эритроидных клетках взаимодействий между
различными функциональными элементами домена практически нет (Б). В не-
дифференциированных предшественниках эритробластов наблюдаются отдельные
взаимодействия между некоторыми элементами, причем возможно несколько вариантов
таких взаимодействий (В). Наконец, в зрелых эритробластах практически все
регуляторные элементы, наряду с промоторами транскрибируемых генов, объединены
в структуру, получившую название «хроматиновый хаб» (chromatin
hub) (Г). Стрелками
показано направление транскрипции работающих генов.
В последние годы активно обсуждается модель,
связывающая активацию транскрипции с перемещением гена из неактивного в
активный ядерный компартмент. Примером активного компартмента могут служить PML-тельца.
Это небольшие компартменты, содержащие PML-белки
и ряд транскрипционных факторов, наиболее активные генные домены выпетливаются
из хромосомных территорий. Показано, что при этом они перемещаются к PML-тельцам,
что, по-видимому, способствует активации транскрипции. Область, прилежащая к
ядерной оболочке, и области, прилежащие к конститутивному (например,
прицентромерному) гетерохроматину, являются неактивными компартментами.
Предполагается, что простое перемещение генов в эти компартменты приводит к их
долговременной инактивации. В модельном эксперименте показано, что активный
трансген, поставленный под контроль сильного энхансера, локализуется в
эухроматине. Трансген без энхансера локализуется рядом с центромерными
областями хромосом (рис 12,приложение 2 ). Следует подчеркнуть, что речь идет
не об интеграции трансгена в эухроматиновую или гетерохроматиновую область
хромосомы, а просто о размещении соответствующего хромосомного домена внутри
ядра. Существует целый ряд экспериментальных данных, свидетельствующих о том,
что локализация в ядре многих тканеспецифичных генов зависит от их
транскрипционного статуса. С помощью флуоресцентной гибридизации in
situ было
продемонстрировано, что в эритроидных клетках глобиновые гены располагаются
далеко от конститутивного гетерохроматина, тогда как в неэритроидных они
практически контактируют с конститутивным гетерохроматином. В лимфоидных
клетках целый ряд генов инактивируется при участии белка «Ikaros».
Эта инактивация коррелирует с перемещением соответствующих генов в один из
прицентромерных компартментов. Белок Ikaros,
по-видимому, играет важную роль в этом перемещении, так как, с одной стороны,
на ДНК имеются участки узнавания Ikaros,
а с другой стороны, Ikaros
способен образовывать комплексы с прицентромерным гетерохроматином.
Важную роль в познании механизма действия
энхансеров сыграли работы по изучению механизма переключения экспрессии β-глобиновых
генов. У человека этот кластер состоит из пяти родственных генов, один из
которых (ε) экспрессируется
на ранней эмбриональной стадии, два других (°у и Ау) экспрессируются на поздней
эмбриональной стадии и, наконец, гены σ
и β
экспрессируются в клетках взрослого организма. Расположение генов в домене
(начиная от области контроля локуса) соответствует порядку их активации по ходу
развития эмбриона. Наиболее интересным представляется тот факт, что экспрессия
всех этих генов контролируется одной и той же группой энхансеров, расположенных
в области контроля локуса (LCR).
Было высказано предположение, что активация транскрипции того или иного из β-глобиновых
генов напрямую зависит от установления прямого физического контакта между
промотором этого гена и LCR.
Понятно, что вероятность установления такого контакта обратно пропорциональна
расстоянию между геном и LCR.
Иными словами, просто в силу своей близости к LCR
эмбриональный ген ε должен
транскрибироваться предпочтительно по сравнению с другими β-глобиновыми
генами. Эффективная транскрипция последних будет возможна лишь после
принудительного выключения гена ε
с помощью некоего отличного от LCR
контрольного механизма. Сформулированная гипотеза, которую можно назвать
«пространственно-статистической» моделью активации транскрипции β-глобиновых
генов, позволила сделать несколько предположений, и они были проверены
экспериментально. Прежде всего, процесс активации индивидуальных глобиновых
генов должен носить статистический характер. Следовательно, в популяции
эмбриональных эритроидных клеток, экспрессирующих преимущественно глобиновый
ген ε,
должно присутствовать определенное количество клеток, экспрессирующих другие
глобиновые гены. При этом в некий фиксированный момент времени на каждой из
хромосом может экспрессироваться только один из глобиновых генов (ген, промотор
которого находится в комплексе с LCR).
Это предсказание оказалось вполне справедливым лишь в случае домена β-глобиновых
генов мыши. В эмбриональных эритроидных клетках человека гены «взрослых»
глобинов вообще не экспрессировались. Другое предсказание, которое можно
сделать на основании «пространственно-статистической» модели функционирования LCR,
состоит в том, что любое изменение позиции гена (перестановка генов, внедрение
дополнительных копий генов и изменение протяженности межгенных спейсеров) в
домене, находящемся под контролем LCR,
должно существенным образом влиять на характер экспрессии всех генов в домене
(в том числе и на время активации транскрипции различных генов по ходу развития
организма). В случае домена β-глобиновых
генов человека это предсказание было подтверждено результатами экспериментов с
трансгенными мышами, в геном которых были внедрены перестроенные копии данного
домена. Наиболее показательными можно считать результаты эксперимента, в
котором были изменены относительные позиции генов ε
(эмбриональный
ген) и β
(ген, экспрессирующийся в эритроидных клетках взрослого организма). После
инверсии всего кластера β-глобиновых
генов относительно LCR
ген β
оказывается расположенным ближе всего к LCR,
тогда как ген е, напротив, оказывается наиболее удаленным от LCR.
При такой конфигурации домена в эмбриональных эритроидных клетках трансгенных
мышей экспрессируется ген β,
а эмбриональный ген ε остается
неактивным. Этот результат позволяет утверждать, что конкуренция за LCR
является важным элементом механизма регуляции экспрессии β-глобиновых
генов. Понятно, однако, что переключение экспрессии глобиновых генов в
эмбриогенезе не может быть объяснено только конкуренцией промоторов
индивидуальных генов за доступ к LCR.
Должны существовать дополнительные регуляторные системы, инактивирующие
эмбриональные гены и активирующие гены взрослого организма. Здесь, скорее
всего, работает механизм создания активных субдоменов при участии связанного с
транскрипцией ацетилирования гистонов. Как уже говорилось, уровень
ацетилирования гистонов в границах домена β-глобиновых
генов существенно различается (рис.6 ). Наиболее высокий уровень ацетилирования
характерен для области контроля локуса и для той группы глобиновых генов
(эмбриональные, либо взрослые), которые транскрибируются в данном типе клеток.
Наряду с энхансерами, в геноме эукариот
присутствуют сайленсеры, которые подавляют активность находящегося под их
контролем промотора. Принцип действия сайленсеров, по-видимому, мало отличается
от принципа действия энхансеров. Как и энхансеры, сайленсеры представляют собой
площадки связывания транскрипционных факторов. Именно последние определяют
направление действия регуляторного элемента (активация транскрипции либо ее
подавление). Одни и те же регуляторные элементы могут быть энхансерами в одном
типе клеток и сайленсерами в другом типе клеток. Классическим примером является
LCR-домена β-глобиновых
генов, который активирует экспрессию находящихся под его контролем генов в
эритроидных клетках и подавляет экспрессию тех же генов в неэритроидных
клетках.
Заключение
Хроматин уже давно перестал быть аморфной массой
и предстал перед глазами исследователей в виде достаточно упорядоченной
структуры, построенной по иерархическому принципу.
Для активной фракции хроматина характерна менее
компактная упаковка, чем для основной массы хроматина, о чем свидетельствует, в
частности предпочтительная чувствительность активного хроматина к нуклеазам.
Активный хроматин отличается от неактивного как на уровне организации
нуклеосомной фибриллы в структуры высших порядков, так и на уровне организации
индивидуальных нуклеосом. Для активного хроматина характерны высокий уровень
ацетилирования гистонов в целом.
Важную роль в регуляции инициации транскрипции у
эукариот играет процесс освобождения промотора от нуклеосом.
Энхансеры существенны как для создания активного
хроматинового домена, так и для поддержания стабильности инициаторного
комплекса РНК-полимеразы II.
Энхансеры участвуют в образовании единого
инициаторного комплекса с промотором. При этом разделяющая энхансер и промотор
хроматиновая фибрилла выпетливается.
Один и тот же регуляторный элемент может быть
энхансером и сайленсером в зависимости от набора связанных с этим элементом
белковых факторов.
Список литературы
1.Хроматин: упакованный геном / С.
В. Разин, А. А. Быстрицкий. - М. : БИНОМ. Лаборатория знаний, 2012.- 176 с.:
ил., [16] с. цв. вкл.
. Экспрессия генов / Патрушев Л.И. -
М.: Наука, 2000.
хроматин
нуклеосомы белок
Приложение 1
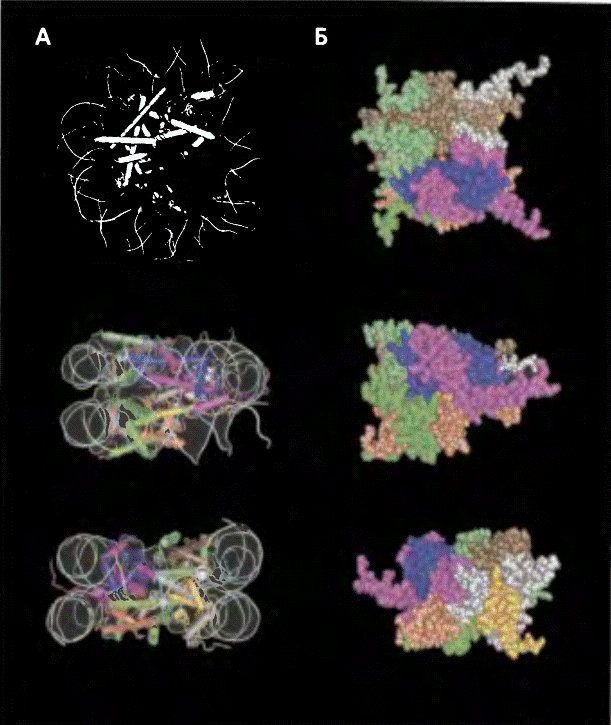
Рис. 3 Модель октамера гистонов
На рисунке представлена молекулярная модель
нуклеосомы (А) и октамера гистонов (Б) в трех разных ракурсах.Разные молекулы
гистонов обозначены следующими цветами: Н2А - красный и коричневый, Н2В -
изумрудный и зеленый. НЗ - розовый и серый. Н4 - синий и оранжевый. «Хвосты»
молекул гистонов показаны не полностью.
Приложение 2
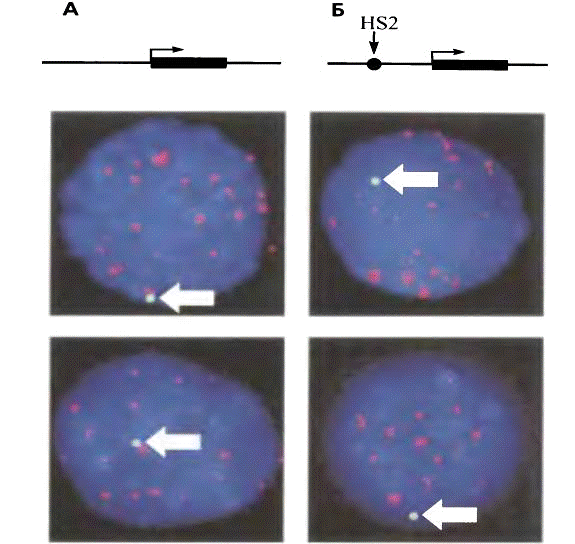
Рис 12. Активность локуса и его внутриядерная
локализация
На рис. показаны результаты визуализации
интегрированной в геном трансгенной конструкции в ядрах эритроидных клеток. Для
гибридизации с трансгеном использовался зонд, меченный зеленым красителем;
красным красителем помечен зонд, позволяющий визуализировать все центромеры
(этот зонд гибридизуется с центромерами всех хромосом). Синяя флуоресценция -
краситель DAPI,
неспецифически окрашивающий тотальную ДНК. Позиции трансгенов отмечены белыми
стрелками. Конструкция, в состав которой входит только ген β-глобина
(А), локализуется преимущественно возле центромер. Так как центромеры содержат
гетерохроматин, то и трансген оказывается гетерохроматинизирован и
репрессирован. Включение же в конструкцию энхансера HS2
из области контроля локуса β-глобинового
домена (Б) приводит к тому, что такой трансген локализуется преимущественно в
эухроматических областях ядра. Никакой гетерохроматинизации не происходит и
трансген активно экспрессируется.
Важно, что во всех рассмотренных клетках
трансгенные конструкции интегрированы в одно и то же место генома. Таким
образом, разница в локализации обусловлена только свойствами самой конструкции
(т. е. присутствием либо отсутствием в ее составе мощного энхансера).