Азиды щелочных металлов
Химический
факультет
Кафедра
неорганической химии
Реферат
«Азиды
щелочных металлов»
Введение
Открытые около ста с лишним лет назад, азиды
сыграли важную роль в истории человечества. Как нестабильные вещества находили
применения в качестве взрывчатых веществ, сегодня, когда изучены хорошо изучены
механизмы их реакций, азиды являются важными компонентами в химическом
производстве.
Целью данной работы служит определение понятия
как таковых азидов, азотистоводородной кислоты, их строения, свойств, изучения
закономерностей их свойств, основных направлений в применении азидов, и
основных методик их синтеза.
Более подробно рассмотрены азиды щелочных
металлов.
Азидоводородная кислота и строение азид иона
Окрытие.
Азотистоводородная кислоты была впервые получена
Курциусом в 1890г. Он предположил, что как их аммиака и азотистой кислоты
образуется азот:
3 + HNO2
= N2 +2H2O
так и из гидразина и азотистой кислоты должен
получится азоимид:
2H4
+ HNO2 = HN3
+ 2H2O
В качестве исходного вещества он применил
гидразиды кислот RCONHNH2,
которые при взаимодействии с азотистой кислотой образуют соответствующие
азоимиды RCON3, например
6H5CONHNH2
+ HONO = C6H5CON3
+ H2O
При омылении щёлочью бензоилазоимид расщепляется
с образованием солей бензойной и азотистоводородной кислот:
6H5CON3
+2NaOH = C6H5COONa
+ NaN3 + H2O
При обработке азида натрия серной кислотой
образуется азидоводородная кислота
3 + H2SO4
= HN3 + NaHSO4
Физические свойства.
Чистый HN3
- это бесцветная жидкость или газ (т. пл. « -80 °С, т. кип. (по оценкам) 35,7
°С, </=1,126 г-см-3 при 0°С). Большие положительные величины энтальпии и
свободной энергии образования подчеркивают присущую соединению нестабильность: ∆H⁰обр(1
атм, 298 К) = 269,5 кДж • моль-1, ∆G⁰обр
(1 атм, 298 К) = 327,2 кДж • моль-1. В безводном состоянии она может взорваться
не только при нагревании, но и от сотрясения:
HN3 = Н2 + 3N2
Он имеет неприятный, сильно раздражающий запах и
является смертельным (хотя и не накапливающимся в организме) ядом; даже при
концентрации в воздухе менее 10-4% он может быть опасен.
Водные растворы HN3
по кислотности сравнимы с уксусной кислотой
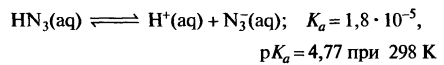
Химические свойства.
В разбавленных растворах азотистоводородная
кислота медленно диспропорционирует:
+ Н2О = N2 + NH2OH
Ион N3-
- окислитель. По окислительным свойствам HN3
напоминает HNO3. При
взаимодействии с металлами HN3 образует
N2 и NH3
+ 3HN3 = Cu(N3)2 +N2 + NH3
Ион N3-
ещё называют псевдогалогенид ионом
Смесь HN3
и HCl, подобно царской
водке, - сильный окислитель за счёт образующегося хлора, способна растворят
благородные металлы:
3 + 3HCl
= NH4Cl
+ Cl2 + N2
2Pt +3HN3 + 13HCl = 2H2[PtCl5] +
3NH4Cl +3N2
Строение.
В течение длительного времени велась дискуссия
по вопросу о строении азотистоводородной кислоты и азидов. Изначально такие
учёные как Кекуле, Фишер, исходя из своих и других работ, предлагали
циклическую форму строения азид иона
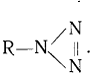
Тиле, изучая строение диазосоединений, пришел к
убеждению, что азиды являются аналогами алифатических диазосоединений, и для HN3
предложил линейную формулу строения
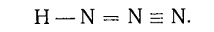
Вопрос о строении азотистоводородной кислоты и
ее производных решался различными способами
Множество учёных за длительное время провели
множество исследований в этой области, в ход шли самые разнообразные методы от
простой аналогии с другими веществами и сопоставления реакций, применения
парохора (величину связывающую относительную молекулярную массу с величиной
поверхностного напряжения), до инфракрасного абсорбционного спектра и
изотопного анализа.
В настоящее время большинство исследователей
считает, что как ион N3-,
так и группа -N3 в ковалентных
соединениях имеют линейное строение и азиды могут существовать в виде
стабильной формы
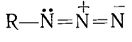
и в виде реакционной формы
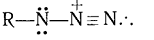
Современное представление.
Конфигурация азидогруппы на примере CH3N3
приведена ниже:

Строение группы -N3
промежуточное между тремя предельными структурами с преобладающим вкладом
первых двух:
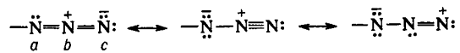
Атом Nb
имеет гибридизацию sp,
Na-sp2,
Nc - spx
(1 < x < 2)
Азид ион имеет линейную форму:
кислота азид натрий азот
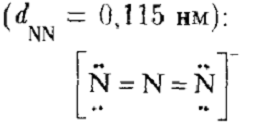
Распределение валентных электронов по
молекулярным орбиталям отвечает электронной конфигурации

Схема строения азидоводородной кислоты:

Азиды щелочных металлов.
Общая характеристика.
Азиды щелочных металлов при нагревании
разлагаются с выделением азота и металла, причем способность разлагаться при
нагревании у них уменьшается с увеличением атомной массы металла. Все азиды
щелочных металлов в воде растворяются, при этом с увеличением атомной массы
металла растворимость их повышается (аналогия с хлористыми металлами). Водные
растворы азидов щелочных металлов имеют слабую щелочную реакцию.
Азид лития, LiN3
Получение. Получается при взаимодействии сернокислого
лития LiSO4 с азидом
бария Ва(N3)2 в водном
растворе. При испарении раствора получаются бесцветные кристаллы, которые
перекристаллизовывают из небольшого количества воды и высушивают над серной
кислотой.
Деннис и Бенёдикт получили соль состава LiN3*H2O
при нейтрализации гидрата окиси лития азотистоводородной кислотой и испарении
раствора на воздухе. При хранении эта соль выделяет азотистоводородную кислоту.
При нагревании соль сначала теряет воду, а потом взрывается. При длительной
сушке над концентрированной H2SO4
азид лития обезвоживается полностью.
Хот и Пил получили азид лития при взаимодействии
NaN3 с хлористым
литием. Франкенбургер и Циммерман получили LiN3,
пропуская азот, не содержащий кислорода, над литием, нагретым до 500-600° С.
В 1957 г. азид лития был получен в виде
бесцветных кристаллов высокой степени чистоты (99,5%) при растворении азида
натрия и сульфата лития в воде с добавлением 96% этанола. Профильтрованная
смесь была выпарена почти досуха на водяной бане и затем при 80° С.
Безводный LiN3
можно получить при взаимодействии металлического лития с раствором азида
аммония в жидком аммиаке. В 1954 г.при испарении и сушке смеси эфирных
растворов избытка HN3
и LiBH4 получен
литийборазид LiB (N3)4,
представляющий собой твердое вещество, белого цвета, растворимое в эфире, легко
гидролизуемое и очень чувствительное к удару.
Свойства. Азид лития растворим в воде (в 100 г
воды при 16° С растворяется 66,41 г и при 10° С - 36,1 г), в абсолютном спирте
(20,26 г при 16° С) и нерастворим в абсолютном эфире.
Азид лития при нагревании на металлической
пластинке сначала плавится, потом взрывается с карминово-красным светом. При
взрыве в сухом состоянии получается яркий свет, как от магния. Температура
вспышки LiN3 для
навески 0,02 г при 5-секундной задержке 245° С. Энергия активации азида лития
19,1 ккал/моль, нормальная энтальпия образования кристаллического азида лития -
2,58 ккал/моль при 25° С, энергия решетки - 194 ккал/моль при 25° С . К удару
азид лития не чувствителен. Скорость детонации 990 м/с.
Азид натрия NaN3.
Получение. Получается при нейтрализации раствора
едкого натрия азотистоводородной кислотой с последующим выпариванием
полученного раствора или осаждении спиртом. Кроме того, существуют специальные
способы получения азида натрия (см. ниже).
Свойства. Растворимость. Азид натрия хорошо
растворяется в воде. В 100 г воды при 10° С растворяется 40,16 г, при 15,2°
С-40,7 г, при 17° С - 41,7 г азида натрия. Температура кипения насыщенного
водного раствора азида натрия равна 110,5° С.
Азид натрия очень хорошо растворяется в жидком
аммиаке. На этом основании в американском патенте 1952 г. рекомендуется очищать
технический азид натрия растворением его в жидком аммиаке с последующим
отделением нерастворимых примесей и удалением аммиака. В патенте указывается,
что после двукратной очистки из аммиака можно получить азид натрия 99,5%-ной
чистоты.
Растворимость азида натрия в ацетоне,
хлороформе, гексане, циклогексане, четыреххлористом углероде, трихлорэтилене,
этил- ацетате при 25°С менее 0,005 г в 100 мл раствора.
В этиловом спирте при 0°С растворяется 0,22 г в
100 мл растворителя и 0,46 г при кипении раствора. Растворимость в метаноле при
25° С равна 2,48 г на 100 мл раствора.
Растворимость азида натрия в воде в присутствии
растворенных в ней других солей или гидратов окислов щелочных металлов
уменьшается.
Растворимость азида натрия в щелочных растворах
уменьшается с повышением концентрации раствора щелочи. С повышением температуры
растворимость азида натрия увеличивается, а в концентрированных растворах
достигает определенного предела, после чего начинает снижаться.
Уменьшение растворимости азида натрия в воде с
увеличением в растворе концентрации гидрата окиси натрия используется в
производстве азида натрия для выделения последнего. В 100 г абсолютного спирта
при 16° С растворяется 0,315 г NaN3;
в абсолютном эфире азид натрия не растворяется.
Вольгемут исследовал систему Н2O-NaN3
и выделил кристаллогидрат NaN3*3H20.
В лабораторной практике в целях очистки азид
натрия пере- кристаллизовывают из воды и высушивают в эксикаторе над серной
кислотой. Перекристаллизацию рекомендуется проводить два раза, упаривая водные
растворы азида натрия или осаждая азид натрия из небольшого количества водного
раствора спиртом или ацетоном. При этом получается продукт с содержанием NaN3
не ниже 99,9%.
Др. свойства. Азид натрия негигроскопичен,
нелетуч, при хранении на воздухе масса за первую неделю увеличивается на 0,6%;
от удара не взрывается. При нагревании на металлической пластинке плавится, при
высокой температуре слабо вспыхивает с ярко-желтым светом (при 330° С в
капилляре не изменяется). При слабом нагревании до температуры выше 330° С азид
натрия может взорваться. В условиях глубокого вакуума азид натрия начинает
разлагаться при 275° С с выделением азота. Плотность NaN3
при 25° С равна 1,8473 , удельная теплоемкость при 0-100° С равна 0,2934 кал/г
. Слабо выраженные взрывчатые свойства азида натрия могут быть объяснены его
сравнительно малой эндотермичностью. Теплота о бразования азида натрия -92
кал/г, в то время как теплота образования азида свинца - 455 кал/г.
По данным Денниса и Бенедикта, азид натрия можно
расплавлять и держать несколько часов в расплавленном состоянии, при этом азид
натрия не разлагается.
Термическое разложение. Ваттенберг показал, что
при нагревании азида натрия до 250°С и выше до начала разложения образуется
нитрид натрия Na3N.
Гарнер и Марке исследовали термический распад
азида натрия. Для опытов применяли кристаллы массой 1-3 мг. Опыты проводили как
в вакууме при температуре 257-365°С, так и в парах натрия. При опытах в вакууме
получали кривые периодов распада, из которых было видно, что вначале происходит
период медленного распада, затем быстрого с постоянной скоростью. Кристаллы
азида натрия распадаются на отдельные части, окрашенные в желтый цвет.
Азид натрия испытывали в парах натрия при
повышенной температуре; каталитическое действие паров натрия небольшое. Энергия
активации равна 10-34 ккал/моль при температуре 365° С и 20-50 ккал/моль при
температуре выше 365° С.
Позднее термический распад NaN3
исследовал Иоффе, а также Томпкинс и Якобе.
Влияние радиации. Мюллер и Броус изучали действие
бомбардировки электронами азида натрия. С этой целью азид натрия помещали в
трубке с вакуумом до 10-6 мм и над ним производили электрический разряд при
различном напряжении тока. Азид натрия при этом распадался. Скорость распада
определялась по измерению давления выделившегося азота. До 11,75 зВ распада не
было, около 12 эВ распад начинал усиливаться, потом с известного момента
постепенно падал до минимума. Такие минимумы наблюдались при 15,5 эВ, 23,5-24,0
и 27,5 эВ. По мнению Мюллера и Броуса, это падение скорости распада обязано
своим происхождением столкновениям электронов с абсорбированными молекулами
азота на поверхности азида натрия.
Мюллер и Броус, кроме того, изучали действие
света на азид натрия. Они нашли, что при полном освещении дугой ртутной лампы
азид натрия быстро разлагается со скоростью, пропорциональной интенсивности
ультрафиолетового облучения. При облучении рентгеновскими лучами и
бомбардировке медленными нейтронами азид натрия становится коричневого цвета.
Позже было показано, что азид натрия, облученный
при комнатной температуре и ниже, вначале имеет бледно-зеленое окрашивание и
позднее при хранении в течение нескольких часов при комнатной температуре
становится коричневым.
Токсичность. Вскоре после открытия Курциусом
азотистоводородной кислоты возник вопрос о возможности использования солей
азотистоводородной кислоты подобно нитритам и нитратам в качестве источника
азота для питания растений и образования белковых веществ растительных клеток.
Для выяснения этого были проведены интересные исследования над различными
растениями, бактериями, плесенью, инфузориями, некоторыми низшими формами
животных и, наконец, над мышами и щенками. Во всех случаях было найдено, что
азид натрия в очень малых концентрациях губителен для организмов. При впрыскивании
0,1 мг раствора азида натрия под кожу мыши она погибала через несколько минут.
Азид натрия более токсичен, чем азид свинца, и рассматривается как яд более
токсичный, чем органические азиды.
Применение. В основном азид натрия применяется в
производстве неорганических и органических азидов. Кроме того, было
предположено применять азид натрия в воспламенительных составах NaN3-35%,
КС103- 30%, Sb2S3
- 35%.
Азид натрия применяется как инициатор
полимеризации эмульсий, как порообразующийся агент и как восстановитель рисунка
протектора при производстве губчатой резины. Азид натрия используется также при
разложении нитритов в присутствии нитратов. Скорость разложения нитрита
увеличивается с увеличением концентрации азида. Оптимальное соотношение CNaN3/CNaNO2
= 3,9. Возможно применение NaN3
в малых дозах для терапевтических целей. Так, имеются указания на применение NaN3
и некоторых других соединений для лечения рака и лейкемии у человека.
Азид калия KN3.
Получение. так же, как азид натрия. Впервые азид
калия был получен в 1898 г. путем испарения раствора едкого калия,
нейтрализованного небольшим избытком HN3.
В 1911 г. азид калия был получен при
взаимодействии металлического калия с азидом аммония в жидком аммиаке.
Свойства. KN3
растворяется в воде. В 100 г воды при 10,5 °С растворяется 46,5 г, при 15,5°
С-48,9 г, при 17° С- 49,6 г азида калия.
В 100 г абсолютного спирта при 16° С
растворяется 0,1375 г азида калия. В абсолютном эфире KN3
не растворяется. KN3
хорошо растворяется в аммиаке и в растворе бромистого калия. В жидком SO2
азид калия желтеет и взрывается.
Водный раствор азида калия имеет щелочную
реакцию. По данным Курциуса и Риссома, водный раствор KN3
при выпаривании не выделяет других веществ, по другим данным выделяется HN3.
Температура плавления KN3
приводится разная: 320°С, 343°С и 350°С. При нагревании на металлической
пластинке KN3 плавится,
разлагается при 355-360° С (кипит от обильного выделения азота) и слабо
вспыхивает (горит образовавшийся металлический калий). При нагревании в
капилляре до 350° С азид калия не изменяется, при более высокой температуре
разлагается на металлический калий и азот.
Энергия активации, по литературным источникам,
равна 36,1 ккал/моль и 41,5 ккал/моль.
KN3 нелетуч,
негигроскопичен (за 14 первых суток хранения на воздухе масса увеличивается
только на 0,05%). От удара не взрывается. Плотность KN3
равна 2,038 г/см - 2,056 г/см3 . Q
= 0,33 ккал/моль, Qгидратации =
157 ккал/моль .
Азид калия реагирует с йодом в присутствии
сероуглерода, образуя йодид калия и выделяя азот. При слабом нагревании
двуокиси марганца с азидом калия реакция проходит довольно интенсивно с
образованием манганата калия.
Применение. Для подрыва азида серебра можно
применять бумагу, пропитанную азидом калия. KN3
может быть использован для качественного и количественного определения тория.
Азид рубидия RbN3.
Получение. Получается при обменном разложении
сульфата рубидия Rb2S04
с азидом бария Ва(N3)2.
Свойства. Азид рубидия - одна из наиболее хорошо
кристаллизующихся солей щелочных металлов азотистоводородной кислоты. При
перекристаллизации азида рубидия из воды при медленном "испарении раствора
на воздухе получаются большие пластинки.
Водный раствор RbN3
имеет щелочную реакцию. В 100 г воды при 16° С растворяется 107,1 г RbN3,
при 17° С - 114,1 г. В 100 г абсолютного спирта при 16° С растворяется 0,182 г RbN3.
В абсолютном эфире азид рубидия не растворяется.
Азид рубидия нелетуч, немного гигроскопичен, при
нагревании на металлической пластинке плавится. При дальнейшем нагревании
происходит бурное выделение азота; образовавшийся металлический рубидий слабо
вспыхивает и горит фиолетовым светом.
При нагревании в капилляре азид рубидия
спекается при 280° С, при 330-390° С становится жидким; при более высокой
температуре разлагается, образуя блестящий серебристый налет рубидия. Обычно
считают, что RbN3 от удара
не взрывается. Гюнтер сообщает, что азид рубидия чувствителен к удару падающего
груза. Температура плавления RbN3
в вакууме 260-300° С с выделением азота . Имеются сведения о температуре
плавления в вакууме 395° С.
Плотность RbN3
равна 2,937 г/см3 . При постоянном давлении Qoбp
= 0,07 ккал/моль. Энергия решетки 155 ккал/моль. При термическом разложении RbN3
осадок содержит нитрид рубидия Rb3N
- зеленовато- серый порошок, очень гиргроскопичный.
Азид цезия CsN3.
Получение. Азид цезия может быть также получен
путем нейтрализации 3%-ного раствора HN3
водным раствором чистого CsOH
с последующим концентрированием раствора на паровой бане, подкисле- нии
азотистоводородной кислотой и добавлении к охлажденному на ледяной бане
раствору двух объемов спирта. Осадок после отфильтровывания, промывания спиртом
и эфиром получается в виде мелких игольчатых кристаллов.
Свойства. Очень хорошо растворим в воде. В 100 г
воды при 0° С растворяется 224,2 г, при 16° С - 307,4 CsN3.
В 100 г абсолютного спирта при 16° С растворяется 1,0366 г азида цезия. В
абсолютном эфире не растворяется. Водный раствор имеет щелочную реакцию. Азид
цезия гигроскопичен. После длительного высушивания в эксикаторе над серной
кислотой становится безводным.
При нагревании на металлической пластинке ведет
себя подобно азидам калия и рубидия. В капилляре плавится при 318-320° С. При
дальнейшем нагревании слабо вспыхивает, оставляя серебристый налет цезия.
Теплота образования 2,37 ккал/моль. От удара не взрывается.
Сравнительная таблица
|
Азиды
свойства
|
температура
плавления, ° С.
|
Рас-ть
в воде, (г в 100г воды при комнатной температуре)
|
Энергия
активации, ккал/моль
|
Eкр решётки
|
Теплота
образования, кал/г
|
Плотность,
г/см3
|
|
LiN3
|
245*
|
66,41
|
19,1
|
194
|
|
|
|
NaN3
|
275**
|
41,7
|
10-34
|
|
92
|
1,847
|
|
KN3
|
343
|
49,6
|
41,5
|
|
330
|
2,038
|
330
|
107
|
|
155
|
70
|
2,937
|
|
CsN3
|
326
|
307
|
|
|
2307
|
|
* - со взрывом;
**- с разложением
Применение азидов щелочных металлов и других
азидов
Получение чистых щелочных металлов из азидов
щелочных металлов. Свойство азидов распадаться при нагревании можно
использовать для получения чистейшего азота. Зурман и Клюзиус использовали это
свойство азидов для получения чистейших щелочных металлов - натрия, калия,
рубидия и цезия. Литий они не получали, так как опыты производились в
стеклянном приборе (натрий и калий в приборе из иенского стекла, рубидий и
цезий - из кварцевого, литий же, температура разложения которого ниже своей
температуры плавления, действовал на это стекло). Опыты разложения азидов
производились в высоком вакууме, результаты которых следущие
|
NaN3
|
KN3
|
RbN3
|
CsN.
|
|
Температура
плавления, °С
|
-
|
343
|
330
|
326
|
|
Температура
начала разложения,°С
|
275
|
355
|
395
|
390
|
|
Выход
металла, %
|
100
|
80
|
60
|
90
|
Азид натрия разлагается при температуре ниже
своей температуры плавления. По окончании разложения азидов выделившийся металл
перегоняли и собирали в соответствующем приемнике. Как видно из приведенных
данных, распад азидов на металл и азот не идет количественно, в особенности при
опытах с рубидием получается значительный остаток. Остаток от разложения азида
рубидия, кроме силиката и неразложившегося азида, содержал 80% нитрида рубидия,
остаток от цезия-70% нитрида цезия. Тот факт, что с увеличением относительной
атомной массы металла (до цезия) выход металла уменьшается, объясняется тем,
что прочность щелочных азидов с увеличением атомной массы металла возрастает, а
нитридов падает.
Можно получать небольшие количества калия,
рубидия и цезия разложением их солей металлическим барием, полученным из азида
бария. Для этого каплю раствора азида бария и данной соли помещают в стеклянную
трубку, быстро выпаривают досуха и при легком нагревании в высоком вакууме
разлагают азид бария на металл и азот. Во время нагревания азот откачивают
насосом. После того как азид разложился и выделившийся барий вытеснил металл
взятой соли, стеклянную трубку отделяют от насоса; затем, нагревая выделившийся
металл, перегоняют его в приемник. Для получения цезия берут каплю раствора
хлористого цезия с азидом бария (1,3 г CsCl
и 5 мл 16%-ного раствора Ba(N3)2,
и выпаривают ее при обыкновенной температуре (во избежание гидролиза). При
медленном нагревании азид бария начинает разлагаться при температуре 100° С.
Выделившийся металлический барий вытесняет цезий из его соединения (при 250°С)
и при 350°С реакция кончается.
Подобным образом можно получить металлический
калий и рубидий. Для натрия этот способ не удобен, так как натрий перегоняется
при значительно более высокой температуре.
Этот способ удобнее для получения металлического
цезия и рубидия, чем непосредственное разложение их азидов, так как процесс
идет при значительно более низкой температуре.
Следует так же отметить, что азид натрия может
быть использован для получения нитридов некоторых металлов, таких как нитрид
титана, вольфрама, хрома, молибдена:
+ 4NaN3 +xMe = (x+1)MeN + 2Na2O +
((11- x)/2)N2
Которые в свою очередь применяются как
жаропрочные материалы, и для создания износостойких и декоративных покрытий,
(поверхности «позолоченых» зубных протезов и куполов в церквях сделаны зачастую
из нитрида титана).
Получение других азидов из азида натрия.
Органические азиды. Селективные реакции по
азидным группам органических полиазидов до последнего времени были неизвестны.
Первый азид - фенилазид был получен в 1854 году.
В последующие 100 лет химиками были детально
изучены механизмы многочисленных реакций азидных групп и синтезированы тысячи
разнообразных азидов. Многие из полученных азидов сейчас широко используются в
различных областях науки и техники. Так, в органическом синтезе азиды часто являются
ключевыми исходными соединениями для получения многих, практически важных,
веществ. Высокая противовирусная активность азидов используется в медицине при
лечении СПИДа и злокачественных опухолей. Способность азидов генерировать под
действием света нитрены, легла в основу широкого применения азидов в
электронике в качестве фоторезисторов и в биологии в качестве фотоаффинных
реагентов.
Взрывчатые вещества. Азид свинца впервые получил
французский химик Гиронимус взаимодействием азида натрия с ацетатом свинца.
Осаждающийся при этом продукт на сегодняшний день является наиболее применяемым
инициирующим ВВ.
Азид свинца РЬ(N3)2
- белый или серый мелкокристаллический порошок, темнеющий па свету. Существует
в виде четырёх модификаций, в основном мелких ромбических кристаллов α
и β
формы плотностью соответственно 4,71 и 4,93. Растворим в уксусной кислоте,
моноэтаноламине (145%20); трудно растворим в воде (0,023%18 и 0,09%70), лучше
растворяется в присутствии ацетата свинца; практически не растворим в спирте,
ацетоне и эфире. При кипячении в воде медленно разлагается. В сухом виде
химически устойчив. Не гигроскопичен. При длительном хранении или нагревании
переходит в стабильную α-модификацию.
Термостоек, взрывоопасен выше 250°С. Чувствителен к удару, трению и II огню.
Первичное ВВ.
Температура вспышки азида свинца 327-345°С в
зависимости от скорости нагрева. Это в любом случае значительно выше, чем у
гремучей ртути (180-190°С). По сравнению с ней азид свинца также менее
чувствителен к механическому воздействию.
Азид свинца более стабилен при хранении: даже
трёхлетнее воздействие влаги не снижает его качеств. При содержании 30% воды он
всё еще сохраняет взрывчатые свойства. Во влажном состоянии азид слабо
реагирует с медью, цинком и алюминием, при этом наиболее опасно образование
сверх взрывчатой медной соли. Продукт хорошо переносит многолетнее воздействие
повышенной температуры (50°С). На свету поверхностные слои его кристаллов
теряют азот и покрываются налётом свинца, который предохраняет вещество от
дальнейшего разложения.
Азид свинца не поддаётся перепрессовке и
сохраняет взрывчатые свойства при любой степени сжатия.
По способности инициировать бризантные ВВ он
значительно превосходит гремучую ртуть, поэтому для детонации зарядов
применяется в дозах в 5-10 раз меньших. Однако скорость его детонации несколько
ниже, чем у гремучей ртути 4,5-5,5 км/с. Также он слегка уступает ей по
фугасности (V0 = 308 л/кг) и
теплоёмкости взрыва (Q
= 1500 кДж/кг).
Азид свинца широко используется в качестве
инициирующего ВВ в основном для военных целей: в производстве капсюлей-
детонаторов и в смеси с хлоратами для изготовления фрикционных зажигательных
шнуров.
Азид натрия как один из наименее взрывоопасных,
и то же время дешёвых относительно других азидов, служит основным прекурсором для
получения органических азидов и азидов других металлов (в том числе азида
свинца), поэтому его получение имеет огромное практическое значение.
Специальные способы получения азида натрия
Получение азида натрия и азотистоводородной
кислоты из гидразина и его производных.
Были предложены различные способы получения
азотистоводородной кислоты и ее солей из гидразина. Одни из них представляют
только теоретический интерес, другие имеют практическое значение.
Курциус впервые указал удобный и безопасный, по
его словам способ получения азотистоводородной кислоты для лекционных опытов.
Для этого бурые окислы азота, полученные при действии азотной кислоты на
мышьяковистый ангидрид, пропускают через охлажденный льдом, разбавленный водный
раствор гидразин - гидрата. Деннштедт и Гелих получили азотистоводородную
кислоту при действии нитрита калия на нормальный гидразинсульфат с выходом
около 20% теоретического количества. Сабанеев и Деньгин разработали способы
получения динитрата гидразина и изучили его разложение при 80- •85°С, 100° С и
при нормальной температуре. При 80-85°С N2H4
(HNO3)2 разлагается на
азотистоводородную и азотную кислоты, азот и воду. Остаток, по-видимому,
состоит из основного азотнокислого гидразина и азотнокислого аммония. При
хранении динитрата гидразина при нормальной температуре над серной кислотой
соль разлагается с выделением азотистоводородной кислоты. Большой интерес
представляет работа Танатара (1902 г.), в которой он предлагал получать
азотистоводородную кислоту при действии окислителей на смесь гидроксилмина и
гидразина в водном растворе. По Танатару, в данном случае происходит следующая
реакция
2H4
+ NH2OH
+ 2O = 3H2O
+ HN3
причем окисление идет лучше в кислой среде, чем
в щелочной. В качестве окислителей Танатар применял бромную воду, перманганат
калия, перекись свинца, сурик. Браун и его сотрудники на протяжении нескольких
лет исследовали возможность применения различных окислителей гидразинсульфата в
присутствии серной кислоты для получения азотистоводородной кислоты. Изученные
Брауном и его сотрудниками окислители с точки зрения выхода HN3
могут быть расположены в следующем порядке

Технические способы получения азида натрия из
гидразина и его производных
В 1908 г. Тиле предложил получать азид натрия из
гидразингидрата (или сульфата) при действии на него этилнитритом в присутствии
щелочи
N2H4*H2O + C2H5ONO + NaOH = NaN3 +
C2H6OH + 3H20. (1)
Полученная смесь подкислялась, отгонялась
азотистоводородная кислота и поглощалась 10%-ным раствором едкого натра.
Полученный раствор азида натрия выпаривался досуха. Выход достигал 77-78 %.
Во время первой мировой войны по заданию Морской
научно- технической лаборатории преподаватели Петроградского университета Б. П.
Орелкин, В. Г. Хлопин и И. И. Черняев в лабораторных условиях приготовляли азид
натрия по несколько видоизмененному способу Тиле (без дистилляции
азотистоводородной кислоты), а гидразин - по способу Рашига. Необходимый для
реакции этилнитрит они готовили путем взаимодействия этилового спирта и азотистой
кислоты
С2Н6ОН + HONO
= Н2O + C2H6ONO
Этилнитрит - жидкость плотностью 0,90,
температура кипения 17° С, хорошо растворяется в спирте, не растворяется в
воде.
Для получения азида натрия Орелкин и др.
помещали молекулярную смесь гидразингидрата и щелочи (1,5 л) в сухую
пятилитровую банку с пришлифованной пробкой. Затем смесь охлаждали льдом, а
когда температура понижалась до 0-5° С, наливали тонкой струей, перемешивая
стеклянной палочкой, 250 мл этилнитрита, после чего быстро приливали 1,5 л
эфира, закрывали банку пробкой, несколько раз встряхивали (осторожно
приоткрывая банку после каждого встряхивания) и оставляли смесь стоять 12 ч во
льду и затем еще 12 ч при нормальной температуре. Азид натрия выделялся при
этом в виде белой мелкокристаллической массы. Жидкость с осадка сливали в
воронку Бюхнера, а остаток промывали декантацией смесью спирта с эфиром,
переносили в воронку, отсасывали, промывали два раза спиртом и 2-3 раза чистым
эфиром. После этого азид натрия сушили и получали продукт с содержанием азида
натрия от 93 до 96% (в зависимости от степени чистоты гидразинсульфата). Выход
азида натрия на гидразин составлял 90-95%.
Метод Тиле получения азида натрия из гидразина
долго не находил заводского применения, главным образом, из-за дефицитности и
дороговизны гидразина.
В настоящее время производство гидразина в
промышленном масштабе значительно увеличилось, качество его улучшилось, что
позволяет выпускать гидразин по значительно более доступной цене.
Таким образом, организация производства азида
натрия из гидразина в современных условиях вполне может конкурировать с
производством азида натрия по методу Вислиценуса (из закиси азота и амида
натрия). В настоящее время в ряде стран в производственных условиях готовят
азид натрия из гидразина.
Способ Штолле аналогичен способу Тиле с той лишь
разницей, что вместо этилнитрита берется амилнитрит, получающийся
взаимодействием изоамилового спирта и нитрита натрия:
С5Н11ОН + NaNO2
+ НСl = C6H11ONO
- NaCl + H2O.
Одним из более поздних является способ получения
азида натрия из гидразина, предложенный Штаудингером в 1913 г. Он отличается от
предыдущих тем, что в качестве окислителя гидразина берется не соль или эфир
азотистой кислоты, а нитрозосоединение. Наиболее удобен дифенилнитрозоамин -
продукт нитрозирования дифениламина. Реакция взаимодействия протекает в
спиртово-щелочной среде:
Дифенилнитрозоамин получается при взаимодействии
спиртового раствора дифениламина с нитритом натрия в кислой среде
(C6H6)2NH + NaNO2 + НС1
= (C6H6)2N-NO + NaCl + H2O
Способ Штаудингера выгодно отличается от способа
Штолле тем, что применение дифениламина дешевле и удобнее, чем амилового
спирта.
Азид натрия можно также получить из производного
гидразина - семикарбазида
NH2-СО-NHNH2
Процесс получения азида натрия из семикарбазида
может быть выражен следующими реакциями:
CONHNH2 + НОNO
= 2Н2O
+ H2NCON3;NCON3 + NaOH = NaN3 + CO2 + NH3.
Для получения семикарбазида можно использовать
работы Тиле по получению нитромочевины и работы ряда авторов по
электровосстановлению нитромочевины до семикарбазида
N-CO-NH2 H2NCONH2HNO3 H2NCONHNO2
H2NCONHNH2.
Нитромочевина приготовляется из азотнокислой
мочевины, получаемой при взаимодействии мочевины и азотной кислоты.
При загрузке азотнокислой мочевины в 95%-ную
серную кислоту происходит реакция дегидратации с образованием при этом
нитромочевины:
2NCONH2HNO3
H2NCONHNO2.
Азид карбаминовой кислоты H2NCON3
- кристаллическое вещество с температурой плавления 94° С. При нагревании с
водой он гидролизуется с образованием аммиака, азотистоводородной кислоты и
углекислоты
NCON3 + Н2O
= СO2
+ NH3 + HN3
При действии щелочей на водные растворы азида
карбаминовой кислоты при нагревании образуется азид натрия
NCON3 + NaOH + СO2
+ NHS + NaN3
Аналогично описанному способу получения азида
натрия из мочевины можно получить азид натрия из азотнокислого гуанидина по
следующей схеме:
2N-С-NHNH2*HNO3
H2NCNHNHNO2
H2NCNHNHNH2
NaN3 + NaHCNH2
+ H2O
Получение азида натрия из закиси азота и амида
натрия
В 1892 г. Вислиценус взял патент на новый способ
получения азотистоводородной кислоты. Его способ основывается на конденсации
закиси азота с аммиаком. Однако, как указано в патенте, эти газы
непосредственно друг на друга не действуют. Соли азотистоводородной кислоты
образуются при пропускании закиси азота над более или менее нагретым амидом
металла. Например, амид натрия реагирует по следующему уравнению:
2 + N2O
= NaN3 + Н2O
Так как согласно этому уравнению образуется
вода, которая затем реагирует с амидом натрия, то наиболее точно реакция будет
выражаться следующим уравнением:
NaNH2 + N2O = NaN3 + NaOH + NH3.
Процесс получения азида натрия из закиси азота и
амида натрия, принятый в большинстве стран, состоит из получения закиси азота,
амида натрия и азида натрия.
Закись азота N2O
впервые была получена в 1776 г. Пристлеем и в чистом виде в 1799 г. Дэви,
который открыл ее опьяняющее действие и назвал ее «веселящим газом».
Получение закиси азота. Закись азота -
бесцветный газ с особым слабым характерным приятным запахом. Масса 1 л при 0°С
и давлении 760 мм рт. ст. равна 1,977 г. Закись азота хорошо растворяется в
холодной воде, хуже - в нагретой. В 100 объемах воды при 0° С растворяется
130,5, при 10° С - 92,0, при 15° С - 77,8, при 20° С- 67,0 и при 25° С - 59,6
объема закиси азота.
В производственных условиях закись азота
получают при разложении нитрата аммония.
4NO3
= Na2O
+ 2Н2O
Расплавленный нитрат аммония при нагревании выше
250-260° С может выделять окислы азота, азот и воду:
NO3 = 0,5N2 + NO + 2Н20;
NH4NO3 = 3N2 + N204 + 8H20;
3NH4NO3
= 2N2 + N203
+ 6H20.
Для нормального процесса образования закиси
азота путем разложения нитрата аммония его, температурный режим и степень
чистоты имеют исключительное значение.
Разложение аммонийной селитры производится в
цилиндрических алюминиевых аппаратах. Сырой газ, полученный при разложении
селитры, по газопроводу направляется в холодильник, охлаждаемый проточной
водой. В холодильнике конденсируются пары воды, частично растворяющие в себе
окислы азота и азотную кислоту. Азотная и азотистая кислоты с аммиаком образуют
нитраты и нитриты аммония, их растворы в воде через сифон стекают в
канализацию.
После холодильника сырая закись азота для
очистки от других окислов азота направляется в специальные установки.
Амид натрия получают пропусканием аммиака при
нагревании до 360°С над металлическим натрием, предварительно очищенным от
керосина:
Na + 2NH3
= 2NaNH2 + Н2 + 42 ккал
Азид натрия получается при взаимодействии закиси
азота и амида натрия в специальных азидных аппаратах:
NaNH2 + N2O = NaN3 + NaOH + NH3
На выход азида натрия влияет качество
применяемой закиси азота и режим ее подачи. Было установлено, что с увеличением
процента закиси азота в газе и уменьшением содержания воздуха скорость реакции
азидирования и выход продукта возрастает. При работе с 20%-ной закисью азота
выход азида натрия уменьшается в 2,5-3 раза.
Так же существует жидкофазный способ получения
азида натрия. В способе используется реакция Вислиценуса, с существенным
отличием в том, что все реакции проходят при низкой температуре в среде жидкого
аммиака. Амид натрия в этом случае получается растворением натрия в жидком
аммиаке. По окончании реакции амидирования образуется суспензия амида натрия в
избытке аммиака. Как показали опыты, эта суспензия довольно легко реагирует с
закисью азота с образованием азида.
Реакция сложная и идёт в несколько стадий. В
конечном итоге отделить полученный азид от щёлочи можно легко, т.к. в жидком
аммиаке щёлочь практически не растворима, а азид натрия хорошо растворим.
Получение азида натрия из закиси азота и амида
натрия непрерывным путём. Сущность метода сводится к следующему.
Расплавленный металлический натрий вводится
непрерывно и равномерно в реакционную ванну, в которой продукты находятся в
непрерывном движении. В эту ванну вводится газообразный аммиак.
Из реакционной ванны расплавленный амид натрия
вытекает в соответствии с поступлением в ванну металлического натрия. Амид
натрия поступает в ступенчатую мельницу, и одновременно в нее вводится закись азота.
Амид натрия, вступивший во взаимодействие с закисью азота, измельчается в
мельнице при помощи шариков или вмонтированных вставок. При переходе со ступени
на ступень амид натрия постепенно превращается в азид натрия и щелочь.
Методика зачётного синтеза.
Сульфат гидразиния (N2H6)SO4


В коническую колбу на 1 л помещают 200 мл
20%-ной аммиачной воды (10,8 моль/л), 5 мл 1%-ного раствора клея или желатины и
затем 100 мл 1 н. раствора NaOCl.
Раствор гипохлорита готовят пропусканием хлора в 5%-ный раствор едкого натра до
достижения рассчитанного привеса*. Смесь быстро нагревают до кипения и кипятят
30 мин, причем весь избыточный аммиак улетучивается, а раствор упаривается
приблизительно наполовину. После охлаждения раствор нейтрализуют сериой
кислотой до рН 7-8 и оставляют стоять некоторое время до выделения серых
хлопьев. Затем фильтруют, и фильтрат сильно подкисляют серной кислотой.
Оставляют на ночь для кристаллизации, на следующий день сульфат гидразиния
отсасывают и промывают ледяной водой. Он получается уже довольно чистым, но его
можно дополнительно очистить перекристаллизацией из кипящей воды. Проба не
должна давать остатка при прокаливании. Выход: 40-50%, считая на хлор.
Раствор необходимо при этом охлаждать до 0 °С..
Вместо раствора клея или желатины предложено
применять хелатообразователь (например, этилендиаминтетрауксусную кислоту),
дающий в воде истинный раствор и связывающий ионы тяжелых металлов, которые
могут катализировать расщепление промежуточно образующегося монохлорамииа.
Однако этот способ дает выход лишь около 20%, так как клей дополнительно
катализирует образование гидразина из NH2CI
и NH3.
Свойства. Толстые блестящие пластинки или
призмы, труднорастворимые в холодной воде (при 22°С 3,05 г в 100 мл воды). В
горячей воде легко растворяется, гидролизуясь до N2H5+
и Н30+; не растворяется в спирте. 4л 254 °С (с разл.).
Заключение
В ходе работы были исследованы свойства азидов
щелочных металлов, основные направления их применения. Все азиды щелочных
металлов имеют некоторые похожие качества, однако, имеют и некоторые
индивидуальные черты. Значение азидов в подрывном деле и химической
промышлености трудно переоценить, практически ни одно военное действие не
обходится без азида свинца, органическая химия азидов постоянно развивается.
Были рассмотрены основные методики синтеза азида натрия, предложенные
различными учёными: получение азида натрия из гидразина и его производных,
получение азида натрия из закиси азота и амида натрия, с разными
технологическими особенностями.
Список используемой литературы
1. Чувурин
А.В. занимательная пиротехника: Опасное знакомство; в 2 ч. Ч.1/ А.В. чувурин -
Харьков: Основа, 2003. - 360 с.
. Багал
Л.И. Химия и технология инициирующих взрывчатых веществ/ Л.И. Бакал - Москва:
Машиностроение, 1975. - 456c.
. Ахметов
Н.С. общая и неорганическая химия. Учебное пособие для вузов./Н.С. Ахметов - 4
изд. - Москва: высшая школа, Изд. центр Академия, 2001. - 743с.
. Угай
Я.А. общая и неорганическая химия/ Я.А. Угай - Москва: высшая школа, 1997. -
527с.
. Гринвуд
Н. химия элементов в 2-х т. Т. 1./Н. Гринвуд, Эрншо А., 2008. 601с.
. Химическая
энциклопедия в 5-и т.: Т.1./ под ред. И.Л. Клуньянца (гл. ред) и др.- Москва,
советская энциклопедия, 1988 - 623с.
. Шиганова
Л.А. самораспространяющийся высокотемпературный синтезмикро- и нанопорошков
нитридов титана, хрома, молибдена и вольфрама с применением азида натрия и
галогенидов/Шиганова Л.А. - Самара, 2010. -22с.
. Чапышев,
С.В. Селективные реакции азидных групп, синтез и свойства высокоспиновых
нитренов/ Чапышев С.В. - Москва, 2004. - 38с.