Лекарственные растения и сырье, содержащие простые фенолы
Оглавление
Введение. Общая характеристика простых фенольных соединений
.1 Понятие о простых фенольных соединениях
.2 Классификация фенольных соединений
.3 Физико-химические свойства простых фенольных соединений
.4 Методы выделения и идентификации простых фенольных соединений
.5 Биосинтез фенольных соединений
.6 Качественное определение
.7 Количественное определение
.8 Фармакологическое действие. Применение
.9 Препараты, ЛС, содержащие простые фенольные соединения. ЛР и
ЛРС, содержащие простые фенольные соединения
.1 Листья брусники - Folia Vaccinii vitisidaeae
.2 Листья толокнянки (медвежье ушко) - Folia Uvae ursi (Folia
Arctostaphyli uvae-ursi)
.3 Корневища мужского папоротника - Rhizomata Filicis maris
.4 Корневища и корни родиолы розовой - Rhizomata et radices
Rhodiolae roseae
Заключение
Список литературы
Введение
Фармакогнозия - одна из
фармацевтических наук, изучающая лекарственные растения, лекарственное сырье
растительного и животного (некоторые группы) происхождения и некоторые продукты
первичной переработки растений и животных.
Особое значение приобрели растения,
в том числе лекарственные, содержащие фенольные соединения.
В настоящее время доказано, что все
фенольные соединения, за небольшим исключением, являются активными метаболитами
клеточного обмена и играют большую роль в различных физиологических процессах -
фотосинтезе, дыхании, росте, устойчивости растений к инфекционным болезням. О
важной биологической роли полифенолов свидетельствует характер их распределения
в растении. Больше всего их содержится в активно функционирующих органах -
листьях, цветках (придают им окраску и аромат), плодах, ростках, а также в
покровных тканях, выполняющих защитные функции. Разные органы и ткани
отличаются не только количеством полифенолов, но и качественным их составом.
Объектом данного исследования
является ассортимент лекарственных препаратов, лекарственных растений и ЛРС,
содержащих простые фенольные соединения.
Целью работы являются изучение
лекарственных растений, содержащих простые фенольные соединения.
Задачи данного исследования
заключается в:
Изучение научной литературы по теме
простые фенольные соединения;
Изучение лекарственных растений,
содержащих простые фенольные соединения;
Изучение макро- и микроскопию ЛРС,
содержащих простые фенольные соединения;
Ознакомление с химическим составом
растений;
Изучение числовых показателей,
подтверждающих качество ЛРС;
Ознакомление с фармакологическим
действием и медицинским применением лекарственных растений;
Научиться определять подлинность
ЛРС, предложенного для анализа.
I. Общая характеристика простых
фенольных соединений
.1 Понятие о простых фенольных
соединениях
Фенолы - ароматические соединения,
которые имеют бензольное ядро с одной или несколькими гидроксильными группами.
Фенольные соединения с одной ОН-группой называют монофенолами, с двумя
ОН-группами - дифенолами, с тремя и более ОН-группами - полифенолами. [12]
К этой группе относят фенольные
соединения со структурой С6, С6-С1, С6-С2. Простейшие фенольные соединения с
одним бензольным кольцом и одной или несколькими гидроксильными группами
(например, фенол, катехол, гидрохинон, пирогаллол, флороглюцин и др.) в
растениях встречаются редко. Чаще всего они находятся в связанном виде (в форме
гликозидов или сложных эфиров) или же являются структурными единицами более
сложных соединений, в том числе полимерных (флавоноиды, лигнаны, дубильные
соединения и пр.).
Наиболее широко в растениях
представлены фенологликозиды - соединения, в которых гидроксильная группа
связана с сахаром. Простейшими формами такой комбинации являются
фенил-О-гликозиды. [1]
Фенолгликозидами называется группа
гликозидов, агликоном которых являются фенолы, оказывающие дезинфицирующее
действие на дыхательные пути, почки и мочевые пути. Фенольные соединения
содержат ароматические кольца с гидроксильной группой. В этих соединениях
сахара соединены с производными фенола [15].
Соединения, содержащие в
ароматическом кольце больше одной гидроксильной группы, называются
полифенолами. Они встречаются в различных частях многих растений - листьях,
цветках (придают им окраску и аромат), плодах.
В природе распространены довольно
широко. Встречаются в семействах ивовых, брусничных, камнеломковых,
толстянковых и др [10].
.2 Классификация фенольных
соединений
В зависимости от характера
заместителей в бензольном кольце фенологликозиды можно разделить на 3 группы:
группа: С6 - ряда
) одноатомные фенолы
простые фенолы (монофенолы) -
моногидроксипроизводные - встречаются в растениях нечасто.
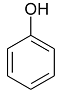
Фенол
Сам фенол обнаружен в иглах и шишках
Pinus silvestris, эфирных маслах листьев Nicotiana tabacum, Ribes nigrum,
лишайниках.
) Дигидроксипроизводные -
двухатомные фенолы (дифенолы)
а) Пирокатехин (1,2-диоксибензол)
найден в листьях эфедры, чешуе лука, плодах грейпфрута (рис. 1.2.1).
б) Из диоксибензолов наиболее
распространен гидрохинон (1,4-диоксибензол) (рис.1.2.2).
Его гликозид арбутин (рис. 1.2.3),
содержащийся в представителях семейств: Ericaceae (листьях толокнянки),
Vacciniaceae (брусники), Saxifragaceae (бадана).
Наряду с арбутином в этих растениях
присутствует метиларбутин (рис. 1.2.4) Агликоном его является метилгидрохинон
в) Резорцин (1,3-диоксибензол) (или
м-диоксибензол) (рис. 1.2.5) содержится в различных естественных смолах,
таннинах.
)Трехатомные фенолы (трифенолы).
Представителем триоксибензолов
является флороглюцин (1,3,5-триоксибензол) (рис. 1.2.6), в свободном виде он
обнаружен в шишках секвойи и чешуе лука, а в виде гликозида флорина - в
околоплоднике плодов разных видов цитрусов.
Более сложные соединения -
флороглюциды (гликозиды флороглюцина), они могут содержать одно кольцо
флороглюцина (аспидинол) (рис. 1.2.7) или представляют собой димеры или тримеры
(кислоты флаваспидиновая и филиксовая).
Значительные количества
флороглюцидов накапливается в корневищах мужского папоротника.
группа:
С6 - С1 - ряда - Фенолкарбоновые
кислоты
Фенолокислоты широко распространены
в растениях, но не являются в них основными биологически активными веществами,
это типичные сопутствующие вещества, участвующие в лечебном эффекте суммарных
препаратов.
Широко распространены в растениях
семейств: бобовые, сумаховые, фиалковые, брусничные.
Широко распространена
n-гидроксибензойная кислота (рис. 1.2.8).
Например, пирокатеховая кислота
(рис. 1.2.9) характерна для покрытосеменных.
Галловая кислота (рис. 1.2.10) может
накапливаться в значительных количествах (в листьях толокнянки)
группа:
С6- С2 - ряда - Фенолоспирты и их
гликозиды содержатся в родиоле розовой
Салидрозид и салицин.
Агликоны этих гликозидов
4-оксифенилэтанол и 2-оксифенилметанол (салициловый спирт). Наряду с фенольными
гидроксилами эти агликоны имеют спиртовые гидроксильные группы, и
гликозидирование их может быть по фенольным и спиртовым группам:
Салициловый спирт (рис. 1.2.11)
Салицин (рис. 1.2.12) получил из
коры ивы французский ученый Леру в 1828 г. Много его в листьях и побегах
толокнянки, брусники, груши, бадана. Часто в растениях ему сопутствует
метиларбутин.
группа:
С6-С3 - ряд Гидроксикоричные кислоты
(коричная, оксикоричная, кофейная (рис. 1.2.14), феруловая, синаповая,
хлорогеновая и др.), имеющиеся практически в каждом растении, являются
метаболитами, принимающими активное участие в биосинтезе различных других
фармакологически активных соединений. Хлорогеновая кислота содержится в зеленых
зернах кофе (6%), листьях табака (8%); розмариновая кислота впервые была
найдена в розмарине лекарственном, но встречается и в других представителях
губоцветных. Предшественником оксикоричных кислот является фенилаланин.
Оксикоричные кислоты обладают антимикробной и антигрибковой активностью,
проявляют антибиотические свойства. Оксикоричные кислоты и их эфиры обладают
направленным действием на функцию почек, печени, мочевыводящих путей.
Содержатся в траве хвоща полевого, зверобоя, цветков пижмы, бессмертника
песчаного. [15, 22].
.3 Физико-химические свойства
простых фенольных соединений
Выделенные в чистом виде фенольные
гликозиды - это белые кристаллические вещества, растворимые в воде, этиловом
спирте, нерастворимые в этиловом эфире и хлороформе. Отличаются оптической
активностью, способны к гидролизу при нагревании с минеральными кислотами.
Химические свойства простых фенолов
обусловлены наличием:
ароматического кольца
фенольного гидроксила
карбоксильной группы
гликозидной связи.
Для фенольных соединений характерны
химические реакции:
. Подвергаются реакции гидролиза (за
счет гликозидной связи) с кислотами, щелочами, ферментами.
. Фенольные гликозиды легко
окисляются, особенно в щелочной среде (даже кислородом воздуха) с образованием
соединений хиноидной структуры.
. Фенольные соединения, обладая
кислотными свойствами, образуют со щелочами растворимые в воде феноляты.
. Образуют с ионами металлов (Fe,
Pb, Al, Mo, Cu, Ni) окрашенные комплексные соединения.
. Вступают в реакции азосочетания с
солями диазония, образуя азокрасители от оранжевого до вишнево-красного цвета.
. Фенолкарбоновые кислоты образуют
сложные эфиры (депсиды). [15, 22].
При гидролизе фенольных гликозидов
образуются различные типы фенолов: арбутин (образуется гидрохинон), салицин
(орто- гидроксибензиловый спирт), хелицин и спиреин (салициловый альдегид),
геин (эвгенол) и т.д [15, 22].
Фенольные гликозиды, со свободной
гидроксильной группой дают все реакции, характерные для фенолов (реакция с
железоаммониевыми квасцами, диазотирования и др.) [15].
Первый фенолгликозид, выделенный из
растений - салицин (рисунок 1.2.1)- представляет собой глюкозид салицилового
спирта. Его получил из коры ивы французский ученый Леру (1828) [15].
Салицин С13Р18О7 (рис. 1.2.12) -
кристаллический глюкозид, горького вкуса, нейтральной реакции, трудно
растворяется в холодной воде и спирте, легче в горячей воде и горячем алкоголе
[15, 22].
Арбутин (риc. 1.2.3) (арбутозид, или
эриколин)- гликозид фенольного типа, состав С12Н16О7•Ѕ Н2О, (бета- D-
глюкопиранозид), принадлежит группе арил - бета - гликозидов (производное
гидрохинона). Молекулярная масса 272.251 [15].
Название по номенклатуре IUPAC: (2R,
3S, 4S, 5R, 6S) - 2 гидроксиметил-6- (4- гидроксифенокси) оксан-3,4,5- триол.
Другие названия: арбутозид, вакцинин, гидрохинон- в-D- глюкопиранозид [15, 22].
Арбутин - горькое вещество, легко
растворимое в горячей воде. Кристаллизуется в виде длинных, шелковистых игл.
Температура плавления- 170є С (по другим источникам - 199.5єС) [15].
С хлорным железом дает голубое
окрашивание; разведенной серной кислотой гидролизуется с образованием сахара и
гидрохинона [15, 25].
В 1967 году при изучении химического
состава родиолы розовой и родиолы четырехчленной были выделены тирозол и
родиолозид (рис. 1.2.13) [15].
Позднее оказалось (Thieme, 1969),
что родиолозид сходен с гликозидом салидрозидом, выделенным Bridel и Beguin в
1926 году из ивы трехтычинковой (Salix triadra L., Salicaceae), и
идентифицированным (1964,1965) как 2-[4- оксифенил] - этанол -1- в-
D-гликопиранозид [25].
Родиолозид легко растворим в воде,
низших спиртах, растворим в ацетоне, пиридине, плохо в диэтиловом эфире,
хлороформе, этилацетате и не растворим в бензоле, петролейном эфире. С
раствором хлорного железа родиолозид дает сине-фиолетовое окрашивание; как и
тирозол, он вступает в реакцию с 1,2-нитрозанафтолом в присутствии азотной
кислоты с образованием продуктов красно- оранжевого цвета (реакция специфична
для паразамещенных фенольных соединений). При хроматографировании на тонком
слое окиси алюминия Rf=0.48-0.49 (система n-бутанол-этанол-вода 5:1:2), при
хроматографировании на бумаге Rf=0.68 (система n-бутанол-этанол-вода 5:1:2) и
Rf=0.67 (система бутанол-уксусная кислота-вода 4:1:5) [25, 3].
Кониферин (С16Н22О8хН2О) фенольный
гликозид. При ферментативном гидролизе распадается на глюкозид и конифериловый
спирт С10Н12О3 - один из исходных продуктов при биосинтезе лигнина. [15, 14].

Открыт Hartigom в камбальном соке
Larix europaea, находится также в соке хвойных растений вообще. Найден также в
свекловице и спарже. Белое кристаллическое вещество, Слабо растворим в
холодной, хорошо в горячей воде и спирте. Точка плавления 185єС. Водный раствор
имеет горький вкус. Вращает влево (б) D20= -66,9. Не действует на Фелингову
жидкость. Растворяется в концентрированной серной кислоте с красным цветом; при
прибавлении воды раствор дает смолу индиго - синего цвета. С фенолом и
концентрированной соляной кислотой, особенно на солнечном свете, окрашивается в
густой синий цвет. [25].
.4 Методы выделения и идентификации
простых фенольных соединений
Фенольные гликозиды из растительного
материала извлекают этиловым и метиловым спиртами (96, 70 и 40°). В дальнейшем
очистку спиртовых извлечений ведут общепринятым для гликозидов методом [25, 3,
18, 27].
Выделение индивидуальных соединений
приводят, как правило, методом адсорбционной хроматографии на полиамиде,
силикагеле, целлюлозе. В качестве элюирующих смесей используется вода и водный
спирт, если адсорбентом служит полиамид или целлюлоза, либо различные смеси
органических растворителей для всех перечисленных адсорбентов [15, 3, 18].
Фенольные гликозиды в лекарственном
растительном сырье могут быть идентифицированы хроматографией в тонком слое
сорбента или на бумаге [15, 25, 3, 18].
Для хроматографирования в тонком
слое сорбента используют системы растворителей: 1) n-бутанол - уксусная кислота
- вода (4:1:5); 2) n-бутанол - уксусная кислота - вода-ксилол (6:2:3:4);
3)хлороформ - метиловый спирт (8:2) [15, 25, 3, 18].
При хроматографии на бумаге
используют 5, 10 и 15% - ную уксусную кислоту [15].
Для индивидуальных веществ
определяют t-плавления, удельное вращение, снимают УФ, ИК спектры [15, 25, 18,
27].
Рассмотрим УФ и ИК спектры на
примере арбутина. В связи с наличием в молекуле фенольных гликозидов
ароматических С-С связей фенольные гликозиды имеют макисмум поглощения в УФ
спектре при 270-300 нм. Максимум поглощения арбутина находится при 287 нм (в
составе арбутина есть остаток гидрохинона с достаточной сопряжённой системой) и
может быть использован как для качественной характеристики, так и
количественного определения арбутина а растительном материале. При анализе
УФ-спектров у растений, содержащих арбутин можно отметить, что на них
присутствуют 2 максимума поглощения, характерных для данного соединения при 220
и 284 нм, причем интенсивность (выраженность) пиков соответствует содержанию
арбутина в исследуемых видах. Например, при исследовании толокнянки, брусники,
зимолюбки, черники и голубики, наибольшая интенсивность пика при 220 нм
характерна для толокнянки, брусники и зимолюбки, менее выражены пики в этой
области для черники и голубики (рис. 1.4.1) [25, 18].
В ИК спектре арбутина имеются
характерные полосы при 3200- 3400 см -1, обусловленные наличием спиртовых и
фенольных гидроксильных групп; полоса 1515,1460, 1440 см-1 типична для С=С-
связей. Имеется ряд полос в области 800-1300 см-1 (область “отпечатка
пальцев”). Совпадение спектров исседуемого гликозида со спектром достоверного
образца указывает на идентичность соединения. Для идентификации фенольных
гликозидов широко используются химические превращения, анализ, ацетилирование,
метилирование и т.д. и сравнение продуктов превращения с литературными данными
для предполагаемого гликозида [8].
Также сейчас распространяется
идентификация фенолгликозидов с помощью метода ВЭЖХ [5, 26]. На рисунке (рис.
1.4.2) показана ВЭЖ-хроматограмма водного экстракта зимолюбки зонтичной, на
которой по УФ-спектрам в сравнении с достоверным образцом идентифицирован
арбутин. В данном конкретном случае, анализ проводился на высокоэффективном
жидкостном хроматографе «Миллихром-А-02» с последующей компьютерной обработкой
результатов исследования с помощью программы МультиХром-СПЕКТР для Windows. В
качестве неподвижной фазы использовали колонку ProntoSIL 120-5-C18 AQ, №80303
размером 2,0Ч75 мм, размер частиц - 5,0 мкм; в качестве подвижной фазы - [4M
LiClO4+0,1M HClO4]: H2O в соотношении 5:95. Скорость подачи элюента - 100,00
мкл/мин. Температура - 40 °C. Давление - 2,0 MPa. Продолжительность анализа -
115 мин. Параллельно с испытуемым раствором в хроматограф вводились растворы
достоверных образцов арбутина, гидрохинона и рутина. Детектирование данных
веществ проведены по УФ-спектрам при длинах волн 210-300 нм.
Существенную практику препаративного
выделения индивидуальных растительных соединений из-за трудоемкости
технологических приемов и высокой себестоимости конечного продукта следует
считать оправданной при наличии в них преобладающих компонентов [16].
1.5 Биосинтез фенольных соединений
фенольный фармакологический
лекарственный
Биосинтез у различных групп
фенольных соединений протекает по одной и той же принципиальной схеме, из общих
предшественников и через сходные промежуточные продукты. Все фенольные
соединения в растениях образуются из углеводов (ацетатно-малонатный путь) и
продуктов их превращения и в процессе биосинтеза проходят шикиматный путь.
Биосинтезу многих фенольных соединений предшествует образование аминокислот -
L-фенилаланина и L- тирозина. Фенольные соединения образуются двумя путями.
Ацетатно-малонатный путь (схема
1.5.1) установлен американскими учеными Берчем и Донованом в 1955 году.
Предшественником является уксусная кислота, которая образуется из сахаров. В
результате ступенчатой конденсации остатков уксусной кислоты образуются
поликетометиленовые кислоты. Присоединение происходит по типу «голова» -
«хвост» при обязательном участии фермента Коэнзима А с промежуточным
образованием ацетил-Коэнзима А, а затем малонил-Коэнзима и поэому называют
ацетатно-малонатный путь). Циклизация поликетонов идет под действием фермента
синтетазы.
Если наращивать цепочку до 16-ти
углеродных атомов (8 остатков уксусной кислоты) образуется ядро антрацена.
По ацетатно-малонатному пути идет
биосинтез простых фенолов и производных антрацена в грибах и лишайниках;
антрахинонов группы хризацина колец А и С антрахинонов группы ализарина в
высших растениях; кольца В молекуле флавоноидов, госсипола, содержащегося в
коре корней хлопчатника.
Шикиматный путь (схема 1.5.2).
Подавляющее большинство растительных фенольных соединений связано
биогенетическим родством. В обширную группу вторичных веществ фенольной природы
входит более десяти классов различных по строению основного углеродного скелета
природных соединений. В свою очередь, каждый из этих классов объединяет сотни
или даже тысячи индивидуальных веществ с существенными отличиями в характере
заместителей и их расположению в молекуле (гидроксидные группы, остатки
сахаров, органические кислоты и другие заместители). Они составляют одно
большое семейство веществ единого «метаболического» происхождения. Обусловлено
это тем, что основной структурный элемент всех фенольных соединений - бензольное
кольцо - образуется в растениях, как правило, по так называемому шикиматному
пути. Синтезированный таким образом фрагмент ароматической структуры является
той базовой единицей, из которой путем разных дополнительных превращений
образуются почти все фенольные соединения растений. Лишь у ограниченного числа
растительных фенолов ароматические кольца синтезируются по другому механизму -
путем поликетидной конденсации ацетатных единиц.
Исходными компонентами в
формировании ароматического ядра по шикиматному пути (схема 1.5.2) являются
фосфоенолпируват, образующийся при гликолитическом распаде глюкозы, и
эритрозо-4-фосфат - промежуточный продукт окисления глюкозы по
пентозо-фосфатному пути. При их конденсации образуется семиуглеродное
соединение - кислота 7-фосфо-3-дезокси-D-арабиногептулозоновая, которое затем
подвергается циклизации, превращаясь в кислоту 3-дегидрохинную. На следующей
стадии кислота 3-дегидрохинная теряет воду и превращается в кислоту
3-дегидрошикимовую и далее под влиянием фермента оксидоредуктазы - в кислоту
шикимовую - одно из важнейших промежуточных соединений пути, за что тот и
получил свое название.
Кислота шикимовая по структуре
близка ароматическим соединениям, однако ее шестичленное углеродное кольцо
содержит только одну двойную связь. Дальнейшие преобразования этого кольца
начинаются с фосфорилирования кислоты шикимовой по 3-му углеродному атому, а
затем к фосфорилированной кислоте присоединяется молекула фосфоенолпирувата -
получается 5-енолпирувилшимикат-3-фосфат.
Последнее соединение претерпевает
далее дефосфорилирование и дегидратацию, что приводит к образованию кислоты
хоризмовой - другого важного промежуточного соединения, которое в своем кольце
имеет уже две двойные связи.
На этой стадии происходит
разветвление шикиматного пути. По одному направлению из кислоты хоризмовой
образуется L-триптофан (и далее индольные производные), по другому -
L-фенилаланин и L-тирозин. Именно с последним ответвлением сопряжены дальнейшие
превращения, которые в конечном счете приводят к образованию в растительных
клетках фенольных соединений.
Начинается этот процесс с
превращением кислоты хоризмовой в кислоту префеновую. Последняя подвергается
либо дегидратации, сопровождающейся декарбоксилированием, либо окислительному
декарбоксилированию. В первом случае из кислоты префеновой образуется
фенилпировиноградная, в другом - кислота n-гидроксифенилпировиноградная. Далее
следует аминирование этих кетокислот с образованием соответственно
L-фенилаланина и L-тирозина [18].
Однако указанные трансформации могут
совершиться и в другой последовательности. Аминирование может иметь место уже
на стадии кислоты префеновой с преобразованием ее сначала в кислоту
L-арогеновую. Лишь затем молекула подвергается дегидратации с
декарбоксилированием или окислительному декарбоксилированию, в результате
которых образуется L-фенилаланин и L-тирозин.
Формированием этих двух
ароматических аминокислот построение бензольного кольца завершается.
Заканчивается и весь шикиматный путь, который как источник указанных
аминокислот фактически представляет собой одну из составных частей первичного
метаболизма клетки. Специфические вторичные превращения, ведущие к биосинтезу
фенольных соединений, начинаются только после этой стадии метаболизма, причем
они берут начало от одного единственного продукта шикиматного пути -
L-фенилаланина. [17]
.6 Качественное определение
Фенольные гликозиды, имеющие
свободную гидроксильную группу, дают все реакции, характерные для фенолов,
например, с железоаммониевыми квасцами, реакцию диазотирования и др.
В случае если фенольный гидроксид
гликозирован, как у салицина, реакции проводят после предварительного гидролиза
гликозида кислотами или ферментами. Эти же качественные реакции используют для
обнаружения фенольных гликозидов на хроматограммах.
В случае хроматографирования в
тонком слое силикагеля хроматограммы можно обработать кроме перечисленных
реактивов еще и 4%- ной Н2SO4 в абсолютном этиловом спирте.
При этом фенольные гликозиды в
зависимости от строения обнаруживаются в виде желтых, красных, оранжевых и
голубых пятен.
При обработке хроматограмм раствором
нитрата серебра и щелочью фенольные гликозиды обнаруживаются в виде коричневых
пятен с различными оттенком.
При обработке хроматограмм реактивом
Паули фенольные гликозиды в зависимости от строения проявляются в виде желтых,
оранжевых или красных пятен.
Методики обнаружения арбутина в
листьях толокнянки и брусники.
.5 г измельченного сырья кипятят с
10 мл Н2О 2-3 минуты и после охлаждения фильтруют. К 1 мл фильтрата прибавляют
кристаллик сульфата закисного Fe, жидкость окрашивается сначала в сиреневый,
затем темно- фиолетовый цвет, и наконец, образуется темно- фиолетовый осадок
(арбутин).
К 1 мл фильтрата (в фарфоровой
чашке) прибавляем 4 мл раствора аммиака и 1 мл 10% раствора Na фосфорно -
молибденовокислого в 10%- ной HCl; появляется синее окрашивание (арбутин).
Реакция основана на образовании комплексного соединения синего цвета.
.5 г мелкоизмельченного
растительного сырья заливают 5 мл этилового спирта и экстрагируют при
периодическом встряхивании и слабом нагревании на водяной бане в течение 1
часа. Полученное извлечение с помощью капилляра наносят на бумагу (3-4
прикосновения капилляра) и хроматографируют восходящим способом в 5%- ной
уксусной кислоте до прохождения фронта растворителя 15-17 см (хроматограмма
проходит в течение 1 часа при использовании бумаги FN-3). Хроматограмму
вынимают, высушивают, обрабатывают раствором 10%- ной спиртовой щелочи и затем
реактивом Паули. Арбутин имеет самое высокое значение R=0.75, отделяется от
сопутствующих гликозидов и проявляются в виде ярко-красного пятна (рис. 1.6.1).
Аналогичные результаты можно получить на пластинке “Силуфол” при
хроматографировании в системе хлороформ-этиловый спирт (7:3) с последующей
обработкой раствором щелочи и реактивом Паули. Хроматограммы до и после
обработки реактивами целесообразно просматривать в УФ свете с целью
идентификации сырья по отдельным компонентам
На салидрозид (сырье родиолы
розовой):
реакция азосочетания с
диазотированным сульфацилом натрия с
образованием азокрасителя
вишнево-красного цвета (рис. 1.6.2). [8]
Согласно ГФ РБ и Европейской
Фармакопее [5, 24] идентификацию фенольных гликозидов в листьях толокнянки
проводят методом тонкослойной хроматографии. К 0.5 г. измельченного сырья
прибавляют 5 мл смеси из равных объемов метанола и воды, нагревают с обратным
холодильником в течение 10 минут. Горячее извлечение фильтруют. Фильтр
промывают смесью из равных объемов метанола и воды и доводят до объема 5 мл
этим же растворителем.
Пластинка: ТСХ пластинка со слоем
силикагеля.
Подвижная фаза: кислота муравьиная
безводная-вода-этилацетат (6:6:88 об/об/об).
Наносимый объем пробы: 10 мкл
раствора сравнения и 20 мкл испытуемого раствора в виде полос.
Фронт подвижной фазы: не менее 15 см
от линии старта.
Высушивание: при температуре от 105
до 110 С до исчезновения запаха растворителей.
Проявление: пластинку опрыскивают
раствором 10 г/л дихлоринохлоримида в метаноле. Затем опрыскивают раствором 20
г/л натрия карбоната безводного. Просматривают при дневном свете.
Согласно ГФ РБ [18] идентификацию
арбутина в листьях брусники проводят следующим образом.
Испытуемый раствор. К 0,5 г
измельченного сырья прибавляют 5 мл смеси из метанола и воды (50:50, об/об) и
кипятят с обратным холодильником в водяной бане в течение 10 мин. Горячее
извлечение фильтруют. Фильтр и пробирку промывают смесью из метанола и воды
(50:50, об/об) и доводят до объема 5 мл этим же растворителем.
Раствор сравнения. 2,5 мг арбутина
растворяют в 5 мл метанола.
Пластинка. ТСХ пластинка со слоем
силикагеля GР.
Подвижная фаза: этилацетат --
кислота муравьиная безводная -- вода (44:3:3,об/об/об).
Наносимый объем пробы: по 10 мкл в
виде полос.
Фронт подвижной фазы: не менее 15 см
от линии старта.
Высушивание: при температуре от
100°С до 105°С.
Проявление: пластинку опрыскивают
раствором 10 г/л 4-аминопиразолона, затем раствором 20 г/л калия ферроцианида и
проявляют в парах аммиака. Просматривают при дневном свете.
Результаты: Арбутин: зона красного
цвета. На хроматограмме испытуемого раствора в верхней половине могут
обнаруживаться и другие зоны. Пирозид - зона красного цвета.
.7 Количественное определение
При количественном определении
фенолгликозидов применяют химические (титриметрические) и инструментальные
(спектрофотометрические и хроматографические) методы анализа.
Нормативно-техническая документация
предусматривает количественное определение арбутина в листьях толокнянки и
брусники. Метод определения основан на иодометрическом титровании гидрохинона,
полученного после извлечения и гидролиза арбутина [5].
Разработан спектрофотометрический
метод определения салидрозида в экстрактек корневищ с корнями родиолы розовой,
который можно использовать для количественного определения салидрозида в
растительном материале [15].
Исходя из строения фенольных
гликозидов и их УФ спектров, возможно количественное
хромато-спектрофотометрическое определение всех представителей этой группы
[18].
И хотя сейчас всё более широкое
применение получают инструментальные методы установления колличественного
содержания фенолгликозидов, ещё применяется и включён в НТД титриметрический
метод количественного определения. [5]
Рассмотрим подробнее методы
количественного определения фенолгликозидов в ЛРС.
)Титриметрический метод
Аналитическую пробу сырья измельчают
до размера частиц, проходящих сквозь сито с отвестиями диаметром 1 мм. Около
0,5 г (точная навеска) измельченного сырья помещают в колбу вместимостью 100
мл, прибавляют 50 мл воды и нагревают на плитке, поддерживая слабое кипение в
течение 30 минут. Горячее извлечение фильтруют в мерную колбу вместимостью 100
мл через бумажный фильтр диаметром 7 мм, избегая попадания частиц сырья на
фильтр. В колбу с сырьем повторно прибавляют 25 мл воды и кипятят 20 минут.
Горячее извлечение вместе с сырьем переносят на тот же фильтр и остаток на
фильтре дважды промывают горячей водой (по 10 мл). К фильтрату прибавляют 3 мл
раствора свинца ацетата основного, перемешивают и по охлаждении доводят объем
фильтрата водой до метки. Колбу помещают в кипящую баню и выдерживают до полной
коагуляции осадка. Горячую жидкость полностью отфильтровывают в сухую колбу
через бумажный фильтр диаметром 10 см, прикрывая воронку часовым стеклом. После
охлаждения к фильтрату прибавляют 1 мл концентрированной серной кислоты, колбу
взвешивают с погрешностью ±0,01 г, присоединяют к обратному холодильнику и
нагревают на плитке в течение 1,5 ч, поддерживая равномерное и слабое кипение.
Колбу с содержимым охлаждают,
доводят до первоначальной массы водой и жидкость полностью отфильтровывают в
сухую колбу через бумажный фильтр диаметром 7 см. К фильтрату прибавляют 0,1 г
цинковой пыли и встряхивают в течение 5 минут. Затем жидкость нейтрализуют по
лакмусовой бумаге натрия гидрокарбонатом (около 1 - 1,5 г), прибавляют еще 2 г
натрия гидрокарбоната и после его растворения фильтруют в сухую колбу через
бумажный фильтр диаметром 7 см.
мл фильтрата переносят в
плоскодонную колбу вместимостью 500 мл, прибавляют 200 мл воды и немедленно
титруют из микро- или полумикробюретки раствором йода (0,1 моль/л) при
встряхивании до появления синего окрашивания, не исчезающего в течение 1 мин
(индикатор - крахмал).
Содержание арбутина в пересчете на
абсолютно сухое сырье в процентах (Х) вычисляют по формуле:
Х = V * 0,01361 * 100 * 100 * 100 /
m * 50 * (100 - W),
Где 0,01361 - количество арбутина,
соответствующее 1 мл раствора йода (0,1 моль/л), в граммах; V - объем раствора
йода (0,1 моль/л), израсходованного на титрование, в миллилитрах; m - масса
сырья в граммах; W - потеря в массе при высушивании сырья в процентах. [9]
)Спектрофотометрический метод
Используется для определения
салидрозида в сырье родиолы розовой.
Аналитическую пробу сырья измельчают
до размера частиц, проходящих сквозь сито с отверстиями диаметром 2 мм. Около
0,5 г (точная навеска) измельченного сырья помещают в колбу вместимостью 100
мл, прибавляют 10 мл воды и нагревают на кипящей водяной бане с обратным
холодильником в течение 15 минут.
Затем извлечение фильтруют через
бумажный фильтр в мерную колбу вместимостью 100 мл, прибавляют 10 мл воды и
нагревают на кипящей водяной бане с обратным холодильником в течение 15 минут.
Затем извлечение фильтруют через
бумажный фильтр в мерную колбу вместимостью 50 мл, избегая попадания частиц
сырья на фильтр. Экстракцию повторяют еще 3 раза по 10 мл воды, нагревая каждый
раз в течение 10 минут и фильтруя в ту же мерную колбу.
К охлажденному фильтрату прибавляют
6 мл 10 % раствора свинца ацетата, 2 мл насыщенного раствора натрия сульфата,
тщательно перемешивают, доводят объем раствора водой до метки и фильтруют через
бумажный фильтр. Первые 15 мл фильтрата отбрасывают.
В мерную колбу вместимостью 25 мл
переносят 5 мл полученного фильтрата, прибавляют 2,5 мл 2 % раствора натрия
карбоната, 2,5 мл диазотированного сульфанила, доводят объем раствора водой до
метки, перемешивают и через 5 минут измеряют оптическую плотность на
спектрофотометре при длине волны 486 нм в кювете с толщиной слоя 10 мм, используя
в качестве раствора сравнения воду.
Содержание салидрозида в пересчете
на абсолютно сухое сырье в процентах (Х) вычисляют по формуле:
Х = D * 250 * 100 / 253 * m * (100 -
W),
Где D - оптическая плотность
анализируемого раствора; 253 - удельный показатель поглощения салидрозида; m -
масса сырья в граммах; W- потеря в массе при высушивании сырья в процентах. [6]
) Гравиметрический метод
Этим методом определяют содержание
флороглюцидов в корневищах папоротника мужского.
г порошка корневищ экстрагируют
около 2 часов в аппарате Сосклета эфиром до тех пор, пока эфир не будет стекать
бесцветным и 10 мл эфирного извлечения не перестанут оставлять при испарении
видимого остатка. Извлечение фильтруют, эфир отгоняют на водяной бане до 30 мл,
после чего остаток взбалтывают в делительной воронке с 30 мл насыщенного
раствора гидрата окиси бария в течение 5 минут. После разделения слоев водный
слой фильтруют, 24 мл фильтрата (=40 г сырья) смешивают с 4 мл
концентрированной соляной кислоты и последовательно взбалтывают с 30, 20, 15 мл
эфира. Объединенные эфирные извлечения обезвоживают 4 г безводного сульфата
натрия и фильтруют через складчатый фильтр во взвешенную колбу. Сульфат натрия
и фильтр промывают эфиром дважды по 10 мл. эфир отгоняют на водяной бане, а остаток
сушат в течение 1 часа при 100°. Содержание сырого филицина в корневище должно
быть не менее 1,8%. [7]
1.8 Фармакологическое действие.
Применение
Фенольные гликозиды - арбутин
(арбутозид) расщепляется на глюкозу и свободный гидрохинон, а метиларбутин
расщепляется на глюкозу и монометиловый эфир гидрохинона, оказывая слабое
антибактериальное действие.
Он хорошо всасывается в тонкой
кишке, фильтруется через почки в мочу. Для достижения необходимого лечебного
эффекта богатые этим гликозидом растения необходимо использовать длительно и в
достаточных количествах [23].
Применение растений, содержащих
арбутин, показывает, что их лечебный эффект значительно выше, чем чистого
арбутина, что связано с наличием в растениях дубильных веществ и флавонов.
Следует отметить, что больным со щелочной реакцией мочи назначать растения,
содержащие арбутин, нецелесообразно, так как он не распадается до бактерицидно
действующего гидрохинона.
В опытах на кроликах арбутин снижает
уровень сахара в крови.
Арбутин, как гликозированный
гидрохинон, может быть источником повышенной канцерогенной опасности, хотя
утверждают также, что арбутин снижает риск возникновения рака. В немецком
институте The German Institute Of Food Research (Потсдам) установлено, что
микрофлора кишечника способна метаболизировать арбутин в гидрохинон, который
является фактором канцерогенеза внутренних органов. Установлено, что 64-75%
арбутина выводится с мочой, а арбутин, трансформированный в гидрохинон,
обеспечивает антимикробное действие в мочевыводящих путях, что поясняет
эффективность брусники в народной медицине, но пока нет доказанных данных
относительно реального риска онкологических заболеваний от применения
препаратов арбутина [2].
Гидрохинон обладает мочегонным и
антисептическим действием эффективен при воспалительных заболеваниях
мочевыводящей системы, интенсивно выводится из организма с мочой, что
подтверждено в опытах на добровольцах после применения препаратов толокнянки
[23].
С арбутином связаны антиоксидантные
свойства растений, содержащих данный гликозид. Арбутин тормозит перекисное
окисление линолевой кислоты и обладает способностью нейтрализовать свободные
радикалы в бесклеточных системах in vitro [23].
На основе изучения кинетики
доказано, что арбутин выступает в роли конкурентного ингибитора тирозиназы, и
его действие является обратимым. Арбутин конкурирует с L-тирозином в процессе
связывания последнего с активным центром фермента.
В исследовании на добровольцах
установлено, что арбутин на 43.5% уменьшал развитие пигментации кожи при
ультрафиолетовом облучении. В связи с этим предлагается использовать отвары
растений для отбеливания кожи в косметологии.
Фенолгликозиды родиолозид,
салидрозид и розавин обладают ярко выраженными адаптогенными и стимулирующими
нервную систему свойствами, подобно препаратам женьшеня, аралии и
элеутерококка. Салициловая кислота и ее производные известны как
противовоспалительные, жаропонижающие и болеутоляющие средства [11, 22].
Салидрозид обладает
бифункциональными свойствами, т.е. проявляет себя как ингибитор или инициатор
окислительных процессов. Проявление того или иного свойства зависит от
концентрации салидрозида в реакционной среде- при низких концентрациях
салидрозид выступает как ингибитор окислительных процессов, при высоких - как
инициатор [11].
По-видимому, этими химическими
свойствами салидрозида определяется и его фармакологический эффект. В опытах на
мышах, в малых дозах салидрозид действует стимулирующе на спонтанную активность
мышей, а при больших дозах снижает двигательную активность интактных животных.
По- разному влияет салидрозид на холинергические и моноаминергические процессы
в центральной нервной системе в зависимости от доз используемого препарата
[11].
Фенолгликозид салицин, используется
в народной медицине при лихорадочных состояниях, при воспалениях слизистых
ротовой полости и верхних дыхательных путей (полоскания), при кожных
заболевания (примочки).
Учитывая фармакологические свойства
салицина, и используя достижения синтетической химии в 20 столетии научными
работниками разных стран мира, было синтезировано значительное количество
органических соединений. Они со временем нашли широкое применение в фармации и
научно-практической медицине как противовоспалительные и анальгетические
средства [11].
.9 Препараты, ЛС, содержащие простые
фенольные соединения
Сырьевая база достаточно хорошо
обеспечена, потребность в сырье толокнянки, брусники, щитовника мужского и
родиолы розовой покрывается за счет дикорастущих растений. Виды хлопчатника
широко культивируются.
Брусника встречается в лесной и
тундровой зонах, толокнянка обыкновенная - в лесной зоне европейской части
страны, в Сибири и на Дальнем Востоке. Брусника произрастает в сосновых,
еловых, зеленомошных и смешанных лесах, на влажных местах, по окраинам торфяных
болот. Толокнянка - в сухих сосновых беломошных и лиственничных лесах, на
вырубках, открытых солнечных местах, песчаных почвах.
Щитовник (папоротник) мужской
произрастает в лесной зоне европейской части и в горах Южной Сибири.
Предпочитает тенистые хвойные и широколиственные леса.
Ареал родиолы розовой охватывает
полярно-арктическую, альпийскую и тундровую зоны европейской части, Урала,
Дальнего Востока, горы юга Сибири (Алтай, Саяны). Родиола розовая образует
заросли в каменистых долинах рек, в редколесьях и на влажных лугах. Основные
заросли находятся на Алтае.
Сырье хлопчатника импортируют из
стран Средней Азии.
Сырье брусники, толокнянки, родиолы
розовой отпускают из аптеки без рецепта врача - приказ министерства
здравоохранения и социального развития РФ № 578 от 13.09.2005 - как лекарственные
средства. Корневища и корни родиолы розовой, кору корней хлопчатника используют
как сырье для получения готовых лекарственных средств.
Из лекарственного растительного
сырья, содержащего фенолгликозиды, получают:
Экстемпоральные лекарственные формы:
отвары (сырье брусники, толокнянки,
родиолы розовой);
сборы (сырье брусники, толокнянки,
родиолы розовой).
. Экстракционные (галеновые)
препараты:
. Новогаленовые препараты:
«Родаскон» из сырья родиолы розовой.
. Препараты индивидуальных веществ:
% линимент госсипола и глазные капли
- 0,1 % раствор госсипола в 0,07 % растворе натрия тетрабората (кора корней
хлопчатника). [28]
II. ЛР и ЛРС, содержащие простые
фенольные соединения
.1 Листья брусники - Folia Vaccinii
vitisidaeae
В качестве лекарственного средства
используют собранные до начала цветения или после созревания плодов листья
многолетнего вечнозеленого дикорастущего кустарника (Vaccinum Vitisidaea L.),
из семейства вересковых (Ericaceae), подсемейства брусничных - Vaccinioideae.
[17]
Брусника (рис. 2.1.1) - небольшой
кустарничек высотой до 25 см с ползучим корневищем и прямостоячими ветвистыми
стеблями. Листья обратнояйцевидные или эллиптические, очередные, кожистые, с
цельным, завернутым на нижнюю сторону краем. Цветки четырехчленные, розоватые,
собраны в поникающие кисти. Тычинок 8, пестик с нижней завязью. Плод -
многосемянная, шаровидная, ярко-красная сочная ягода. Цветет в мае-июне, плоды
созревают в августе-сентябре.
Брусника имеет обширный
голарктический ареал с преобладанием в северной части Евразии. Распространена
на значительной части территории СНГ, всей Средней Азии, подавляющей части
Казахстана и Закавказья).
Встречается в лесной и арктической
зонах, поднимаясь в горы до гольцового пояса. Произрастает в хвойных и
смешанных лесах, в горных и равнинных тундрах. Наиболее обильна в светлохвойных
лесах - сосновых и сосново-еловых.
Основные районы заготовок -
северные, северо-восточные и западные области России, Сибирь (Томская область,
Республика Тува), а также Белоруссия. [20]
Макроскопия (внешние признаки)
Цельное сырье. Состоит из кожистых
короткочерешковых листьев обратнояйцевидной или эллиптической формы длиной 7-30
мм, шириной 5-15 мм. Листья цельные, цельнокрайные, с завернутыми на нижнюю
сторону краями; сверху темно-зеленые, снизу - светло-зеленые; жилкование
перистое. Важным диагностическим признаком является наличие на нижней
поверхности темно-коричневых точек (железок), видимых простым глазом. Запах
отсутствует, вкус горький, вяжущий. (Рис. 2.1.2).
Измельченное сырье. Кусочки листьев,
проходящие сквозь сито с отверстиями диаметром 3 мм. [20]
Микроскопия.
Микроскопическое строение листа
(Рис. 2.1.3).
Цельное сырье. При рассматривании
листа с поверхности видны клетки со слабоизвилистыми, слабоволнистыми и
извилистыми стенками верхнего эпидермиса (длиной 29-62 мкм, шириной 21-37 мкм)
(рис. 2.1.5); клетки со слабоизвилистыми, слабоволнистыми и почти прямыми
стенками около железок нижнего эпидермиса (длиной 21-544 мкм, шириной 8-33 мкм)
(рис. 2.1.4). Стенки клеток имеют четковидное утолщение. Местами может
наблюдаться легкая морщинистость кутикулы (продольно-морщинистая).
Морщинистость кутикулы слабо выраженная. Среди клеток эпидермиса встречаются
пигментные клетки, заполненные буро-бордовым содержимым. Устьица мелкие (длиной
29-334 мкм, шириной 21-25 мкм), расположены на нижнем эпидермисе и окружены 2
околоустьичными клетками, расположенными параллельно устьичной щели (парацитный
тип), с частотой встречаемости 122-331 на 1 мм в квадрате. Около железок
устьица отсутствуют. На нижней стороне листа встречаются железки булавовидной
формы (рис. 2.1.4) длиной 158-204 мкм, состоящие из многоклеточной ножки,
постепенно переходящей в овальную многоклеточную головку (высота головки
104-141 мкм) с коричневым содержимым, с частотой 0-17 на 1 мм в квадрате. По
жилкам и на черешке встречаются одноклеточные конусовидные или крючковидные
волоски с толстыми стенками и гладкой слабобородавчатой поверхностью длиной до
417 мкм (рис. 2.1.5, 2.1.6). В мезофилле содержатся редкие одиночные
призматические кристаллы оксалата кальция размером 2-8 мкм и друзы диаметром
12-25 мкм, более часто они встречаются в черешке и ближе к жилкам. Лист имеет дорсовентральное
строение (рис. 2.1.7-2.1.9). Губчатая паренхима с крупными воздухоносными
полостями. Клетки ее, кроме субэпидермальных, нелопастные округлой или
неправильной формы. По краю листа (в углах поперечных срезов) наблюдается
уголковая колленхима. На кончике листа расположена гидатода, клетки эпидермиса
которой с более толстыми стенками, водяные устьица на ней круглые, выпуклые,
обычно числом около 10.
Клетки эпидермиса черешка вытянуты
по его ширине, прямоугольной, веретеновидной, ромбовидной формы и их
комбинациями с прямыми четковидно утолщенными стенками.
Измельченное сырье. Проводя анализ,
выбирают из аналитической пробы для определения подлинности, измельченности и
содержания примесей крупные кусочки листа. Готовят микропрепараты аналогично
микропрепаратам из цельного сырья. [19]
При исследовании цельного сырья
берут кусочки пластинки листа с краем и жилкой. При исследовании резаного сырья
берут по нескольку различных кусочков.
Просветление можно проводить двумя
способами.
Несколько кусочков сырья помещают в
колбу или пробирку, прибавляют 5 % раствор едкого натра, разведенный водой
(1:1), и кипятят в течение 1-2 минут. Затем содержимое выливают в чашку Петри
(или фарфоровую), жидкость сливают и сырье тщательно промывают водой. Из воды
кусочки сырья вынимают скальпелем или лопаточкой и помещают на предметное
стекло в каплю раствора хлоралгидрата или глицерина.
Кусочки кипятят в растворе
хлоралгидрата, разведенного водой (1:1), в течение 5-10 минут (до
просветления). Просветленный кусочек сырья помещают на предметное стекло в
каплю раствора хлоралгидрата или глицерина, разделяют скальпелем или
препаровальной иглой на две части, одну из них осторожно переворачивают. Объект
накрывают покровным стеклом, слегка подогревают до удаления пузырьков воздуха и
после охлаждения рассматривают лист с обеих сторон под микроскопом сначала при
малом, затем при большом увеличении. При приготовлении микропрепаратов из
толстых листьев их предварительно раздавливают скальпелем.
При необходимости приготовления
поперечных срезов листьев и стеблей их кипятят в растворе хлоралгидрата в
течение 10 минут и делают срезы, зажимая кусочки листа в пробку или сердцевину
бузину. Готовые срезы помещают в воду и далее используют для приготовления
микропрепаратов, рассматривая их в растворе хлоралгидрата. [6]
Наблюдают анатомо-диагностические
признаки, аналогичные признакам цельного сырья.
Из оставшейся части взятой на анализ
пробы отсеивают фракцию крупного порошка через сито с отверстиями диаметром 2
мм. Готовят микропрепараты по методике приготовления микропрепаратов порошка.
[19]
На предметное стекло наносят 1-2
капли раствора хлоралгидрата и небольшое количество исследуемого порошка.
Порошок берут кончиком препаровальной иглы, смоченной хлоралгидратом, тщательно
размешивают, закрывают покровным стеклом и нагревают до удаления пузырьков
воздуха. Затем стекло слегка придавливают ручкой препаровальной иглы,
выступившую по краям жидкость удаляют полоской фильтровальной бумаги. Порошки
кожистых листьев просветляют кипячением в 5 % растворе едкого натра. [6]
Наблюдают анатомо-диагностические
признаки, характерные для порошка листьев брусники.
Порошок. Микропрепараты порошка
(Рис. 2.1.4-2.1.5) под микроскопом представляют собой смесь из различных
частиц:
обрывков эпидермиса с клетками со
слабоизвилистыми, слабоволнистами, извилистыми или почти прямыми четковидно
утолщенными стенками, иногда с легкой морщинистостью кутикулы, с мелкими
парацитными устьицами;
обрывков эпидермиса с железками
булавовидной формы;
обрывков жилок и черешка с одноклеточными
конусовидными или крючковидными волосками с толстыми стенками и гладкой или
слабобородавчатой поверхностью;
обрывков эпидермиса с пигментными
клетками, заполненными буро-бордовым содержимым;
обрывков листа с редкими одиночными
призматическими кристаллами и друзами оксалата кальция в мезофилле;
обрывков листа с губчатой паренхимой
с крупными воздухоносными полостями. [20]
Числовые показатели.
Цельное сырье. Арбутина,
определяемого йодометрическим титрованием, - не менее 4,5 %; влажность - не
более 13 %; золы общей - не более 7 %; золы, нерастворимой в 10 % растворе
кислоты хлоистоводородной, - не более 0,5 %; почерневших и побуревших с обеих
сторон листьев - не более 7 % (их наличие - следствие несоблюдения сроков
заготовки и режимов сушки). Для цельного сырья содержание измельченных частиц,
проходящих сквозь сито с отверстиями диаметром 3 мм, не должно превышать 2 %.
Содержание других частей растения - до 1 %; примесей: органических - не более 1
%, минеральных - не более 0,5 %.
Измельченное сырье. Дополнительно
определяют содержание частиц, не проходящих сквозь сито с отверстиями диаметром
3 мм (не более 5 %). [20]
Химический состав.
Листья брусники содержат арбутин
(4-9 %), свободный гидрохинон; флавоноиды - гиперозид, кверцитрин,
изокверцитрин, рутин, кемпферол; дубильные вещества преимущественно
конденсированного ряда (до 15 %); кислоты урсоловую, эллаговую и хинную;
концентрируют Fe, Zn, Se, Sr, Ag, Mn. [20]
Применение. Назначают в виде отвара
или настоя как дезинфицирующее и мочегонное средство, главным образом при
почечнокаменной болезни, циститах, ревматизме и подагре. Препараты брусники
(рис. 2.1.10) оказывают менее выраженное и более мягкое диуретическое действие,
чем препараты толоенянки, так как содержат меньше арбутина и дубильных веществ.
Входят в сбор «Бруснивер». Применяются в гомеопатии и БАДах. [20]
Лекарственные формы. Настой.Столовая
ложка листьев настаивают 30 минут в стакане кипятка, охлаждают и пьют по
столовой ложке 3-4 раза в день.
Отвар. 2-3 чайные ложки кипятят в
стакане воды 15 минут, выпивают в течение дня.
Сбор, обработка, сушка. Листья
собирает до цветения (при более позднем сборе они при сушке чернеют), в том
числе ранней весной- перезимовавшие под снегом; сушат в сухом теплом помещении
или на чердаках, разложив тонким слоем (3-5 см) на бумаге или ткани, часто
перемешивая. Выход сухого сырья 20-22%. Сухие листья упаковывают в мешки весом
по 20-25 кг и хранят в сухих, хорошо проветриваемых помещениях на стеллажах.
Срок хранения не установлен [23].
.2 Листья толокнянки (медвежье ушко)
- Folia Uvae ursi (Folia Arctostaphyli uvae-ursi)
В качестве лекарственного средства
используют собранные весной до и в начале цветения или осенью с начала
созревания плодов до появления снежного покрова и высушенные листья
дикорастущего вечнозеленого кустарничка толокнянки обыкновенной -
Arctostaphylos uva - ursi (L.) Spreng. из семейства вересковых - Ericaceae
используют в качестве лекарственного сырья и средства.
Толокнянка (рис. 2.2.1) -
сильноветвистый кустарничек с простертыми побегами длиной до 2 м. Листья
очередные, слегка блестящие, темно-зеленые, кожистые, обратнояйцевидные, в
основании клиновидные, короткочерешковые. Цветки - розоватые, собраны в
поникающие короткие верхушечные кисти. Венчик кувшинчатой формы,
спайнолепестный с пятизубчатым отгибом. Тычинок 10. Пестик с верхней
пятигнездной завязью. Плод - ценокарпная мучнистая костянка красного цвета, с
пятью косточками, несъедобная. Цветет в мае - июле, плоды созревают в июле -
августе.
Распространена в лесной зоне
европейской части СНГ, Сибири и Дальнего Востока России, а также на Кавказе и в
Карпатах.
Растет преимущественно в сухих
лиственничных и сосновых лесах (борах) с лишайниковым покровом (беломошниках),
а также на открытых песчаных местах, приморских дюнах, скалах, на гарях и вырубках.
Растение светолюбивое, малоконкурентноспособное, при восстановлении леса после
пожара или рубки оно выпадает из состава фитоценоза. В пределах своего ареала
встречается рассеянно, куртинами.
Основные районы заготовок, где
встречаются продуктивные заросли: Белоруссия; Псковская, Новгородская,
Вологодская, Ленинградская и Тверская области России. Представляют интерес для
промышленных заготовок некоторые районы Сибири (Красноярский край, Иркутская
область и Якутия).
Несмотря на то, что биологические
запасы толокнянки велики, потребность в ней удовлетворяется далеко не
полностью, поскольку заросли, пригодные для промышленных заготовок, занимают
около 1 % территории, где она произрастает. Губительно сказывается на
регенерации зарослей частая заготовка на одних и тех же площадях, без учета
биологических особенностей этого растения. Именно поэтому в местах, наиболее
благоприятных для ее роста и развития, особенно в горах и на вырубках в
сосняках - беломошниках, целесообразно создавать заказники для толокнянки.
Макроскопия (внешние признаки).
Цельное сырье. Готовое сырье состоит
из мелких цельнокрайних, кожистых, сверху темно-зеленых блестящих листьев, с
нижней стороны они немного светлее (рис. 2.2.2). Форма обратнояйцевидная или
продолговато-обратнояйцевидная. К основанию листья клиновидно суженные,
короткочерешковые; жилкование сетчатое. Длина листьев - 1-2,2 см, ширина -
0,5-1,2 см. запах отсутствует, вкус сильно вяжущий, горьковатый.
Порошок. Кусочки листьев, проходящие
сквозь сито с отверстиями диаметром 2 мм. [20]
Микроскопия.
Микроскопическое строение листа
толокнянки (рис. 2.2.3).
Цельное сырье. При рассматривании
листа с поверхности (рис. 2.2.4) с
Обеих сторон видны клетки эпидермиса
многоугольной изодиаметрической формы с прямыми и довольно толстыми стенками
редко четковидно утолщенными, длиной 12-54 мкм, шириной 8-37 мкм. Устьица
крупные округлые, расположены с нижней стороны листа (длиной 41-54 мкм, шириной
37-50 мкм, частота встречаемости 52-192 на 1 мм в квадрате), с узкой устьичной
щелью, широким передним двориком, отрганиченным от внешней среды кутикулярным
сводом, имеющим в центре неправильное, в очертаниях лучистое отверстие,
окружены 8 (5-9) околоустьичными клетками (аномоцитного типа). Околоустьичные
клетки мельче остальных клеток эпидермиса. Устьица выступающие. Крупные жилки
сопровождаются кристаллами оксалата кальция в виде призм, их сростков и друз
(рис. 2.2.7). Волоски простые и головчатые (рис. 2.25, 2.2.6). Простые волоски
(длиной до 187 мкм) 1-2-клеточные толстостенные с бородавчатой поверхностью
конусовидные прямые и согнутые (крючковидные), расположены по краям молодых
листьев и в области черешка и основания листа с верхней стороны листа с верхней
стороны листа. Головчатые волоски (длиной 37-62 мкм) на 1-2 клеточной ножке, с
2-6-клеточной двухрядной головкой (длиной 16-42 мкм) расположены в области
черешка с верхней стороны листа. Лист дорсовентрального строения (рис.
2.2.9-2.2.10). Губчатая паренхима рыхлая с крупными воздухоносными полостями.
Крупные жилки сверху и снизу, под эпидермисом имеются тяжи уголковой
колленхимы. Колленхима встречается и по краю листа.
Эпидермис черешка (рис. 2.2.6)
представлен вытянутыми по ширине черешка клетками почти прямоугольной формы с
ровными стенками. С верхней стороны черешка и основания листа встречаются
простые и головчатые волоски.
Измельченное сырье. Проводя анализ,
выбирают из аналитической пробы для определения подлинности, измельченности и
содержания примесей крупные кусочки листа. Готовят микропрепараты аналогично
микропрепаратам из цельного сырья (ГФ ХI, выпуск 1, стр. 278). Наблюдают
анатомо-диагностические признаки, аналогичные признакам цельного сырья.
Из оставшейся части взятой на анализ
пробы отсеивают фракцию крупного порошка через сито с отверстиями диаметром 2
мм. Готовят микропрепараты по методике приготовления микропрепаратов порошка
(ГФ ХI, выпуск 1, стр. 278-279). Наблюдают анатомо-диагностические признаки,
характерные для порошка листьев толокнянки.
Порошок. Микропрепараты порошка
(рис. 2.2.7, 2.2.8) под микроскопом представляют собой смесь из различных
частиц:
обрывков эпидермиса листа с
многоугольными клетками с прямыми сильно утолщенными (местами четковидно
утолщенными) стенками, устьицами аномоцитного типа (или без них), с более
мелкими по размеру клетками вокруг устьиц;
обрывков эпидермиса черешка с
вытянутыми клетками почти прямоугольной формы с ровными стенками с простыми и
головчатыми волосками (и без них);
обрывков паренхимы и жилок с
кристаллами оксалата кальция;
обрывков губчатой паренхимы с
воздухоносными полостями;
обрывков жилок и паренхимы с
уголковой колленхимой. [19]
Числовые показатели.
Арбутина - не менее 6 %; Влажность -
не более 12 %; Золы общей - не более 4 %; Золы, нерастворимой в 10 %-ном
растворе кислоты хлористоводородной, - не более 2 %; Побуревших и потемневших с
обеих сторон листьев - не более 3 %; Других частей растения (веточки, плоды) -
не более 4 %; Органической примеси - не более 0,5 %; Минеральной примеси - не
более 0,5 %. [20]
Химический состав.
Применение.
Листья толокнянки (рис. 2.2.11)
присеняют в виде отвара, настоя, экстракта как дезинфицирующее,
противовоспалительное и слабое мочегонное средство при воспалениях мочевых
путей, почек, мочевого пузыря и др. листья толокнянки входят в состав
урологических сборов. Лечебное (прежде всего антисептическое) действие
обусловлено гидрохиноном, образующимся в результате гидролиза арбутина и
метил-арбутина в щелочной среде мочи при рН 7,5-8,0, и усиливается действием
дубильных веществ. [12]
В исследованиях влияния
фитопрепаратов из растений флоры России на концентрацию инсулина и глюкозы в
крови крыс с экспериментальным аллоксановым диабетом использовали отвары
надземных частей некоторых растений, в том числе и отвар листьев толокнянки.
Приведенные в статье исследования подтвердили, что при лечении отварами
надземных частей толокнянки и рутином, восстанавливается способность
бета-клеток островков Лангерганса в ответ на нагрузку глюкозой реагировать
повышением инкреции инсулина в кровь у аллоксан диабетических крыс, что
позволяет рекомендовать их включение в комплексную терапию больных
инсулин-зависимым сахарным диабетом. [4]
При приеме больших доз препаратов
может наблюдаться обострение воспалительных явлений в результате длительного
раздражения почечных канальцев. Для устранения побочного действия препараты
толокнянки следует использовать в комплексе с другими растениями, обладающими
противовоспалительными свойствами. Кроме того, в листьях содержится много
дубильных веществ, поэтому натощак это средство принимать нельзя (вяжущее
действие). Применяется в гомеопатии и в составе БАД. [20]
.3 Корневища мужского папоротника -
Rhizomata Filicis maris
В качестве лекарственного средства
используют собранные осенью или ранней весной, очищенные от корней и отмерших
листьев, с оставленными основаниями черешков, высушенные корневища
дикорастущего многолетнего травянистого растения щитовника мужского
(папоротника мужского) - Dryopterix filix mas (L.) Schott из семейства
аспидиевых - Aspidiaceae используют в качестве лекарственного сырья.
Папоротник мужской (рис. 2.3.1) -
многолетнее споровое растение с мощным косорастущим корневищем. Листья (вайи)
крупные, до 1 метра длиной, дважды перисторассеченные, с
продолговато-эллиптической в очертании пластинкой. На нижней стороне листа в
середине лета развиваются сорусы (пучки спорангиев), покрытые почковидными
покрывальцами (индузиями). Спороносит с конца июня до сентября; споры созревают
в августе - сентябре.
Мужской папоротник имеет
дизъюнктивный европейско-западноазиатский тип ареала. Основная часть ареала
охватывает лесные области европейской части СНГ, кроме крайнего северо-востока.
Обособленные участки ареала находятся в горно-лесных районах Северного Кавказа,
Закавказья, Крыма, в восточных районах Казахстана, в северной Киргизии,
Узбекистане и Таджикистане.
Растет в хвойных, смешанных и
широколиственных лесах, преимущественно по оврагам и другим тенистым местам на
богатых перегноем почвах.
Основные промысловые заготовки сырья
сосредоточены в средней полосе европейской части России и украинских Карпатах.
Макроскопия (внешние признаки)
Сырье представляет собой цельные
корневища (рис. 2.3.2) длиной 5-20 см, толщиной 2-3 см, а вместе с покрывающими
его основаниями черешков - до 5-7 см. Допускается наличие отдельных оснований
черешков. Основания черешков покрыты одноцветными, светло-бурыми пленчатыми
чешуйками, несущими по краю сдвоенные выступы-зубчики. Цвет корневища и
покрывающих его черешков снаружи черно-бурый, на свежем изломе светло-зеленый
или желто-зеленый, излом ровный. Бурый цвет на изломе указывает на залежалость
сырья и непригодность к употреблению. Запах слабый, вкус слегка раздражающий,
неприятный.
При заготовке корневищ мужского
папоротника необходимо уметь отличать его от возможных примесей.
У женского папоротника (кочедыжника
женского) (рис. 2.3.3) - Athyrium filix-femina (L.) Roth листья нежные, трижды
перисторассеченные, с мелкими зубчатыми сегментами. Сорусы отличаются
продолговатой формой. Корневища усажены основаниями черешков, имеющими
трехгранную форму почти черную окраску. Чешуйки цельнокрайные.
У страусопера (страусника
обыкновенного) (рис. 2.3.4) - Matteuccia struthiopteris (L.) Todaro из
семейства Onocleaceae листья весьма похожи на мужской папоротник, но не несут
сорусов и растут, образуя воронку, в центре которой часто находятся несколько
коротких светло-зеленых, а при созревании спор - бурых спороносных листьев.
Корневище крупное, вертикальное, овальное в очертании. Чешуйки темно-бурые,
цельнокрайные, основания черешков трехгранные.
У папоротника игольчатого (рис.
2.3.5) - Dryopteris carthusiana (Vill/) H.P.Fuchs листья в очертании
узкотреугольной формы, дважды и трижды перисторассеченные; краевые зубцы
вытянуты в мягкую иголочку. Корневища более мелкие; чешуйки по краю усажены
головчатыми волосками.
У папоротника австрийского (рис.
2.3.6) - Dryopteris austriaca (Jacq.) Woyn. Ex Schinz et Thell. листья в
очертании треугольные, трижды перисторассеченные, самый нижний сегмент второго
порядка, направленный к основанию листа, значительно длиннее других. Чешуйки,
покрывающие основания черешков, двухцветные, с широкой продольной темной
полосой. [20]
Микроскопия
Строение проводящих пучков корневища
и листовых черешков на поперечных срезах в основном одинаково. Проводящие пучки
(так называемые столбы) располагаются по периферии, овальные в очертании,
концентрические, центроксилемные. Ксилема состоит из крупных лестничных
трахеид, окрашивающихся флороглюцином с кислотой хлористоводородной в красный
цвет. Каждый проводящий пучок окружен одним рядом буроватых клеток эндодермы.
Основная ткань состоит из рыхло расположенных клеток тонкостенной паренхимы,
образующих большие межклеточные пространства. В межклетниках встречаются особые
зеленоватые клетки, называемые клетками Шахта. Они имеют округлую форму и
вытянуты в ножку (рис. 2.3.7).
При обработке ванилином и
концентрированной кислотой хлористоводородной содержимое клеток шахта
окрашивается в красный цвет. [20]
Числовые показатели.
Сырого филицина - не болee 1,8 %;
влажность - не более 14 %; золы общей - не более 3 %; корневищ, побуревших в
изломе и плохо очищенных от корней и остатков отмерших листьев, - не более 5 %;
мелких частей, проходящих сквозь сито с диаметром отверстий 2 мм,- не более 3
%; посторонних примесей: органической - не более 1 %; минеральной - не более 2
%. [20]
Химический состав.
В корневищах папоротника содержатся
фенольные соединения - флороглюциды (кислоты филиксовая и флаваспидиновая,
аспидинол, альбаспидин), представляющие собой моно-, ди- и тримерные
производные флороглюцина. Кроме того, найдены дубильные вещества (7-8 %),
горечи. Сырье концентрируют Fe, Zn, Se, Ba, Al. [20]
Применение.
В медицине используется экстракт
мужского папоротника густой (список Б). Это густая малоподвижная масса зеленого
или буро-зеленого цвета неприятного запаха. Применяется против ленточных
глистов и остриц, бычьих и свиных цепней, широких лентецов. Его применяют не только
в медицине, но и в ветеринарии. Препарат "Филиксан" применяется
аналогично. Лечение препаратами папоротника проводят лишь по рекомендациям и
под наблюдением врача. В народной медицине настой корневищ употребляют для ванн
при ревматизме и судорожном сокращении мышц ног. [20]
В народной медицине папоротники
рекомендуют в качестве не только глистогонного, но и ранозаживляющего средства,
при плеврите. Проведенные исследования элементного состава папоротников
показали, что они накапливают богатый комплекс биогенных химических элементов в
допустимых для растений количествах, что свидетельствует об экологической
чистоте сырья и дает возможность дальнейшего изучения папоротников для
внедрения их в медицинскую практику. [21]
.4 Корневища и корни родиолы розовой
- Rhizomata et radices Rhodiolae roseae
В качестве лекарственного средства
используют собранные в фазу цветения и плодоношения, очищенные и отмытые от
земли, разрезанные на куски и высушенные корневища и корни многолетнего
дикорастущего травянистого растения родиолы розовой - Rhodiola rosea L. из
семейства толстянковых - Grassulaceae используют в качестве лекарственного
сырья.
Родиола родиола (рис. 2.4.1) -
многолетнее суккуленетное двудомное растение. Корневище мощное, многоглавое, с
толстыми и тонкими придаточными корнями. Стебли обычно многочисленные,
прямосточие, неветвистые. Листья сидячие, очередные, продолговатые,
обратнояйцевидно-ланцетовидные, цельнокрайные или редкозубчатые. Соцветие
щитковидное, многоцветковое. Цветки однополые, четырехчленные, редко
пятичленные. Плод - многолистовка. Цветет в июне-июле; семена созревают в
июле-августе.
Произрастает в альпийском и
субальпийском поясах, в верхней части лесного пояса. Типичными местообитаниями
являются каменистые долины рек. Встречается в лиственнично-кедровых
редколесьях, в зарослях субальпийских кустарников, на влажных лугах.
Основными районами заготовок в
промышленных масштабах являются некоторые хребты Горного Алтая, Западных и
Восточных Саян. [20]
Макроскопия (внешние признаки).
Куски корневищ и корней различной
формы (рис. 2.4.2). Куски корневищ длиной до 9 см, толщиной 2-5 см, твердые,
морщинистые, со следами отмерших стеблей и остатками чешуевидных листьев. От
корневища отходят немногочисленные корни длиной 2-9 см, толщиной 0,5 см - 1 см.
Поверхность корневища и корня блестящая, серовато-коричневого цвета; при
отслаивании пробки обнаруживается золотисто-желтый слой. Цвет на изломе
розовато-коричневый или светло-коричневый. Запах специфический, напоминающий
запах розы. Вкус горьковато-вяжущий. [20]
Микроскопия.
На поперечном срезе корневища видна
слоистая перидерма. Корневище имеет пучковый тип строения. Проводящие пучки
открытые, коллатеральные, веретеновидные, расположены кольцом, ориентированы к
периферии корневища флоэмой и к центру - ксилемой. Возможно наличие второго
кольца более мелких проводящих пучков, в которых флоэма ориентирована к центру,
а ксилема - к периферии. Паренхима корневища состоит из крупных клеток,
заполненных крахмалом (рис. 2.4.3). Крахмальные зерна простые, округлые или
овальные, 5-20 мкм в диаметре. [20]
Числовые показатели.
Салидрозида не менее 0,8%; влажность
не более 13%; золы общей не более 9%; других частей растения (листьев, стеблей,
в том числе отделенных при анализе) - не более 4%; органической примеси не более
1%; минеральной примеси не более 3%. [20]
Химический состав.
Корневища и корни родиолы розовой
содержат фенолоспирт тирозол и его глюкозид салидрозид (около 1 %); флавоноиды
- производные гербацетина, трицина и кемпферола; гликозиды коричного спирта - розавин
(до 2,5 %), розарин, розин; флавонолигнан родиолин; монотерпены - розиридол и
розиридин; дубильные вещества (около 20 %), эфирное масло и органические
кислоты; концентрируют Mo, Se, Fe.
Согласно данным ряда сообщений,
химический состав растений, собранных в разных частях ареала, отличается, что
связано с исследованиями разных хеморас. [20]
Применение.
Корневища и корни родиолы используют
для получения жидкого экстракта (рис. 2.4.4), который применяют как
стимулирующее и тонизирующее средство при функциональных заболеваниях ЦНС,
гипотонии, нервном и физическом истощении. Кроме того, выпускают сухой экстракт
в виде таблеток. Применяется в гомеопатии и БАДах. [20]
В настоящее время значительно возрос
интерес к фитоадаптогенам, в частности препаратам родиолы розовой. Одно из
самых серьезных препятствий к их широкому внедрению в медицинскую практику -
недостаточность сырьевой базы. Наиболее перспективным методом решения этой
проблемы является культивирование изолированных клеток и тканей на
искусственных питательных средах в условиях in vitro.
В лаборатории экстремальных
состояний НИЦ Первого МГМУ имени И.М.Сеченова в городе Москва, были проведены
доклинические испытания спиртовой настойки биомассы культуры ткани родиолы
розовой и сравнение ее с официнальным экстрактом природного корня родиолы
розовой. Проведены сравнения общетоксического действия препаратов. В
результате, препараты родиолы розовой - как природного, так и
биотехнологического происхождения - показали себя чрезвычайно низкотоксичными и
высокобезопасными по показателям острой и хронической токсичности. [13]
Заключение
В заключение своей курсовой работы
мне хотелось бы сделать следующие выводы:
.Лекарственные растения в народной
медицине используются с древних веков до нашего времени, количество
лекарственных растений многообразно. И поиски все новых достижений в
фармакогнозии не останавливаются, и появляются новые методы исследований, что
позволит выделить еще большее количество лекарственных растений и
лекарственного растительного сырья.
. Фенольные гликозиды оказывают
самое различное действие на организм человека. Но, необходимо отметить, что,
несмотря на применение растений, содержащих фенольные гликозиды, в современной
терапевтической практике, все-таки их возможности еще не раскрыты в полной
мере. Поэтому, создание новых, изучение уже открытых свойств растений,
содержащих фенольные гликозиды, может занять достойное место в будущих научно-
исследовательских работах.
. При написании данной курсовой
работы, изучая материал, я пришел к выводу, что растения, содержащие фенольные
гликозиды, представляют особый интерес в плане профилактики и лечения
заболеваний, сопровождающиеся ослаблением антиоксидантной защиты организма,
повышением противоопухолевой резистентности, препятствованию развития метастазов.
Особенно желательно их применение на экологически неблагоприятных территориях.
Мы живем в век стрессов, загрязнения окружающей среды, химизации, искусственной
ароматизации продуктов и многих других неблагоприятных факторов. Статистические
исследования последних лет показывают, что наблюдается значительный рост
онкологических заболеваний.
. Поиск новых перспективных видов
ЛРС, содержащих фенолгликозиды является актуальной задачей современной науки,
но это лишь первый шаг.
Следующий шаг должны сделать люди,
которые начинают применять ЛРС. Они должны научиться правильно его применять,
добиваясь максимальной эффективности. Но для того, чтобы научиться как это
делать, необходимо знать, как оно будет работать в тех или иных ситуациях. Для
этого требуется проводить клинические исследования. Это задача непростая, но
она вполне решаемая.
Во-первых, необходимо отслеживать
результаты применения ЛРС, фиксируя как положительные, так и отрицательные
результаты. Со временем появится информация к размышлению над полученными
результатами. Во-вторых, нужно стараться анализировать результаты применения
ЛРС, обращая внимание на симптомы или данные анализов, состояние организма до и
после применения трав.
. Необходимо разработать более
эффективные методы качественного и количественного определения фенолгликозидов
в ЛРС.
Например, анализируя различные
методики количественного определения можно придти к выводу, что наименьшую
относительную ошибку даёт спектрофотометрический метод определения, который
характеризуется точностью и простотой выполнения. Фотоэлектроколориметрический
метод даёт большую относительную ошибку, например, в методике предусмотрено
применение реосаждения сопутствующих полифенольных соединений, что приводит к
соосаждению и арбутина. Йодометрический метод даёт завышенные результаты
вследствие неспецифичности используемой реакции.
В связи с вышеизложенным, для
количественного определения фенолгликозидов рекомендуется использовать
спектрофотометрический метод. Но применяя данный метод, исследователи
используют в основном токсичный хлороформ.
Перспективными для анализа я считаю,
являются гибридные методы химического анализа (гибридные
жидкохроматографические системы). Например, для качественного определения
возможно применение очень точных методов: жидкостная хроматография-масс-спектрометрия
(ЖХ-МС) или жидкостная хроматография - инфракрасное детектирование с
фурье-преобразованием (ЖХ-ФПИК), которые сейчас используются в научных
лабораториях различных стран мира [26].
Я надеюсь, что многообразный мир
растений, преподнесет немало находок и открытий, которые послужат надежным
инструментом в борьбе за здоровье человека.
Список литературы
1. Алексеева Г.М., Белодубровская Г.А., Блинова К.Ф.,Гончаров
М.Ю., Жохова Е.В. Фармакогнозия: Лекарственное сырье растительного и животного
происхождения: учебное пособие. Санкт-Петербург СпецЛит, 2013. С. 378.
2. Балицкий, К.П. Лекарственные растения в терапии
злокачественных опухолей. Ростов-на Дону: Изд-во Ростовского университета,
1980. С. 295.
. Бандюкова, В.А. Применение цветных реакций для
обнаружения флавоноидов путем хроматографии на бумаге/В.А. Бандюкова //
Растительные ресурсы.-1965.- Т. 1.- Вып. 4.- С. 591-597
. Барнаулов О.Д. Сравнительная оценка влияния
фитопрепаратов из растений флоры России на концентрацию инсулина и глюкозы в
крови крыс с экспериментальным аллоксановым диабетом. Психофармакология и
биологическая наркология. Выпуск №3-4/том 8/2008
. Государственная Фармакопея Республики Беларусь/ Центр
экспертиз и испытания в здравоохранении// Под общ. ред. А.А. Шерякова -
Молодечно: Типография “Победа”, 2006.-2009. - Т.2:Контроль качества
вспомогательных веществ и лекарственного растительного сырья.-2008. С. 472.
. Государственная фармакопея СССР ХI, выпуск 1,
издательство «Медицина» Москва - 1987 С. 278-279
. Государственная фармакопея СССР Х издательство «Медицина»
Москва - 1968. С. 308-596
. Гринкевич Н.И., Сафронич Л.Н., химический анализ
лекарственных растений. Москва «высшая школа» 1983. С. 58-59
. Государственная фармакопея СССР ХI, выпуск 2,
издательство «Медицина» Москва - 1990. С. 275-366
. Запрометов, М.Н. Фенольные соединения. Распространение,
метаболизм и функции в растениях/М.Н. Запрометов - М.: Наука,1993. С. 272.
. Ишмуратова, М.М. О фармакологических и экологических
свойствах видов рода Rhodiola, определяемых их химическим составом/М.М.
Ишмуратова //Вестник Башкирского университета.-2001.- Т.2.- № 2.- С.74-76
. Козин С.В., Крендаль Ф.П., Левина Л.В., Чубарев В.Н.,
Сравнение общетоксического действия препаратов родиолы розовой
биотехнологического и природного происхождения журнал биомедицина выпуск №3 том
1 - 2011.
. Костина, В.М. Особенности фенольного метаболизма
растений/В.М. Костина- М.: Институт физиологии растений им.К.А.Тимирязева
РАН,2009. С. 109.
. Кретович, В.Л. Биохимия растений/Л.В.Кретович. - М.:
Высшая школа,1980. С. 445.
. Кулак, В.А. Содержание флавоноидов и фенолгликозидов в
листьях белорусских видов ив/ В.А. Кулак, Н.А. Кузьмичева//Информационно-
маркетинговый центр молодежной науки в Беларуси.- Режим доступа: URL:
htpp://www.metolit.by (Дата доступа: 21.02.2010)
. Машковский Д.М., Лекарственные средства. Пособие для
врачей том 1, 14 издание, переработанное, исправленное и дополненное, Москва
ООО «новая волна», издатель С.Б.Дивов, 2002. С. 491-492.
. Охрименко, Л.П., Калинкина Г.И., Дмитрук С.Е.
Сравнительное исследование толокнянки, брусники и близких к ним видов,
произрастающих в Республике Саха (Якутия). Химия растительного сырья.- 2005.-
№1.- С. 31-36
. Самылина И.А., Аносова О.Г., Фармакогнозия атлас том 2,
лекарственное растительное сырье. Анатомо-диагностические признаки
фармакопейного и нефармакопейного лекарственного растительного сырья., Москва
издательская группа «Гэотар-Медиа» 2007 С. 9-36
. Самылина И.А., Яковлев Г.П., Фармакогнозия: учебник.
Москва издательская группа «Гэотар-Медиа» 2013 С. 409-429
. Федько И.В., Китапова Р.Р., Хващевская А.А., Камбалина
М.Г., Характеристика элементного состава папоротников, произрастающих на
территории Западной Сибири. Фундаментальные исследования 2013 № 6(5) С.
1193-1195
. Халецкий, А.М. Фармацевтическая химия/А.М. Халецкий- Л.:
Медицина, 1966. С. 748.
. Шмерко, Е.П. Лечение и профилактика растительными
средствами/ Е.П. Шмерко, И.Ф.Мазан - Баку: Издательство «Азербайджан»,1992. С.
314.
. European Pharmacopoeia: 5th Edition /
Strasbourg.-2004.-5439 p.
. Mabry, T.J The systematic identification of Flavonoids /
T.J. Mabry, K.R. Markham, M.B. Thomas-New York etc. Springer - Verlag, 1970. -
354 p.
. Niessen, W.M. Liquid Cromatography - Mass Spectrometry/
W.M.Niessen, A. van der Greef-New York: Marcel Dekker, 1992. - 315 p.
. Pearl, I.A., Darling S.F. Spectrometry as an aid for
determining structures ol naturall glucosides/ I.A. Pearl, S.F. Darling//
Phytochem.- 1989.- Vol. 7. - №5. - P. 831-836.