Сравнительная оценка клиники, течения и терапии инфаркта миокарда у больных в хирургической и терапевтической клинике
Выпускная
квалификационная работа
Сравнительная
оценка клиники, течения и терапии инфаркта миокарда у больных в хирургической и
терапевтической клинике
Оглавление
инфаркт миокард фармакотерапия
хирургический
Список
сокращений и условных обозначений
Введение
Глава
1. Обзор литературы. Современные представления об остром инфаркте миокарда
.1
Этиология и патогенез
.2
Классификация острого инфаркта миокарда
.3
Стандарты диагностики острого инфаркта миокарда
.4
Стандарты лечения больных острым инфарктом миокарда
Глава
2. Анализ результатов обследования и лечения больных острым инфарктом миокарда
в хирургической и терапевтической клинике БГМУ
.1
Клинико-функциональная характеристика больных
.2
Методы исследования
.3
Результаты исследований
Глава
3. Фармакотерапия
Заключение
Выводы
Практические
рекомендации
Список
использованной литературы
Список сокращений и условных обозначений
ИМ - инфаркт миокарда
ИБС - ишемическая болезнь сердца
БГМУ - Башкирский государственный медицинский
университет
ОИМ - острый инфаркт миокарда
КБГМУ - Клиника Башкирского Государственного
Медицинского Университета
ЭКГ - электрокардиограмма
ЭХО-КГ - ЭХО-кардиография
СКВ - Системная красная волчанка
КА - Коронарная артерия
ЧКВ - чрескожное вмешательство
АКШ - аортокоронарное шунтирование
АВ - атриовентрикулярный
ЦНС - центральная нервная система
АД - артериальное давление
СОЭ - скорость оседания эритроцитов
ИМ с ЛИ - инфаркт миокарда с летальным исходом
ИМ без ЛИ - инфаркт миокарда без летального
исхода
БЛНПГ - блокада левой ножки пучка Гиса
БПНПГ - блокада правой ножки пучка Гиса
ФВ - фракция выброса
АСК - ацетилсалициловая кислота
иАПФ - ингибитор ангиотензинпревращающего
фермента
АРА - антагонист рецепторов ангиотензина
ААЛС - антиаритмические лекарственные средства
ГБ - гипертоническая болезнь
ХСН - хроническая сердечная недостаточность
ССЗ - сердечно-сосудистые заболевания
Введение
Актуальность проблемы. ХХI век характеризуется
многими социальными проблемами, в том числе ростом заболеваемости и смертности
населения. Нынешний этап развития нашего общества связан с демографическим
кризисом, снижением продолжительности жизни, снижением психического состояния
населения страны, что вызывает обеспокоенность многих ученых и специалистов.
Особую остроту в период социальных перемен
приобретает проблема заболеваемости инфарктом миокарда.
Факторы риска (курение, избыточный вес,
гиперхолестеринэмия, нарушение питания, стрессы, наследственность, условия
труда и отдыха, гиподинамия, возраст) наносят непоправимый урон физическому
здоровью населения России.
Это обстоятельство определило, в частности,
внимание к проблеме заболевания инфарктом миокарда со стороны медицины, но в
гораздо меньшей степени оно осмысливается в рамках социологии. Это говорит о
том, что общество еще не осознает заболевание инфарктом миокарда как социально
значимую проблему. Хотя медицинские исследования убедительно доказывают
разрушительное воздействие факторов риска на возникновение инфаркта миокарда.
Среди различных заболеваний населения ряд
болезней имеет особо важное социальное значение. Значимость таких заболеваний
связана не только и даже не столько с их широким распространением, сколько с
той ролью, которые эти заболевания играют в смертности и инвалидизации
населения, в экономическом ущербе для экономики страны из-за временной утраты
трудоспособности, инвалидности и преждевременной смерти.
Одной из самых актуальных проблем научной
медицины практического здравоохранения второй половины ХХ века и начале ХХI
века являются болезни системы кровообращения. Социальное значение этих
заболеваний определяется не только, а вернее не столько частотой
распространения, сколько их тяжестью. Эти болезни занимают ведущее второе место
среди всех причин смерти в большинстве экономически развитых странах мира, в
том числе и в России. В нашей стране болезни системы кровообращения занимают
первое место среди причин инвалидности.
Инфаркт миокарда - очень распространенное
заболевание, является самой частой причиной внезапной смерти. Проблема инфаркта
до конца не решена, смертность от него продолжает увеличиваться. Сейчас все
чаще инфаркт миокарда встречается в молодом возрасте. В возрасте от 35 до 50
лет инфаркт миокарда встречается в 5 раз чаще у мужчин, чем у женщин.
Цель исследования. Изучить особенности
клинического течения, диагностики и терапии ОИМ у больных в хирургической и
терапевтической клинике.
Задачи. В соответствии с целью исследования были
поставлены следующие задачи:
. Оценить степень соответствия медицинской
помощи в клинике существующим стандартам диагностики и лечения ОИМ в
неспециализированных лечебных учреждениях.
. Выявить особенности и различия тактики ведения
пациентов с ОИМ в хирургических и терапевтических отделениях ГКБ №18.
Материал и методы исследования. В основу
выпускной квалификационной работы положен ретроспективный анализ результатов
клинического обследования и лечения 48 больных (16 случаев ОИМ в хирургических
отделениях, 32 случая в терапевтических отделениях) перенесших острый инфаркт
миокарда, находившихся на стационарном лечении в ГКБ №18 в 2011 году.
Все больные были обследованы в
условиях ГКБ №18, где была проведена верификация диагноза ОИМ, наличие
осложнений основного заболевания. Диагноз заболевания основывался на изучении
анамнеза, всем больным проводилось медицинское обследование, включавшее клинический
осмотр, общий анализ крови, мочи, биохимическое исследование крови, ЭКГ,
рентгенологическое исследование органов грудной клетки, качественный
тропониновый тест, ЭХО-КГ; в группе с летальным исходом также проводилось
патологоанатомическое исследование.
Практическая значимость. Выявление
несоответствия объема оказания медицинской помощи в клинике существующим
стандартам диагностики и лечения ОИМ, особенностей и различий тактики ведения
пациентов с ОИМ в хирургических и терапевтических отделениях ГКБ №18 позволит
выработать практические рекомендации для более эффективного ведения пациентов
для снижения риска летальных исходов, повторных ИМ и осложнений течения ОИМ.
Глава 1. Обзор литературы. Современные
представления об остром инфаркте миокарда
Инфаркт миокарда (ИМ) - наиболее тяжелый и
опасный для больных клинический вариант ИБС. Патоморфологическим проявлением
его является очаговый некроз миокарда, который возникает вследствие острой
коронарной недостаточности, обусловленной тромбозом или длительным спазмом
коронарных сосудов. В большинстве случаев ИМ развивается у больных, страдающих
выраженным коронарным склерозом с уменьшением коронарного кровотока по основным
артериальным стволам не менее чем на 70%. Спазм малоизмененных коронарных
сосудов как причина ИМ встречается значительно реже и преимущественно у лиц
молодого возраста.
.1 Этиология и патогенез
Основной причиной ИМ является атеросклероз и
только у незначительной части больных - другие заболевания, приводящие к
сужению или эмболии коронарных сосудов: септический эндокардит, системные
васкулиты, расслаивающая аневризма аорты со сдавлением устья коронарных
сосудов. Атеросклерозом коронарных сосудов в значительной степени обусловлено
формирование тромбов, которые являются у большинства больных непосредственной
причиной острой коронарной недостаточности. Развитию ИМ способствует
стенозирующий атеросклероз, нарушение целостности атероматозной бляшки и резкое
повышение потребности миокарда в кислороде при физическом напряжении,
гипертонических кризах, эмоциональных стрессах и острых инфекционных
заболеваниях.
Основные причины возникновения инфаркта миокарда
кроме атеросклероза и коронароспазма:
. Заболевания коронарных артерий.
А. Артерииты:
люетический
узловой полиартериит
СКВ
анкилозирующий спондилит
ревматоидный артрит
синдром Кавасаки
Б. Травмы артерий
В. Утолщение артериальной стенки вследствие
болезней обмена или пролиферации
Интимы:
мукополисахаридоз
болезнь Фабри
амилоидоз
ювенильный идеопатический кальциноз артерий
прием контрацептивных препаратов или изменения
интимы в послеродовом периоде
Г. Расслоение аорты и коронарных артерий.
. Эмболии коронарных артерий:
инфекционный эндокардит
пролапс митрального клапана
тромбоэмболии из левых камер сердца
миксома сердца
тромбообразование на имплантированных клапанах
или при коронарографии и хирургических вмешательствах на коронарных артериях.
. Врожденные дефекты коронарных артерий
. Резкое несоответствие потребности миокарда в
кислороде и его поступления.
аортальные пороки сердца
отравление углекислым газом
тиреотоксикоз
длительная артериальная гипотензия
. Нарушения коагуляции
полицитемия
тромбоцитоз
диссеминированное внутрисосудистое свертывание
тромбоцитопеническая пурпура.
Факторы риска
Табакокурение и пассивное курение
Возраст
Мужчины чаще страдают от инфаркта миокарда, чем
женщины
Нерегулярное и неправильное питание
Ожирение
Гиподинамия
Употребление алкоголя
Психическое и физическое перенапряжение
Сахарный диабет
Генетическая неполноценность регуляции
Патогенез
В патогенезе инфаркта миокарда различают стадии:
1. Ишемии
2. Повреждения (некробиоза)
. Некроза
. Рубцевания
Возникновению тромбоза КА способствуют местные
изменения интимы сосудов (разрыв атеросклеротической бляшки или трещина в
покрывающей ее капсуле, реже кровоизлияние в бляшку), а также повышение
активности свертывающей и снижение активности антисвертывающей системы. При
повреждении бляшки коллагеновые волокна обнажаются, в месте повреждения
происходит адгезия и агрегация тромбоцитов, выделение тромбоцитарных факторов
свертывания крови и активация плазменных факторов коагуляции. Образуется тромб,
закрывающий просвет артерии. Тромбоз КА, как правило, сочетается с ее спазмом.
Возникшая острая окклюзия коронарной артерии вызывает ишемию миокарда и, если не
происходит реперфузия, - его некроз. Накопление недоокисленных продуктов обмена
при ишемии миокарда ведет к раздражению интерорецепторов миокарда или
кровеносных сосудов, что реализуется в виде появления резкого болевого
приступа.
К факторам, определяющим размеры ИМ, относятся:
. Анатомические особенности КА и тип
кровоснабжения миокарда.
. Защитное влияние коронарных коллатералей. Они
начинают функционировать при уменьшении просвета КА на 75%. Выраженная сеть
коллатералей может затормозить темп и ограничить размеры некроза. Коллатерали
лучше развиты у больных с нижним ИМ. Поэтому передние ИМ поражают большую
область миокарда и чаще заканчиваются смертью.
. Реперфузия окклюзионной КА. Восстановление
кровотока в первые 6 ч улучшает внутрисердечную гемодинамику и ограничивает
размеры ИМ. Однако возможен и неблагоприятный эффект реперфузии: реперфузионные
аритмии, геморрагический ИМ, отек миокарда.
. Развитие "оглушения" миокарда
(stunned myocardium), при котором задерживается на определенное время
восстановление сократительной функции миокарда.
. Другие факторы, в т.ч. влияние медикаментов,
которые регулируют кислородные потребности миокарда.
Локализация инфаркта миокарда и некоторые его
клинические проявления определяются локализацией нарушения коронарного кровообращения
и индивидуальными анатомическими особенностями кровоснабжения сердца. Тотальная
или субтотальная окклюзия передней нисходящей ветви левой коронарной артерии
обычно приводит к инфаркту передней стенки и верхушки левого желудочка,
передней части межжелудочковой перегородки, иногда - папиллярных мышц. В связи
с большой распространенностью некроза часто возникает ишемия ножек пучка Гиса и
дистальная атриовентрикулярная блокада. Гемодинамические нарушения выражены в
большей степени, чем при заднем инфаркте миокарда. Поражение огибающей ветви
левой коронарной артерии вызывает в большинстве случаев некроз боковой стенки
ЛЖ и (или) его заднебоковых отделов. При наличии более обширного бассейна этой
артерии ее проксимальная окклюзия приводит к ишемии также заднедиафрагмальной
области левого, частично правого желудочка и задней части межжелудочковой
перегородки также, что приводит к возникновению атриовентрикулярной блокады.
Нарушение кровоснабжения синусового узла способствует возникновению аритмий.
Окклюзия правой коронарной артерии сопровождается инфарктом заднедиафрагмальной
области ЛЖ и довольно часто инфарктом задней стенки правого желудочка. Реже
наблюдается поражение межжелудочковой перегородки. Часто развивается ишемия
атриовентрикулярного узла и ствола пучка Гиса, несколько реже - синусового узла
с соответствующими нарушениями проводимости.
.2 Классификация острого инфаркта миокарда
По стадиям развития:
Продромальный период (0-18 дней)
Острейший период (до 2 часов от начала ИМ)
Острый период (до 10 дней от начала ИМ)
Подострый период (с 10 дня до 4-8 недель)
Период рубцевания (с 4-8 нед до 6 месяцев)
По анатомии поражения:
Трансмуральный
Интрамуральный
Субэндокардиальный
Субэпикардиальный
По объему поражения:
Мелкоочаговый, не Q-инфаркт
Локализация очага некроза.
Инфаркт миокарда левого желудочка (передний,
боковой, нижний, задний).
Изолированный инфаркт миокарда верхушки сердца.
Инфаркт миокарда межжелудочковой перегородки
(септальный).
Инфаркт миокарда правого желудочка.
Сочетанные локализации: задне-нижний,
передне-боковой и др.
По течению:
Моноциклическое
Затяжное
Рецидивирующий ИМ (в 1у коронарную артерию
подсыпает, новый очаг некроза от 72 часов до 8 дней)
Повторный ИМ (в другую КА, новый очаг некроза через
28 дней от предыдущего ИМ)
Клиническая классификация, подготовленная
объединенной рабочей группой Европейского общества кардиологов, Американского
кардиологического колледжа, Американской ассоциации сердца и Всемирной
кардиологической федерации (2007):
Спонтанный ИМ (тип 1), связанный с ишемией
вследствие первичного коронарного события, такого как эрозия бляшки и/или
разрушение, растрескивание или расслоение.
Вторичный ИМ (тип 2), связанный с ишемией,
вызванной увеличением недостатка кислорода или его поступления, например, при
коронарном спазме, коронарной эмболии, анемии, аритмии, гипер- или гипотензии.
Внезапная коронарная смерть (тип 3), включая
остановку сердца, часто с симптомами предполагаемой ишемии миокарда с ожидаемой
новой элевацией ST и новой блокадой левой ножки пучка Гиса, выявлением свежего
тромба коронарной артерии при ангиографии и/или ауто-псии, наступившей смертью
до получения образцов крови или перед повышением концентрации маркеров.
ЧКВ-ассоциированный ИМ (тип 4а).
ИМ, связанный с тромбозом стента (тип 4б),
который подтвержден ангиографией или аутопсией.
АКШ-ассоциированный ИМ (тип 5).
Нужно иметь ввиду, что иногда у пациентов может
возникать несколько типов ИМ одновременно или последовательно. Следует учесть,
что термин "инфаркт миокарда" не входит в понятие "некроз
кардиомиоцитов" вследствие проведения АКШ (отверстие в желудочке,
манипуляции с сердцем) и влияния следующих факторов: почечной и сердечной
недостаточности, кардиостимуляции, электрофизиологической абляции, сепсиса,
миокардита, действия кардиотропных ядов, инфильтративных заболеваний.
Клиническая картина
Типичным клиническим проявлением является
тяжелый и продолжи тельный сердечно-болевой приступ. Боль не снимается приемом
нитратов, требует применения наркотиков или нейролептанальгезии (status
anginosus).
Она интенсивная, может быть давящей, сжимающей
жгучей, иногда острой, "кинжальной", чаще локализуется за грудиной с
различной иррадиацией. Боль волнообразная (то усиливается, то ослабевает),
продолжается более 30 мин, иногда несколько часов сопровождается чувством
страха, возбуждением, тошнотой, резкой слабостью, потливостью.
Могут быть одышка, нарушения сердечного ритма и
проводимости, цианоз. В анамнезе у значительной часта таких больных имеются
указания на приступы стенокардии и факторы риска ИБС Больные, испытывающие
интенсивную боль, часто возбуждены беспокойны, мечутся в отличие от больных
стенокардией, которые "замирают" во время болевого приступа.
При обследовании больного отмечается бледность
кожных покровов, цианоз губ, повышенная потливость, ослабление I тона,
появление ритма галопа, иногда шум трения перикарда. АД чаще снижается.
В первые сутки нередко наблюдается тахикардия,
различные нарушения ритма сердца, к концу первых суток - повышение температуры
тела до субфебрильных цифр, которое сохраняется в течение 3-5 суток. В 30%
случаев могут быть атипичные формы ИМ: гастралгическая, аритмическая,
астматическая, цереброваскулярная, бессимптомная, коллаптоидная, по типу
рецидивирующих приступов стенокардии,в правожелудочковой локализацией.
Гастралгический вариант инфаркта миокарда
характеризуется появлением болевого приступа в эпигастральной области с
распространением в загрудинное пространство. Одновременно возникают
диспептические жалобы: отрыжка воздухом, икота, тошнота, многократная рвота,
вздутие живота с ощущением расширения брюшной полости. Гастралгический вариант
инфаркта миокарда следует дифференцировать с пищевой токсикоинфекцией,
прободной язвой желудка, панкреатитом.
Астматический вариант инфаркта миокарда характеризуется
развитием острой левожелудочковой недостаточности, которая как бы затушевывает
болевой синдром, проявляется в виде приступа удушья.
Аритмический вариант инфаркта миокарда
характеризуется возникновением острого нарушения ритма с развитием угрожающей
для жизни аритмии. Сюда относятся политопная желудочковая экстрасистолия,
желудочковая тахикардия, фибрилляция желудочков, пароксизмальная тахикардия,
мерцательная аритмия, нарушение проводимости сердца.
Церебральный вариант инфаркта миокарда. Обусловлен
развитием нарушения церебрального кровообращения в остром периоде инфаркта
миокарда, что связано с уменьшением кровоснабжения головного мозга, особенно
при развитии кардиогенного шока. Будет проявляться появлением общемозговых
симптомов с явлениями ишемии мозга: тошнота, головокружение, нарушение
сознания, с развитием обморока и также в виде очаговых симптомов со стороны
головного мозга, симулируя нарушение мозгового кровообращения в той или иной
области головного мозга.
Бессимптомный вариант инфаркта миокарда
характеризуется отсутствием клинических проявлений инфаркта миокарда и
неожиданным проявлением на ЭКГ острого инфаркта миокарда. Частота этого
варианта колеблется от одного до десяти процентов среди всех атипичных форм
заболевания.
Рецидивирующий инфаркт миокарда характеризуется
длительным, затяжным течением на протяжении 3-4 недель и дольше. В основе этой
формы заболевания лежат замедленные процессы замещения соединительной ткани
участков некроза в сердечной мышце.
Клиническая картина рецидивирующего инфаркта
миокарда характеризуется проявлением особо частых приступообразных загрудинных
болей, развитием болевого приступа различной интенсивности, который может
сопровождаться развитием острых нарушений ритма, кардиогенного шока. Нередко
рецидивирующий инфаркт миокарда развивается по астматическому варианту течения.
Кроме того, могут наблюдаться острые стрессовые
эрозии и язвы желудочно-кишечного тракта, которые нередко осложняются
кровотечением, острая почечная недостаточность, острые психозы.
Осложнения ранние:
острая сердечная недостаточность
кардиогенный шок
нарушения ритма и проводимости (довольно частое
осложнение)
тромбоэмболические осложнения
разрыв миокарда с развитием тампонады сердца.
Вероятность данного осложнения при современной терапии составляет около 1%.
перикардит
Поздние осложнения:
постинфарктный синдром (синдром Дресслера)
тромбоэмболические осложнения
хроническая сердечная недостаточность
аневризма сердца
Кроме того, могут наблюдаться острые стрессовые
эрозии и язвы желудочно-кишечного тракта, которые нередко осложняются
кровотечением, острая почечная недостаточность, острые психозы.
Нарушения ритма и проводимости наблюдаются у 90%
больных в остром периоде инфаркта миокарда. Форма нарушений ритма и
проводимости иногда зависит от локализации ИМ.
Так, при нижнем (диафрагмальном) ИМ чаще
встречаются брадиаритмии, связанные с преходящими нарушениями функции
синусового узла и атриовентрикулярной проводимости, синусовая аритмия,
синусовая брадикардия, атриовентрикулярная блокада различной степени. При
переднем ИМ чаще наблюдаются синусовая тахикардия, внутрижелудочковые нарушения
проводимости, АВ-блокада III ст. типа Мобитц-2 и полная дистальная АВ-блокада.
Почти в 100% случаев встречаются суправентрикулярные и желудочковые
экстрасистолы, в том числе политопные, групповые, ранние.
Прогностически неблагоприятным нарушением ритма
является пароксизмальная желудочковая тахикардия. Самой частой непосредственной
причиной смерти больных острым ИМ является фибрилляция желудочков.
Кардиогенный шок - синдром, развивающийся
вследствие резкого снижения насосной функции левого желудочка,
характеризующийся неадекватным кровоснабжением жизненно важных органов с
последующим нарушением их функции. Шок при ИМ возникает как следствие
повреждения более 30% кардиомиоцитов левого желудочка и его неадекватного
наполнения.
Резкое ухудшение кровоснабжения органов и тканей
обусловлено: снижением сердечного выброса, сужением периферических артерий,
уменьшением объема циркулирующей крови, открытием артериовенозных шунтов,
внутрисосудистои коагуляцией и расстройством капиллярного кровотока
("сладж-синдром"). К основным критериям кардиогенного шока относятся:
периферические признаки (бледность, холодный
пот, спавшиеся вены) и нарушение функций ЦНС (возбуждение или заторможенность,
спутанность сознания либо его временная потеря);
резкое падение АД (ниже: 90 мм рт.ст.) и
уменьшение пульсового давления ниже 25 мм рт.ст.;
олигоанурия с развитием острой почечной
недостаточности;
давление "заклинивания" в легочной
артерии более 15 мм рт.ст.;
сердечный индекс менее 2,2 л/(мин-м2).
При инфаркте миокарда различают следующие виды
кардиогенного шока: рефлекторный, истинный кардиогенный, аритмический и
связанный с разрывом миокарда. При тяжелом течении кардиогенного шока,
рефрактерном к проводимой терапии, говорят об ареактивном шоке. Рефлекторный
шок развивается на фоне ангинозного статуса. Ведущим механизмом его развития
являются рефлекторные гемодинамические реакции на боль. Этот вариант шока чаще
наблюдается при заднем инфаркте миокарда. Обычно это шок с вазодилатацией, со
снижением как систолического, так и диастолического АД и с относительным
сохранением (в пределах 20-25 мм рт.ст.) пульсового АД. После своевременного и
адекватного обезболивания, однократного введения адреномиметиков гемодинамика,
как правило, восстанавливается. При истинном кардиогенном шоке основным
патогенетическим механизмом является резкое снижение сократительной функции
миокарда при обширном ишемическом повреждении (более 40% миокарда), уменьшение
сердечного выброса.
По мере прогрессирования шока развивается
синдром диссеминированного внутрисосудистого свертывания, нарушения
микроциркуляции с образованием микротромбозов в микроциркуляторном русле. При
аритмическом шоке ведущую роль играют нарушения гемодинамики, обусловленные
нарушениями сердечного ритма и проводимости: пароксизмальной тахикардией или
высокой степенью атриовентрикулярной блокады.
Ареактивный кардиогенный шок представляет собой
шок: в необратимой стадии как возможный исход предыдущих его форм, чаще истинного.
Проявляется быстрым падением гемодинамики, тяжелой полиорганной
недостаточностью, выраженным диссеминированным внутрисосудистым свертыванием
крови и заканчивается летальным исходом.
К основным механизмам развития острой
левожелудочковой недостаточности относятся сегментарные нарушения сократимости
миокарда, его систолическая и/или диастолическая дисфункция. В соответствии с
классификацией Killip выделяют 4 класса острой левожелудочковой
недостаточности. Классификация острой левожелудочковой недостаточности у
больных острым инфарктом миокарда по Killip
Характеристика класса
Признаки сердечной недостаточности отсутствуют
Влажные хрипы, преимущественно в нижних отделах
легких, трехчленный ритм (ритм галопа), повышение центрального венозного
давления
Отек легких
Кардиогенный шок, часто в сочетании с отеком
легких, как правило, развитие отека легких связано с обширным поражением
миокарда с вовлечением в процесс более 40% массы миокарда ЛЖ, возникновением
острой аневризмы ЛЖ или острой митральной недостаточности вследствие отрыва или
дисфункции папиллярных мышц.
Острый интерстициальный отек легких,
проявляющийся типичным приступом сердечной астмы, связан с массивным
накоплением жидкости в интерстициальном пространстве легких, значительной
инфильтрацией серозной жидкостью межальвеолярных перегородок, периваскулярных и
перибронхиальных пространств и существенным повышением сосудистого
сопротивления. Важным патогенетическим звеном альвеолярного отека легких
является проникновение транссудата в полость альвеол и пенообразование. Дыхание
становится клокочущим, выделяется пенистая, иногда розовая мокрота в большом
количестве - "утопление в собственной мокроте". Резко повышается
давление заклинивания в капиллярах легких (до 20 и более мм рт. ст.), снижается
сердечный выброс (менее 2,2 л/мин/м2).
Разрыв сердца обычно возникает на 2-14 день
заболевания.Провоцирующий фактор - недостаточное соблюдение больным постельного
режима. Характеризуется резкой болью с последующей потерей сознания,
бледностью, цианозом лица, шеи с набуханием шейных вен; исчезает пульс, АД.
Характерен симптом электромеханической диссоциации - прекращение механической
деятельности сердца при сохранении на короткий период электрических потенциалов
сердца, что проявляется на ЭКГ наличием синусового или идиовентрикулярного
ритма. Летальный исход наступает в пределах от нескольких секунд до 3-5 минут.
Для разрыва межжелудочковой перегородки
характерны резкая боль в сердце, падение АД, быстрое развитие правожелудочковой
недостаточности (набухание шейных вен, увеличение и болезненность печени,
повышение венозного давления); грубый систолический шум над всей областью
сердца, лучше выслушивается над средней третью грудины и в 4-5 межреберье слева
от нее. При разрыве папиллярной мышцы возникают резчайшие боли в области
сердца, коллапс, быстро развивается острая левожелудочковая недостаточность,
появляется грубый систолический шум, проводящийся в левую подмышечную область,
вследствие регургитации крови в левое предсердие, иногда шум писка.
Аневризма сердца может формироваться в остром и
реже подостром периоде. Критерии аневризмы: прогрессирующая недостаточность
кровообращения, прекардиальная пульсация в III-IV
межреберье слева, систолический или (реже) систолодиастолический шум в области
пульсации, на ЭКГ - "застывшая" монофазная кривая, типичная для
трансмурального инфаркта миокарда. При рентгенологическом исследовании
отмечается парадоксальная пульсация аневризмы, на рентгенокимограмме или при
ультразвуковом сканировании сердца выявляются зоны акинезии. Нередко аневризма
сердца осложняется пристеночным тромбэндокардитом, который проявляется
длительным лихорадочным состоянием, лейкоцитозом, увеличением СОЭ, стабильной
стенокардией, возникновением тромбоэмболического синдрома - в сосуды мозга,
магистральные сосуды конечностей, мезентериальные сосуды, при перегородочной
локализации - в систему легочной артерии.
Постинфарктная недостаточность кровообращения
протекает в основном по левожелудочковому типу, однако позднее может
присоединиться и правожелудочковая недостаточность.
Постинфарктный кардиосклероз. Диагноз ставится
не ранее чем через 2 месяца с момента возникновения инфаркта миокарда.
Постинфарктный кардиосклероз диагностируется на основании патологических
изменений ЭКГ в отсутствие клинических и биохимических (повышение активности
ферментов) признаков острого инфаркта миокарда. Если на ЭКГ нет признаков
перенесенного в прошлом инфаркта миокарда, диагноз постинфарктного
кардиосклероза может быть поставлен на основании медицинской документации
(изменения ЭКГ и повышение активности ферментов в анамнезе). Тяжесть состояния
больного ИБС с постинфарктным кардиосклерозом определяется по наличию и
характеру аритмии, наличию и выраженности сердечной недостаточности. Сердечная
недостаточность характеризуется этапным течением: вначале она протекает по
левожелудочковому типу и лишь в поздних стадиях становится бивентрикулярной. Ей
часто сопутствует мерцательная аритмия, вначале пароксизмальная, затем
постоянная, а также цереброваскулярная недостаточность. Данные физикального
обследования не специфичны. В тяжелых случаях может наблюдаться ортопноэ,
возможны приступы сердечной астмы и отека легких, особенно при сопутствующей
артериальной гипертензии, альтернирующий пульс.
Относительно поздно присоединяются признаки
правожелудочковой недостаточности. Верхушечный толчок постепенно смещается
влево и вниз. При аускультации отмечается ослабление 1 тона на верхушке, может
выслушиваться ритм галопа, короткий систолический шум в проекции митрального
клапана. На ЭКГ определяются очаговые изменения после перенесенного инфаркта
миокарда, а также в различной степени выраженности диффузные изменения.
Возможны признаки хронической аневризмы сердца,
однако диагностическая ценность ЭКГ в данном случае меньше, чем информативность
эхокардиографии. Часто отмечается гипертрофия левого желудочка, блокада ножек
пучка Гиса.
В ряде случаев можно выявить признаки безболевой
субэндокардиальной ишемии в виде депрессии сегмента ST более чем на 1 мм,
иногда в сочетании с отрицательным зубцом Т. Интерпретация этих изменений может
быть неоднозначной из-за их неспецифичности. Более информативной является
регистрация преходящей ишемии (безболевой или болевой) при нагрузочных пробах
или при холтеровском мониторировании. При рентгенологическом исследовании
сердце умеренно увеличено, главным образом, за счет левых отделов. На
эхокардиограмме определяется дилатация левого желудочка, часто его умеренная
гипертрофия. Характерны локальные нарушения сегментарной сократимости, включая
признаки аневризмы. В далеко зашедших случаях гипокинезия носит диффузный
характер и обычно сопровождается дилатацией всех камер сердца. Как проявление
дисфункции сосочковых мышц, возможно незначительное нарушение движения створок
митрального клапана. Аналогичные изменения наблюдаются и при вентрикулографии.
Сцинтиграфия миокарда способствует выявлению стойких очагов гипоперфузии
различных размеров, нередко множественных, и преходящую очаговую гипоперфузию
при стресс-тестах вследствие усиления ишемии миокарда.
По величине рубца невозможно достаточно точно
оценивать состояние больного. Решающее значение имеет функциональное состояние
коронарного кровообращения в участках миокарда вне рубца. Это состояние
определяется по наличию или отсутствию у больного приступов стенокардии, по
толерантности к физической нагрузке. Коронарография показывает, что состояние
коронарных артерий у больных постинфарктным кардиосклерозом может значительно
различаться (от трехсосудистого поражения до неизмененных коронарных артерий).
Стенозирующих изменений в коронарных артериях у больных постинфарктным
кардиосклерозом может не быть, если произошла полная реканализация сосуда в зоне,
поражение которой привело к инфаркту миокарда. Обычно эти больные не имеют
стенокардии. Кроме окклюзионного поражения в сосуде зоны рубца, возможно
поражение одной или двух магистральных коронарных артерий. У этих больных
наблюдаются стенокардия и снижение толерантности к физической нагрузке.
Наличие стенокардии, которая является одним из
важнейших клинических критериев состояния больного постинфарктным
кардиосклерозом, существенно влияет на течение и прогноз заболевания Известно,
что преходящая ишемия миокарда ведет к дисфункции в зона поражения. При
ангинозном приступе, вызванном физической нагрузкой, нарушения сократительной
функции миокарда могут быть настолько выраженными, что развивается приступ
сердечной астмы или отек легких. Аналогичный приступ астмы у больных
постинфарктным кардиосклерозом может развиться в ответ на тяжелый приступ
спонтанной стенокардии. Прогрессирование коронарного атеросклероза
сопровождается все большим поражением миокарда - его дилатацией, снижением
сократительной способности, приводящем к сердечной недостаточности.
По мере дальнейшего прогрессирования наступает
такой период, когда на физическую нагрузку больной всегда реагирует одышкой, а
не ангинозным приступом. Трансформируются клинические проявления приступов
ишемии миокарда. Обычно в этот период у больных обнаруживают клинические
признаки выраженной застойной сердечной недостаточности. Сохраняющаяся после ИМ
стабильная стенокардия напряжения также отягощает прогноз жизни. При
сохраняющейся после ИМ стенокардии напряжения необходимо определить показания к
проведению коронарографии для определения возможности радикального
вмешательства - АКШ или транслюминальной ангиопластики, возможно с применением
агентирования сосуда. У женщин с постинфарктной стенокардией прогноз после ИМ
хуже, чем у мужчин.
.3 Стандарты диагностики острого инфаркта
миокарда
Достоверный диагноз инфаркта миокарда требует
сочетания как минимум двух из следующих трех критериев:
) длительный приступ боли в грудной клетке;
) изменения ЭКГ, характерные для ишемии и
некроза;
) повышение активности ферментов крови.
Различные локализации ИМ НА ЭКГ
Перегородочный V1,V2, V1-V2
Передний V3,V4
Переднеперегородочный V1-V4
Боковой I, aVL, V5-V6
Переднебоковой I, aVL, V3 -V6
Задне-диафрамальный II, III, aVF
Задне-базальный V7 - V9 , увеличение зубца R,
снижение сегмента ST и увеличение зубца Т в отведениях V1,V2.
Крупноочаговый инфаркт, трансмуральный (некроз,
захватывающий все слои миокарда), Q-инфаркт. Для данного типа характерна
следующая картина ЭКГ.
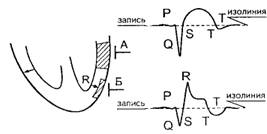
А - электрод, регистрирует зубец Q,
Б - электрод, направленный на регистрацию зубца
R).
Измеряя амплитуду зубцов R и Q, можно определить
глубину поражения сердца в зоне инфаркта. Существует деление крупноочагового
инфаркта миокарда на трансмуральный (в этом случае R-зубец будет отсутствовать)
и субэпикардиальный. При трансмуральном инфаркте миокарда регистрируется
комплекс QS хотя бы в одном из следующих отведений: aVL, I, II, III, aVF или QR
(если Q больше 0,03 сек и Q/R больше 1/3 зубца R во II, III, aVF).
Мелкоочаговый инфаркт (не Q-инфаркт).
Выделяют два типа мелкоочагового инфаркта.
Первый тип - субэндокардиальный инфаркт (некроз участков сердца, прилегающих к
эндокарду) (рис. 4).
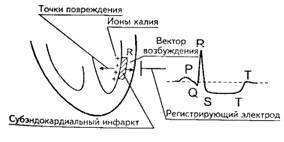
Основным ЭКГ - признаком субэндокардиального
инфаркта является смещение сегмента S-T ниже изоэлектрической линии, при этом
не регистрируется патологический Q зубец в отведениях aVL и I.
Второй тип мелкоочагового инфаркта -
интрамуральный (омертвление стенки миокарда, но при этом эндокард и эпикард не
повреждены).

Острый инфаркт миокарда с наличием
патологического зубца Q (трансмуральный, крупноочаговый) Клиника и диагностика.
Клинически выделяют 5 периодов в течении ИМ: 1.
Продромальный (предынфарктный), длительностью от
нескольких часов, дней до одного месяца, нередко может отсутствовать.
Острейший период - от возникновения резкой
ишемии миокарда до появления признаков некроза (от 30 мин до 2 часов). 3. В
участках ишемии развивается субэндокардиальное повреждение, что проявляется
первоначальным смещением интервала ST книзу от изолинии.
Повреждение и ишемия быстро распространяются
трансмурально на субэпикардиапьную зону. Интервал ST смещается) куполообразно
вверх, зубец Т сливается с интервалом ST (монофазная кривая).
Острый период (образование некроза и миомаляция,
перифокальная воспалительная реакция) - от 2 до 10 дней. 4. Острая стадия
(стадия некроза) связана с образованием некроза в центре очага повреждения и
значительной зоны ишемии вокруг зоны повреждения, длится 2-3 недели.
ЭКГ-признаки: появление патологического зубца Q (шире, чем 0,03 с и глубже 1/4
зубца R); уменьшение или полное исчезновение зубца R (трансмуральный инфаркт);)
куполообразное смещение сегмента ST кверху от изолини - волна Парди,
формирование отрицательного зубца Т.

Подострый период (завершение начальных процессов
организации рубца, замещение некротической ткани грануляционной) - до 4-8
недель от начала заболевания. 5. Подострая стадия отражает изменения ЭКГ,
связанные с наличием зоны некроза, в которой идут процессы рассасывания,
репарации, и зоны ишемии. Зоны повреждения уже нет.
Сегмент ST спускается к изолинии. Зубец Т
отрицательный, в виде равнобедренного треугольника, затем постепенно
уменьшается, может стать изоэлектричным.

Стадию рубцевания - увеличение плотности рубца и
максимальная адаптация миокарда к новым условиям функционирования
(постинфарктный период) - более 2-х месяцев от начала ИМ. Стадия рубцевания
характеризуется исчезновением ЭКГ-признаков ишемии со стойким сохранением
Рубцовых изменений, что проявляется наличием патологического зубца Q. Сегмент
ST находится на изоэлектрической линии.
Зубец Т положительный, изоэлектричный или
отрицательный, нет динамики его изменений. Если зубец Т отрицательный, он не
должен превышать 5 мм и быть меньше 1/2 амплитуды зубцов Q или R в
соответствующих отведениях.

Если амплитуда отрицательного зубца Т больше, то
это свидетельствует о сопутствующей ишемии миокарда в той же области. Таким
образом, для острого и подострого периода крупноочагового ИМ характерно:
формирование патологического, стойко сохраняющегося зубца Q или комплекса QS,
уменьшение вольтажа зубца R с подъемом сегмента ST и с инверсией зубца Т, могут
быть нарушения проводимости.

Рис. 1. Острейшая фаза трансмурального переднего
инфаркта миокарда
Лабораторные исследования в остром периоде ИМ
отражают развито резорбционно-некротического синдрома. К концу первых суток в
крови наблюдается лейкоцитоз, который достигает максимума к 3 суткам,
анэозинофилия, сдвиг влево, с 4-5 дня - увеличение СОЭ при начавшемся снижении
лейкоцитоза - симптом перекреста. С первых суток наблюдается повышение
активности креатинфосфокиназы (КФК), МВ-фракции КФК, ЛДГ-1,
аспартатаминотрансферазы (АсАТ), увеличение содержания миоглобина в моче и в
крови. Увеличивается титр моноклональных антител к миозину и тропонину.
Повышение содержание тропонинов Т и I выявляется в первые 2-3 ч от начала ИМ и
сохраняется до 7-8 дней.
Характерным является гиперкоагуляционный синдром
- повышение в крови уровня фибриногена и продуктов его деградации, снижается
уровень плазминогена и его активаторов.
Ишемия и повреждение миокарда вызывают изменения
белковых структур кардиомиоцитов, в связи с чем они приобретают свойства
аутоантигена. В ответ на появление аутоантигенов в организме начинают
накапливаться антикардиальные аутоантитела и увеличивается содержание
циркулирующих иммунных комплексов.
Радионуклидное исследование выявляет накопление
в очаге некроза пирофосфата технеция, что имеет значение особенно в поздние
сроки (до 14-20 дня) заболевания. В то же время изотоп таллия - 2C1 TI
накапливается лишь в участках миокарда с сохраненным кровоснабжением прямо
пропорционально интенсивности перфузии. Поэтому зона некроза характеризуется
снижением накопления изотопа ("холодный очаг").
При эхокардиографическом исследовании
обнаруживаются признаки очагового поражения миокарда - пассивное парадоксальное
движение межжелудочковой перегородки и снижение ее систолической экскурсии
менее 0,3 см, уменьшение амплитуды движения задней стенки и акинезию или
гипокинезию одной из стенок левого желудочка.
О суммарной сократимости левого желудочка,
наличии аневризмы его и сегментарных нарушений свидетельствует радионуклидная
ангиография. В последние годы для диагностики ишемии миокарда и ИМ используют
позитронио-эмиссионную томографию, ядерно-магнитный резонанс.
.4 Стандарты лечения больных острым инфарктом
миокарда
В 2005 году рабочая группа по подготовке текста
рекомендаций при поддержке Национального института сердца, легких и крови (США)
сформировала "Руководство по ведению больных с инфарктом миокарда с
подъёмом ST" (2009 Focused Updates: ACC/AHA Guidelines for the Management
of Patients With ST-Elevation Myocardial Infarction (Updating the 2004
Guideline and 2007 Focused Update) and ACC/AHA/SCAI Guidelines on Percutaneous
Coronary Intervention (Updating the 2005 Guideline and 2007 Focused Update)
которая появилась в русскоязычной версии благодаря экспертам ВНОК как
"Национальные рекомендации по диагностике и лечению больных острым
инфарктом миокарда с подъемом сегмента ST ЭКГ"
Рекомендации основаны на результатах, полученных
методами доказательной медицины. В России также создана Программа модернизации
здравоохранения, в которую включена указанная нозология.
Неотложная терапия преследует несколько
взаимосвязанных целей:
. Купирование болевого синдрома.
. Восстановление коронарного кровотока.
. Уменьшение работы сердца и потребности
миокарда в кислороде.
. Ограничение размеров инфаркта миокарда.
. Лечение и профилактика осложнений инфаркта
миокарда.
. Купирование болевого приступа
при остром инфаркте миокарда - одна из важнейших
задач, поскольку боль через активацию симпатоадреналовой системы вызывает
повышение сосудистого сопротивления, частоты и силы сердечных сокращений, то
есть увеличивает гемодинамическую нагрузку на сердце, повышает потребность
миокарда в кислороде и усугубляет ишемию.
Если предварительный сублингвальный прием
нитроглицерина (повторно по 0,5 мг в таблетках или 0,4 мг в аэрозоле) боль не
купировал, начинается терапия наркотическими анальгетиками, обладающими кроме
анальгетического и седативного действия влиянием на гемодинамику: вследствие
вазодилатирующих свойств они обеспечивают гемодинамическую разгрузку миокарда,
уменьшая в первую очередь преднагрузку. На догоспитальном этапе препаратом
выбора для купирования болевого синдрома при инфаркте миокарда является морфин,
обладающий не только необходимыми эффектами, но и достаточной для
транспортировки длительностью действия. Препарат вводится внутривенно дробно: 1
мл 1% раствора разводят физиологическим раствором натрия хлорида до 20 мл (1 мл
полученного раствора содержит 0,5 мг активного вещества) и вводят 2-5 мг каждые
5-15 минут до полного устранения болевого синдрома либо до появления побочных
эффектов (гипотензии, угнетения дыхания, рвоты). Суммарная доза не должна
превышать 10-15 мг (1-1,5 мл 1% раствора) морфина (на догоспитальном этапе не
допускается превышение дозы 20 мг).
При невыраженном болевом синдроме, пациентам
старческого возраста и ослабленным больным наркотические анальгетики могут
вводиться подкожно или внутримышечно. Не рекомендуется вводить подкожно более
60 мг морфина в течение 12 часов.
Для профилактики и купирования таких побочных
эффектов наркотических анальгетиков как тошнота и рвота рекомендуют
внутривенное введение 10-20 мг метоклопрамида (церукала, реглана). При
выраженной брадикардии с гипотонией или без нее показано использование атропина
в дозе 0,5 мг (0,5 мл 0,1% раствора) внутривенно; борьба же со снижением
артериального давления проводится по общим принципам коррекции гипотензии при
инфаркте миокарда.
Недостаточная эффективность обезболивания
наркотическими анальгетиками служит показанием к внутривенной инфузии нитратов.
При низкой эффективности нитратов в сочетании с тахикардией дополнительный
обезболивающий эффект может быть получен введением бета-адреноблокаторов. Боль
может быть купирована в результате эффективного тромболизиса.
Упорные интенсивные ангинозные боли служат
показанием к применению масочного наркоза закисью азота (обладающей седативным
и анальгезирующим действием) в смеси с кислородом. Начинают с ингаляции
кислорода в течение 1-3 минут, затем используется закись азота (20%) с
кислородом (80%) с постепенным повышением концентрации закиси азота до 80%;
после засыпания больного переходят на поддерживающую концентрацию газов - 50´50%.
Положительный момент - закись азота не влияет на функцию левого желудочка.
Возникновение побочных эффектов - тошноты, рвоты, возбуждения или спутанности
сознания - является показанием для уменьшения концентрации закиси азота или
отмены ингаляции. При выходе из наркоза ингалируют чистый кислород в течение 10
минут для предупреждения артериальной гипоксемии.
Для решения вопроса о возможности использования
наркотических анальгетиков следует уточнить ряд моментов:
выяснить, имеются ли в анамнезе хронические
заболевания системы дыхания, в частности, бронхиальная астма;
уточнить, когда было последнее обострение
бронхообструктивного синдрома;
установить, имеются ли в настоящее время
признаки дыхательной недостаточности, какие, какова степень ее выраженности;
выяснить, имеется ли у больного в анамнезе
судорожный синдром, когда был последний припадок.
. Восстановление коронарного кровотока в
острейшей фазе инфаркта миокарда, достоверно улучшающее прогноз, при отсутствии
противопоказаний осуществляется путем системного тромболизиса.
А). Показаниями к проведению тромболизиса служат
наличие подъема сегмента ST более чем на 1 mm по крайней мере в двух
стандартных отведениях ЭКГ и более чем на 2 mm в двух смежных грудных
отведениях или остро возникшая полная блокада левой ножки пучка Гиса при сроке,
прошедшем с начала заболевания, более 30 минут, но не превышающем 12 часов.
Применение тромболитических средств возможно и позже в случаях когда
сохраняются подъем сегмента ST, продолжается боль и/или наблюдается
нестабильная нгемодинамика.
В отличие от внутрикоронарного системный
тромболизис (осуществляется внутривенным введением тромболитических средств) не
требует каких-либо сложных манипуляций и специального оборудования. При этом он
достаточно эффективен, если начат в первые часы развития инфаркта миокарда,
поскольку сокращение летальности на прямую зависит от сроков его начала.
Для этого применяют стрептокиназу в дозе 1,5 млн
МЕ внутривенно на 100 мл 0,9% раствора хлорида натрия в течение 30-60 мин.
Также используют альтеплазу на 100-200 мл изотонического раствора по схеме: 15
мг внутривенно струйно, затем 0,75 мг/кг в течение 30 мин (но не более 50 мг) и
далее 0,5 мг/кг в течение 60 мин (но не более 35 мг). Альтеплаза имеет
преимущества перед стрептокиназой в виде более эффективного восстановления
коронарного кровотока за счёт тропности к фибрину тромба, а также отсутствии
антигенности.
Одновременное назначение гепарина при
использовании стрептокиназы не требуется - предполагают, что стрептокиназа сама
обладает антикоагуляционными и антиагрегационными свойствами. Показано, что
внутривенное введение гепарина не снижает летальность и частоту рецидивов
инфаркта миокарда, а эффективность его подкожного введения сомнительна. Если
гепарин по каким-либо причинам был введен ранее, это не является препятствием к
проведению тромболизиса. Рекомендуется назначение гепарина через 4 ч после
прекращения инфузии стрептокиназы. Рекомендовавшееся ранее использование
гидрокортизона для профилактики анафилаксии признано не только малоэффективным,
но и небезопасным в острейшей стадии инфаркта миокарда (глюкокортикоиды
увеличивают риск разрыва миокарда).
Основные осложнения тромболизиса
). Кровотечения (в т.ч. наиболее грозные -
внутричерепные) - развиваются вследствие угнетения процессов свертывания крови
и лизиса кровяных сгустков. Риск развития инсульта при системном тромболизисе
составляет 0,5-1,5% случаев, обычно инсульт развивается в первые сутки после
проведения тромболизиса. Для остановки незначительного кровотечения (из места
пункции, изо рта, носа) достаточно сдавления кровоточащего участка. При более значимых
кровотечениях (желудочно-кишечном, внутричерепном) необходима внутривенная
инфузия аминокапроновой кислоты - 100 мл 5% раствора вводят в течение 30 мин и
далее 1 г/час до остановки кровотечения, или транексамовой кислоты по 1-1,5 г
3-4 раза в сутки внутривенно капельно; кроме того эффективно переливание
свежезамороженной плазмы. Следует однако помнить о том, что при использовании
антифибринолитических средств возрастает риск реокклюзии коронарной артерии и
реинфаркта, поэтому использовать их необходимо лишь при угрожающих жизни
кровотечениях.
). Аритмии, возникающие после восстановления
коронарного кровообращения (реперфузионные). Не требуют интенсивной терапии
медленный узловой или желудочковый ритм (при частоте сердечных сокращений менее
120 в мин и стабильной гемодинамике); наджелудочковая и желудочковая
экстрасистолия (в том числе аллоритмированная); атриовентрикулярная блокада I и
II (типа Мобитц I) степени. Требуют неотложной терапии фибрилляция желудочков
(необходимы дефибрилляция, комплекс стандартных реанимационых мероприятий);
двунаправленная веретенообразная желудочковая тахикардия типа
"пируэт" (показаны дефибрилляция, введение сульфата магния
внутривенно струйно); иные разновидности желудочковой тахикардии (используют
введение лидокаина либо проводят кардиоверсию); стойкая суправентрикулярная
тахикардия (купируется внутривенным струйным введением верапамила или
новокаинамида); атриовентрикулярная блокада II (типа Мобитц II) и III степени,
синоатриальная блокада (внутривенно струйно вводят атропин в дозе до 2,5 мг,
при необходимости проводят экстренную электрокардиостимуляцию).
). Аллергические реакции. Сыпь, зуд,
периорбитальный отек встречаются в 4,4% случаев, тяжелые реакции (отек Квинке,
анафилактический шок) - в 1,7% случаев. При подозрении на развитие
анафилактоидной реакции необходимо немедленно остановить инфузию стрептокиназы
и ввести внутривенно болюсом 150 мг преднизолона. При выраженном угнетении
гемодинамики и появлении признаков анафилактического шока внутривенно вводят 1
мл 1% раствора адреналина, продолжая введение стероидных гормонов внутривенно
капельно. При лихорадке назначают аспирин или парацетамол.
). Рецидивирование болевого синдрома после
проведения тромболизиса купируется внутривенным дробным введением наркотических
анальгетиков. При нарастании ишемических изменений на ЭКГ показано внутривенное
капельное введение нитроглицерина или, если инфузия уже налажена, - увеличение
скорости его введения.
). При артериальной гипотонии в большинстве
случаев бывает достаточно временно прекратить инфузию тромболитика и поднять
ноги пациента; при необходимости уровень АД корректируется введением жидкости,
вазопрессоров (допамина или норадреналина внутривенно капельно до стабилизации
систолического АД на уровне 90-100 мм рт.ст.).
Клинические признаки восстановления коронарного
кровотока:
прекращение ангинозных приступов через 30-60 мин
после введения тромболитика,
стабилизация гемодинамики,
исчезновение признаков левожелудочковой
недостаточности,
быстрая (в течение нескольких часов) динамику
ЭКГ с приближением сегмента ST к изолинии и формированием патологического зубца
Q, отрицательного зубца Т (возможно внезапное увеличение степени подъема
сегмента ST с последующим его быстрым снижением),
появление реперфузионных аритмий (ускоренного
идиовентрикулярного ритма, желудочковой экстрасистолии и др.),
быстрая динамику МВ-КФК (резкое повышение ее
активности на 20-40%).
Системный тромболизис возможен в пожилом и
старческом возрасте, а также на фоне артериальной гипотензии (систолическое АД
менее 100 мм рт. ст.) и кардиогенного шока.
В). С первых минут инфаркта миокарда всем
больным при отсутствии противопоказаний показано назначение малых доз
ацетилсалициловой кислоты (аспирина), антитромбоцитарный эффект которой
достигает своего максимума уже через 30 минут и своевременное начало применения
которой позволяет существенно снизить летальность. Наибольший клинический
эффект может быть получен при применении ацетилсалициловой кислоты перед
проведением тромболизиса в нагрузочной первой дозе 150-300 мг. Для этих целей
не подходит кишечно-растворимая форма, так как начало его действия медленное.
При выраженной тошноте, рвоте, сопутствующих заболеваниях желудка возможно
внутривенное введение ацетилсалициловой кислоты в дозе 250-500 мг. Далее
ацетилсалициловая кислота показана таким больным пожизненно в дозе 75-150
мг/сут. При наличии противопоказаний к ацетилсалициловой кислоте применяют
клопидогрел в нагрузочной первой дозе 300 мг и в последующем 75 мг/сут.
Комбинация клопидогрела с аспирином эффективнее, чем монотерапия аспирином при
инфаркте миокарда без подъёма сегмента ST.
. Уменьшение работы сердца и потребности
миокарда в кислороде кроме полноценного обезболивания обеспечивается
применением
а) вазодилататоров - нитратов,
б) бета-адреноблокаторов и
в) средствами комплексного воздействия - магния
сульфата.
А. Внутривенное введение нитратов при остром
инфаркте миокарда не только помогает купировать болевой синдром,
левожелудочковую недостаточность, артериальную гипертензию, но и уменьшает
размеры некроза и летальность. Растворы нитратов для внутривенного введения
готовят ex tempore: каждые 10 мг нитроглицерина (например, 10 мл 0,1% раствора
в виде препарата перлинганит) или изосорбида динитрата (например, 10 мл 0,1%
раствора в виде препарата изокет) разводят в 100 мл физиологического раствора
(20 мг препарата - в 200 мл физиологического раствора и т.д.); таким образом 1
мл приготовленного раствора содержит 100 мкг, а 1 капля - 5 мкг препарата.
Нитраты вводят капельно под постоянным контролем артериального давления и
частоты сердечных сокращений с начальной скоростью 5-10 мкг/мин с последующим
увеличением скорости на 20 мкг/мин каждые 5 минут до достижения желаемого
эффекта или максимальной скорости введения - 400 мкг/мин. Обычно эффект
достигается при скорости 50-100 мкг/мин. При отсутствии дозатора приготовленный
раствор, содержащий в 1 мл 100 мкг нитрата, вводят при тщательном контроле (см.
выше) с начальной скоростью 6-8 капель в минуту, которая при условии стабильной
гемодинамики и сохранения болевого синдрома может быть постепенно увеличена
вплоть до максимальной скорости - 30 капель в минуту. Продолжительность
внутривенного введения нитратов - 24 часа и более; за 2-3 часа до окончания
инфузии дается первая доза нитратов перорально. Передозировка нитратов,
вызывающая падение сердечного выброса и снижение систолического артериального
давления ниже 80 мм рт. ст., может приводить к ухудшению коронарной перфузии и
к увеличению размеров инфаркта миокарда.
Для решения вопроса о возможности назначения
нитратов необходимо уточнить ряд моментов
убедиться, что систолическое артериальное
давление выше 90 мм рт. ст. (для короткодействующего нитроглицерина) или выше
100 мм рт. ст (для более продолжительно действующего изосорбида динитрата);
исключить наличие стеноза устья аорты и
гипертрофической кардиомиопатии с обструкцией выносного тракта (аускультативно
и по данным ЭКГ), тампонаду сердца (клиническая картина венозного застоя по
большому кругу кровообращения при минимальных признаках левожелудочковой
недостаточности) и констриктивный перикардит (триада Бека: высокое венозное
давление, асцит, "малое тихое сердце");
исключить внутричерепную гипертензию и острую
церебральную дисциркуляцию (в том числе как проявления инсульта, острой
гипертонической энцефалопатии, недавно перенесенной черепно-мозговой травмы);
исключить возможность провокации нитратами
развития синдрома малого выброса вследствие поражения правого желудочка при
инфаркте или ишемии правого желудочка, которые могут сопутствовать задней
(нижней) локализации инфаркта левого желудочка, или при тромбоэмболии легочной
артерии с формированием острого легочного сердца;
убедиться с помощью пальпаторного обследования в
отсутствии высокого внутриглазного давления (при закрытоугольной глаукоме);
уточнить, нет ли у больного непереносимости
нитратов.
Б. Внутривенное введение бета-адреноблокаторов
также как и применение нитратов способствует купированию болевого синдрома;
ослабляя симпатические влияния на сердце (эти влияния усилены в первые 48 часов
инфаркта миокарда вследствие самого заболевания и в результате реакции на боль)
и снижая потребность миокарда в кислороде, они способствуют уменьшению размеров
инфаркта миокарда, подавляют желудочковые аритмии, уменьшают риск разрыва
миокарда и повышают таким образом выживаемость пациентов. Очень важно, что
бета-адреноблокаторы согласно экспериментальным данным позволяют отсрочить
гибель ишемизированных кардиомиоцитов (они увеличивают время, в течение
которого окажется эффективным тромболизис).
При отсутствии противопоказаний бета-адреноблокаторы
назначаются всем больным острым инфарктом миокарда. В первые 2-4 часа
заболевания показано дробное внутривенное введение пропранолола (обзидана) по 1
мг в минуту каждые 3-5 минут под контролем артериального давления, частоты
сердечных сокращений и ЭКГ до достижения частоты сердечных сокращений 55-60
уд./мин или до общей дозы 10 мг. При наличии брадикардии, признаков сердечной
недостаточности, AV-блокады и снижении систолического артериального давления
менее 100 мм рт. ст. пропранолол не назначается, а при развитии указанных
изменений на фоне его применения введение препарата прекращается.
В) Внутривенная инфузия магния сульфата
проводится у больных с доказанной или вероятной гипомагнезиемией или при
синдроме удлиненного QT, а также в случае осложнения инфаркта миокарда
некоторыми вариантами аритмий. При отсутствии противопоказаний магния сульфат
может служить определенной альтернативой применению нитратов и
бета-адреноблокаторов, если их введение по какой-то причине невозможно
(противопоказания или отсутствие). По результатам ряда исследований он, как и
другие средства, уменьшающие работу сердца и потребность миокарда в кислороде,
снижает летальность при остром инфаркте миокарда, а также предотвращает
развитие фатальных аритмий (в том числе, реперфузионных при проведении
системного тромболизиса) и постинфарктной сердечной недостаточности. При
лечении острого инфаркта миокарда 1000 мг магния (50 мл 10%, 25 мл 20% или 20
мл 25% раствора сернокислой магнезии) вводятся внутривенно капельно в течение 30
минут в 100 мл изотонического раствора натрия хлорида; в последующем проводится
внутривенная капельная инфузия в течение суток со скоростью 100-120 мг магния в
час (5-6 мл 10%, 2,5-3 мл 20% или 2-2,4 мл 25% раствора сернокислой магнезии).
. Ограничение размеров инфаркта миокарда
достигается адекватным обезболиванием, восстановлением коронарного кровотока и
уменьшением работы сердца и потребности миокарда в кислороде. Этой же цели
служит оксигенотерапия, показанная при остром инфаркте миокарда всем больным в
связи с частым развитием гипоксемии даже при неосложненном течении заболевания.
Ингаляция увлажненного кислорода, проводящаяся, если это не причиняет
чрезмерных неудобств, с помощью маски или через носовой катетер со скоростью
4-6 л/мин, целесообразна в течение первых 24-48 часов заболевания (начинается
на догоспитальном этапе и продолжается в стационаре).
. Лечение и профилактика осложнений инфаркта
миокарда.
Все перечисленные мероприятия вместе с
обеспечением физического и психического покоя, госпитализацией на носилках
служат профилактике осложнений острого инфаркта миокарда. Лечение же в случае
их развития проводится дифференцированно в зависимости от варианта осложнений:
отек легких, кардиогеннй шок, нарушения сердечного ритма и проводимости, а также
затянувшийся или рецидивирующий болевой приступ.
). При острой левожелудочковой недостаточности с
развитием сердечной астмы или отека легких одновременно с введением
наркотических анальгетиков и нитроглицерина внутривенно струйно вводят 40-120
мг (4-12 мл) раствора фуросемида (лазикса), максимальная доза на догоспитальном
этапе - 200 мг.
). Основой лечения кардиогенного шока служит
ограничение зоны повреждения и увеличение объёма функционирующего миокарда
путём улучшения кровоснабжения его ишемизированных участков, для чего
проводится системный тромболизис.
Аритмический шок требует немедленного
восстановления адекватного ритма путем проведения электроимпульсной терапии,
электрокардиостимуляция, при невозможности их проведения показана
медикаментозная терапия.
Рефлекторный шок купируется после проведения
адекватной анальгезии; при исходной брадикардии опиоидные анальгетики нужно
сочетать с атропином в дозе 0,5 мг.
Истинный кардиогенный шок (гипокинетический тип
гемодинамики) служит показанием к в/в капельному введению негликозидных
кардиотонических (положительных инотропных) средств - допамина, добутамина,
норэпинефрина. Этому должна предшествовать коррекция гиповолемии. При
отсутствии признаков застойной левожелудочковой недостаточности ОЦК
корригируется струйным введением 0,9% раствора натрия хлорида в объёме до 200
мл за 10 мин с повторным введением той же дозы при отсутствии эффекта или
осложнений.
Допамин в дозе 1-5 мкг/кг/мин оказывает
преимущественно вазодилатирующее действие, 5-15 мкг/кг/мин - вазодилатирующее и
положительное инотропное (и хронотропное) действие, 15-25 мкг/кг/мин -
положительное инотропное (и хронотропное) и периферическое вазоконстриктивное
действие. Начальная доза составляет 2-5 мкг/кг/мин с постепенным увеличением до
оптимальной.
Добутамин в отличие от допамина не вызывает
вазодилатацию, но обладает мощным положительным инотропным эффектом и менее
выраженными увеличением ЧСС и аритмогенном эффектом. Препарат назначается в
дозе 2,5 мкг/кг/мин с увеличением каждые 15-30 мин на 2,5 мкг/кг/мин до
получения эффекта, побочного действия или достижения дозы 15 мкг/кг/мин.
Комбинация допамина с добутамином в максимально
переносимых дозах используется при отсутствии эффекта от максимальной дозы
одного из них или при невозможности использования максимальной дозы одного
препарата из-за появления побочных эффектов (синусовая тахикардия более 140 в
минуту или желудочковая аритмия).
Комбинация допамина или добутамина с
норэпинефрином, назначаемым в дозе 8 мкг/мин.
Норэпинефрин (норадреналин) в качестве
монотерапии применяется при невозможности использовать другие прессорные амины.
Назначается в дозе, не превышающей 16 мкг/мин, в обязательном сочетании с
инфузией нитроглицерина или изосорбида динитрата со скоростью 5-200 мкг/мин.
). Желудочковая экстрасистолия в острой стадии
инфаркта миокарда может быть предвестником фибрилляции желудочков. Препарат
выбора для лечения желудочковых нарушений ритма - лидокаин - вводится
внутривенно болюсом из расчета 1 мг/кг массы с последующей капельной инфузией
2-4 мг/мин. Не рекомендуется применявшееся ранее профилактическое назначение
лидокаина всем больным острым инфарктом миокарда (препарат увеличивает
летальность вследствие асистолии). Больным с застойной сердечной
недостаточностью, заболеваниями печени, лидокаин вводят в дозе, сниженной
вдвое.
При желудочковой тахикардии, трепетании
предсердий и мерцательной аритмии с высокой ЧСС и нестабильной гемодинамикой
средством выбора является дефибрилляция. При мерцательной тахиаритмии и
стабильной гемодинамике используют пропранолол (анаприлин, обзидан) для
урежения ЧСС.
При развитии атриовентрикулярной блокады II-III
степени внутривенно вводят 1 мл 0,1% раствора атропина, при неэффективности
пробной терапии атропином и появлении обмороков (приступов
Морганьи-Эдемса-Стокса) показана временная электрокардиостимуляция.
Профилактика ОИМ. Под профилактикой инфаркта
миокарда подразумевают систему мероприятий, основным направлением которых
является предупреждение атеросклероза и исключение, по возможности, факторов
риска инфаркта миокарда. Целью профилактики после перенесенного инфаркта
миокарда является предотвращение летального исхода, развития повторного
инфаркта миокарда и хронической сердечной недостаточности. Профилактика
инфаркта миокарда, как и любого другого заболевания, может быть первичной и
вторичной.
Первичная профилактика. Первичная профилактика
инфаркта миокарда основывается на соблюдении принципов "здорового образа
жизни", следовании медицинским рекомендациям, чтобы предотвратить развитие
ишемической болезни сердца, нормализовать уровень артериального давления,
устранении гиперлипидемии, ожирения и предупреждении развития сахарного
диабета. "Три кита", на которых стоит понятие "здоровый образ
жизни":
) правильное питание;
) физическая активность;
) отсутствие вредных привычек, т.е. исключение
курения и умеренное употребление алкоголя.
В рационе оказывается большое количество
насыщенных жиров, соли, сахара, а также маленькая доля грубой клетчатки,
которая содержится в овощах и фруктах. Таким образом, объясняются неутешительные
данные о смертности от сердечнососудистых заболеваний. Необходимо соблюдать
диетические рекомендации, приведенные в разделе "Лечение инфаркта
миокарда", всю жизнь. Диета является дешевым методом снижения холестерина
в крови. Имеются данные, что при правильной организации питания можно уменьшить
уровень холестерина в крови на 10-20%. Правильно питаться дешевле, чем
лечиться.
·
Физическая
активность. Значение регулярных физических тренировок трудно переоценить.
Регулярные физические нагрузки всегда рекомендуются в качестве составной части
реабилитационной программы пациентов, перенесших инфаркт миокарда. Существуют
способы, укрепляющие сердечную мышцу, такие рекомендации дает только
врач-кардиолог. В основном рекомендуется тренировка сердца, которую осуществляют
с помощью физических упражнений, таких, как ходьба, бег, плавание, катание на
лыжах. Лучшая профилактика - здоровый образ жизни. Необходимо систематически
выполнять тренирующие нагрузки умеренной и средней степени тяжести по 30-40 мин
в день, или минимум три раза в неделю, обязательно после консультации
врача-кардиолога.
·
Отказ
от вредных привычек. Если пациент перенес инфаркт миокарда, продолжение
курения, чрезмерное употребление алкоголя удваивает шансы повторного развития
данного заболевания. Доказано, что курение повышает риск развития основных
клинических проявлений ишемической болезни сердца, куда включается инфаркт
миокарда, в любых возрастных группах. Кроме неблагоприятного воздействия на
сердечнососудистую систему, курение способствует увеличению риска развития
различных патологических процессов в органах дыхания и влияет на возникновение
злокачественных новообразований. Вместе с методами психологической реабилитации
широко применяются и фармакологические методы, такие, как заменители никотина
("Никорет") и препараты, уменьшающие абстинентный синдром
("Цибан" - буроприон).
·
Чрезмерное
потребление алкоголя также может стать фактором возникновения заболеваний
сердца и других органов. Очень часто злоупотребление алкоголем резко
увеличивает угрозу развития инфаркта миокарда (особенно после алкогольного
эксцесса), а также повышения уровня артериального давления, влияет на
возникновение многих заболеваний желудочно-кишечного тракта (цирроза печени) и
травм. Очень важно убедить больного, что чрезмерное употребление алкоголя
оказывает отрицательное влияние на работу сердца. Чрезвычайно важно
контролировать состояние липидного спектра крови. При выявлении первых
признаков дислипидемий принимать все меры для их коррекции. Повышение
артериального давления характеризуется риском возникновения осложнений
ишемической болезни сердца, в основном инфаркта миокарда, а регуляция
стабильного артериального давления на уровне нормальных значений, напротив,
снижает риск развития данного и целого ряда других заболеваний. Следует
тщательно контролировать уровень артериального давления. За повышение уровня
значения артериального давления принимаются значения 140 мм рт. ст. и выше -
для систолического и 90 мм рт. ст. и выше - для диастолического. Повышение
артериального давления во многих случаях может не чувствоваться в течение
длительного времени и не оказывать какого-либо влияния на самочувствие. При
этом угроза развития сердечнососудистых осложнений не снижается, а наоборот,
значительно возрастает! Современные препараты, которые назначаются при
длительном лечении группам лиц с артериальной гипертонией, довольно редко
оказывают побочное действие. Характер нежелательного эффекта основывается на
фармакологических особенностях каждого лекарственного средства. Этот факт учитывается
при назначении препарата. Следует брать во внимание не только особенности
течения имеющегося заболевания, но и различные клинические данные, что
предоставляет возможность назначить оптимальный препарат в оптимальной
дозировке. Однако при возникновении побочных эффектов на фоне терапии
назначенным препаратом следует незамедлительно обратиться к врачу. Не
рекомендуется прекращать принимать назначенные лекарственные препараты или
начинать прием других лекарственных средств самостоятельно, без рекомендации
врача. Кроме средств для лечения артериальной гипертонии, в целях профилактики
инфаркта миокарда могут быть назначены препараты, уменьшающие уровень сахара и
липидов в крови, а также лекарства, снижающие свертывание крови и улучшающие
мозговой кровоток, нормализующие обменные процессы в тканях головного мозга и
т.п. Развитие сахарного диабета или нарушенной толерантности к глюкозе влияет
на увеличение риска возникновения сердечнососудистых осложнений. Таким образом,
тщательный контроль за уровнем сахара крови сопровождается значительным
снижением риска заболеваний сердца, предотвращая также риск повторного инфаркта
миокарда. Этого можно достигнуть с помощью разнообразных диет, которые
предусматривают ограниченное потребление легкоусвояемых углеводов. Возможно и
при повышении физической активности, а в необходимых случаях - назначении
сахароснижающего медикаментозного лечения. Для многих пациентов нормальным
является уровень сахара натощак менее 6,1 ммоль/л, содержание гликированного
гемоглобина - менее 7%.
·
Только
точное выполнение всех рекомендаций, касающихся мер, которые направлены на
поддержание стабильного уровня сахара крови на целевом уровне, способствует
обеспечению полноценной профилактики сердечно-сосудистых осложнений у пациентов
с сахарным диабетом или нарушением толерантности к глюкозе.
·
Вторичная
профилактика после инфаркта миокарда. Вторичная профилактика после
перенесенного инфаркта миокарда имеет своей целью предотвращение летального
исхода, развития повторного инфаркта миокарда и хронической сердечной
недостаточности. Отдаленный прогноз после перенесенного инфаркта миокарда
определяется следующими факторами:
·
возрастом
больного;
·
тяжестью
и распространенностью стенозирующего атеросклероза коронарных артерий;
·
наличием
потенциально опасных для жизни аритмий;
·
наличием
и степенью выраженности ишемии миокарда;
·
проходимостью
инфаркт-связанной коронарной артерии;
·
степенью
дисфункции левого желудочка.
Исходя из вышеизложенного, для вторичной
профилактики после ИМ рекомендуются следующие лекарственные препараты: непрямые
антикоагулянты (варфарин, синкумар и др.); аспирин; β-адреноблокаторы;
антагонисты кальция (верапамил, дилтиазем); ингибиторы ангиотензинпревращающего
фермента (у больных с явлениями сердечной недостаточности в остром периоде
инфаркта миокарда); амиодарон (кордарон) (у больных с опасными желудочковыми
аритмиями) и гипохолестеринемические препараты из группы вастатинов.
В качестве препаратов, эффективных для вторичной
профилактики инфаркта миокарда, достаточно изучена ацетилсалициловая кислота (в
случае ее непереносимости клопидогрель или тиклопидин). Результаты исследований
позволили предположить целесообразность применения ацетилсалициловой кислоты и
с целью первичной профилактики инфаркта миокарда. Аспирин при проведении
вторичной профилактики после инфаркта миокарда менее эффективен, чем непрямые
антикоагулянты (снижает смертность на 15%, частоту повторного инфаркта миокарда
- на 31%), зато значительно реже вызывает побочные эффекты. Аспирин назначается
в дозе 160-325 мг/сут, однако профилактический эффект достигается и при
использовании дозы 75-150 мг/сут. Аспирин - лекарственный препарат, снижающий
агрегацию (склеивание) тромбоцитов, предотвращая тем самым образование
кровяного тромба в просвете коронарной артерии. Обычно назначают всем
пациентам, перенесшим инфаркт миокарда, исключение составляет категория
больных, имеющих ранее желудочно-кишечное кровотечение, имеет значение язвенная
болезнь или аллергическая реакция на аспирин. Аспирин можно принимать
длительно, на протяжении всей последующей жизни.
При возникновении гастроэнтерологических жалоб,
таких, как голодная боль в эпигастральной области, чувства тяжести, распирания
и быстрого наполнения после еды, после обязательной консультации
гастроэнтеролога с целью профилактики используют омепразол 20 мг утром за 30-40
мин до завтрака (можно принимать другой блокатор протонового насоса:
ланзопразол, пантопразол, рабепразол, эзомепразол в адекватной дозировке). В
последнее время с антиагрегантной целью, если имеется непереносимость аспирина,
рекомендуется принимать клопидогрель или тиклопидин. Тиклид (тиклопидин)
считается более безопасным препаратом. Применение тиклида помогает более чем в
два раза уменьшить риск возникновения инфаркта миокарда как у пациентов с
нестабильной стенокардией, так и у других больных с сосудистой патологией
(тяжелый церебральный атеросклероз, облитерирующий атеросклероз нижних
конечностей). Успешно применяется еще более эффективный новый
антитромботический препарат плавикс. Эффективность этих препаратов в
профилактике повторных инфарктов продолжает изучаться.
Глава 2. Анализ результатов обследования и
лечения больных острым инфарктом миокарда в хирургической и терапевтической
клинике БГМУ
.1 Клинико-функциональная характеристика больных
В основу выпускной квалификационной работы
положен анализ результатов клинического обследования и лечения 48 больных (16
случаев ОИМ в хирургических отделениях, 32 случая в терапевтических отделениях)
перенесших острый инфаркт миокарда, находившихся на стационарном лечении в ГКБ
№18 в 2011 году.
Все пациенты, перенесшие ОИМ, были в возрасте от
34 до 92 лет. Среди них был зафиксирован 21 случай с летальным исходом. Таким
образом все пациенты были разделены на две клинические группы: ИМ с ЛИ и ИМ без
ЛИ.
Таблица 1. Госпитальная заболеваемость и
летальность ОИМ в стационарах ГКБ№18 с 2007 по 2011 гг.

Следует отметить, что наибольший, устойчиво
высокий, уровень летальности (Рис. 1) был зафиксирован в хирургических
отделениях - 93,8% и 16,1% в терапевтических отделениях.

Рис. 1. Структура больных ОИМ без ЛИ по возрасту

Рис. 2. Структура больных ОИМ с ЛИ по возрасту
В группе ИМ без ЛИ преобладали лица зрелого и
пожилого возраста, 77% всех случаев составили лица в возрасте старше 60 лет,
сходная тенденция наблюдалась в группе ИМ с ЛИ, в этой группе лиц пожилого
возраста было больше, чем лиц зрелого возраста, 52% случаев старше 60 лет.

Рис. 3. Динамика летальности больных ОИМ в ГКБ
№18, 2007-2011 гг.

Рис 4. Структура больных ОИМ без ЛИ по полу

Рис. 5. Структура
больных ОИМ с ЛИ по полу
В обеих группах преобладали лица мужского пола:
52% в группе ИМ без ЛИ, 76,19% в группе ИМ с ЛИ.

Рис. 6. Структура больных ОИМ по характеру
госпитализации
Большинство пациентов клинки с ИМ были
направлены в плановом порядке поликлиникой - 64,5%, экстренно доставлено 29,2%
бригадой СМП, 6,3% в порядке самообращения.
В соответствии с существующими стандартами
лечения ОИМ поток больных был разделен на три клинические группы: с началом
ангинозного приступа в пределах 3х часов (для направления на ЧКВ) - 3%, от 3х
до 6 часов (для проведения тромболизиса) - 10%, более 6 часов (консервативное
лечение, ЧКВ/тромболизис не показаны) - 87,5%.
Все больные были разделились на 2 группы по
характеру начала ангинозного приступа: 56,25% предъявляли типичные жалобы на
боли в грудной клетке, 43,75% поступили с нетипичными жалобами ("нозологическими
масками"), из них 4,2% - астматический тип, 14,5% - гастралгический тип,
4,2% церебральный, 20,8% неклассифицированные варианты начала приступа.
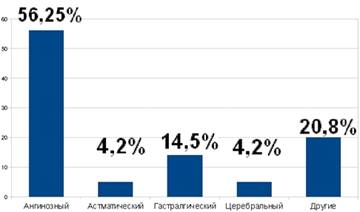
Рис. 7. Структура больных ОИМ по характеру
начала ангинозного приступа
По характеру нозологии выставленному в качестве
первичного диагноза приёмным отделением клиники: 37% ОИМ, 21% острая
хирургическая патология, 12,5% Сахарный диабет, 6% острая сосудистая патология,
12,5% другие (Бронхиальная астма, ЦВЗ, Плеврит).
Рис. 8. Структура больных ОИМ по характеру
нозологии в качестве первичного диагноза
По обширности повреждения миокарда - среди
пациентов с ОИМ с ЛИ у всех был зафиксирован крупноочаговый инфаркт, ИМ без ЛИ
- 73% крупноочаговых инфарктов и 37% мелкоочаговых.
Среди больных ИМ без ЛИ структура по течению
показывает преобладание первичных (56,25%) ИМ над повторными, в группе ИМ с ЛИ
76,2% случаев составили пациенты с повторным ИМ и 23,8% с первичным.
В трети (33,3%) всех случаев ИМ
были зафиксированы какие либо осложнения: 35% МА, 29% желудочковой
экстрасистолии, 18% пароксизмальной желудочковой тахикардии, 12% БЛНПГ, 6%
БПНПГ.

Рис. 9. Структура нарушений ритма у больных ОИМ
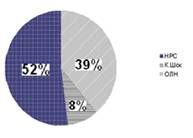
Рис. 10. Структура кардиальных осложнений у
больных ОИМ
2.2 Методы исследования
Всем пациентам с ОИМ необходимо
проводить: сбор анамнеза и жалоб, общеклиническое обследование (общий анализ
крови, ЭКГ, определение индекса массы тела, сахара крови, общий анализ мочи),
качественный тест на тропонин/миоглобин, ЭХО-КГ, рентгенография грудной клетки.
.3 Результаты исследований
В стационаре из групп ИМ без ЛИ и ИМ с ЛИ у всех
больных был проведен сбор анамнеза и оценка жалоб, только 89,5% и 81%
исследуемых был проведен Тропониновый тест или МВ КФК, определение нарушения
локальной сократимости миокарда (ФВ на ЭХО-КГ) у 58,3% и 19,0% соответственно,
КАГ не был проведен ни водной из групп ввиду отсутствия ангиографа.
Из этого следует, что диагностические
мероприятия, проводимые в клинике БГМУ за 2011 год, в целом соответствуют
существующим рекомендациям по диагностике ОИМ, но проводятся не в полном
объеме, не всем пациентам.
Таблица 2. Объём обследований при ОИМ в
стационаре ГКБ №18, 2012
|
Исследования
|
ИМ
без ЛИ
|
ИМ
с ЛИ
|
|
Тропониновый
тест/МВ КФК
|
89.5%
|
81.0%
|
|
Определение
нарушения локальной сократимости миокарда (ФВ на ЭХО-КГ)
|
58.3%
|
19.0%
|
|
Коронарография
|
0
|
0
|
Глава 3. Фармакотерапия
При поступлении в стационар, пациентам
проводилась лекарственная терапия направленная на купирование болей, в 23%
наркотические анальгетики, 76,4% НПВС. Прием АСК в дозе 75-160 мг/сут. (при
отсутствии противопоказаний) в течение всего периода пребывания в стационаре у
84,3% больных, большинству больных также показан Клопидогрел в дозе 75 мг/сут,
однако применялся он лишь в 38,5% случаев.
Лечение НФГ в виде в/в инфузий под контролем
АЧТВ в 1,5-2 раза выше ВГН до 8 дня показано всем пациентам, но применялось у
96,4% в терапевтических и в 60% случаев в хирургических отделениях.
Нитраты применялись всем больным в полном
объёме, у которых сохранялись жалобы на ангинозные боли после первых суток, за
исключением случаев с выраженной брадикардией и гипотонией.
Бета-блокаторы в терапевтических отделениях
больные получали в полном объеме, зп исключением случаев АВ блокады, назначение
этой группы препаратов в хирургических отделениях выполнено не в полном объеме
(40% больных) иАПФ/АРА назначались в 85,7% и 46,6% случаев в терапевтических и
хирургических отделениях соответственно.
Блокада рецепторов альдостерона (группа
Диуретики - спиронолактон) в 86,7% и 46,6%.
В осложненных случаях применялись дополнительно
антиаритмичесие лекарственные средства (АК, амиодарон, коргликон/дигоксин),
средства оказывающие положительную инотропную поддержку (допамин).
Статины, в отсутствии противопоказаний не
получали 51,9% пациентов терапии и все пациенты хирургии.
Все госпитализированные в первые 6 часов
подверглись тромболитической терапии, стоит отметить, что части из них возможно
было проведение ЧКВ при наличии ангиографа.
Таблица 3. Сравнительная оценка объема оказанной
консервативной терапии при ОИМ отделениях ГКБ№18 различного профиля, 2012
|
Терапевтические
отделения, %
|
|
Антикоагулянты
|
96.4
|
60
|
|
Нитраты
|
85.7
|
93.75
|
|
Бета-блокаторы
|
93
|
40
|
|
иАПФ/АРА
|
85.7
|
53.33
|
|
Диуретики
|
86.7
|
46.6
|
|
Инотроп
поддержка
|
14.8
|
13.3
|
|
АК
|
11.1
|
0
|
|
ААЛС
|
18.5
|
0
|
|
Статины
|
48.1
|
0
|
|
ТЛ
|
14.8
|
0
|
Таблица 4. Фармакотерапия при ОИМ в стационаре
ГКБ №18, 2012
|
НПВС,
%
|
Наркотические
анальгетики, %
|
Аспирин,
%
|
Клопидогрел,
%
|
|
76.4
|
23
|
84.3
|
38.5
|
Заключение
Проведенные исследования показывают:
1. В целом медицинская помощь в клинике
соответствует существующим стандартам диагностике и лечения ОИМ в
неспециализированных лечебных учреждениях. Большинство больных проходило
лечение в РАО или ПИТ, где не проводится мониторирование ЭКГ.
2. Консервативное лечение (двойная
антитромбоцитарная терапия, не применяются в/в бета-блокаторы), ЧКВ проводятся
в недостаточном объеме.
. Смертность в хирургических отделениях
существенно выше чем в терапевтических.
. Недостаточен объем терапии больных ОИМ в
хирургических отделениях (Статины, бета-блокаторы)
. Относительно много случаев с нетипичным
началом ангинозного приступа
. Относительно высокую летальность показывают
пациенты с повторным ОИМ
Выводы
. Необходимо внедрить современный этап
диагностики - КАГ с последующим ЧКВ.
. Высокая заболеваемость и смертность ОИМ в
хирургических отделениях требует мероприятий по прогнозированию и профилактике
кардиальных осложнений внесердечных хирургических вмешательств.
. Пациенты с первичным ОИМ требуют расширения
объема реабилитационных мероприятий.
Практические рекомендации
1. Для
снижения летальности вследствие ОИМ, пациентам, страдающим ИБС, ГБ, ХСН или
имеющих факторы риска развития ОИМ необходимо стратифицировать по прогнозу
кардиальных осложнений внесердечных хирургических вмешательств.
2. Пациентам,
имеющим факторы риска ССЗ, при планируемом хирургическом вмешательстве
проводить ЭКГ мониторирование, ЭХО-КГ, стресс ЭХО.
Список использованной литературы
1. Комитет
экспертов ВНОК: Диагностика и лечение больных острым инфарктом миокарда с
подъёмом сегмента ST ЭКГ // Кардиоваскулярная терапия и профилактика. - 2010. -
Т. 6. - №8.
2. Комитет
экспертов ВНОК: Диагностика и лечение больных острым инфарктом миокарда без
стойкого подъёма сегмента ST ЭКГ // Кардиоваскулярная терапия и профилактика. -
2008. - Т. 8. - №5.
. Комитет
экспертов ВНОК: Прогнозирование и профилактика кардиальных осложнений
внесердечных хирургических вмешательств // Национальные рекомендации. М.: 2011
. Комитет
экспертов ВНОК: Рекомендации по диагностике и лечению стабильной стенокардии //
Национальные рекомендации. М.: 2012
. Н.Н.
Крюков Ишемическая болезнь сердца // Монография. - Самара, 2010. - 651 с.