Методы отделения биомассы от культуральной жидкости
Содержание
1. Введение
1.1 Биотехнология
1.2 Объекты биотехнологии
1.3 Виды биотехнологических процессов
1.4 Преимущества биотехнологических процессов
1.5 Основные этапы развития биотехнологии
2. Типовая схема и основные стадии биотехнологических производств
2.1 Биотехнологическая стадия
2.2 Подготовительные стадии
2.3 Разделение жидкости и биомассы
2.4 Выделение продуктов биосинтеза
2.5 Очистка продукта
2.6 Концентрирование продукта
2.7 Получение готовой формы продукта
2.8 Очистка стоков и выбросов
3. Основные понятия о методах отделения биомассы от культуральной
жидкости
3.1 Характеристика метода флотации
3.2 Характеристика методов центрифугирования и сепарации
Список литературы
1. Введение
1.1
Биотехнология
Биотехнология - это целенаправленное
получение ценных для народного хозяйства и различных областей человеческой
деятельности продуктов, в процессе которого используется биохимическая
деятельность микроорганизмов, изолированных клеток или их компонентов.
Наиболее часто биотехнологию путают с
растениеводством или животноводством.
Например, получение пшеницы из воды и
удобрений на первый взгляд - биотехнология. Однако здесь используется
биохимическая деятельность не изолированных клеток, а целого растения,
макроорганизма, относящегося к высшим, многоклеточным организмам. Это - не
биотехнология, а растениеводство.
Точно так же получение лекарства из корня
женьшеня - не биотехнология. А вот когда из этого корня берут отдельные клетки,
отделяя их с помощью ферментов от многоклеточной растительной ткани, и разводят
эти отдельные, изолированные клетки на специальном питательном растворе,
как дрожжи, получая биомассу изолированных клеток женьшеня, из которой путем
настаивания можно получить столь же ценное лекарство, как из целого корня, -
это уже биотехнология.
1.2 Объекты
биотехнологии
Объектами биотехнологии могут быть: микроорганизмы (вирусы,
бактерии, грибы), клетки, ткани (животных, растений, человека), вещества
биологического происхождения, являющиеся клеточными метаболитами (ферменты,
нуклеиновые кислоты, глюкоза).
1.3 Виды
биотехнологических процессов
1. Наращивание
клеточной массы, которая и представляет собой продукт. К такому классу технологий
относится получение пекарских дрожжей, кормовых дрожжей, многих вакцин.
2. Образование
(биосинтез) в процессе роста и развития клеток ценных биохимических продуктов -
некоторые
из них выделяются в среду (внеклеточные продукты), некоторые накапливаются в
биомассе (внутриклеточные продукты). В этих случаях производство существует
ради получения таких продуктов, а не самой биомассы, которая часто является
балластом.
3. Биотрансформация
- процесс,
в результате которого под воздействием биохимической деятельности
микроорганизмов или ферментов происходит изменение химического состава
исходного химического вещества. Отличие от рассмотренного процесса биосинтеза
состоит в том, что при этом обычно происходят относительно небольшие изменения
в химической структуре вещества, оно не синтезируется заново из относительно
более простых веществ. Кроме того, в процессе биотрансформации используют
обычно уже готовый биологический агент - клетки микроорганизмов или ферменты, в
ходе самого процесса биотрансформации они не образуются.
Пример процесса биотрансформации -
превращение глюкозы во фруктозу под воздействием фермента глюкозоизомеразы. Оба
сахара имеют одну формулу СбН12О6, но различную
пространственную структуру молекулы.
Интересно, что подобный процесс в природе
осуществляют пчелы (если кормить их глюкозой). Но поскольку здесь в операции
принимает участие макроорганизм - пчела, мы не можем данный процесс назвать
биотехнологическим.
биомасса культуральная жидкость сепарация
Или другой пример. Глицерин,
представляющий собой трехатомный спирт, под воздействием клеток глюконобактерий
прекращается в диоксиацетон.
Небольшое изменение в структуре молекулы
(уходят два атома водорода, т.е. происходит дегидрирование) приводит к
образованию нового вещества, по своим свойствам заметно отличающегося от
исходного - глицерина.
4.
Потребление
микроорганизмами из жидких сред различных веществ, которые являются
нежелательными примесями (загрязнениями). Здесь биомасса микроорганизмов служит
промежуточным агентом, по окончании процесса она становится ненужной. Такие
процессы применяют при биологической очистке сточных вод.
5.
Продуктом
здесь является очищенная вода, а биомасса активного ила, которая потребляет
загрязнения, все время отводится от системы и затем обезвреживается или
перерабатывается для получения из нее других полезных продуктов.
6.
Выщелачивание
с помощью микроорганизмов, т.е. перевод в растворенное состояние некоторых веществ,
находящихся в твердых телах. Примером является микробиологическое выщелачивание
ценных металлов из руд - меди, цинка, урана и др.
7.
Особым
случаем является использование биохимической деятельности микроорганизмов с
целью образования газов и за счет этого создания, например, пористых
материалов. Так, для этого используют дрожжи при приготовлении хлеба. Одно из
назначений дрожжей при получении пива или шампанского - также создать в среде
высокую концентрацию растворенного диоксида углерода, чтобы вино или пиво
хорошо пенилось.
Рассмотренные шесть основных направлений биохимической
деятельности микроорганизмов являются основой для получения широкого класса
продуктов биотехнологии.
1.4
Преимущества биотехнологических процессов
По сравнению с химической технологией
биотехнология имеет следующие основные преимущества:
· возможность получения
специфичных и уникальных природных веществ, часть из которых (например, белки,
ДНК) еще не удается получать путем химического синтеза;
· проведение
биотехнологических процессов при относительно невысоких температурах и
давлениях;
· микроорганизмы имеют
значительно более высокие скорости роста и накопления клеточной массы, чем
другие организмы. Например, с помощью микроорганизмов в ферментере объемом 300
м3 за сутки можно выработать 1 т белка (365 т/год). Чтобы такое же
количество белка в год выработать с помощью крупного рогатого скота, нужно
иметь стадо 30 000 голов. Если же использовать для получения такой скорости
производства белка бобовые растения, например горох, то потребуется иметь поле
гороха площадью 5400 га;
· в качестве сырья в
процессах биотехнологии можно использовать дешевые отходы сельского хозяйства и
промышленности;
· биотехнологические
процессы по сравнению с химическими обычно более экологичны, имеют меньше
вредных отходов, близки к протекающим в природе естественным процессам;
· как правило, технология и
аппаратура в биотехнологических производствах более просты и дешевы.
1.5 Основные
этапы развития биотехнологии
Наука-биотехнология формировалась и эволюционировала по мере
формирования и развития человеческого общества. Это, в частности,
непосредственно относится и к биотехнологии. Ее возникновение, становление и
развитие условно можно подразделить, на 4 периода: эмпирический,
этиологический, биотехнический и генотехнический. Эмпирический (от греч.
empeirikos - опытный) или доисторический
период - самый длительный, охватывающий примерно 8000 лет, из которых более
6000 лет - до нашей эры и около 2000 лет - нашей эры. Древние народы того
времени интуитивно использовали приемы и способы изготовления хлеба, пива и
некоторых других продуктов, которые теперь мы относим к разряду
биотехнологических. Кризис охотничьего промысла (хозяйства) стал побудительным
мотивом революции в изготовлении продуктов питания. Эта революция началась
около 8000 лет назад и привела к изобретению техники земледелия - началу
производительного ведения хозяйства (неолит и бронзовый века.)
Стали формироваться так называемые приречные цивилизации
Месопотамии, Египта, Индии и Китая. Шумеры-первые жители Месопотамии (на
территории современного Ирака) создали цветущую в те времена цивилизацию. Они
выпекали хлеб из кислого теста, владели искусством готовить пиво. В этом
следовали им ассирийцы и вавилоняне, жившие также в Месопотамии, египтяне и
древние индусы. В течение нескольких тысячелетий известен уксус, издревле
приготавливавшийся в домашних условиях, хор о микробах-индукторах этого
процесса мир узнал в 1868 г. благодаря работам Пастера, и это несмотря на
существование с XIV в. так называемого "Орлеанского способа"
приготовления уксуса; первая дистилляция вина осуществлена в XII в.; водку из
хлебных злаков получили в XVI в.; шампанское известно с XVIII в., но получение
почти абсолютного этанола впервые удалось в XIV в. испанцу Раймунду Луллию
(1235-1315) благодаря перегонке вина с негашеной известью.
В те древние времена продукты питания растительного и
животного происхождения использовались не только в пищу, но и для лечебных
целей. Например, в ассирийской столице Ниневии (8 - 7 века до н.э.) была
царская библиотека, насчитывавшая более 30 000 клинописных табличек, из которых
в 33 имелись сведения о лекарственных средствах и их рецептуре, и в самом
городе размещался сад лекарственных растений.
К тому же эмпирическому периоду относятся: получение
кисломолочных продуктов, квашеной капусты, медовых алкогольных напитков,
силосование кормов, мочка лубоволокнистых растений.
Таким образом, народы исстари пользовались на практике
микробиологическими процессами, ничего не зная о микробах. Эмпиризм также был
характерен и в практике использования полезных растений и животных.
Второй, этиологический (от греч. aitia-причина) период в
развитии биотехнологии охватывает вторую половину XIX века и первую треть XX века
(1856-1933 гг.). Он связан с выдающимися исследованиями великого французского
ученого Луи Пастера (1822-1895) - основоположника научной микробиологии и ряда
микробиологических дисциплин (промышленной, медицинской, химической,
санитарной). С аналитической микробиологией непосредственно связано открытие
Пастером молекулярной ассиметрии (стереоизомерии). Это, по существу,
бриллиантовый век микробиологии. Пастер вскрыл микробную природу брожений,
доказал возможность жизни в бескислородных условиях, экспериментально опроверг
ходячее тогда представление о самопроизвольном зарождении живых существ, создал
научные основы вакцинопрофилактики и вакцинотерапии; предложил метод
стерилизации, называемый по его имени пастеризацией и т.д.
Немеркнущая слава Пастера не затмила имен его выдающихся
учеников и сотрудников: Э. Дюкло, Э. Ру, Ш.Э. Шамберлана, Ж.А. Вильемена, И.И.
Мечникова. В этот же период творили Р. Кох, Д Листер, Ш. Китазато, Г.Т.
Риккетс, Д И. Ивановский, А. Лаверан и другие.
Параллельно с Пастером трудился в Германии, а позднее - во
Франции, выдающийся миколог А. де Бари (1831-1888) - основоположник
физиологической микологии. Изучив стадии размножения и историю индивидуального
развития грибов (онтогенетический метод), с учетом их взаимоотношений с другими
видами, а также цитологических и биологических особенностей, де Бари создал
классификацию, которая и сегодня лежит в основе современных классификационных
схем микро - и макромицетов.
Де Бари - основоположник микофитопатологии - науки о грибных
болезнях растений (от греч. fiton - растение,pathos - болезнь), под его
руководством сформировалась плеяда выдающихся ученых (в том числе - из России):
Ф. М Бальфур, И.В. Баранецкий, М. Бейеринк, О. Брефельд, М.С. Воронин, А. Кох,
А С. Фаминицин и др.
В биотехнологии важными являются питательные среды для
культивирования ряда биообъектов. Уже Л. Пастер приготовил первую жидкую
питательную среду в 1859 году, метод выращивания грибов на желатине предложил
О. Брефельдв 1864 г., Ж. Ролен сообщил о жидких средах для выращивания нитчатых
грибов в 1870 г., Р. Коху в 1876 г. удалось вырастить бациллы сибирской язвы в
капле водянистой влаги, извлеченной из глаза погибшей коровы. В 80-е годы XIX
столетия Р. Кох предложил метод культивирования бактерий на стерильных ломтиках
картофеля и затем - на агаризованных питательных средах.
В настоящее время, предлагая самые сложные и необычные в
каком-либо отношении среды для выращивания биообъектов, мы опираемся на
основополагающие результаты этих выдающихся ученых. Аналогичным образом можно
сказать и о вариантах способов стерилизации питательных сред, имея в виду
тиндализацию, кипячение, дробную стерилизацию и др. Все они основывались на
необходимости уничтожения посторонней микрофлоры, которая попадала в среды в
процессе их изготовления.
В ряду открытий всемирного значения стоит обнаружение в 1892
г. вируса мозаичной болезни табака Д.И. Ивановским (1864 - 1920). Последовавшие
за этим обнаружения других вирусов обеспечили становление новой научной
дисциплины - вирусологии: Ф. Леффлер и П. Фрош в 1898 г. открыли вирус ящура,
Д. Кэррол в 1901 г. - вирус желтой лихорадки, Ф. Туорт в 1915 г. и Ф. д'Эрелль
в 1917 г. - вирусы бактерий (бактериофаги). Большой вклад в вирусологию был
внесен отечественными и зарубежными учеными - Л. А Зильбером, А. А Смородинцевым,
М.П. Чумаковым, А. Борелем, К. Левадити, К. Ландштейнером, В. Стэнли, П.
Лейдлоу, П. Руа, П.Ф. Эндерсом и многими другими.
Этиологический период знаменателен тем, что удалось доказать
индивидуальность микробов и получить их в чистых культурах. Более того, каждый
вид мог быть размножен на питательных средах и использован в целях
воспроизведения соответствующих процессов (бродильных, окислительных и др.).
Например, маслянокислые бактерии и вызываемое ими маслянокислое брожение,
лактобактерии и молочнокислое брожение, дрожжи - сахаромицеты и спиртовое
брожение, уксуснокислые бактерии и окисление этанола до уксусной кислоты и т.д.
В этот период было начато изготовление прессованных пищевых дрожжей, а также
некоторых продуктов обмена (метаболизма) - ацетона, бутанола, лимонной и
молочной кислот; во Франции приступили к созданию биоуставовок для
микробиологической очистки сточных вод.
Знание причин биологических процессов еще не исключало
нестерильные операции, хотя и стремились к использованию чистых культур
микроорганизмов.
Для всестороннего изучения морфолого-физиологических свойств
и продуктов обмена, прежде всего, микробов все ранее предложенные способы их
выращивания оказались малопригодными. Более того, накопление однородной по
возрасту большой массы клеток оставалось исключительно трудоемким процессом.
Вот почему требовался принципиально иной подход для решения многих задач в
области биотехнологии. В 1933 году А. Клюйвер и Л. X.Ц. Перкин опубликовали
работу "Методы изучения обмена веществ у плесневых грибов", в которой
изложили основные технические приемы, а также подходы к оценке и интерпретации
получаемых результатов при глубинном культивировании грибов. С этого времени
начинается третий период в развитии биологической технологии - биотехнический.
Началось внедрение в биотехнологию крупномасштабного герметизированного
оборудования, обеспечившего проведение процессов в стерильных условиях.
Особенно мощный толчок в развитии промышленного биотехнологического
оборудования был отмечен в период становления и развития производства
антибиотиков (время второй мировой войны 1939 - 1945 гг., когда возникла острая
необходимость в противомикробных препаратах для лечения больных с
инфицированными ранами). Все прогрессивное в области биологических и технических
дисциплин, достигнутое к тому времени, нашло свое отражение в биотехнологии.
Следует отметить, что уже в 1869 г.Ф. Мишер получил
"нуклеин" (ДНК) из гнойных телец (лейкоцитов); В. Оствальд в 1893 г.
установил каталитическую функцию ферментов; Т. Леб в 1897 г. установил
способность к выживанию вне организма (в пробирках с плазмой или сывороткой
крови) клеток крови и соединительной ткани; Г. Хаберланд в 1902 г. показал
возможность культивирования клеток различных тканей растений в простых
питательных растворах; Ц. Нейберг в 1912 г. раскрыл механизм процессов
брожения; Л. Михаэлис и М.Л. Ментен в 1913 г. разработали кинетику
ферментативных реакций, а А. Каррел усовершенствовал способ выращивания клеток
тканей животных и человека и впервые применил экстракт эмбрионов для ускорения
их роста; Г.А. Надсон и Г.С. Филлипов в 1925 г. доказали мутагенное действие
рентгеновских лучей на дрожжи, а в 1937 г.г.
Кребс открыл цикл трикарбоновых кислот (ЦТК); в 1960 г.Ж.
Барски и др. впервые обнаружили соматические гибриды опухолевых клеток мыши.
Следовательно, накопленные научные факты стали побудительным мотивом для
разработки способов крупномасштабного культивирования клеток различного
происхождения. Это необходимо было для получения различных клеточных продуктов
и самих клеток для нужд человека, и, прежде всего, в качестве или в составе
лечебных и профилактических средств: пенициллина, стрептомицина, тетрациклинов,
декстрана, ряда аминокислот и многих других веществ. К 1950 г.Ж. Моно (Франция)
разработал теоретические основы непрерывного управляемого культивирования
микробов; в 50-е годы вопросам практической реализации непрерывного
культивирования микроорганизмов посвятили свои исследования М. Стефенсон, И.
Малек, Н.Д. Иерусалимский и др.
Примерно за 40 лет третьего периода были решены основные
задачи по конструированию, созданию и внедрению в практику необходимого
оборудования, в том числе главного из них - биореакторов. Это оборудование
используют и в настоящее время.
Четвертый период в биотехнологии -
генотехнический (от греч. genesis - происхождение, возникновение, рождение)
начался с 1972 г. В этом году П. Берг со своими сотрудниками в США создали
первую рекомбинангную молекулу ДНК. Однако следует отметить, что в 1969 г. Дж.
Бекуит с коллегами выделил в химически чистом виде лактозный ген из кишечной
палочки, показав тем самым возможность направленных манипуляций с генетическим
материалом бактерий.
Естественно, что без фундаментальной работы Ф. Крика и Дж.
Уотсона (1953) по установлению структуры ДНК было невозможным достигнуть
современных результатов в области биотехнологии. Выяснение механизмов
функционирования и регуляции ДНК, выделение и изучение специфичных ферментов
привело к формированию строго научного подхода к разработке биотехнологических
процессов на основе генно-инженерных работ. В этом суть генотехнического
периода.
Уже в 1982 г. поступил в продажу человеческий инсулин,
выработанный кишечными палочками, несущими в себе искусственно встроенную
генетическую информацию об этом гормоне. На таком же уровне или с близким к
тому заделом находятся следующие генно-инженерные препараты: интерфероны,
фактор некротизации опухоли (ТNF), интерлейкин-2, соматотропный гормон человека и
аналог его соматомедин Ц и другие.
Зная строение аппарата наследственности у разных организмов,
удается манипулировать не только нуклеиновыми кислотами, но и целыми
хромосомами (хромосомная инженерия) и клетками (клеточная инженерия).
Для генотехнического периода характерны: разработка
интенсивных процессов (вместо экстенсивных) на основе направленных
фундаментальных исследований (с продуцентами антибиотиков, ферментов,
аминокислот, витаминов), получение суперпродуцентов; создание продуцентов,
несущих в себе бессмысленную генетическую информацию (например, гены
интерферона человека в клетках Pseudomonas aeruginosa); создание необычных
организмов, ранее не существовавших в природе (неклубеньковых растений, несущих
гены азотобактерий, ответственные за способность фиксировать молекулярный азот
из воздуха); разработка и внедрение экологически чистых и, по возможности,
безотходных технологий; разработка и внедрение в практику специальной
аппаратуры блочного (сменного) типа для различных биотехнологических схем;
автоматизация и компьютеризация биотехнологических процессов; создание
экономически оптимальных производственных процессов при максимальном
использовании сырья и минимальном потреблении энергии. Вот почему инженер -
биотехнолог в современном понимании должен быть широко и глубоко подготовленным
специалистом, в распоряжении которого оказываются сложнейшие биологические
системы (или аналоги их), синхронно работающие в заданном направлении. В любом
биотехнологическом процессе наиважнейшим звеном является биообъект,
"капризы" которого по любому поводу могут пагубно сказаться на
результатах этого процесса.
2. Типовая
схема и основные стадии биотехнологических производств
Рассмотренные продукты биотехнологии получают по
индивидуальным технологиям со своими биологическими агентами, сырьем, числом
стадий производства и их технологическими режимами. Тем не менее можно
представить себе обобщенную типовую схему биотехнологических производств.
2.1
Биотехнологическая стадия
Основной стадией является собственно биотехнологическая
стадия, на которой с использованием того или иного биологического агента (микроорганизмов,
изолированных клеток, ферментов или клеточных органелл) происходит
преобразование сырья в тот или иной целевой продукт.

Рисунок 2.1 Типовая схема, основные стадии и реализующие их
технологические процессы в биотехнологических производствах
Обычно главной задачей биотехнологической стадии является
получение определенного органического вещества.
Однако биотехнологическая стадия, как правило, включает в себя не
только синтез новых органических соединений, но и ряд других биотехнологических
процессов, перечисленных далее (рисунок 2.1).
Ферментация - процесс,
осуществляемый с помощью культивирования микроорганизмов.
Биотрансформация - процесс
изменения химической структуры вещества под действием ферментативной активности
клеток микроорганизмов или готовых ферментов. В этом процессе обычно не
происходит накопления клеток микроорганизмов, а химическая структура вещества
меняется незначительно. Вещество как бы уже в основном готово, биотрансформация
осуществляет его химическую модификацию: добавляет или отнимает радикалы,
гидроксильные ионы, дегидрирует и т.п.
Биокатализ - химические
превращения вещества, протекающие с использованием биокатализаторов-ферментов.
Биоокисление - потребление загрязняющих веществ с помощью микроорганизмов или
ассоциации микроорганизмов в аэробных условиях.
Метановое брожение - переработка органических отходов с помощью ассоциации метаногенных
микроорганизмов в анаэробных условиях.
Биокомпостирование - снижение
содержания вредных органических веществ ассоциацией микроорганизмов в твердых
отходах, которым придана специальная взрыхленная структура для обеспечения
доступа воздуха и равномерного увлажнения.
Биосорбция - сорбция
вредных примесей из газов или жидкостей микроорганизмами, обычно закрепленными
на специальных твердых носителях.
Бактериальное выщелачивание - процесс перевода нерастворимых в воде соединений металлов в
растворенное состояние под действием специальных микроорганизмов.
Биодеградация - деструкция вредных соединений под воздействием
микроорганизмов-биодеструкторов.
Обычно биотехнологическая стадия имеет в качестве выходных потоков
один жидкостной поток и один газовый, иногда только один - жидкостной. В
случае, если процесс протекает в твердой фазе (например, созревание сыра или
биокомпостирование отходов), выходом является поток переработанного твердого
продукта.
2.2
Подготовительные стадии
Подготовительные стадии служат для приготовления и подготовки
необходимых видов сырья биотехнологической стадии.
На стадии подготовки могут быть использованы следующие
процессы.
Приготовление среды, обычно жидкой,
включающей необходимые компоненты питания для биотехнологической стадии.
Стерилизация среды - для асептических
биотехнологических процессов, где нежелательно попадание посторонней микрофлоры.
Подготовка и стерилизация газов (обычно воздуха),
необходимых для протекания биотехнологического процесса. Чаще всего подготовка
воздуха заключается в очистке его от пыли и влаги, обеспечении требуемой
температуры и очистке от присутствующих в воздухе микроорганизмов, включая
споры.
Подготовка посевного материала. Очевидно, что для
проведения микробиологического процесса или процесса культивирования
изолированных клеток растений или животных необходимо подготовить и посевной
материал - предварительно выращенное малое по сравнению с основной стадией
количество биологического агента.
Подготовка биокатализатора. Для процессов
биотрансформации или биокатализа необходимо предварительно подготовить
биокатализатор - либо фермент в свободном или закрепленном на носителе виде,
либо биомассу микроорганизмов, выращенную предварительно до состояния, в
котором проявляется ее ферментативная активность.
Предварительная обработка сырья. Если сырье поступает в
производство в виде, непригодном для непосредственного использования в
биотехнологическом процессе, то проводят операцию по предварительной подготовке
сырья. Например, при получении спирта пшеницу сначала дробят, а затем
подвергают ферментативному процессу "осахаривания", после чего
осахаренное сусло на биотехнологической стадии путем ферментации превращается в
спирт.
Другой пример - использование древесины для получения
дрожжей. Древесину сначала измельчают, а затем подвергают нагреву до 200°С в
кислой среде. В результате такого процесса кислотного гидролиза происходит
превращение древесины в раствор глюкозы и лигнин. Раствор глюкозы (гидролизат)
как раз и используется в биотехнологическом процессе для получения кормовых
дрожжей.
Переходим теперь к стадии, следующей за биотехнологической.
2.3
Разделение жидкости и биомассы
Чаще всего целевой продукт находится либо в самой биомассе,
либо в жидкости. В обоих случаях необходимо сначала разделить эти две фазы. В
зависимости от свойств биомассы и жидкости для этих целей могут быть
использованы различные процессы.
Отстаивание - разделение под действием гравитационных
сил (обычно при очистке сточных вод).
Фильтрация - пропускание суспензии через фильтрующий
материал, на котором задерживаются частицы твердой фазы - биомасса. Такой
способ применяют в производстве антибиотиков, особенно в тех случаях, когда
микроорганизм-продуцент имеет мицелиальный характер.
Сепарация, центрифугирование - разделение под действием
центробежных сил. Наиболее часто используется для отделения дрожжей или
бактерий в производстве кормовой биомассы.
Микрофильтрация, ультрафильтрация - пропускание суспензии
через мембраны с весьма малым размером пор, обеспечивающее удержание клеток
микроорганизмов на мембране и получение раствора, свободного от взвешенных
клеток. Ультрафильтрация задерживает уже не только клетки, но и крупные
молекулы растворенных веществ.
Коагуляция - добавление в суспензию реагентов,
способствующих образованию и осаждению более крупных клеточных агломератов и
отделению их от жидкости путем отстаивания.
Флотация - захват биомассы микроорганизмов пузырьками пены и
выделение ее из пенной фракции.
2.4 Выделение
продуктов биосинтеза
Эта стадия имеет определенные отличия, связанные с тем,
являются продукты внеклеточными или внутриклеточными.
Так, для внутриклеточных продуктов сначала необходимо
разрушить клеточную оболочку одним из методов, среди которых можно назвать
следующие.
Дезинтеграция клеток. Этот процесс разрушения
клеточной оболочки может осуществляться физическими методами (с помощью мелющих
тел, путем замораживания и продавливания, воздействием ультразвуком, методом
декомпрессии - резкого сброса давления) или химическими и биотехнологическими
методами.
Гидролиз - разрушение клеточных оболочек под действием
химических реагентов и температуры.
Ферментолиз - разрушение клеточных оболочек под
действием ферментов при повышенной температуре.
Автолиз - разновидность ферментолиза, когда используют
собственные ферменты клетки.
После проведения предварительной операции разрушения клеток
выделение целевого продукта осуществляется из раствора методами, которые
являются общими для внеклеточных и внутриклеточных продуктов.
Экстракция - переход целевого продукта из водной фазы в
не-смешивающуюся с водой органическую жидкость (экстрагент). Наиболее известно
выделение жироподобных веществ жидкими углеводородами (типа бензина), но
применяются и многие другие виды экстрагентов (хлороформ, эфир, бутилацетат).
Экстракция прямо из твердой фазы (в том числе и биомассы микроорганизмов)
называется экстрагированием.
Осаждение - выделение целевого продукта путем добавления к
жидкости реагента, взаимодействующего с растворенным продуктом и переводящего
его в твердую фазу.
Адсорбция - перевод растворенного в жидкости продукта в
твердую фазу путем его сорбции на специальных твердых носителях (сорбентах).
Ионный обмен - то же, что адсорбция, но в этом случае
в твердую фазу переходят ионы (катионы или анионы), а не целиком молекула
целевого продукта или примеси.
Отгонка, ректификация - эти методы используют
для выделения растворенных в культуральной жидкости легкокипящих продуктов.
Пример - этиловый спирт.
Ультрафильтрация, нанофильтрация и обратный осмос применяются для
выделения высокомолекулярных соединений (белков, поли пептидов,
полинуклеотидов). Обратный осмос и нанофильтрация позволяют отделять даже небольшие
по размеру молекулы.
Центрифугирование, ультрацентрифугирование используют для выделения
вирусов, клеточных органелл, высокомолекулярных соединений.
2.5 Очистка
продукта
На стадии выделения продукта главная задача - отделить
основную часть продукта, пусть даже и с некоторыми примесями. Получается как бы
неочищенный продукт. Поэтому, когда необходимо получать биопродукты высокой
кондиции, добавляют еще стадию очистки продукта. Задача этой стадии - убрать
примеси, сделать продукт максимально чистым.
Эта задача решается с помощью разнообразных процессов, в
числе которых многие из тех, что уже были рассмотрены ранее. Это экстракция
и экстрагирование, адсорбция, ионный обмен, ультрафильтрация и обратный осмос,
ректификация и ферментолиз. Кроме этих процессов используют и следующие.
Хроматография - процесс, напоминающий
адсорбцию. На твердом сорбенте собираются растворенные вещества, но не одно, а
несколько, часто близких по структуре. Например, смеси белков, нуклеотидов,
Сахаров, антибиотиков. При адсорбции они и десорбируются вместе. А вот при
хроматографии они выходят из сорбента как бы по очереди, что и позволяет их
разделять и, значит, очищать друг от друга.
Диализ - процесс, в котором через полупроницаемую
перегородку могут проходить низкомолекулярные вещества, а высокомолекулярные
остаются. Путем диализа осуществляют очистку вакцин и ферментов от солей и
низкомолекулярных растворимых примесей.
Кристаллизация. Этот процесс базируется
на различной растворимости веществ при разных температурах. Медленное
охлаждение позволяет формировать кристаллы из растворов целевых продуктов,
причем чистота их обычно очень высока. Вся "грязь" остается в
маточном растворе. Таким образом, например, получают кристаллы пенициллина.
Можно даже получить еще более чистый продукт, если кристаллы
растворить в воде или растворителе, а потом снова кристаллизовать (т.е.
провести процесс перекристаллизации).
2.6
Концентрирование продукта
После очистки продукта он часто находится все-таки в растворе
с небольшими концентрациями примесей. Дальнейшая задача - обеспечить его
концентрирование.
Кстати, необходимо рассмотреть, как обычно меняется
концентрация целевого продукта от биотехнологической стадии до готовой формы
продукта. На выходе из биотехнологической стадии суспензия обычно содержит
целевого продукта примерно 0,1 - 1%, после стадии отделения биомассы - 0,1-2%,
после стадии выделения - 1-10%, после очистки - 50-80%, и, наконец, после
концентрирования - 90-100%.
На стадии концентрирования применяют такие процессы, как выпаривание,
сушка, осаждение, кристаллизация с фильтрацией получившихся кристаллов,
ультрафильтрация и гиперфильтрация или нанофильтрация, обеспечивающие как
бы "отжим" растворителя из раствора.
2.7 Получение
готовой формы продукта
На завершающей стадии производства продукт приобретает
товарную форму за счет проведения процессов гранулирования (формирование
гранул из порошка или прямо из раствора), дражирования, таблетирования
(формирование драже, таблеток), розлива или фасовки, ампулирования
(затаривания в ампулы).
2.8 Очистка
стоков и выбросов
Таким образом, мы рассмотрели схему основного
биотехнологического производства, которое на некоторых стадиях, если не на
всех, имеет определенные стоки и выбросы в атмосферу. Очистка этих стоков и
выбросов - специальная задача, которая обязательно должна решаться в наше
экологически неблагополучное время. По существу очистка стоков - это отдельное
биотехнологическое производство, имеющее свои подготовительные стадии,
биотехнологическую стадию, стадию отстаивания биомассы активного ила и стадию
дополнительной очистки стоков и переработки осадка. Очищенная вода иногда может
быть возвращена в основное производство. Так организована, например,
безотходная технология получения кормового белка из парафинов нефти. На заводе
в г. Кириши после создания такой схемы удалось полностью ликвидировать
технологические стоки в реку Волхов, а реально - просто заглушить трубопровод
большого диаметра. И свежая вода стала забираться из реки Волхов только для
компенсации потерь воды за счет испарения из градирен и с готовым продуктом
(кормовой белок имеет влажность до 10%).
3.
Основные понятия о методах отделения биомассы от культуральной
жидкости
Для отделения взвешенных биологических частиц от
культуральной жидкости используются различные физико-химические свойства:
плотность частиц;
размер частиц;
поверхностные свойства частиц.
При разделении суспензий по плотности частиц
используют следующие методы:
) седиментация (отстаивание) - для крупных частиц
размером от 2,3 мкм до 1 мм, по плотности отличающихся от окружающего раствора;
) гидроциклонирование - от 5 до 700 мкм;
) центрифугирование - от 400 до 900 нм;
) ультрацентрифугирование - от 10 нм до 1 мкм.
По размеру частиц методы разделения
биологических суспензий могут быть следующими:
) фильтрация через тканевые фильтры - для частиц
размером от 10 мкм до 1 мм;
) микрофильтрация - для частиц размером от 200 нм до
10 мкм;
) ультрафильтрация, позволяющая отделять частицы
размером от 10 нм до 5 мкм.
Мицелиальные грибы имеют размеры микроколоний до 1 мм, что
упрощает их отделение от жидкости. Есть также нерастворимые компоненты среды
(мука, дробина в спиртовом производстве). Гранулы биокатализаторов имеют
размеры около 1 мм (чтобы их легче было отделять).
Макромолекулы имеют размеры частиц в диапазоне 10-120 нм,
микрочастицы - от 120 нм до 10 мкм, тонкие взвеси - от 10 до 100 мкм и грубые
взвеси - от 100 мкм до 1 мм.
Поверхностные свойства частиц используются в процессе флотации.
За основу в этом методе принимается не размер, а способность клеток
удерживаться пузырьками воздуха; ориентировочный диапазон размеров флотируемых
частиц варьирует от 1 до 200 мкм.
Конкретный выбор того или иного метода зависит от опытной
проверки, так как не всегда точно известны свойства отделяемых частиц и их
поведение в условиях использования тех или иных методов разделения.
3.1
Характеристика метода флотации
Флотация - это выделение клеток микроорганизмов из
культуральной жидкости за счет адгезии (прилипания) микроорганизмов к
поднимающимся в жидкости пузырькам воздуха и затем сбора пены и ее конденсации
(коалесценции). Обычно чем меньше пузыри, тем медленнее они поднимаются и тем
больше время пребывания их в жидкости и вероятность захвата клеток
микроорганизмов.
На рисунке 3.1.1 представлен один из вариантов конструкции
флотатора.
Флотатор представляет собой две коаксиально расположенные
цилиндрические обечайки, кольцевой канал между которыми заполняется флотируемой
суспензией.

Рисунок 3.1.1 - Схема флотации культуральной жидкости: внешняя
обечайка флотатора; пена; 3 - флотируемая жидкость; 4 - внутренняя
обечайка флотатора; 5 - скоалесцированная пена; I - воздух; II - флотат;
III - обедненный
раствор
В этот канал снизу подается через специальный диспергатор сжатый
воздух, при этом образуется большое количество мелких пузырей. Пузыри
всплывают, захватывая по пути клетки микроорганизмов. Далее пена переваливается
через край внутреннего цилиндра и отстаивается в кольцевом зазоре внешнего. При
этом пузыри разрушаются. Флотат - обогащенная по биомассе жидкость.
Измерения показали, что для хорошо флотирующихся клеток концентрация
клеток в пене в 5-7 раз превышает их концентрацию в исходной суспензии.
Для оценки производительности флотатора важно знать время отстоя
пены, а оно зависит от множества физико-химических факторов. При этом в
обедненной жидкости после ее отвода из аппарата остается 5-8 % общего
количества биомассы микроорганизмов, что является потерями.
Во время отстоя пены происходит ее осушение: жидкость по стенкам
пузырьков стекает вниз, а биомасса остается в осушенной пене.
Размеры клеток флотируемой жидкости - до 10 мкм.
Для облегчения флотации в суспензию добавляют флотореагенты -
длинноцепочечные жирные кислоты и амины.
Для обычной флотации размеры пузырей составляют 100 мкм и выше.
Такая флотация называется пневматической, или барботажной.
Важной модификацией процесса флотации является напорная флотация.
Сущность ее состоит в том, что жидкость сначала насыщается газом (обычно
воздухом) под давлением (до 5 атм), после чего происходит резкий сброс
давления. В результате появляются мелкие пузырьки воздуха, которые и оказывают
флотационное действие. При этом размеры пузырьков меньше - около 40 мкм, что
облегчает флотацию.
3.2
Характеристика методов центрифугирования и сепарации
Для преодоления отмеченных ранее трудностей осаждения
скорость осаждения клеток усиливают, помещая суспензию в поле центробежных сил.
Центрифуги и сепараторы, которые это поле создают, часто называют
осадительными.
На частицу в центробежном поле действует центробежная сила  :
:
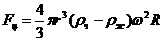 , (3.2.1)
, (3.2.1)
где r-радиус частиц; и
и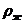 - плотность частицы и жидкости
соответственно;
- плотность частицы и жидкости
соответственно;  - угловая скорость; R- радиус вращения частицы вокруг оси
центрифуги.
- угловая скорость; R- радиус вращения частицы вокруг оси
центрифуги.
Сила сопротивления среды определяется согласно закону Стокса:
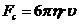 , (3.2.2)
, (3.2.2)
где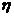 - динамическая вязкость жидкости;
- динамическая вязкость жидкости; 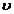 - скорость движения частицы относительно
жидкости.
- скорость движения частицы относительно
жидкости.
Приравнивая эти силы, получаем:
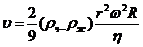 . (3.2.3)
. (3.2.3)
Итак, чем больше скорость вращения центрифуги и ее радиус и чем
больше разность плотностей жидкости и частицы, тем быстрее происходит
осаждение. Вязкость жидкости снижает скорость осаждения.
Разные типы центрифуг оценивают по так называемому фактору
разделения 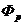 , показывающему, во сколько раз ускорение
центробежного поля больше ускорения свободного падения g:
, показывающему, во сколько раз ускорение
центробежного поля больше ускорения свободного падения g:
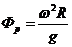 . (3.2.4)
. (3.2.4)
У обычных центрифуг этот фактор составляет до 3500, а у
суперцентрифуг выше - 5000-7000. Ультрацентрифуги могут иметь 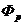 до 20000.
до 20000.
Скорость вращения барабана варьируется от 3000 до 30 000 об/мин.
Существенным показателем работы центрифуги является индекс производительности  :
:
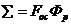 , (3.2.5)
, (3.2.5)
где 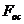 - площадь цилиндрической поверхности
осаждения.
- площадь цилиндрической поверхности
осаждения.
Скорость свободного осаждения  связана со скоростью осаждения в центробежном поле соотношением
связана со скоростью осаждения в центробежном поле соотношением
 , (3.2.6) или
, (3.2.6) или
 . (3.2.7)
. (3.2.7)
Общая производительность центрифуги определяется соотношением
 . (3.2.8)
. (3.2.8)
В этом уравнении член  характеризует свойства центрифуги (суммарную поверхность
осаждения, умноженную на суммарный фактор разделения). Его следует определять
экспериментально для заданной скорости вращения центрифуги.
характеризует свойства центрифуги (суммарную поверхность
осаждения, умноженную на суммарный фактор разделения). Его следует определять
экспериментально для заданной скорости вращения центрифуги.
Величина  характеризует приведенную скорость
свободного осаждения и зависит только от свойств жидкости. Ее лучше определять
экспериментально на центрифуге с известной величиной
характеризует приведенную скорость
свободного осаждения и зависит только от свойств жидкости. Ее лучше определять
экспериментально на центрифуге с известной величиной  (например, на лабораторной
стаканчиковой).
(например, на лабораторной
стаканчиковой).
Рассчитывать  исходя из свойств жидкости
нецелесообразно, так как обычно различаются размеры и плотность частиц, да и
вязкость жидкости.
исходя из свойств жидкости
нецелесообразно, так как обычно различаются размеры и плотность частиц, да и
вязкость жидкости.
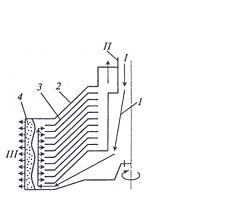
Рисунок 3.2.1 Принципиальная схема центробежного сепаратора: 1 -
полый вал; 2 - корпус; 3 - коническая тарелка; 4 - слой осадка; I - вход жидкости; II -
выход жидкости; III - выход сгущенной биомассы
Рассмотрим теперь конструкцию наиболее распространенного в
биотехнологии тарельчатого сепаратора Рисунок 3.2.1
Этот сепаратор изобрел шведский ученый Густав де Лаваль в 1896 г.
Сепараторы выпускает известная в биотехнологической промышленности фирма,
которая так и называется - "Альфа Лаваль".
Сепаратор имеет полый вал, неподвижный корпус с размещенным в нем
пакетом вращающихся с валом конических тарелок, находящихся одна над другой
так, что образуется коническое пространство. Жидкость входит по полому валу под
нижней тарелкой и доходит до внешнего цилиндрического края корпуса. Далее она
движется между коническими тарелками к центробежному коллектору, из которого
осуществляется выход жидкости.
В процессе этого движения частицы биомассы отбрасываются по
направлению от центра вращения и сползают по коническим поверхностям тарелок к
боковой стенке корпуса, создавая в конечном счете возле нее слой сгущенной
биомассы.
В корпусе расположены сопла, из которых под большим давлением
происходит выгрузка сгущенной биомассы.
Существуют различные модификации подобных сепараторов, в том числе
с ручной, а также механизированной циклической и непрерывной выгрузкой осадка.
В целом такая конструкция увеличивает время пребывания частиц в
сепараторе и тем самым его производительность.
Преимущества центробежных
сепараторов:
высокая производительность;
хорошая степень концентрирования (до 10-15); достигается
концентрация биомассы 5-15 % по сухой массе;
возможность повышения скорости сепарирования предварительной
обработкой жидкости флокулянтами.
Недостатки:
сложность оборудования;
энергоемкость процесса (хотя по сравнению с выпаркой затраты
энергии все же меньше).
Список
литературы
1. Беккер
М.Е. Введение в биотехнологию Пер с латышского. - Рига.: Изд.
"Звайгэне", 1978
2. Бирюков
В.В. Основы промышленной биотехнологии. - М., 2004. - 296с
. Елинов
Н.П. Основы биотехнологии. - СПб.: фирма "Наука". 1995
. Тихонов
И.В., Рубан Е.А., Грязнева Т.Н. и др. Биотехнология (под ред. акад. РАСХН
Воронина Е. С.) - СПб.: ГИОРД, 2005. - 792с
. Касаткин
А.Г. Основные процессы и аппараты химической технологии - М.: Химия, 1973 - 752
с.
. Черкасова
Г.Н., Фирсова Н.В., Таранцева К.Р. Методические указания к выполнению курсовых
работ по дисциплине "Введение в специальность" - Пенза: Изд-во ПГТА,
2009. - 20с