Кислотно-щелочной баланс у реанимационных больных различного профиля
Министерство
образования и науки Российской Федерации
Федеральное
государственное бюджетное образовательное
учреждение
высшего профессионального образования
КУБАНСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра
биохимии и физиологии
МАГИСТЕРСКАЯ
ДИССЕРТАЦИЯ
КИСЛОТНО-ЩЕЛОЧНОЙ
БАЛАНС У РЕАНИМАЦИОННЫХ БОЛЬНЫХ РАЗЛИЧНОГО ПРОФИЛЯ
Работу выполнила М. С. Закревская
Направление магистерской подготовки
020400.68 Биология
Нормоконтролёр, канд. биол. наук,
доц. В. В. Хаблюк
Краснодар
2013
РЕФЕРАТ
Работа выполнена на 59 листах машинописного текста, содержит 4 таблицы,
45 литературных источника.
Исследования проводились на базе детской краевой клинической больнице, в
период с января 2012 года по январь 2013 года.
Ключевые слова: КИСЛОТНО-ЩЕЛОЧНОЕ СОСТОЯНИЕ, ЭЛЕКТРОЛИТНЫЙ БАЛАНС,
АЦИДОЗ, АЛКАЛОЗ, ДЕТСКИЙ ВОЗРАСТ.
Цель работы: помощь в повышение качества лечебной помощи при нарушениях
кислотно-щелочного баланса у реанимационных больных различного профиля,
детского возраста.
Использовался электродный метод определения электролитов и кислотного
статуса на автоматическом газовом анализаторе АВL 800 компании Radiometr.
Данная работа посвящена исследованию кислотно-щелочного состояния у
реанимационных больных различного профиля в детском возрасте. В работе
отраженны изменения происходящие с кислотно-щелочным состоянием и электролитным
балансом при патологиях различных систем у детей разного возраста находящихся в
критическом состоянии.
СОДЕРЖАНИЕ
Введение
1. Аналитический
обзор литературы
1.1 Типовые
нарушения ph цитоплазмы
1.2 Формы
нарушения кислотно-основного состояния
1.2.1 Дыхательный
(респираторный) ацидоз
1.2.2 Дыхательный
(респираторный) алкалоз
1.2.3 Метаболический
ацидоз
1.2.4 Метаболический
алкалоз
1.3 Регуляция
кислотно-основного состояния
1.3.1 Буферные
системы
1.3.1.1 Гидрокарбонатная
буферная система
1.3.1.2 Фосфатная
буферная система
1.3.1.3 Аммоний
1.3.1.4 Белковая
буферная система
1.3.2 Физиологические
механизмы
1.3.2.1 Легкие
1.3.2.2 Почки
1.4 Основные
электролиты организма
1.5 Связь
между водно-электролитным балансом и кислотно-щелочным состоянием
1.6 Преаналитический
этап
1.6 Интерпретация
показателей анализа газов крови
2. Материал и
методы исследования
2.1 Контингент
2.2 Материал
исследования
2.3 Методы
исследования
2.4 Статистическая
обработка результатов
3. Кислотно-щелочной
баланс у реанимационных больных различного профиля
3.1 Показатели
кислотно-щелочного и электролитного балансов у больных с патологией легких
3.2 Показатели
кислотно-щелочного и электролитного балансов у больных с сахарным диабетом
3.3 Показатели
кислотно-щелочного и электролитного балансов у больных с патологией почек
3.4 Показатели
кислотно-щелочного и электролитного балансов у больных с черепно-мозговой
травмой
3.5 Коррекция
нарушений кислотно-щелочного состояния
Заключение
Библиографический
список
ОПРЕДЕЛЕНИЯ,
ОБОЗНАЧЕНИЯ, СОКРАЩЕНИЕ
КЩС - кислотно-щелочное состояние.
АИ - анионный интервал.
ВВЕДЕНИЕ
Кислотно-щелочной баланс (КЩБ) один из важнейших гомеостатических свойств
внутренней среды организма.
За последние сто лет кислотно-щелочная химия заняла особое место в
клинической медицине. Врачи, как правило, соглашаются с важностью
кислотно-щелочного состояния, но сопротивляются пониманию научной части,
патологии и области ее применения. Несомненно, организм тщательно контролирует
относительные концентрации водорода и гидроксильных ионов во внеклеточном и
внутриклеточном пространствах. Изменение этого "баланса" нарушают
работу трансмембранных ионных помп, что ведет к серьезным проблемам.
Исследование кислотно-щелочного состояния имеет кардинальное значение в
диагностике и лечении различных неотложных состояний. Без правильной
интерпретации результатов анализа газов крови современной клинической медицине
не обойтись. Но акцептируя внимание на интерпретации результатов, а не на
патофизиологи существует недопонимания причины, эффекта и лечения нарушения
кислотно-щелочного состояния.
Для нормального функционирования клеток и протекания метаболических
процессов в организме поддерживается постоянный баланс между кислотами и
основаниями [Анестезиология и интенсивная терапия: Практическое руководство,
2006]. При расщеплении жиров и углеводов для получения энергии выделяется CO2
который растворяется в крови с образованием угольной кислоты. При метаболизме
белков образуется соляная серная и другие кислоты. Поэтому для поддержания pH
необходимо постоянно удалять ионы Н+. Для эффективного протекания
процессов жизнедеятельности концентрация Н+ должна, находится, в
жестких пределах. В противном случае нарушение этих процессов неминуемо приведет
к смерти.
От соотношения концентраций ионов водорода и ионов OH- крови
зависят активность ферментов, процессы расщепления синтеза белка, окисления
углеводов и липидов, чувствительность клеточных рецепторов к медиаторам и
гормонам, проницаемость клеточных мембран, физико-химические свойства
коллоидных систем клеток и межклеточных структур и многое другое. Даже
незначительное колебание кислотно-щелочного равновесия в ту или иную сторону
оказывает влияние на активность ферментов, а следовательно, изменяется скорость
биохимических процессов, что в конечном итоге влияет на состояние организма в
целом. Понимание того, что ферментативные системы и метаболические процессы,
ответственные за поддержание клеточной функции, зависят от окружающей среды со
стабильной ионной концентрацией электронов и водорода, уже более 100 лет назад
привел Клода Бернара к описанию "внутренней среды", в поддержание
которой вовлечены сложные гомеостатические механизмы. Исследование
кислотно-основного состояния широко используются для мониторинга состояния
больных в критическом состоянии. Изменение pH крови выше 7,8 или ниже 6,8
несовместимы с жизнью. Кислотно-основное состояние включает, наряду с
измерением pH, определение и физиологически важных газов, присутствующих в
крови таких как кислород и углекислый газ, и еще несколько других параметров.
Это обусловлено тем, что все эти показатели и их значения тесно взаимосвязаны
друг с другом. Например, от уровня рН крови зависит распределение ионов в
организме, и изменения рН может вызвать изменение концентрации ионов, что
влияет на функционирование различных систем организма и требует
соответствующего контроля [Современная неотложная помощь…, 2009].
У тяжелых больных могут наблюдаться существенные изменения этих
показателей в течение короткого времени. Регулярный анализ газов крови
позволяет заранее предупреждать об ухудшении состояния и позволяет оценить
эффективность лечения.
Цель работы повысить качество лечебной помощи при нарушениях
кислотно-щелочного баланса у реанимационных больных различного профиля,
детского возраста.
В связи с поставленной целью решались следующие задачи:
. Установить основные показатели кислотно-щелочного состояния при
различных формах алкалоза и ацидоза;
. Выявить закономерности изменения показателей электролитного баланса при
нарушениях кислотно-щелочного равновесия.
. Обосновать коррекцию кислотно-щелочного баланса у реанимационных
больных различного профиля.
По данной работе опубликованы статьи:
Показатели кислотно-щелочного и электролитного баланса педиатрических больных
в критическом состоянии. Современная биология: вопросы и ответы: материалы II
международной научной конференции, 29-30 марта 2012 года, город
Санкт-Петербург.
Проблема нарушения кислотно-щелочного и электролитного баланса у детей.
Актуальные вопросы экологии и охраны природы экосистем южных регионов России и
сопредельных территорий: материалы XXV Межреспубликанской научно-практической
конференции с международным участием, посвященной 40-летию Учебного
ботанического сада Кубанского государственного университета, 12 октября 2012 г.
Краснодар.
Динамика концентрации K+, Na+, Cl-, Са2+ в крови при
ацидозе, алкалозе реанимационных больных. Медицинский академический журнал.
Материалы II Всероссийской научной конференции молодых ученых "Проблемы
биомедицинской науки третьего тысячелетия" город Санкт-Петербург
Зависимость изменений электролитов крови от нарушений кислотно-щелочного
состояния у детей в условиях лечения в реанимационном отделении. Кубанский
научный медицинский вестник 2012 №5 (134).
1. АНАЛИТИЧЕСКИЙ ОБЗОР ЛИТЕРАТУРЫ
1.1 Типовые
нарушения pH цитоплазмы
Гомеостаз внутриклеточного pH обеспечивается метаболическими процессами,
в которых продуцируются или потребляются ионы водорода. Основной источник ионов
водорода в клетке - их высвобождение в процессах расщепления углеродных
скелетов в структурах белков, жиров, углеводов с образованием промежуточных
продуктов: кетоновых тел, пирувата, лактата и других органических кислот, а так
же нелетучих кислот (серной, фосфорной, мочевой и др.). Самый мощный источник
ионов водорода - двуокись углерода, образуемая как конечный продукт окисления
глюкозы и жирных кислот при аэробном метаболизме:
₂+H₂O↔H₂CO₃↔H⁺+HCO₃ˉ.
Реакцию катализирует фермент карбоангидраза. Свободные ионы водорода
имеют очень короткий период жизни и находятся в растворах вне организма в виде
гидроксония: H⁺+H₂O↔H₃O. В организме образующиеся ионы
водорода немедленно включаются во все биологические процессы, являясь общим
реактантом в биологических процессах. В клетках существуют также системы, в
которых утилизация ионов водорода ведет к формированию сигнала для индукции
клеточного роста и обуславливает прямой транспорт растворов и макромолекул
через плазматическую мембрану [Михайлов, 2001].
1.2 Формы
нарушения кислотно-основного состояния
В том случае, когда компенсаторные механизмы организма не способны
предотвратить сдвиги концентрации водородных ионов, наступает расстройство
кислотно-основного состояния (КОС). При этом наблюдаются два противоположных
состояния. Ацидоз характеризуется увеличением концентрации водородных ионов
выше нормальных пределов, при этом pH уменьшается. Снижение pH ниже 6,8
вызывает смерть. Если концентрация водородных ионов уменьшается (соответственно
pH растет), наступает состояние алкалоза. Предел совместимости с жизнью
достигается при величине pH=8. Нарушения КОС оценивают главным образом на
основании определения значений истинного pH, парциального напряжения CO2
и избытка или дефицита оснований (бикарбоната) в крови. Так как парциальное
напряжение CO2 в крови контролируется легкими, то первичную причину
изменения этого показателя называют респираторной. Первичной причиной изменения
уровня бикарбоната в крови служат метаболические нарушения, поэтому такая
первопричина называется метаболической. На основании этих понятий все
расстройства КОС разделяют на 4 основные категории:
) если в основе расстройства лежит увеличение pCO2 (pH
крови снижается), то такое состояние называется респираторным (дыхательным)
ацидозом;
) если в основе расстройства лежит снижение pCO2 (pH
крови повышается), то такое состояние называется респираторным (дыхательным)
алкалозом;
) если в основе расстройства лежит увеличение уровня бикарбоната
(pH крови повышается), то такое состояние называется метаболическим алкалозом;
) если в основе расстройства лежит снижение уровня бикарбоната (pH
крови снижается), то такое состояние называется метаболическим ацидозом [Горн,
Хейту, Сверинген, 1999].
Так как сохранение нормальных значений pH крови является жизненно важным,
то регуляторные системы стремятся корригировать любые нарушения pH. Этот
процесс называется компенсацией и заключается в восстановлении нормального
состояния HCO3 /pCO2. Первичные респираторные нарушения,
при которых изменяется pCO2, компенсируются за счет регуляции при
помощи метаболического компонента - бикарбоната. В свою очередь, метаболические
нарушения, при которых изменяется концентрация бикарбоната, компенсируются за
счет респираторного компонента - pCO2.
В случае если компенсаторные механизмы достаточны для нормализации
значений pH крови, говорят, что больной полностью компенсирован. Другими
словами, при компенсированном нарушении КОС абсолютные показатели pCO2
и бикарбоната выше или ниже нормальных, но отношения их к друг другу такие же
как в норме, и pH крови в пределах нормальных значений. Если компенсаторные
механизмы достаточны для нормализации значений pH крови, но не достаточны, для
того чтобы состояние пациента полностью нормализовалось, то говорят о частичной
компенсации. Необходимо помнить, что и полная и частичная компенсация не норма,
не смотря на то, что соотношение HCO3¯/pCO2 и pH крови в норме, ведь уровень бикарбоната и
значения pCO2 могут быть существенно нарушены по сравнению с нормой.
Респираторная компенсация метаболических расстройств, происходит в пределах
нескольких часов. Почечная компенсация дыхательных расстройств развивается
немного медленнее - за несколько дней или недель [Учайник, Молочный, 2005].
1.2.1
Дыхательный (респираторный) ацидоз
Избыточное накопление углекислоты в крови в результате недостаточной
вентиляционной функции легких или увеличения "мертвого" пространства.
Снижение pH ниже нормальных значений свидетельствует о декомпенсированном
ацидозе. О компенсации судят по изменению показателей при повторных
исследованиях (нормализация pH, рост буферных оснований).
К развитию респираторного ацидоза могут приводить:
недостаточный объем спонтанной вентиляции;
ошибочный выбор параметров искусственной вентиляции легких;
нарушение функционирования дыхательного центра;
тяжелые двусторонние поражения легких.
Изменения показателей КОС при дыхательном ацидозе зависят от того, когда
оценивается состояние: вскоре после развития острого ацидоза или во время
стабилизированного хронического дыхательного ацидоза. После начала острого
дыхательного ацидоза концентрация HCO3ˉ в плазме крови
увеличивается незначительно, а сдвиги pH ограничены. Компенсаторная реакция
почки на нагрузку кислотой происходит медленно, поэтому увеличение содержания
HCO3ˉ в плазме крови являются результатом не почечных
механизмов, а клеточных и внеклеточных буферных систем. Хлор обменивается на
внутриклеточный HCO3ˉ, в связи с этим этот сдвиг концентрации
HCO3ˉ называется хлоридным сдвигом. При остром дыхательном
ацидозе концентрация HCO3ˉ увеличивается на 0,1 ммоль/л на
каждый 1 мм рт. ст. повышение величины артериального pCO2. Острый
дыхательный ацидоз представляет собой наиболее опасное нарушение КОС,
развивающееся остро в связи с декомпенсацией функции внешнего дыхания. По мере
снижения pH возникают электролитные сдвиги с тенденцией к увеличению фосфатов и
калия в плазме [Современная неотложная помощь…,2009].
В случае если дыхательный ацидоз носит хронический характер, то
возрастание в плазме крови концентрации HCO3ˉ обусловлено
увеличенной задержкой HCO3ˉ почкой. Экскреция аммония почкой
повышается, а канальцевая реабсорбция HCO3ˉ усиливается. При
длительном течении периода компенсации концентрация HCO3-
возрастает на 0,3 ммоль/л на каждый 1 мм рт.ст. pCO2 в артериальной
крови.
Независимо от причины дыхательного ацидоза нарушения КОС проявляются
определенными клиническими признаками и симптомами. Повышение pCO2 в
артериальной крови неспецифически влияют на ЦНС, что может выражаться в
возникновении спутанности сознания, головной боли и тремора рук. При особенно
высоких значениях pCO2 может развиться кома.
Респираторный ацидоз может быть устранен только путем восстановления
нормального pCO2. Однако, если высокое pCO2 сохраняется
долгое время, происходит компенсация за счет усиления экскреции ионов водорода
почками.
Главным в лечении дыхательного ацидоза являются мероприятия, направленные
на улучшение легочной вентиляции и лечения основного заболевания [Пауков,
Литвицкий, 2004].
1.2.2
Дыхательный (респираторный) алкалоз
Снижение количества углекислоты в крови ниже нормы в результате
гипервентиляции. Он возникает при увеличенной частоте или глубине дыхания,
вызывающей ускоренное выведение pCO2. Причины дыхательного алкалоза
следующие:
гипервентиляция;
черепно-мозговая травма;
тканевая гипоксия;
травматические повреждения легких;
интоксикация салицилатами;
гиперкомпенсация метаболического ацидоза.
Повышение pH выше нормальных значений свидетельствует о
декомпенсированном алкалозе. О компенсации судят по изменению показателей при
повторных исследованиях (нормализация pH, снижение буферных оснований).
При остром дыхательном алкалозе основной механизм естественной
компенсации связан с немедленным падением концентрации HCO3-
в плазме. Концентрация HCO3- снижается в результате
действия внеклеточных механизмов, прежде всего - титрования внутриклеточными
небикарбонатными буферными системами. Концентрация HCO3-
плазмы падает на 0,2 ммоль/л на каждый 1 мм рт. ст. снижения pCO2
артериальной крови. Почечная компенсация включается только на 2-3-й день
дыхательного алкалоза. Секреция H+ снижается, что находит выражение
в уменьшении секреции аммиака и угнетении реабсорбции HCO3-.
Компенсацию определяют по состоянию HCO3-/pCO2.
Концентрация HCO3- плазмы падает в среднем на 0,4 ммоль/л
при снижении pCO2 артериальной крови на каждый 1 мм рт. ст
[Назаренко, Кишкун, 2000].
Клиническими проявлениями дыхательного алкалоза является усиленная
частота или глубина дыхания, вследствие низкого pCO2 в артериальной
крови, наблюдается головокружение.
Лечение респираторного алкалоза сводится к устранению нарушений внешнего
дыхания и лечению основного заболевания. Необходимо помнить, что если
гипервентиляция устраняется быстро, то у больного может развиться
метаболический ацидоз вследствие активного включения почечной компенсации
[Анестезиология и интенсивная терапия, 2006].
1.2.3
Метаболический ацидоз
При метаболическом ацидозе первичным нарушением является либо усиленная
продукция, либо снижение экскреции ионов водорода.
Основные причины накопления в организме ионов Н+ могут быть
следующие:
недостаточное выведение СО2;
неадекватное снабжение клеток кислородом;
аномальное образование кислот;
повышенные потери бикарбоната;
повышенное выведение бикарбоната с мочой или нарушенная способность почек
регенерировать бикарбонат;
неадекватное выведение нециркулирующих кислот.
Существует две основные формы метаболического ацидоза. Первая группа
включает те случаи, когда кислотой поступающей в кровь, является HCl. Поступление HCl в кровь уменьшает концентрацию HCO3-
и увеличивает уровень Cl- (НСl + НСО3-→Н2СО3+Сl-). Поэтому данный тип метаболического ацидоза называют
гиперхлоремическим метаболическим ацидозом. Причинами такого ацидоза являются
экзогенная кислотная нагрузка, потеря бикарбонатов, уменьшенная секреция кислот
почками.
Вторая группа метаболического ацидоза включает состояние, при которых в
кровь поступает не НСl, а
другая кислота (например молочная кислота). При накоплении в организме кислот
иных, чем НСl, концентрация HCO3-
снижается без повышения уровня Сl-. Этот ацидоз называется ацидоз с
высоким анионным интервалом (АИ). АИ - косвенная мера анионов в сыворотке, она
соответствует разнице между концентрацией натрия и суммой концентраций хлоридов
и бикарбоната в сыворотке.
В норме АИ составляет 10 - 18 ммоль/л. При гиперхлоремическом ацидозе
накапливается НСl, и каждое
снижение концентрации HCO3- уравновешивается повышением
концентрации Сl-, поэтому АИ остается нормальным. Однако когда
накапливается иная кислота, то HCO3- замещается иным
анионом. Поэтому сумма (Сl- + HCO3-)
снижается, а АИ повышается [Малышев, 2005].
Компенсация осуществляется гипервентиляцией, которая усиливает выведение
диоксида углерода из организма и снижает pCO2. Уменьшается отношение
pCO2 и [HCO3-], что сопровождается снижением
[H+]. Гипервентиляция является прямым следствием возрастания [H+],
стимулирующим дыхательный центр. Респираторная компенсация не может привести к
полной нормализации [H+], поскольку высокая концентрация ионов
водорода сама стимулирует компенсаторную гипервентиляцию. Более того, усиленная
работа дыхательных мышц сопровождается продукцией диоксида углерода, и
возможная степень снижения pCO2, таким образом, уменьшается. Если
причина ацидоза не устраняется новое состояние, характеризующееся повышенной [H+],
сниженной концентрацией бикарбоната и низким pCO2.
Возможности компенсации ограничиваются, если начинает страдать
респираторная функция. У здоровых людей гипервентиляция вызывает респираторный
алкалоз. Как правило, механизмы компенсации любого нарушения кислотно-основного
баланса приводят к развитию вторичных нарушений, имеющих противоположную
направленность. Если у пациента с нереспираторным ацидозом почечные функции в
норме, избыток ионов водорода может выводиться почками. Полная коррекция
нереспираторного ацидоза означает устранение причины его возникновения
[Капитан, 2006].
1.2.4
Метаболический алкалоз
Это первичный избыток основания с ВЕ выше нормы, приводящий к повышению
pH крови. Он возникает в результате:
потерь Н+ и Сl
через желудочно-кишечный тракт;
потерь калия;
увеличения HCO3- из-за введения щелочных растворов,
метаболизации цитрата, гиперкомпенсации респираторного ацидоза, потерь
внеклеточной жидкости.
Выделяют два вида метаболического алкалоза:
хлорид-чувствительный алкалоз, который устраняется внутривенным вливанием
растворов, содержащих хлорид натрия и хлорид калия;
хлорид-резистентный алкалоз, не устраняемый такой инъекцией.
У больных с хлорид-чувствительным алкалозом одновременно развивается
дефицит объема внеклеточной жидкости, падение концентрации хлора.
При потерях содержимого из желудка метаболический алкалоз сопровождается
снижением общего содержания натрия почками, так и потерь с содержимым желудка.
К потерям натрия присоединяется потеря калия как следствие роста секреции
альдостерона в ответ на развивающийся дефицит объема внеклеточной жидкости.
Мочегонные препараты вызывают потерю натрия, внеклеточной жидкости,
калия, хлора, не увеличивая экскрецию бикарбоната. В результате в крови
увеличивается содержание бикарбоната, что приводит к развитию метаболического
алкалоза [Клиническая биохимия, 2004].
Хлорид-резистентный алкалоз сопровождается содержанием хлорида в моче
выше нормы, повышенным или нормальным объемом внеклеточной жидкости и
артериальной гипертензией. Необходимое условие развития метаболического
алкалоза этого типа - увеличение концентрации минералокортикоидов в крови. Это
приводит к росту реабсорбции натрия и усилению экскреции протонов водорода и
калия. Гипокалиемия стимулирует образование аммиака в эпителиоцитах канальцев,
что ведет к увеличению выведения протонов водорода в виде аммониевых катионов и
метаболическому алкалозу. Одновременно гипокалиемия снижает скорость
клубочковой фильтрации, что уменьшает эффективность бикарбоната как
компенсаторной реакции [Кишкун, 2010].
1.3 Регуляция
кислотно-основного состояния
В нормальных условиях pH крови неизменно поддерживается на уровне
7,35-7,45. Диапазон различий выглядит на первый взгляд очень незначительно,
однако необходимо помнить о том , что между pH и и концентрацией водорода [H⁺] существует логарифмическая
зависимость. Поэтому повышение pH с 7,35 до 7,45 отражает снижение [H⁺] с 45 до 35 нмоль/л, в то время как
снижение pH до 7,1 обусловлено увеличение [H⁺] до 80 нмоль/л.
Нормальные метаболические процессы приводят к образованию ионов водорода,
главным образом при окислении аминокислот. Водород - наиболее распространенный
атом во всех клетках в основном в составе воды. Ион водорода играет главную
роль в образовании кислот и оснований, его концентрация, должна, находится в
строгих пределах, иначе клетка погибнет. Это связано, главным образом, с
действием H⁺ на форму и функцию белков и активных ферментов. Основание является
акцептором ионов водорода, а кислота - донором [Рагимов, Еременко, Никифоров,
2005].
Концентрация ионов водорода в клетках и биологических жидкостях является
одним из важных факторов обеспечения гомеостаза, так как величина [H⁺] во внеклеточной жидкости
существенно влияет на многие жизненно важные свойства: активность ферментов;
физико-химическое и структурное состояние мембран; способность гемоглобина
связывать кислород; чувствительность рецепторов к биологически активным
веществам; возбудимость и проводимость нервных структур и ряд других.
Отклонение ионов водорода от оптимального диапазона обусловливает нарушения
метаболизма и функций клеток тканей и органов (вплоть до гибели) [Ноздрачев,
2001]
Весь метаболизм белков, жиров и углеводов в организме человека -
наработка протонов водорода.
Углеводы аэробный метаболизм→ вода + CO2 ;
Углеводы анаэробный метаболизм → молочная кислота;
Жиры и фосфолипиды → вода + CO2 + H2PO4ˉ;
Белки → вода + CO2 + H2PO4ˉ+HCl.
Любую кислоту можно рассматривать как находящуюся в равновесии между ее
диссоциированной (А-) и недиссоциированной формами(НА):
Н++А-↔НА.
Отношение концентрации свободного протона, свободного аниона и связанной
пары протон-анион можно выразить как константу диссоциации(К):
К=[Н+][А-]/[НА].
Используя данное уравнение для Н+, получаем:
[Н+]=К[НА]/[А-].
При использовании отрицательного логарифма для каждой стороны уравнения
получаем: -log[Н+]= -log К -log([НА]/[А-]). Отрицательный
логарифм концентрации протонов (-log[Н+]) и есть pH, а -log К можно
обозначить как рК. Изменив знаки получаем следующее уравнение:
-log[Н+]= -log К+ log([А-]/[НА])
Это и есть уравнение Гендерсона-Хассельбаха. Оно позволяет рассчитать pH
кислотно-основной системы по данным молекулярного отношения кислоты и основания
[ Назаренко, Кишкун, 2000].
Потенциал кислотообразования велик у диоксида углерода, который
образуется при окислительном метаболизме, сопряженным с выработкой энергии.
Основной источник кислоты в организме - углекислый газ, являющийся продуктом
аэробного метаболизма [Кислотно-щелочной баланс в интенсивной терапии, 2005]. Хотя сам CO2 не является кислотой, в присутствии воды он претерпевает
гидратацию с образованием слабой угольной кислоты. Неудивительно, что нарушение
выведения CO2 является важной причиной ацидоза.
Содержание H⁺ прямо пропорционально концентрации pCO2 и обратно
пропорционально концентрации HCOˉ3. Биологический смысл
компенсаторных процессов состоит в поддержании отношения на постоянном уровне.
При изменении одного из компонентов отношения происходят соответственно
изменения другого компонента. При повышении уровня pCO2 возрастает
содержание HCOˉ3, а снижение уровня pCO2
сопровождается снижением содержания HCOˉ3. Эти
изменения представляют собой компенсаторные реакции, ограничивающие диапазон
изменений pH, но не всегда предотвращающий их [Малышев, 2005].
В эволюции сформировались системные, хорошо интегрированные механизмы
регуляции КЩР и устранение сдвигов его при развитии патологии. В норме в
организме образуется почти в 20 раз больше кислых продуктов, чем основных. В
связи с этим в нем преобладают системы, обеспечивающие нейтрализацию, выведение
и секрецию избытка соединений с кислыми свойствами. К этим системам относятся
химические буферные системы и физиологические механизмы [Сумин, 2000].
Химические буферные системы представлены в основном бикарбонатным,
фосфатным, белковым и гемоглобиновым буферами. Эти буферные системы начинают
действовать сразу же при увеличении или снижении [H⁺]. Буферы крови, например, способны
устранить умеренные сдвиги КЩР в течение 10 - 40 секунд.
Физиологические механизмы. Для их реализации и достижения необходимого
эффекта требуется больше времени - от нескольких минут до нескольких часов. К
наиболее эффективным механизмам регуляции КЩР относят процессы, протекающие в
легких, почках, печени и желудочно-кишечном тракте [Пауков, Литвицкий, 2004].
1.3.1
Буферные системы
Буферы присутствуют во всех жидкостях организма и при изменении pH
действуют немедленно (в течение 1 секунды). Они соединяются с избытком кислот
или оснований и образуют вещества, которые не влияют на pH. Буферные системы
состоят из слабых кислот и сопряженного основания. Если в такую буферную
систему добить ионы водорода, они частично соединяются с коньюгированным основанием
и превратят его в недиссоциированую кислоту. Эффективность любого буфера
ограничена его концентрацией и положением равновесия. Лучше всего буфер
работает при таких концентрациях ионов водорода, которые обеспечивают примерное
равенство концентраций недиссоциированной кислоты и сопряженного основания
[Камкин, Каменский, 2004].
В организме человека присутствует несколько буферных систем как внутри,
так и вне клетки:
Бикарбонатный буфер - [CO2]/[HCO3-].
Важный буфер присутствует во многих жидкостях организма.
Фосфатная буферная система - облегчает экскрецию H+ в
канальцах почек.
Белковая буферная система - присутствует в клетках крови и плазмы.
Наиболее важный белковый буфер гемоглобин.
Аммоний - при избытке кислот аммиак выделяемый клетками почечных канальцев,
соединяется с H+ в почечных канальцах, образуя ион аммония
[Клиническая биохимия, 2004] .
Принцип действия химических буферных систем заключается в трансформации
сильных кислот и сильных оснований в слабые. Эти реакции реализуются как
внутри- так и внеклеточно. Рассмотрим поподробнее эти механизмы.
1.3.1.1
Гидрокарбонатная буферная система
Во внеклеточной жидкости самой важной буферной системой является
бикарбонатная, она самая мощная и пожалуй, наиболее управляемая. Бикарбонатная
система представляет собой сопряженную кислотно-основную пару, состоящую из
молекулы угольной кислоты, выполняющей роль донора протонов, и бикарбонат-иона,
выполняющего роль акцептора протона. На долю бикарбонатного буфера приходится
около 10% всей буферной емкости крови.
Даже при нормальных концентрациях ионов водорода во внеклеточной жидкости
концентрация угольной кислоты составляет примерно 1,2 ммоль/л, а содержание
бикарбоната в 20 раз выше. Однако емкость бикарбонатной системы в организме
значительно возрастает вследствие того, что угольная кислота может быстро
образовываться из диоксида углерода или быстро разлагаться до диоксида углерода
и воды
CO2+H2O↔H2CO3
Гидрокарбонатный буфер внеклеточной жидкости состоит из смеси угольной
кислоты и гидрокарбоната натрия. В клетках в состав соли угольной кислоты
входят калий и натрий.
Гидрокарбонатная буферная система тесно связана с метаболизмом
органического углерода, поскольку конечным продуктом его является CO2
или HCO3ˉ. Гидрокарбонатный буфер система открытого типа, она ассоциирована
с функцией внешнего дыхания и почек. Система внешнего дыхания поддерживает pCO2
крови, а почки поддерживают содержание аниона HCO3-.
Именно это обеспечивает функционирование системы HCO3-/H2CO3
в качестве эффективного и емкого буфера внеклеточной среды даже в условиях
образования большого количества нелетучих кислот [Цыганенко, Жуков,…,2002].
1.3.1.2
Фосфатная буферная система
Представляет собой сопряженную кислотно-основную пару, состоящую из иона
H2PO4- (донор протонов) и иона HPO42-
(акцептор протонов). Фосфат во внеклеточной жидкости является
второстепенным буфером, но имеет большое значение для буферных свойств мочи,
она является главной буферной системой почек. Фосфаты присутствуют в
гломерулярном фильтрате, причем примерно 80% - в виде двухвалентного аниона HPO42-.
Этот анион соединяясь с ионами водорода, превращается в H2PO4.
Фосфат, играет существенную роль в регуляции КЩС внутри клеток особенно
канальце почек. Это обусловлено более высокой концентрацией фосфатов в клетках
в сравнении с внеклеточной жидкостью. Фосфатный буфер состоит из двух
компонентов: щелочного (Na2HPO4) и кислого (NaH2PO4).эпителий
канальцев почек содержит компоненты буфера в максимальной концентрации, что
обеспечивает его высокую мощность. В крови фосфатный буфер способствует
поддержанию гидрокарбонатной буферной системы. При увеличении кислот в плазме
крови увеличивается концентрация H2CO3 и уменьшается
содержаниеNaHCO3:
H2CO3 + Na2HPO4 ↔ NaHCO3
+ NaH2PO4.
В результате избыток угольной кислоты устраняется, а уровень NaHCO3
возрастает [Биохимия…,2001].
1.3.1.3
Аммоний
Другая важная буферная система мочи основана на аммиаке, который
образуется в клетках почечных канальцев при дезаминировании глутамина. Фермент
глутаминаза, который катализирует эту реакцию, индуцируется в почках при
хроническом ацидозе, что обеспечивает увеличение продукции аммиака и,
следовательно, усиление экскреции ионов водорода в составе ионов аммония.
Аммиак легко диффундирует через клеточные мембраны, тогда как ионы аммония,
образующиеся при забуферивании ионов водорода аммиаком, к этому не способны.
Таким образом предотвращается пассивная реабсорбция ионов аммония. При
нормальных внутриклеточных концентрациях ионов водорода большая часть аммиак
существует в виде ионов аммония. Диффузия аммиака из клеток нарушает
равновесие, что вызывает образование дополнительных количеств аммиака
[Гриппи,2005].
1.3.1.4
Белковая буферная система
Буферная емкость внутренней среды организма зависит и от внутриклеточных
белков. Компонентами белкового буфера являются слабодиссоциирующий белок с
кислыми свойствами (белок-COOH) и соли сильного основания (белок-COONa). При
нарастании уровня кислот они взаимодействуют с солью белка с образованием
нейтральной соли и слабой кислоты. При увеличении концентрации оснований реакция
их происходит с белком с кислыми свойствами. В результате вместо сильного
основания образуется слабоосновная соль. При хроническом ацидозе важное
значение имеют буферные свойства белковоподобного матрикса костной ткани
[Механизмы регуляции КОС].
Гемоглобиновый буфер составляет более половины всей буферной емкости
крови. Он состоит из кислого компонента - оксигенированого Hb - HbO2
и основного неоксигенированого.
Гемоглобин играет главную роль в транспорте кислорода. Содержание
кислорода - это объем кислорода, связанного с гемоглобином и находящегося в
растворенном состоянии. Информативным в оценке транспорта кислорода является
показатель saO2. Транспорт кислорода из легких в ткани и из тканей в
легкие обусловлен изменениями, которые воздействуют на сродство гемоглобина к
кислороду. На уровне тканей из-за снижения pH это сродство уменьшается и
вследствие этого улучается отдача кислорода. В крови легочных капилляров
сродство гемоглобина к кислороду увеличивается из-за снижения pCO2 и
возрастает pH, что приводит к насыщению артериальной крови кислородом.
Но основная роль гемоглобина заключается в его участии транспорта CO2
от тканей к легким.
Высокая растворимость и способность CO2 к диффузии в воде
делает его особенно удобным средством удаления кислоты из тканей в кровь. В
капиллярах большого круга кровообращения HbO2 отдает кислород. В
эритроцитах CO2 взаимодействует с водой и образует H2CO3.
Эта кислота диссоциирует на HCO3ˉ и H⁺, который соединяется с гемоглобином.
Анионы HCO3ˉ из эритроцитов выходят в плазму крови, а в
эритроциты поступает эквивалентное количество анионов Clˉ. Остающиеся в
плазме крови ионы Na⁺ взаимодействуют с HCO3ˉ и благодаря этому
восстанавливают ее щелочной резерв. В капиллярах легких, в условиях низкого pCO2
и высокого pO2 Hb присоединяет кислород с образованием HbO2.
Карбаминовая связь разрывается, в связи с чем высвобождается CO2.
При этом HCO3ˉ из плазмы крови поступает эритроциты ( в обмен
на ионы Clˉ) и взаимодействует с H⁺, отщепившимся от Hb в момент его
оксигенации. Образующаяся H2CO3 под влиянием
карбоангидразы расщепляется на CO2 и H2O. CO2 диффундирует
в альвеолы и выводится из организма [Литвицкий, 2003].
В результате нормального метаболизма происходит постоянное образование
ионов водорода, которые связывают буферные системы крови. Однако буферные
системы имеют ограниченные возможности и при отсутствии возможности удаления
ионов водорода быстро исчерпали бы свои возможности, что привело к опасному pH
крови.
1.3.2
Физиологические механизмы
Наряду с мощными и быстро действующими химическими системами в организме
функционируют органные механизмы компенсации и устранения сдвигов КЩР. Для их
реализации и достижения необходимого эффекта требуется больше времени - от
нескольких минут до нескольких часов. К наиболее эффективным физиологическим
механизмам регуляции КЩР относят процессы, протекающие в легких, почках печени
и ЖКТ.
1.3.2.1
Легкие
Это первая линия защиты в поддержании КЩР, поскольку они обеспечивают
механизм почти немедленной регуляции выведения кислоты. Парциальное давление CO2
в плазме крови в норме составляет около 40 мм рт. ст. Поддержание постоянства
этого уровня зависит от равновесия между образованием CO2 в процессе
метаболизма и его выведением из организма через альвеолы легких.
Последовательность этих процессов можно представить в виде следующих этапов.2
диффундирует в соответствии с концентрационным градиентом из клеток во
внеклеточную жидкость и возвращается с кровью в легкие, откуда и поступаю в
выдыхаемый воздух [Гриппи, 2005].
Частота дыхания и, следовательно, скорость выделения CO2 из
организма регулируется двумя типами хеморецепторов: рецепторы, чувствительные к
CO2, находятся в продолговатом мозгу, аортальном и каротидных
тельцах; и рецепторы pH, локализованные в каротидных тельцах. Снижение pH в
жидкостях организма является специфическим рефлекторным стимулом увеличения
частоты и глубины дыхательных движений [Nishino T.,2000]. Вследствие этого легкие выделяют избыток CO2.
В результате содержание H⁺ в плазме крови и других жидкостях организма снижается.
Повышение pH в жидких средах организма снижает возбудимость инспираторных
нейронов дыхательного центра. Это приводит к уменьшению альвеолярной вентиляции
и выведению из организма CO2, то есть к гиперкапнии. В связи с этим
в жидких средах организма возрастает уровень угольной кислоты, диссоциирующей с
образованием H⁺, - показатель pH снижается [Физиология человека, Т2, 2005].
1.3.2.2 Почки
В почках функционирует механизм регенерации бикарбонатной буферной
системы за счет постоянной реабсорбции HCO3ˉ, эта способность у
почек высока. В норме моча почти не содержит бикарбонатов. Самым важным местом
реабсорбции HCO3ˉявляется проксимальный каналец, где происходит
всасывание 90% бикарбоната. Однако это осуществляется не за счет прямого
транспорта HCO3ˉ через люминальную мембрану, так как обращенная
к просвету почечных канальцев поверхность клеток непроницаема для бикарбоната,
а по средствам специального механизма. В просвете канальцев из бикарбонатов
сначала образуется CO2, а в клетках канальцев эквивалентное количество
CO2 превращается в бикарбонаты. Функционирование этого механизма
зависит от действия карбоангидразы на люминальной стороне щеточной каемки
клеток проксимального канальца. Образующаяся углекислота диссоциирует с
появлением ионов водорода и бикарбоната. Ионы водорода проходят через базальную
мембрану клеток в интерстициальную жидкость. Ионы водорода выделяются через
обращенную в просвет канальцев мембрану в обмен на ионы натрия, которые
сопровождают бикарбонат при его перемещении в интерстициальную жидкость. В
жидкости почечных канальцев ионы водорода соединяются с бикарбонатом с
образованием углекислоты, большая часть которой диссоциирует на диоксид
углерода и воду. Некоторое количество углерода диффундирует обратно в клетки
почечных канальцев, а остальная часть экскретируется в мочу.
Выделяют строгую последовательность этапов этого процесса:
бикарбонаты проникают через мембрану клубочков в ультрафильтрат, где их
концентрация, как и в плазме крови, примерно 25 ммоль/л;
бикарбонат ультрафильтрата взаимодействует с ионами водорода,
секретируемыми клетками канальцев, с образованием H2CO3;
угольная кислота превращается в воду и углекислый газ с помощью
карбоангидразы;
при повышении pCO2 в просвете канальцев CO2
диффундирует обратно в клетку проксимального канальца в соответствии с
концентрационным градиентом;
в условиях повышения концентрации внутриклеточного CO2
карбоангидраза катализирует ее взаимодействие с водой, приводящее вновь к
образованию угольной кислоты, которая диссоциирует на H+ и HCO3ˉ,
тем самым завершая этот цикл;
по мере секреции H⁺ внутриклеточная концентрация HCO3ˉ
нарастает, и бикарбонат диффундирует во внеклеточную жидкость, что
сопровождается реабсорбцией натрия в обмен на H⁺ [Шейман, 1999].
Некарбоновые кислоты секретируются вставочными α-кетками собирательных трубок коры и
наружного мозгового слоя почек. Секрецию H⁺ в просвет канальца осуществляет H⁺-АТФ-аза, тогда как в реабсорбции HCO3ˉ
через базолатеральную поверхность клеток участвует обменник Clˉ, HCO3ˉ.
Главным фактором от которого зависит количество выделяемых кислот,
является присутствие буферных систем в моче. Максимальный pH жидкости в
просвете собирательной трубки - 4,0, поэтому только 0,1-0,2% суточной нагрузки
кислот могут быть выведены в форме незабуференных ионов H⁺. Остальная часть H⁺ в моче должна быть выведена в форме
буферов.
алкалоз кислотный щелочный реанимационный
1.4 Основные
электролиты организма
Основными катионами внутриклеточного водного пространства являются калий
и магний, внеклеточного - натрий, а основными анионами - соответственно фосфаты
и белки, вне клеток - хлор и бикарбонат.
Основная роль натрия - обеспечение осмотического давления во
внеклеточном пространстве, поддержание имеющейся в организме массы воды и
перемещение ее между секторами. Натрий способствует секреции антидиуретического
гормона (АДГ), определяет тонус артериол, потенцирует действие адреналина. В
сыворотке крови его концентрация в норме у взрослого человека составляет
135-145 ммоль/л, у ребенка 137-147 ммоль/л. Около 20 % Nа+
сконцентрировано в костях и непосредственного участия в метаболизме не
принимает. Самая большая часть натрия почти полностью находится в жидкости
внеклеточного пространства. Nа
является основным катионом внеклеточной жидкости. Физиологическое значение
натрия заключается в поддержании осмотического давления и рН во внутри-
внеклеточных пространствах.
Натрий экскретируется почками (с мочой), желудочно-кишечным трактом (с
калом), кожей (с потом). Почечный механизм самый важный фактор в поддержании
концентрации натрия в плазме. Многие причины гипонатриемии и гипернатриемии
связаны с нарушением функции почек. Значительное уменьшение или увеличение
содержания натрия в сыворотке крови наступает вследствие непропорциональных
потерь воды и солей.
Гипонатриемия - состояние, при котором концентрация натрия в плазме крови
ниже 137 ммоль/л.
Гипернатриемия - состояние, при котором концентрация натрия в плазме
крови выше 147 ммоль/л.
Калий является основным регулятором осмотического давления внутри
клеток. В организме 98 % его количества содержится в клетках. Вместе с ионами
натрия он играет главную роль в создании мембранного потенциала клетки (калий
обеспечивает потенциал покоя, натрий - потенциал действия). Калий участвует в
деятельности различных ферментов, в синтезе белка. В сыворотке крови его
концентрация равна 3,5- 5,0 ммоль/л - у взрослого, 3,7 - 5,1 ммоль/л у детей.
Концентрация калия в сыворотке - показатель его общего содержания в организме,
однако на его распределение между клетками и внеклеточной жидкостью могут
влиять различные факторы в том числе и кислотно-основной баланс. К гипокалиемии
относят концентрацию калия ниже 3,7 ммоль/л, а к гиперкалиемии - выше 5,1
ммоль/л.
Кальций - ключевое звено в механизме связи возбуждения и
сокращения (связь нерва и мышцы). Он стимулирует выделение норадреналина и
ацетилхолина в синапсах вегетативных центров, в ганглиях, нервно-мышечных
синапсах, оказывает инотропное действие на деятельность сердечной мышцы,
является одним из факторов свертывания крови (IV), составной частью костной
ткани (фосфат кальция), активирует или ин-габирует ряд ферментов. Часть
циркулирующего в крови кальция связана с белком. Ионизированный, свободный
кальций плазмы является обменным пулом этого вещества в организме. Количество
ионизированного кальция в плазме крови взрослого человека составляет - 1,15-1,3
ммоль/л, а ребенка - 1,05-1,3. Кальций обладает способностью накапливаться в
местах, где имеются повреждения тканей различными патологическими процессами.
Примерно 99% кальция находится в костях, остальное количество - главным образом
во внеклеточной жидкости. Около половины кальция сыворотки циркулирует в
ионизированном форме, другая половина - в комплексе преимущественно с
альбумином.
Метаболизм кальция регулируется паратириоидным гормоном, кальцитонином и
производными витамина D.
Хлор - самый распространенный анион в организме. Его биологическая
роль состоит в нейтрализации положительно заряженных катионов и создании
осмотического давления в биологических жидкостях [Долгов, Морозов…, 1995]. Хлор
играет важную роль в поддержании кислотно-основного состояния, осмотического
равновесия, баланса воды в организме, активирует амилазу, участвует в
образовании хлористоводородной кислоты желудочного сока. Хлор - основной анион,
компенсирующий влияние катионов, в первую очередь натрия, во внеклеточной
жидкости. В физиологических условиях изменения концентрации хлора вторичны по
отношению к изменениям других электролитов и направлены в первую очередь на
создание электронейтральности среды. Хлор из организма в основном выводиться с
мочой, а также потом и калом. Обмен хлора регулируется гормонами корково
вещества надпочечников и щитовидной железы.
Гидрокарбонат (H2CO3) участвует в регуляции
КОС, являясь составной частью бикарбонатного буфера. Это основной
внутриклеточный анион, влияющий на КОС. В клетках гидрокарбонат образуется
преимущественно в ходе процессов декарбоксилирования в цикле Кребса [Perlman J.M. 2001]. Помимо
буферных функций гидрокарбонат участвует в более чем в 10 реакциях обмена с
превращением углерода СО2 в углерод органических соединений в
реакциях карбоксилирования. В обменных процессах гидрокарбонат выступает в роли
регулятора активности многих ферментов и биосинтетических реакций. В клетках
синтез гидрокарбоната детерминирует транспорт ионов натрия и хлора, что
способствует созданию трансмембранного электрического потенциала.
.5 Связь между водно-электролитным балансом и кислотно-щелочным
состоянием
Водно-электролитные и кислотно-основные состояния нельзя рассматривать
изолировано, так как они тесно связаны друг с другом [Синдром нарушения
кислотно-щелочного состояния и водно-электролитного баланса]. Объединяют их два
общих физико-химических закона и третий - физиологический, преимущественно
относящийся к кислотно-щелочному состоянию:
) закон электронейтральности;
) закон изоосмолярности;
) стремление организма к постоянству рН.
Закон электронейтральности гласит, что сумма отрицательных зарядов
анионов должна быть равна сумме положительных зарядов катионов.
По закону изоосмолярности, во всех жидкостных системах организма, между
которыми существует свободный обмен водой, устанавливается одно и то же
осмотическое давление.
Иногда законы электронейтральности и изоосмолярности взаимодействуют друг
с другом. Так бывает, если между двумя пространствами находится полупроницаемая
мембрана, через которую свободно проходит вода, но которая является более или
менее заметным препятствием для проникновения различных ионов. В этом случае
между двумя пространствами возникает разность потенциалов, которая, например,
для межклеточной жидкости и внутреннего содержимого мышечного волокна равна 80
мВ.
На полупроницаемых мембранах возникает и доннановский аффект. Проявляется
он, в частности, различиями между составом электролитов плазмы и внеклеточной
жидкости. Белки плазмы не проходят через мембраны, благодаря чему концентрация
анионов С1- и НСОз- в 1,05 раза выше в плазме; для катионов Na+, К+ характерны
обратные отношения [Скальный,2004].
Третий закон, управляющий кислотно-щелочным состоянием и электролитным
балансом, носит физиологический характер и выражает стремление организма
постоянно поддерживать рН на нормальном уровне.
1.6
Преаналитический этап
Для того чтобы показатели кислотно-основного состояния были определены
правильно, в технике забора материала необходимо правильно произвести
преаналитический этап.
Анализ желательно проводить при относительно стабильном состоянии
больного, всегда надо помнить, что результаты анализа отражают состояние
больного только в момент забора пробы. Это важно поскольку многие из измеряемы
параметров могут существенно изменится в течение нескольких секунд. Средства
забора образцов крови должны содержать достаточное количество гепарина для
предупреждения свертывания. Неадекватная гепаринизация приводит к образованию
сгустков, что может привести к искажению результатов. Во избежание ошибок при
определении электролитов следует пользоваться гепарином, сбалансированным по
электролитам. Гепарин, не сбалансированный по электролитам, будет служить
помехой, поскольку он связывает катионы, такие как кальций и калий. Если в
шприце оказались пузырьки воздуха, то шприц следует установить вертикально,
прикрыть кусочком марли и удалить пузырьки нажатием на поршень. После удаления
воздуха шприц закрыт колпачком, а содержимое тщательно перемешать до полного
растворения гепарина. Анализ пробы нужно провести как можно быстрее, чтобы по
возможности минимизировать последствия продолжающегося метаболизма, диффузии
кислорода через пластик контейнера, а также утечка калия из эритроцитов в
плазму. Если немедленный анализ пробы невозможен, его необходимо сделать в
течение 30 минут [Анализ газов артериальной крови…,2006].
1.7
Интерпретация показателей анализа газов крови
(7,35 -7,45) менее 7,35 - ацидоз, более 7,45 - алкалоз.
Из-за логарифмического характера шкалы небольшие изменения pH отражают
значительные изменения в концентрации ионов H+.
Близкое к норме значение рН могут быть следствием респираторной или
метаболической компенсации. Эта компенсация никогда не бывает полной, поэтому
если значение рН близко к норме, это свидетельствует о наличии
компенсированного ацидоза (уровень рН немного снижен) или компенсированного
алкалоза (уровень рН немного повышен) [Современная неотложная помощь при
критических состояниях у детей, 2009].2 (более 80 мм рт. ст. в
артериальной крови при дыхании атмосферным воздухом).2 не отражает
содержание кислорода в крови, но от него зависит степень сатурации гемоглобина
кислородом.2 (35 - 45 мм рт. ст.) оно прямо пропорционально
содержании CO2 в крови.3- (22-28 ммоль/л)
высокий уровень бикарбоната указывает на метаболический алкалоз, а низкий на
метаболический ацидоз.
ВЕ (-2 до +2ммоль/л) положительная величина означает что имеется избыток
оснований, отрицательная - недостаток.
Натрий (135 - 145 ммоль/л) концентрация в плазме.
Калий (3,5 - 5,5 ммоль/л) концентрация в плазме.
Хлор (95 - 105 ммоль/л) концентрация в плаз [Газы крови руководство…,
2006].
2. Материал и методы исследования
2.1
Контингент
Работа проводилась на базе детской краевой клинической больницы города
Краснодара. Обследовались пациенты реанимационного отделения ДККБ в возрасте от
4 месяцев до 17 лет. Всего было обследовано 150 детей.
В результате работы все больные были разделены на пять групп: в первую
группу вошло 30 детей с заболеванием легких, во вторую 30 детей с сахарным
диабетом, третью 30 детей с заболеванием почек, четвертая 30 детей с
черепно-мозговыми травмами, пятая контрольная группа относительно здоровых
детей 30 человек. Группы были разделены по возрастам на 3 подгруппы: медиальный
возраст первой подгруппы (а) - 7±3 мес: X±m; медиальный возраст второй
подгруппы (б) - 5±3 лет: X±m; медиальный возраст третьей подгруппы (в) - 13±3
лет: X±m.
2.2 Материал
исследования
Материалом исследования служила венозная кровь, набранная в шприц
обработанный гепарином, забор проводился с соблюдением преаналитического этапа
исследования. Анализ крови производился в дневное время в 12 часов.
Если определение газового состава крови требуется больным, получающим
оксигенотерапию или находящимся в условиях искусственной вентиляции легких,
необходимо подождать 30 минут, чтобы эффекты этих процедур могли
стабилизироваться, так как эти процедуры оказывают влияние на результаты
анализа. За исключением этого, время взятия крови не играет существенной роли.
Забор производился в удобное время, чтобы избежать промедлений в выполнении
анализа. Пациент должен быть отдохнувшим, забор венозной крови производился по
причине меньшей болезненности и простоты забора крови. Как правило венозная
кровь содержит повышенное количество СО2, выделяемого тканями при
метаболизме и уменьшенное количество О2, отражающее утилизацию
кислорода. Диагностическая ценность пробы венозной крови заключается в оценке
системного метаболизма. Уменьшение рО2 свидетельствует об увеличении
экстракции кислорода тканями, увеличение - о шунтировании артериальной крови
мимо периферических сосудов либо нарушении утилизации кислорода.
Соблюдались следующие правила, такие как: использование жгута для взятия
пробы венозной крови, запрещено. В этом случае, вследствие расстройств
локального кровообращения, результат пробы будет неинформативный.
Кровь собиралась шприцем, который содержал гепарин, предотвращающий
свертывание образца. Но жидкий гепарин является слабой кислотой, поэтому
чрезмерное количество гепарина в шприце приводит к ацидозу вследствие
разведения бикарбоната. Разведение крови также приводит к занижению значений
некоторых электролитов. Также гепарин является натриевой солью и может
искусственно завышать истинную концентрацию натрия в крови. Кальций и калий
связываются с негативно заряженным гепарином, что приводит к ложному занижению
их количества. И поэтому для точного определения натрия кальция и калия в пробе
крови использовался сбалансированный электролитный гепарин. Кровь необходимо
хорошо перемешать с гепарином, если кровь плохо перемешана, могут
образовываться небольшие тромбы, мешающие проведению анализа. От быстрого
выполнения анализа зависит его точность. При длительном простое пробы
наблюдается рост рСО2, что приводит к снижению рН, а также падению
рО2. Напряжение кислорода в крови падает вследствие активного
поглощения клетками крови, преимущественно лейкоцитами, тромбоцитами и
ретикулоцитами.
Следует отметить несколько моментов, важных для получения воспроизводимых
результатов рН-метрии.
. Если анализ не собираются делать в ближайшие 15 мин, нужно немедленно
охладить кровь, которая в таком виде может храниться в течение 4 ч.
. Непосредственно перед измерением необходимо хорошо перемешать кровь.
. В промежутках между измерениями рН-электрод должен быть заполнен
очищающим и стабилизирующим раствором, как рекомендуют изготовители.
. Если электрод калибрует по буферу, нужно: а) заполнить электрод
буфером; б) продуть его; в) заполнить буфером повторно и тогда уже измерить рН.
. Один раз в неделю электрод следует промывать раствором пепсина и
соляной кислоты
2.3 Методы
исследования
Анализы производились на анализаторе газов крови, оксиметрии,
электролитов и метаболитов ABL
800 FLEX.
ABL
800 FLEX создан для работы с неразведенной
цельной кровью человека и газом выдоха.
Использовался электродный метод определения кислотно-щелочного состава
крови и электролитного баланса автоматическим газовым анализатором модель ABL
800 FLEX компании радиометр медикал, данная модель заменяла собой несколько
анализаторов:
) газоанализатор, измеряя рН, рО2, рСО2
) электролитный анализатор, измеряя К, Na, Ca, Cl.
Данный анализатор являлся экономически выгодным, так как снабжен
долгоживущими электродами, и каждая баночка с реактивом вычерпывается "до
донышка", что создает экономичность по расходным материалам даже при очень
больших нагрузках на анализатор.
Прибор идеально подходил для педиатрических проб. Объем пробы 95 мкл
(микропроба) - 195 мкл. Анализатор позволял измерять максимально возможное
количество параметров при вводимом объеме пробы. А также отсутствие ошибок при
пробах малого объема, что делает данный прибор бесценным для детских реанимаций
Метод определения параметров кислотно-щелочного состояния предусматривает
прямое измерение показателей при помощи электрода, сконструированного
Severing-haus и Bradley. Анализатор данной фирмы снабжен электродами следующих
показателей pH, pCO2, pO2, Na+, K+,
Cl-. Это позволило экономить рабочее время, особенно в тех случаях,
когда необходимо производить много анализов, так как проводятся одновременно
все измерения и калибровки.
Ионоселективные электроды это электрохимические электроды, равновесный
потенциал которых в растворе электролита, содержащем определенные ионы,
обратимо и избирательно зависит от концентрации этих ионов. На этом основании
эти электроды использовались для определения концентрации (активности)
различных ионов в крови.
В данном анализаторе использовались стеклянные электроды, они являются в
настоящее время лучшими рН- электродами, поскольку практически не чувствительны
к окислительно-восстановительным системам, высоко селективны в широком
диапазоне рН. Электрод позволяет проводить измерения кислотности среды с
точностью до ±0,03 ед. рН, причем возможна химическая стерилизация электрода,
что дает возможность использования его для измерения кислотности биологических
объектов. Срок работы электрода измеряется годами.
Электрод для определения pCO2 окружен тонким слоем раствора
гидрокарбоната натрия, который отделен от крови проницаемой для СО2
мембраной. Благодаря СО2 через эту мембрану раствор гидрокарбоната
приводился в равновесие с калибрационным газом или кровью. У стеклянных
электродов мембраны изготавливаются из стекол различного состава. Они
представляют собой трубочку специального сорта стекла с выдутым на ее конце
шариком с тонкой стенкой. Внутрь электрода заливают раствор электролита с
измененной величиной активности ионов и помещают электрод сравнения -
хлорсеребряный электрод.
Электрод для определения рО2 устроен аналогично электроду рCO2.
Анализатор рН крови в лабораторных условиях вычислил методом
потенциометрии, используя уравнение Нернста. Для каждого иона, находящегося по
обе стороны полупроницаемой мембраны, включая и ион водорода, существует
равновесный потенциал, при котором электрический и концентрационный градиенты
уравновешиваются и суммарный поток ионов через мембрану становится равен нулю
Еion=61log[A]e/[A]i
Где Ае - концентрация ионов вне клетки, Аi - концентрация ионов внутри клетки.
Для определения рН крови использовался электрод, заполненный жидкостью с
известным химическим составом, мембрана которого проницаема только для Н+.
диффузия ионов водорода из крови в жидкость электрода создает определенный
электрический потенциал между двумя сторонами мембраны, который можно измерить.
Величина этого потенциала пропорциональна логарифму отношения концентрации
ионов водорода по обе стороны мембраны, согласно уравнению Нернста:
Еm=61log[H+]e/[H+]b
Гдe [H+]e
и [H+]b
- значения ионов водорода внутри электрода и в крови соответственно.
Так как количество ионов водорода в электроде заведомо известно получим:
Em~log1/[H+]b
Согласно математическим законам, уравнение можно преобразовать:
Em~-log[H+]b
А так как рН=-log[H+]b,
то
Em~рН
Генерируемый потенциал на рН - электроде составляет 61,5 мВ/ЕД рН. Таким
образом при рН=7 и температуре 250С концентрация ионов Н+
и ОН- будут составлять по 50%.
Несмотря на то, что концентрация ионов водорода очень мала, рН играет
важную роль в регуляции постоянства внутренней среды.
2.4
Статистическая обработка результатов
Статистическая обработка полученных данных проводилась с помощью
программы Microsoft Excel для Windows.
Определялись: среднее арифметическое (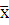 ), ошибка среднего арифметического (±m), показатель достоверности (р). Различия считались
достоверными при 0,05 уровне значимости (р
), ошибка среднего арифметического (±m), показатель достоверности (р). Различия считались
достоверными при 0,05 уровне значимости (р 0,05).
0,05).
3. Кислотно-щелочной баланс у
реанимационных больных различного профиля
.1 Показатели
кислотно-щелочного и электролитного балансов у больных с патологией легких
У пациентов первой группы во всех трех подгруппах было отмечено снижение
показателей pH, что говорит об ацидозе в данной
группе. Данные значения pH и концентрация ионов крови (K+, Na+,
Ca2+, Cl-) пациентов представлены в таблице 1.
Достоверность различий (P) определяли при сравнении подгрупп с контрольной
группой. Для понимания типа ацидоза изучали
показатели рСО2 и НСО3-. В данном случае
наблюдалось повышенное значение рСО2 и нормальное значение НСО3-,
это свидетельствует о респираторном ацидозе. Респираторный ацидоз обусловлен
накоплением СО2, ведущим к повышению уровня Н2СО3.
Повышение рСО2 происходило при снижении легочной вентиляции. У первой подгруппы, детей раннего возраста наблюдалось более
низкое значение рН т.е. склонность к ацидозу. Это связанно с высокой
интенсивностью у них биоэнергетических процессов, ограниченными функциональными
возможностями почек и других органов и систем, участвующих в регуляции
кислотно-щелочного равновесия [Петрова Н. А. 2012]. Снижение рH
крови вследствие повышенного рСО2 приводило к увеличению напряжения
СO2 в клетках канальцевого эпителия. В результате этого
увеличивалась продукция угольной кислоты и образование при ее диссоциации НСО3-
и Н+. Ионы водорода секретировался в
канальцевую жидкость, а бикарбонат поступал в плазму крови. Функциональная активность почек по стабилизации рH способна
восполнить дефицит бикарбоната и удалить избыток ионов водорода, однако для
этого требуется значительное время.
Таблица 1 - Показатели кислотно-щелочного и электролитного балансов у
детей с заболеванием легких.
|
Показатели
|
Референтные значения
|
Подгруппа (а)
|
Подгруппа (б)
|
Подгруппа (в)
|
|
|
Испытуемая группа
|
Контрольная группа
|
Испытуемая группа
|
Контрольная группа
|
Испытуемая группа
|
Контрольная группа
|
|
pH
|
7,32-7,43
|
7,29±0,5 Р<0,01
|
7,37±0,01
|
7,31±0,02 Р<0,01
|
7,4±0,02
|
7,31±0,01 Р<0,01
|
7,39±0,02
|
|
pCO2
мм.рт.ст.
|
41-55
|
53,0±0,3 Р<0,05
|
41,3±3,1
|
52,1±0,04 Р<0,05
|
42,2±0,71
|
55,7±0,2 Р<0,05
|
44,5±0,2
|
|
pO2
мм.рт.ст.
|
37-49
|
42,5±1,2 Р<0,05
|
47,2±3,1
|
44,3±1,3 Р<0,05
|
48,7±1,3
|
50,9±0,2 Р<0,05
|
48,5±0,2
|
|
K+ ммоль/л
|
3,4-5,1
|
3,5±0,2 Р<0,01
|
3,7±0,2
|
3,4±0,1 Р<0,01
|
4,0±0,3
|
3,4±0,2 Р<0,01
|
4,2±0,2
|
|
Na+ ммоль/л
|
137-147
|
135±0,3 Р<0,01
|
137±0,2
|
134±0,3 Р<0,05
|
138±0,1
|
135±0,4 Р<0,01
|
138±0,1
|
|
Ca2+ ммоль/л
|
1,05-1,3
|
0,84±0,03 Р<0,05
|
1,01±0,2
|
0,83±0,01 Р<0,05
|
1,1±0,03
|
0,84±0,2 Р<0,05
|
1,12±0,04
|
|
Cl- ммоль/л
|
96-107
|
103±0,3 Р<0,01
|
103±0,4
|
100±0,2 Р<0,01
|
105±0,5
|
99±0,3 Р<0,01
|
106±0,3
|
|
HCO3 ммоль/л
|
23-28
|
25,3±0,5 Р<0,01
|
23,9±0,4
|
25,5±0,3 Р<0,01
|
23,6±0,5
|
28,1±0,2 Р<0,01
|
24,7±0,5
|
У старшей подгруппы (в) в возрасте 13±3 лет показатели НСО3-
выше, чем у первых (а) и (б) подгрупп, следовательно почечная компенсация у них
более развита.
Показатели электролитов у данной группы незначительно изменены.
Наблюдалось только снижение показателей кальция. Это связано с конкурентным
отношением между ионами кальция и ионами водорода за участки связывания в
тропомиозиновом комплексе.
Итак в данной группе с патологией легких изменения
вентиляционно-перфузионных соотношений привели к такому нарушению
кислотно-щелочного баланса как респираторный ацидоз. Равновесные системы организма
практически не затронулись, о чем мы можем судить по сохранению равновесия в
электролитном балансе.
У пациентов контрольной группы показатели pH и электролитов крови при
обследовании не выходили за пределы референтных значений. У детей первого года
жизни показатели рН ниже двух других подгрупп, это является физиологической
нормой для данного возраста.
3.2
Показатели кислотно-щелочного и электролитного балансов у больных с сахарным
диабетом
При сахарном диабете имелось снижение pH крови у всех групп больных. Снижение pH показало, что у детей с данным
заболеванием наблюдался ацидоз т. к. показатели HCO3 у всех групп снижены то это - метаболический ацидоз,
а снижение pCO2 соответствует дыхательной компенсации данного
ацидоза. Данные значения pH и концентрация ионов крови (K+, Na+,
Ca2+, Cl-) пациентов представлены в таблице 2.
Достоверность различий (P) определяли при сравнении подгрупп с контрольной
группой.
В нормальных условиях инсулин являлся мощным ингибитором
кетонообразования, снижая как активность липолиза, так и активность
ацилкарнитинтрансферазы (АКТФ) - фермента, который облегчает поступление
свободных жирных кислот в митохондрии гепатоцитов, что в итоге через комплекс
ферментативных реакций обеспечивает наработку кетоновых тел [Клеточно-метаболический
ацидоз, 2012].
Метаболический ацидоз при данном заболевании развивался из-за
относительного или абсолютного дефицита инсулина нарушалась утилизация глюкозы
сыворотки крови клетками организма, что привело к их голоданию, несмотря на
избыток глюкозы в плазме [Corey E. Howard, 2005]. Недостаток энергетического
субстрата в клетках организма привел к усилению глюконеогенеза и гликогенолиза
в печени, а также стимуляции выброса катаболических (стрессорных) гормонов. Под
их действием содержание глюкозы в крови увеличивается еще больше. Для
удовлетворения энергетических потребностей клеток в организме усилился расход
запасов жира и белка. Скорость распада превышало возможности организма
полностью использовать эти альтернативные источники энергии, и в крови
накапились кетоновые тела.
Для понимания к какой группе метаболического ацидоза относится данный
ацидоз рассчитали анионный интервал (АИ) для всех трех подгрупп. Первая
подгруппа АИ=18,4; вторая подгруппа АИ=19,4; третья подгруппа АИ=18,9.
Показатели АИ выше нормы (10-18), а отсюда следует, что у данных больных не
гиперхлоремический ацидоз и накапливаются иные кислоты такие как кетокислоты.
При накоплении в организме большого количества недоокисленных продуктов
обмена и органических кислот включились компенсаторные механизмы. Сильная
кислота при реакции с бикарбонатом перешла в слабую угольную кислоту. Угольная
кислота возбудила дыхательный центр, а продукты ее диссоциации удалились через
легкие (рСО2) и почки (Н2О).
Таблица 2 - Показатели кислотно-щелочного и электролитного балансов у
детей с заболеванием сахарный диабет.
|
Показатели
|
Референтные значения
|
Подгруппа (а)
|
Подгруппа(б)
|
Подгруппа (в)
|
|
|
Испытуемая группа
|
Контрольная группа
|
Испытуемая группа
|
Контрольная группа
|
Испытуемая группа
|
Контрольная группа
|
7,32-7,43
|
7,26±0,3 Р<0,01
|
7,37±0,01
|
7,28±0,02 Р<0,01
|
7,4±0,02
|
7,3±0,01 Р<0,01
|
7,39±0,02
|
|
pCO2
мм.рт.ст.
|
41-55
|
30,3±0,5 Р<0,05
|
41,3±3,1
|
32±0,4 Р<0,05
|
42,2±0,71
|
32,3±0,5 Р<0,05
|
44,5±0,2
|
|
pO2
мм.рт.ст.
|
37-49
|
46,3±0,3 Р<0,05
|
47,2±3,1
|
45,3±0,2 Р<0,05
|
48,7±1,3
|
45,7±0,3 Р<0,05
|
48,5±0,2
|
|
K+ ммоль/л
|
3,4-5,1
|
3,2±0,3 Р<0,05
|
3,7±0,2
|
3,3±0,4 Р<0,01
|
4,0±0,3
|
3,2±0,2 Р<0,01
|
4,2±0,2
|
|
Na+ ммоль/л
|
137-147
|
131±1,3 Р<0,01
|
137±0,2
|
135±0,3 Р<0,01
|
138±0,1
|
134±0,01 Р<0,01
|
138±0,1
|
|
Ca2+ ммоль/л
|
1,05-1,3
|
1,03±0,2 Р<0,05
|
1,01±0,2
|
0,97±0,1 Р<0,05
|
1,1±0,03
|
0,98±0,2 Р<0,05
|
1,12±0,04
|
|
Cl- ммоль/л
|
96-107
|
101±0,2 Р<0,01
|
103±0,4
|
100±0,2 Р<0,01
|
105±0,5
|
100±0,3 Р<0,01
|
106±0,3
|
|
HCO3 ммоль/л
|
23-28
|
17,8±0,3 Р<0,01
|
23,9±0,4
|
18,9±0,2 Р<0,01
|
23,6±0,5
|
18,3±0,4 Р<0,01
|
24,7±0,5
|
Израсходованный бикарбонат восполнился путем соответствующих реакций в
эритроцитах и почках. Почки усиленно выводят Н+ [Ацидоз и алкалоз у
детей, 2012].
Показатели калия у всех трех подгрупп снижены примерно одинаково. Это
связано с лекарственной терапией сахарного диабета и перераспределением калия
внутрь клетки. Основными причинами усиленного перехода калия из внеклеточного
пространства внутрь клетки является лечение инсулином. Инсулин вводили для
лучшего проникновения глюкозы в клетку. Избыточное введение инсулина приводит к
задержке воды в тканях, потери калия.
Значения натрия и кальция у всех подгрупп не значительно отличаются от
референтных значений. Показатели хлора при данном заболевании у всех трех
подгрупп нормальные, это связано с тем, что в организме накапились производные
кетоновой кислоты, а не HCl.
Таким образом, у группы детей больных сахарным диабетом имеет место
метаболический ацидоз. В связи с инсулиновой недостаточностью происходил сбой в
равновесии электролитного баланса. Это связано с перераспределением ионов в
тканях, из-за коррекции диабета инсулином.
3.3
Показатели кислотно-щелочного и электролитного балансов у больных с патологией
почек
У детей с заболеванием почек наблюдалось снижение pH и HCO3-. Такие нарушения характерны для метаболического ацидоза.
Снижение рН жидких сред стимулировало легочную вентиляцию и приводило к
уменьшению парциального давления двуокиси углерода [Метаболический ацидоз,
2012]. Данные значения pH и концентрация ионов крови (K+, Na+,
Ca2+, Cl-) пациентов представлены в таблице 3.
Достоверность различий (P) определяли при сравнения подгрупп с контрольной
группой.
Таблица 3 - Показатели кислотно-щелочного и электролитного балансов у
детей с заболеванием почек.
|
Показатели
|
Референтные значения
|
Подгруппа (а)
|
Подгруппа (б)
|
Подгруппа (в)
|
|
|
Испытуемая группа
|
Контрольная группа
|
Испытуемая группа
|
Контрольная группа
|
Испытуемая группа
|
Контрольная группа
|
|
pH
|
7,32-7,43
|
7,29±0,3 Р<0,01
|
7,37±0,01
|
7,3±0,03 Р<0,01
|
7,4±0,02
|
7,32±0,1 Р<0,01
|
7,39±0,02
|
|
pCO2
мм.рт.ст.
|
41-55
|
43,6±0,4 Р<0,01
|
41,3±3,1
|
39,0±0,1 Р<0,05
|
42,2±0,71
|
39,1±0,1 Р<0,05
|
44,5±0,2
|
|
pO2
мм.рт.ст.
|
37-49
|
50,8±0,3 Р<0,05
|
47,2±3,1
|
48,3±0,03 Р<0,05
|
48,7±1,3
|
45,4±0,05 Р<0,05
|
48,5±0,2
|
|
K+ ммоль/л
|
3,4-5,1
|
3,7±0,5 Р<0,01
|
3,7±0,2
|
3,6±0,1 Р<0,01
|
4,0±0,3
|
3,5±0,03 Р<0,01
|
4,2±0,2
|
|
Na+ ммоль/л
|
137-147
|
134±0,2 Р<0,01
|
137±0,2
|
132±0,1 Р<0,01
|
138±0,1
|
132±0,2 Р<0,01
|
138±0,1
|
|
Ca2+ ммоль/л
|
1,05-1,3
|
0,98±0,03 Р<0,05
|
1,01±0,2
|
0,87±0,03 Р<0,05
|
1,1±0,03
|
0,83±0,01 Р<0,05
|
1,12±0,04
|
|
Cl- ммоль/л
|
96-107
|
112±0,4 Р<0,01
|
103±0,4
|
108±0,3 Р<0,01
|
105±0,5
|
109±0,2 Р<0,01
|
106±0,3
|
|
HCO3 ммоль/л
|
23-28
|
19,6±0,05 Р<0,01
|
23,9±0,4
|
19,7±0,03 Р<0,01
|
23,6±0,5
|
19,9±0,5 Р<0,01
|
24,7±0,5
|
.Нарушение
работы почек способствовало потери их обеспечению биохимического гомеостаза,
при этом в организме задерживались продукты метаболизма, в норме удаляемые с
мочой. При заболеваниях почек ацидоз являлся результатом уменьшения выведения
из организма нелетучих кислот, приводящих к затруднению удаления кислых
фосфатов, органических кислот [Болезни обмена веществ Ацидоз, 2012].
При хронической почечной недостаточности главным образом снижалась
способность почек экскретировать аммиак, несмотря на то, что у некоторых
больных с мочой экскретировался и гидрокарбонат, поэтому мы видели снижение
показателей крови НСО3-. Значение НСО3-
первой подгруппы ниже значений второй и третьей подгрупп это связано с
недостаточным развитием функции почек, что характерно для детей этого возраста.
Механизмы стабилизации концентрации ацидоза состоят в том, что: 1)
развитый ацидоз стимулирует экскрецию кислоты, которая в какой-то мере
происходит даже в больной почке; 2) карбонат и фосфат костной ткани оказывают
буферное противодействие метаболическим кислотам, образованным в организме в
течение дня [Афанасьева, 2005].
Показатели натрия снижены более выражено у второй и третьей подгрупп.
Данная гипонатриемия связана с увеличением количества реабсорбируемого натрия.
Значения калия у больных с данной патологией находились в пределах нормы. Хоть
почки и являлись основным регулятором концентрации калия в плазме крови, в клубочках
почек калий свободно фильтровался. Но секреция калия почкой страдает
незначительно вследствие сохраняющейся активности механизма ацидогенеза
(образование в почечных канальцах кислого однозамещенного фосфата натрия (NaH2PO4)
из двузамещенного (Na2HPO4); один из механизмов почечной
регуляции кислотно-щелочного равновесия) [Нарушения кислотно-основного
состояния…, 2012]. А значения хлора повышены у всех трех подгрупп. Для
интерпретации одной из групп ацидоза высчитаем АИ. Первая подгруппа АИ=8,1;
вторая подгруппа АИ=7,9; третья подгруппа АИ=5,6. В данном случае наблюдалось
развитие гиперхлоремического ацидоза с нормокалиемией [Медицинская лабораторная
диагностика, программы и алгоритмы, 2001].
У данных больных наблюдался метаболический ацидоз. При заболеваниях с
патологией почек ацидоз развивался из-за недостаточной компенсации
кислотно-щелочного состояния почками. Нарушение выведения из организма веществ
привело к изменению электролитного баланса организма.
.4 Показатели
кислотно-щелочного и электролитного балансов у больных с черепно-мозговой
травмой
При черепно-мозговых травмах наблюдалось повышение pH, и снижение рСО2, что
соответствовало дыхательному алкалозу. Индикатором алкалоза являлись низкие
показатели pCO2. Данные значения pH и концентрация ионов крови (K+,
Na+, Ca2+, Cl-) пациентов представлены в
таблице 4. Достоверность различий (P) определили при сравнения подгрупп с
контрольной группой. Черепно-мозговые травмы всегда сопровождались нарушения
функции внешнего дыхания вследствие обтурации верхних дыхательных путей слизью,
кровью, желудочным содержимым, западения корня языка и нижней челюсти, что
являлося причинами усугубления первичной гипоксии мозга.
При данной патологии алкалоз объяснялся тем, что в результате угнетения
возбудимости дыхательного центра локализованном на вентральной поверхности
продолговатого мозга, нарушалось внешнее дыхание и pCO2 становился
ниже порога - 41 мм рт ст. Уменьшение рСО2 происходило в результате
гипервентиляции легких, которая приводила к повышенному выведению из организма
углекислоты и защелачиванию крови [Болезни нервной системы 2001].
Снижение рСО2 в плазме крови сочеталось с возрастанием
поступления жидкой части крови в интерстициальное пространство, откуда калий и
в меньшей степени натрий проникали в клетки.
Таблица 4 - Показатели кислотно-щелочного и электролитного балансов у
детей с черепно-мозговыми травмами.
|
Показатели
|
Референтные значения
|
Подгруппа (а)
|
Подгруппа (б)
|
Подгруппа (в)
|
|
|
Испытуемая группа
|
Контрольная группа
|
Испытуемая группа
|
Контрольная группа
|
Испытуемая группа
|
Контрольная группа
|
|
pH
|
7,32-7,43
|
7,42±0,3 Р<0,01
|
7,37±0,01
|
7,42±0,01 Р<0,01
|
7,4±0,02
|
7,44±0,1 Р<0,01
|
7,39±0,02
|
|
pCO2
мм.рт.ст.
|
41-55
|
35,8±0,2 Р<0,05
|
41,3±3,1
|
30,5±0,3 Р<0,05
|
42,2±0,71
|
33,0±0,2 Р<0,05
|
44,5±0,2
|
|
pO2
мм.рт.ст.
|
37-49
|
60,4±0,2 Р<0,05
|
47,2±3,1
|
63,6±1,2 Р<0,05
|
48,7±1,3
|
45,4±1,2 Р<0,05
|
48,5±0,2
|
|
K+ ммоль/л
|
3,4-5,1
|
3,1±0,4 Р<0,05
|
3,7±0,2
|
3,3±0,03 Р<0,05
|
4,0±0,3
|
3,0±0,1 Р<0,05
|
4,2±0,2
|
|
Na+ ммоль/л
|
137-147
|
138±0,1 Р<0,01
|
137±0,2
|
141±0,2 Р<0,01
|
138±0,1
|
136±0,2 Р<0,01
|
138±0,1
|
|
Ca2+ ммоль/л
|
1,05-1,3
|
0,88±0,03 Р<0,05
|
1,01±0,2
|
0,73±0,04 Р<0,05
|
1,1±0,03
|
0,78±0,03 Р<0,05
|
1,12±0,04
|
|
Cl- ммоль/л
|
96-107
|
106±0,1 Р<0,01
|
103±0,4
|
107±0,1 Р<0,01
|
105±0,5
|
102±0,1 Р<0,01
|
106±0,3
|
|
HCO3 ммоль/л
|
23-28
|
23,8±0,3 Р<0,01
|
23,9±0,4
|
21,3±0,2 Р<0,01
|
23,6±0,5
|
22,2±0,2 Р<0,01
|
24,7±0,5
|
Из клеток же в интерстиций выходили Н+ и Cl-. Поступая с лимфой в кровоток, Н+ и Cl- усиленно выделялись из организма почками с мочой. В
связи с потерей Н+ и Cl- и накоплением К+ и Na+ постепенно происходило защелачивание цитозоля, что
стимулировало поступление в клетку Са2+, и показатели
ионизированного кальция в крови снижались [Черепно-мозговая травма, 2012].
Изменения электролитного баланса при данной патологии связано с
перераспределением данных ионов внутри клеточного пространства. Значения
кислотно-щелочного баланса, показали дыхательный алкалоз, это связанно с
нарушением нейрогуморальной регуляции организма.
3.5 Коррекция
нарушений кислотно-щелочного состояния
Часто анализ кислотно-щелочного состояния крови нужен врачам только для
констатации самого факта наличия метаболических расстройств. Лечение таких
заболеваний проходит по принципу "ацидоз - бикарбонат, алкалоз - соляная
кислота". Но необходимо думать, что же стало причиной развития такого
состояния и лечить патологию, а не следствие нарушения метаболизма [Костюченко,
2009].
Важнейшими методами лечения являются методы, направленные на ликвидацию
причин, вызвавших нарушение кислотно-щелочного баланса. Лечение легочной,
почечной недостаточности, черепно-мозговой травмы и сахарного диабета - эти
мероприятия оказывают непрямое нормализующее влияние на кислотно-щелочное
состояние. И только после этих мероприятий оказывают прямое нормализующее
влияние на кислотно-щелочной баланс. К таким мероприятиям относят:
оксигенотерапию, и применение буферных растворов.
При метаболическом ацидозе оксигенотерапия активирует аэробные процессы,
усиливая активацию недоокисленных продуктов и устраняя гипоксимию. А буферные
растворы связывают Н+, превращая в угольную кислоту. При
респираторном ацидозе переливание буферных растворов может вызвать проявление
метаболического алкалоза. И проведение мероприятий направленно на улучшение
альвеолярной вентиляции.
Коррекция и профилактика дыхательного алкалоза заключается в нормализации
внешнего дыхания.
Не следует интерпретировать анализ газов крови и кислотно-щелочного
состояния как новомодное интеллектуальное упражнение. В действительности он
является одной частью общего диагностического и лечебного процесса.
ЗАКЛЮЧЕНИЕ
В проделанной нами работе были рассмотрены биохимические показатели
изменения кислотно-щелочного состояния у реанимационных пациентов различного
возраста с заболеваниями легких, почек, сахарным диабетом, черепно-мозговыми
травмами. Было выявлено, что изменения кислотно-щелочного состояния влекут за
собой изменения электролитного баланса крови, в связи с включением
компенсаторных систем организма.
Согласно поставленным целям мы выяснили, что своевременное определение
нарушения кислотно-щелочного баланса может повысить качество лечебной помощи,
проведя коррекцию инфузионной терапии.
Получив данные исследования мы сделали следующие выводы:
. В группе с патологией легких изменения вентиляционно-перфузионных
соотношений ведут респираторному ацидозу. При респираторном ацидозе равновесные
системы организма не затрагиваются и электролитный баланс сохраняется.
. У группы детей больных сахарным диабетом наблюдался метаболический
ацидоз. Инсулиновая недостаточность приводила к сбоям в равновесии
электролитного баланса, происходило перераспределение ионов в тканях, из-за
коррекции диабета инсулином.
. Метаболический ацидоз также наблюдался при патологии почек. Так как
происходила недостаточная компенсация кислотно-щелочного состояния почками.
Нарушение выведения из организма веществ привело к изменению электролитного
баланса организма.
. У пациентов с черепно-мозговыми травмами, в связи с нарушением
нейрогуморальной регуляции организма развился дыхательный алкалоз. Изменения
электролитного баланса при данной патологии связано с перераспределением данных
ионов внутри клеточного пространства.
БИБЛИОГРАФИЧЕСКИЙ
СПИСОК
1. Айан
А. М. Хеннеси, Алан Дж. Джапп. Анализ газов артериальной крови понятным языком
/ пер. с англ. под ред. В. Л. Кассиля. - М., 2010. - 140 с., ил.
. Ацидоз
и алкалоз у детей / MedMoon.ru / Режим доступа:
http://www.medmoon.ru/ (дата обращения 21. 12. 2012)
. Афанасьева
Т.Н. Нарушения кислотно-основного состояния организма (патофизиологические
аспекты): Метод. Рекомендации. Мн., 2005. - 35 с.
. Болезни
обмена веществ Ацидоз / Эндокринология / Режим доступа:
http://www.medkarta.com/ (дата обращения 24. 11.2012).
. Болезни
нервной системы. Под редакцией Н.Н.Яхно, Д.Р.Штульмана. Издание второе,
переработанное и дополненное. М., 2001. 370 с.
. Газы
крови руководство отпечатано в Дании компанией Ratiometer Medical ApS, DK-2700
Bronshoj, 2006. 110 с.
. Гельфанд
Б. Р., Кириенко П. А., Гриненко П. А., Гурьянов В. А. и др. Анестезиология и
интенсивная терапия: Практическое руководство. М., 2006. 576 с.
. Горн
М.М., Хейту У.И., Сверинген П. Л. при участии Вебер К.С. Водно-электролитный и
кислотно-основной баланс (краткое руководство) пер с англ. СПб., М., 1999.
320с., ил.
. Гриппи
М. А. Патофизиология легких. Изд 2-е, исправ. М., 2005. 304с., ил.
. Долгов
В., Морозов В., Мадрало А. и др. Клинико-диагностическое значение лабораторных
показателей. М., 1995. 224с.
. Джеймс
А. Шейман Патофизиология почки. Пер с англ. - 2-е изд., испр. М., СПб., 1999.
206 с., ил.
. Камкин
А.Г. и Каменский А. А. Фундаментальная и клиническая физиология: Учебник для
студ. высш. уч. Заведений. М., 2004. 1072с.
. Капитан
Т.В. Пропедевтика детских болезней с уходом за детьми / Т.В.Капитан - 3-е
издание, доп. М., 2006. 704 с.
. Кислотно-щелочной
баланс в интенсивной терапии Patrick J Neligan MA MB FCARCSI, Clifford S Deutschman MS MD FCCM Copyright Patrick Neligan Department of Anesthesia University of Pennsylvania 2005.Перевод с английского С. С.
Костюченко, Dec 2009 Режим доступа:
http://intmedical.ru/assets/files/st/kcs.pdf (дата обращения 20.12.2012).
. Кишкун
А. А. Клиническая лабораторная диагностика: учебное пособие М., 2010. 976с.
. Клеточно-метаболический
ацидоз // Фундамент патологий Александр Дмитриевич Рылов Режим доступа
http://www.rylov.ru/acidos (дата обращения 12. 12. 2012).
. Костюченко
С. С. Кислотно-щелочной баланс в интенсивной терапии: Мн., 2009. 268с.
. Литвицкий
П. Ф. Патофизиология: учебник: В 2 т. - 2-е изд., испр. и доп. М., 2003. - Т.1.
- 752 с., ил.
. Малышев
В. Д. Кислотно-основное состояние и водно-электролитный баланс в интенсивной
терапии: Учебное пособие. М., 2005. 228 с., ил.
. Малышев
В.Д. Интенсивная терапия острых водно-электролитных нарушений. М., 1985. 192с.,
ил.
. Медицинская
лабораторная диагностика, программы и алгоритмы. Под ред. проф. Карпищенко А.И.
СПб., 2001. 100с.
. Метаболический
ацидоз/ RMS/ Режим доступа:
http://www.rusmedserver.ru/ (дата обращения 11. 11. 2012).
. Механизмы
регуляции КОС. Роль буферных систем, почек, легких, печени, желудочно-кишечного
тракта в регуляции КОС. Режим доступа:
http://dok-s.ru/src/ebooks/el_tnov/770.html (дата обращения 01.11.2012).
. Михайлов
В. В. Основы патологической физиологии: Руководство для врачей. М., 2001. 704
с.
. Назаренко
Г. И. Кишкун А.А. Клиническая оценка результатов лабораторных исследований. М.,
2000. 544с.
. Нарушение
кислотно-щелочного баланса/ Здоровье/ Новости медицины / Режим доступа:
http://www.werno.ru/zdorove/news_medicine/1213-narushenie-kislotno-shhelochnogo-balansa.html
(дата обращения 03. 12. 2012).
. Нарушения
кислотно-основного состояния Метаболический алкалоз Режим доступа:
http://bono-esse.ru/blizzard/Lab/MedlabDs/met_alkaloz.html (дата обращения
01.12.2012).
. Неотложные
состояния: Учебное пособие / под ред. Проф. Кондратенко П. Г. Донецк, 2001. 500
с.
. Ноздрачев
А. Д. Начала физиологии: Учебник для вузов. СПб., 2001. 1088с.
. Пауков
В. С., Литвицкий П. Ф. Патология: Учебник М., 2004. 400с.
. Петрова
Н. А. Особенности регуляции дыхания у недоношенных новорожденных и детей с
бронхолегочной дисплазией /Санкт-Петербургская Государственная Медицинская
Педиатрическая Академия /Детская Городская Больница № 1, Санкт-Петербург от
23.08.12 Режим доступа: http://icj.ru/ (дата обращения 12. 11. 2012).
. Протокол
оказания медицинской помощи пострадавшим с тяжёлой черепно-мозговой травмой на
госпитальном этапе / Журнал "Интенсивная терапия" // Журнал // N2 -
2008 Режим доступа:
http://icj.ru/journal/number-2-2008/165-protokol-okazaniya-medicinskoy-pomoschi-postradavshim-s-tyazheloy-cherepno-mozgovoy-travmoy-na-gospitalnom-etape.html
(дата обращения 01.12.2012).
. Рагимов
А. А., Еременко А. А., Никифоров Ю. В. Трансфузиология в реаниматологии. М.,
2005. 784 с., ил.
. Рябов
ГА. Синдромы критических состояний. М., 1994. 368 с., ил.
. Синдром
нарушения кислотно-щелочного состояния и водно-электролитного баланса. Режим
доступа: http://www.eyest.ru/obmen/53-obmen2.html (дата обращения 21.12. 2012).
. Скальный
А. В. Химические элементы в физиологии и экологии человека. М., 2004. 216с.,
ил.
. Современная
неотложная помощь при критических состояниях у детей. М., 2009. 438 с.
. Сумин
С. А. Неотложные состояния./ 2-е изд., М., 2000. 464 с.
. Учайник
В. Ф., Молочный В. П. Неотложные состояния в педиатрии: практическое
руководство/ Учайкин В.Ф., Молочный В.П. М., 2005. 256с., ил.
. Физиология
человека: в 3-х томах Т.2. Пер с англ. / под ред. Р. Шмидта и Г Тевса - 3-е
изд. М., 2005. 314с., ил.
. Физиология
человека: в 3-х томах Т.3. Пер с англ. / под ред. Р. Шмидта и Г Тевса - 3-е
изд. М., 2005. 228с., ил.
. Черепно-мозговая
травма. Патофизиология, клиника, принципы диагностики, алгоритмы лечения и т.д.
Сайт II травматологического отделения Сергиево-Посадской районной больницы.
Режим доступа: http://traumatolog.zagorsk.ru/ (дата обращения 02. 12. 2012).
43. Corey
E. Howard. Fundamental principles of acid-base physiology//Critical Care 2005,
9:184-192.
. Nishino
T. Physiological and pathophysiological implications of upper airway reflexes
in humans // Jpn J Physiol. - 2000. - Vol. 50. - P. 3 - 14.
. Perlman
J.M. Neurobehavioral deficits in premature graduates of intensive care-
potential medical and neonatal risk factors // Pediatrics. 2001. 108 p.