Значення цитохрому р-450 у метаболізмі ксенобіотиків
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ УКРАЇНИ
"КИЇВСЬКИЙ ПОЛІТЕХНІЧНИЙ ІНСТИТУТ"
Факультет біотехнології і біотехніки
Кафедра екобіотехнології та біоенергетики
РЕФЕРАТ
на тему: «Значення цитохрому р-450 у метаболізмі ксенобіотиків»
Виконала:
студентка
5 курсу
ФБТ,
групи БЕ-31м
Лелеко
І.Г.
Перевірила:
Гринюк
І.І.
КИЇВ 2014
ЗМІСТ
ВСТУП
1. ЗАГАЛЬНА
ХАРАКТЕРИСТИКА ЦИТОХРОМ Р-450- ЗАЛЕЖНОЇ СИСТЕМИ
2. МЕТАБОЛІЧНІ
ПЕРЕТВОРЕННЯ, ЩО КАТАЛІЗУЮТЬСЯ МІКРОСОМАЛЬНИМИ ФЕРМЕНТАМИ ПЕЧІНКИ
3. ОКИСНЕННЯ ТА
ВІДНОВЛЕННЯ МІКРОСОМАЛЬНИМИ МОНООКСИГЕНАЗАМИ
3.1 Основні ферменти
мікросомальних електронтранспортних ланцюгів
3.2 НАДФН -залежні
реакції окислення ксенобіотиків
3.3 НАДФН-залежні реакції
відновлення ксенобіотиків
4. ВПЛИВ КСЕНОБІОТИКІВ НА
АКТИВНІСТЬ МІКРОСОМАЛЬНИХ ФЕРМЕНТІВ
5. ХАРАКТЕРИСТИКА
ЦИТОХРОМУ Р-4502E1
5.1 Властивості та
фізіологічні функції цитохрома Р-4502E1
5.2 Kсенoбiomичнi
субстрати цитохрому P-4502E1
5.3 Poль цитохрому
P-4502E1 в ініціації оксидативного стресу та вільнорадикальної активації
спиртів
5.4 Регуляція експресії
цитохрому Р-4502Е1
5.5 Видові та
індивідуальні відмінності в експресії цитохрому P-4502E1. Поліморфізм гена
CYP2E1
5.6 Зміни активності
цитoxpoму P-4502E1 за pізниx станів opгaнізму. Йoгo індуктоpи та інгібітори
ВИСНОВКИ
СПИСОК ВИКОРИСТАНИХ
ДЖЕРЕЛ
ВСТУП
цитохром метаболізм
ксенобіотик стрес
У промисловості,
сільському господарстві, медицині та побуті використовуються більше 70 000
чужорідних для організму речовин, значна частина яких негативно впливає на
людину. Більшість ксенобіотиків, що надходять до організму, метаболізуються. В
першій окислювальній фазі метаболізму в їхній молекулі утворюється хімічно
активна група, яка під час другої фази кон’югується з ендогенними молекулами.
Ці метаболіти, здебільшого, хімічно менш активні і легко елімінуються з
організму, хоча відомо багато прикладів утворення токсичних сполук. Для
ферментів, які метаболізують ксенобіотики, також відомі ендогенні субстрати,
тому шляхи обміну чужорідних речовин і ендобіотиків перетинаються [1].
Значною подією в
біохімії ферментів можна вважати відкриття цитохрому Р-450. Трохи більше сорока
років тому Гарфінкл та Клінгенберг встановили, що ендоплазматична сітка печінки
експериментальних тварин містить невідому пігментну речовину, яка,
відновлюючись, приєднує окис вуглецю і утворює комплекс з максимумом поглинання
при 450 нм. Пізніше таку сполуку було названо Р-450, а коли була визначена його
гемопротеіновая природа - цитохромом Р-450. Згодом виявилося, що цитохром Р-450
є простетичною групою ферментів, що відносяться до монооксигеназ (гідроксилаз).
Вони широко поширені в живій природі, так як виявлені в різних таксономічних
групах (безхребетні, хребетні тварини, рослини, бактерії). Їх локалізація у
тварин не обмежується печінкою, а включає широке коло органів і тканин [2].
Найбільш дивовижною
властивістю цитохром Р-450 залежних ферментів є те, що вони окиснюють велике
число природних субстратів і практично всі ксенобіотики. Звідси значний інтерес
до цієї проблеми виник не лише у біохіміків, але також у хіміків, молекулярних
біологів і генетиків. У біохімії основна увага приділяється молекулярній
організації, каталітичним властивостям і механізму дії ферментів. Хімічні
аспекти пов'язані з вивченням фізико-хімічних властивостей субстратів і
визначенням взаємозв'язку структура-активність ферментів, а також пошуком
модельних систем для встановлення хімічних принципів активації молекулярного
кисню, що імітують монооксигенази.
Не можна не відзначити
ключову роль цитохром Р-450-залежних ферментів у фармакології. Вони настільки
адаптовані до дослідницької роботи фармаколога, що отримали свою назву
"ліки-метаболізуючі ферменти". Вони в багатьох випадках визначають
активність ліків (проліків), їх фармакологічний профіль, а також побічну дія і
толерантність.
Особливе увага до цих
ферментних систем приділяється і в токсикології. Метаболіти, що утворюються в
процесі монооксигеназного каталізу, справляють визначальний вплив на генетичні
процеси, стан клітинного ділення (репродукцію, мутагенез, онкогенез) [2].
Отже, з вище сказаного,
можна зробити висновок, що питання пов’язане з вивченням будови, форм та
функціонування цитохрому P-450 є досить актуальним.
Метою даної доповіді є
огляд літератури щодо системи міросомальних ферментів, зокрема цитохрому Р-450.
Основним завданням є
характеристика ферментних систем, що беруть участь у перетворенні ендогенних та
чужорідних (ксенобіотичних) речовин, опис реакцій та перетворень, що
відбуваються за участю цитохрому Р-450, характеристика будови та регуляції
цитохрому Р-450, наведення вплив ксенобіотиків та функціонування мікросомальних
ферментів, опис деяких клінічних аспектів.
1. ЗАГАЛЬНА
ХАРАКТЕРИСТИКА ЦИТОХРОМ Р-450- ЗАЛЕЖНОЇ СИСТЕМИ
Монооксигеназна система,
до якої належать цитохроми Р-450 та b5, NADРН- і NADН-редуктази, є
неперевершеною за різноманітністю субстратів їхньої дії і типів реакцій. З усіх
її компонентів лише цитохром Р-450 (неспецифічна монооксигеназа) здатен
активувати молекулярний кисень за участю електронів, донором яких є NADРН і
(або) цитохром b5. Цитохроми Р-450 - це група структурно подібних гемотіолатних
білків, у яких атом заліза координується чотирма зв’язками з ядром
протопорфірину IX, п’ятим лігандом заліза є тіольна група (залишок цистеїну)
білкової частини ферменту, а шостим - молекула води, яка може заміщуватись на
молекулу кисню. Каталітичну активність цитохроми виявляють за присутності
фосфоліпідів, які стабілізують фермент у функціонально активній конформації
[1].
Всі цитохроми Р-450
містять консервативне структурне ядро, яке відповідає за зв’язування гемового
заліза і за варіабельні місця на ділянках, які асоційовані з розпізнаванням
субстрату та зв’язуванням редокс-партнера. Будова субстратзв’язувальної частини
молекули визначає субстратну вибірковість різних форм цитохрому. В цитохромі
Р-4502Е1 залишки Sеr129, Lеu-209 та Рhе-477 є критичними для орієнтації
субстрату в активному центрі та його каталітичної дії.
Каталітичний цикл
цитохрому Р-450 наведено на рисунку 1.1.

Рисунок 1.1 Каталітичний
цикл цитохрому Р-450 [3]
На першій стадії
окислена форма ферменту асоціюється із субстратом, утворюючи
фермент-субстратний комплекс (RН)Fе3+, що підтверджується спектральними змінами
в молекулі. Більшість субстратів спричинюють зміни першого типу внаслідок
збільшення частки високоспінової форми ферменту. На другій стадії
спостерігається відновлення комплексу електроном, який передається
NADРН-редуктазою (цихротом b5 на цій стадії не бере участі), і утворення
відновленого комплексу (RH)Fе2+. До нього (третя стадія) приєднується кисень і
утворюється комплекс (RН)Fе2+O2, який в четвертій стадії після перенесення
електронів із заліза на кисень перетворюється на комплекс (RН)Fе3+O2, (можлива
також його дисоціація і виділення суперок- сидного радикала). На п’ятій стадії
попередній комплекс відновлюється ще одним електроном, який надходить від
NADРН-редуктази або цитохрому b5, з утворенням пероксикомплексу (RН)Fе3+O2=.
Потім (шоста стадія) за участю двох протонів відбувається гетеролітичний розрив
зв’язку O-O з вивільненням води і утворенням комплексу RН(Fе-O)3+, в якому
міститься електрондефіцитний (шестиелектронний) оксеноїдний атом кисню. Під час
цих процесів також можлива дисоціація комплексу (RН)Fе3+O2= з виділенням
пероксиду водню. Oксеноїдний комплекс RН(Fе-O)3+ вважається найважливішим
окисником у циклі цитохрому Р-450. 0дним із поширених шляхів його взаємодії з
молекулою субстрату є вивільнення атома водню з утворенням радикала субстрату і
координованого із залізом гідроксильного радикала - R∙(Fе0Н)3+ (стадія 7)
з наступною рекомбінацією їх, за якої гідроксильна група включається в молекулу
субстрату R0Н(Fе3+), після чого окислений субстрат відділяється від ферменту
(стадія 8). 0днак можливе і безпосереднє включення атома кисню у зв’язок С-Н,
відокремлення гідрид-іона і проміжне утворення карбонієвого іона. Шлях, яким
відбуватиметься реакція, визначається будовою субстрату [1].
Оксеноїдний комплекс -
не єдиний окисник у каталітичному циклі цитохрому Р-450; такі властивості
притаманні і іншим гіпервалентним комплексам заліза: нуклеофільному
пероксизалізу, нуклеофільному або електрофільному гідропероксизалізу, кожний з
яких специфічно взаємодіє із субстратом.
Різні типи окисників
забезпечують різноманітність механізмів окислення субстратів, широку субстратну
специфічність монооксигеназ та значний набір продуктів реакції (рисунок 1.2).
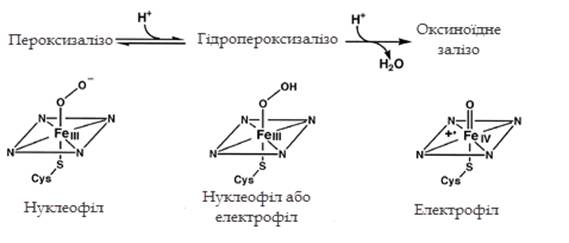
Рисунок 1.2 Окисники в
каталітичному циклі цитохрому Р-450 [4]
Особливістю
монооксигеназної системи є істотна видова і індивідуальна варіабельність,
органна та тканинна специфічність, яка здебільшого пояснюється різним набором
ізоферментів. Близько 40% чужорідних для організму речовин за метаболізму
каталізується поліморфними ферментами, чим зумовлюються індивідуальні і етнічні
розбіжності в їхній фармакокінетиці, фармакодинаміці й токсичності. Що
стосується ліків, то поліморфізм цитохрому Р-450 може бути причиною таких
процесів: 1) надмірного терапевтичного ефекту внаслідок сповільненої
метаболічної інактивації ліків в осіб зі зниженою активністю ферментів
(“повільних метаболізаторів”); 2) зменшення ефекту лікарських препаратів через
прискорення інактивації в осіб з аномально високою активністю ферментів
(“швидких метаболізаторів”); 3) збільшення токсичності ліків швидкими метаболізаторами
і утворенням токсичних метаболітів; 4) підвищення їхньої токсичності за
повільної метаболізації, якщо сам препарат є отрутою; 5) утворення токсичних
метаболітів у разі перерозподілу звичайних шляхів метаболізму ліків.
Уповільнений обмін речовин здебільшого спостерігається за наявності мутантних
алелей гена “зі втраченою функцією”, який кодує білок зі зниженою
ферментативною активністю, а ультрашвидкий метаболізм може обумовлюватись
дублюванням гена або збільшенням його активності [5]. Проміжні метаболізатори,
переважно, є гетерозиготними або несуть алелі з мутаціями, які помірно
зменшують активність ферментів.
Різні форми цитохрому
Р-450 характеризуються невисокою субстратною специфічністю, що ускладнює їхню
класифікацію. Тому систематизація множинних форм ферменту грунтується на
спільності походження генів і подібності амінокислотного складу білків.
Цитохром Р-450 - це суперсімейство ферментів, в якому у тварин, рослин, грибів
та бактерій налічується більше 300 сімейств та підсімейств і понад 1925 представників.
Тільки в людини виявлено більше 55 генів та 29 псевдогенів цитохрому, а в мишей
63 та 21 відповідно. До сімейства включають такі білки, подібність
амінокислотного складу яких становить близько 40%, до підсімейства - білки,
подібність амінокислотного складу яких перевищує 55%. У межах підсімейства вона
становить понад 65%. Для генів цитохрому Р-450 і продуктів їхньої експресії
використовують абревіатуру CYP (від виразу cytochrome P-450) з позначенням
сімейства цифрою, підсімейства - буквою латинського алфавіту, індивідуального
гена - цифрою, яка стоїть після назви підсімейства. Множинні форми CYP, які
метаболізують ксенобіотики у ссавців, належать до сімейств CYP1, CYP2, CYP3.
Найчисленнішим із них є сімейство, яке включає підсімейства 2А, 2В, 2C, 2D, 2Е,
2F, 2G, 2J тощо [1].
2. МЕТАБОЛІЧНІ
ПЕРЕТВОРЕННЯ, ЩО КАТАЛІЗУЮТЬСЯ МІКРОСОМАЛЬНИМИ ФЕРМЕНТАМИ ПЕЧІНКИ
В організмі тварини
чужорідні органічні сполуки зазнають широкий ряд метаболічних перетворень,
багато з яких каталізується ферментами ЕПР (мікросомальна фракція) печінки.
Тому метаболічні перетворення чужорідних сполук можна узагальнено підрозділити
на перетворення, які каталізуються ферментами ЕПР печінки і, ймовірно, інших
тканин (мікросомальні), і на перетворення, які каталізується ферментами,
локалізованими в інших місцях (немікросомальні). Грунтуючись на хімічній
природі цих реакцій, їх більш детально можна класифікувати наступним чином [6].
Окиснення
мікросомальними ферментами: гідроксилювання ациклічних, ароматичних і
аліциклічних сполук, епоксидування, N- гідроксилювання амінів, N-окиснення
третинних амінів, S-окиснення, дезалкілування, дезамінування та сульфування.
Відновлення
мікросомальними ферментами: відновлення нітро- та азосполук.
Немікросомальне
окиснення: дезамінування, окиснення спиртів і альдегідів, ароматизація
аліциклічних сполук.
Немікросомальне
відновлення: відновлення альдегідів і кетонів.
Гідроліз: гідроліз
складних ефірів та амідів за участю мікросомальних і немікросомальних
ферментів.
Інші реакції:
відбуваються багато інших перетворень, але недостатнє знання їх механізмів і
локалізації ферментів, що приймають в них участь не дозволяє дати більш повну
їх класифікацію. До цих реакцій відносяться дегідроксилювання катехолу і
гідроксамових кислот, дегалогенування, розрив кільця, утворення кільця,
відновлення ненасичених сполук, відновлення дисульфідів в меркаптанів, окисне
розщеплення миш'якових сполук у арсеноксиди та ін. [6].
Продукти цих
метаболічних перетворень потім можуть піддаватися:
а) виділенню без
подальших змін;
б) кон'югації з
подальшим виділенням;
в) метаболізму в процесі
проміжного обміну або з'єднанню з тканинами.
Сполуки, особливо з
декількома функціональними групами, можуть метаболізуватися за допомогою більш
ніж однієї з цих реакцій, даючи ряд різних метаболітів. [6]
3. ОКИСНЕННЯ ТА
ВІДНОВЛЕННЯ МІКРОСОМАЛЬНИМИ МОНООКСИГЕНАЗАМИ
Мікросомальні оксидази -
ферменти, локалізовані в мембранах гладкого ЕР, що функціонують в комплексі з
двома зовнішньомітохондріальними ланцюгами переносу електронів. Ферменти, що
каталізують відновлення одного атома молекули О2 з утворенням води і включення
іншого атома кисню в сполуку, що окиснюється, отримали назву мікросомальних
оксидаз зі змішаною функцією або мікросомальних монооксигеназ [7].
Мікросомальна система не
містить розчинних у цитозолі білкових компонентів, всі ферменти - мембранні
білки, активні центри яких локалізовані на цитоплазматичнії поверхні ЕР.
Система включає кілька білків, що входять до електронтранспортного ланцюга. У
ЕР існують два такі ланцюги, перший складається з двох ферментів - NADPH-P450
редуктази і цитохрому Р450, друга включає фермент NADH-цитохром-b5 редуктазу,
цитохром b5 і ще один фермент - стеароїл-КоА-десатуразу [7].
Монооксигенази, в яких
роль простетичної групи виконує цитохром Р-450, залежно від місця локалізації
можна розділити на три групи [2].
. Мікросоми печінки
НАДФН → Флавонопротеід II → Негеміновий Fe-білок → Цитохром
Р-450 → О2.
. Мітохондрії
наднирників НАДФН → Флавонопротеід III → Адренодоксина Цитохром
Р-450 → О2.
. Бактеріальні
монооксигенази НАДФН → Флавонопротеід III → Путідаредоксин →
Цитохром Р-450 → О2.
Електронтранспортний
ланцюг - NADPH-P450 редуктаза - цитохром Р450. У більшості випадків донором
електронів (e) для цього ланцюга служить NADPH, що, окиснюється NАDРН-Р450
редуктазою. Фермент в якості простетичної групи містить 2 кофермента -
флавінаденінди-нуклеотид (FAD) і флавинмононуклеотид (FMN). Протони і електрони
з NADPH переходять послідовно на коферменти NADPH-P450 редуктази. Відновлений
FMN (FMNH2) окиснюється цитохромом Р450 (див. схему нижче). [7]
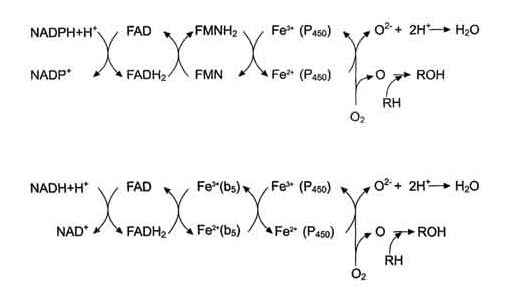
Цитохром Р450 -
гемопротеин, що містить простетичну групу гем і має ділянки зв'язування для
кисню і субстрату (ксенобіотика).
Субстрат, що окиснюється
(донор електронів) для NADH - цитохром b5-редуктази - NADH (схема 3.1). Протони
і електрони з NADH переходять на кофермент редуктази FAD, наступним акцептором
електронів служить Fe3+ цитохрому b5. Цитохром b5 в деяких випадках може бути
донором електронів для цитохрому Р450 або для стеароїл-КоА-десатурази, яка
каталізує утворення подвійних зв'язків у жирних кислотах, переносячи електрони
на кисень з утворенням води (рис. 3.1 ) [7].

Рисунок 3.1
Електронтранспортні ланцюги ЕР. RH - субстрат цитохрому Р450; стрілками
показані реакції перенесення електронів. В одній системі NADPH окиснюється
NADPH цитохром Р450-редуктазою, яка потім передає електрони на ціле сімейство
цитохромів Р450. Друга система включає в себе окиснення NADH цитохром
b5-редуктазою, електрони переходять на цитохром b5; відновлену форму цитохрому
b5 окиснює стеароїл-КоА-десатураза, яка переносить електрони на О2.
NADH-цитохром b5
редуктаза - двухдоменний білок. Глобулярний цитозольний домен пов'язує
простетичну групу - кофермент FAD, а єдиний гідрофобний "хвіст"
закріплює білок в мембрані.
Цитохром b5 -
гемовмісний білок, який має домен, локалізований на поверхні мембрани ЕР, і
короткий "занурений" в ліпідному бішарі спіралізований домен.цитохром
b5-редуктаза і цитохром b5, будучи "зануреними" білками, не фіксовані
строго на певних ділянках мембрани ЕР і тому можуть змінювати свою локалізацію
[7].
Число субстратів, що
приймають участь у монооксигеназному каталізі дуже значне. Тому прийнято
розділяти його на певні типи реакцій (таблиця 3.1) [8] .
Таблиця 3.1

З хімічної структури
субстратів і продуктів їх окиснення (метаболітів) очевидно, що такі реакції
можуть здійснюватися як з ендогенними, так і з чужорідними (ксенобіотики)
речовинами. До першої групи належать стероїди, жирні кислоти, жовчні кислоти,
простагландини, лейкотрієни, біогенні аміни, ретиноїди, гідроперикиси ліпідів.
До другої групи
відносяться багато синтетичних і природних лікарських засобів, пестициди,
гербіциди, промислові отрути, відходи промислових підприємств, харчові добавки
і т. д. [9].
З фізіологічної точки
зору, реакції гідроксилювання ксенобіотиків спрямовані на захист живих систем
від накопичення в них гідрофобних сполук. Однак у багатьох випадках ці реакції
призводять до утворення проміжних реакційноздатних активних метаболітів,
продуктів неповного відновлення кисню, які хімічно модифікують макромолекули і
стимулюють реакції перекисного окислення. Все це служить причиною прояву різних
видів токсичності, канцерогенезу, мутагенезу, тератогенезу і алергій.
Отже, цитохроми Р450
відіграють надзвичайно важливу роль у підтримці стаціонарного рівня ендогенних
лігандів, викликаючи лігандомодулюючу транскрипцію генів, визначаючи тим самим
зростання, диференціацію, апоптоз, а також клітинний гомеостаз і нейрогуморальну
функцію.
Виходячи із загальних
положень біохімії про субстратній специфічності ферментів (абсолютна і відносно
широка) все ж важко припустити навіть для другого випадку, що каталітичне
окиснення таких численних за хімічною структурою субстратів може здійснюватися
одним цитохром Р450-залежним ферментом.
Спочатку для доказу
існування цитохрому Р450 в різних ізоформах були використані його індуктори.
Кількість речовин, що викликають індукцію монооксигеназ, які окиснюють
ксенобіотики, перевищує кілька сотень [10].
Це різні по хімічній
природі і біологічній дії сполуки. Єдиною загальною властивістю для них є те,
що вони жиророзчинні і в значних кількостях накопичуються в ендоплазматичної
сітці клітин. Таке виборче надходження речовин в цитомембрани сприяє взаємодії
ферменту з субстратом. Чим довше субстрат знаходиться в організмі, тим
триваліше його контакт з ферментом, і, отже, більш високий рівень його
індукції. Можна припустити, що індукція в своїй основі носить пристосувальний
характер, оскільки призводить до збільшення швидкості метаболізму
ксенобіотиків, тобто до прискорення їх елімінації з організму [8].
Дослідження, проведені з
класичними індукторами (фенобарбітал-3-метилхолантрен) цитохрому Р450, а також
спектральними характеристики комплексів фермент - субстрат показали, що в
одному і тому ж біологічному об'єкті цей гемопротеин існує в декількох
різновидах. Такий висновок призводить до подальших питань, що стосуються
насамперед кількості цих ізоферментів і можливості їх класифікації.
Виявилося, що множинні
форми цитохрому Р-450 в порівнянні з іншими ферментами мають відносно невисоку
субстратную специфічність і часто один і той же субстрат окиснюється різними
ізоформами. На жаль, відсутні і специфічні по відношенню до тих чи інших
ізоформам цитохрому індуктори або інгібітори. Все це ускладнює класифікацію
ізоформ цитохрому Р450 [8].
.2 НАДФН -залежні
реакції окислення ксенобіотиків
Мікросомальні ферментні
системи каталізують наступні реакції окислення (гідроксилювання) ксенобіотиків.
Окисне деалкілування.
Воно пов'язане найчастіше з відщепленням алкільних груп від атомів N, О і S в
молекулі ксенобіотика.деалкілування - основний спосіб метаболізму вторинних і
третинних амінів. Ці реакції найбільш докладно вивчені стосовно до наркотиків і
анальгетиків. Наприклад, деметилювання морфіну по азоту призводить до утворення
норморфіна і альдегіду (реакція 3.1) [11]:
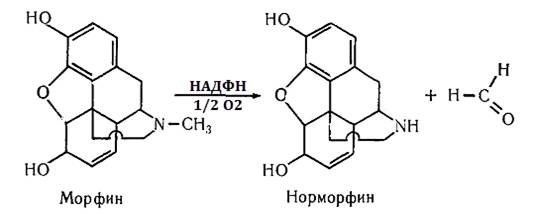 (3.1)
(3.1)
Дана реакція, як і всі
наступні НАДФН-залежні реакції окиснення, протікають за участю цитохрому Р-450 і
флавопротеїну [12].
О-Деалкілування
ксенобіотиків проходить за загальною схемою (реакція 3.2):
SOCH3 →SOH +
альдегид (3.2)
За принципом
О-деметилювання в печінці людини метаболізуються кодеїн, колхіцин, папаверин та
інші препарати. В результаті О-деметилювання кодеїну утворюється морфін, що
пояснює знеболюючу дію кодеїну(реакція 3.3) [11]:
 (3.3)
(3.3)
N-Окиснення. Багато
лікарських речовини містять у своєму складі атом азоту, окиснення якого змінює
як фармакологічні, так і токсичні властивості ксенобіотиків. Утворення
N-оксидів характерне для первинних, вторинних і третинних амінів, однак
цитохром Р-450 здатний окиснювати тільки первинні аміни (реакція 3.4) [11]:
 (3.4)
(3.4)
Окислювальне
дезамінування. Відщеплення амінних груп від лікарських препаратів найчастіше
призводить до втрати фармакологічного ефекту. Що стосується токсичної дії, то
воно може і зменшитися, і збільшитися в залежності від будови вихідної
речовини. Найбільш вивченою реакцією окиснювального дезамінування в мікросомах
печінки є метаболізм амфетаміну (реакція 3.5) [11]:
 (3.5)
(3.5)
Окиснення і
десульфування. Це найменш вивчений тип монооксигеназних реакцій. Проте участь в
цих реакціях цитохрому Р-450 було доведено за допомогою інгібіторного аналізу.
Прикладом 5’-окиснення можна навести метаболічне перетворення хлорпромазина
(реакція 3.6) [11]:
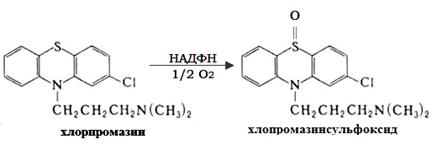 (3.6)
(3.6)
Реакція десульфування,
тобто заміщення сірки киснем, також протікає за участі цитохрому Р-450 за
схемою (реакція 3.7):
 (3.7)
(3.7)
.3 НАДФН-залежні реакції
відновлення ксенобіотиків
Реакції відновлення в
ЕПР протікають за участю НАДФН-залежного флавопротеїну і цитохрому Р-450.
Найбільш часто зустрічається відновлення нітро-і азосполук:

4. ВПЛИВ КСЕНОБІОТИКІВ
НА АКТИВНІСТЬ МІКРОСОМАЛЬНИХ ФЕРМЕНТІВ
Багато чужорідних
речовин, потрапляючи в організм, впливають на синтез або активність
мікросомальних монооксигеназ. Більшість з них є індуцібельними ферментами, які
регулюються ендогенними метаболітами. Разом з тим є велика кількість
ксенобіотиків, що викликають індукцію їх синтезу. Ефект особливо важливий при
дії фармакологічно активних речовин на такі ферменти, як цитохром Р-450. Деякі
з цих препаратів представлені в табл. 4.1[11] .
Таблиця 4.1
Індуктори мікросомальних
монооксигеназ
|
Лікарський препарат
|
Фармаокологічний ефект
|
|
Барбітурати, ноксирон
|
Седативний, снотворний
|
|
Фторатан, метоксифлуран
|
Засоби для наркозу
|
|
Кордиамін,фенамін
|
Стимулятори ЦНС
|
|
Мепробамат,сибазон
|
Транквілізатори, нейролетики
|
|
Бутамід, букарбон
|
Гіпоглікімічні засоби
|
|
Бутадіон
|
Протизапалювальні засоби
|
|
Мебедрол
|
М'язевий релаксант
|
Всі індуктори
монооксигеназ поділяють на дві групи: індуктори широкого спектру дії та
індуктори вузького спектру дії.
До першої групи
відносяться похідні барбітурової кислоти, що володіють здатністю посилювати
біотрансформацію багатьох ксенобіотиків за рахунок індукції синтезу цитохрому
Р- 450. Одним з представників другої групи індукторів є метилхолантрен та інші
ароматичні вуглеводні. Вони індукують синтез однієї молекулярної форми
цитохрому, саме цитохрому Р-448, відсутнього у інтактних тварин. Ця форма
ферменту має вузьку субстратную специфічність і каталізує процеси
біотрансформації фенантрена, бензантрацена і деяких піренів.
Таким чином, лікарські
речовини не тільки метаболізуються монооксигеназними системами, але й змінюють
активність або синтез ферментів біотрансформації.
Цей феномен пояснює
звикання до лікарських препаратів, що має місце, коли метаболіти останніх
фармакологічно неактивні. Наприклад, фенобарбітал індукує синтез цитохрому Р-
450, причому утворюються гідроксібарбітурати фармакологічно неактивні. Для
досягнення фармакологічного ефекту необхідно збільшувати дозу препарату. Інша
ситуація складається в тому випадку, якщо саме метаболіти лікарського препарату
виявляються фармакологічно активними . Той же фенобарбітал, посилюючи синтез
цитохрому Р- 450, сприяє збільшенню фармакологічного ефекту цих метаболітів
[11].
5. ХАРАКТЕРИСТИКА
ЦИТОХРОМУ Р-4502E1
Білок цитохром Р-4502Е1
є продуктом гена CYP2E1, який відділився від генів підсімейства CYP2C майже 230
млн. років тому [14]. Молекула цитохрому Р-4502Е1 печінки людей включає 493
амінокислотних залишки, має молекулярну масу 56 849 Да і 78%-ву амінокислотну
подібність до білків щурів та мишей. Між ферментами останніх спостерігається
92% амінокислотної гомології. У людини ген СУР2Е1 локалізується на 10-й
хромосомі і містить 11 413 пар основ, 9 екзонів та типовий ТАТА-бокс. За
каталітичними властивостями ортологічні форми ферменту людини, кролів, щурів,
мишей і хом’яків практично тотожні [1].
Цитохром Р-4502Е1 у
людини та щурів експресується в печінці, легенях, нирках, тонкому кишечнику,
кістковому мозку, простаті, яєчках, матці, плаценті, гіпокампі, корі головного
мозку та слизовій оболонці носа. Експресія його в печінці починається відразу
після народження людини. В печінці ізофермент переважно локалізується
перицентрально, а в гепатоцитах - в ендоплазматичному ретикулумі і, в незначній
кількості, в інших компартментах [1].
Фізіологічні функції
цитохрому Р-4502Е1 вивчено недостатньо. Доведено його участь в адаптації організму
до високих концентрацій етанолу через здатність каталізувати окислення спирту
до ацетальдегіду (реакція 5.1) та ацетату (реакція 5.2) [13]:
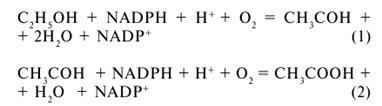 (5.1
та 5.2)
(5.1
та 5.2)
Механізм окислення
етанолу включає: взаємодію його молекули з оксеноїдним комплексом ферменту,
елімінацію атома водню, утворення гемінального діолу та дегідратацію останнього
до ацетальдегіду [3]. Якщо утворений в першій реакції діол, знову окислюється,
то синтезується оцтова кислота. Окиснюватись може безпосередньо і ацетальдегід,
але після попередньої гідратації до діолу (рисунок. 5.1)

Рисунок 5.1 Механізм
окиснення етанолу та ацетальдегіду цитохромом Р-450Е1
Важливою функцією
цитохрому P-4502E1 є його участь у перетворенні ацетону на молочну кислоту. Цей
шлях має істотне значення в синтезі глюкози під час голодування та за інших
станів організму, які супроводжуються гіперкетонемією. Фермент каталізує
послідовне гідроксилювання ацетону з утворенням ацетолу і метилгліоксалю, а
останній за участю гліоксалази I (лактоїлглутатіонліази - КФ 4.4.1.5) та
гліоксалази II (гідроксіація глутатіонгідролази - КФ 3.1.2.6) перетворюється на
молочну кислоту (рис. 5.2).
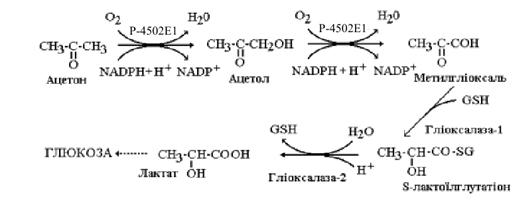
Рисунок 5.2 Участь
цитохрому P-4502E1 у перетворенні ацетону на молочну кислоту
Провідну роль P-4502E1 в
утилізації ацетону показано на мишах, нокаутованих за геном CYP2E1, у яких під
час голодування вміст ацетону у крові підвищується у 28 разів, тоді як у мишей
дикого типу - лише у 2,5-4,4 раза [1].
Цитохром P-4502E1
каталізує гідроксилювання лінолевої і арахідонової кислот [20], бере участь у
катаболізмі дофаміну в мозку, активує перетворення індолу на індоксил
(попередник індикану). Гідропероксиди жирних кислот також належать до фізіологічних
субстратів цитохрому P-4502E1, який в анаеробних умовах розщеплює їх з
утворенням альдегідів та алканів (рис. 5.3).
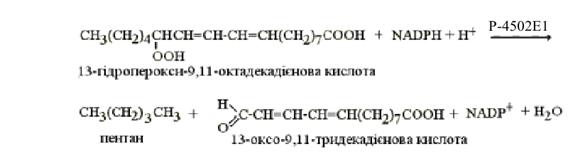
Рисунок 5.3 Bіднoвлeння
гідpoпepoкcидів жирних кислот
Цим, очевидно,
пояснюється наявність останніх у видихуваному повітрі тварин та людини, а також
підвищення їхнього рівня внаслідок активації пероксидації ліпідів.
.2 Kсенoбiomичнi
субстрати цитохрому P-4502E1
Цитохром P-4502E1 здатен
метаболізувати величезну кількість невеликих органічних молекул (на сьогодні їх
відомо понад 100), здебільшого з утворенням реакційноздатних метаболітів. У
таблиці 5.1 наведено приклади ендогенних та ксенобіотичних субстратів ферменту;
деякі з них використовують як його маркери.
Таблиця 5.1
Приклади ендогенних та
ксенобіотичних субстратів ферменту [1]
|
Класи сполук
|
Субстрати цитохрому Р-4502Е1
|
|
Спирти, альдегіди, кетони, прості
ефіри
|
Етанол, метанол, пропанол,
бутанол, гліцерол, ацетальдегід, бутанон, ацетон, ацетол, ацетоацетат,
діетиловий ефір, метил-трет-бутиловий ефір.
|
|
Ароматичні сполуки
|
Парацетамол, анілін, бензол,
кофеїн, ізоніазид, хлорзоксазон, фенол, w-нітрофенол, піридин, піразол,
стирол, толуол, етилбензол, ксилол, кумол, хлорбензол, метиланізол.
|
|
Жирні кислоти
|
ω -1- та ω -2-гідроксилювання арахідонової кислоти і ω
-1-гідроксилювання лауринової кислоти.
|
|
Алкани, алкени та їхні
галогенопохідні
|
Гексан, пентан, етан,
1,3-бутадієн, тетрахлорметан, хлороформ, дихлорметан, дихлоретан,
трихлоретан, трихлоретилен, вінілхлорид, інгаляційні анестетики (фторотан,
енфлуран, метоксифлуран, севофлуран).
|
|
Нітрозаміни і азосполуки
|
N-диметилнітрозамін,
N-діетилнітрозамін, N-нітрозо-2,3-диметилморфолін, N-нітрозопіролідин,
N-нітрозобензилметиламін, метилазоксиметанол, азоксиметан.
|
|
Різні речовини
|
N-диметилацетамід, N-диметилформамід,
тіоацетамід, етилкарбамат, ацетонітрил, акрилонітрил, уретан.
|
|
Субстрати, що відновлюються
|
Тетрахлорметан,
третбутилгідропероксид, гідропероксид кумолу, гідропероксиди жирних кислот,
хром (VI), кисень.
|
Цитохром Р-4502Е1 є
основним каталізатором активації нітрозамінів із короткими алкільними ланцюгами
(N-нітрозодиметиламіну, N-нітрозометилетиламіну, N-нітрозодіетиламіну) до
мутагенних та канцерогенних метаболітів. Він активує реакції α-C-гідроксилювання, ω-гідроксилювання,
N-деалкілування, N-окислення нітрозамінів з утворенням алкіл(арил)діазонієвих
іонів, після розщеплення яких утворюються електрофільні частинки, здатні
алкілувати (арилувати) нуклеофільні центри в ДНК та білках.
Крім того, фермент
каталізує утворення епоксидних метаболітів бензолу, стиролу, бромбензолу і
ксилолу; метилгідроксилювання толуолу та гепатотоксичну активацію бромбензолу;
епоксидацію і утворення ціанідів з акрилонітрилу. Він також бере участь у
перетворенні бензолу на токсичний епоксид, а за окислення його метаболіту
фенолу - на катехоли та гідрохінони, які в редокс-циклах генерують семіхінонні
радикали та активні форми кисню.
Цитохром P-4502E1
каталізує перетворення парацетамолу на токсичний метаболіт
N-ацетил-n-бензохінонімін, при цьому токсична дія лікарського препарату тісно
корелює з активністю ферменту, зокрема в печінці щурів. Він також бере участь у
перетворенні інгаляційних анестетиків - галотану (фторотану), севофлурану і
енфлурану - на високотоксичні метаболіти (трифтороцтову кислоту,
трифторацетилхлорид та ін.), які ацилюють білки і спричинюють утворення
неоантигенів та розвиток автоімунного ураження печінки [1].
.3 Poль цитохрому
P-4502E1 в ініціації оксидативного стресу та вільнорадикальної активації
спиртів
Всі цитохроми P-450,
передусім 2E1, здатні відновлювати молекулярний кисень і за відсутності
субстрату (футильний цикл, “негерметичний” фермент). Як випливає з рис. 1.2,
вивільнення одного електрона відбувається з діоксигенового комплексу (Fe2+O2RH →
Fe3+RH + O2-), а двох електронів - із комплексу Fe3+O2=RH, коли замість
молекули води, елімінується пероксид водню [3].
Унаслідок високої
оксидазної активності цитохром P-4502El потенціює утворення гідроксильних
радикалів у модельній системі Фентона і прискорює залежний від них метаболізм
етанолу та диметилсульфоксиду [14]; за його присутності стимулюється
пероксидація ліпідів у мікросомах і ліпосомах, а також у суспензії
ліпопротеїнів [14].
Гостре або хронічне
введення етанолу тваринам, як і алкоголізація у людини, призводить до
накопичення у тканинах продуктів пероксидації ліпідів та виснаження
антиоксидантної системи організму [44]. При цьому алкоголь не лише стимулює
пероксидацію ліпідів, але є джерелом вільних радикалів. Мікросомна фракція
печінки щурів активно окислює етанол, пропанол, бутанол з утворенням
гідроксіетильного, гідроксипропільного та гідроксибутильного радикалів
відповідно. Утворення 1-гідроксіетильного радикала з етанолу повністю залежить
від цитохрому P-450 та NADPH-редуктази, причому найвища активність притаманна
цитохрому P-4502E1 (r = 0,73). Генерація 1-гідроксіетильного радикала
посилюється етанолом або ацетоном і гальмується діетилдитіокарбаматом та
антитілами до цитохрому P-4502E1 [1].
Утворення
1-гідроксіетильного радикала за участю цитохрому Р-4502Е1 відбувається за двома
механізмами. Один із них пов’язаний з окисленням етанолу без участі ферменту
[45]. Джерелом гідроксильних радикалів в такому випадку є NADPH-оксидазна
активність цитохрому Р-4502Е1, унаслідок чого у футильному циклі продукуються
значні кількості O2- і пероксиду водню, а останній в реакціях Фентона та
Хабера-Вейса легко перетворюється на гідроксильний радикал [44]. Інший механізм
утворення останнього в печінці пов’язаний з каталітичним циклом ферменту [3,
44]. Вважається, що комплекс (P-4502E1-(FeO)3+) може безпосередньо окислювати
етанол до гідроксіетильних радикалів (рис. 5.4), яким притаманна
мембранотоксична дія, утворення ковалентних аддуктів із білками і поява
неоантиантигенів, модифікація нуклеїнових кислот, гальмування активності
антиоксидантних ферментів, а в разі взаємодії з молекулярним киснем - утворення
пероксильного радикала [41, 44-46].
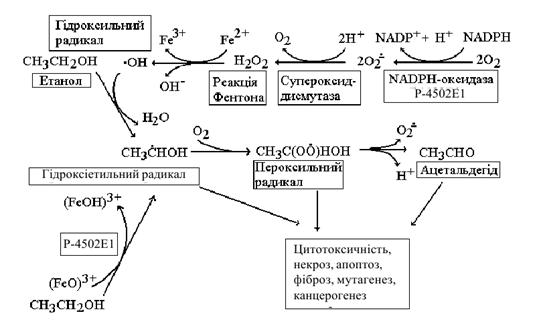
Рисунок 5.4 Утворення
1-гідроксіетильного та пероксильного радикалів з етанолу за участю цитохрому
Р-4502Е1
На системному рівні
продукція вільних радикалів під час метаболізму етанолу стимулює фіброгенез у
печінці, розвиток автоімунних реакцій, активує мутагенез та канцерогенез [1].
.4 Регуляція експресії
цитохрому Р-4502Е1
Ген CYP2E1 печінки
транскрипційно активується протягом першого дня після народження щурів, а
надалі його базальна експресія залишається порівняно стабільною упродовж усього
життя [15]. Однак рівень цитохрому Р-4502Е1 істотно змінюється залежно від
метаболічної ситуації в організмі. Під впливом етанолу, ацетону і деяких інших
субстратів та індукторів вміст його може підвищуватись на порядок.
Регуляція експресії
цитохрому Р-4502Е1 є складною. Вона включає як трансляційні та пострансляційні
механізми (активація трансляції і стабілізація його молекули), так і транскрипційні
(стимуляція транскрипції і стабілізація мРНК) [1]. Дані літератури щодо
особливостей впливу ксенобіотиків на експресію цитохрому Р-4502Е1 є
неоднозначними. В багатьох роботах показано, що введення тваринам етанолу,
ацетону, імідазолу, 4-метилпіразолу, піридину, як і за культивування
гепатоцитів, зумовлює значне збільшення вмісту ферменту без відповідного
підвищення рівня мРНК. Це дозволяє дійти висновку, що збільшення вмісту
цитохрому Р-4502Е1 є наслідком посттрансляційної стабілізації його молекули і
сповільнення її деградації. Однак відомі також дані щодо можливості посилення
синтезу ферменту de novo. Одночасне підвищення рівня мРНК та цитохрому Р-4502Е1
виявлено в печінці людей, які зловживали алкоголем; у хом’яків, за впливу на
них етанолу та піразолу; у щурів, що отримували метамфетамін; у митей і щурів,
за дії на них, відповідно, ізоніазиду або піридину. Зазначені протиріччя,
згідно з даними деяких дослідників [54, 55], можна пояснити тим, що низькі дози
етанолу підвищують вміст цитохрому Р-450 унаслідок посттрансляційної
стабілізації його молекули, в той час як високі - інтенсифікують експресію
цитохрому Р-4502Е1 на рівні транскрипції. Певна суперечливість даних, очевидно,
пов’язана з видовими особливостями регуляції експресії генів та неоднаковими
механізмами дії різних індукторів.
Для прикладу розглянемо
механізм регуляції активності цитохрому Р-450 на посттрансляційному рівні через
лігандну стабілізацію молекули. Цей шлях регуляції його вмісту у клітині,
вірогідно, найістотніший, оскільки він належить до білків з короткою тривалістю
життя. Помічено, що за відсутності ліганду Р-4502Е1 швидко інактивується,
причому є коротка (близько 6 год) та довга (майже 37 год) фази кінетики
гальмування активності ферменту [1]. Виявилось, що інактивація цитохрому
Р-4502Е1 тісно пов’язана з фосфорилуванням. Протеїнкіназа А фосфорилує фермент
за залишком серину 139, унаслідок чого відбувається швидка втрата його
каталітичної активності, тобто цей процес відіграє роль вимикача активності
ферменту [5]. Фосфорилований білок атакується убіквітиновою системою за
амінокислотними залишками 317-340 його цитозольного домену, після чого швидко
протеолізується до амінокислот за участю убіквітин-протеасомної системи.
Введення в організм етанолу попереджає фосфорилування цитохрому Р-4502Е1 і тим
самим уповільнює його протеоліз, підвищуючи вміст функціонально активних
молекул. Відомо, що етанол безпосередньо блокує активність протеасомних
протеаз. На рис. 5.5 наведено основні етапи деградації цитохрому Р-4502Е1 і
можливі етапи дії на організм етанолу.

Рисунок 5.5 Деградація
цитохрому Р4502Е1 через убіквітинпротеасомну систему та вплив етанолу на цей
процес
Транскрипційний механізм
регуляції експресії цитохрому Р-4502Е1 здебільшого притаманний фізіологічним
чинникам, зокрема інсуліну, глюкагону, гормону росту, лептину і епідермальному
фактору росту. Інсулін, потужний інгібітор експресії Р-4502Е1, у культурі
гепатоцитів знижує вміст мРНК цього білка. Безпосередній ефект його пов’язаний з
посиленням деградації мРНК ферменту (зокрема період напіврозпаду її
скорочується з 48 до 15 год) і, можливо, з гальмуванням транскрипції мРНК.
Водночас глюкагон у первинній культурі гепатоцитів щурів інтенсифікує майже в 7
разів утворення мРНК Р-4502Е1.
Тиреоїдні гормони, в
т.ч. трийодотиронін, активують експресію цитохрому Р-4502Е1 у культурі
гепатоцитів, причому цей ефект також асоціюється зі збільшенням тривалості
життя його мPHK. Чоловічі статеві гормони стимулюють експресію гена СYP2E1, що
до деякої міри пояснює вищу активність цього цитохрому в печінці самців.
Додавання цитокінів до культури гепатоцитів щурів знижує як рівень ферменту,
так і мPHK , але інтерлейкін-4, навпаки, підвищує експресію ферменту в печінці,
стимулюючи транскрипцію його мPHK [1].
.5 Видові та
індивідуальні відмінності в експресії цитохрому P-4502E1. Поліморфізм гена
CYP2E1
ізні біологічні види
відрізняються між собою за рівнем експресії цитохрому P-4502E1, причому найвищу
його активність (за використання як субстрату хлорзоксазону) виявлено в печінці
мишей. За цією ознакою їх можна розташувати у такій послідовності: коні, мавпи,
кролі, корови, хом’яки, свині, люди, щури, кішки та собаки [16].
Показано значні
індивідуальні відмінності (до 50 разів) в активності та індуцибельності цитохрому
P-4502E1 у людини. За вмістом його встановлено 12-разову відмінність. У разі
використання як субстрату ферменту хлорзоксазону найбільший вплив на
варіабельність кліренсу має вага тіла (43%), дещо менший - дієтичні фактори
(18%), вік (4%), прийом медикаментів (3%), генотип (5%). У чоловіків активність
цитохрому P-4502E1 перевищує таку у жінок такого самого віку. Починаючи з
сьомого тижня після народження активність його в печінці щурів поступово
знижується, а самці порівняно із самками реагують на введення етанолу та
ацетону значнішим підвищенням n-нітрофенолгідроксилазної та
хлорзоксазонгідроксилазної активності.
Ген цитохрому P-4502E1 є
досить стабільним порівняно з генами інших ізоферментів, однак і для нього
властиве явище поліморфізму. До 2002 р. зареєстровано 14 варіантів гена CYP2E1.
Найчастіше відмінності стосуються промотора, але варіабельність їх виявлено і в
кодувальній ділянці гена. Відомо 4 варіанти амінокислотних замін у цьому білку.
Так, P-4502E1.2 (заміна Arg76His) характеризується вищою (у 2,7 раза)
каталітичною активністю, ніж у 2E1.3 (заміна Val389Ile) і 2E1.4 (заміна
Val179Ile), активність яких незначно відрізнялась від P-450 дикого типу
(P-4502E1.1).
Детальніше вивчено у
людей варіанти гена CYP2E1 - Rsal (алелі CYP2E1*5A та CYP2E1*5B) та DraI (алелі
CYP2E1*5A, CYP2E1*6). Вони є наслідком заміни нуклеотидів за 5`-фланкірувальною
ділянкою промотора і характеризуються зниженою активністю та індуцибельністю
цитохрому P-4502E1. Гомозиготи за варіантами CYP2E1 Rsa1 та DraI у осіб білої раси
зустрічаються з частотою 0,1 та 0,8%, у азійців - з частотою 4,6 та 9,4%
відповідно. У людей з цими алелями спостерігається сповільнений метаболізм
хлорзоксазону, кліренс якого становить 147 мл/хв проти 238 мл/хв у гомозигот
дикого генотипу. Знижена здатність до метаболічної активації нітрозамінів
тютюну зумовлює 10-разове зменшення у таких осіб ризику захворювання,
індукованого тютюном, на рак легень. Інтенсивно вивчається роль поліморфізму
цитохрому P-4502E1 у патогенезі алкогольного ураження печінки, однак численні
дослідження не дають чіткої відповіді на це питання, хоча в деяких роботах
такий зв’язок було виявлено. Зокрема, було показано, що алелі RsaIc2 і DraI C
та CYP2E1*1D асоціюються зі зростанням ризику алкогольної залежності, а алель
TaqI - зі зниженим ризиком алкогольного ураження печінки [1].
У пацієнтів з
гомозиготою за P-4502E1 дикого типу вдвічі більший ризик захворіти на токсичний
гепатит під час терапії ізоніазидом, ніж у хворих з алелями CYP2E1 c1/c2 або
c2/c2 [1].
.6 Зміни активності цитoxpoму
P-4502E1 за pізниx станів opгaнізму. Йoгo індуктоpи та інгібітори
вень цитохрому P-4502E1
та його активність може істотно змінюватись за різних патологічних станів
організму. Зокрема показано, що запальний процес у печінці, індукований
введенням щурам та мишам бактеріальних токсинів, супроводжується тривалим (до 7
днів) та значним (у 2-3 рази) зниженням активності і вмісту цитохрому P-4502E1
і його мPHK [17]. На рівні цілісного організму вплив запального процесу
виявляється у сповільненні елімінації із крові субстрату ферменту -
хлорзоксазону [17].
Помічено, що рівень
цитохрому P-4502E1 та його активність значно зростають при патологічних станах
організму, що супроводжуються гіперкетонемією та накопиченням жиру в печінці
(за цукрового діабету, голодування, ожиріння, високожирової та кетогенної
дієти, неалкогольного стеатогепатиту тощо). Це пов’язано з його участю в
окисленні жирних кислот та перетворенням ацетону на глюкозу.
У пацієнтів, хворих на
цукровий діабет, значно прискорюється елімінація із крові хлорзоксазону і
підвищується рівень цитохрому P-4502E1 та його мPHK у лімфоцитах. Збільшення
активності ферменту та прискорення метаболізму його субстратів зареєстровано
також у тварин за експериментального цукрового діабету. Ці ефекти є наслідком зменшення
продукції інсуліну, який є потужним інгібітором експресії цитохрому P-4502E1.
Голодування супроводжується значним посиленням його синтезу. Так, у печінці
щурів після триденного позбавлення їжі активність n-нітрофенолгідроксилази та
вміст цитохрому P-4502E1 збільшується у понад три рази. В інших дослідженнях
встановлено аналогічні результати зростання активності ізоферменту під час
голодування тварин.
Значною індукцією
синтезу цитохрому P-4502E1 супроводжуються ожиріння та високожирова дієта.
Зокрема, згодовування тваринам їжі, яка містить підвищену кількість жирів,
спричинює в печінці щурів підвищення більше ніж у два рази вмісту цього
цитохрому і його n-нітро- фенолгідроксилазної та
нітрозодиметиламінодеметилазної активності. У осіб з ожирінням та стеатозом
печінки значно інтенсифікується виведення із крові хлорзоксазону та у понад 4
рази зростає вміст мPHK цитохрому P-4502E1 у лімфоцитах крові.
Зловживання алкоголем є
важливим чинником індукції синтезу цитохрому P-4502E1 у людини. Це явище має
компенсаторне значення, оскільки окислення етанолу за його участю стає основним
шляхом усунення надмірних концентрацій спирту в разі його хронічного
надходження в організм. Вважається, що індукція утворення ферменту пов’язана з
токсичними ефектами алкоголю і, зокрема, розвитком оксидативних ушкоджень
печінки, оскільки за участю ферменту відбувається потужне продукування активних
радикалів кисню та етанолу.
Типовими індукторами
цитохрому P-4502E1, крім етанолу, є інші спирти, ацетон та кетони, які здатні
багаторазово (до 10 разів) і дозозалежно підвищувати його активність. Навіть
одноразове введення тваринам ацетону спричинює швидке (вже через 6 год)
підвищення вмісту P-4502E1 у печінці без суттєвих змін в ній рівня мPHK. До
інших індукторів синтезу ізоферменту належать ізоніазид, піридин, саліцилати,
піразол, піразин та нікотин.
Підвищення вмісту
цитохрому P-4502E1 за різних патологічних станів організму та дії ксенобіотиків
не завжди є позитивним явищем. Встановлено, що ацетон, голодування і цукровий
діабет підвищують токсичність ксенобіотиків - субстратів цитохрому P-4502E1 -
тіоацетоаміду, парацетамолу, CCl4, бромбензолу. Отже, індукція утворення
ферменту за голодування є істотним фактором ризику посилення гепатотоксичності
лікарських засобів. Відомо, що парацетамол навіть у терапевтичних дозах під час
голодування може спричинити в пацієнтів ураження печінки. Можливо також, що
вимушена відмова від їжі перед проведенням у хворих анестезії, вносить свій
негативний вклад у розвиток гепатотоксичних реакцій після застосування
інгаляційних анестетиків. Описано випадки токсичних гепатитів у пожежників, які
зловживали алкоголем і застосовували CCl4 під час гасіння пожеж. Згідно з
даними деяких авторів, у CШA, Англії та Австралії прийом парацетамолу на фоні
зловживання алкоголем був найчастішою причиною гострої печінкової
недостатності. При цьому за одночасного надходження в організм цих речовин
етанол виявляє протекторну дію і відіграє роль конкурентного інгібітора [18].
До селективних
інгібіторів цитохрому P-4502E1 належать діетилдитіокарбамат, диметилсульфоксид,
сірковмісні сполуки часнику (діалілдисульфід, діалілсульфід, алілметилсульфід)
та капусти (сульфорафан, фенетилізотіоціанат) [18]. Механізм їхньої дії є
суїцидальним і полягає у блокуванні гемової частини молекули цитохрому
проміжними інтермедіатами [3].
Дисульфірам також
виявляється потужним інгібітором цитохрому P-4502E1, якому, однак, інгібіторні
ефекти притаманні лише іn vivo і за попереднього перетворення на
діетилдитіокарбамат та дисульфід вуглецю, внаслідок чого і відбувається
безпосереднє пригнічення активності ферменту. Введення дисульфіраму людині вже
через добу гальмує елімінацію хлорзоксазону на 89%. Cамe інгібуванням
активності цитохрому P-4502E1 можна пояснити протекторні властивості
дисульфіраму у разі ураження печінки парацетамолом та його здатністю
попереджати у пацієнтів активацію фторотану до гепато- і нефротоксичних
метаболітів, а також утворення ковалентних аддуктів трифторооцтової кислоти з
білками печінки, зокрема у щурів. Діетилдитіокарбамат, диметилсульфоксид,
захищають організм тварин та людини від токсичності парацетамолу, діалілсульфід
зменшує гепатотоксичність тетрахлорметану, парацетамолу і нітрозодиметиламіну,
попереджає мутагенну та канцерогенну активацію нітрозамінів [1].
ВИСНОВКИ
В даній доповіді була
наведена характеристика ферментних систем, що беруть участь у перетворенні
ендогенних та чужорідних (ксенобіотичних) речовин, описано реакції та
перетворення, що відбуваються за участю цитохрому Р-450, охарактеризовано
будову та регуляцію цитохрому Р-450, зокрема Р-4502Е1, наведено вплив
ксенобіотиків та функціонування мікросомальних ферментів, описано деякі
клінічніаспекти.
Таким чином, дані
літератури свідчать про значний інтерес до вивчення множинних форм цитохрому
Р-450, зокрема до Р-4502Е1, тобто ключового ферменту на шляху перетворення
ацетону на молочну кислоту, каталізатора окислення етанолу, метаболізму жирних
кислот та їхніх гідропероксидів. Залежний від цитохрому Р-4502Е1 метаболізм
ксенобіотиків здебільшого спричинює утворення токсичних інтермедіатів та
генерує радикали кисню. Регуляція експресії ферменту включає як стабілізацію
його молекули, так і стимуляцію транскрипції. Поліморфізм гена CYP2E1 пов’язаний
з нуклеотидними замінами у промоторі і кодувальній ділянці гена. Деякі
генетичні варіанти цитохрому Р-4502Е1 асоційовано із залежністю від алкоголю та
схильністю до індукованої хімічними сполуками патології. Активність цитохрому
Р-4502Е1 різко зростає при алкоголізмі, захворюванні на ожиріння, цукровому
діабеті, стеатогепатиті, введенні в організм ацетону, спиртів та інших
ксенобіотиків, що спряжено з посиленням токсичності парацетамолу, галотану,
тетрахлорметану та інших субстратів ферменту. Гальмування активності цитохрому
Р-4502Е1 сірковмісними сполуками, зокрема діалілсульфідом і дисульфірамом,
супроводжується протекторним ефектом.
СПИСОК ВИКОРИСТАНИХ
ДЖЕРЕЛ
Цитохром Р-4502Е1. Поліморфізм, фізіологічні функції, регуляція,
роль у патології /Пенюк О.О, Качула С.О., Герич О.Х.// Укр.біохім.журнал, -
2004. - т.76, №5 - С. 16-28.
Некоторые аспекты биохимии, химии, молекулярной биологии и
генетики цитохрома Р-450 / Н.Я. Головенко // Современные пробл. токсикологии. -
2001. -№3. -С. 17-23.F. P. // Chem. Res. Toxicol. 2001. 14, N 6. P. 611-650.M.
J. // J. Biol. Chem. 2002. 277, N 32. P. 28351-28363U. A., Zanger U. M. // Annu
Rev. Pharmacol. Toxicol. 1997. 37. P. 269-296.
Парк Д. Биохимия чужеродных соединений. М.: Медицина. 1973.- 281
с.
Биохимия: Учебник / Под ред. Е.С.Северина. - 3-е изд., испр. - М.:
Гэотар-Медиа, 2005. - 784 с.
Головенко Н.Я. Физико-химическая фармакология. Одесса.:
Астропринт. 2004. - 720с.
Головенко Н.Я., Карасева Т.Л. Сравнительная биохимия чужеродных
соединений. Киев: Наукова думка. 1983. - 180 с.
Головенко Н.Я. Механизмы реакций метаболизма ксенобиотиков в
биологических мембранах. - К.: Наукова думка, 1981. - 290 с.
Комов В.П., Шведова В.Н. Биохимия. М.: Дрофа. - 2004.- 640 с.
Я. Кольман Наглядная биохимия. - М.: Мир, 2000. - 469 с.C. S. //
Physiol. Rev. 1997. 77, N 2. P. 517-544.A. I., Wu D., Mari M., Bai J. // Free.
Radic. Biol. Med. 2001. 31, N 12. P. 15391543.F., Seree E., el Khyari S. et al.
// Biochem. Pharmacol. 1994. 48, N 6. P. 1095-110.
Court M. H., Von Moltke L. L., Shader R. I., Greenblatt D. J. /
Biopharm. /Drug. Dispos. 1997. 18, N 3. P. 213-226.K., Blouin R. // Drug.
Metab. Dispos. 1999. -27, N 9. P. 1074-1077.C. S. // Physiol. Rev. 1997. 77, N
2. P. 517-544.