Разработка методик качественного и количественного анализа действующих веществ экстракта плодов аронии черноплодной
Государственное
бюджетное образовательное учреждение высшего профессионального образования
«Сибирский государственный медицинский университет» Министерства
здравоохранения Российской Федерации
Фармацевтический
факультет
Кафедра
фармацевтической химии
Курсовая
работа
Разработка
методик качественного и количественного анализа действующих веществ экстракта
плодов аронии черноплодной
Студентка IV
курса
Фармацевтического факультета
Крюкова Е.А.
Руководитель: доцент кафедры фармацевтической
химии,
кандидат фармацевтических наук
Кадырова Т.В.
Томск - 2013
ОГЛАВЛЕНИЕ
Введение
Глава 1. Обзор литературы
.1 Плоды рябины черноплодной.
Характеристика ЛРС, применение в медицине
1.2 Физико-химические свойства
антоцианов, применение
Глава 2. Материалы и методы
исследования
Глава 3. Обсуждение результатов
.1 Получение водно-спиртового
экстракта
.2 Качественный анализ
.3 Количественный анализ
.4 Фракционирование органическими
растворителями
Выводы
Список литературы
ВВЕДЕНИЕ
арония
экстракт антоциан
Плоды аронии черноплодной (Aronia melanocarpa)
применяются в Российской Федерации в качестве поливитаминного средства.
Основной нормативный документ на данный вид сырья - фармакопейная статья ФС
42-66-87. Необходимость пересмотра устаревших методик определения качественного
и количественного состава очевидна. Это позволит не только повысить качество
продукции, но и заметно упростить анализ данного сырья. К тому же данная статья
предусматривает анализ только свежего сырья. Методики определения качества
сухих плодов вообще не приводится.
Для более детального изучения биохимического
состава плодов аронии предполагается использовать метод фракционирования,
основанный на различной растворимости каждой из групп биологически активных
соединений в определённых органических растворителях.
В соответствии с современными методологическими
подходами лекарственное растительное сырье целесообразно анализировать по
ведущей группе биологически активных веществ (БАВ), что продиктовано наибольшей
ее уязвимостью к технологическим стадиям заготовки и хранения сырья, а также
производства препаратов на его основе. Ведущей группой БАВ плодов аронии
черноплодной являются антоцианы, однако в ней присутствует и целый комплекс
других не менее полезных и активных соединений, которые ещё не совсем изучены.
Таким образом, целью данной работы является:
изучение качественного и количественного состава БАВ в экстракте плодов аронии
черноплодной.
Задачи:
1. Провести
анализ литературных данных.
2. Получение
водно-спиртового экстракта из плодов аронии.
3. Провести
качественный и количественный анализ полученного экстракта.
4. Разделение
на фракции экстракта плодов аронии, с использованием органических
растворителей.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Плоды рябины черноплодной. Характеристика
ЛРС, применение в медицине
Арония (рябина) черноплодная - Aronia
melanocarpa, относящаяся к семейству розоцветные - Rosaceae, представляет собой
Листопадный кустарник высотой до 3 м. Продуктивный возраст ветвей не более 10
лет. Восстановление куста происходит за счет ежегодно образующихся порослевых
побегов и корневых отпрысков. Однолетние побеги красно-бурые, побеги старшего
возраста темно-серые. Корневая система мощная, поверхностная, мочковатая,
состоит из вертикально и горизонтально расположенных корней.
Листья очередные, широкоовальные или
обратно-яйцевидные, длиной 4-8 см и шириной 3-5 см, простые, цельные, летом
ярко-зеленые, осенью красные; верхняя сторона листьев кожистая, глянцевая,
гладкая, темно-зеленая, нижняя - слабоопушенная с беловато-матовым оттенком.
Цветки собраны по 12-35 шт. в плотных щитовидных
соцветиях; лепестки белые или чуть розоватые. Цветет арония в мае-июне,
примерно через 2 недели после распускания листьев, цветение продолжается 12-15
дней. Позднее цветение аронии исключает возможность повреждения цветков
весенними заморозками, что обеспечивает ежегодное плодоношение этого растения.
Арония - самоопыляемое растение.
Плоды шаровидные или чуть вытянутые,
яблокообразные, до 1,5 см в диаметре, голые, черные, блестящие, иногда с сизым
налетом, реже темно-красные, сочные, кисловато-сладкие с вяжущим привкусом.
Плоды созревают в августе-сентябре, не осыпаются до заморозков.
Родиной этого растения является Северная
Америка, в России широко культивируется, благодаря своей неприхотливости и
зимостойкости интродуцирована почти во всех экологогеографических районах нашей
страны, даже в тех, где затруднено возделывание других плодово-ягодных культур
[1].
В свежих плодах содержатся гликозиды цианидина,
флаваноновый гликозид гесперидин, флавоноловый рутин, свободный кверцетин и
некоторые другие флавоноиды. Присутствуют катехины и дубильные вещества,
аскорбиновая кислота (около 110 мг/100 г), витамины B1, B6, Е, РР, органические
кислоты (0,8%), микроэлементы (соли молибдена, марганца, меди, бора),
каротиноиды и до 10% сахаров (глюкоза, фруктоза, сахароза). Основной химической
группой считают антоцины.
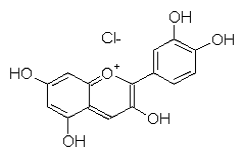

Антоцианы аронии черноплодной представлены
цианидином (рис.1) и его гликозидированными формами - цнанидин-3-гликозидом,
цианидин-3-5-диглюкозидом, цианидин-3-галактозидом. Из лейкоантоцианов в плодах
находится главным образом лейкоцианидин [5].
Свежие плоды назначают для профилактики
Р-витаминной недостаточности, лечения гипертонической болезни I и II стадии и
других заболеваний, сопровождающихся повышением артериального давления.
Принимают по 100 г 3 раза в день; курс лечения 10-30 дней. Сок аронии
черноплодной применяют в начальной стадии гипертонической болезни, при
кровотечениях различного происхождения, при атеросклерозе, анацидных гастритах.
Плоды аронии принимают при гепатитах, аллергиях, отравлениях. Плоды
противопоказаны больным с повышенной свертываемостью крови, а также при
язвенной болезни желудка и двенадцатиперстной кишки и гиперацидном состоянии
желудка.
Лечебные свойства плодов аронии сохраняются и
при их переработке. Выявлено, что в 3 столовых ложках (50 г сухих плодов)
черноплодной рябины заключено столько витамина Р, которое обеспечивает его
суточную дозу при этом авитаминозе. Вяжущий вкус черноплодки напоминает о том,
что она содержит много дубильных веществ, органических кислот и пектинов, а
значит, прекрасно влияет на пищеварение [4].
Так как черноплодная рябина содержит большое
количество органических кислот, при гиперацидном гастрите и язвенной болезни
желудка и двенадцатиперстной кишки ее употребляют умеренно и только вне
обострений. Также употребление плодов и сока лекарственной черноплодной рябины
противопоказано при язве 12-перстной кишки, язвенной болезни желудка, при пониженном
давлении, тромбофлебитах, частых запорах, пациентам с повышенной
свертываемостью крови [9].
1.2 Физико-химические свойства антоцианов,
применение
Антоцианами называют группы растительных
пигментов, обусловливающих окраску цветов, а также плодов и ягод. Они широко
распространены в растительном мире. Однако среди плодовых и ягодных растений
мало культур, которые характеризовались бы таким высоким содержанием
антоциановых пигментов, как арония черноплодная.
Строение антоцианов установлено в
1913 году немецким биохимиком Р. Вильштеттером
<#"816055.files/image003.gif">

Антоцианы являются гликозидами,
содержащими в качестве агликона-антоцианидина гидрокси- и метоксизамещённые
соли флавилия (2-фенилхроменилия), у некоторых антоцианов гидроксильные группы
ацетилированы. Углеводная часть связана с агликоном обычно в положении 3, у
некоторых антоцианов - в положениях 3 и 5, при этом в роли углеводного остатка
могут выступать как моносахариды глюкоза
<#"816055.files/image005.gif">

Где В - остаток тетраацетилглюкозы
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве объекта исследования использовали
сырьё, собранное в 2012 году культивируемое в Кемеровской области.
Для получения водно-спиртового экстракта был
использован метод мацерации с применением лабораторного реактора. Метод основан
на настаивании измельчённого сырья с соответствующим экстрагентом в течение
определённого времени [2]. Для ускорения процесса была применена турбо мешалка
и поддержание повышенной температуры с помощью паровой рубашки реактора.
Приборы: блок регулирования температуры
циркуляционный «МО1», мешалка верхнеприводная «RZR
2020», стеклянный реактор для лабораторного синтеза «Rad
Ceys».
Реактивы: спирт 70%, содержащий 1% кислоты
хлороводородной, вода дистиллированная, сухое измельчённое сырьё.
Далее проводился отгон спирта и концентрация
экстракта с добавлением горячей воды и осаждением смолистых веществ.
Приборы: роторный испаритель «Heidolph»,
вакумный насос для фильтрования.
Затем проводился анализ полученного
водно-спиртового экстракта по качественным и количественным характеристикам.
Определяли антоцианы, фенолкарбоновые кислоты, дубильные вещества, флавоноиды,
сумму фенольных соединений.
Реактивы: спирт 70%, раствор железоаммонийных
квасцов, раствор 10% средней соли ацетата свинца, раствор калий перманганата,
хлороводородная кислота, металлический цинк, порошок магния, 1% спиртовой
раствор щелочи, 0,5% растворо хлорного железа, 5% раствор алюминия хлорида, 1%
раствором желатина, 5% раствор калия бихромата, реактив Фолина-Дениса (смесь
фосфорномолибденовой и фосфорновольфрамовой кислот.
Использовали химическую посуду: пробирки,
часовые стёкла, колбы для титрования, делительные воронки и другое.
Проводили хроматографический анализ
методом тонкослойной хроматографии для качественного обнаружения антоцианов,
флавоноидов, фенольных соединений. Метод ТСХ основан на различии в скорости
перемещения компонентов смеси в плоском тонком слое (толщина 0,1-0,5 мм)
сорбента <#"816055.files/image007.gif">
.2 Качественный анализ
Определение фенольных соединенений
Б) Реакция с ацетатом свинца. К 1 мл извлечения
добавляли 2 мл раствора 2% уксусной кислоты и 1 мл раствора 10% средней соли
ацетата свинца. В уф свете наблюдалось ясно-голубое окрашивание [12].
Опеределение фенолкарбоновых кислот
Хроматографическое определение: 0,05 мл
спиртового извлечения наносили микропипеткой или микрокапилляром на линию
старта хроматографической бумаги EFN
- 12 (Германия) размером 60 х 9 см в виде тонкой линии 10мм, рядом наносили в
виде тонкой линии также в 10 мм 0,05 мл раствора достоверного образца кислоты
хлорогеновой. Хроматографическую бумагу с нанесенными пробами высушивали на
воздухе в течение 5 мин, затем помещали в камеру (предварительное насыщение
камеры не менее суток), содержащую 70% раствор кислоты уксусной и
хроматографировали восходящим способом. Когда фронт растворителей прошел 58 см,
хроматографическую бумагу вынимали из камеры, высушивали в вытяжном шкафу в
течение 10 мин и просматривали в УФ-свете при длине волны 360 нм (рис. 3). На уровне
пятна достоверного образца хлорогеновой кислоты должно наблюдаться пятно
желтого цвета, которое и было нами идентифицировано. При этом допустимо наличие
других пятен.
Опеределение флавоноидов
А) Проба Синода. Взяв три пробирки с одинаковым
количеством полученного экстракта (1 мл), в них прибавляли по 5 капель
концентрированной кислоты хлористоводородной. Затем в одну из пробирок
добавляли несколько крупинок металлического цинка, во вторую - порошок магния,
в третьей оставался только фильтрат. Все пробирки нагревали на водяной бане до
кипения и оставляли для охлаждения на 5-10 минут. О присутствии в извлечении
флавоноидов свидетельствует окраска продукта реакции, которая зависит от группы
флавоноидов. Третья пробирка контрольная: появление розового или красного
окрашивания в ней указывает на наличие антоциановых пигментов, халконов и
ауронов.

Рисунок 3 - Схема хроматограммы на бумаге на ФКК
в плодах аронии черноплодной (система: 70% раствор кислоты уксусной): 1 - известный
образец (хлорогеновая кислота); 2 - спиртовое извлечение плодов аронии
черноплодной.
Б) Реакция со щелочью. К 0,5 мл полученного выше
спиртового извлечения добавляли несколько капель 1% спиртового раствора щелочи.
Флавоны и флавонолы растворяются в щелочах с образованием желтой окраски.
Антоцианы дают синее или фиолетовое окрашивание.
В) Проба с 0,5% раствором хлорного железа. К 0,5
мл полученного выше спиртового экстракта добавляли 1-2 капли раствора хлорного
железа. Давать окраску с хлорным железом - общее свойство полиоксифенольного
соединения. Ортооксифенольные группы в молекулах флавоноидов обуславливают
зеленую, а триоксифенольные группы - синюю окраску.
Г) Проба с алюминия хлоридом. К 1 мл спиртового
извлечения добавляли 3-5 капель 5% спиртового раствора реактива. При наличии
флавоноидов появляется грязно-желтое окрашивание [5, 12].
Д) Хроматографическое определение. Испытуемый
раствор. Около 2,0г сырья, измельченного до величины частиц, проходящих сквозь
сито с отверстиями диаметром 1 мм, помещали
в коническую колбу со шлифом вместимостью 100 мл,
прибавляли 20 мл 95 % спирта
этилового, закрывали пробкой и перемешивали в течение 30 мин на встряхивающем
аппарате. После охлаждения извлечение фильтровали через бумажный фильтр.
На линию старта хроматографической пластинки со
слоем силикагеля, на алюминиевой подложке, высокоэффективной (ПТСХ-АФ-В или
аналогичного качества), размером 100×100
мм,
проведенную на расстоянии 1,5 - 2 см от нижнего края пластинки, микропипеткой
наносили 0,02 мл извлечения в виде пятна диаметром около 5 мм. В качестве
заведомо известных веществ сравнения наносили по 0,02 мл растворы рутина и
кверцетина также в виде пятен диаметром около 5мм. Пластинку с нанесенными
пробами высушивали на воздухе при комнатной температуре, затем помещали в
хроматографическую камеру (выложенную изнутри фильтровальной бумагой,
предварительно насыщенную не менее 24 часов) с верхним слоем смеси
растворителей: н-бутанол - ледяная уксусная кислота - вода (4:1:2) и
хроматографировали восходящим методом.
Когда фронт растворителей прошел не менее 8 см
от линии старта, пластинку вынимали из камеры, высушивали в вытяжном шкафу при
комнатной температуре до удаления следов растворителей и просматривали в
видимом и УФ - свете.
На хроматограмме испытуемого раствора на уровне
пятна достоверного образца рутина обнаруживали зону адсорбции в виде пятна
желтого цвета, которая полностью совпадала с зоной адсорбции спиртового
извлечения из плодов аронии черноподной (Rf
- 0,57). При этом допускается обнаружение дополнительных зон (рис. 4).

Рисунок 4 - Схема ТСХ на флавоноиды в плодах
аронии черноплодной (система: н-бутанол - кислота уксусная ледяная - вода
(4:1:2)): 1 - известный образец раствора рутина; 2 - известный образец раствора
кверцетина; 3 - спиртовое извлечение плодов аронии черноплодной.
Определение дубильных веществ
А) Осаждение 1% раствором желатина: к 2 мл
испытуемого раствора добавляли по каплям 1% раствор желатина в 10% растворе
натрия хлорида. При наличии дубильных веществ появляется осадок, исчезающий при
добавлении избытка желатина.
Б) Реакция с калия дихроматом: к 3-5 мл
извлечения добавляли 2-3 капли 5% раствора калия бихромата. При наличии
таннидов наблюдается потемнение раствора или выпадение желто-коричневого осадка.
В) Реакция с реактивом Фолина-Дениса (смесь
фосфорномолибденовой и фосфовольфрамовой кислот). К 3-5 мл извлечения добавляли
3-5 капель реактива Фолина-Дениса и небольшое количество натрия карбоната. При
наличии таннидов образуется вольфрамовая или молибденовая синь. Окраска
устойчива. Эта реакция может быть использована для количественного определения
дубильных веществ [5, 12].
Опеределение антоцианов
А) К 1 мл
испытуемого раствора прибавляли 1 мл
1 % кислоты хлористоводородной, раствор окрашивался в интенсивно красный цвет.
Б) В пробирку помещали 0,5 мл извлечения и
добавляли 0,5 мл 10% раствора натрия гидроксида. В присутствии антоцианов
появлялось окрашивание сине-зеленого цвета.
В) Метод ТСХ. На линию старта хроматографической
пластинки со слоем силикагеля, на алюминиевой подложке, высокоэффективной
(ПТСХ-АФ-В или аналогичного качества), размером 100×100
мм,
проведенную на расстоянии 1,5 - 2 см от нижнего края пластинки, микропипеткой
наносили 0,02 мл извлечения в виде пятна диаметром около 5мм. Пластинку с
нанесенными пробами высушивали на воздухе при комнатной температуре, затем
помещали в хроматографическую камеру (выложенную изнутри фильтровальной
бумагой, предварительно насыщенную не менее 24 часов) с верхним слоем смеси
растворителей: н-бутанол - кислота уксусная ледяная - вода (4:1:2) и
хроматографировали восходящим методом.
Когда фронт растворителей прошел не менее 8
см
от линии старта, пластинку вынимали из камеры, высушивали в вытяжном шкафу при
комнатной температуре до удаления следов растворителей и просматривали в
видимом свете.
На хроматограмме испытуемого раствора наблюдали
зону адсорбции фиолетового цвета с величиной Rf
около 0,35 (цианидин - 3-О- глюкозид); возможно присутствие розового пятна с
величиной Rf около 0,5
(гликозид мальвидина); допускается обнаружение дополнительных зон (рис. 5).
Известно также, что в данной системе
растворителей стандартный образец цианидин-3-О- глюкозида дает Rf
- 0,35.Это дает нам возможность утверждать, что в извлечениях из плодов аронии
черноплодной присутствует данное вещество.
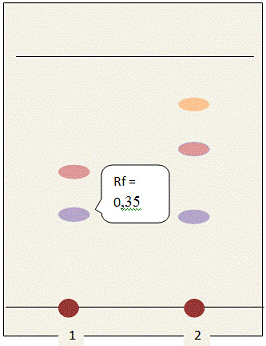
Рисунок 5 - Схема ТСХ на антоцианы в плодах
аронии черноплодной
(система: н-бутанол - кислота уксусная ледяная -
вода (4:1:2)):
- спиртовое извлечение плодов аронии
черноплодной;
- спиртовое извлечение черники обыкновенной
Для уточнения данных нами была использована ТСХ
не только для плодов аронии черноплодной, но и для плодов черники обыкновенной,
для которой известно из литературных данных значение Rf
для цианидин-3-О-глюкозида, равное 0,35. Для этого, из плодов черники
обыкновенной было получено спиртовое извлечение аналогично методике для плодов
аронии и проведена ТСХ паралельно этих двух извлечений на одной
хроматографической пластинке. По результатам хроматограммы в тонком слое
сорбента были идентифицированы фиолетовые пятна, с величиной Rf
= 0,35 как у плодов аронии, так и у плодов черники обыкновенной, что позволяет
нам судить о наличие цианидин-3-О-глюкозида в плодах аронии (рис. 5).
Таблица полученных результатов качественного
определения (табл.1)
Таблица 1. Качественный анализ экстракта
|
Исследуемые
вещества
|
Наличие
веществ в экстракте
|
|
Фенольные
соединения
|
+
|
|
Фенолкарбоновые
кислоты
|
+
|
|
Флавоноиды
|
+
|
|
Дубильные
вещества
|
+
|
|
Антоцианы
|
+
|
4.2 Количественный анализ
Определение суммы флавоноидов
Определяли спектрофотометрическим методом с
использованием комплексообразующей реакции с алюминия хлоридом [5,12].
Показания снимали в УФ-области при длине волны 410 нм.
Количественное содержание флавоноидов в
пересчёте на рутин и абсолютно сухое сырьё колебалось в пределах от 5,20% до
5,80%.
Определение дубильных веществ
Использовали методику, предложенную
Г.М.Федосеевой с соавторами, в которой проведено осаждение дубильных веществ
раствором желатина и повторное титрование фильтрата калия перманганатом. По
разнице объемов титрования рассчитывали содержание в сырье дубильных веществ
[5,12].
Методика определения. Около 3,0 г (точная
навеска) измельченного сырья, просеянного сквозь сито с диаметром отверстия 1
мм, помещали в коническую колбу вместимостью 250 мл, заливали 100 мл 40% спирта
и кипятили с обратным холодильником на водяной бане в течение 30 минут.
Экстракцию проводили повторно для более полного истощения сырья. Извлечение
охлаждали до комнатной температуры и процеживали в мерную колбу вместимостью
250 мл, доводили до метки водой (раствор А).
1) 10
мл раствора А помещали в колбу для титрования вместимостью 500 мл, прибавляли
250 мл воды, 10 мл раствора индигосульфокислоты и титровали перманганатом калия
(0,02 моль/л) до золотисто желтого окрашивания при постоянном перемешивании.
Параллельно проводили контрольный опыт
(определяли индиго число). Брали 10 мл индигосульфокислоты, прибавляли 250 мл
воды и титровали калия перманганатом (0,02 моль/л) до золотисто желтого
окрашивания при постоянном перемешивании.
мл раствора калия перманганата (0,02 моль/л)
соответствует 0,004157г окисляемых веществ в пересчете на танин.
Содержание суммы полифенолов в пересчете на
абсолютно сухое сырье в процентах (Х) вычисляли по формуле:
х = 
 , где
, где
V - объем экстракта,
взятый для титрования, в миллилитрах;
V1 - объем раствора
калия перманганата (0,02 моль/л), пошедший
на титрование извлечения, в миллилитрах;
V2 - объем раствора
калия перманганата (0,02 моль/л), израсходованное на титрование в контрольном
опыте, в миллилитрах;
V3 - общий объем
извлечения, в миллилитрах;
К - 0,004157 - количество окисляемых веществ,
соответствующее 1 мл раствора калия перманганата (0,02 моль/л) в пересчете на
танин, в граммах;
m - масса навески
сырья, в граммах;
W - потеря в массе
при высушивании сырья, в %.
) 10 мл раствора А помещали в колбу
вместимостью 100 мл, добавляли 2 мл 1% раствора желатина, выпавший осадок
центрифугировали и отфильтровывали. 10 мл фильтрата помещали в колбу для
титрования вместимостью 500 мл, прибавляли 250 мл воды, 10 мл
индигосульфокислоты и титровали при постоянном перемешивании раствором калия
перманганата (0,02 моль/л) до золотисто-желтого окрашивания.
Содержание суммы полифенолов после осаждения
дубильных веществ в пересчете на абсолютно сухое сырье в процентах (Х)
вычисляли по формуле аналогично как в определении 1.
Содержание дубильных веществ в сырье (X)
рассчитывали по разнице между данными определения 1 и 2.
Определение антоцианов
Использовали прямой спектрофотометрический метод
в видимой области. Метод заключается в непосредственном измерении оптической
плотности, что стало возможным благодаря наличию сопряженных двойных связей в
молекулах антоцианов. Исследование проводили, опираясь на методику
количественного определения антоцианов в плодах черники обыкновенной [12].
Содержание суммы антоцианов (в %) в плодах
аронии черноплодной в пересчете на цианидин-3-О-глюкозид и абсолютно сухое
сырье (Х) вычисляют по формуле:

 , где
, где
А - оптическая плотность испытуемого
раствора;
m - масса
сырья, в граммах;
- удельный показатель поглощения
цианидин-3- О - глюкозида;
W - потеря в
массе при высушивании, в %.
Количественное содержание антоцианов
колебалось в пределах от 6,4% до 11,62%.
Таблица сводных результатов
количественного определения (табл.2)
Таблица 2. Количественный анализ
экстракта
|
Исследуемые
вещества
|
Содержание
в экстракте
|
|
Сумма
флавоноидов
|
5,20
- 5,80%.
|
|
Дубильные
вещества
|
3,62
- 4,07%.
|
|
Антоцианы
|
6,4
- 11,62%
|
4.3 Фракционирование органическими
растворителями
Схема фракционирования представлена следующим
образом:

Методика: 100 мл экстракта помещали в колбу,
добавляли 50мл органического растворителя и экстрагировали в течении 10 минут.
Затем помещали в делительную воронку до расслоения жидкости на фазы. Отдельно
сливали фазу органического растворителя и экстракт. Процедуру повторяли до
обесцвечивания растворителя.
В дальнейшем планируется детальное изучение
полученных фракций, с целью установления более точного химического состава и
определения его фармакологических свойств.
ВЫВОДЫ
. Проведен анализ литературных данных.
. В ходе экспериментальной работы был
получен водной-спиртовой экстракт плодов аронии черноплодной методом мацерации
с использованием лабораторного реактора.
. В плодах аронии с помощью известными
методик установлено наличие фенольных соединений, фенолкарбоновых кислот,
дубильных веществ, флавоноидов и антоцианов. Спектрофотометрическими и
титриметрическими методами проведён количественный анализ экстракта
. С помощью органических растворителей
получены фракции водно-спиртового экстракта плодов аронии черноплодной, которые
планируется в дальнейшем изучить и установить химический состав.
ЛИТЕРАТУРА
. Муравьёва,
Д.А. Фармакогнозия / Д.А. Муравьёва, И.А. Самылина, Г.П. Яковлев. - М.:
Медицина, 2002. - 656 с.
2. Технология
лекарственных форм. Учебник в 2-х томах. Том 2 / Р.В. Бобылев, Г.П. Грядунова,
Л.А. Иванова и др.; под ред. Л.А. Ивановой. - М.: Медицина, 1991. - 544 с.
. Методы
фармакогностического анализа лекарственного растительного сырья. В 2-х ч. Ч.
II. Химический анализ: учебное пособие / Е.Н.Сальникова, Г.И.Калинкина,
Н.В.Исайкина и др./ - Томск: СибГМУ, 2008. - 55с.
. Муравьева
Д. А. Фармакогнозия / Д.А.Муравьева, И.А.Самылина, Г.П.Яковлев.-Москва:
Медицина,2002.-462с.
5. Википедия
[Электронный ресурс]: виртуальная энциклопедия / Арония черноплодная. -
Электрон. дан. - Режим доступа: <http://ru.wikipedia.org/wiki/>арония. -
Загл. с экр.
. Государственная
фармакопея СССР. Вып.1. Общие методы анализа / МЗ СССР.-11-е изд., доп.- М:
Медицина,1987.- 336 с.
. Государственная
фармакопея СССР. Вып.2. Общие методы анализа. Лекарственное растительное сырье
/ МЗ СССР.-11-е изд., доп.- М: Медицина,1989.- 400 с.
. Химик.
Сайт о химии [Электронный ресурс] / Антоцианы. - Электрон. дан. - Режим доступа:
http://www.xumuk.ru/encyklopedia/337.html . - Загл. с экр.
. Качество.
Потребительские обзоры [Электронный ресурс] / Черноплодная рябина: полезные
свойства. - Электрон. дан. - Режим доступа:
<http://www.kachestvo.ru/interesno/chernoplodnaja-rjabina-poleznye-svojjstva.html>.
- Загл. с экр.