Химия и биологическая роль элементов IIIБ – VБ групп
ГБОУ ВПО ОрГМА МИНЗДРАВА РОССИИ
КАФЕДРА
ХИМИИ И ФРМАЦЕВТИЧЕСКОЙ ХИМИИ
РЕФЕРАТ
Химия
и биологическая роль элементов IIIБ - VБ групп
Выполнила: студентка 105 группы
лечебного факультета
Сагеева С.У
Проверила: Шарапова Н.В.
Оренбург,
2013
1. Общая характеристика, краткие сведения об
истории открытия элементов и их распространённости в природе
К химическими элементам IIIБ - VБ групп относят
: подгруппу IIIБ (скандий, иттрий, лантан, актиний), подгруппу IVБ (титан,
цирконий, гафний), подгруппу VБ (ванадий, ниобий, тантал, протактиний).
Биогенными элементами являются лантан, титан,
ванадий.
Лантан - элемент побочной подгруппы третьей
группы шестого периода периодической системы химических элементов Д. И.
Менделеева, атомный номер 57. Относится к редкоземельным элементам. Природный
лантан состоит из двух изотопов 139La (99,911 %) и радиоактивного 138La
(0,089%; Т1/2 2.1011 лет). Обозначается символом La (лат. Lanthanum).
Конфигурация двух внешних электронных слоев 5s2p6d16s2. Простое вещество лантан
- металл серебристо-белого цвета.
Лантан, как химический элемент, не удавалось
открыть на протяжении 36 лет. В 1803 г. 24-летний шведский химик Йёнс Якоб
Берцелиус исследовал минерал, известный теперь под названием церита. В этом
минерале была обнаружена иттриевая земля и ещё одна редкая земля, очень похожая
на иттриевую. Её назвали цериевой. В 1826 г. Карл Мозандер исследовал цериевую
землю и заключил, что она неоднородна, что в ней, помимо церия, содержится ещё
один новый элемент. Доказать сложность цериевой земли Мозандеру удалось лишь в
1839 г. Он сумел выделить новый элемент, когда в его распоряжении оказалось
большее количество церита. Металлический лантан, разумеется, далеко не чистый,
впервые был получен Мозандером при нагревании хлористого лантана с калием.
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса
назвали лантаном. Оно было дано в честь истории его открытия и происходит от
др.-греч. λανθάνω
- «скрываюсь», «таюсь».
Содержание лантана в земной коре колеблется в
пределах 18 - 30 г/т, в воде океанов 0,012 мкг/л.
Получение лантана связано с разделением
исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом
и неодимом. Сначала из смеси отделяют церий, затем оставшиеся элементы
разделяют экстракцией
Титан - элемент побочной подгруппы четвёртой
группы, четвёртого периода периодической системы химических элементов Д. И.
Менделеева. Обозначается символом Ti (Titanium). Порядковый номер 22, атомный
вес 47,90. Состоит из 5 устойчивых изотопов; получены также искусственно
радиоактивные изотопы. Электронное строение атома 1s22s22p63s23p63d24s2
В 1791 году английский химик У. Грегор нашёл в
песке из местечка Менакан (Англия, Корнуолл) новую «землю», названную им
менакановой. В 1795 году немецкий химик М. Клаирот открыл в минерале рутиле
неизвестную еще землю, металл которой он назвал Титан [в греч. мифологии титаны
- дети Урана (Неба) и Геи (Земли)]. В 1797 году Клапрот доказал тождество этой
земли с открытой У. Грегором. Чистый титан выделен в 1910 году американским
химиком Хантером посредством восстановления четырёххлористого титана натрием в
железной бомбе.
Титан редкий и рассеянный элемент. Содержание
титана в земной коре около 0,61% по массе. Для титана характерна миграция в
горячих подземных водах вместе с цинком и концентрация в гидротермальных
месторождениях. В биосфере известен 1 очень редкий самостоятельный минерал
титана рутил TiO2.
Как правило, исходным материалом для
производства титана и его соединений служит диоксид титана со сравнительно
небольшим количеством примесей. В частности, это может быть рутиловый
концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в
мире весьма ограничены, и чаще применяют так называемый синтетический рутил или
титановый шлак, получаемые при переработке ильменитовых концентратов.
Для получения титанового шлака ильменитовый
концентрат восстанавливают в электродуговой печи, при этом железо отделяется в
металлическую фазу (чугун), а не восстановленные оксиды титана и примесей
образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или
сернокислотным способом.
Концентрат титановых руд подвергают
сернокислотной или пирометаллургической переработке. Продукт сернокислотной
обработки - порошок диоксида титана TiO2. Пирометаллургическим методом руду
спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
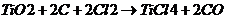
Образующиеся пары TiCl4 при 850 °C
восстанавливают магнием:
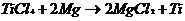
Полученную титановую «губку» переплавляют
и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из
TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или
плазменную переработку.
Ванадий - элемент побочной подгруппы
пятой группы, четвёртого периода периодической системы химических элементов Д.
И. Менделеева, с атомным номером 23. Обозначается символом V (лат. Vanadium).
Простое вещество ванадий - пластичный металл серебристо-серого цвета.
Электронное строение атома 1s22s22p63s23p63d34s2.
Ванадий назван в честь богини
красоты древних скандинавов - легендарной Фреи Ванадис. Это имя элементу дал в
1831 г. Гавриил Сефстрем, профессор Горного института в Стокгольме. Он выделил
элемент из шлака, получающегося при плавке руды в доменных печах. Работу Г.
Сефстрем осуществил вместе со своим учеником Иоганном Якобом Берцелиусом.
Объективность требует сказать, что
до Г. Сефстрема этот элемент уже был выделен, и даже не один, а два раза. В
1801 г. мексиканский минералог Андрес Мигуэль дель Рио обнаружил в бурой
свинцовой руде не встречавшийся прежде элемент и назвал его «эритронием».
Однако он усомнился в своих выводах и решил, что имеет дело с недавно открытым
хромом, поэтому не обнародовал своей находки. Чуть раньше Г. Сефстрема к
открытию этого элемента подошел Фридрих Вёлер, тот самый, с именем которого
связывают первый в истории синтез органического вещества в лаборатории. Ф.
Вёлер исследовал привезенные из Мексики руды (с которыми имел дело и Дель Рио)
и обнаружил в них нечто необычное, но тут он некстати заболел, а когда
возобновил работу и определил, что имеет дело с новым элементом, то было уже
поздно - Г. Сефстрем к этому времени опубликовал известие о своем открытии.
Таким образом, честь открытия ванадия оставалась за Г. Сефстремом.
Ф. Велер же, «прозевавший» ванадий,
так написал другу о своей неудаче: «Я был настоящим ослом, проглядев новый
элемент в бурой свинцовой руде, и прав был Берцелиус, когда он не без иронии
смеялся над тем, как неудачно и слабо, без упорства, стучался я в дом богини
Ванадис» .
Однако на самом деле Сефстрем
выделил из шлака не чистый металл, а твердые и жаростойкие его соединения -
карбиды ванадия. Он получил порошок черного цвета, а в чистом виде ванадий -
ковкий металл светло серого цвета. Но это выяснилось лишь после 1667 г. (т. е.
более тридцати лет спустя после открытия Г. Сефстрема), когда ванадий и его
соединения как следует изучили Генри Энфильд Роско и Эдуард Горне. В 1869 г. Г.
Роско удалось впервые получить ванадий 96-процентной чистоты. Металл оказался
хрупким и твердым, но только, что несколькими строчками выше говорилось, что
ванадий - ковкий, а не хрупкий. Противоречия здесь нет. По мере удаления
оставшихся 4% примесей ванадий становится все более пластичным и ковким.
Впервые чистый ванадий получен в 1927 г.
На его долю приходится пять из
каждых ста тысяч атомов земной коры. Однако число богатых месторождений
невелико. Первое из них было обнаружено в 1902г. в Испании - ванадий
сопутствовал свинцу. Исключительной по своему содержанию является руда,
добываемая на высоте 4700 м в Перу: она состоит из сульфида ванадия - V2S5. При
обжиге получается одновременно два нужных экономике продукта: оксид серы (IV),
необходимый для получения серной кислоты, и ванадий - для оборонной
промышленности. Ведь ванадий - стратегическое сырье, без него не обходится
производство специальных сортов стали.
Всего известно более 65 минералов,
включающих ванадий. Интересной особенностью распространения этого элемента
является его содержание в ископаемых растительного происхождения: углях, нефти,
горючих сланцах и др. Вода морей содержит 0,3 г ванадия на 1000 т, и некоторые
обитатели морей (морские ежи, голотурии) включают его в состав своего
организма.
Долгое время не получали чистый
ванадий, а когда это произошло, то оказалось, что свойства даже 96% ванадия
резко отличаются от свойств 100 %. Это металл серебристо-серого цвета, ковкий и
пластичный. При температуре, близкой к абсолютному нулю (4,3 К), обладает
сверхпроводимостью. Однако даже небольшие примеси кислорода, азота или водорода
делают металл твердым и хрупким, как бы переводя его из типичного металла в
нетипичный. В таком изменении свойств есть своя логика: по мере того как он все
более насыщается кислородом и переходит от VO к V2O5, его металлический
характер меняется на неметаллический.
Процесс получения чистого ванадия
довольно сложный. Сначала стремятся получить его оксид (V2O5 или V2O3) или
галогенид (VС13 или VI3), а затем применяют либо металлотермию:
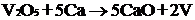
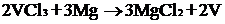
либо восстановление углем в вакууме:
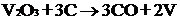
либо термическую диссоциацию в
вакууме на горячей проволоке:
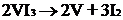
Последним способом получают металл
высокой чистоты.
2. Изменение в группах величины радиуса атомов и
ионов, потенциала ионизации
Если рассматривать относительные величины
атомных радиусов, то легко обнаружить периодичность их зависимости от номера
элемента.
В периодах орбитальные атомные радиусы по мере
увеличения заряда ядра в общем монотонно уменьшаются из-за роста степени
взаимодействия внешних электронов с ядром.
В группах радиусы в основном увеличиваются из-за
возрастания числа электронных оболочек.
У s- и p-элементов изменение радиусов как в
периодах, так и в подгруппах более ярко (в периоде атомные радиусы
уменьшаются), чем у d- и f-элементов, поскольку d- и f-электроны внутренние. У
d- и f-элементов кривая изменения радиусов атомов по периоду имеет более плавный
характер. Уменьшение радиусов у d- и f-элементов в периодах называется d- и
f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных
аналогов d-элементов пятого и шестого периодов практически одинаковы.
Размеры атомов следуют периодичности системы
Менделеева. Исключения составляют элементы от № 57 (лантан) до №71 (лютеций),
где радиусы атомов не увеличиваются, а равномерно уменьшаются (так называемое
лантаноидное сжатие), и элементы от № 89 (актиний) и дальше (так называемое актиноидное
сжатие).
Таблица 1
|
Химический
элемент
|
Атомный
радиус
|
|
IIIБ
|
|
Скандий
|
184
· 10 − 12 (Метр)
|
|
Иттрий
|
212
· 10 − 12 (Метр)
|
|
Лантан
|
187
• 10 − 12 (Метр)
|
|
Актиний
|
188
• 10 − 12 (Метр)
|
|
IVБ
|
|
Титан
|
176
· 10 − 12 (Метр)
|
|
Цирконий
|
206
· 10 − 12 (Метр)
|
|
Гафний
|
208
· 10 − 12 (Метр)
|
|
VБ
|
|
Ванадий
|
171
· 10 − 12 (Метр)
|
198
· 10 − 12 (Метр)
|
|
Тантал
|
200
· 10 − 12 (Метр)
|
|
Проактиний
|
161•
10 − 12 (Метр)
|
Следовательно, в IIIБ - VБ подгруппах
периодической системы химических элементов Д.И. Менделеева в вертикальном
направлении сверху вниз радиус атома химических элементов увеличивается, за
исключением лантана, актиния и проактиния.
В группах (в подгруппах s- и p-элементы) сверху
вниз энергия ионизации уменьшается. Это обусловлено увеличением радиусов
атомов: чем больше размер атома, тем легче от него оторвать электрон, тем
меньше значение энергии ионизации.
В подгруппах d-элементов, кроме подгруппы
скандия (IIIБ), как правило, сверху вниз повышается. Например:
Ø V I1=6,74 ЭВ/атом.
Ø Nb I1=6,88 ЭВ/атом.
Ø Ta I1=7,88 ЭВ/атом.
Повышение энергии ионизации в подгруппах d-элементов
вызвано эффектом проникновения электронов к ядру. Согласно квантовой теории
внешние электроны проникают ближе к ядру под d-подуровень.
Это приводит к повышению прочности связи внешних электронов с ядром.
Таблица 2( Энергии ионизации нейтральных атомов
DЕ (М®М+))
|
Химический
элемент
|
Энергия
ионизации, кДж/моль
|
|
IIIБ
|
|
Скандий
|
631
|
|
Иттрий
|
616
|
|
Лантан
|
538.1
|
|
Актиний
|
499
|
|
IVБ
|
|
Титан
|
658
|
|
Цирконий
|
660
|
|
Гафний
|
642
|
|
VБ
|
|
Ванадий
|
650
|
|
Ниобий
|
664
|
|
Тантал
|
761
|
|
Проактиний
|
568
|
. Устойчивые степени окисления элементов IIIБ -
VБ групп в соединениях
В пределах одной декады переходных элементов
(например, от скандия до цинка) максимальная устойчивая степень окисленности
элементов сначала возрастает (благодаря увеличению числа d-электронов,
способных участвовать в образовании химических связей), а затем убывает
(вследствие усиления взаимодействия d-электронов
с ядром по мере увеличения его заряда). Так, максимальная степень окисленности
скандия, титана, ванадия, хрома и марганца совпадает с номером группы, тогда
как для железа она равна 6 ,для кобальта, никеля и меди - трём, а для цинка -
двум. В соответствии с этим изменяется и устойчивость соединений, отвечающих
определённой степени окисленности элемента. Например, оксиды ТiO
и VО, содержащие титан
и ванадий в степени окисления +2, - сильные восстановители, а аналогичные
оксиды меди и цинка (Cuo
и ZnO) восстановительных
свойств не проявляют
Наиболее устойчивая степень окисления лантана в
соединениях +3 (валентность III).
Наиболее устойчивая степень окисления титана в
соединениях является +4.
Титан принадлежит к металлам. Имеет степени
окисления +2,+3,+4. Титан типичный металл, так как он очень сильный
восстановитель: на внешнем четвертом энергетическом уровне 4s2, элемент имеет 2
электрона, которые при соединении с неметаллами он отдает. При этом он может
отдать еще 2 электрона с 3d подуровня и тем самым получить устойчивую
структуру.
Наиболее устойчивая степень окисления ванадия в
соединениях +4.
Ванадий считают как бы связующим между
элементами первой и побочной подгрупп V группы. Его химия напоминает химию
подгруппы азота тем, что в степени окисления +5 ванадию соответствует кислота
НVО3, гораздо более устойчивая, чем кислоты сурьмы и висмута - членов главной
подгруппы. В то же время этот элемент образует простое вещество, которое,
подобно другим членам побочной подгруппы, является типичным устойчивым
тугоплавким металлом.
По количеству степеней окисления ванадий
напоминает азот. Ни у кого из его аналогов (ни у ниобия, ни у тантала) нет
такого количества степеней окисления, как у ванадия. Точно известны четыре его
состояния: +2, +3, +4 и +5. У азота есть еще два других: +1 и -3. Относительно
недавно появилось сообщение о том, что при содержании кислорода 14,5-15,5 %
происходит образование σ-фазы,
близкой по составу к V2O. Наличие степени окисления +4 и +1 подтверждается
органическими производными ванадия. Что же касается соединений с водородом,
когда формально степень окисления соответствует -3, то ванадий обладает
способностью растворять водород и при этом образовывать с ним гидрид.
По стабильности валентные состояния ванадия
неравноценны. В обычных условиях самым устойчивым состоянием будет +4. В это
состояние он может быть переведен из +3 даже молекулярным кислородом, а из +5
восстановлен мягкими восстановителями. На этом основана, кстати сказать,
ванадатометрия - определение при помощи соединений ванадия присутствия,
например, ионов Fe2+, Os4+, Mo+5.
. Окислительно-восстановительные реакции,
реакции комплексообразования и образования малорастворимых соединений
Титан
С водородом Титан соединений не образует.
Титан образует соединения с галогенами.
Получают взаимодействием:
2TiCL3(ТВ) 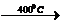 TiCL2(ТВ)+TiCL4(г)
TiCL2(ТВ)+TiCL4(г)
TiCL2 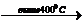 Ti +TiCL4
Ti +TiCL4
Сульфид Титана образуется активно
при непосредственном взаимодействии:
+S TiS2
TiS2
С азотом Титан соединений не
образует.
С углеродом Титан образует
соединение:
+C TiC
TiC
При прокаливании Титан образует белый порошок
оксид Титана (минерал рутил):
Ti+O2 TiO2
TiO2
(IV) - TiO2 - Двуокись титана. Имеет
амфотерный характер. Наиболее устойчив и имеет наобольшее практическое
значение.(III) - Ti2O3 - окись титана. Имеет основной характер. Устойчив в
растворе и является сильным восстановителем, как и остальные соединения
Ti(III).(II) - TiO2 - Закись титана. Имеет основной характер. Наименее
устойчив.
Двуокись титана, ТiO2, - соединение
титана с кислородом, в котором титан четырёхвалентен. Белый порошок, желтый в
нагретом состоянии. Встречается в природе главным образом в виде минерала
рутила, t°пл выше 1850°. Плотностъ 3,9 - 4,25 г/см3. Практически нерастворима в
щелочах и кислотах, за исключением HF. В концентрированной Н2SO4 растворяется
лишь при длительном нагревании. При сплавлении двуокиси титана с едкими или
углекислыми щелочами образуются титанаты, которые легко гидролизуются с
образованием на холоду ортотитановой кислоты (или гидрата) Ti(OH)4, легко
растворимой в кислотах. При стоянии она переходит в мстатитановую кислоту
(форма), имеющую микрокристаллическую структуру и растворимую лишь в горячей
концентрированной серной и фтористоводородной кислотах. Большинство титанатов
практически нерастворимы в воде. Основные свойства двуокиси титана выражены
сильнее кислотных, но соли, в которых титан является катионом, также в
значительной мере гидролизуются с образованием двухвалентного радикала титанила
TiO2+. Последний входит в состав солей в качестве катиона (например,
сернокислый титанил TiOSO4*2H2O). Двуокись титана является одним из важнейших
соединений титана, служит исходным материалом для получения других его
соединений, а также частично металлического титана.
Используется главным образом как
минеральная краска, кроме того, как наполнитель в производстве резины и
пластических металлов. Входит в состав тугоплавких стекол, глазурей, форфоровых
масс. Из нее изготовляют искусственные драгоценные камни, бесцветные и
окрашенные.
Диоксид титана не растворяется в
воде и разбавленных минеральных кислотах (кроме плавиковой) и разбавленных
растворах щелочей.
Медленно растворяется в
концентрированной серной кислоте:
2+ 2H2SO4 = Ti(SO4)2 + 2H2O
С пероксидом водорода образует
ортотитановую кислоту H4TiO4:
В концентрированных растворах
щелочей:
+ 2NaOH = Na2TiO3+ H2O
При нагревании диоксид титана с
аммиаком образует нитрид титана:
TiO2 + 2NH3 = 2TiN + 3H2O + O2
В насыщенном растворе гидрокарбоната
калия:
2 + 2KHCO3 = K2TiO3 + H2O + 2CO2
При сплавлении с оксидами,
гидроксидами и карбонатами образуются титанаты и двойные оксиды:
TiO2 + BaO = BaO∙TiO2(BaTiO3)+
BaCO3 = BaO∙TiO2 + CO2(BaTiO3)+ Ba(OH)2 = BaO∙TiO2(BaTiO3)
Гидроскида Ti(IV) - Ti(OH)4 или H4TiO4 -
ортотитановой кислоты по видимому вообще не существует, а осадок, выпадающий
при добавлении оснований к растворам солей Ti(IV), представляет собой
гидратированную форму TiO2. Это вещество растворяется в кончентрированных
щелочах, и из таких растворов можно выделить гидратированные титанаты общей
формулы: M2TiO3∙nH2O и M2Ti2O5∙nH2O.
Для титана характерно комплексообразование с
соответствующими галогеноводородными кислотами и особенно с их солями. Наиболее
типичны комплексные производные с общей формулой Мe2TiГ6 (где Мe -
одновалентный металл). Они хорошо кристаллизуются и подвергаются гидролизу
гораздо менее, чем исходные галогениды TiГ4. Это указывает на устойчивость
комплексных ионов TiГ6 в растворе.
Окраска производных титана сильно зависит от
природы входящего в них галогена:
Устойчивость солей комплексных кислот типа
Н2ЭГ6, в общем, возрастает по ряду Ti-Zr-Hf и уменьшается в ряду галогенов
F-Cl-Br-I.
Производные трёхвалентных элементов более или
менее характерны лишь для титана. Тёмно-фиолетовый оксид Тi2O3 (т. пл. 1820 °С)
может быть получен прокаливанием TiO2 до 1200 °C в токе водорода. В качестве
промежуточного продукта при 700-1000 °С образуется синий Ti2O3.
В воде Ti2O3 практически нерастворим. Его
гидроксид образуется в виде тёмно-коричневого осадка при действии щелочей на
растворы солей трёхвалентного титана. Он начинает осаждаться из кислых
растворов при рН = 4, имеет только основные свойства и в избытке щелочи не
растворяется. Однако производящиеся от HTiO2 титаниты металлов (Li, Na, Mg, Mn)
были получены сухим путём. Известна также сине-чёрная “титановая бронза”
состава Na0,2TiO2.
Гидроксид титана (III) легко окисляется
кислородом воздуха. Если в растворе нет других способных окисляться веществ,
одновременно с окислением Ti(OH)3 идёт образование пероксида водорода. В
присутствии Са(ОН)2 (связывающего Н2О2) реакция протекает по уравнению:
Ti(ОН)3
+ O2 + 2H2O = 2Ti(OH)4 + H2O2
Азотнокислые соли Тi(OH)3 восстанавливает до
аммиака.
Фиолетовый порошок ТiCl3 может быть получен
пропусканием смеси паров ТiCl4 c избытком водорода сквозь нагретую до 650 °С
трубку. Нагревание вызывает его возгонку (с частичным образованием димерных
молекул Ti2Cl6) и затем дисмутацию по схеме:
TiCl3 = TiCl4 + TiCl2
Интересно, что уже при обычных условиях
тетрахлорид титана постепенно восстанавливается металлической медью, образуя
чёрное соединение состава CuTiCl4 (т. е. СuCl•TiCl3).
Трёххлористый титан образуется также при
действии на TiCl4 водорода в момент выделения (Zn + кислота). При этом
бесцветный раствор окрашивается в характерный для ионов Ti3+ фиолетовый цвет, и
из него может быть выделен кристаллогидрат состава ТiCl3•6H2O. Известен и
малоустойчивый зелёный кристаллогидрат того же состава, выделяющийся из
насыщенного HCl раствора TiCl3. Структуре обеих форм, равно как и аналогичных
кристаллогидратов СrCl3, отвечают формулы [Ti(Н2O)6]Cl3 и [Ti(Н2O)4Cl2]Cl•2Н2О.
При стоянии в открытом сосуде раствор TiCl3 постепенно обесцвечивается ввиду
окисления Ti3+ до Ti4+ кислородом воздуха по реакции:
4TiCl3 + O2 +2H2O = 4TiOCl2 + 4HCl.
Ион Тi3+ является одним из очень немногих
восстановителей, довольно быстро восстанавливающих (в кислой среде) перхлораты
до хлоридов. В присутствии платины Тi3+ окисляется водой (с выделением
водорода).
Безводный Ti2(SO4)3 имеет зелёный цвет. В воде
он нерастворим, а раствор его в разбавленной серной кислоте имеет обычную для
солей Ti3+ фиолетовую окраску. От сульфата трёхвалентного титана производятся
комплексные соли, главным образом типов Мe[Ti(SO4)2]•12H2O (где Мe - Сs или Rb)
и Me[Ti3(SO4)5] (с переменным в зависимости от природы катиона содержанием
кристаллизационной воды).
Теплота образования TiO (т. пл. 1750 °С)
составляет 518 кДж/моль. Он получается в виде золотисто-жёлтой компактной массы
нагреванием в вакууме до 1700 °С спрессованной смеси TiO2 + Ti. Интересным
способом его образования является термическое разложение (в высоком вакууме при
1000 °С) нитрила титанила. Похожий по виду на металл, тёмно-коричневый TiS
получен прокаливанием TiS2 в токе водорода (первоначально при этом образуются
сульфиды промежуточного состава, в частности Ti2S3). Известны также TiSe, TiTe
и силицид состава Ti2Si.
Все TiГ2 образуются при нагревании
соответствующих галогенидов TiГ3 без доступа воздуха за счёт их разложения по
схеме:
TiГ3 = TiГ4 + TiГ2
При несколько более высоких температурах
галогениды TiГ2 сами подвергаются дисмутации по схеме
TiГ2 = TiГ4 + Ti
Двухлористый титан может быть получен также
восстановлением TiCl4 водородом при 700 °С. Он хорошо растворим в воде (и
спирте), а с жидким аммиаком даёт серый аммиакат TiCl2•4NH3. Раствор TiCl2
может быть получен восстановлением TiCl4 амальгамой натрия. В результате
окисления кислородом воздуха бесцветный раствор TiCl2 быстро буреет, затем
становится фиолетовым (Ti3+) и, наконец, вновь обесцвечивается (Ti4+). Получаемый
действием щёлочи на раствор TiCl2 чёрный осадок Ti(OH)2 исключительно легко
окисляется.
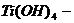 амфотерный
амфотерный
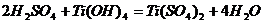
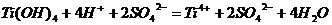
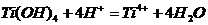
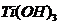 - основной
- основной

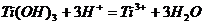
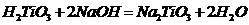

Образование комплексов
Титан может образовывать
многочисленные комплексные соединения, так как в галогенных соединениях Ti+4
имеет свободные орбитали:
3d
4p
4S
6 свободных орбиталей
Это обуславливает возможность
комплексообразования, но его комплексные соединения имеют координационное число
6. Лигандами могут быть ионы воды. Титан может образовывать комплексные
соединения - соли:
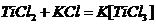
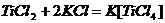
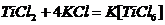
Окислительно-восстановительные процессы
Титан является характерным металлом, поэтому ему
свойственны восстановительные свойства. Но характер оксида титана амфотерен.
Однако восстановительные свойства выражены немного ярче. Кислотные свойства
лучше проявляются в кислотной среде. Основные - в щелочной.
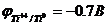
Ti + NaBiO3
+ H2O = TiO(OH)2(тв)
+ Bi(OH)3(тв)
+ …
Составим ионно-электронный баланс:
| Ti0 - 4e + 3H2O = Ti+4O(OH)2 + 4H+ |*1
|
| (Bi+5O3)- + 2e + 3H2O = Bi+3(OH)3 + 3(OH)- |*2
Суммарное уравнение:
0 + 3H2O + 2(BiO3)- + 6H2O = TiO(OH)2 + 4H+ + 2Bi(OH)3 + 6(OH)-
Ti0 +
2(BiO3)- + 9H2O = TiO(OH)2 + 4H2O + 2Bi(OH)3 + 2(OH)-+ 2(BiO3)- + 5H2O =
TiO(OH)2 + 2Bi(OH)3 + 2(OH)-
Итоговое уравнение реакции:+
2NaBiO3 + 5H2O = TiO(OH)2 + 2Bi(OH)3 + 2NaOH2O3 + H2O2 + KOH = …(TiO4)4- + …
Составим ионно-электронный баланс:
| Ti2+3O3 -
2e + 10(OH)- = 2(Ti+4O4)4- + 5H2O
1|
| H2O2-1 + 2e = 2(O2-H)-
Суммарное уравнение:
O3 + 10(OH)-
+ H2O2 = 2(TiO4)4- + 5H2O + 2(OH)-2O3 + 8(OH)- + H2O2 = 2(TiO4)4- + 5H2O
Итоговое уравнение реакции:
O3 + H2O2 +
8KOH = 2K2TiO4 + 5H2O(OH)3 + K2MoO4 + H2SO4 = (TiO)2+… + (MoO)2+… + …
Составим ионно-электронный баланс:
|
| (Mo+6O4)2-
+ 2e + 6H+ = (Mo+4O)2+ + 3H2O |*1
Суммарное уравнение:
Ti(OH)3 +
8H+ + (MoO4)2- + 6H+ = 2(TiO)2+ + 4H2O + (MoO)2+ + 3H2O
Ti(OH)3 +
(MoO4)2- + 14H+ = 2(TiO)2+ + (MoO)2+ + 7H2O
Итоговое уравнение реакции:
Ti(OH)3 +
K2MoO4 + 4H2SO4 = 2(TiO)SO4 + (MoO)SO4 + K2SO4 + 7H2O
Ванадий
На воздухе ванадий не изменяется,
устойчив он к воде, к растворам минеральных солей и щелочей. Кислоты на него
действуют только такие, которые одновременно являются окислителями. На холоде
на него не действуют разбавленные азотная и серная кислоты. По-видимому, на
поверхности металла образуется тончайшая пленка оксида, препятствующая
дальнейшему окислению металла («пассивированное состояние»). Для того чтобы
заставить пассивированный ванадий интенсивно реагировать, его нужно нагреть.
При 600-700°С происходит интенсивное окисление компактного металла, а в
мелкораздробленном состоянии он вступает в реакции при более низкой
температуре:
V +5O2 2V2O5
2V2O5 2VO2 + O2;
2VO2 + O2;
V +5F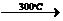 2VF5;
2VF5;
2V +2Cl2 в токе
хлораt
VCl4
Прямым взаимодействием элементов при
нагревании могут быть получены сульфиды, карбиды, нитриды, арсениды, силициды.
Для техники важны желто-бронзовый нитрид VN (tпл = 2050°С),
устойчивый к воде и кислотам, а также обладающий высокой твердостью карбид VC (tпл = 2800
°С).
Ванадий очень чувствителен к
примесям газов (O2, N2, H2), которые
резко меняют его свойства, даже если присутствуют в самых незначительных
количествам. Поэтому и сейчас можно в разных справочниках встретить различную
температуру плавления ванадия. Загрязненный ванадий, в зависимости от чистоты и
способа получения металла, может плавиться в интервале от 1700 до 1900°С. При
чистоте 99,8 - 99,9 % его плотность равна 6,11 г/см3 при 20°С, температура
плавления составляет 1919°С, а температура кипения 3400 °С.
Металл исключительно стоек как в
органических, так и в большинстве неорганических агрессивных средах. По
стойкости к действию НС1, НВr и холодной серной кислоты он
значительно превосходит титан и нержавеющую сталь. С галогенами, за исключением
самого агрессивного из них - фтора, соединений не образует. С фтором же дает
кристаллы VF5,
бесцветные, возгоняющиеся без превращения в жидкость при 111°С. Атмосфера из
углекислого газа на металлический ванадий действует значительно слабее, чем на
его аналоги - ниобий и тантал. Он обладает высокой стойкостью к расплавленным
металлам, поэтому может применяться в конструкциях атомных реакторов, где
расплавленные металлы используются как теплоносители. Ванадий не ржавеет ни в
пресной, ни в морской воде, ни в растворах щелочей. Действуют на него лишь
расплавленные щелочи:
V + 12NaOH + 5O2 = 4Na3VО4 + 6H2О
Из кислот на него действуют
концентрированная серная и азотная кислоты, плавиковая и их смеси:
+ 4H2SО4 = V(SО4)2 + 2H2О + 2SО2
Особенностью ванадия считается
высокая растворимость в нем водорода. В результате такого взаимодействия
образуются твердые растворы и гидриды. Наиболее вероятная форма существования
гидридов - металлообразные соединения с электронной проводимостью. Они способны
довольно легко переходить в состояние сверхпроводимости. Гидриды ванадия могут
с некоторыми твердыми или жидкими металлами образовывать растворы, в которых
повышается растворимость водорода.
Самостоятельный интерес представляют
карбиды ванадия, так как по своим качествам дают для современной техники
материал с весьма ценными свойствами. Они исключительно тверды, тугоплавки и
обладают хорошей электрической проводимостью. Ванадий способен для образования
своих карбидов даже вытеснить другие металлы из их карбидов:
V + Fе3С = V3С + 3Fе
Известен целый ряд соединений
ванадия с углеродом:
3С; V2C; VC; VзС2; V4С3
С большинством членов главной
подгруппы ванадий дает соединения как бинарные (т. е. состоящие только из двух
элементов.), так и более сложного состава. Нитриды образуются при
взаимодействии порошка металла или его оксидов с газообразным аммиаком:
V + 2NН3 = 2V3N + 3Н2
V2О2 + 2NH3 = 2VN + 2H2О + H2
Для, полупроводниковой техники
интерес представляют фосфиды V3Р, V2P, VP, VP2 и арсениды
V3As, VAs.
Комплексообразующие свойства ванадия
проявляются в образовании соединений сложного состава типа фосфорно-ванадиевой
кислоты H7PV12O36 или Н7[Р(V2O6)6].
В системе ванадий - кислород
взаимодействие начинается при нагревании до температуры примерно 300°С.
Получено большое количество оксидов ванадия, характер которых постепенно
меняется при переходе от низших оксидов к высшим. Относительно недавно
обнаружен низший оксид V2О. Он нестоек и по своему характеру близок к
металлическому состоянию. Его светло-серые кристаллы отливают металлическим
блеском, хорошо проводят электрический ток.
Оксид VO более стоек, нерастворим в
воде, но растворяется в разбавленных кислотах с образованием двухзарядного
катиона V2+.
+ H2SО4 = VSО4 + H2О
Водные растворы ванадия в такой
степени окисления окрашены в фиолетовый, или в бледно-голубой цвет. Растворы
солей иона V2+ неустойчивы и настолько сильные как восстановители, что при
стоянии выделяют водород прямо из воды, а ион ванадия переходит в более
устой-чивые высшие степени окисления. При добавлении к растворам любого даже
слабого основания образуется бурый аморфный осадок V(OH)2. В чистом виде,
однако, выделить его нельзя, так как на воздухе он быстро превращается в
серо-зеленый гидроксид V(ОН)3.
Из особенностей оксида можно
отметить существование при определенных концентрациях ванадия димера V2О2, а
также совершенно особое влияние температуры на его состояние. Оксиды обычно
делаются нестойкими при высоких температурах и разлагаются. Здесь же
наблюдается совершенно удивительное свойство: оксид VO устойчив лишь при
высокой температуре. Даже при медленном и постепенном охлаждении он разлагается
и переходит в высшие оксиды.
Оксид ванадия, соответствующий
степени окисления +3, имеет амфотерный характер с преобладанием основных
свойств. Как кислотные качества можно рассматривать образование им с оксидами
MgO, MnO, СаО двойных соединений, а с Fe2О3, Сr2О3, Аs2О3 непрерывный ряд
твердых растворов. С оксидами же щелочных металлов Li2О и Na2О получаются соли
LiVO3, NаVОз, которые можно считать ванадиевыми солями.
Внешне V2O3 - блестящие черные
кристаллы (tпл = 1970°С), по структуре подобны корунду, в воде, растворах
щелочей и кислотах не растворяются, кроме плавиковой и азотной (быстрее всего в
кипящей):
O3 + 6НМОз = 2V(NО3)3 + ЗН2O
Водные растворы таких солей окрашены
в зеленый цвет. Из них добавлением аммиака можно осадить рыхлый серо-зеленый
осадок, который считается гидроксидом ванадия в степени окисления +3. Отметим,
что такое состояние менее устойчиво и менее характерно для ванадия, чем +4 и
+5. Поэтому соединения ванадия со степенью окисления +3 стремятся перейти в
более стабильное состояние и проявляют, следовательно, свойства
восстановителей.
Сине-голубые кристаллы VO2 на
воздухе теряют свою форму, так как вещество гигроскопично. Это наиболее
устойчивый оксид ванадия, поэтому его можно получить либо окислением низших
оксидов:
V2О3 + О2 = 4VО2,
либо восстановлением высшего:
O5 + Н2С2О4 = 2VО2 + 2СО2 + Н2О
Оксид VO2 амфотерен и одинаково
легко растворяется как в основаниях:
VО2 + 2NaOH + 6H2О = Na2 [V4O5] •
7Н2O,
так и в кислотах:О2 + 2HC1 = VОСl2 +
Н2O;+ H2SO4 = VOSO4 + H2O
Водный его раствор не изменяет цвета
ни синей, ни красной лакмусовой бумажек, т. е. его амфотерность распределена
поровну между кислотными качествами и основными. Водные растворы солей содержат
ванадий не в виде простого катиона, а в виде иона ванадила, имеющего две формы
существования: VO2+- и V2O24+ - и придающего синий цвет растворам.
В щелочах образуются соли
поливанадиевых кислот H4V4O9 или H2V2O5, называются соли ванадитами или
поливанадатами. При величине рН = 4 из растворов солей можно осадить
серовато-бурый аморфный гидроксид VO(OH)2. Если щелочность увеличить, при рН от
8 до 10 гидроксид (в соответствии со своими амфотерными качествами) будет
растворяться, превращаясь в соли. При сплавлении этого оксида ванадия с
оксидами щелочноземельных металлов получаются ванадаты:
+ CaO = CaVO3
Могут образовываться три ряда
ванадатов СаVО3, Са2VO4, Ca3VO5 со сложной структурой.
Наиболее важным и интересным, с
точки зрения химика, считается высший оксид ванадия V2O5, который может иметь
вид красных или красно-желтых кристаллов либо оранжевого порошка. Получается он
по реакции ванадия с кислородом. При 600-700°С взаимодействие идет очень
быстро, так как образующийся оксид V2О5 расплавляется (tпл = 675°С) и
скатывается с поверхности металлического ванадия. Лабораторный способ его
получения - из метаванадата аммония;
NH4VО3 = V2О5+2NH3+H2О
Высший оксид ванадия имеет ярко
выраженный кислотный характер и при растворении в воде образует ванадиевую
кислоту:О5 + Н2О = 2НVО3
Форма существования ванадия в
растворе кислоты - в виде катиона VO2+, цвет раствора желтовато-оранжевый. При
растворении оксида ванадия (V) в основаниях получаются соли изомерных
ванадиевых кислот, напоминающих фосфаты:
O5+2NaOH =
2NaVO3+H2OO5+6NaOH = 2Na3VO4+3H2O
По форме они соответствуют мета -
[НVO3], орто - [Н3VO4] и H2V2O7 пированадиевым кислотам. В этом отношении
ванадий обнаруживает сходство уже не с азотом, а с фосфором.
Особенность ванадия (в степени
окисления +5) при растворении в сильных кислотах - образовывать комплексные
соединения, содержащие до девяти -двенадцати атомов ванадия на молекулу. Другим
замечательным свойством оксида можно считать способность в расплавленном
состоянии проводить электрический ток, скорее всего вследствие диссоциации на
ионы:
O5  VO2+ + VO3-
VO2+ + VO3-
А ведь пропускание электрического
тока считается безусловной «привилегией» металлов. По этому свойству
распознается принадлежность вещества к металлам или неметаллам.
Ванадиевая кислота, подобно
фосфорной и мышьяковой имеет три формы: НVО3 (мета-), H3VO4 (орто-), H4V2O7
(nupo-). Сами кислоты в чистом виде не получаются, но соли их можно осадить из
раствора. Например, регулированием кислотности среды можно выделить серебряную
соль во всех трех формах
Наиболее устойчивой в водных
растворах является метаванадиевая кислота, которая все время именуется как
просто ванадиевая. Это соединение обладает признаками амфотерности, которые
более значительны, чем у фосфорных кислот. Для нее возможны направления
электролитической диссоциации как с отщеплением Н+, так и ОН-.
- + H+ HVO3 = VO2OH VO2
+ + ОН-
Существование VO2-
можно доказать тем, что соляная кислота реагирует с раствором ванадиевой
кислоты и окисляется до свободного хлора:
2VO2+ + 2HCl 2V02 + + Cl2 +
2OH-
Следовательно, в этом случае проявляются
некоторые признаки основания.
По цвету раствора и по солям, выделяющимся из
него, можно судить, в форме ионов каких кислот присутствует ванадий в растворе.
При растворении в воде оксида ванадия (V)
появляется желтая окраска, которая может меняться и даже исчезать совсем в
зависимости от среды. Такая особенность объясняется возможностью иона VO3-
существовать в различных формах. Желтый цвет обусловлен присутствием этого иона
в тримерной форме [V3О9]3-. При
сильно щелочной среде раствор бесцветен: там находятся ионы пиро- и
ортованадиевых кислот:
[V309]3- + 60H- = 3[V2O7]4- + 3H2O;
[V2О7]4-
+ 2ОН- = 2[VO4] 3- + Н2О
По мере уменьшения щелочности окраска опять
становится желтой и даже оранжевой. Это связано с изменением формы
существования иона VO3-
от [V3О9]3- в щелочной
среде и [VO4]3- в
нейтральной до [V6O17]4-
в кислой:
[VО4]3- + 6H+ = 3[V2 O9]3- + 3H2О;
[V3О9]3- + 2H+ = [V6Ol7]4- + H2О
[V6O17]
4- + 2OН- = 2[V3О9]3-
+ H2O
Оранжевый цвет приписывается присутствию иона
декаванадата:
[V6O17]4-
+ 2Н+ = 3[V10O28]6-
+ Н2О
который может быть выделен из раствора в виде
оранжевой соли кальция Ca3V10O28.16H2О.
Здесь приведены простейшие формулы. Реально же в небольших количествах
присутствуют и другие соединения, заключающие в составе своей молекулы до 12
атомов ванадия.
Из солей ванадиевой кислоты растворимы соли
одновалентных металлов (К, Na
и т.д.), а ванадаты аммония, двух- и трехвалентных металлов труднорастворимы.
Из них особенно важен ванадат аммония. Из него при действии на его раствор
сульфида аммония образуется вишнево-красный раствор тиосоли:
VО3
+ 4(NH4)2S + 3H2О
= (NH4)3VS4 + 6NH4ОH
Пероксид водорода Н-О-О-Н производит в нем
замену части атомов кислорода на пероксидную группу -O-O- и превращает его в
перванадат:
NH4VО3
+ 3H2О2 = (NH4)2H2V2О10
+ 2H2О
Сами по себе и в щелочной среде такие соединения
устойчивы, а при подкислении образуются свободные надкислоты общей формулы H4V2Ox
(причем x > 7). Они
постепенно разлагаются с выделением кислорода. Свойство давать пероксидные
соединения характерно и для остальных членов подгруппы ванадия.
Из других солей пятивалентного ванадия
достаточно полно охарактеризованы сульфид V2S5 и единственное соединение с
галогенами - пентафторид ванадия VF5.
Первое из этих двух соединений проще всего может быть получено в виде черного
порошка нагреванием V2О3 с серой
при 350°С;
V2O3
+ 13S = 2V2S5
+ 3SO2
При нагревании на воздухе он сгорает до V2S5,
а при 400°С и в отсутствие воздуха способен распадаться на V2S3
и серу. В воде V2S5
практически нерастворим, но легко растворяется в щелочах.
Пентафторид может быть легко получен при
взаимодействии элементов (300°С), он представляет собой бесцветное
кристаллическое вещество. Возгоняется при 111°С, водой VF5
полностью гидролизуется. Ему соответствует комплексная кислота H[VF6].
Сама она не выделена, но получены соли некоторых металлов - (калия, серебра,
бария). К нагреванию они не особенно устойчивы:
K[VF6]
330°C
KF+VF5
В соединениях с серой и фтором ванадий выступает
в роли типичного металла.
Таким образом, в кислородсодержащих кислотах и
их солях он ведет себя как неметалл, но в других своих соединениях - как
металл. Следовательно, пятивалентный ванадий проявляет свойства неметалла, и
этому его качеству соответствуют кислоты, но он способен проявлять признаки
металличности в некоторых соединениях.
Четырехвалентному ванадию соответствуют
предполагаемые кислоты H2V4О9;
Н2VO3; H4VO4
и H6VO5.
Соединения элемента такой степени окисления становятся в растворе производными
ванадила.
Ванадию со степенями окисления +3, +2
соответствуют основания V(OH)3
и V(OH)2.
Оба они образуются при действии щелочи на растворы, содержащие соответственно
ионы V3+ и V2+. В этих состояниях окисления ионы ванадия ведут себя как
типичные ионы металлов. Отличает их разве только неустойчивость. Ванадий
стремится перейти в свое самое стабильное состояние +4. Поэтому оба основания
на воздухе легко окисляются до степени окисления ванадия +4, т. е. являются
восстановителями:
V(OH)2
+ O2 = 2VO(OH)2;
V(ОН)3 + O2
= 4VО(ОН)2 + 2Н2O
Из-за своей неустойчивости в чистом виде
гидроксиды не получены. Они могут существовать некоторое время при действии
щелочей на растворы солей ванадия: V(ОН)3
в виде рыхлого зеленого осадка, а V(ОН)2 - буро-коричневого.
Однако соли трехкислотного основания V(ОН)3
вполне устойчивы. Безводный трифторид VF3
зеленовато-желтого цвета плавится лишь при температуре выше 800°С. Трихлорид -
красно-фиолетовые кристаллы - устойчив в отсутствие влаги. Менее устойчивы
бромид и иодид.
Состояние окисления +2 ванадия наименее
устойчиво, поэтому ванадий, содержащийся в солях, стремится, отдав электрон или
два, перейти в более глубокую степень окисления. Все-таки осторожным
восстановлением из смеси паров тетрахлорида и водорода может быть получен
дихлорид:
4 + H2
= VCl2 + 2HCl.
в виде бледно-зеленых кристаллов. При
растворении в воде сначала появляется фиолетовая окраска, которая быстро
меняется на зеленую. Происходит переход ванадия из двузарядного иона в
трехзарядный:
2+-e
= V3+
На этом процесс не заканчивается, ванадий
стремится перейти в наиболее стабильное состояние +4. Происходит снова
изменение цвета раствора. Подобным же образом ведут себя бромид и иодид.
Лантан.
Лантан в сухом воздухе покрывается тонкой
пленкой окисла, которая защищает его от дальнейшего окисления. Но такая
"защита" происходит только в сухом воздухе.
По своему химическому поведению лантан
напоминает кальций. Как и многие активные металлы, он разлагает воду, хорошо
реагирует с кислотами, а при нагревании энергично - с хлором, серой и другими
металлоидами, т. е. проявляет свойства типичного металла.
Важнейшим не растворимым в воде соединением
лантана является оксид лантана, La2O3, белый аморфный порошок, растворимый в
кислотах. Взаимодействуя с CO2 переходит в карбонат.
4La+3O2  2La2O3
2La2O3
Другим не растворимым в воде
соединением лантана является гидроксид лантана (III) - неорганическое
соединение с формулой La(OH)3, белые кристаллы или аморфное вещество.
Образуется при взаимодействии лантана с водой, солей лантана с растворами
щелочей.
La+6H2O  2La(OH)3
+3H2(NO3)3+3NaOH
2La(OH)3
+3H2(NO3)3+3NaOH La(OH)3
+3NaNO3
La(OH)3
+3NaNO3
Установлено, что нитрат лантана с
нитратом азотнокислой соли тетраметиламмония образует комплексную двойную соль,
которая была выделена и количественно проанализирована на содержение лантана и
нитрат иона. Результаты химического анализа полученного комплекса подтвердили
его состав. Сравнение штрихрентгенограмм исходных гексагидрата нитрата лантана,
нитрата тетраметиламмония и выделенного комплекса свидетельствуют об
индивидуальности последнего. В полученных для комплекса La(NO3)3 ·
3{[(CH3)4N] · NO3} ИК-спектрах наблюдаются полосы поглощения
координированной нитратогруппы, см -1 : ν1(А1) = 1300; ν2(А1) =
1048; ν3(А1) =740; ν4(В2) =1495;
ν5(В1) =835.
Численное значение Δν =195см -1
указывает на то, что в выделенном комплексе связь нитратогруппы с лантаном
прочнее, чем в кристаллогидрате нитрата лантана.
Имеются данные о синтезе новых
ацетамидных комплексных соединений иодидов лантана, гадолиния и эрбия состава
LаI3 • 4AA • 4H2O (Lа = La, Gd, Er; AA = CH3CONH2). Полученные комплексные
соединения охарактеризованы данными химического анализа, ИК-спектроскопии и
изучены методом РСА.
5. Особенности свойств элементов IIIБ-группы по
сравнению с другими элементами d-блока
, La, Ас - серебристо-белые металлы, Sc имеет
желтоватый оттенок. Металлы Sc и Y не изменяются на воздухе, a La и Ас быстро
тускнеют, покрываясь пленкой гидроксида. Лантан пирофорен, отделенные в
результате трения или удара частицы металла сами загораются на воздухе.
Некоторые свойства Sc, Y, La и Ас указаны в табл.3.
Таблица 3. Некоторые свойства элементов
подгруппы скандия
|
Металл
|
Т.
пл., °С
|
Т.
кип., °С
|
r,
г / см3
|
Стандартный
электродный потенциал j°, В
|
|
Sc
|
1539
|
2700
|
3,02
|
-2.08(Sc3+/Sc)
|
|
Y
|
1526
|
3340
|
4,47
|
-2.37(Y3+/Y)
|
|
La
|
920
|
3470
|
6,16
|
-2.52(La3+/La)
|
|
Ac
|
1050
|
3300
|
10,1
|
-2.6(Ac3+/Ac)
|
Sc, Y, La, Ac - первые d-элементы в
соответствующих периодах периодической системы. Строение внешних электронных
оболочек их атомов (n-l)d1ns2, тогда как элементы главной подгруппы (IIIА)
имеют конфигурацию внешнего слоя ns2np1. Поэтому свойства простых веществ
подгрупп IIIA и IIIБ сильно различаются. Вместе с тем ионы Al3+ (группа IIIA) и
Sc3+, Y3+ La3+ Ас3+ (группа IIIБ) являются аналогами, так как все они имеют
электронную конфигурацию атомов благородных газов. Наоборот, ионы Ga3+ , In3+,
Tl3+ (группа IIIA), у которых внешний электронный слой содержит 10d-электронов,
не являются аналогами Sc3+ Y3+, La3+, Ac3+ (см. разд. Подгруппа IIIA (бор,
алюминий, галлий, индий, таллий)
<javascript:parent.reDisplay('4.1.3.3',1,0)>).
Данная закономерность обусловливает
своеобразное изменение свойств соединений элементов третьей подгруппы
периодической системы: зависимость свойств от порядкового номера элемента
является плавной в ряду B-Al-Sc-Y-La, а в подгруппе IIIA она претерпевает
резкое изменение при переходе от Al к Ga (рис.).
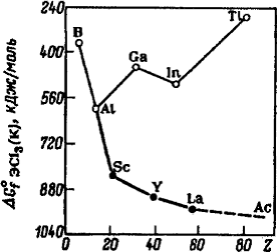
Рис. Изменение стандартных энтальпий образования
хлоридов элементов в пределах III группы
Рассматриваемые элементы являются очень
активными металлами, по многим свойствам напоминающими магний и кальций.
Актиний - радиоактивный элемент, наиболее
долгоживущий его изотоп 227Ac имеет период полураспада 21,77 года.
СаО(к) + H2O(ж) = Са(ОН)2(к); DH° = -58кДж
,5La2O3(к)+1,5H2O(ж) = Lа(ОН)3(к); DH° = -77кДж
Рассматриваемые металлы вытесняют водород из
кислот. При растворении скандия в разб. HNO3 образуется NH4NO3:
Sc + 30HNO3 ® 8Sc(NO3)3 + 3NH4NO3 + 9Н2O
При нагревании металлы подгруппы IIIБ реагируют
с кислородом, образуя Э2O3, с азотом, давая ЭN, и с многими другими веществами.
Sc, Y и La склонны к комплексообразованию, причем в пределах подгруппы
координационные числа элементов растут: если для Sc типично к. ч. 6, то у Y и
La оно достигает 8 и 9. Соли этих элементов ЭF3, Э2(SO4)3, Э2(СO3)3, Э(NO3)3
образуют с соответствующими солями щелочных металлов комплексные соединения
вида Mn+[ЭFn+3] (n=1, 2, 3), М3+ЭХ3 (X = SO42-СO32-, С2O42-), M2+[ЭX2]
(X=SO42-, С2O42-), М2+[Э(NO3)5]. Эти комплексы в растворах сравнительно легко
диссоциируют, они ближе к двойным солям. Наиболее устойчивы фтороскандиаты
Мз+[ScF6]. В кристаллогидратах и водных и растворах существуют аквакомплексы
[Sс(H2O)6]3+, [Y(H2O)9]3+, [La(H2O)9]3+.
6. Медико-биологическое
значение элементов IIIБ - VБ групп
Лантан - это микроэлемент, который содержится в
организме человека в селезенке, дентине и эмали зубов. Лантан улучшает
фагоцитарную активность лейкоцитов. Карбонат лантана применяют в медицине при
терминальной стадии почечной недостаточности, которая сопровождается
гиперфосфатемией и почечной остеодистрофией. Данный элемент предотвращает
всасывание фосфатов из пищи.
В связи с образованием труднорастворимых
соединений (фосфатов) лантан всасывается в организм из желудочно-кишечного
тракта крайне медленно. Выводится лантан в основном с желчью. Данный
микроэлемент подобно другим лантаноидам конкурирует в различных биохимических
процессах с такими элементами, как кальций, марганец, магний, медь, цинк и
кобальт.
Биологическая роль лантана не до конца изучена.
В 30-е годы 20 века советский ученый А. А. Дробков проводил исследования
влияния лантана на растения. Он вводил редкоземельные металлы с марганцем и
бором в такие растительные культуры как горох, репа и другие. В результате
ученый выяснил, что металлы необходимы для нормального развития данных
растений.
Все соединения лантана являются токсичными. В
основном токсичные эффекты данного элемента связаны с его воздействием на
метаболизм фосфатов. Имеются данные, что лантан способен оказывать токсическое
действие на печень. В радиоактивных осадках присутствуют изотопы лантана в
числе побочных продуктов распада урана, тория, плутония.
Титан есть в морской воде, тканях растений и
животных, а значит, и в продуктах растительного и животного происхождения.
Растения получают титан из почвы, на которой растут, а животные получают его,
поедая эти растения, однако вначале - уже в XIX веке - химики открыли титан в
организме животных, а уже потом в растениях. Эти открытия снова были сделаны
англичанином и немцем - Г. Ризом и А. Адергольдом.
Человеческий организм должен получать
физиологический титан для нормального функционирования всех органов и систем.
Содержание титана в организме человека составляет около 9 мг, причём лёгкие
содержат около 2,4 мг. Титан совместно с кремнием и ванадием участвует в
процессах восстановления костной ткани после переломов. Титан входит в состав
хрусталика глаз, эпителиальной ткани, волос, ногтей, костей. Хорошо изучено
глубокое влияние титана на восстановительные процессы в повреждённых суставах,
при артритах, артрозах. Титан принимает непосредственное участие в
регулировании окислительных процессов в сыворотке крови, стимулирует
образование крови. В мозге, особенно в зрительно центре в центре равновесия
(вестибулярном), обнаружены высокие концентрации титана
Около 0,85 мг титана поступает в организм
ежесуточно с пищей и жидкостями, с питьевой водой - 0,002 мг, с воздухом -
0,0007 мг. Всасывание соединений титана в желудочно-кишечный тракт составляет
1-3% от всего поступаемого количества. Менее 1% от поглощенной дозы поступает в
организм ингаляционным путем, при этом до трети всего потребляемого вещества
задерживается в легких.
Общепринятое мнение, что повышенное содержание
титана в легких обусловлено его поступлением с пылью городских улиц,
промышленных выбросов и автомобильных выхлопов. Чем старше человек, тем выше
концентрация титана в организме. У пожилых людей количество титана в несколько
раз выше, чем у детей - это плата за многолетнее вдыхание пыли. А курение
увеличивает его содержание в лёгких в десятки раз.
Определить уровень содержания титана в организме
можно на основании исследований крови, мочи и волос. Средний уровень содержания
титана в волосах составляет 0,5-2,0 мкг/г. В крови концентрация титана
достигает 0,07 мг/л, а в его компоненте - сыворотке - титана содержится 0,05
мг/л. Индикатором элементного статуса титана является определение его
содержания в волосах и моче.
Выводится титан из организма в основном с калом
(0,52 мг), в меньшей степени с мочой (0,33 мг).
Однозначно подтвержденных данных о существовании
токсических или летальных доз для человека нет. Что будет, есть проглотить
титановый зубной штифт, доподлинно неизвестно. По крайне мере, учёные умы об
этом скромно умалчивают. Однако, учитывая, крайнюю инертность титана как
химического элемента, можно предположить, что ничем трагическим такой казус не
закончится. Штифт выйдет естественным путём, не вступая в химические соединения
с жидкостями организма.
Нет однозначно достоверных данных и том, что
существуют титано-дефицитные состояния, угрожающие здоровью или жизни человека.
Разные медицинские школы дают свои описания состояний при дефиците титана. Так,
по одним данным, дефицитом титана сопровождается большинство тяжелых
заболеваний, причём при прогрессирующем течении заболевания заметно снижается
содержание титана в поражённых тканях. Это состояние снимается введением в организм
титансодержащих препаратов. После их введения наступает заметное улучшение.
По другим данным, оказалось, что титан - это
мощный антиоксидант, которые, как известно, быстро расходуются организмом.
Потребление титаносодержащих препаратов тормозит окислительные процессы в
организме, защищая мелкие сосуды и клетки кожи от свободных радикалов.
Существует медицинская теория, согласно которой
избыток титана в организме может привести к поражению дыхательной и
лимфатической систем. По данным этой теории, избыток титана может
спровоцировать воспаление легких, легочных и периферических лимфатических
узлов, гранулематоз легких и плевры, альвеолит, трахеит. Серьёзный перечень,
чтобы с осторожностью относиться к глотанию титановых протезов.
Если о влиянии чистого титана на организм
человека однозначных данных в медицинских и научных кругах нет, то о влиянии
соединений титана нет никаких разногласий. Медики однозначны в своих оценках
влияния двуокиси титана на дыхательную систему: это хуже курения. Вдыхание
двуокиси титана вызывает как минимум раздражение легких у человека. На
внедрение двуокиси титана в дыхательную систему организм реагирует кашлем,
часто с мокротой и одышка.
А хроническое воздействие оксида титана приводит
к его накоплению в легких (более 4 мг/кг сырого веса), а также в легочных (до
24 мг/кг сырого веса) и периферических (до 120 мг/кг сырого веса) лимфатических
узлах. Это отнюдь не такое безопасное состояние, как при проглоченном штифте.
При регулярном вдыхании окиси титана возможно развитие воспаления лёгких, а в
некоторых случаях и гранулематоза легких и плевры, если это будет сочетаться с
воздействием оксида титана с другими реагентами, например с асбестом,
силикатами, никелем или алюминием. Такие состояния возможны у работающих на
химических предприятиях, в металлургии.
Медики выявили прямую зависимость тяжести
силикоза с накоплением титана в легких, и особенно прикорневых лимфоузлах. Тем
не менее, есть основания полагать, что явления фиброза и воспаления в
бронхо-легочной системе обусловлены в основном действием соединений кремния, а
не титана.
Однако и этих данных должно быть достаточно для
того, чтобы с большой ответственностью относится к качеству вдыхаемого воздуха
и «вентиляции» лёгких. Если есть возможность выбирать жильё, старайтесь не
селиться поблизости от металлургических заводов или автобанов. Чаще гуляйте в
лесу, на свежем воздухе вдали от выхлопов большого города. И тогда никогда не
придётся испытать на себе ни возможных отравлений титаном и его соединениями,
ни дефицита этого малоизученного элемента.
Ванадий - это микроэлемент, участвующий в
регулировании углеводного обмена, сердечно-сосудистой деятельности (в
частности, уменьшает выработку холестерина). Ванадий участвует также в
процессах формирования костей и зубов, роста и метаболизма жиров, а также
стимулирует рост и репродукцию клеток, действуя при этом как противораковое
средство. Ванадий вместе с цирконием, сопутствуя серебру, благотворно действует
на функции паренхиматозных органов (печень, селезенка, легкие), щитовидной и
поджелудочной желез, гипофиза, половых органов, мышечной системы.
Хотя дефицит ванадия у человека - редкое
явление, однако у подопытных животных нехватка ванадия приводит к ухудшению
роста зубов, костей, хрящей и мускулов, а также ослаблению функции размножения.
Существуют также американские данные о том, что недостаток ванадия связан с
развитием диабета. По крайней мере дефицит ванадия, наряду с недостатком хрома
и цинка, является одним из важнейших индикаторов симптомов диабета.
Депонируется ванадий в основном в костных и жировых тканях.
Уровень суточной потребности организма человека
в ванадии не установлен, но по экспертным оценкам составляет около 2 мг в день.
7. Применение титана и тантала
в медицине
В медицине титан необыкновенно популярен: из
него делают превосходные инструменты, и при этом доступные и недорогие - титан
стоит от 15 до 25 долларов за килограмм. Любят титан ортопеды, стоматологи и
даже нейрохирурги - и неудивительно.
Оказывается, у титана есть ценное для медиков
качество - биологическая инертность: это означает, что конструкции из него
прекрасно себя ведут в организме человека, и абсолютно безопасны для мышечных и
костных тканей, которыми они обрастают со временем. Структура тканей при этом
не меняется: титан не подвержен коррозии, а его механические свойства очень
высоки. Достаточно сказать, что в морской воде, которая по составу очень близка
к лимфе человека, титан может разрушаться со скоростью 0,02 мм за 1000 лет, а в
растворах щелочей и кислот он по устойчивости похож на платину.
Среди всех используемых в медицине сплавов
титановые отличаются чистотой, и примесей в них почти нет, чего нельзя сказать
о кобальтовых сплавах или нержавеющей стали.
Внутренние и наружные протезы, изготовленные из
титановых сплавов, не разрушаются и не деформируются, хотя всё время
выдерживают рабочие нагрузки: механическая прочность титана в 2-4 раза выше,
чем у чистого железа, и в 6-12 раз выше, чем у алюминия.
Пластичность титана позволяет делать с ним всё,
что угодно - резать, сверлить, шлифовать, ковать при низких температурах,
прокатывать - из него получается даже тонкая фольга.
Температура его плавления, однако, довольно
высока - около 1670°C.
Электропроводность у титана очень низкая, и он
относится к немагнитным металлам, поэтому пациентам с титановыми конструкциями
в организме можно назначать физиотерапевтические процедуры - это безопасно.
В пищевой промышленности используется диоксид
титана - в качестве красителя, обозначающегося как Е171. Им окрашивают конфеты
и жвачку, кондитерские изделия и порошковые продукты, лапшу, крабовые палочки,
изделия из фарша; им же осветляют глазури и муку.
В фармакологии диоксидом титана окрашивают
лекарства, а в косметологии - кремы, гели, шампуни и другие средства.
Уникальное качество тантала - его высокая
биологическая совместимость, т.е. способность приживаться в организме, не
вызывая раздражения окружающих тканей. На этом свойстве основано широкое
применение тантала в медицине, главным образом в восстановительной хирургии -
для ремонта человеческого организма. Пластинки из этого металла используют,
например, при повреждениях черепа - ими закрывают проломы черепной коробки. В
литературе описан случай, когда из танталовой пластинки было сделано
искусственное ухо, причем пересаженная с бедра кожа при этом настолько хорошо прижилась,
что вскоре танталовое ухо трудно было отличить от настоящего.
Танталовой пряжей иногда возмещают потери
мускульной ткани. С помощью тонких танталовых пластин хирурги укрепляют после
операции стенки брюшной полости. Танталовыми скрепками, подобными тем, которыми
сшивают тетради, надежно соединяют кровеносные сосуды. Сетки из тантала
применяют при изготовлении глазных протезов. Нитями из этого металла заменяют
сухожилия и даже сшивают нервные волокна. И если выражение «железные нервы» мы
обычно употребляем в переносном смысле, то людей с танталовыми нервами, быть
может, вам приходилось встречать.
Право, есть что-то символическое в том, что
именно на долю металла, названного в честь мифологического мученика, выпала
гуманная миссия - облегчать людские муки.
титан тантал атом ионизация
Список литературы
1.
Ахметов Н.С. Общая и неорганическая химия. 3-е изд. М.: Высш. шк., 1998.
Барковский Е.В., Ткачёв С.В., Атрахимович Г.Э. Введение в химию биогенных
элементов и химический анализ. М.:Высшая школа. 1997.
.
Селезнёв К.А. Аналитическая химия. М.:Высшая школа. 1966.
.
Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М.: Химия, 2001.
Скальный А.В., Рудаков И.А. Биоэлементы в медицине. М.: Мир, ОНИКС, АСТ. 2004.
.
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. Т. 1-3. М.: Мир,
1969.
.
Неорганическая химия / Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю.
Цивадзе. Т. 1, 2. М.: Химия, 2001.
.
Хьюи Дж. Неорганическая химия: строение вещества и реакционная способность. М.:
Химия, 1987.