Химическая технология: получение акролеина и акриловой кислоты
Содержание
Введение
1. Материальный баланс стадии синтеза
2. Тепловой баланс стадии синтеза
3. Термодинамический анализ основной реакции и расчет константы
равновесия
4. Кинетические расчеты
5. Принципиальная технологическая схема стадии синтеза
Список литературы
Введение
Практическое значение процессов окисления в промышленности
основного органического и нефтехимического синтеза трудно переоценить. Их
первостепенную роль обусловили следующие причины:
) большая ценность соединений получаемых окислением (спиртов,
альдегидов, кетонов, карбоновых кислот и их ангидридов, нитрилов и т.д.)
2) широкое многообразие реакций окисления, к которым
способны органические вещества, в том числе и углеводороды всех классов.
) доступность и низкая себестоимость большинства
окислителей, среди которых главное место занимает кислород воздуха.
Изложенные причины привели к тому, что окислительные процессы
получили большое распространение в органическом синтезе. Для осуществления ряда
процессов большое значение приобрело гетерогенно-каталитическое окисление
(окисление олефинов по насыщенному атому углерода, прямой синтез этиленоксида).
Методом окисления олефинов по насыщенному атому углерода
получают акролеин и акриловую кислоту.
Акролеин - простейший альдегид этиленового ряда. Он может
быть использован для разнообразных синтезов, основанных на реакциях
присоединения по двойной связи и на реакциях карбонильной группы, а также для
диеновых синтезов, характерных для соединений с сопряженными двойными связями.
Акролеин - жидкость с резким раздражающим запахом. Он хорошо
растворим в воде и образует с ней азеотропную смесь. При длительном хранении
или нагревании легко полимеризуется в циклические или линейные полимеры, что
заставляет при его переработке использовать добавки ингибиторов. Акролеин
широко применяется для получения акриловой кислоты и эфиров, аллилового спирта,
синтетического глицерина и других продуктов, в том числе метионина, являющегося
ценной добавкой к корму для птиц.
1. Материальный баланс стадии синтеза
Данные для расчета материального баланса:
Основная реакция СН2=СН-СН3 + О2
= СН2=СН-СНО + Н2О (1)
Побочные реакции: 2СН2=СН-СН3 + О2=
2СН3С (О) СН3 (2)
СН2=СН-СН3 +9 О2 = 6СО2
+ 6 Н2О (3)
Таблица № 1
|
Производительность
реактора, т/г Число дней работы реактора в году, n Технологический выход продукта, f, %
|
9500 340 97,0
|
|
Степень
превращения ХА, %
|
6
|
|
Селективность
реакций, %
|
Основной (1)
|
75
|
|
побочной (2)
|
19
|
|
Состав
пропилено-воздушной смеси % (об.)
|
пропилен
|
9,5
|
|
примесь -
пропан
|
2,5
|
|
воздух
|
88
|
|
Состав воздуха,
(% об.)
|
азот
|
79,0
|
|
кислород
|
21
|
Физические свойства веществ, участников реакции представлены
в таблице № 2.
Таблица № 2
|
Вещества
|
Свойства
|
|
Молекулярная
масса
|
Плотность, кг/м3
|
Тпл, 0С
|
Ткип, 0С
|
|
С3Н6
|
42
|
233
|
-187,65
|
-47,7
|
|
С3Н8
|
44
|
2,019
|
-187,69
|
-42,7
|
|
О2
|
32
|
|
|
|
|
N2
|
28
|
|
|
|
|
С3Н4О
|
56
|
838,9
|
-86,95
|
52,69
|
|
Н2О
|
18
|
998,2
|
|
|
|
С3Н6О
|
58
|
790,5
|
|
|
|
СО2
|
44
|
|
|
|
Приход
) Количество пропилена, требуемое для получения 0,356
кмоль/мин акролеина:
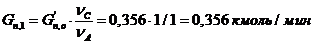 .
.
2) Количество пропилена с учетом селективности:
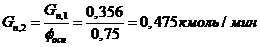 .
.
3) Количество пропилена, требуемое для получения
акролеина с учетом степени превращения:
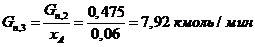 . (177, 408 м3/мин)
. (177, 408 м3/мин)
4) Количество пропилена, пошедшее на побочные реакции:
Gn,4 = Gn,2 - Gn,1 = 0,475 - 0,356 = 0,119
кмоль/мин.
) Селективность второй побочной реакции:
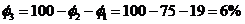 .
.
6) Количество пропилена, пошедшего на 1-ую побочную
реакцию:
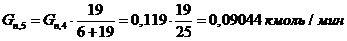
7) Количество пропилена пошедшего на 2-ую побочную
реакцию:
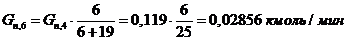
8) Количество непрореагировавшего пропилена:
Gn,7 = Gn,3 - Gn,2 = 7,92 - 0,475 = 7,445
кмоль/мин.
) Процентное содержание кислорода и азота воздуха в
пропилено-воздушной смеси
 объем кислорода в смеси
объем кислорода в смеси
 объем азота в смеси
объем азота в смеси
10) Объем кислорода и азота в смеси (определяется по
пропилену):
, 408 - 9,5 %, Х - 18,48 % Gn,8 (О2) =345,1 м3/мин
или 15,4 кмоль/мин.
,408 - 9,5 %, Х - 69,52 %Gn,9 (N2) =1298 м3/мин
или 57,95 кмоль/мин.
) Количество примеси пропан:
,408 - 9,5 %, Х - 2,5 %Gn,10 =46,68 м3/мин
или 2,084 кмоль/мин.
) Количество кислорода, пошедшего на основную реакцию:
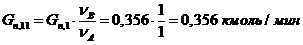
13) Количество кислорода, пошедшего на 1-ую побочную
реакцию:
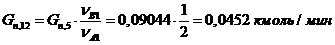
14) Количество кислорода, пошедшего на 2-ую побочную
реакцию:
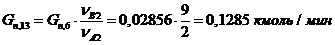
15) Количество непрореагировавшего кислорода:
Gn,14 = Gn,8 - Gn,11 - Gn,12 - Gn,13=
15,4-0,356-0,0452-0,1285= 14,8703 кмоль/мин.
Расход
) Количество акролеина, образовавшего в основной
реакции:
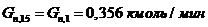 .
.
17) Количество воды, образовавшего в основной реакции:
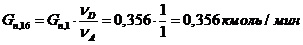
18) Количество 2СН3С (О) СН3,
образовавшего в первой побочной реакции:
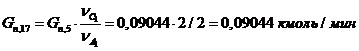
19) Количество СО2, образовавшего во второй
побочной реакции:
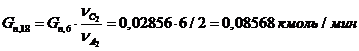
20) Количество воды, образовавшейся во второй побочной
реакции:
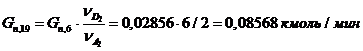
Таблица № 3. Материальный баланс синтеза акролеина
|
Сырье
|
Приход
|
|
кмоль/мин.
|
% моль
|
кг/мин
|
% масс.
|
м3/мин
|
% об.
|
|
С3Н6
(42) С3Н8 (44) О2 (32) N2 (28)
|
7,92 2,084 15,4 57,95
|
9,5 2,5 18,48
69,52
|
332,64 91,696
492,8 1622,6
|
13,1 3,61 19,4
63,89
|
177,408 46,68
345,1 1298
|
9,5 2,5 18,48
69,52
|
|
Итого
|
83,354
|
100
|
2539,74
|
100
|
1867,18
|
100
|
|
Продукты
реакции
|
Расход
|
|
1. С3Н4О
(56) 2. Н2О (сумм) (18) 3 С3Н6 (непр.) (42)
4. С3Н6О (58) 5. О2 (непрореаг) 6. СО2 7.
Н3Н8 (44) 7. N2 (28)
|
0,356 0,4417 7,445 0,09044 14,8703 0,0857 2,084 57,95
|
0,427 0,53
8,935 0,109 17,847 0,104 2,501 69,547
|
19,936 7,9506
312,69 5,245 475,85 3,7708 91,69 1622,6
|
0,785 0,313
12,31 0, 207 18,74 0,148 3,61 63,887
|
7,974 9,895
166,77 2,025 333,095 1,92 46,68 1298
|
0,427 0,53
8,936 0,108 17,847 0,103 2,5 69,55
|
|
Итого
|
83,324
|
100
|
2539,74
|
100
|
1866,36
|
100
|
|
|
|
|
|
|
|
|
2. Тепловой
баланс стадии синтеза
Таблица № 4. Данные для расчета теплового баланса
|
Температура
исходных реагентов 0 С
|
315
|
|
Температура
продуктов реакции 0 С
|
395
|
|
Тепловые потери
от прихода тепла %
|
9
|
Термодинамические параметры веществ, участников реакции
представлены в таблице № 5:
Таблица № 5
|
Вещество
|
∆Н298
|
Сp = ƒ (t) Дж/моль. К
|
|
кДж/моль
|
а
|
в*103
|
с*106
|
с/*10-5
|
|
С3Н6
|
20,41
|
12,44
|
188,38
|
-47,6
|
-
|
|
С3Н8
|
-103,9
|
-4,80
|
307,3
|
-160,16
|
-
|
|
О2
|
0
|
31,46
|
3,39
|
-
|
-3,77
|
|
N2
|
191,5
|
27,88
|
4,27
|
-
|
-
|
|
С3Н4О
|
-80,77
|
31,26
|
150
|
-49,06
|
-
|
|
Н2О
|
-241,81
|
30
|
10,71
|
-
|
0,33
|
|
С3Н6О
|
-217,57
|
22,47
|
201,8
|
-63,5
|
-
|
|
СО2
|
-393,51
|
44,14
|
9,04
|
-
|
-8,54
|
. Количество тепла, которое поступает с исходными
реагентами:
Тисх= 315+273=588 К.
.1 Определим количество тепла, которое поступает в реактор с
пропиленом:
СрС3Н6 =а+вТi+cTi2 =12,44 + 188,38×10-3 × 588 - 47,6×10-6 ×5882 = 106,75
Дж/моль×К,
QС3Н6 = Gi×Cpi×Ti = 7,92 × 106,75 ×588 = 497130 кДж/мин.
.2 Определим количество тепла, которое поступает с примесью
пропан:
СрС3Н8 =а+вТi+cTi2 = - 4,8+307,3× 10-3×588 - 160,16×10-6×5882 = 120,52
Дж/моль×К
QС3Н8 = Gi×Cpi×Ti = 2,084 × 210,52 ×588=147684 кДж/мин.
.3 Определим количество тепла, которое поступает с кислородом
воздуха:
СрО2 =а+вТi+c // Ti2 = 31,46+3,39×10-3×588 - 3,77×105/5882=
32,36 Дж/моль×К,
Q О2 = Gi×Cpi×Ti = 15,4 × 32,36 ×588=293026 кДж/мин
.4 Определим количество тепла, которое поступает с азотом
воздуха:
СрN2 =а+вТi+c // Ti2= 27,88+4,27×10-3×588=30,39 Дж/моль×К
Q N2 = Gi×Cpi×Ti = 57,95 × 30,39 ×588= 1035527 кДж/мин
Суммарное количество тепла, которое поступает в реактор с
исходными реагентами:
 = 497130 + 147684 + 293026+1035527 = 1973367 кДж/мин.
= 497130 + 147684 + 293026+1035527 = 1973367 кДж/мин.
. Определим количество тепла, выделяющееся в результате
химического превращения.
.1 Рассчитаем тепловой эффект химических реакций при температуре
Тj = 668К
Основная реакция: СН2=СН-СН3 + О2
= СН2=СН-СНО + Н2О
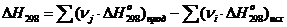 = ( (-80,77) + (-241,81)) - (20,41+0) =-342,99 кДж/моль
= ( (-80,77) + (-241,81)) - (20,41+0) =-342,99 кДж/моль
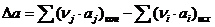 = (31,26+30) - (12,44+31,46) =17,36
= (31,26+30) - (12,44+31,46) =17,36
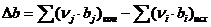 = (150+10,71) ×10-3
- ( (188,38+3,39) ×10-3)
=-31,06×10-3
= (150+10,71) ×10-3
- ( (188,38+3,39) ×10-3)
=-31,06×10-3
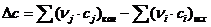 = ( - 49,06×10-6)
- (-47,7×10-6) = - 1,46 ×10-6
= ( - 49,06×10-6)
- (-47,7×10-6) = - 1,46 ×10-6
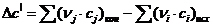 =0,33×105
- (-3,77×105) =4,1×105
=0,33×105
- (-3,77×105) =4,1×105
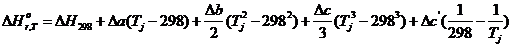 =
=
=-324,99×103+17,36
(668-298)
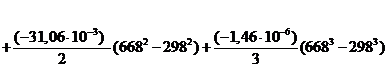
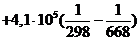 =-341487 кДж/моль,
=-341487 кДж/моль,
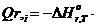 Gi
(j), = - (-341487 × 0,356) =121569 кДж/мин
Gi
(j), = - (-341487 × 0,356) =121569 кДж/мин
.2 Тепловой эффект для первой побочной реакции:
СН2=СН-СН3 + О2= 2СН3С
(О) СН3
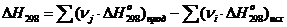 = (2×
(-217,57)) + (2×20,41+1×0) =-457,96 кДж/моль
= (2×
(-217,57)) + (2×20,41+1×0) =-457,96 кДж/моль
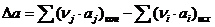 = (2×22,47) -
(2×12,44+31,46) =-11,14
= (2×22,47) -
(2×12,44+31,46) =-11,14
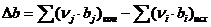 = (2×201,8) ×10-3 - ( (2×188,38+3,39) ×10-3) =23,61×10-3
= (2×201,8) ×10-3 - ( (2×188,38+3,39) ×10-3) =23,61×10-3
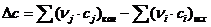 = 2× ( - 63,5×10-6) - (2× (-47,7×10-6) +1×0) = - 31,8 ×10-6
= 2× ( - 63,5×10-6) - (2× (-47,7×10-6) +1×0) = - 31,8 ×10-6
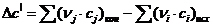 =0- (-3,77) ×105
=-3,77×105
=0- (-3,77) ×105
=-3,77×105
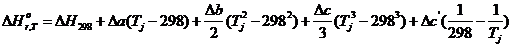 =
=
=-475,96×103+
( (-11,14) (668-298))
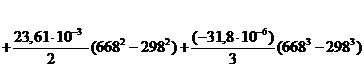
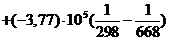 = - 479442 Дж/моль,
= - 479442 Дж/моль,
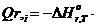 Gi
(j), = - (-479442 × 0,09044) =43360 кДж/мин
Gi
(j), = - (-479442 × 0,09044) =43360 кДж/мин
.3 Тепловой эффект для второй побочной реакции:
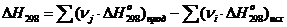 = (6×
(-393,51) + 6×
(-241,81) _- (2×20,41+9×0) = - 3852 кДж/моль
= (6×
(-393,51) + 6×
(-241,81) _- (2×20,41+9×0) = - 3852 кДж/моль
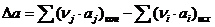 = (6×44,14+6×30) - (2×12,44+9×31,46)
=136,82
= (6×44,14+6×30) - (2×12,44+9×31,46)
=136,82
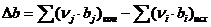 = (6×9,04+6×10,71) ×10-3) - ( (2×188,38+9×3,39) ×10-3) = - 288,7×10-3
= (6×9,04+6×10,71) ×10-3) - ( (2×188,38+9×3,39) ×10-3) = - 288,7×10-3
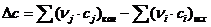 = (6×0+6×0) - (2× (-47,7×10-6))
= 95,2 ×10-6
= (6×0+6×0) - (2× (-47,7×10-6))
= 95,2 ×10-6
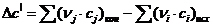 = (6× (-8,54)
+6×0,33) ×105 - (2×0+9× (-3,77×105) =-15,33×105
= (6× (-8,54)
+6×0,33) ×105 - (2×0+9× (-3,77×105) =-15,33×105
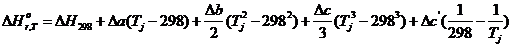 =
=
=-3852×103+136,82
(668-298))
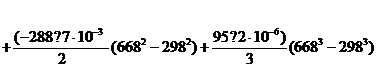
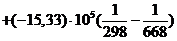 = - 3847899 Дж/моль
= - 3847899 Дж/моль
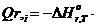 Gi
(j), = - (-3847899 × (0,08568+0,08568) =659375 кДж/мин
Gi
(j), = - (-3847899 × (0,08568+0,08568) =659375 кДж/мин
Суммарное количество тепла, выделяемое в ходе химической реакции:
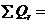 121569 +43360 +659375 = 824304 кДж/мин.
121569 +43360 +659375 = 824304 кДж/мин.
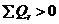 -
-
реакция экзотермическая, его значение ставим в приход теплового
баланса.
. Так как при данной температуре не происходит фазовое
превращение, то Qф = 0
Расход тепла
4. Определим количество тепла, требуемое для нагревания
исходных реагентов до температуры реакции.
Так как температура реакции на входе в реактор отличается от
температуры в зоне реакции, то теплоемкость веществ участников реакции
рассчитаем при средней температуре:
Тср = (588+668) /2 = 628 К.
.1 Количество тепла, необходимое для нагревания пропилена до
температуры реакции:
СрС3Н6 = а + вТср + сТср2
= 12,44 + 188,38×10-3 × 628 - 47,6×10-6 ×6282=111,969
Дж/моль*КС3Н6 = 7,92 × 111,969 × (668-588) =70943 кДж/мин
.2 Количество тепла, необходимое для нагрева азота до
температуры реакции:
СрN2 = а + вТср + с // Тср2
= 27,88 + 4,27×10-3 × 628=30,56 Дж/моль*КС3Н6
= 57,95 × 30,56 × (668-588) =141676 кДж/мин
.3 Количество тепла, необходимое для нагрева кислорода до
температуры реакции:
СрО2 = а + вТср + с // Тср2
= 31,46 + 3,39×10-3 × 628+ (-3,77×10-6) /6282=32,63
Дж/моль*КО2 = 32,63 × 15,4 × (668-588) =40200 кДж/мин
.4 Количество тепла, необходимое для нагрева пропана:
СрС3Н8 = а + вТср + сТср2
= - 4,80 + 307,3×10-3 × 628 - 160,16×10-6 ×6282 =125,0
Дж/моль*КС3Н6 = 2,084 × 125 × (668-588) =20840 кДж/мин
Суммарное количество теплоты, которое необходимо для нагрева
исходных реагентов до температуры реакции:
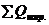 = 70943 +141676 +40200+20840 =273659 кДж/мин.
= 70943 +141676 +40200+20840 =273659 кДж/мин.
. Количество тепла, которое выходит из реактора с продуктами
реакции при температуре Tj = 668 K,
.1 Количество тепла, которое выходит с акролеином:
СрС3Н4О = а + вТср + сТср2
= 31,26 + 150×10-3
× 668 - 49,06×10-6 ×6682 =109,56 Дж/моль*К, QС3Н4О = 0,356 × 109,56 × 668=26054 кДж/мин
.2 Количество тепла, выходящее с водяным паром (суммарное)
СрН2О = а + вТср + с // Тср2
= 30 + 10,71×10-3 × 668+ (0,33×105) /6682=37,23 Дж/моль*КН2О
= 0,4417 × 37,23 × 668=10984,9 кДж/мин
.3 Количество тепла, выходящее с ацетоном:
СрС3Н6О = а + вТср + сТср2
= 22,47 + 201,8×10-3
× 668 - 63,5×10-6 ×6682 =128,93 Дж/моль*КС3Н6О = 0,09044 × 128,93 × 668=7789 кДж/мин
.4 Количество тепла, выходящее с углекислым газом:
СрСО2 = а + вТср + с // Тср2
= 44,14 + 9,04×10-3
× 668- (8,54×105) /6682=48,26 Дж/моль*К, QСО2
= 0,0857 × 48,28 × 668=2763 кДж/мин
.5 Количество тепла, выходящее с пропаном (примесью):
СрС3Н8 = а + вТср + сТср2
= - 4,8 + 307,3×10-3
× 668 - 160,16×10-6 ×6682 =129 Дж/моль*КС3Н8
= 2,084 × 129 × 668=179582 кДж/мин
.7 Количество тепла, выходящее с непрореагировавшим кислородом:
СрО2 = а + вТср + с // Тср2
= 31,46 + 3,39×10-3
× 668+ (-3,77×105) /6682=33,22 Дж/моль*КО2
= 14,8703 × 33,22 × 668=329986 кДж/мин
.8 Тепло с непрореагировавшим пропиленом:
СрС3Н6 = а + вТср + сТср2
= 12,44 + 188,38×10-3
× 668 - 47,6×10-6 ×6682 =117,04 Дж/моль*КС3Н6 = 7,445 × 117,04 × 668=582070 кДж/мин
.9 Количество тепла выходящее с азотом (примесь):
СрN2 = а + вТср + с // Тср2
= 27,88 + 4,27×10-3
× 668=30,73 Дж/моль*КN2 = 57,95 × 30,73 × 668=1189576 кДж/мин
Суммарное количество тепла, которое выходит из реактора с
продуктами реакции:
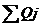 =26054 +10984,9 +7789+ 2763 + 179582 + 329986+582070+1189576 =
2328804 кДж/мин.
=26054 +10984,9 +7789+ 2763 + 179582 + 329986+582070+1189576 =
2328804 кДж/мин.
. Определим потери тепла:
приход = ∑Qi. + ∑Qr = 1973367 +824304
=2797671 кДж/мин,потерь = 0,09 × 2797671 = 251790 кДж/мин.
. Определим количество тепла, отводимое (подводимое) от реактора
при помощи теплоносителя (хладагента):
Орасход = Qj + Qнагр. + Qпотерь=2328804
+273659 +251790 =2854253 кДж/мин,F = 2854253 - 2797671 = 56582
кДж/мин.F > 0, тепло необходимо подводить, его значение ставим в
расход тепла с отрицательным знаком.
. Исходя из тепловой нагрузки на реактор определим поверхность
теплообмена.
F=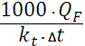
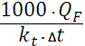 где QF=56582 кДж/мин.
где QF=56582 кДж/мин.
Kt= 48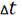
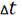 =
=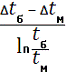
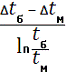
Принимаем начальную температуру хладагента 500С,
конечную
0С
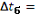
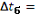 355-50=305 0С
355-50=305 0С
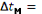
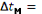 355-200=155 0С
355-200=155 0С
 =
= =
=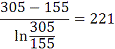 0С
0С
F=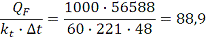 м2
м2
Результаты расчетов сводим в таблицу теплового баланса.
Таблица № 6. Тепловой баланс стадии синтеза
|
Приход тепла
|
Расход тепла
|
|
Тепловой поток
|
кДж/мин
|
%
|
Тепловой поток
|
кДж/мин
|
%
|
|
Qi.
|
1973367
|
70,54
|
Qj
|
2328804
|
83,24
|
|
Qr
|
824304
|
29,46
|
Qнагр
|
273659
|
|
|
|
Qпотерь
|
251790
|
8,99
|
|
|
|
QF
|
-56582
|
-2,0
|
|
Итого
|
2797671
|
100
|
Итого
|
2797671
|
100
|
3.
Термодинамический анализ основной реакции и расчет константы равновесия
Определить вероятность протекания реакции и значение
константы равновесия:
СН2=СН-СН3 + О2 = СН2=СН-СНО
+ Н2О
|
Температурный
интервал, оС
|
30 - 830
|
|
Шаг изменения
температуры, оС
|
80
|
Таблица № 7. Термодинамические свойства веществ
|
Вещество
|
∆Hof,298,кДж/моль
|
∆Sof,298,Дж/мольК
|
Ср =
f (T) #
|
|
|
|
a
|
b∙103
|
c∙106 с’∙10-5
|
|
Пропилен
Кислород (г) Акролеин Вода (г)
|
20,41 0 80,77
241,81
|
266,94 205,03
287,90 188,74
|
12,44 31,46
31,26 30
|
188,38 3,39 150
10,71
|
-47,6 3,77
49,06 0,33
|
. Вычисляем тепловой эффект данной реакции, протекающей в
заданном интервале температур.
Изменение энтальпии реакции при стандартных условиях:
∆Нrо298 = - 342,99 кДж/моль, ∆а = 17,36 ∆b = - 31,06∙10-3
∆с = - 1,46∙10-6 ∆с’
= 4,1∙105
При t=30 0 C =303К
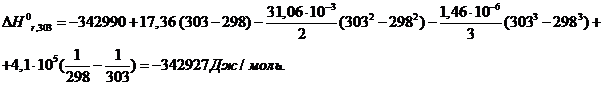
При t=830 0 C =1103К

Результаты расчета теплового эффекта при других температурах
представлены в таблице
1. Определим изменение энтропии в этом интервале
температур.
Изменение энтропии реакции при стандартных условиях:
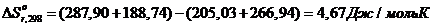

При t=830
0 C =1103К
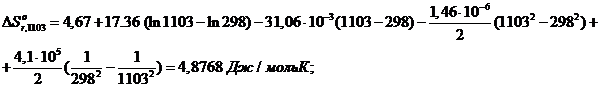
Результаты расчета изменения энтропии для остальных температур
представлены в таблице.
2. Вычисляем изменение изобарно-изотермического
потенциала системы (свободной энергии Гиббса) в ходе реакции при стандартном
давлении Р = 1 атм. и при заданном интервале температур и оцениваем
термодинамическую вероятность протекания данной реакции:
∆G0r,303 = - 342927 - 303∙4,8768
= - 344404 Дж/моль
∆G0r,1103 = - 346166 - 1103∙3,7022
= - 350323 Дж/моль
Результаты расчета значений энергии Гиббса для остальных
температур представлены в таблице.
. Из уравнения изотермы Вант-Гоффа, определяем
константу равновесия реакции
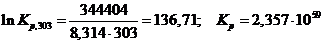
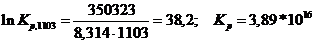
Результаты проведенных расчетов сводим в таблицу зависимости
термодинамических функций от температуры.
Таблица № 8. Зависимость термодинамических функций от
температуры
|
№
|
Т, К
|
∆Н0r,T Дж/моль
|
∆S0r,T Дж/моль. К
|
∆G0r,T Дж/моль
|
ln Kp
|
Kp
|
|
1
|
303
|
-342927
|
4,8768
|
-344404
|
136,71
|
2,357*1059
|
|
2
|
383
|
-342122
|
7,2549
|
-344900
|
108,31
|
1,09*1047
|
|
3
|
463
|
-341621
|
8,4549
|
-345535
|
89,76
|
9,63*1038
|
|
4
|
543
|
-341381
|
8,9394
|
-346235
|
76,69
|
2,03*1033
|
|
5
|
623
|
-341383
|
8,9395
|
-346952
|
66,98
|
1,23*1029
|
|
6
|
703
|
-341619
|
8,5878
|
-347656
|
59,48
|
6,8*1025
|
|
7
|
783
|
-342081
|
7,9677
|
-348319
|
53,5
|
1,72*1023
|
|
8
|
863
|
-342767
|
7,1347
|
-348924
|
48,63
|
1,31*1021
|
|
9
|
943
|
-343677
|
6,1281
|
-349455
|
44,57
|
2,27*1019
|
|
10
|
1023
|
-344810
|
4,9768
|
-349901
|
41,14
|
7,3*1017
|
|
11
|
1103
|
-346166
|
3,7022
|
-350323
|
38,2
|
3,89*1016
|
По рассчитанным данным строим графики зависимостей
∆Н0r,T=f (T)
∆S0r,T=f (T)
∆G0r,T=f (T)
ln Kp=f (1/T)
Т.к. Кр>>1, равновесие в системе смещено в сторону
образования продуктов реакции (выход продукта велик). Реакция имеет
самопроизвольный характер на все протяжении интервала температур. Из расчета Кр
видно, что выход продукта велик и при малых значения температур и дальнейшее
увеличение температуры ведет к снижению скорости реакции.
Таким образом, из полученных результатов расчета видно, что
во всем интервале температур реакция экзотермическая (∆Нr,T <0).
4.
Кинетические расчеты
Имеются экспериментальные данные зависимости концентрации реагента
от времени  и зависимости константы скорости реакции
от температуры.
и зависимости константы скорости реакции
от температуры.
Таблица № 9. Кинетические данные
|
 , сек. со, моль/л , сек. со, моль/л
|
|
|
0
|
0,10
|
|
3
|
0,091
|
|
6
|
0,082
|
|
9
|
0,073
|
|
13
|
0,064
|
|
18
|
0,055
|
|
23
|
0,046
|
|
30
|
0,037
|
|
38
|
0,028
|
|
50
|
0,019
|
|
69
|
0,01
|
Таблица № 10.
Экспериментальные данные константы скорости реакции от температуры
|
Температура, К
|
605
|
620
|
635
|
650
|
|
К, с-1
|
231,73
|
267,07
|
305,76
|
347,86
|
Необходимо определить порядок реакции, энергию активации и
составить полное кинетическое уравнение.. Определение порядка реакции.
Порядок реакции определяется методом постановки и графическим
методом. Согласно метода подстановки, подставляем значения концентрации и
времени в уравнения реакции.
) Для момента времени τ=3 сек.
Для реакции первого порядка:
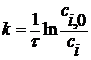 =
=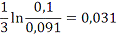
Для реакции второго порядка:
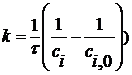 =
=
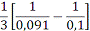 =0,329
=0,329
Для реакции третьего порядка:
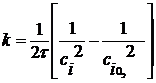 =
=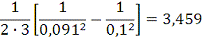
2) Для момента времени τ=6 сек
Для реакции первого порядка:
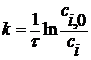 =
=
Для реакции второго порядка:
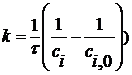 =
=
 =0,366
=0,366
Для реакции третьего порядка:
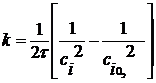 =
=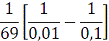 =0,7219
=0,7219
3) Для момента времени τ=69 сек
Для реакции первого порядка:
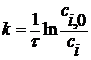 =
=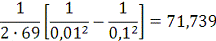
Для реакции второго порядка:
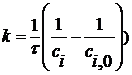 =
=
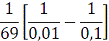 =0,7219
=0,7219
Для реакции третьего порядка:
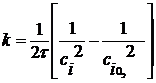 =
=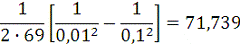
Значения констант скоростей для времени τ.
Таблица № 11
|
№
|
k-для реакции 1-го порядка
|
k-для реакции 2-го порядка
|
k-для реакции 3-го порядка
|
|
1
|
0,031
|
0,329
|
3,459
|
|
2
|
0,033
|
0,366
|
4,06
|
|
3
|
0,035
|
0,411
|
4,869
|
|
4
|
0,034
|
0,432
|
5,543
|
|
5
|
0,033
|
0,454
|
6,41
|
|
6
|
0,034
|
0,51
|
8,099
|
|
7
|
0,033
|
0,567
|
10,51
|
|
8
|
0,033
|
0,677
|
15,467
|
|
9
|
0,029
|
0,735
|
26,7
|
|
10
|
0,033
|
1,3
|
71,739
|
|
кср
|
0,0328
|
0,5781
|
15,6856
|
|
Δ %
|
3,41
|
33,8
|
85,5
|
Погрешность расчета констант скоростей Δ определяется:
Δабc=| Кср-К|
Δабc. ср=
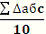
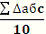
Δ%= 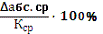
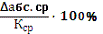
Для реакции первого порядка: Δ%= 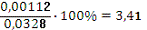
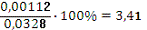 %
%
Для реакции второго порядка: Δ%= 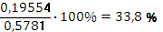
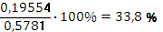
Для реакции третьего порядка: Δ%= 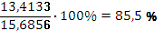
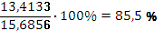
Как видно из проведенных расчетов, близкие между собой значения
получены из уравнения I-го порядка,
следовательно, реакция протекает по кинетическому уравнению
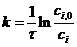 .
.
4) Для определения порядка реакции графическим методом,
строят графические зависимости в координатах:
 для реакций первого порядка,
для реакций первого порядка,
 для реакций второго порядка,
для реакций второго порядка,
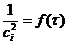 для реакций третьего порядка.
для реакций третьего порядка.
Данные для построения графиков.
Таблица № 12
|
τ сек
|
С моль/л
|
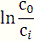
|

|
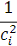
|
|
3
|
0,091
|
0,094
|
10,98
|
120,75
|
|
6
|
0,082
|
0, 198
|
12, 19
|
148,72
|
|
9
|
0,073
|
0,315
|
13,69
|
187,65
|
|
13
|
0,064
|
0,446
|
15,625
|
244,14
|
|
18
|
0,055
|
0,598
|
18,18
|
330,57
|
|
23
|
0,046
|
0,776
|
21,74
|
472,59
|
|
30
|
0,037
|
0,994
|
27,03
|
730,46
|
|
38
|
0,028
|
1,273
|
35,71
|
1275,5
|
|
50
|
0,019
|
1,66
|
52,63
|
2770
|
|
69
|
0,01
|
2,3
|
100
|
10000
|
Прямолинейная зависимость получена в координатах lnci,0/ci, = f (τ), следовательно, исследуемая реакция первого порядка.
II Определение энергии активации.
Энергию активации определим аналитически и графически.
) Для определения аналитическим методом используем
формулу:

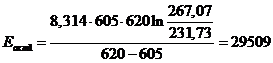 Дж/моль
Дж/моль
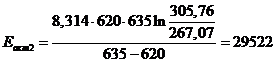 Дж/моль
Дж/моль
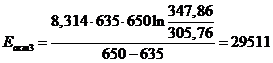 Дж/моль
Дж/моль
Среднее значение энергии активации: <Еакт> =29514
Дж/моль
2) Строим график зависимости в координатах lnK =f (1/T).
График зависимости представлен на рисунке № 8
Таблица № 12 Данные для построения графика.
|
Т, К
|
k
|
lnk
|
1/Т
|
|
605
|
231,73
|
5,45
|
0,00165
|
|
620
|
5,59
|
0,00161
|
|
635
|
305,76
|
5,72
|
0,00157
|
|
650
|
347,86
|
5,85
|
0,00153
|
По графику определим тангенс угла наклона
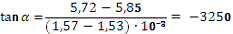
Определим энергию активации по уравнению:
Еакт= - R 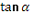
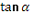 = - 8,324 (-3250) = 27020, 5 Дж/моль
= - 8,324 (-3250) = 27020, 5 Дж/моль
Относительную ошибку между значениями энергии активации,
полученными аналитическим и графическим методами.
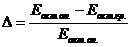 ,
, 
По графику зависимости, построенному в координатах lnK =f (1/T), определим предэкспоненциальный
множитель:
Ln A0=7,43 A0=1685
и по рассчитанным значениям порядка реакции и энергии активации
запишем общее кинетическое уравнение:
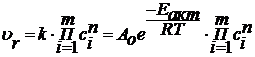 ,
,
где Ао - предэкспоненциальный множитель;
n - порядок реакции.
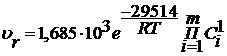
Установлено, что реакция получения акролеина протекает по
уравнению первого порядка, что подтверждается проведенными расчетами
аналитическим и графическим методами и т.к. концентрация одного из реагентов
находится в постоянном избытке по отношению к другому. Энергия активации для
данного процесса составляет порядка 29514 Дж/моль.
5.
Принципиальная технологическая схема стадии синтеза
Принципиальная схема синтеза акролеина представлена на
рисунке 9.
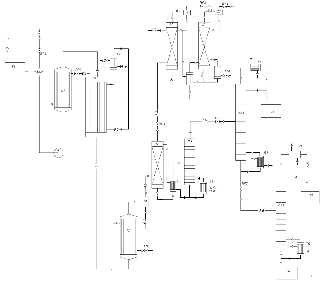
Описание технологической схемы.
Пропилен из ёмкости Е1 смешивается с воздухом в смесителе 1
СМ1 и газодувкой Н-1 подаётся в подогреватель П1, в котором реакционная смесь
подогревается до 315°С греющим паром. Из подогревателя П1 реакционная смесь
поступает в реактор Р, где на катализаторе происходит окисление пропилена в
акролеин. Выделяющееся тепло реакции снимается циркулирующим
высокотемпературным теплоносителем (кремнийорганическая жидкость
тетра-м-крезоксисилан [ТСК]). ТСК циркулирует через котёл-утилизатор КУ, в
котором используется для выработки пара. После реактора реакционная смесь
поступает в холодильник Х1, охлаждаемый водой. Для отделения акролеина от
реакционной смеси смесь подаётся в абсорбер А1, орошаемый водой. Акролеин
хорошо растворяется в воде. Водный раствор акролеина, выходящий с нижней части
абсорбера А1, направляется на предварительную ректификацию в ректификационную
колонну РК1. Выходящие с верха абсорбера А1 реакционные газы, содержащие
непрореагировавший пропилен, кислород, а также оксид и диоксид углерода, азот,
направляются на дальнейшую очистку в абсорбер А2. В ректификационной колонне
РК1 акролеин и другие продукты окисления отделяются от промывной воды. Вода,
вытекающая из низа ректификационной колонны РК1, направляется на орошение
абсорбера А1. Акролеин и другие продукты окисления отводятся сверху
ректификационной колонны РК1 и направляются на ректификацию в ректификационную
колонну РК2, где происходит отделение от акролеина побочных продуктов окисления
(ацетальдегид). Сверху колонны РК2 отбирается ацетальдегид, собирается в
ёмкость Е2 и затем отгружается потребителям. С низа колонны РК2 отбирается
акролеин-сырец, который направляется на окончательную ректификацию в
ректификационную колонну РК3. С верха колонны РК3 отбирается товарный акролеин,
который собирается в ёмкости Е3 и по мере накопления отгружается потребителю. С
низа колонны РК3 отбирается кубовые остатки, которые собираются в ёмкости Е4 и
затем направляются на обезвреживание. В абсорбере А2 реакционные газы,
поступающие из абсорбера А1, очищаются от СО2. Для этого в верх абсорбера
подаётся поташ. Поташ вступает в реакцию с СО2 с образованием гидрокарбоната
калия:
К2СО3 + СО2 + Н2О → 2КНСО3
Очищенные от СО2 реакционные газы с верха абсорбера А2
направляются в цех обезвреживания отходов, где используются при сжигании
органосодержащих промстоков. С низа колонны отбирается гидрокарбонат калия,
который поступает в десорбер Д, где из него выделяется СО2. Выделившийся в
десорбере СО2 направляется в цех получения углекислоты. Стекающий с низа
десорбера гидрокарбонат калия снова направляется на орошение абсорбера А2.
Список
литературы
1. Лебедев
Н.Н. Химия и технология основного органического и нефтехимического синтеза -
Л.: Химия, 1988-592с.
2. Краткий
справочник физико-химических величин. Под ред. К.П. Мищенко и А.А. Равделя -
Л.: Химия, 1972-80c.
. Расчеты
химико-технологических процессов под ред. Мухленова И.П. - Л.: Химия, 1977-80с.