Изучение степени распространения высоко контагиозного птичьего гриппа и определение напряженности иммунитета в поствакцинальный период у вакцинированных птиц Акмолинской области
Введение
грипп птица вирус казахстан
Всемирная организация здравоохранения (ВОЗ) уже
давно признает, что безопасность, в особенности биологическая, является важной
международной проблемой.
Среди инфекционных болезней млекопитающих и
птиц, грипп представляет наиболее важную и актуальную проблему в связи с
возникновением в природе новых штаммов, вызывающих эпизоотии и эпидемии.
Уникальным возбудителем гриппа животных является вирус гриппа рода А, который,
обладает способностью изменять свою антигенную структуру и патогенность в
отношении разных биологических видов.
Наибольшую опасность в
последнее время представляет один из его подтипов - H5N1, который не только
нанес огромный экономический ущерб промышленному птицеводству, но и перешел,
так называемый видовой барьер. В мире с 2003 по 2006 г. гриппом птиц заболело
258 человек, из которых 153 скончались.
Заболевание установлено во многих странах мира,
в том числе и в странах СНГ. Экономический ущерб слагается из убытков от
падежа, вынужденного убоя и выбраковки птиц, потерь от снижения продуктивности
и затрат на проведение карантинных и оздоровительных мероприятий.
В связи со сложной эпизоотической обстановкой по
гриппу птиц в мире в 2006 г. проводился плановый лабораторный мониторинг гриппа
птиц с целью своевременного выявления очагов инфекции иммунологического
контроля и специфической вакцинопрофилактики данного заболевания в
индивидуальных подворьях граждан.
Вспышки высоко патогенного птичьего гриппа H5N1,
начавшиеся в юго-восточной Азии в середине 2003 г. и распространившиеся в
настоящее время на некоторые части Европы, являются самыми крупными и
серьезными зарегистрированными вспышками. На сегодняшний день вспышки болезни
были зарегистрированы в девяти азиатских странах (перечисленных в порядке
регистрации): Республике Корея, Вьетнаме, Японии, Таиланде, Камбодже, Лаосской
Народно-Демократической Республике, Индонезии, Китае и Малайзии. В трех из них
- Японии, Республике Корея и Малайзии - вспышки болезни были ликвидированы, и в
настоящее время эти страны считаются свободными от болезни. В некоторых из
первоначально охваченных болезнью странах Азии вирус стал эндемическим.
Масштабность драматического
воздействия на человечество гриппа птиц становится ощутимой, если принять во
внимание многомиллиардную численность диких и домашних птиц на Земле. Крайне
усугубляет опасность пандемического распространения воздушно-капельный путь
передачи смертельного вируса. Фактором дестабилизации во всем мире является еще
и то, что вирусы гриппа птиц (ВГП) переносятся на большие расстояния дикими
стаями, среди которых водоплавающие являются естественным, постоянно
функционирующим резервуаром культивирования возбудителя. Способствует
глобальному распространению вирусоносительство, как правило, не сопровождаемое
клинически выраженными заболеваниями. Особенность эту следует рассматривать
ключевой с эпизоотологических позиций, так как заражение вирусом гриппа птичьих
популяций не снижает их потенциальных возможностей преодолевать значительные
расстояния при ежегодных весенне-осенних миграциях.
На сегодняшний день случаи заболевания людей
были зарегистрированы в семи странах, большинство из которых расположены в
Азии: Вьетнаме, Индонезии, Ираке, Камбодже, Китае, Таиланде и Турции. У первых
пациентов, зарегистрированных во Вьетнаме, во время нынешней вспышки болезни
симптомы заболевания появились в декабре 2003 г., а инфекция H5N1 была
подтверждена 11 января 2004 г. Сообщения из Таиланда о первых случаях
заболевания поступили 23 января 2004 г. Сообщение о первом случае заболевания в
Камбодже поступило 2 февраля 2005 г. Следующей страной стала Индонезия, которая
подтвердила свой первый случай инфекции 21 июля. Китай сообщил о первых двух
случаях заболевания 16 ноября 2005 г. Подтверждение первых случаев в Турции
поступило 5 января 2006 г., после чего, 30 января 2006 г., последовало
сообщение о первом случае заболевания в Ираке. Все случаи заболевания людей
совпадали по времени со вспышками высоко патогенного птичьего гриппа H5N1 среди
домашних птиц. На сегодняшний день страной, пораженной болезнью в наибольшей
степени, является Вьетнам, где произошло более 90 случаев заболевания.
Продолжающиеся вспышки высокопатогенного
птичьего гриппа H5N1 среди домашней птицы в Азии и, в последнее время, в Европе
вызывают обеспокоенность по поводу источника инфекции и опасности для людей
различных форм воздействия. Согласно имеющимся данным, подавляющее большинство
заболевших людей заразились в результате прямого контакта с инфицированной
живой или забитой птицей. Воздействие также может иметь место при вдыхании
вируса с пылью и, возможно, в результате контакта с поверхностями, зараженными
вирусом. Инфицированная птица выделяет вирус в слюне и фекалиях. ВОЗ находится
в курсе выражаемой в последнее время обеспокоенности по поводу того, что вирус
также может распространиться на людей в результате контакта с зараженными
продуктами из птицы. На сегодняшний день не существует каких-либо
эпидемиологических данных, указывающих на то, что болезнь может передаваться
людям через должным образом приготовленные пищевые продукты (даже если они были
инфицированы вирусом до приготовления), или что продукты, отправленные из
затронутых районов, являются источником инфицирования людей.
Перелетные водоплавающие птицы, особенно дикие
утки, являются естественным резервуаром всех вирусов гриппа А. Птичий грипп
существует также в высокопатогенной форме. Среди 16 основных подтипов вируса
гриппа А лишь подтипы штаммов H5 и Н7 вызывают высокопатогенную форму птичьего
гриппа, которая является высококонтагиозной и вызывает быструю смерть среди
подверженных ей видов птицы. Куры и индейки особенно подвержены эпидемиям; в
качестве причины часто рассматривается прямой или косвенный контакт домашнего
поголовья с дикой водоплавающей птицей. Рынки живой птицы также играют важную
роль в распространении эпидемий. Птицы, перенесшие инфекцию, могут выделять
вирус вплоть до 10 дней через слюну и фекалии, способствуя таким образом
дальнейшему распространению.
В отличие от кур, некоторые домашние утки
обладают устойчивостью к вирусу и могут являться носителями вируса, не
обнаруживая симптомов и являясь, таким образом, "скрытым
резервуаром", который продлевает передачу. В последние месяцы растет число
фактов, свидетельствующих о том, что, по крайней мере, некоторые виды
мигрирующих птиц непосредственно распространяют вирус H5N1 в его
высокопатогенной форме в некоторых частях Средней Азии и Европы; ожидается, что
распространение через этого носителя будет продолжаться. Подозрения о том, что
птицы могут разносить высокопатогенный вирус вдоль маршрутов миграций, были
подкреплены после выявления вспышек среди дикой и домашней птицы в Российской
Федерации и сопредельных районах Казахстана начиная с конца августа 2005 года.
В октябре 2005 г. вспышки были выявлены в Турции, Румынии и Хорватии. Через все
эти недавно затронутые районы пролегают миграционные маршруты птиц.
Распространение на новые районы рассматривается в качестве высокой вероятности.
В соответствии с рекомендацией ВОЗ, к павшим диким птицам или птицам с
признаками болезни должны прикасаться только представители властей, обладающие
надлежащими средствами защиты.
В связи с выше изложенным, мы задались целью
изучить степень распространения высоко контагиозного птичьего гриппа и
определить напряженность иммунитета в поствакцинальный период у вакцинированных
птиц Акмолинской области.
Для достижения цели, нами поставлены следующие
задачи:
провести мониторинг птичьего гриппа в мире и в
Республике Казахстан;
изучить методы диагностики птичьего гриппа.
1. Обзор литературы
.1 Эпизоотология гриппа птиц
Ортомиксовирусная инфекция птиц впервые описана
Perroncito 125 лет назад в Италии [1].
За последние 44 года в ВОЗ были зарегистрированы
21 эпизоотия гриппа птиц в различных станах мира, а в ряде стран они
неоднократно повторялись[2].
Крупная эпизоотия среди дикой птицы была
зарегистрирована в 1961 г. в Южной Африке, где эпизоотическим агентом был
высокопатогенный для всех видов птиц вирус А (Н5N3). В СССР вирусы А (H5N1), A
(H5N2), A (H5N3) в 1962 г. были изолированы от кур, а также в 1976 г. - во
время эпизоотии среди диких птиц в Астраханской области. В большинстве стран,
которые в прошлом были охвачены эпизоотиями птичьего гриппа (1959 - 2003 гг.) и
в которых с декабря 2003 г. по апрель 2004 г. были выявлены поражения
высокопатогенными вирусами птиц типа A (H5N1) (Южная Корея, Вьетнам, Япония,
Таиланд, Камбоджа, Китай, Лаос, Индонезия) и подтипов A (H7) и A (H9)
(Пакистан). Домашнюю птицу (кур, уток, индеек) разводят на мелких фермах со
свободным содержанием птиц, на территориях без серьезных ограждений. Это создает
возможность контактов домашней птицы с дикими особями птиц, в т.ч. и
перелетными [2].
В Китае на 60% территории страны в маленьких
крестьянских хозяйствах (на фермах) содержится примерно 13,2 млрд. кур, которые
из-за небольших территорий земельных участков проживают в теснейшем контакте с
людьми, а также с другими домашними (утки и пр.) и дикими птицами и домашними
животными, в т.ч. со свиньями и поросятами, восприимчивыми к инфекциям,
вызываемым вирусами гриппа птиц. В Индонезии, по данным местного министерства
сельского хозяйства, проживает в тесном контакте с людьми и дикой природой
более 1 млрд. кур. Подобная ситуация существует и в других странах
Юго-Восточной и Восточной Азии (рисунок 1).
Основными носителями птичьего гриппа считаются
водоплавающие птицы. Вирусы легко преодолевают межвидовой барьер и передаются
другим видам птиц и млекопитающих. Они выделены от многих видов диких птиц:
уток, гусей, лебедей, чаек, крачек, фазанов, соколов, бакланов и буревестников,
а также от всех видов домашних птиц: кур, гусей, уток, индюков, цесарок,
перепелок и куропаток, страусов, бойцовских петухов и других вольерных птиц. Из
млекопитающих к нему восприимчивы человек и многие домашние (свиньи, лошади) и
дикие (норки, тюлени, китообразные и др.) животные. В популяциях диких
водоплавающих птиц вирусы эволюционно стабильны, сбалансированы и размножаются,
не вызывая манифестных форм заболевания и смертности. Чаще всего межвидовой
перенос приводит к транзиторной инфекции, которая может сопровождаться гибелью
нового хозяина, а при отсутствии эффективных путей передачи к прекращению
эпизоотии. Реже в результате этого могут появляться постоянные, самостоятельные
эволюционные линии вирусов гриппа А. Именно такие линии образовались у
человека, свиней, лошадей и домашней птицы [3].
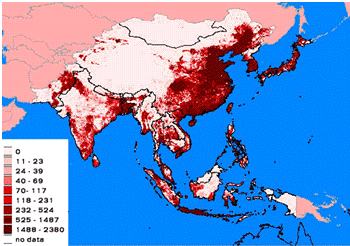
Рисунок 1 - Плотность популяций домашней птицы в
ЮВА
Вирусы птичьего гриппа уникальны в своем
многообразии и изменчивости. Их генетическая лабильность, антигенная
вариабельность, полиморфизм вирионов могут приводить к различного рода мутациям
и гибридизации, обуславливающим высокую вероятность появления штаммов с
измененными свойствами, в том числе с повышенной вирулентностью. У этих вирусов
отсутствуют механизмы корректировки считывания и репарации ошибок репликации
генома (повышается способность к генетическому дрейфу), а полигостальность
выступает как движущий фактор отбора новых шифтовых вирусных субтипов. АIV
устойчивы во внешней среде вне организма теплокровных, особенно при умеренно
низких температурах, и высушивании. Они могут сохраняться в воде при 0оС
более 30 дней (по некоторым данным до 6-8 месяцев), при 22оС - до 4
дней. Особенно большое количество вирусов содержится в фекалиях инфицированных
птиц, сохраняясь там до 3 месяцев. По наблюдениям последних лет достоверно
отмечается увеличение патогенности вируса, его устойчивости, расширение круга
носителей. Так в 2003 году вирионы во внешней среде сохранялись до 2 дней, а в
2004 году - до 6 дней. Инфицированные утки в 2003 году выделяли вирус в течение
10 дней, в 2004 году - до 17 дней и более. В настоящее время вирус увеличил
свою патогенность в отношении кур, гусей, уток, индюшек, свиней, лошадей и
человека. Стало известно о заражении птичьим гриппом мышей и кошек,
резистентных к этому вирусу. В связи с высокой контагиозностью вирус способен
быстро распространяться механическим способом и путем непрямого контакта через
контаминированные корма, клетки, транспорт, оборудование и тару [4].
Эпизоотология птичьего вируса изучена
недостаточно. Штаммы вируса, циркулирующие в популяциях разных видов птиц,
могут различаться по вирулентности, спектру патогенности и структуре
поверхностных белков. У диких птиц, появившихся в процессе эволюции гораздо
раньше человека, насчитывается по гемагглютинину 15, по нейраминидазе - 9
субтипов вируса [3, 4]. У диких птиц, в первую очередь уток, выделяются
субтипы, характеризующиеся десятками антигенных комбинаций (H+N). От них
изолированы вирусы со всеми известными сочетаниями поверхностных антигенов. При
этом возможны различного рода перекомбинации в геноме, которые могут приводить
к образованию высокопатогенных вариантов вируса и вызывать развитие интенсивных
вспышечных эпизоотий в популяциях млекопитающих, домашнего скота и птицы,
заболевания людей с высокой летальностью. Зарегистрированы вспышки у свиней
(H1N1), лошадей (H3N8), китов (H7N7, H5N5, H4N6, H13N2, H13N9), норок (H10N4).
Способность к резкому преобразованию с последствиями в виде массовой
заболеваемости и смертности домашних птиц особенно характерна вирусам субтипов
H5 и H7 [5].
Отсутствуют полные данные по Южной Америке и
Африке. В 2004-2005 гг. появились сообщения о выявлении в Южно-Африканской
республике штаммов птичьего гриппа разновидности Н5N2 в страусиных хозяйствах.
При этом отмечалось, что зараженными оказалось 16,6% хозяйств, однако эпизоотии
у птиц развивались без видимых клинических проявлений.
У диких птиц - основных носителей, как правило,
вирус не вызывает выраженных заболеваний, длительно сохраняясь в кишечнике,
слюне, носовых секретах и фекалиях. Инфекция у них может протекать бессимптомно
или со слабо выраженными одним (чаще всего в виде энтерита - воспаления кишок,
сопровождающееся поносом и рвотой) или несколькими симптомами в зависимости от
штамма вируса и вида птиц. В ряде случаев уровень инфицированности птиц
достаточно велик. Так, по некоторым данным, во Вьетнаме в дельте реки Меконг
среди диких водоплавающих птиц зараженными птичьим гриппом особи составляли
70%. Передача возбудителя происходит при контакте восприимчивых птиц с
контаминированным нозальным, респираторным или фекальным материалом
инфицированных особей. В природе, по-видимому, преобладает фекально-оральный
путь заражения [3].
Эпизоотии в популяциях домашней птицы начали
регистрироваться с 1959 года. С тех пор было выявлено более 50 случаев
эпизоотических вспышек на 6 континентах в 27 странах. До 2003 года широкого
распространения инфекции не регистрировалось. С декабря 2003 года начали
отмечаться массовые заболевания птичьим гриппом кур, индюшек, гусей, уток,
куропаток и перепелов, бойцовских петухов высокопатогенными штаммами вируса
разновидности H7N7 в странах Западной Европы и H5N1 в странах Юго-Восточной
Азии, сопровождавшиеся большими экономическими потерями, связанными с гибелью и
забоем птицы. В Гонконге (Китай), Вьетнаме, Камбодже и Таиланде эти эпизоотии
зачастую осложнялись заболеваниями людей с высокой (54%) смертностью. В
июле-августе 2005 года появились сообщения о расширении географического ареала
птичьего гриппа серотипа H5N1: эпизоотии на домашних птицах были зарегистрированы
в Новосибирской, Омской, Тюменской, Курганской, Челябинской областях, Алтайском
крае России и в 4 областях Казахстана. Интересно, что в России уровень
смертности домашней птицы при развитии эпизоотий не превысил 5%. В 2005 году
вирусы Н5 были обнаружены в Монголии на индийском гусе и у лебедя-кликуна. В
Ценральном Китае в одном из природных заповедников вирусы H5N1 в августе 2005
г. выделены от индийского гуся, черноголового хохотуна, тибетской чайки, огаря
и большого баклана. Достаточно широкое распространение получили вирусы H5N1 в
Индонезии и Таиланде, что связывают с массовым нелегальным вывозом бойцовских
петухов и других вольерных птиц. В одном из зоопарков Таиланда зарегистрирован
случай заражения тигра при кормлении больной птицей с последующей передачей
инфекции другому тигру [6, 7, 8].
Наиболее широко распространены и имеют большое
эпизоотологическое и эпидемиологическое значение вирусы субтипов H5N1 (44,7%),
ареал которых, однако, пока ограничен Азией, и H7N7 (14,9%), регистрируемый в
Европе, Северной Америке и Австралии. Очаги с постоянной эпизоотической
активностью птичьего гриппа разновидности H5N1 отмечаются во Вьетнаме и
Таиланде, периодической - Индонезии, Малайзии, Камбодже и Китае. Специальными
генетическими исследованиями подтверждено наличие 2 разновидностей вирусов
H5N1, различающихся по степени патогенности. Ареалы их географически не
перекрываются. Так популяции высокопатогенных штаммов циркулируют среди птиц в
странах Индокитая: Вьетнаме, Лаосе, Камбодже и Таиланде. Именно здесь развивались
массовые эпизоотии и эпидемические осложнения птичьего гриппа. Слабопатогенные
штаммы H5N1 обнаруживались как бы по периферии этой зоны в Китае, Корее,
Казахстане, России, Индонезии, Филиппинах. В 2005 г. по общему числу вспышек
явно доминировал азиатский континент [9].
Эпизоотии птичьего гриппа отмечались в 13
странах. Из общего количества вспышек на долю Вьетнама пришлось 55,2%, Таиланда
- 33,4%, индонезии - 6,5%. На рисунке 2 приводится диаграмма, иллюстрирующая
эту ситуацию.
Высокопатогенный вирус H5N1 воспроизводится в
дыхательных путях и кишечнике диких птиц. На местах массовой скученности,
преимущественно на водоемах, скапливается большое количество инфицированных
птиц, в первую очередь водоплавающих. В течение длительного периода времени они
могут выделять во внешнюю среду с экскретами и секретами большое количество
активного возбудителя, что может приводить к заражению восприимчивых особей, в
том числе домашних уток и гусей, посещающих водоемы вблизи или в окрестностях
населенных пунктов. Возможны заносы вируса на фермы, отстоящие от водоемов, с
помощью массовых видов диких птиц, охотно живущих рядом с человеком: голубей,
ворон, сорок, галок, воробьев. Предполагается, что сначала дикими птицами или
домашними утками и гусями в популяции кур заносится вирус низкой патогенности,
где циркулируя в течение нескольких месяцев может видоизменяться в очень
патогенную форму. Дальнейшее распространение эпизоотий на домашней птице
происходит с помощью инфицированных диких птиц, а чаще по рыночным каналам при
перемещении больной живой домашней птицы или продуктов ее переработки. При
расследовании эпизоотической вспышки в Тюменской области в селе Пеганово было
установлено, что заболевания кур на частных подворьях были спровоцированы тем,
что дети приносили домой ослабленных больных утят красноголовой чернети,
пытаясь выращивать их вместе с домашними утятами. Факторы, определяющие высокую
патогенность вирусов H5N1 для млекопитающих, остаются во многом неясными [10].
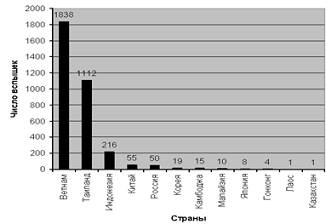
Рисунок 2 - Число эпизоотических вспышек
птичьего гриппа в Азии с января по август 2005-2007 года
Среди домашней птицы, по-видимому, большая роль
в качестве носителей принадлежит уткам, которые выделяют вирус во внешнюю среду
в большем количестве и в течение более длительного периода времени. При этом у
них могут и не обнаруживаться видимые симптомы заболевания. Куры, особенно их
молодняк, болеют остро и в массе гибнут при эпизоотиях. При тяжелом течении
болезнь у них развивается быстро: инкубационный период длится 1-7 дней,
температура тела повышается до 44оС, наблюдаются угнетенность,
малоподвижность, отечность слизистых, дрожь, истечения из носовой полости,
хриплое дыхание, цианоз (синюшность) гребня и сережек, коматозное состояние,
паралич и гибель через 24-72 часа. Летальность достигает 100%. При средней
тяжести в течение 7-8 дней наблюдаются взъерошенность перьев, снижение
активности, слабость, учащенное дыхание, выделения их носа и рта, атония зоба,
диарея, помет имеет желто-зеленый цвет. При легком и среднем течении погибает
от 0,2 до 20% птиц. Куры-несушки болеют тяжелее: яйценоскость снижается на
40-60%, но после выздоровления восстанавливается. Утята в возрасте 7-45 дней
болеют чаще взрослых уток: их погибает до 30-60%. При латентном течении у птиц
всех видов и возрастов заболевание протекает без видимых клинических проявлений
и повышенного отхода.
Развитие эпизоотий птичьего гриппа в Азии за
2004-2005 гг. носило явно сезонный характер. На рисунке 3 приводится кривая
динамики вспышек по месяцам. Хорошо выражены два пика заболеваний в популяциях
домашней птицы - в феврале и в августе - сентябре. Логично предположить, что
такая сезонность связана со сроками концентрации и перемещений зимующих птиц,
заносом возбудителя домашними водоплавающими на подворья.
Как правило, заражение птичьим гриппом
отмечается при совместном содержании кур с утками и гусями, посещающими
открытые водоемы в окрестностях населенных пунктов. Чаще поражаются птицы на
личных частных подворьях и фермах, где животные выпускаются за пределы дворов.
Крупные птицеводческие хозяйства, где соблюдается закрытый режим содержания
птицы, поражаются реже. Стойловое содержание птиц ограничивает возможность
массового заражения и предотвращает развитие крупных вспышек. Человек может
заражаться птичьим гриппом контактным путем. Не исключается воздушно-капельный
(разделка мяса, уход за больными животными) и алиментарный (через
контаминированные вирусом продукты переработки животноводства: кровь, тушки,
яйца, подстилка, корма, перо и др.) механизмы заражения. Термическая обработка
мяса птицы при температуре выше 70оС быстро уничтожает вирус.
При эпизоотологическом обследовании необходимо в
первую очередь обращать внимание на места массового скопления мигрирующих и
гнездящихся птиц. Вирус птичьего гриппа можно выделить в течение 2-3 дней со
дня заболевания животного, а сероконверсию получить в течение 1-2 недель. Для
лабораторной диагностики исследуются пробы воды, добытые птицы и их фекалии.
Вирусы можно обнаружить во внутренних органах: легком, сердце, мозгу, поджелудочной
железе, селезенке, печени и почках. Серологические методы и ПЦР-диагностика
используются в течение первых 3 дней с начала клинических симптомов гриппа. У
живых животных исследуются мазки из зева, носовой полости, трахей. У забитых
животных - трахеальные, легочные, клоачные мазки и фекальные образцы [11].
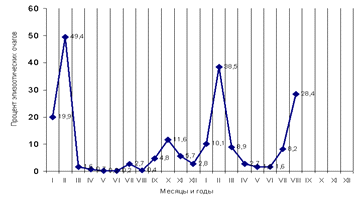
Рисунок 3 - Динамика эпизоотических проявлений
птичьего гриппа на азиатском континенте в 2004-2005 гг.
По данным Беляева и других ученных
противоэпизоотические меры носят преимущественно радикальный характер. В ряде
случаев практикуется массовая вакцинация домашней птицы, эффективность которой,
однако, оценивается неоднозначно. Зачастую они не дают существенного снижения
заболеваемости и не оправданы экономически (Беляев, Слепушкин, 2004) [12].
Неспецифическая профилактика включает
ветеринарно-санитарный контроль, карантинные мероприятия, зонирование, переход
к стойловому содержанию птицы, санитарный убой животных (стемпинг-аут),
дезинфекцию. Считается, например, что эпизоотии и заболевания среди людей в
1997 году в Гонконге были прекращены только благодаря поголовному уничтожению
домашней птицы на птицефабриках и рынках. При забое птицы применяется
бескровный электрошок. При обнаружении эпизоотического очага выделяют
"зараженную зону" (внутреннюю) в радиусе 5 км от очага,
"карантинную зону" (промежуточную) в радиусе 15 км, и "зону
наблюдения" (внешнюю) - до 30 км от эпицентра. В каждой из этих зон
профилактические работы регламентированы и ведутся с учетом конкретной
обстановки. На зараженной территории и в районах к ней примыкающих запрещаются
торговля живой птицей, выставки животных, перемещения и перевоз птиц, кормов и
оборудования. Товарное яйцо от больной птицы проваривают, инкубационное -
уничтожают. Тщательно контролируются качество водоснабжения и торговли мясом
птицы. Можно рекомендовать запрещение охоты на водоплавающую дичь в
неблагоприятных по птичьему гриппу регионах. Это не только снизит вероятность
заболеваний птичьим гриппом среди охотников, но в первую очередь приведет к
ограничению перелетов мигрирующих птиц в результате снижения фактора
беспокойства. Потревоженные выстрелами стайные птицы постоянно перемещаются в
поисках новых водоемов, способствуя рассеиванию заразного начала. В качестве
мер пестконтроля в настоящее время пока воздерживаются от истребления диких
птиц в природе. При высокой численности грызунов в птичьих хозяйствах
необходима дератизация. В связи с тем, что вирусы легко инактивируются всеми
известными дезинфектантами, арсенал применяемых для дезинфекции средств
достаточно широк. Показано применение йодсодержащих препаратов, хлорамина Б,
хлорной извести, растворов гипохлорита кальция, перекиси водорода, хлорэффекта,
ДП-2, ПВК, аммиака. Эффективны обработка в пароформалиновых камерах, сжигание,
ультрафиолетовое облучение.
В связи с тем, что в природных условиях вирус
AIV может длительно циркулировать в популяциях диких птиц, они становятся
основным объектом изучения при эпизоотологическом обследовании. Вопросам
возможного формирования вторичных очагов этой инфекции на путях массового
пролета мигрирующих птиц, зимующих на территории, эндемичной по птичьему
гриппу, должно уделяться большое внимание. Из 700 видов птиц, гнездящихся на
территории России и сопредельных стран, около 615 совершают регулярные сезонные
миграции. Из них 428 (70%) видов относятся к перелетным, зимующим на большом
удалении от мест гнездования в зонах мягких и теплых зим Европы, Африки и Азии.
Из Европейской части России на другие материки улетают зимовать 216 видов птиц:
в том числе в Африку - 201, Азию - 14, Северную Америку - 1. В качестве
носителей птичьего гриппа большое значение имеют птицы околоводного
(лимнофильного) комплекса - 160 видов, и прежде всего гусеобразных (43 вида),
ржанкообразных (40) и чайкообразных (22). На территории России на настоящее
время выделено более 700 штаммов вируса птичьего гриппа от диких птиц в
регионах Северной Евразии, Западной Сибири и Дальнего Востока (Львов и др.,
2005) [8].
На территории Нижнего Поволжья авиафауна
представлена 335 видами птиц, из которых к фоновым (массовым) гнездящимся
перелетным и мигрирующим пролетным относятся 139 (42%) видов. Среди них к
околоводным птицам можно отнести 68 (49%) видов. Из них следует выделить группу
стайных птиц, встречающихся на гнездовьях, на кормежке или отдыхе большими
скоплениями - таких видов лишь 30 (в основном утки, чайки и кулики).
Роль перелетных птиц
В 2005 г. впервые стал очевидным, но все еще
малопонятным дополнительный значительный источник международного
распространения вируса среди птиц. Ученые все больше убеждаются в том, что
сейчас, по крайней мере, некоторые перелетные водоплавающие птицы переносят
вирус H5N1 в его высоко патогенной форме, иногда на большие расстояния, и
заносят его в стаи домашних птиц в районах, расположенных на их миграционном
маршруте. Основные пути миграции весенне-осеннего пролета диких перелетных птиц
через территорию Казахстана показаны на рисунке 4.
Если эта новая роль перелетных птиц будет научно
подтверждена, это будет означать изменение в длительном устойчивом
взаимоотношении вируса H5N1 и его природного резервуара, которым являются дикие
птицы.
Данные, свидетельствующие о таком изменении
роли, начали появляться в середине 2005 г., и с тех пор их становится все
больше. Падёж более чем 6000 перелетных птиц, инфицированных высоко патогенным
вирусом H5N1, который начался в природном заповеднике у озера Кингхай в
центральном Китае в конце апреля 2005 г., был в высшей степени необычным и,
возможно, беспрецедентным событием. До этого случаи смерти диких птиц от высоко
патогенного птичьего гриппа были редкими - как правило, это были отдельные
погибшие птицы, найденные в пределах перелета от места вспышки болезни среди
домашних птиц. В результате научных исследований, во время которых проводилось
сравнение вирусов, выявленных во время разных вспышек болезни у птиц, было
обнаружено, что вирусы, выявленные в странах, недавно охваченных вспышками (все
из которых лежат на миграционных маршрутах), почти идентичны вирусам,
обнаруженным у мертвых перелетных птиц у озера Кингхай. Вирусы, изолированные в
первых двух случаях заболевания людей в Турции, которые закончились смертельным
исходом, также практически идентичны вирусам, выявленным у озера Кингхай [13].
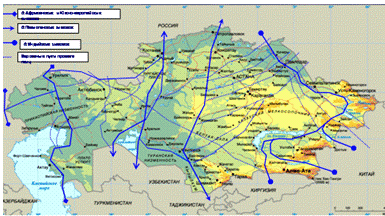
Рисунок 4 - Основные пути миграции
весенне-осеннего пролета диких перелетных птиц через территорию Казахстана
Видовой состав водоплавающих птиц на пролете:
серый гусь, кряква, серая утка, шипохвост, чирок, нырок, голубая черкеть,
широконоска, огарь, лысуха, лебедь шипун, лебедь кликун.
Страны, охваченные вспышками болезни у птиц
Вспышки высоко патогенного птичьего гриппа H5N1,
начавшиеся в юго-восточной Азии в середине 2003 г. и распространившиеся в
настоящее время на некоторые части Европы, являются самыми крупными и серьезными
зарегистрированными вспышками. На сегодняшний день вспышки болезни были
зарегистрированы в девяти азиатских странах (перечисленных в порядке
регистрации): Республике Корея, Вьетнаме, Японии, Таиланде, Камбодже, Лаосской
Народно-Демократической Республике, Индонезии, Китае и Малайзии. В трех из них
- Японии, Республике Корея и Малайзии - вспышки болезни были ликвидированы, и в
настоящее время эти страны считаются свободными от болезни. В некоторых из
первоначально охваченных болезнью странах Азии вирус стал эндемическим.
В конце июля 2005 г. вирус стал распространяться
за пределы своей первоначальной концентрации в Азии и поразил домашних и диких
птиц в Российской Федерации и прилегающих к ней районах Казахстана. Почти в это
же время Монголия сообщила о выявлении высоко патогенного вируса у диких птиц.
В октябре 2005 г. вирус был зарегистрирован в Турции, Румынии и Хорватии. В
начале декабря 2005 г. о первой вспышке болезни среди домашних птиц сообщила
Украина. Многие из этих новых вспышек болезни были выявлены быстро, также
быстро были переданы сообщения о них. Тем не менее, ожидается дальнейшее
распространение вируса на миграционных маршрутах диких водоплавающих птиц. К
тому же, миграция птиц является периодическим событием. Страны, лежащие на пути
перелета птиц из центральной Азии могут постоянно сталкиваться с опасностью
интродукции или реинтродукции вируса в стаи домашних птиц [14].
До того, как сложилась нынешняя ситуация,
вспышки высоко патогенного птичьего гриппа у домашних птиц считались редкими.
За исключением нынешних вспышек, вызванных вирусом H5N1, с 1959 г. в мире было
зарегистрировано только 24 вспышки высоко патогенного птичьего гриппа. 14 из
них произошли за последние десять лет. Большинство вспышек имело ограниченное
географическое распространение, некоторые из них ограничивались пределами одной
фермы или стаи и лишь одна вспышка имела международное распространение. Все
крупные вспышки болезни нанесли большой ущерб сельскохозяйственному сектору, а
их ликвидация была трудным процессом.
.2 Страны, в которых зарегистрированы случаи
заболевания людей птичьим гриппом и план глобальных мероприятий ВОЗ по борьбе с
гриппом
На сегодняшний день случаи заболевания людей
были зарегистрированы в семи странах, большинство из которых расположены в Азии:
Вьетнаме, Индонезии, Ираке, Камбодже, Китае, Таиланде и Турции. У первых
пациентов, зарегистрированных во Вьетнаме, во время нынешней вспышки болезни
симптомы заболевания появились в декабре 2003 г., а инфекция H5N1 была
подтверждена 11 января 2004 г. Сообщения из Таиланда о первых случаях
заболевания поступили 23 января 2004 г. Сообщение о первом случае заболевания в
Камбодже поступило 2 февраля 2005 г. Следующей страной стала Индонезия, которая
подтвердила свой первый случай инфекции 21 июля. Китай сообщил о первых двух
случаях заболевания 16 ноября 2005 г. Подтверждение первых случаев в Турции
поступило 5 января 2006 г., после чего, 30 января 2006 г., последовало
сообщение о первом случае заболевания в Ираке. Все случаи заболевания людей
совпадали по времени со вспышками высоко патогенного птичьего гриппа H5N1 среди
домашних птиц (рисунок 5). На сегодняшний день страной, пораженной болезнью в
наибольшей степени, является Вьетнам, где произошло более 90 случаев
заболевания [15, 16].
В общей сложности более половины всех
лабораторно-подтвержденных случаев заболевания закончились смертельным исходом
(таблица 1). Птичий грипп H5N1 у людей до сих пор является редкой, но тяжелой
болезнью, которую необходимо тщательно изучать, особенно в связи с
потенциальной возможностью этого вируса принять форму, способную привести к
пандемии.
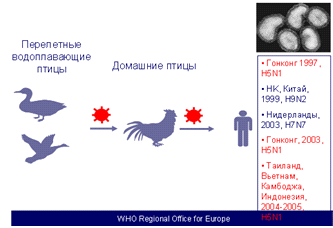
Рисунок 5 - Заражение человека от птиц
В настоящее время разработан ВОЗ план глобальных
мероприятий по борьбе с гриппом с целью помощи службам здравоохранения стран -
членов ВОЗ быть в состоянии полной медицинской готовности немедленно
отреагировать в случае угрозы и развития пандемии гриппа. Этот значительно
переработанный и обновленный вариант плана заменяет опубликованное ВОЗ в 1999
году руководство по планированию мероприятий по борьбе с пандемией гриппа на
национальном и региональном уровнях (Influenzapandemicplan. Theroleof WHO
andguidelines for national and regional planning). Новый план нацелен на
продолжающий существовать пандемический потенциал вируса гриппа, например, на
увеличение циркуляции, по сравнению с 2003 годом, субтипа вируса гриппа H5N1
среди домашних птиц в Азии. В обновленном плане также предусмотрена возможность
возникновения разной степени угрозы развития пандемии одновременно в нескольких
странах, как это случилось в 2004 году: вспышки птичьего гриппа H7N3 в Канаде и
H5N1 в Азии [13].
Таблица 1 - Совокупное число подтвержденных
человеческих случаев птичьего гриппа (H5N1) по сообщению ВТО на 18 марта 2008
года
|
Страна
|
2003
|
2004
|
2005
|
2006
|
2007
|
2008
|
Общее
количество
|
|
случаи
|
смертельные
случаи
|
случаи
|
смертельные
случаи
|
случаи
|
смертельные
случаи
|
случаи
|
смертельные
случаи
|
случаи
|
смертельные
случаи
|
случаи
|
смертельные
случаи
|
случаи
|
смертельные
случаи
|
|
Азербайджан
|
0
|
0
|
0
|
0
|
0
|
0
|
8
|
5
|
0
|
0
|
0
|
0
|
8
|
5
|
|
Камбоджа
|
0
|
0
|
0
|
0
|
4
|
4
|
2
|
2
|
1
|
1
|
0
|
0
|
7
|
7
|
|
Китай
|
1
|
1
|
0
|
0
|
8
|
5
|
13
|
8
|
5
|
3
|
3
|
3
|
30
|
20
|
|
Джибути
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
|
Египет
|
0
|
0
|
0
|
0
|
0
|
0
|
18
|
10
|
25
|
9
|
4
|
1
|
47
|
20
|
|
Индонезия
|
0
|
0
|
0
|
0
|
20
|
13
|
55
|
45
|
42
|
37
|
12
|
10
|
129
|
105
|
|
Ирак
|
0
|
0
|
0
|
0
|
0
|
0
|
3
|
2
|
0
|
0
|
0
|
0
|
3
|
2
|
|
Lao
Народная Демократическая республика
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
2
|
2
|
0
|
0
|
2
|
2
|
|
Myaнмар
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
1
|
0
|
|
Нигерия
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
0
|
0
|
1
|
1
|
|
Пакистан
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
0
|
0
|
1
|
1
|
|
Таиланд
|
0
|
0
|
17
|
12
|
5
|
2
|
3
|
3
|
0
|
0
|
0
|
0
|
25
|
17
|
|
Турция
|
0
|
0
|
0
|
0
|
0
|
0
|
12
|
4
|
0
|
0
|
0
|
0
|
12
|
4
|
|
Вьетнам
|
3
|
3
|
29
|
20
|
61
|
19
|
0
|
0
|
8
|
5
|
5
|
5
|
106
|
52
|
|
Общее
количество
|
4
|
4
|
46
|
32
|
98
|
43
|
115
|
79
|
86
|
59
|
24
|
19
|
373
|
236
|
Новый план заново определяет фазы возрастания
риска развития пандемии, вызванной новыми субтипами вируса гриппа; дает
рекомендации для действий национальных властей и обозначает мероприятия,
которые должны быть предприняты ВОЗ в период каждой из этих фаз. В результате,
это должно привести к улучшению предсказуемости мер, которые должны быть
предприняты всеми задействованными организациями, включая ВОЗ, на разных этапах
пандемии, а также должно улучшить международную координацию и четкость
рекомендованных национальных мероприятий. Данное руководство также призвано
помочь руководителям национального здравоохранения в разработке национальных
планов борьбы с пандемией, в зависимости от фазы ее развития.
Ответственность за регулирование степени риска
развития пандемии гриппа в странах лежит, в первую очередь, на соответствующих
национальных органах власти. Каждой стране абсолютно необходимо разработать или
обновить национальный план мероприятий по борьбе с гриппом в соответствии с
рекомендациями, представленными в данном руководстве. Руководители органов
здравоохранения всех стран должны сыграть свою роль в достижении
согласованности действий при организации глобальных мероприятий по борьбе с
гриппом, т.к. это является ключом к успеху снижения риска распространения
гриппа и развития пандемии.
Пересмотр определения фаз был необходим для
того, чтобы привлечь внимание к опасности распространения гриппа животных среди
людей, непосредственно связать изменение мероприятий по борьбе с изменением
фазы риска, а также сконцентрировать внимание на ранних мероприятиях в период
"пандемической тревоги", когда быстрые согласованные национальные и
международные действия могут сдержать или отсрочить распространение новых
штаммов вируса гриппа среди людей. Даже в том случае, если мероприятия по
ограничению распространения пандемии оказались безуспешными, такой подход
позволяет выиграть время для разработки вакцин против новых штаммов и
проведения других противоэпидемических мероприятий, которые были запланированы
заранее. Успех же будет зависеть от нескольких факторов, в том числе и от
надзора, который предоставляет возможности раннего предупреждения заражения
людей новыми субтипами вируса гриппа. Новые фазы и соответствующие задачи
общественного здравоохранения суммированы в таблице на следующей странице.
Документ также содержит предложения для
руководителей национального здравоохранения дополнительно разделить некоторые
фазы для отражения ситуации в стране. Предлагается дополнительно разделять фазы
2-5 в зависимости от того, были зарегистрированы случаи заражения в стране
(либо существуют тесные торговые и транспортные связи со страной, где были
зарегистрированы случаи) или нет. Также предлагается разделять фазу 6, фазу
пандемии, в зависимости от ситуации в стране: случаев заражения не было, были
случаи (или существуют тесные торговые и транспортные связи со страной, где
были случаи), заболеваемость снизилась или зарегистрированы последовательные
подъемы заболеваемости.
Для того, чтобы обеспечить достижение целей
здравоохранения в каждой фазе, специфические задачи и мероприятия, стоящие
перед ВОЗ и национальными органами власти разделены на пять категорий: 1)
планирование и координация; 2) мониторинг и оценка ситуации; 3) предупреждение
и ограничение распространения; 4) ответные мероприятия системы здравоохранения;
5) связь и обмен информацией. Некоторые задачи и мероприятия являются
специфическими для гриппа, в то время как другие нацелены на многочисленные
опасные ситуации, в которые вовлекается много людей. Также многие страны имеют
планы экстренных медицинских мероприятий на случай стихийных бедствий и других
непредвиденных обстоятельств. Планы борьбы с пандемией гриппа для надежности дополнены
некоторыми из этих мероприятий. Степень их выполнения зависит от имеющихся
ресурсов [9].
Чрезвычайно важную роль при подготовке к
пандемии гриппа играет планирование межведомственных взаимодействий и
вовлечение сторонних немедицинских партнеров. В число этих партнеров должны
быть вовлечены немедицинские правительственные учреждения различных уровней
(сельскохозяйственные, транспортные, торговые, производственные, силовые,
образовательные и юридические), также как и частные предприятия, включая промышленные
корпорации и неправительственные организации [10].
Невозможно предсказать, когда может возникнуть
следующая пандемия и насколько ужасными могут оказаться ее последствия. Начиная
с 16 века, документально были зарегистрированы, в среднем, по три пандемии за
столетье, возникающие с интервалом 10-50 лет. В 20-м веке пандемии случались в
1918, 1957 и 1967 гг. Установлено, что пандемия 1918 года привела к гибели
свыше 40 миллионов человек менее чем за один год, причем пик смертности
пришелся на людей в возрасте 20-45 лет. Пандемии 1957 и 1968 гг. были мягче
(зарегистрировано 1-4 миллиона смертельных исходов в основном в традиционных
группах риска, например среди пожилых людей), и несмотря на это, ресурсы
здравоохранения многих страны испытали существенное напряжение. Если появится
вирус гриппа, подобный тому, что вызвал пандемию в 1918 г., даже с учетом
значительного прогресса медицины с тех пор, можно будет ожидать настолько же
беспрецедентное количество заболеваний и смертей. Воздушные путешествия могут
ускорить распространение новых вирусов и уменьшить время, которое необходимо
для подготовки ответных мер. Системы здравоохранения могут быстро оказаться
перегруженными, экономика напряжена, а общественный порядок подорван. Несмотря
на то, что считается невозможным полностью остановить распространение
пандемического вируса, можно свести к минимуму последствия пандемии если
заранее подготовиться к встрече с предстоящими трудностями.
1.3 Морфология высокопатогенного гриппа птиц
Популяции вируса гриппа характеризуется
гетерогенностью формы и размеров вирионов (рисунок 6). У большинства вирионов
форма близка к сферической, со средним диаметром 80-120 нм. Длина нитевидных
вирионов, характерных для свежевыделенных эпидемических штаммов, превышает в
несколько раз размеры сферических частиц [17]. После 2-3 пассажей вируса через
куринные эмбрионы в популяции преобладают вирионы сферической формы. Эти
популяции, помимо высокоинфекционных зрелых вирусов, содержат также
значительное число "не полных" вирусных частиц, характеризующихся
малым содержанием РНК и сниженной инфекционной активностью. Данные о
взаимоднйствии между морфологической и функциональной гетерогенностью вируса
гриппа и механизм этого явления очень ограничены.


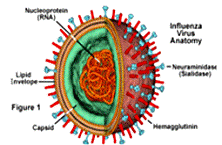
Рисунок 6 - Структура вируса гриппа
По данным электронно-микроскопического
исследования анатомии вириона и субвирусных структур в структуре вириона четко
выделяются два слоя мембран (наружный и внутренний) и сердцевина вириона
(core). Из наружной мембраны вириона выступают гликопротеидные структуры (шипы)
длиной 8-10 нм и толщиной 4-5 нм, с расстояниями между их центрами в 7,5-10 нм.
Шипы образованы двумя гликопротеидами, один из них является функционально
активными гемаглютинином (НА+), а другой - нейроминидазой (NA+).
Гемаглютинин формирует цилиндры с основанием,
погруженным в липидную оболочку. Нейраминидаза образует структуры с двумя
утолщениями, меньшее из которых у основания.
По данным спектроскопии, липиды внешней мембраны
вируса гриппа образуют жесткую двухслойную структуру, более устойчивую по
сравнению с плазматической мембраной клетки. Сохраненные структуры мембраны
после удаления гликопротеидных шипов свидетельствует о том, что ее организация
не связана с участием СА+ и Na+.
Непосредственно к внутренней поверхности
мембраны вириона примыкает внутренняя гранулярная белковая мембрана сердцевины
вириона (core membrane), состоящая из мембранного белка. Этот полипептид
является самостоятельным элементом вирусной частицы, играющим важную роль в
создании структуры вириона и образовании защитного слоя вокруг нуклеокапсида.
Сердцевина вириона представлена нуклекапсидом,
образованным спиралью рибонуклеопротеида, состоящего из РНК и белка
нуклеопротеида(NP) Choppin P Compans R., 1975. диаметр витка спирали РНК
состовляет 70-80 нм, а толщина нити - около 10 нм. На значительном протяжении
РНК закручен в двойную спираль. Кроме того, в состав (core) входят белки
полимеразного комплекса (Р1-Р3) и М-белок, образующий внешнюю мембрану этой
структуры. Поскольку липидный и углеводный компоненты вириона имеют клеточное
происхождение [18], а сама популяция вируса морфологически неоднородна, не
представляется возможным установить точное значение молекуляроной массы вириона
и его химический состав. Существует согласованное мнение о колебаниях
содержания РНК, полипептидов и других компонентов в вирионе вируса гриппа.
Молекулярная масса вириона составляет в среднем
270+10-290+10 дальтон при содержании 0,8-1,1% РНК, 70-75% суммарной массы
белка, 20-25% липидов и 5-8% углеводов происхождение. Липиды представлены
главным образом фосфолипидами и холетерином. В состав углеводного компонента
вируса гриппа, кроме рибозы, входят, по крайней мере, 4 типа сахаров: глюкозамин,
манноза, галактоза и фруктоза. Состав углеводов и липидов вируса гриппа в
значительной степени определяется клеткой хозяина, поэтому химический состав
углеводного компонента вируса гриппа сходен с составом других оболочечных
вирусов. Основное отличае заключается в том, что вирионы вируса гриппа не
содержат остатков нейраминовой (сиаловой) кислоты, широко представленной во
всех клеточных мембранах. Снаружи вирус покрыт липидной оболочкой. Именно
липиды ответственны за ту интоксикацию, которая поражает человека во время
болезни. На поверхности вируса находятся выступы (гликопротеины) -
гемагглютинин (названный по способности агглютинировать эритроциты) и
нейраминидаза (фермент). Гемагглютинин обеспечивает способность вируса
присоединяться к клетке. Нейраминидаза отвечает, во-первых, за способность
вирусной частицы проникать в клетку-хозяина, и, во-вторых, за способность
вирусных частиц выходить из клетки после размножения. Нуклеопротеид (также
называемый S-антигеном) постоянен по своей структуре и определяет тип вируса
(А, В или С). Поверхностные антигены (гемагглютинин и нейраминидаза -
V-антигены), напротив, изменчивы и определяют разные штаммы одного типа вируса.
.4 Антигены высокопатогенного гриппа птиц
Вирусы гриппа имеют два антигена - S и V.
S-антиген, или комплементсвязывающий растворимый антиген, представляет собой
нуклеокапсид вируса и по химическому составу является нуклеопротеидом [19].
В составе вирусной частицы имеется другой
антиген - гемагглютинин, или V - антиген. По химическому составу это
липомукопротеид. Распологается в наружной оболочке вируса. Чтобы разделить S и
V - антигены, прибегают к следующему методу, разработанному Lief и Helne в 1956
году [19, 20].
Успехи достигнутые в молекулярной биологии за
последние 20 лет, во многом обусловлены исследованиями в области химии и физики
вирусов. Однако очистка большинства вирусов животных до середины 50-х годов
представляла значительную проблему [21].
В 1947 г. Кокс с сотрудниками успешно применили
для концентрирования вируса гриппа метод преципитации метанолом. В 1949 г.
Bradford M. с сотр. случайно установили, что протаминсульфат осаждает из
вируссодержащей суспензии средние и крупные вирусы. Образовавшийся комплекс
вируа с белком затем легко диссоцируется в 1М NaCL [22, 23].
Фримель Х.В. в 1987 г. показал, что вирус гриппа
осаждается щелочными белками типа папаина и клупеина в виде инфекционного
комплекса, который диссоцирует в солевой среде с востановлением первоночальной
инфекционной активности [24].
Методом ультрофильтрации пользуется для изуение
вирусов более 60 лет. В 1931 г. А.С. Гринин и др. создали более совершенные,
точно калиброванные ультрофильтры и определили величину многих вирусов. Эти
рание исследования в то время были очень ценными при изучении свойств вирусов
[23]. В.И. Товарнецкий и Г.П. Глухарев в 1937 г. для очистки и концентрирования
вирса гриппа использовали также - ультрофильтрацию (из журнала Вопр. вирусол.)
[25]. А в 1967 г. для этих целей Уоллис и Мельник применили мембранные
миллипоровские фильтры [25].
Самый распространеный метод очистки и
концентрирования вирусов это ультроцентрифугирование. Агравал и Брунинг
проводили определение плотности вируса гриппа равновесным зональным
центрифугированием в сахарозном градиенте 30-75% (вес/об) в течение 23 и 46
часов при 100000 g. В обоих случаях образовался 1 пик с плотностью 1,20 г/мл.
[23].
В 1941 г. Солк применил метод адсорбции и элюции
на фосфате кальция для концентрирования. Процесс адсорбции вируса гриппа на
эритроцитах был подробно изучен М.В. Соколовой [26] в 1949, Т.В. Еремеев и О.М.
Чалкина усовершенствовали этот метод, использоав для этих целей
формалинизированные эритроциты.P. в 1954г. использовал для очистки вируса
гриппа метод хромотографии на фосфате кальция [27].
В конце 1966 г. Иванова Г.А. и др. предложили
простой метод частичной очистки вируса диализом вируссодержащей суспензии
против 0,001М фосфатного буфера при рН 5,5. При этой процедуре выход вируса
состовляет 96% при его 20-кратной очистке [28].
По данным Т.А. Сатиной и А.П. Простякова [85],
осаждение вируса 20% этанолом вызвало потерю инфекционности вируса, в то время
как при осаждении 20% метанолом получали концентрированный препарат, очищенный
на 99%, с сохранением его инфекционности. Метод спиртовой преципитации успешно
применили при концентрировании и очистке вируса гриппа птиц.
Букринская А.Г. [42] проводила сравнительную
очистку вирусов гриппа с помощью депротенизации фторуглеродами. Очистка вируса
гриппа фреоном-113 давал лучший результат по сравнению методом адсорбции и
элюции [29].
.5 Клинические признаки и патологоанатомические
изменения
Инкубационный период болезни - 21 день. Наиболее
чувствительны индейки и куры, кроме того, болеют фазаны, японские перепела,
домашние и дикие водоплавающие птицы. Высокопатогенный вирус гриппа птиц
поражает все поголовье птицы в птичниках, с последующей 100% смертностью в
течение 48-96 часов.
В случае гибели птицы за 48
часов полностью отсутствует какая-либо клиническая картина и
патологоанатомические изменения в органах и тканях погибшей птицы, что затрудняет
установить истинные причины массовой гибели птицы.
При более длительном периоде
течения заболевания 96 часов, наблюдается характерные клинические признаки:
депрессии, отказ от корма и потребления воды. Отмечается синюшность слизистых
оболочек, гребня и сережек, а в некоторых случаях некроз частей гребня и
сережек, наблюдаются признаки поражения центральной нервной системы в виде
тремора головы и паралича крыльев и ног (рисунки 7, 8). Имеет место
гемморрагические поражения желудочно-кишечного тракта, панкреатит, и не всегда
отмечается респираторный синдром (рисунки 9-13). Практически всегда поражается
репродуктивная система, что отражается на показателях яичной продуктивности
птицы и за период вспышки продуктивность полностью прекращается [30].
Среди кур, грипп протекает не только как
классическая чума птиц, но и в виде респираторной болезни, при которой погибают
от 1 до 70-80% больных, что зависит от вирулентности штамма, возраста и вида
птицы, условии содержания и сопутствующих инфекции. У больной птицы наблюдают
сонливость, чихание, хрипы, одышку, выделения из носа, слезотечение,
взъерошенность оперения, отставания в росте и развитии. У отдельных птиц
отмечают тремор, указывающий на поражение нервной системы.
При вскрытии птицы с респираторной формой гриппа
обнаруживают катаральный конъюнктивит, ринит, синусит, трахеит, аэросаккулит,
интерстициальную пневмонию, катарально-геморрагические энтериты и нефриты. В
отдельных случаях наблюдаются поражения яйцеводов и яичников. В случае
осложнения болезни патогенной Е.coli отмечают фиброзно-дифтеритический
аэросаккулит, перикардит и синусит.
Патоморфология респираторного тракта весьма
сходна и не зависит от серологической принадлежности вируса и вида птицы. У
индюшат и перепелят встречаются некрозы в поджелудочной железе, а у цесарят - в
гонадах. Сведений о вирусных включениях при гриппе птиц в литературе нет.
Рисунок 7 - Выпадение перьев при гриппе птиц
При классической чуме птиц (грипп Н7) наблюдают
кровоизлияния преимущественно в серозных покровах, паренхиматозных органах,
скелетных мышцах, пищеварительном тракте. Характерны катары желудочно-кишечного
тракта с сильным утолщением слизистой оболочки и обилием слизистых выделений,
очаговые некрозы в селезенке, печени, почках и центральной нервной системе.
Три штамма вируса гриппа птиц
А5, как и вирус КЧП, оказывают пантропное действие. При вскрытии обнаруживали
венозный застой и цианоз кожи, мышечной ткани и внутренних органов,
кровоизлияния в строму фолликул и желточный перитонит у несушек, а также
энтериты, выраженные в различной степени. У кур, зараженных штаммом крачка
/Южная Африка/ 61, преобладал катарально-геморрагический гастроэнтерит вплоть
до язвенного воспаления [31].

Рисунок 8 - Поражение центральной нервной
системы при гриппе птиц
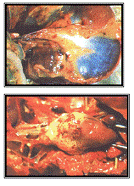
Рисунок 9 - Геморрагии в жире, на поверхности
мышечного желудка и миокарде
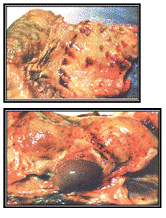
Рисунок 10 - Кровоизлияния и геморрагии на
железистом желудке и на серозных оболочках в области живота
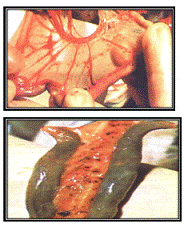
Рисунок 11 - Геморрагии на брыжейке и язвы в
тонком отделе кишечника

Рисунок 12 - Кровоизлияния на слизистой трахеи и
некротическое поражение зоба
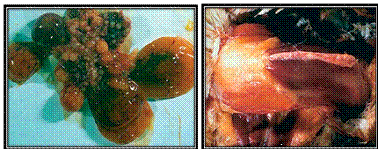
Рисунок 13 - Геморрагическое поражение фолликул
яичек и геморрагии на грудной мышце
1.6 Руководящие принципы ВОЗ по взятию образцов
у животных для лабораторной диагностики инфекции гриппа (от 12
января 2005 г.)
Общая информация
Успешное проведение диагностики вирусных
инфекций, в значительной степени, зависит от качества образцов и условий, в
которых они перевозились и хранились до проведения их исследований в
лаборатории. Образцы для выделения респираторных вирусов в клеточных культурах
или куриных яйцах с развивающимися эмбрионами и для прямого выявления вирусных
антигенов или нуклеиновых кислот, как правило, следует брать в течение первых
трех дней после появления клинических симптомов гриппа. У млекопитающих,
включая людей, свиней и лошадей, грипп представляет собой, главным образом,
инфекцию дыхательных путей, в то время как у птиц он может проявляться в виде
инфекции как дыхательных путей, так и кишечника.
Типы образцов
Для диагностики вирусных инфекций верхних
дыхательных путей подходят различные образцы, взятые у млекопитающих и птиц:
· назальный мазок
· мазок из зева
· мазок из трахеи
В дополнение к мазкам из верхних дыхательных
путей, взятие образцов у птиц для диагностики гриппа должно включать:
· мазок из клоаки
· образец фекалий
По возможности мазки из клоаки необходимо брать
у живых или только что забитых птиц. Часто образцы фекалий можно взять только
из клеток или окружающей среды, что исключает полную уверенность в их
принадлежности конкретным особям.
Если в ходе расследования обнаружены мертвые
животные, необходимо предположить наличие высоко патогенного птичьего гриппа и,
помимо образцов из дыхательных путей и кишечника, взять репрезентативные
образцы внутренних органов, включая мозг, селезенку, сердце, легкие,
поджелудочную железу, печень и почки.
Образцы для лабораторной диагностики инфекции
гриппа необходимо брать в порядке следующей очередности:
· У живых животных
· Из трахеи
· Из зоба/носа
· Из клоаки
· Фекалии (из окружающей среды)
· Питьевую воду
· У мертвых животных
· Легочные смывы
· Смешанную ткань (в том числе трахеи
и легких)
· Фекалии (из окружающей среды)
· Из клоаки
· Питьевую воду
Процедуры взятия образцов
Необходимый материал:
· 1-3 мл пластмассовые пробирки с
завинчивающимися крышками
· Полиэфирные зонды с волоконными
наконечниками (зонды-тампоны)
· Транспортная среда для вирусов
· Инструменты для аутопсии
Транспортная среда для вирусов:
(А) Транспортная среда 199
. Среда для тканевых культур 199, содержащая
0,5% раствор бычьего сывороточного альбумина (БСА)
. В 1 литр 0,5% раствора БСА добавить: -
бензилпенициллин (2 x 106 IU/литр) - стрептомицин (200 мг/литр) - полимиксин B
(2 x 106 IU/литр) - гентамицин (250 мг/litre) - нистатин (0.5 x 106
IU/litre) - офлоксацин гидрохлорид (60 мг/литр), and - сульфаметоксазол (0.2
г/литр)
. Провести стерилизующую фильтрацию и разлить в
1,0-2,0 мл пробирки с завинчивающимися крышками.
Примечание: При растущем применении антибиотиков
в животноводстве стало необходимым использование высоких концентраций
противобактериальных и противогрибковых средств.
(Б) Глицериновая транспортная среда
. Забуференный фосфатом физиологический раствор
(PBS):
|
NaCl
|
8
г
|
|
KCl
|
0.2
г
|
|
Na2HPO4
|
1.15
г
|
|
KH2PO4
|
0.2
г
|
|
Дистиллированная
вода
|
до
получения 1 литра
|
. Стерилизовать ЗФФР в автоклаве и соединить в
соотношении 1:1 со стерильным глицерином до получения 1 литра
. К 1 литру ЗФФР/глицерина добавить:
бензилпенициллин (2 x 106IU/литр) - стрептомицин
(200 мг/литр) - полимиксин B (2 x 106 IU/литр) - гентамицин (250 мг/литр) -
нистатин (0.5 x 106 IU/литр) - офлоксацин гидрохлорид(60 мг/литр) и -
сульфаметоксазол (0.2 г/литр).
Для правильного выбора среды см. ниже раздел
"Подготовка к взятию образцов".
Подготовка пробирок для взятия образцов
В стерильные пластмассовые пробирки с
завинчивающимися крышками разлить по 1,0-2,0 мл транспортной среды.
Предпочтительно хранить пробирки до их использования при температуре - 20°С.
Однако в течение 48-96 часов (оптимальный период - менее 48 часов) их можно
хранить при 4°С, а в течение более короткого периода времени (1-2 дня) - при
комнатной температуре.
Подготовка к взятию образцов
Пробирки должны быть пронумерованы в
соответствии с номерами, указанными в Форме для сбора данных в полевых
условиях. По возможности, в Форме для сбора данных в полевых условиях
необходимо указывать следующую информацию: тип животного, вид животного, тип
образца, дату и место взятия образца и др.
Среда для тканевых культур (А) широко
применяется для взятия и транспортировки клинических образцов у всех видов
животных. Среда на основе глицерина (Б) обеспечивает более длительную
устойчивость образцов в условиях, когда их незамедлительное охлаждение
невозможно; она подходит для инокуляции яиц, но не подходит для инокуляции
тканевых культур.
Клинические образцы необходимо брать указанными
ниже способами и помещать в транспортную среду. Все образцы следует хранить в
емкостях со льдом или при температуре 4 °С.
Всегда следует соблюдать стандартные меры
предосторожности, а при взятии образцов у пациентов необходимо применять
барьерные методы защиты.
Назальный мазок
Сухой полиэфирный зонд-тампон ввести на
несколько секунд в ноздрю параллельно нёбу. Затем вращательными движениями
медленно вынуть зонд, прижимая его к нижней внутренней поверхности носа.
Образцы из обеих ноздрей берутся одним и тем же зондом. Наконечник зонда ввести
в пробирку, содержащую 2-3 мл транспортной среды, и отломить стержень
аппликатора.
Мазок из зева
Энергично потереть заднюю стенку зева и
поместить мазок в транспортную среду, как указано выше.
Мазок из трахеи
Для взятия мазка из трахеи живых птиц ввести
полиэфирный зонд-тампон в трахею и осторожно потереть им о стенки. Затем
поместить мазок в транспортную среду, как указано выше.
Мазки из трахеи мертвых животных, включая свиней
на скотобойнях, можно брать после удаления легких и трахеи из туши. Надеть
перчатки, взять трахею рукой, ввести зонд-тампон на максимальную длину и
энергично потереть им о стенки трахеи. Затем поместить мазок в транспортную
среду, как указано выше.
Мазок из клоаки
Для взятия мазка из клоаки живой птицы ввести
зонд-тампон глубоко в отверстие клоаки и энергично потереть им о стенки.
Зонд-тампон должен быть сильно испачкан фекалиями. Затем поместить мазок в
транспортную среду, как указано выше.
Образцы фекалий
Образцы фекалий из клеток живых домашних птиц на
птичьих рынках или образцы фекалий диких птиц из окружающей среды необходимо
собирать из свежего влажного помета; зонд-тампон должен быть сильно испачкан
фекалиями. Затем поместить мазок в транспортную среду, как указано выше.
Взятие сывороток для диагностики гриппа и
эпиднадзора за ним
Образцы тканей
Образцы тканей, в идеале, необходимо немедленно
замораживать без транспортной среды, а позднее измельчать и помещать в
транспортную среду перед инокуляцией яиц или тканевых культур.
Для диагностики образец сыворотки острой фазы
(3-5 мл цельной крови) необходимо брать вскоре после появления клинических
симптомов и не позднее 7 дней после их появления. Образец сыворотки фазы
выздоровления необходимо брать через 2-4 недели. Для серологических
исследований животных на скотобойнях или свободно летающих диких птиц,
выпускаемых на волю после взятия крови, берется один образец сыворотки.
Свернувшуюся кровь центрифугировать при 2500 оборотах в минуту в течение 15
минут для отделения красных кровяных клеток от сыворотки. Сыворотку
отпипетировать, а красные кровяные клетки можно утилизировать. Образцы
сыворотки хранить при температуре -20°С [32].
.7 Иммунитет и специфическая профилактика
Антигенная изменчивость вируса
гриппа птиц, затрагивающая поверхностные белки вириона - гемагглютинин и
нейраминидазу, изменяющиеся независимо друг от друга, создает существенные
трудности в решении проблемы вакцинопрофилактики гриппа. Поэтому необходимы
своевременное выделение новых эпизоотических вариантов вируса и подбор
адекватных вакцинных штаммов, для чего необходимо применять эффективный метод
оценки антигенного соответствия вакцинных штаммов циркулирующим эпизоотическим
(рисунок 14). Для этого широко используют радиоиммунологический метод.
Для профилактики гриппа,
вызываемого вирусом H7N1, применяют живые вакцины из аттенуированных штаммов Ру
и Р5. С целью профилактики гриппа птиц, вызываемого вирусами подтипов А1-А8,
применяют активную инактивированную вакцину, которая производится биофабриками.
Для специфической профилактики
в Англии применяют живую нейраминидазо-1Ч-специфическую вакцину, преимущество
которой в том, что она не интерферирует при серологической диагностике болезни
в РЗГА.
В США успешно применяют
масляно-эмульсионную вакцину против гриппа птиц на цыплятах-бройлерах и
курах-несушках [33].

Рисунок 14 - Стратегии
разработки современных вакцин против гриппа птиц
.8 Организационно-карантинные
мероприятия
1. Ограничение контактов с
территориями, неблагополучными по ГП: при выявлении в стране ВГП независимо от
его антигена запрещение ввоза птицеводческой продукции из соответствующей
страны или ее части; разрешать импорт продукции птицеводства из неблагополучных
регионов спустя 6 мес. после ликвидации последнего случая гриппа, вызванного
высоковирулентным штаммом возбудителя; при возникновении вспышек гриппа,
вызванных низковирулентными штаммами, установленные ограничения по ввозу
продукции сокращаются до 3 мес. после последнего случая болезни; разрешение на
ввоз птицеводческой продукции из стран-экспортеров, где установлено
неблагополучие по гриппу, можно выдавать только после квалифицированного
экспертного всестороннего обследования ветспециалистами страны-импортера
птицеводческих хозяйств и птицеперерабатывающих предприятий неблагополучных
регионов и получения документальных доказательств, подтверждающих ликвидацию
заболевания.
. Осуществление эффективных
программ биологической безопасности: выбор высококачественных и эффективных
дезинфектантов; применение эффективной наружной защиты птицехозяйства от заноса
возбудителей болезней с учетом известных факторов риска; сокращение до минимума
движения транспорта и посетителей; очистка и дезинфекция всех транспортных
средств и оборудования, поступающих на производственные участки; эффективное
использование дезинфекционных ковриков для обработки обуви; исключение
попадания диких птиц в производственные помещения и их контакта с товарным
стадом; очистка территории птицехозяйства, особенно под кормовыми бункерами и
на пути следования кормовозов, чтобы не привлекать рассыпавшимся кормом диких
птиц; устранение застоя воды, отказ от использования в качестве питьевой воды
для товарной птицы поверхностных вод, которые могут быть загрязнены пометом
диких птиц; контроль перемещения птицы; проведение периодического
серомониторинга от каждой партии птиц.
Целесообразно на угрожаемых
территориях проводить и серомониторинг людей, обслуживающих производство птицы
(птичницы, работники убойных цехов, ветеринарные специалисты птицехозяйств).
3. Поголовный убой всей птицы в
инфицированном хозяйстве. Ряд ученых и специалистов государственной
ветеринарной службы обоснованно считают, что предпочтительный способ контроля
за ситуацией заключается в своевременном убое всех птиц, инфицированных и из
хозяйств соседних районов. Таким образом, создается свободная от домашней птицы
зона для препятствия дальнейшего распространения вируса.
Однако техническое обеспечение,
необходимое для оперативного, безопасного (в том числе для людей) и гуманного
убоя и утилизации большого поголовья домашней птицы (включая при необходимости
частный сектор), организация отчужденных мест зимовок перелетных птиц для
большинства стран (Россия здесь не исключение), являются задачей, требующей
огромных материальных затрат.
. Оперативная вакцинация
поголовья в угрожаемых зонах. Перед угрозой громадных материальных потерь
проведение специфической профилактики в хозяйствах, где по каким-либо причинам
(административные, организационные, хозяйственные, профессиональные и др.)
своевременная иммунизация против ГП птиц не осуществлялась как плановое
мероприятие. Другим поводом может быть, например, применение вакцины, более
полно совпадающей по антигенному профилю входящих в нее штаммов по сравнению с
ранее применявшимся в хозяйстве или хозяйствах препаратом. Реально
характеристику "оперативная" следует принимать весьма условно и
только в приложении к быстроте исполнения, так как суть вакцинации -
толерантность к возбудителям инфекционных заболеваний, а она формируется лишь
спустя 2-4 недели после введения вакцины.
Вакцинация как дополнительное
профилактическое мероприятие по контролю за ГП применялась во многих странах,
среди которых США, Мексика, Италия, Пакистан, Индонезия, Китай и в Гонконге.
При этом итоги иммунизации, как правило, были положительными.
Какие доводы, отрицающие
специфическую профилактику, можно услышать сегодня:
вакцинация создает
потенциальную возможность для скрытой циркуляции уличных вирусов;
наиболее распространенный
диагностический тест реакция торможения гемагглютинации не позволяет
дифференцировать антитела, индуцированные в результате болезни и вакцинации.
Непонятно почему эти вопросы не
адресуются к тем же нозологическим формам, как известные всему миру
инфекционная бурсальная болезнь, ньюкаслская болезнь или болезнь Марека. И
почему этим неудобствам не противопоставить громадную биологическую,
экологическую и социальную опасность вируса гриппа птиц.
В мировой практике именно
иммунизация привела (по данным лабораторных и полевых наблюдений, проведенных в
Гонконге) к тому, что иммунизированные куры опытной группы после их заражения
массивными дозами уличного штамма ГП выделяли во внешнюю среду примерно в 10
тыс. раз меньше вирулентного вируса по сравнению с контрольными
невакцинированными. Конечным результатом применения вакцины в Гонконге стала
успешная ликвидация вспышки ГП на соответствующих фермах.
Установлено, что своевременная
вакцинация приводит к снижению абсолютной (по всем органным структурам)
вирусной нагрузки у птицы. Одновременно уменьшается количество инфицированных
особей в стаде, что эффективно пре пятствует расширению очага болезни.
Отсутствие среды воспроизводства ВГП существенно снижает риск инфицирования
людей, обслуживающих потенциально зараженную птицу.
Для дифференцирования антител,
при желании, можно применять диагностические тесты, основанные на выявлении
антител к нейраминидазе, М - и NS-белкам, ИФА-тесты. Были бы полезны здесь и
молекулярно-биологические методы (полимеразно-цепная реакция, геномное
секвенирование), позволяющие выявлять различные и сходные геномные фрагменты
вируса, и более доступные вирусологические приемы (заражение отобранными
образцами куриных эмбрионов, монослойных клеточных культур), нацеленные на
изоляцию полевых вирусов и их дальнейшую идентификацию [34].
В качестве еще одного аргумента
в пользу вакцинации против ГП необходимо привести американские исследования,
продемонстрировавшие, что антитела, синтезированные в результате иммунизации,
подавляют репродукционную активность вируса ГП, что снижает возможность мутационных
изменений в геноме. В этих же работах показано, что для эффективной защиты не
требуется полного антигенного соответствия между полевыми и вакцинными
штаммами. Более высокая эффективность вакцинации против ГП отмечена, если оба
штамма (вакцинный и полевой) принадлежат к одному сероподтипу по характеристике
гемагглютинина.
Заключение. Вследствие того что
карантинные меры обеспечивают не более чем временный, непродолжительный и
частный результат, отличающийся крайне высокими дестабилизирующими финансовыми
затратами и структурными технологическими разрушениями хозяйств, а также
системным деструктивным воздействием на всю отрасль, необходимо в РФ оперативно
переходить к тотальной иммунизации домашней птицы (инактивированными вакцинами,
с первых часов жизни цыплят). Проводить контроль ГП комплексно, с учетом
перечисленных выше принципов. Такая стратегия профилактики ГП может быть
реализована только при государственной поддержке на самом высоком уровне,
точнее, административном патронаже, как это уже было успешно отработано в
деталях с ньюкасловской болезнью.
Предлагаемая стратегия при
несущественном давлении на ценообразование конечной продукции (для сравнения -
в отрасли повсеместно применяется до 10 вакцин) сохранит отечественное
высокотехнологичное промышленное птицеводство как один из основных источников
продовольственного благополучия страны, а при прогнозируемом драматическом
развитии событий защитит еще от подневольности, и диктата импорта.
2. Основная часть
2.1 Характеристика объекта
Исследовательский центр Государственного
учреждения "Национальный центр мониторинга, референции, лабораторной
диагностики и методологи в ветеринарии" МСХ РК (ИЦ ГУ "НЦМР")
является самостоятельным юридическим лицом и аккредитована на техническую
компетентность Госстандартом РК.
ИЦ возглавляет Директор ГУ "Национальный
центр мониторинга, референции, лабораторной диагностики и методологии в
ветеринарии" МСХ РК и в своей деятельности подчинен Учредителю
(Учредителем государственного учреждения является государство в лице
Правительства Республики Казахстан).
Органом Государственного управления
Республиканского государственного учреждения "Национальный центр
мониторинга, референции, лабораторной диагностики и методологи в
ветеринарии", а также органом, осуществляющим по отношению к нему функции
субъекта права государственной собственности является Министерство сельского
хозяйства Республики Казахстан.
В своей деятельности ИЦ руководствуется
действующим законодательством Республики Казахстан, организационными и
методическими документами Госстандарта.
Организация и проведение исследования материала,
анализ и оформления их результатов находятся в компетенции исследовательского
центра.
Прием и увольнение работников ИЦ и установление
им должностных окладов производит Директор ГУ "Национальный центр
мониторинга, референции, лабораторной диагностики и методологии в
ветеринарии" МСХ РК в пределах установленного Учредителем фонда оплаты
труда.
Распределение обязанностей между работниками ИЦ
и утверждение должностных инструкции производит Директор ГУ "Национальный
центр мониторинга, референции, лабораторной диагностики и методологии в
ветеринарии" МСХ РК.
Штаты ИЦ ГУ "НЦМР" укомплектовываются
специалистами, имеющими соответствующее образование, профессиональную
подготовку, квалификацию и опыт проведения исследования. Их обязанности, права
и ответственность устанавливаются должностными инструкциями.
Сотрудники ИЦ допускаются к работе после
ознакомления с обязанностями и инструкциями. Повышение квалификации сотрудников
обеспечивается через прохождение курсов повышения квалификации в соответствии с
должностной инструкцией.
ИЦ ГУ "НЦМР" проводит исследование
материала на соответствие требованиям межгосударственных и государственных
стандартов, или других нормативных документов.
Основные задачи:
. Осуществление лабораторных исследований
материалов особо опасных заразных болезней животных по утвержденному перечню
Правительством Республики Казахстан;
. Привлекается в установленном порядке к работам
по отбору проб для проведения исследований.
. Обеспечение полноты и правильности проведения
исследований, объективности и достоверности результатов.
. Научная разработка нормативно-методических
документов по ветеринарному лабораторному делу.
. Обеспечение непрерывного функционирования
системы качества услуг, оказываемых заказчиками.
. Принимать участие в информационном обмене с
другими ИЛ аналогичного профиля для внедрения в практику деятельности
согласованных методик и получения сопоставимых результатов исследований.
Права:
Исследовательский центр имеет право:
указывать в рекламных материалах, в различных
документах (в том числе, содержащих результаты испытаний), что он аккредитован
в Государственной системе сертификации Республики Казахстан, Системе
аккредитации;
заключать договоры о взаимодействии с другими
организациями; (если ИЦ ГУ "НЦМР" аккредитован на техническую
компетентность, договор заключается от юридического лица, в состав которой он
входит);
участвовать в работе отечественных и
международных организаций по стандартизации, исследованиям, оценки и контролю
качества;
- проводить арбитражные исследования по
поручению соответствующих органов;
расширять область аккредитации, в установленном
порядке;
передавать материалы в судебные органы при
нарушении заказчиками условий контракта (договора), препаратов и оборудования.
Исследовательский центр обязан:
проводить исследования и выдавать акты экспертиз
в соответствии системы аккредитации в пределах области аккредитации;
ссылать на факт своей аккредитации только
применительно к установленной области аккредитации;
обеспечивать достоверность, объективность и
требуемую точность результатов исследований;
проводить исследования для постановки диагноза и
четко идентификации образцов материалов, сопровождаемые актом отбора;
доводить до соответствующих органов государственного
надзора информация об отрицательных результатах исследований по требованиям,
обеспечивающим безопасность жизни и здоровья людей, имущества граждан и
окружающей среды;
предоставлять заказчику возможность наблюдения
за проводимыми для него исследованиями;
соблюдать установленные сроки проведения
исследований;
проводить по требованию Госстандарта контрольные
исследования для проверки или подтверждения технической компетентности своей
или другой лабораторий;
предоставлять при необходимости, образцы
исследуемых материалов для проведения меж лабораторных сличений;
принимать участие в программах меж лабораторных
сличений;
создавать необходимые условия для проведения
государственного контроля за деятельностью исследовательского центра;
вести учет предъявляемых претензий по
результатам исследований;
обеспечивать конфиденциальность информации при
проведении исследований;
своевременно информировать Госстандарт об
изменениях юридического статуса ИЦ, наименования, адреса, организационной
структуры;
в случае приостановления или аннулирования
Аттестата аккредитации немедленно прекратить деятельность по исследованиям в
соответствии с требованиями нормативных документов системы аккредитации и
нормативных правовых актов Республики Казахстан.
2.2 Материалы и методы исследований
Отбор проб проводят из трахеи, легких,
воздухоносных мешков, экссудата, костного мозга, подглазничных синусов,
содержимое кишечника и клоаки, из печени, головного мозга, селезенки, крови
(рисунок 15). От больных и трупов павших утят, кроме этого, берут соскобы со
слизистой оболочки носа, гортани и подглазничных синусов. Материал для
последующих исследовании хранят в охлажденном, лучше замороженном виде. Для
выделение вируса ГП используют 9-11 - дневные куриные эмбрионы, которые
заражают в аллантоисную или амниотическую полость. Все штаммы вируса А1
(классической чумы птиц) вызывает гибель эмбрионов через 25-36 часов после
заражения, с возрастанием вирулентности возбудителя по мере увеличения
количества пассажей, до 107-108 ЭЛД 50/мл.
После выделения проводят серологическую
идентификацию вируса, определяя специфическую антигенные способности штамма в
РЗГА, РН в эмбрионах кур, ИФА, реакция торможения нейраминидазой активности
(РТНА), реакция радиального гемолиза, в РДП (определяя сходство гемагглютинина
и нейраминидазы), в полимеразой цепной реакции (ПЦР) - для определения генома
вируса, выявленные вирусной нуклеиновой кислоты в пробах патологического
материала и в аллантоисной жидкости зараженных куриных эмбрионов, а также для
дифференциации антигенных подтипов вируса. Биопроба проводиться внутривенным
заражением цыплят аллантоисной жидкостью эмбрионов кур, инфицированных
выделением изолятом вируса ГП. Если из 10 цыплят в течение 10 дней гибнет 6
голов, то выделенный вирус ГП считается высокопатогенным.

Рисунок 15 - Отбор проб материалов (сердце,
селезенка)
Схема лабораторной диагностики птичьего гриппа
показана на рисунке 16. Применяемые в настоящее время методы лабораторной
диагностики гриппа птиц можно разделить на четыре группы:
Серологические реакции
- Реакция гемагглютинации (РГА)
- Реакция торможения гемагглютинации
(РТГА)
Иммуноферментный анализ (ИФА)
Реакция нейраминидазы (РИНА)
Реакция нейтрализации (РН)
Выделение вируса
- Реакция на куриных эмбрионах
- Культура клеток MDCK, Vero
Молекулярно-генетические исследования
- Полимеразная цепная реакция (ПЦР)
- Реал-тайм ПЦР
Расшифровка генома вируса
Электронно-микроскопические исследования
- Изучение морфологии вируса
Электронно-микроскопическое фотографирование
РГА
Для идентификации вируса в патологическом
материале можно использовать РГА. Надосадочную жидкость после центрифугирования
суспензии проб из органов и тканей больной птиц, а также смывов исследуют в
капельной или пробирочной РГА с 1% суспензии эритроцитов кур или 0,5% взвесью
эритроцитов морской свинки. Реакцию учитывают через 20 минут и 1 час.
Специфичность определяют в РТГА [35].
Идентификацию испытуемого вируса проводят с
набором эталонных штаммоспецифицеских гриппозных сывороток к его антигенным
вариантам. Для дифференциации в реакцию вводят сыворотку против вируса БН. РТГА
ставят микро- или макрометодом по общепринятой методике [36].
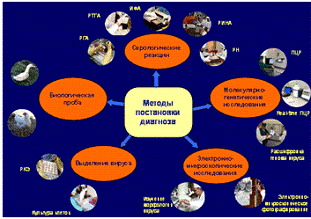
Рисунок 16 - Лабораторная диагностика птичьего
гриппа
Диагностика гриппа комплексная с обязательным
выделением, идентификацией вируса и постановкой биопробы. Для ретроспективной
серологической диагностики используют РЗГА. Для серологических исследований
используют РДП, РНГА, МФА, РСК, а также метод иммуноферментного анализа (ИФА),
предназначенный для экспресс титрования антител к вирусу ГП по гемагглютинину и
нейраминидазе.
При проведении иммуноферментного анализа (ИФА)
используют оборудование, показанное на рисунке 17. На рисунке 18 показаны схемы
проведения ИФА.

Рисунок 17 - Оборудование для проведения ИФА

Рисунок 18 - Схемы метода ИФА
Схема метода ИФА двойных антител
"сэндвича" для определения антигена
Схема "непрямого" метода ИФА для
определения антител
В полимеразой цепной реакции (ПЦР) - определяют
геном вируса, выявленные вирусной нуклеиновой кислоты в пробах патологического
материала и в аллантоисной жидкости зараженных куриных эмбрионов, а также для
дифференциации антигенных подтипов вируса. При постановке реакции используют
следующие оборудование (рисунок 19):

Рисунок 19 - Оборудование для ПЦР
2.3 Результаты собственных исследований
Учитывая эпизоотическую ситуацию по данному
заболеванию в Казахстане за предыдущие годы, а также мировую ситуацию
вероятность возникновения эпизоотии остается высокой. Основная угроза в
распространении отводится диким перелетным птицам, в особенности утке, гусю,
лебедю (рисунок 20).
Весенний миграционный поток перелетных птиц на
территорию Сибири проходит через Казахстан по трем основным направлениям
(рисунок 21) - с Африканских и Южно-Европейских зимовок охватывает территории
Западно-Казахстанской, Атырауской, Мангистауской областей; с пакистанских
зимовок миграция проходит через южные и центральные области Казахстана; с
индийских зимовок поток охватывает восточные и северные регионы Республики.
Осенняя миграция проходит теми же путями.
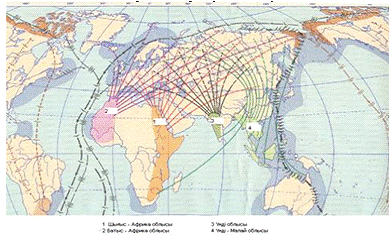
Рисунок 20 - Пути миграции птиц в мире

Рисунок 21 - Основные участки миграционных
потоков птиц
Всю миграцию можно разделить на три этапа - ране
прилетные птицы, средне и поздние прилетные также как и ране отлетные, средне и
поздние отлетные. Данное обстоятельство зависит от режима температуры воздуха
окружающей среды. Весенний пролет ране прилетной птицы, в которую входят
наиболее подверженные вирусоносительству виды - утка, гусь, лебедь происходит,
когда средне суточный показатель температуры воздуха приходится на интервал
5-10єС. Массовый прилет приходится примерно на двадцатые числа февраля в Южных
областях Казахстана и во второй декаде апреля в северной части.
Весной происходит занос латентной инфекции при
посредстве вирусоносителей, в июль-сентябрь месяцах происходит естественный
пассаж вируса через организм водоплавающих птиц, усиление вирулентности и
развитие инфекции. В связи с этим, Национальным центром мониторинга,
референции, лабораторной диагностики и методологи в ветеринарии была продолжена
и разработана схема зонирования территории РК для проведения мониторинга по
высокопатогенному гриппу птиц (рисунок 22). Согласно схемы были определены:
зона реальной угрозы (Северно-Казахстанская, Павлодарская, Акмолинская,
Мангистауская и северные районы Восточно-Казахстанской областей), угрожаемая
зона (Костанайская область, южные районы Восточно-Казахстанской области,
северные районы Алматинской, Жамбылской, Южно-Казахстанской, Кызылординской
областей, южные районы Актюбинской и Атырауской областей.) и зона наблюдения
(южные и западные области Казахстана).
Рисунок 22 - Зонирование территории РК по
высокопатогенному птичьему гриппу в 2007 г.
В 2007 году в мире птичий грипп зарегистрирован
в 33 странах. В основном это страны юго-восточной Азии, Африка, Европа. Прогноз
зависит от того, где будет регистрироваться птичий грипп. Если это будут страны
юго-восточной Азии, то будет существовать реальная угроза заноса гриппа весной
на территории Алматинской, Восточно-Казахстанской, Карагандинской,
Северо-Казахстанской, Павлодарской, Костанайской, Акмолинской областей. Если
это будет Европа или Африка то заносу гриппа подвержены западные области
Казахстана. При осенней миграции угроза будет исходить от приграничных областей
Российской Федерации, следовательно под угрозой заноса птичьего гриппа будут
находиться восточные, северные и западные области Казахстана.
Птичьи грипп в 2005 года зарегистрирован в
следующих областях Республики Казахстан (рисунок 23):
В крестьянском хозяйстве "Нан",
расположенного на территории села Голубовка Абайского сельского округа
Иртышского района Павлодарской области. Дата наложения карантина 1 августа 2005
года. В данном хозяйстве уничтожено путем сжигания 2 800 голов птицы.
В селе Виноградовка Наумовского сельского округа
Аккольского района Акмолинской области. Дата наложения карантина 3 августа 2005
года. Изъято и уничтожено 467 голов.
В селе Ушсарт Кызылсайского сельского округа
Коргалжынского района Акмолинской области. Дата наложения карантина 1 августа
2005 года. Дата наложения карантина 4 августа 2005 года. Изъято и уничтожено 2
745 голов.
В селе Тумсык Шетского сельского округа Шетского
района Карагандинской области. Дата наложения карантина 10 августа 2005 года.
Изъято и уничтожено 510 голов.
В селе Дубровное Дубровинского сельского округа
Мамлютского района Северо-Казахстанской области. Дата наложения карантина 12
августа 2005 года. Изъято и уничтожено 2722 голов.
В селе Талапкер Амангельдинского сельского
округа Есильского района Северо-Казахстанской области. Дата наложения карантина
15 августа 2005 года. Изъято и уничтожено 3408голов.
В селе Нолобино Нолобинского сельского округа
Кызылжарского района Северо-Казахстанской области. Дата наложения карантина 17
августа 2005 года. Изъято и уничтожено 211 голов.
В целях предупреждения распространения птичьего
гриппа в полном объеме проведен комплекс мероприятий по локализации и
ликвидации очагов.
По всем указанным неблагополучным пунктам изъято
и уничтожено 12 860 голов домашней птицы [ГУ "НЦМРЛДМВ" МСХ РК]
(Государственное учреждение Национальный центр мониторинга, референции,
лабораторной диагностики и методологии в ветеринарии).

Рисунок 23 - Эпизоотическая состояние Республики
Казахстан по птичьему гриппу в 2005-2006 гг.
В 2007 году из 8 областей Республики Казахстана
в лабораторию микробиологии и вирусологи ГУ "НЦМРЛДМВ" МСХ РК на
исследование поступило 154 проб патологического материала от домашних и диких
птиц, которые были подвергнуты тщательному патологоанатомическому и
лабораторному исследованию, результаты исследований которых были отрицательными
(таблица 2).
В лабораторию микробиологии и вирусологии АФ ГУ
"НЦМР" за 2007 г. поступило 949 проб для вирусологического и
бактериологического исследований. Изучение биоматериала проводилось с
использованием молекулярно-биологических и иммунологических методов
исследований (таблица 3). В результате гистологического исследования обнаружены
нуклеопротеиды вируса гриппа в отдельных ячейках нерва (рисунок 24), островках
поджелудочной железы (рисунок 25), в цитоплазме и ядре мозговых нейронов
(рисунок 26), в гранулированном слое мозжечка (рисунок 27).
Рисунок 24 - Обнаружение нуклеопротеидов вируса
гриппа в отдельных ячейках нерва
Рисунок 25 - Выявление нуклеопротеидов вируса
гриппа в отдельных островках поджелудочной железы
Таблица 2 - Сведения
лабораторных исследований на вирусные инфекции
|
№
п/п
|
Наименование
заболевания
|
Количество
материала
|
Биологическая
проба
|
Проведены
лабораторные исследования
|
|
|
|
|
РИД
|
РГА
|
РСК
|
ИДАФ
|
ИФА
|
Иммуннохроматография
|
Получено
положительных результатов
|
Всего
проведено исследований
|
|
Болезни
птиц
|
|
1
|
Птичий
грипп
|
154
|
|
|
18
|
|
|
154
|
99
|
|
271
|
|
Болезни
КРС
|
|
2
|
Лейкоз
|
212
|
|
152
|
|
|
|
212
|
|
115
|
364
|
|
3
|
Ящур
|
3668
|
|
|
|
690
|
|
3668
|
21
|
24
|
4379
|
|
Болезни
плотоядных
|
|
4
|
Бешенство
|
5
|
|
|
|
|
1
|
|
|
-
|
5
|
|
5
|
Чума
плотоядных
|
4
|
|
|
|
|
|
|
|
4
|
4
|
|
Болезнь
свиней
|
|
6
|
Классическая
чума свиней
|
41
|
2
|
|
|
|
|
41
|
|
|
43
|
|
Итого:
|
4084
|
2
|
152
|
18
|
690
|
1
|
4075
|
120
|
143
|
5062
|
Таблица 3 - Результаты
лабораторно-диагностических исследований
|
На
какие болезни проводились исследования и по каким видам животных
|
Кол-во
проб
|
Из
них проведено исследований
|
Получены
положительные результаты
|
|
|
Пат.
- анат
|
Микроскоп
|
Бактериол
|
Вирусолог
|
Биологич
|
Серологич
|
Гематолог
|
Капролог
|
Химич
(биохимич)
|
Гистологии
|
|
|
Бруцеллез
сыворотка крови КРС
|
56
|
|
|
|
|
|
56
|
|
|
|
|
-
|
|
Бруцеллез
цельная кровь МРС
|
21
|
|
21
|
63
|
|
|
|
|
|
|
|
|
|
Колибактериоз
|
19
|
|
19
|
38
|
|
|
|
|
|
|
|
-
|
|
Пастереллез
диких животных пат.материал
|
88
|
|
88
|
176
|
|
|
|
|
|
|
|
-
|
|
Сальмонелл
ез
|
54
|
|
54
|
54
|
|
|
|
|
|
|
|
-
|
|
Сибирская
язва пат.материал
|
30
|
|
30
|
30
|
|
|
|
|
|
|
|
-
|
|
Ящур
сыворотка крови КРС наИФА
|
62
|
|
|
|
62
|
|
|
|
|
|
|
-
|
|
Ящур
сыворотка крови МРС на ИФА
|
10
|
|
|
|
10
|
|
|
|
|
|
|
|
|
Листериоз
пат.материал
|
41
|
|
41
|
82
|
|
|
|
|
|
|
|
-
|
|
Грипп
птиц пат.материал ПЦР
|
|
|
|
358
|
|
|
|
|
|
|
-
|
|
Грипп
птиц сыворотка крови ИФА
|
210
|
|
|
|
210
|
|
|
|
|
|
|
-
|
|
Всего:
|
949
|
|
253
|
443
|
640
|
|
56
|
|
|
|
|
|
Рисунок 26 - Выявление нуклеопротеидов вируса
гриппа в цитоплазме и ядре мозговых нейронов
Рисунок 27 - Выявление нуклеопротеидов вируса
гриппа в гранулированном слое мозжечка
-9 ноября 2005 г. состоялось совещание по
птичьему гриппу и пандемическому гриппу человека, совместно созванное ВОЗ,
Продовольственной и сельскохозяйственной организацией, Всемирной организацией
здоровья животных и Всемирным банком. В ходе этого совещания был проведен обзор
состояния заболеваемости животных птичьим гриппом, вызываемым высокопатогенным
вирусом H5N1, и оценены сопутствующие риски для здоровья человека, в том числе
риски, которые возникнут с появлением пандемического вируса. Обеспокоенность
последствиями такого события предопределила ход обсуждения вопросов здоровья
человека в направлении рассмотрения двух основных наборов действий. Последние
были нацелены на предупреждение появления пандемического вируса или, если это
окажется невозможным, на отсрочку первоначального международного
распространения пандемии, и на подготовку всех стран к такому противодействию
пандемии, чтобы сократить заболеваемость и смертность, а также ослабить
экономические и социальные потрясения.
Участники пришли к ряду выводов и согласовали
план действий из 12 пунктов. Основных, из которых 5. Эти пять мероприятий
составляют основу стратегического плана, который нацелен на решение двух
всеобъемлющих задач:
использовать все практически осуществимые
возможности для предупреждения развития у вируса H5N1способности вызвать
пандемию и в случае безуспешности этих усилий,
обеспечить принятие мер по снижению высокой
заболеваемости и смертности и ослаблению социально-экономических потрясений,
которых можно ожидать в ходе следующей пандемии.
Перед каждым стратегическим мероприятием
ставится цель, достижение которой способствует решению этих более масштабных
задач.

Профилактика и меры борьбы с высококонтагиозным
птичьим гриппом включают в себя общую профилактику и меры при вспышках.
Общая профилактика состоит из 1) исключения
контактов домашней птицы с дикими птицами, особенно с водоплавающими; 2)
недопущения в хозяйство птицы с неизвестным эпизоотическим статусом; 3)
контроля перемещения людей (персонала); 4) тщательной очистки и дезинфекции
хозяйства; 5) разведения птицы одной возрастной группы (все пусто - все
занято). Меры при вспышках должны включать: 1) карантин; 2) убой всей птицы
(стемпинг-аут) в радиусе 3-10 км; 3) утилизацию всех трупов и всей продукции;
4) очистку и дезинфекцию; 5) зонирование; 6) мониторинг за дикой фауной; 7)
вакцинацию по паказаниям ("Инфлювак" - Нидерланды,
"Вакцигрипп" - Франция, "Флюарикс" - Бельгия,
"Гриппол" и "Грипповакс" - Россия.
3. Экономическое обоснование
Основной задачей проведения
научных исследований является определение экономической эффективности
ветеринарных мероприятий, выявление резервов повышения их эффективности,
изучение экономического ущерба, причиняемого заразными болезнями животных,
определение экономического эффекта, получаемого в результате внедрения
достижений ветеринарной науки и практики в производство.
При определении экономических
показателей эффективности данных научных исследований определяли следующие
экономические показатели: фактический экономический ущерб, предотвращенный
ущерб, затраты на проведение ветеринарных мероприятий и экономическую
эффективность ветеринарных мероприятий.
Экономический ущерб от
уничтожения больных гриппом птиц определяем формуле (1):
У=МЧЖЧЦ, (1)
где: М - количество павших,
вынужденно убитых птиц,
Ж - средняя масса птиц разных
видов, кг
Ц - средняя реализационная цена
единицы продукции, тенге
Например, в птицеводческом
хозяйстве зарегистрирован высококонтагиозный грипп птиц. Заболело и пало 1000
кур, живой массой 3,5 кг. Карантин был снят через 21 день после уничтожения
последнего трупа. Средняя реализационная цена 1 кг живой массы составляет 300
тенге. Трупы павших животных сожжены. Ущерб от падежа составил:
У1=МЧЖЧЦ=1000 Ч3,5Ч300=1050000
тенге
Ущерб от падежа 1000 кур
составил 1050000 тенге.
Таким образом, экономический
ущерб в случае возникновения высококонтагиозного птичьего гриппа в хозяйстве с
птицепоголовьем в 1000 кур составит 1 050 000 тенге, что говорит о высокой
опасности данного заболевания, тем более, что оно является опасным и для
человека.
4. Охрана окружающей среды
В настоящее время в Республике Казахстан
сложилась неблагоприятная экологическая обстановка. Этому во многом
способствует то, что на протяжении многих десятилетий в Казахстане складывалось
преимущество сырьевая система природопользования. Это сопровождалось
экстремально высокими техногенными нагрузками на окружающую среду. Поэтому
кардинального улучшения экологической ситуации не произошло, и она по прежнему
характеризуется деградацией природных систем, что ведет к дестабилизации
биосферы, утрате ее способности поддерживать качество окружающей среды,
необходимое для жизнедеятельности общества.
Годы независимости в Казахстане стали годами
образования экологической безопасности, управление охраной окружающей среды и
природопользования - хорошо организованной и территориально разветвленной
системой исполнительных органов в области охраны окружающей среды РК.
С момента принятия данной концепции в РК
произошли серьезные перемены в общественном развитии. Разработаны
стратегические документы развития государства, создана основа природоохранного
законодательства, подписан ряд международных конвекций по вопросам окружающей
среды, создана система управления природоохранной деятельностью.
Задачей законодательства РК в области охраны
окружающей среды является урегулирование отношений в сфере взаимодействия
общества и природы с целью улучшения качества окружающей среды, укрепление
законности и правопорядка.
Каждый гражданин обязан охранять окружающую
среду и бережно относиться к природным ресурсам, соблюдать законодательство об
охране окружающей среды, повышать уровень своих экологических знаний и
содействовать экологическому воспитанию подрастающих поколений. Земля и ее
недра, вода, растительный и животный мир, другие природные ресурсы составляют
материальную основу суверенитета РК и находятся в государственной собственности
[37].
Одной из важнейших экологических проблем в
пищевой промышленности является выброс в атмосферу вредных веществ, объем
которого в 2000г. составил 181,8 тыс.т. Основные компоненты выбросов: оксид
углерода (40% общего объема выбросов в отрасли), диоксид серы (28%), твердые
вещества (13%) и оксид азота (12%). Показатель улавливания и обезвреживания
вредных веществ в 2000 г. достиг максимального.
Воздействие на атмосферный воздух объектов
пищевой промышленности определяется тем, что в выбросах, помимо общих для
промышленности вредных веществ, присутствуют сильно пахнущие компоненты, сухие
продукты животного происхождения, канцерогенные вещества. Решение этих вопросов
осложняется тем, что объем выбросов загрязняющих веществ распределяется между
многочисленными предприятиями
Не менее важной и сложной проблемой является
использование водных ресурсов. В пищевой промышленности в 2000 г. использовано
573,6 млн. куб.м. воды. В структуре сброса значительную часть составляют
загрязненные сточные воды (56%), на нормативно чистые воды приходится 38%.
Сбрасывая в поверхностные водные объекты
преимущественно загрязненные производственные воды с высоким содержанием
вредных веществ предприятия загрязняют водоемы органическими веществами,
сульфатами, фосфатами, нитратами, щелочами и кислотами.
Таким образом, основной экологической задачей
всех пищевых производств на современном этапе является достижение должного
уровня качества окружающей среды [38].
В число эффективных мер по охране окружающей
среды следует отнести, прежде всего, широкое внедрение прогрессивных
технологических процессов; улучшение работы очистных сооружений и установок;
усиление охраны атмосферного воздуха; обеспечение рационального использования и
защиты земель; улучшение работы по охране, воспроизводству и рациональному
использованию растительного и животного мира; воспитание у людей чувства
ответственности за сохранение и преумножение природных богатств и др.
Эксплуатация объектов сельскохозяйственного
назначения должна осуществляться с учетом установленных экологических
требований и с использованием экологически обоснованных технологий, необходимых
очистных сооружений и санитарно-защитных зон, исключающих загрязнение
окружающей среды. При эксплуатации данных объектов должны внедряться
малоотходные и безотходные технологии и производства, они должны оснащаться
эффективными средствами для очистки, обезвреживания и утилизации вредных
отходов, выбросов и сбросов, загрязняющих веществ, применять безопасные виды
топлива, экономно и рационально использовать природные ресурсы, принимать меры
по экологической безопасности.
Должностные лица и специалисты, связанные с
деятельностью, охватывающей вредное воздействие на окружающую среду, обязаны
иметь необходимую экологическую подготовку и обладать знанием основ
законодательства об охране окружающей среды. Профессиональная экологическая
подготовка руководителей и специалистов учитывается при их назначении на
должность аттестацией и переаттестацией.
Охрана окружающей среды - одна из насущных задач
человечества. Научно-техническая революция, ставшая возможной в результате
великих открытий в биологии, физике, химии, и многих других науках, намного
расширяет возможности интенсивного использования природных ресурсов,
необходимых для дальнейшего развития производительных сил, удовлетворения
материальных и духовых потребностей общества. В то же время научно-техническая
революция нередко усложняет взаимоотношение человека с окружающей природной
средой, вносит весьма заметные и непредвиденные изменения в экологические
системы, в регуляцию биосферы в целом. Нередко они связаны с загрязнением
воздушного бассейна, морских акваторий и пресноводных водоемов, нарушением
почвенного покрова и ценных ландшафтов, водных и лесных ресурсов, уменьшением
численности полезных видов животных и растений [39].
Химические и бактериологические загрязнения
пищевых продуктов происходит как в результате загрязнения окружающей среды, так
и по причине отсутствия элементарных гигиенических условий в местах
производства и потребления пищевых продуктов.
Учеными Республики установлено, что во всех
неблагополучных регионах отмечаются высокие уровни общей заболеваемости: рост
бронхитов и тонзиллитов в 5-15 раз, осложнений беременности и родов более в чем
в 5 раз, гастритов, дуоденитов, холециститов в 10 раз, ишемической болезни
сердца, инфарктов миокарда в 7 раз, гипертонии в 5 раз.
Следовательно, экономические исследования,
экологический подход - условия при планировании вмешательства человека в
природу, в том числе и путем природоохранительных мероприятий.
Специалист сельского хозяйства должен быть
организатором и проводником мероприятий по охране природы в сочетании с
задачами сельскохозяйственного производства. Для решения этой проблемы он
должен овладеть полученными основами комплексной охраны природы и практически применять
полученные экологические знания с учетом особенностей ведения сельского
хозяйства в конкретном регионе.
Природа, ее богатства - общие достояние забота о
том, чтобы ее красота и щедрость были сохранены, приумножены и для грядущих
поколений, должна быть всенародной.
Сельскохозяйственное производство, как никакое
другое, тесно и неразрывно слито с природой. Его развитие и конечные результаты
во многом определяются качеством и состоянием основных компонентов биосферы -
земли, воды и атмосферы.
Человечество постоянно стремится наращивать
производство продукции. Но такое увеличение нельзя оправдать, если оно
сопровождается нерациональной тратой природных ресурсов и пагубно действует на
окружающую среду, которая в сложившейся ситуации особенно нуждается в охране.
Целью государственной политики в области
экологической безопасности является обеспечение защищенности природных систем,
жизненно важных интересов общественных прав личности от угроз, возникающих в
результате антропогенных и природных последствий на окружающую среду.
Для достижения данной цели необходимо решить
следующие задачи:
- снижение антропогенного воздействия,
ведущего к изменению климата и разрушение озонового слоя Земли;
- сохранение биоразнообразия и
предотвращение опустынивания и деградации земель;
- реабилитация зон экологического
бедствия, полигонов военно-космического и испытательного комплексов;
- предупреждение загрязнения шельфа
Каспийского моря;
- предупреждение истощения и
загрязнения водных ресурсов;
- ликвидация и предотвращение исторических
загрязнений, загрязнения воздушного бассейна, радиоактивного,
бактериологического и химического загрязнений, в том числе трансграничного;
- сокращение объемов накопления
промышленных и бытовых отходов;
- предупреждение чрезвычайных ситуаций
природного и техногенного характера.
Территория Республики Казахстан разнообразна по
своим природным и географическим условиям. Ее фауна насчитывает множество
видов, через ее пространства проходят пути сезонных миграций диких животных и
птиц, что не может не оказывать влияние на экологию вирусов. Кроме того, в
последние годы повысилась интенсивность взаимных контактов с зарубежными
странами. Указанные факторы способствуют значительному усилению циркуляции и
увеличению вероятности заноса в природу республики разнообразных патогенных
микроорганизмов, в том числе и вирусов, ранее здесь не регистрировавшихся.
Данные ряда неполных исследований показывают, что у сельскохозяйственных
животных страны отмечаются инфекционные болезни неизвестной этиологии,
отдельные случаи которых остаются незамеченными или неисследованными.
Тема дипломной работы: "Эпизоотический
мониторинг и организация ветеринарно-санитарных мероприятий против
высокопатогенного гриппа птиц". То есть при выполнении цели и задач данных
исследований, мы в огромной степени увеличиваем экологическую безопасность
нашей страны, путем предупреждения распространения инфекционного
высококонтагиозного заболевания, которым болеет и человек.
5. Охрана труда
Охрана труда включает в себя
мероприятия по облегчению и оздоровлению условий труда, внедрение
производственных процессов управления рабочего труда и замещение его
механизации и автоматизации трудоемких и вредных процессов, внедрение
совершенных технологий и техники безопасности, устранению причин вызывающих вред
и травматизм работающим и служащим. А также включает в себя нормы гигиенических
и санитарно-бытовых условий.
В настоящее время в каждом хозяйстве,
объединении, области республики имеются комплексные планы улучшения условий,
охраны труда и социально-оздоровительных мероприятий. На их осуществление
выделены необходимые материальные ресурсы и денежные средства, что способствует
улучшению работы по охране труда в колхозах и совхозах [40, 41].
Кодекс законов по охране труда от 15 мая 2007 г.
регулирует общественные отношения в области охраны труда и направлен на
обеспечение безопасности, сохранение жизни и здоровья работников в процессе
трудовой деятельности, а также устанавливает основные принципы государственной
политики в области безопасности и охраны труда.
Основными принципами в области безопасности и
охраны труда являются:
1) приоритет жизни и здоровья работников по
отношению к результатам производственной деятельности;
2) недопущение необратимых последствий
вредного воздействия производственных факторов на жизнь и здоровье работника;
) гарантирование государством защиты прав
работников на условия труда, соответствующие требованиям безопасности и охраны
труда;
) установление единых требований в
области безопасности и охраны труда посредством разработки и принятия
нормативных правовых актов.
Организация охраны труда
Все производственные помещения, оборудование,
технологические процессы должны отвечать требованиям обеспечения здоровых и
безопасных условий труда.
Требования к производственному оборудованию,
равно как и к его размещению и организации рабочих мест, а также требования
безопасности, предъявляемые к организации производственных процессов и
направленные на предупреждение производственного травматизма, закрепляются в
правилах по технике безопасности. Перечень допускаемых стандартами (санитарными
нормами) уровней концентрации и других параметров, опасных и вредных
производственных факторов, свойственных производственным процессами, содержит
нормы производственной санитарии, предотвращающие возникновение профессиональных
заболеваний работников.
Требования, содержащиеся в правилах и касающиеся
техники безопасности и производственной санитарии, должны выполняться при
строительстве предприятий, начиная со стадии проектирования, при
конструировании и изготовлении оборудования, станков, машин.
Ни одно предприятие, цех, участок, производство
не могут быть приняты и введены в эксплуатацию, если на них не обеспечены
здоровые и безопасные условия труда.
Новые или реконструируемые производственные
объекты средства производства не могут быть приняты в эксплуатацию, если они не
имеют сертификата безопасности.
Чтобы требования охраны труда соблюдались
работниками, на администрацию возложено проведение инструктажа.
Помимо инструктажа рабочие (в зависимости от
сложности профессии) знакомятся с правилами по охране труда применительно к
своей профессии. В случае их нарушения или применения неправильных, опасных
методов и приемов работы работник проходит внеплановый инструктаж. Охрана труда
включает обязательные предварительные при поступлении на работу и периодические
медицинские осмотры работающих и является в своей основе предупредительной
мерой для предохранения здоровья работников от вредного воздействия физически
тяжелой работы и с вредными условиями.
Администрацией ГУ "НЦМРЛДМВ" МСХ РК
приняты меры по созданию безопасных условий труда работников и соблюдению
санитарно-гигиенического режима в помещениях, а также повышения культуры
лабораторной работы. Для чего внедрен принцип разделения помещений, в которых
непосредственно проводится работа с инфицированным материалом и комнат, в
которых проводят другие (подготовительные) работы, не связанные с вредными
условиями.
В каждой рабочей комнате установлены
ультрафиолетовые лампы, обеспечивающие обеззараживание помещений и боксов. Отдел
обеспечен дезсредствами для проведения влажной и аэрозольной дезинфекций.
Сотрудники обеспечены специальной одеждой (халатами, чепчиками и др.).
Ограничено посещение помещений посторонними лицами, также сотрудниками других
отделов.
Таким образом, создание режимных условий
исключает распространение возбудителей болезней за пределы отдела и
обеспечивает безопасность самих сотрудников.
Для того, чтобы все работающие знали, а в нужных
случаях и умели действовать, так, чтобы обезопасить себя и других от несчастных
случаев и заболеваний, администрацией предусмотрены соответствующие правила
работы и техника безопасности данной лаборатории.
Общий режим работы в лабораториях ГУ
"НЦМРЛДМВ" МСХ РК.
Перед тем как войти в отдел сотрудник обязан
надеть специальную одежду (халат, медицинский колпак или белую косынку), а при
входе в вирусологическое и бактериологическое подразделения, кроме того,
специальную обувь.
Верхнюю одежду и обувь оставляют в специально
отведенном месте.
Работникам отдела не разрешается:
выходить за пределы отдела в спецодежде и
спецобуви;
надевать верхнюю одежду на халат;
вносить в производственные помещения лаборатории
посторонние вещи;
курить, принимать пищу в производственных
помещениях и хранить в них продукты питания;
За каждым сотрудником вирусологического,
серологического и других отделов закрепляют определенное рабочее место.
Все сотрудники обязаны всегда содержать свои
рабочие места в строгом порядке и чистоте.
При работе с патологическим материалом,
патогенными культурами бактерий, а также с ядовитыми веществами следует
избегать касания руками лица и пользоваться носовым платком.
Работать с патологическим материалом необходимо
в резиновых перчатках и пользоваться при этом инструментами (пинцетами,
корнцангами, ножницами и др.). Прикасаться к исследуемому материалу
непосредственно руками запрещается.
По окончании работы с патологическим и другим
исследуемым материалом, рабочее место обязательно обрабатывают соответствующим
дезинфицирующим раствором. Остатки инфицированного материала (культуры)
термически обеззараживают. Руки дезинфицируют одним из рекомендуемых для этой
цели растворов, потом тщательно моют теплой водой с мылом.
Мероприятия в случае аварии при работе с
культурами микроорганизмов, заразным материалом, кислотами и щелочами.
В подразделениях лаборатории, где проводится
работа с культурами бактерий и вирусов или с жидким заразным материалом,
необходимо иметь и хранить в отдельном месте резервный набор предметов для
ликвидации последствий аварии (дезинфекции места аварии, обработки рук, обуви,
уборки заразного материала: бак, эмалированный тазик, пинцет, гигроскопическую
вату, 5% раствор хлорамина, резиновые перчатки, галоши).
Для нейтрализации кислот и щелочей в случае
аварии следует иметь в резерве 2% раствор двууглекислой соды, 1% раствор
аммиака и 1% раствор лимонной или уксусной кислоты, насыщенный раствор борной
кислоты, а также ватно-марлевые тампоны и марлевый бинт.
Если во время работы разбилась посуда,
содержащая заразный материал (культуру, эмульсию, кровь), или пролился жидкий
заразный материал, работник, у которого это произошло, немедленно должен
обработать 5%-ным раствором хлорамина руки, загрязненные участки тела и место,
залитое культурой (жидким материалом). При этом работник остается на месте,
вызывает лаборанта и со всеми необходимыми предметами для дезинфекции места
аварии и уборки заразного материала. Обеззараживать место аварии обязательно в
резиновых перчатках, галошах.
Жидкую часть заразного материала собирают при
помощи пинцета гигроскопической ватой, которую складывают в эмалированный
тазик; осколки посуды собирают в тот же тазик пинцетом и совочком и вместе с
собранным заразным материалом помещают в водонепроницаемую посуду (бак), а
затем сдают для автоклавирования. Место, где произошла авария, осторожно обжигают.
При случайном попадании кислоты или щелочи на
поверхность кожи рекомендуется немедленно тщательно промыть пораженное место
сначала струей воды из водопроводного крана, затем, если попала кислота - 2%
раствором двууглекислой соды или 1% раствором аммиака, если попала щелочь - 1%
раствором лимонной или уксусной кислоты и наложить на это место сухую повязку.
В случае попадания кислоты или щелочи в глаз
немедленно и тщательно промывают его водой, после этого раствором двууглекислой
соды, если попала кислота, и насыщенным раствором борной кислоты, если попала
щелочь.
Требования по безопасному обращению с
электрооборудованием.
Электроаппаратура в лаборатории устанавливается
и заземляется специалистами-электриками.
В помещении, где установлены приборы, должны
храниться инструкции по их эксплуатации с кратким описанием каждого прибора.
На полу перед каждым электроприбором должен
лежать резиновый коврик.
К электроприборам и установкам, находящимся под
током, необходим свободный подступ.
Запрещается работать с электроприборами и
приближаться к ним в темноте, хранить вблизи них одежду, легковоспламеняющиеся
материалы.
Перед пуском в работу электроаппаратов тщательно
проверяют их исправность.
В случае нарушения или неисправности заземления,
оголенности проводов или появления искр электроустановку необходимо отключить.
При возникновении огня в электроустановке около
проводов или на проводах установка должна быть немедленно выключена из
электросети рубильником.
Гасить огонь в таких случаях рекомендуется сухим
песком или углекислотным огнетушителем, не прикасаясь руками к горящим
проводам.
Гасить огонь водой или жидким огнетушителем
воспрещается.
Электроприборы должны находиться под постоянным
техническим наблюдением специалиста-электрика.
С целью предупреждения электротравм запрещается:
а) работать в сырых помещениях с
электроприборами под напряжением 120-220 В;
б) работать с неисправными приборами;
в) прикасаться к не огражденным щитам,
трансформаторам и батареям центрального отопления.
Уходя из лаборатории, сотрудники обязаны
удостовериться в отключении электроприборов.
Ответственность за выполнение режима,
установленного настоящими правилами, несут заведующие отделами.
Следует отметить, что вопрос охраны труда
является одним из важнейших на современном этапе жизни нашего общества.
Поскольку изучаемое мною управление является государственным, то соответственно
и требования по охране труда выполняются на должном уровне.
Список литературных источников
1 Беляев
А.Л., Слепушкин А.Н. Грипп птиц - глобальная проблема // Журн. РЭТ-инфо, 2004 -
№3 (51). - С. 39-41
2 Беляев
А.Л., Слепушкин А.Н. Грипп птиц - глобальная проблема // Журн. РЭТ-инфо, 2004.
- №3 (51). - С. 39 - 43.
3 Макаров
В.В., Воробьев А.А., Бондаренко В.М., Боев Б.В. Высокопатогенный вирус гриппа
птиц, вызывающий гриппозную пневмонию у человека // Журн. Микробиол., 2005. -
№3. - С. 105-109.
Бакулин
В.А., "Диагностика и эпизоотолого-эпидемиологические тенденции гриппа
птиц". Вопросы вирусологии 82/2. Санкт-Петербург, 2006.
5 Ю.В.
Разумова, М.Ю. Щелканов, С.И. Золомых, А.А. Дурыманова, В.А. Терцовой, А.Б.
Беклемишев, А.А. Славский, А.К. Юрлов, А.М. Шестапалов, Д.К. Львов, С.В.
Нетесов. "Результаты мониторинга вируса гриппа А в популяциях диких птиц
на Юго-Западной Сибири" Воп. вир. 2006/3. Москва.
6 "Молекулярно-генетический
анализ биологических свойств высокопатогенных штаммов вируса гриппа А (Н5N1;
изолированных от диких и домашних птиц в период эпизоотии в Западной Сибири
(июль 2005 г) Вопросы вирусологии 2006 г. Москва.
7 Д.К.
Львов, М.Ю. Щелканов, П.Г. Дерябин, Т.В. Гребенникова, А.Г. Прилипов, Е.А.
Непоклонов, Т.Г. Онищенко, Н.А. Власов, Т.И. Алипер. "Изоляция штаммов
вируса гриппа А/Н5N1 от домашних и диких птиц в период эпизоотии в Западной
Сибири (июль 2005 г.) и их депонирование в государственную коллекцию вирусов (8
августа 2005). Вопросы вирусологии 2006 г. Москва.
8 Львов
Д.К. Новые и вновь возникающие вирусные инфекции // Вопр. вирусол. - 2000. - Т.
45, №4. - С. 4-7.
9 Epidemiologyof
WHO-confirmed humancases of avianinfluenza A(H5N1) infection// 30 JUNE 2006,
81st YEAR No. 26, 2006, 81, 249-260
10 И.Т.
Харитоненков, Г.В. Елизарова, Ю.А. Заканырдин, "Выделение препаративных
количеств нейраминидазы вируса гриппа методом аффинной хроматографии".
Вопросы вирусологии 85/1. Москва.
11 WHO
intercountry consultation. Influenza A/H5N1 in humans in Asia. Manila,
Philippines, 6-7 May 2005
12 Отчеты
МЭБ в электронной форме // Интернет сайт www.oie.net.
13 Lipatov
A. Pathogenesis of avian influenza A (H5N1) viruses in pigs. // Submitted to:
Research Conference on Orthomyxoviruses July 1, 2007.
14 Каверин
Н.В., Смирнов Ю.А. Межвидовая трансмиссия вирусов гриппа А и проблема пандемий
// Вопр. вирусол. - 2003. - Т. 48, №3. - С. 4-10.
Харитоненков
И.Т., Возбудитель гриппа птиц. С. 112-124, 1981 г.
16 В.М.
Жданов, С.Я. Гайдамович "Вирусология" "Медицина" М: 1966
В.М.
Жданов "Вирусология" "Медицина" М: 1967.
А.С.
Гринин, И.Н. Титов, "Очистка, концентрирование и фракционирование вирусов
животных" М "Колос"1971 г.
19 Bradford
M.A rapid and sensitive method fer the qvantitation of microgram qvantitaties
of protein utilizing the principle of protein - due binding // Anal. Biochem.
- 1976. - Vol. 72. №4. - P. 248-254.
А.С.
Гринин, И.Н. Титов, "Очистка, концентрирование и фракционирование вирусов
животных" М "Колос" 1971 г.
Фримель
Х.В. кн.: Иммунологические методы. Ред. Фримель Г. // Москва: Медицина, 1987. -
с. 89-97.
22 Каверин
Н.В., Смирнов Ю.А. Межвидовая трансмиссия вирусов гриппа А и проблема пандемий
// Вопр. вирусол. - 2003. - Т. 48, №3. - С. 4-10.
Соколова
М.В., М.Я. Христова, И.Г. Харитоненков, "Иммуноферментная тест-система на
основе F(ab)2 - фрагментов антител для индикации вируса гриппа". Вопросы
вирусологии 87/4. Москва.
24 Brown
P, Wolff A, Gajdusek DC. A simple and effective method for inactivating virus
infectivity in formalin-fixed tissue samples from patiens with Creutzfeld-Jakob
disease. Neurology, 1990, 40:887-890.
25 Иванова
Г.А. Экспериментальная изменчивость вируса классической чумы птиц. Дисс. докт.
М. 1966 г.
26 Букринская
А.Г. Вирусология // Москва: Медицина, 1987.
Филдс
Б. и др. Вирусология // Москва "Мир", 1989.
28 Beatty
J., Beatty P., Vlahos W. Measurement of monoclonal antibodi affinity by non -
copetitive immunoassay //J. Immunol. Meth. - 1987. -
Vol. 100, №3. - P. 173-179.
Методические
указания по лабораторной диагностике высокопатогенного гриппа птиц. МСХ РК,
2005 г.
Л.С.
Косицкая, Б.Н. Софронов, М.А. Бичурина, Е.А. Брянцева, Н.Р. Розаева.
"Индукция иммунного ответа к антигенам вируса гриппа антиидиотипическими
антителами". ЖЭ и И 1995 №1. Санкт-Петербург.
Л.М.
Михайлов, А.М. Тишенко, М.П. Рудник, О.Д. Захлебная. "Использование
моноклональных антител для выявления общих антигенных детерминант BRUCELLA.SPP.
и YERSINIA ENTEROCOLITICA 0:9". ЖЭ и И 2000/3. Иркутск.
32 В.Н.
Сюрин, А.Я. Самуйленко, Б.В. Соловьев, Н.В. Фомина "Вирусные болезни
животных" М., ВНИТИБП, 1998г С. 324-350.
В.Н.
Сюрин, А.Я. Самуйленко, Б.В. Соловьев, Н.В. Фомина "Вирусные болезни
животных" М., ВНИТИБП, 1998 г С. 324-350.
34 Васильевич М.А., Михайлович Г.В.
"Охрана природы". Москва 1981 г. с. 3-9.
35 Галеева А.М., Курок М.Л. "Об охране
окружающей среды". Москва 1986 г. с. 18-31.
36 Окружающая
среда и человек. Д.П. Никитин, Ю.В. Новиков, 1986.
37 Денисенко
Г.Ф. "Охрана труда". Москва 1985. - С. 5-11.
Зайцев
В.П., Свердлов М.С. "Охрана труда в животноводстве". М. 1989. - С.
31-42.