Планарная сцинтиграфия
НАЦИОНАЛЬНЫЙ
ИССЛЕДОВАТЕЛЬСКИЙ ЯДЕРНЫЙ УНИВЕРСИТЕТ «МИФИ»
КАФЕДРА
«МЕДИЦИНСКАЯ ФИЗИКА»
Курс «ФИЗИКА
визуализации изображений в МЕДИЦИНе»
Реферат
на тему
Планарная
сцинтиграфия
Автор: студент гр. Т07-35
Третьякова В.В.
Проверил: доцент каф. 35, к.ф.-м.н. Штоцкий
Ю.В./
Зав. каф.35 профессор, д.ф.-м.н. Беляев В.Н./
Москва - 2014 г.
ВВЕДЕНИЕ
Ядерная медицина определяется как направление
медицины, связанное с использованием радиоактивных материалов для диагностики и
терапии пациентов и в определенной степени для изучения болезней человека. В
настоящее время ее методы и инструментарий широко используются в различных
областях научной и практической медицины - в онкологии, кардиологии,
гепатологии, урологии, пульмонологии, иммунологии и др. На нужды ядерной
медицины (ЯМ) расходуется более 50 % годового производства радионуклидов во
всем мире. Чтобы лучше уяснить место ядерной медицины в современном мире,
приведем некоторые цифры по США.
Более трети пациентам, направляемым в
медицинские учреждения США, проводятся процедуры с использованием
радиофармпрепаратов. У 28 % таких пациентов полученные результаты
радионуклидных исследований вынуждают менять тактику дальнейшего лечения.
Продажа радиофармацевтических препаратов (РФП) приносит около $500 млрд. дохода
в год во всем мире, 70 % этих продаж совершается в США. По прогнозам Society of
Nuclear Medicine (SNM) в течение последующих 10 лет ожидается прирост числа
проводимых радионуклидных процедур на 7-16 % ежегодно. Сегодня в США
сертифицировано 4000 врачей-специалистов по ядерной медицине, и 14000
технических специалистов, которые планируют и непосредственно проводят
инструментальное обследование и лечение больных с помощью методов ядерной
медицины.
Несмотря на богатейший потенциал в плане
производства различных радионуклидов (р/н) и РФП, развитие ядерной медицины в
России сильно отстало в последние десятилетия от мирового уровня. Однако
недавние решения Президента и Правительства РФ свидетельствуют, что плачевное
положение с ядерной медициной в нашей стране может в недалеком будущем
существенно измениться.
В разных регионах России планируется
строительство нескольких крупных, хорошо оснащенных центров ядерной медицины и
лучевой терапии (центр в г. Димитровграде уже строится) и более 100 центров
позитронно- эмиссионной томографии (ПЭТ).
Необходимым условием успешного функционирования
этих центров является наличие высококвалифицированных кадров как медицинского,
так и физического профиля. Перед Высшей школы России встает ответственная
задача быстрого увеличения количества специалистов разного профиля, всесторонне
подготовленных для работы в области ядерной медицины в соответствии с
современными стандартами образования. Возможность решения этой важнейшей задачи
в существенной степени зависит от наличия качественной учебной литературы,
отвечающей современному уровню развития ядерной медицины. К сожалению, в
настоящее время таких учебников по ядерной медицине в России практически нет.
. ИСТОРИЯ
Ядерная медицина является относительно молодым
многодисциплинарным направлением современной науки и практической деятельности
человека. Развитие ядерной медицины (ЯМ) все время осуществлялось совместными
усилиями физиков, особенно ядерных физиков, химиков, математиков, специалистов
по информационным технологиям и, конечно, медиков. Ее принципиальная
особенность заключается в широком использовании радиоактивных материалов в виде
радиофармпрепаратов (РФП) для диагностики и терапии болезней пациентов, а также
для исследования самих заболеваний человека. Отличительной чертой методов
диагностической ядерной медицины является их функциональность. Не обладая столь
высоким пространственным разрешением, как изображения, получаемые с помощью
рентгеновской компьютерной или магнитно-резонансной томографии, сцинтиграммы
способны отражать физиологические и патофизиологические изменения, происходящие
в организме. Это дает возможность выявлять отклонения от нормы на самых ранних
стадиях и точно локализовать патологию.
В РФП терапевтического назначения радионуклид
является основным лечебным началом, позволяющим локализовать лечебную дозу
излучения непосредственно в органе-мишени или, иногда, в пораженных клетках и,
соответственно, обеспечить минимальное облучение окружающих здоровых клеток
органов и тканей.
Дату рождения ЯМ условно по предложению
известного ученого C. Edwards можно поместить где-то между изобретением
циклотрона в 1930 г. (O. Lawrence) и открытием искусственной радиоактивности в
1934 г. (F. Joliot and I. Curie). Уже в 1937 г. J. Lawrence впервые применил
циклотрон для получения 32P, который он успешно использовал для лечения
пациента, больного лейкемией. Хотя дату рождения ЯМ можно совместить и с
другими более ранними знаменитыми открытиями в физике, химии и медицине,
например, созданием атомной теории материи (J. Dalton, 1808 г.) или открытием
рентгеновских лучей (W. Rontgen, 1895 г.) и эффекта их воздействия на
биологические ткани и др.
Следующий мощный толчок развитию ЯМ дал процесс
мирного использования атомной энергии, начавшийся в конце 40-х и начале 50-х
годов прошлого века в США, СССР, Великобритании и Франции. Важной вехой на этом
этапе можно считать директиву президента США Трумена (1946 г.) о производстве
на реакторе Окфордской национальной лаборатории 131I с целью его использования
квалифицированными медиками в лечебном процессе. Несколько позднее подобные
решения были приняты и в СССР. Уже в декабре 1946 г. была опубликована
знаменитая работа Seidlin в Журнале Американской Медицинской Ассоциации, в
которой автор описывал полное исчезновение метастазов в щитовидной железе в
результате лечения радиоактивным йодом. Хотя первоначальное применение 131I
произошло в терапии, очень скоро 131I стал использоваться и в диагностических
целях. Для автоматизации и убыстрения процедуры радиоизотопной диагностики
состояния щитовидной железы были созданы в 1950 г. первые подвижные
сцинтилляционные сканеры. В течение нескольких лет после этого события в
научных лабораториях и клиниках наблюдалась высокая активность по изучению
возможности применения радиоизотопного сканирования для решения других
клинических проблем, кроме болезней щитовидной железы.
Несмотря на успешное использование подвижных
сцинтилляционных сканеров, молодой физик H.O. Anger, работавший в
Калифорнийском университете, пришел к убеждению, что наилучшим подходом к
визуализации является разработка неподвижного детекторного устройства. В
результате своих исследований он создал свою стационарную сцинтилляционную
камеру, которую описал в 1957 г. в работе. Эта камера имела неподвижный
кристалл NaI(Tl) диаметром 10 см и толщиной 6,2 мм. Используя один пинхольный
коллиматор, H.O. Anger успешно визуализировал щитовидную железу. Так родилась
знаменитая гамма-камера Ангера, сыгравшая выдающуюся роль в прогрессе ЯМ.
Выдающимся достижением этого периода является
также открытие для медицины короткоживущего низкоэнергетического радионуклида
99mTc и разработка на его основе первых представителей этого семейства РФП,
которые очень скоро стали самыми назначаемыми РФП в ЯМ. Сам радионуклид был
открыт в 1937 г. C. Perrier и E. Segre, но, так как он является радиоактивным и
в природе не существует, то его можно получить только искусственным путем.
Отсюда и название этого изотопа, которое дали ему первооткрыватели, означающее
в переводе с греческого "искусственный" (не существующий в природе).
Доступным для использования в медицине этот радионуклид стал после того, как
группа ученых под руководством P. Richards создала в 1960 г. 99Mo/99mTc
генераторную систему. После нескольких лет интенсивных клинических исследований
свойств 99mTc, обобщенных в работе, генератор 99Mo/99mTc поступил в 1965 г. на
рынок.
Первые попытки использовать радиоактивные
индикаторы для исследования в области кардиологии относятся к 1927 г., когда H.
Blumgart изобрел метод введения радона в кровеносную систему для измерения скорости
крови. Однако широкое применение радионуклидной диагностики началось
значительно позднее (в 1975 г.), после работ E. Leibowitz с коллегами, которые
продемонстрировали визуализацию системы кровоснабжения, используя РФП, меченный
радионуклидом 201Tl.
Параллельно с развитием методов и
инструментальной базы ЯМ происходило и организационное оформление специалистов
в области ЯМ. Наиболее активные участники нарождающейся атомной медицины
организовали в начале 1954 г. Общество Ядерной Медицины США. В 1972 г.
специальность "ядерная медицина" получила в США официальный статус.
Радиоизотопные методы диагностики и терапии несколько позднее начали
развиваться и в СССР, однако организационное оформление в виде общества
произошло только в 1996 г.
Первым президентом Общества ядерной медицины
России стал д. м. н., профессор, заведующий отделом радиофармацевтических
препаратов ФМБЦ им. А.И. Бурназяна В.Н. Корсунский.
2. Планарная
сцинтиграфия
Планарная сцинтиграмма, общий принцип получения
которой показан на рис. 1, наиболее широко используемая в клинической
диагностике разновидность радиоизотопных изображений. С расширением сферы
применения компьютеров, работающих в реальном масштабе времени, диагностическая
сцинтиграфия начинает приобретать все более возрастающее значение, особенно при
оценке функционального состояния сердца, легких и почек.
Для получения простейших аналоговых
радиоизотопных изображений необходимы следующие компоненты: современная
гамма-камера с большим полем зрения, укрепленная на штативно-повоторном
устройстве с электромеханическим приводом; набор коллиматоров, необходимый для
проведения различных клинических исследований, и высококачественная система
получения и хранения аналоговых изображений. Это оборудование в сочетании с
широко распространенными РФП позволит получать аналоговое радиоизотопное
изображение, которое в ядерной медицине эквивалентно рентгенограмме.
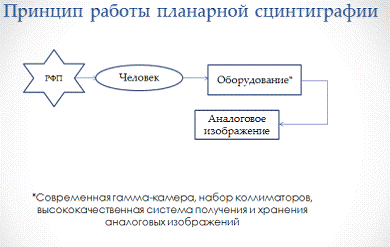
Рис. 1. Общий принцип работы планарной
сцинтиграфии
Получение высококачественных аналоговых изображений
было до недавнего времени основным назначением сцинтиграфической системы.
Конструкции выпускаемых промышленносью
устройств, показанные на рис.2 демонстрируют технические решения, позволяющие
легко изменять положение детектора при настройке и обеспечивающие неизменность
его положения во время исследования.


Рис. 2. Виды электромеханических штативных
устройств, используемых в гамма-камерах: а - гамма-камера модели Siemens
Pho/Gamma IV c устройством для смены коллиматора; б - общий вид установки для
получения изображения всего тела фирмы Nuclear Enterprises; в - гамма-камера
модели GE 400AT с уравновешенным штативом для поворота детекторной головки при
томографических исследованиях на 360о
С помощью планарной сцинтиграфии можно,
например, получить изображение желудочка или почек (рис. 3-6).

Рис. 3. а - суммарное изображение, полученное
методом первого прохождения и показывающее вклад верхней полой вены, правого и
левого желудочков, а также область интереса, для которой построена кривая
временной активности желудочков (б)

Рис. 4. а - маркеры на кадре используются для
определения вклада левого желудочка в ходе исследований, иллюстрированных на
рис. 3; б - кривая зависимости объема левого желудочка от времени этого
исследования

Рис. 5. Суммарные перфузионные изображения и
область интереса, включающую в себя почку, подвздошную артерию и участок фона
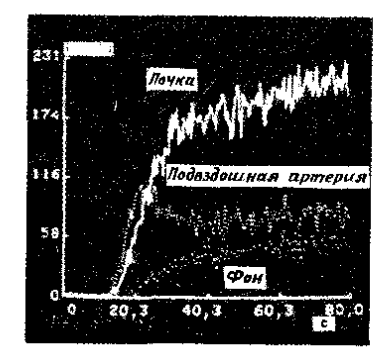
Рис. 6. Кривые зависимости активности от времени
для
областей интереса, показанных на рис. 5
2.1 Характеристики
компонентов
.1.1 Предыстория
Первые радиоизотопные изображения были получены
с использованием сцинтилляционного детектора, соединенного со свинцовым
фокусирующим коллиматором. Благодаря коллиматору сцинтиллятор эффективно
регистрировал лишь те рентгеновские или γ-кванты,
которые были излучены малым участком ткани вблизи фокуса коллиматора. При
двухкоординатном сканировании этим детектором исследуемого участка тела в
поперечном направлении можно было построить распределение РФП. В 1950-х гг.
были разработаны двухкоординатные сканеры с одним или двумя детекторами на
кристаллах NaI(Tl)
большого объема, а также с тяжелыми свинцовыми фокусирующими коллиматорами,
которые позволяли получать изображение распределения таких изотопов, как 18F,
51Cr, 131I,
198Au и 59Fe.
Несмотря на значительную чувствительность при детектировании γ-квантов
высоких энергий, в таких устройствах недостаточно эффективно используется
введенный пациенту РФП, поскольку в них слишком мало времени тратится на
визуализации определенных участков тела.
До разработки кристаллов с большой площадью
поверхности предпринимался ряд попыток создания стационарных систем
визуализации с большим полем зрения, в которых использовалось множество
отдельных детекторов в виде фиксированной матрицы.
Однако разработка монокристаллов NaI(Tl)
с большой площадью поверхности привела к изобретению гамма-камеры и
радикальному изменению в радиоизотопной визуализации. Для определения
направления прихода регистрируемых γ-квантов
используется одинарный свинцовый коллиматор, по площади соответствующий
размерам кристалла и содержащий множество параллельных отверстий,
перпендикулярных поверхности коллиматора. Различные комбинации кристаллов и
коллиматоров диаметром до 50 см позволяют осуществить визуализацию внутренних
органов больших размеров . При этом возможно также получение динамической
информации о кратковременных изменениях в распределении РФП.
Пространственное разрешение, достигаемое в
гамма-камерах, составляет 1-2 см на полной глубине и улучшается по мере
приближения к коллиматору, что позволяет получать изотопные изображения с
высоким разрешением.
В настоящее время известно около 1850 нуклидов,
280 из которых стабильны. В земной коре, в океанских и морских водах находится
ряд естественных долгоживущих р/н, образующих цепочки последовательного
радиоактивного распада. Этот ряд включает 235U, 238U, 232Th. Кроме того, на
Земле имеется 16 других долгоживущих естественных р/н, включая 40K, 50V, 87Rb,
113Cd и 115In. Дополнительно некоторое количество короткоживущих р/н образуется
из естественных источников и космическими лучами.
Большинство р/н создается искусственно путем
превращения стабильных нуклидов в нестабильные нуклиды с помощью
бомбардирования их нейтронами, протонами, дейтронами, α-частицами,
γ-излучением
и другими ядерными частицами. Источником этих частиц могут быть р/н, ядерные
реакторы или различного типа ускорители. Большое разнообразие искусственно
созданных р/н способствовало прогрессу во многих приложениях физики, биологии,
и конечно, медицине.
.1.2 ПЧД
Позиционно-чувствительными называют детекторы,
которые позволяют определить координату места попадания в них заряженных частиц
или квантов рентгеновского или излучения, а во многих случаях - одновременно и
энергию, переданную частицей или квантом чувствительному объему детектора.
В известных в настоящее время ПЧД для
декодирования позиционной информации используют следующие параметры самих
коллекторных элементов или генерируемых ими сигналов:
а) номера коллекторных элементов, в цепи которых
при детектировании частицы были зарегистрированы импульсы тока с интегральным
зарядом, превышающим некоторое пороговое значение (дискретное декодирование);
б) заряды, переносимые импульсами тока в
нескольких выходных цепях одного коллектора (аналоговое декодирование на основе
измерения отношения зарядов);
в) распределение зарядов между несколькими
коллекторными элементами коллекторной системы (аналоговое декодирование на
основе определения центра тяжести зарядового распределения);
г) задержки появления сигналов в различных
выходных цепях одного коллектора (аналоговое декодирование на основе временных
измерений);
д) задержки появления сигналов в выходных цепях
различных коллекторных элементов, обусловленные введением в коллекторную
систему специальной линии задержки (аналоговое декодирование с помощью линий
задержки);
е) задержки появления сигналов относительно
момента ионизации в выходной цепи одного или нескольких коллекторных элементов,
обусловленные конечной скоростью перемещения (дрейфа) первичного заряда от
точки образования до соответствующего коллекторного элемента (аналоговое
декодирование на основе измерения скорости дрейфа).
2.1.3 Производство
радионуклидов на ядерных реакторах
Наиболее мощным и экономически выгодным
источником нейтронов для наработки р/н является ядерный реактор. Ядерные
реакторы производят нейтроны за счет реакции деления 235U, 239Pu или 233U.
Нейтроны, образующиеся при делении, имеют непрерывный энергетический спектр в
интервале от 0,1 до 20 МэВ с наиболее вероятной энергией, равной 1 МэВ, и
средней энергией, равной 2 МэВ. За счет процессов взаимодействия и замедления
спектр нейтронов модифицируется и расширяется в область малых энергий (вплоть
до тепловых энергий). Конкретный вид спектра зависит от типа реактора и
конструкции активной зоны. Мощные энергетические реакторы мало приспособлены
для производства р/н, поэтому для этих целей используются, как правило,
исследовательские реакторы теплового типа. Типичный энергетический спектр
такого реактора показан на рис. 7.

Рис. 7. Типичный энергетический спектр нейтронов
реактора на тепловых нейтронах
Нейтроны обычно группируются в три категории:
тепловые нейтроны (En < 0,4 эВ), эпитепловые нейтроны (0,4 эВ < En <
100 кэВ) и быстрые нейтроны (En >100 кэВ). Энергетический спектр тепловых
нейтронов аппроксимируется распределением Максвелла с максимумом около энергии
0,025 эВ. Эти нейтроны наиболее эффективны (имеют максимальные сечения
взаимодействия) для получения р/н. Используемая плотность потока таких
нейтронов зависит от мощности реактора и расположения мишени и находится в
диапазоне от 5•106 до 5•1015 нейтрон/(см2•с).
Большинство исследовательских реакторов на
тепловых нейтронах имеют активную зону, погруженную в бассейн с водой или
тяжелой водой, которая одновременно выполняет функции замедления нейтронов,
охлаждения реактора и защиты от излучений. Мишени для облучения обычно
размещают в специальных каналах, проходящих через активную зону реактора.
Приводится список р/н (см. табл.1), важных для
ЯМ, которые производятся на ядерных реакторах. Для этого применяются три типа
ядерных реакций:
реакция захвата нейтрона (n,γ);
реакция захвата нейтрона с последующим
радиоактивным распадом;
Наиболее широко используется реакция (n,γ)
с тепловыми нейтронами в силу простоты реализации и высокого выхода продукта.
Во многих случаях мишени изготавливаются из такого же элемента (иногда
природного материала), поэтому не требуется последующее химическое разделение
мишени и продукта. Этот же момент является недостатком данной технологии, так
как при невозможности химического отделения радиоактивного продукта стабильные
атомы разбавляют радиоактивные. Такое разбавление приводит к уменьшению
специфической (удельной) активности конечного продукта. Другой недостаток
заключается в возможности образования радиоактивных примесей вследствие реакции
(n,γ)
на других изотопах элемента мишени или химических примесей в мишени. Применение
изотопного обогащения мишени помогает минимизировать наличие радиоактивных
примесей в продукте, однако существенно увеличивает его стоимость. Тем не
менее, такое обогащение применяется достаточно часто.
В некоторых случаях возможно повышение удельной
активности р/н, получаемых по (n,γ)
реакции, используя процесс Сциларда - Чалмерса. Данный процесс основывается на
том, что после поглощения нейтрона испускается γ-квант,
который может вызвать отдачу ядра и последующее нарушение молекулярной связи.
Это возбуждение в некоторых случаях переводит "горячий" атом в другое
химическое состояние, отличное от атомов, не вступавших в реакцию. Таким
образом, становится возможным химическое разделение.
Другая ситуация возникает в результате (n,γ)
реакции, когда представляет интерес распад промежуточного р/н в требуемый
продукт. Такой процесс используется при получении р/н 125I с помощью реакции
124Xe(n,γ)135Xe
→ 125I. Так как конечный продукт в этом случае может быть химически
отделен от мишени, то становится достижимой удельная активность,
соответствующая теоретическому значению для чистого р/н.
Таблица 1. Перечень наиболее
важных для ЯМ радионуклидов, производимых на ядерных реакторах
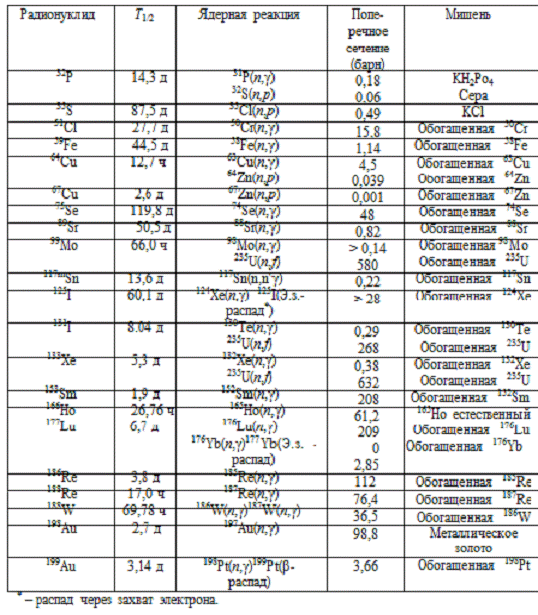
Очевидно, что необходимо применять химически
чистые мишени и реагенты, чтобы избежать попадания в продукт стабильных
нуклидов. В примере с 125I это означает, что как мишень, так и реагенты не
должны содержать стабильный йод. Желательно также использовать обогащенные
мишени, чтобы минимизировать попадание в продукт долгоживущих р/н или
стабильных нуклидов. Для примера, если 126Xe (относительное содержание 0,09 % в
природном ксеноне) облучается вместе с 124Хе, то образуется 127Xe, который
затем распадается в стабильный 127I. В этом случае, однако, так как мишень и
продукт химически разделяются, то имеется возможность восстановления
обогащенного мишенного материала для повторного использования.
В результате деления 235U образуются продукты
деления с атомными номерами от 30 до 66, разделить которые и выделить
интересующий р/н можно с помощью химических процедур. Наиболее важными
медицинскими р/н, получаемые с использованием реакции деления, являются 131I,
133Xe и 99Mo.
Ряд полезных р/н получают, применяя реакцию
(n,p), идущую при облучении мишеней быстрыми нейтронами (например, 35S, 64Cu),
или цепочку "непрямых" реакций. Например, при облучении нейтронами
6Li образуется 3H с достаточно высокой энергией, чтобы вызвать реакцию с
соседним ядром 16O (в соединении Li2CO3), в результате которой образуется F.
Перечень наиболее важных для ЯМ радионуклидов, производимых на ядерных
реакторах, представлен в Табл. 1.
циклотрон многокристальный ядерный камера
3. Производство
радионуклидов на ускорителях
3.1 Циклотрон
Из всех типов ускорителей циклотроны наиболее
широко используются для производства р/н. Достоинством циклотрона является
отсутствие инжектора, в котором происходит предварительное ускорение протонов,
достаточно простая конструкция и высокая интенсивность пучка. Вывод пучка из
циклотрона происходит при достижении заряженными частицами максимальной
энергии, поэтому производители выпускают циклотроны, рассчитанные на генерацию
пучков строго определенной энергии. Однако диапазон возможных энергий
достаточно широк и простирается от 3 МэВ для малых циклотронов до 700 МэВ для
больших синхроциклотронов, предназначенных для физических исследований.
Принцип действия циклотрона иллюстрируется на
рис. 8. Ионы, производимые дуговым источником, инжектируются в центр вакуумного
промежутка между двумя полукруглыми полыми металлическим камерами, называемыми
дуантами. На электроды дуантов подается разность потенциалов, вызывающая
ускорение ионов в промежутке между дуантами. Большой магнит создает почти
однородное магнитное поле, направленное перпендикулярно к плоскости дуантов.
Это поле вызывает закручивание траекторий ионов. Электрический потенциал
подается на дуанты от высоко-частотного осциллятора, который реверсирует
полярность поля на дуантах перед тем, как заряженная частица достигает
ускоряющего промежутка. Это вызывает новое ускорение частицы по направлению к
другому дуанту. Приращение кинетической энергии при однократном прохождении промежутка
равняется произведению заряда частицы на разность потенциалов и обычно
находится в диапазоне от 30 до 60 кэВ.
Диаметр полюсов магнита циклотронов,
предназначенных для наработки р/н, как правило, изменяется от 75 до 150 см в
зависимости от энергии выходящего пучка.
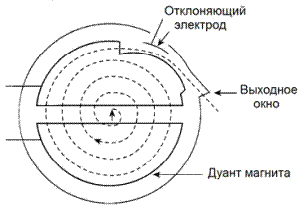
Рис. 8. Схема работы циклотрона
Таблица 2. Перечень наиболее важных для ЯМ
радионуклидов, производимых на циклотронах
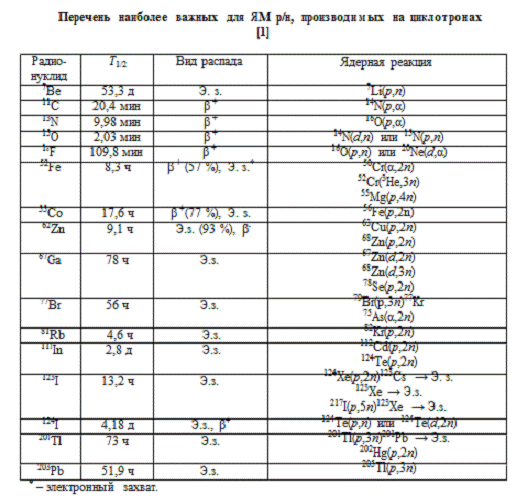
Разнообразие ускоряемых частиц (p, d, 3He, α)
и широкий энергетический диапазон делают циклотрон гибкой системой, позволяющей
производить широкий набор р/н. Приводится далеко не полный список р/н,
получаемых в настоящее время на циклотронах. Причем, для многих р/н существует
несколько реакций, дающих одинаковый продукт. Например, 16, 8, 4 и 9 реакций
можно использовать для позитронных излучателей 11C, 13N, 15O и 16F. Перечень
наиболее важных для ЯМ радионуклидов, производимых на циклотронах представлен в
таблице 2.
3.2 Линейный ускоритель
Принцип работы линейного ускорителя основан на
повторяющемся небольшом ускорении ионов высокочастотным полем при прохождении
ионами зазоров между последовательными волноводами. Внутри трубы электрическое
поле отсутствует, поэтому частицы движутся с постоянной скоростью к следующему
зазору. При фиксированной частоте ускоряющего поля частицы должны достигать
следующего зазора синхронно с ускоряющей волной. Достоинством линейных ускорителей
являются стабильность, высокое качество и большой ток пучков, возможность
ускорения различных ионов до больших энергий. Недостатком циклотрона является
ограничение существенно нерелятивистскими энергиями частиц, так как даже не
очень большие релятивистские поправки (отклонения γ
от единицы) нарушают синхронность ускорения на разных витках и частицы с
существенно возросшими энергиями уже не успевают оказаться в зазоре между
дуантами в нужной для ускорения фазе электрического поля. В обычных циклотронах
протоны можно ускорять до 20-25 МэВ. Вместе с тем линейные ускорители ионов
потребляют большую электрическую мощность, а их линейные размеры значительно
(почти линейно) возрастают с увеличением энергии генерируемого пучка ионов. Это
препятствует их применению непосредственно в клиниках, и они используются
главным образом в физике высоких энергий.
В настоящее время только три линейных ускорителя
в мире (один из них в Дубне) производят заметное количество р/н, в основном
тех, реакции получения которых идут при высоких энергиях бомбардируемых частиц.
Перечень р/н, нарабатываемых данными ускорителями, представлен в табл. 3,
наиболее важными из них являются 82Sr и 68Ge.
4. Генераторы
Более столетия назад Резерфорд наблюдал, как
один р/н может быть получен из другого р/н в результате распада последнего. Он
отметил, что препараты тория испускают, кроме α-частиц,
и некое неизвестное ранее вещество, так что воздух вокруг препаратов тория
постепенно становится радиоактивным. Это вещество он предложил назвать эмана́цией
(от латинского emanatio - истечение) тория и дать ему символ Em. Последующие
наблюдения показали, что и препараты радия также испускают некую эманацию,
которая обладает радиоактивными свойствами и ведет себя как инертный газ.
Первоначально эманацию тория называли торо́ном,
а эманацию радия радо́ном. Первый
вид генератора был создан еще в начале двадцатого столетия, когда было
обнаружено, что применение радона помогает в лечении онкологических
заболеваний. Такими генераторами стали системы 226Ra/222Rn, которые были
разработаны для производства радоновых капсул. Разделение 222Rn и 226Ra
проводилось по относительно простой технологии: радий находился в растворе, а
радон, образующийся при распаде радия, являясь газом, выходил из раствора и
собирался в специальных емкостях.
Развитие ЯМ тесно связано с разработкой и
производством препаратов, меченных р/н. В настоящее время для медицинских целей
предложено несколько сотен различных р/н, причем значительная часть из них
является короткоживущими р/н. Очевидным преимуществом р/н с коротким периодом
полураспада является значительное уменьшение дозы, получаемой пациентом, по
сравнению с долгоживущими р/н. Однако обеспечение медицинских учреждений
короткоживущими р/н столкнулось с проблемой значительного времени, требуемого
для транспортировки этих р/н от места производства до клиник. Для решения
проблемы учеными был предложен ряд генераторных систем.
Таблица 3. Перечень наиболее важных для ЯМ
радионуклидов, производимых на линейных ускорителях

Кратко формулируя, генератор представляет
устройство, в котором материнский р/н распадается в дочерний р/н, причем
последний отделяется от материнского. Полезные генераторные системы используют
более продолжительный период полураспада материнского продукта по сравнению с
дочерним, что позволяет повторять экстракцию.
Обычно метод разделения основывается на том, что
дочерний и материнский радионуклиды являются различными химическими элементами.
Разделение осуществляют с помощью методов хроматографии, экстракции или
сублимации. Большинство коммерческих генераторов радионуклидов
хроматографического типа и представляют собой стеклянную, металлическую или
пластиковую колонку, помещенную в защитный кожух (рис9). Колонка заполнена
сорбентом, содержащим материнский радионуклид. При этом сорбент не должен
связывать дочерний радионуклид, который вымывают (элюируют) из генератора,
прокачивая специальный раствор (элюент) через колонку с помощью шприца,
вакуумированных насосов или перистальтического насоса.
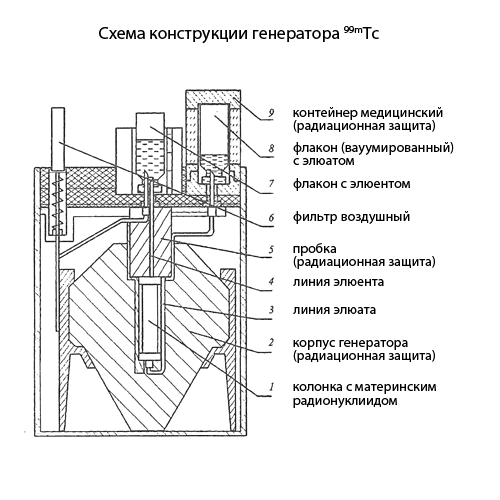
Рис. 9 Схема конструкции генератора 99mTc
Методы отделения дочернего продукта от
материнского могут основываться на различном физических состояниях (например,
жидкость и газ), но чаще используются технологии, базирующиеся на различных
химических свойствах: испарении, основанном на различной летучести двух
элементов; экстрации из раствора, основанной на различной растворимости;
хромотографическом разделении, основанном на различном сродстве с
ионно-обменными смолами или полимерами.
Чтобы быть клинически полезной, генераторная
система должна обладать рядом важных свойств. К таким свойствам относятся:
простота эксплуатации; надежная защита от излучения; получение продукта в
форме, позволяющей немедленное использование; доступная для медицинских
учреждений стоимость. Выбор р/н для производства с помощью генераторов также
обусловлен наличием у них ряда полезных свойств.
Кроме того, для минимизации облучения пациента
желательно, чтобы дочерний продукт распадался в стабильный или долгоживущий
р/н.
5. Системы визуализации
.1 Двухкоординатные
сканеры
Первая из радиоизотопных систем визуализации
была основана на двухкоординатоном сканировании с помощью электромеханического
привода с одной или двумя детекторными головками (рис. 10)

Рис. 10. Схематическое представление
двухкоординатного радиоизотопного сканера
Эти автоматически сканирующие устройства
обеспечивают точное поперечное и продольное позиционирования кристалла
сцинтиллятора, который снабжен свинцовым фокусирующим коллиматором для
исследования небольшой области поверхности тела. Поперечный разрез
фокусирующего коллиматора показан на рис. 11. В качестве сцинтиллятора обычно
используется кристалл NaI(Tl).
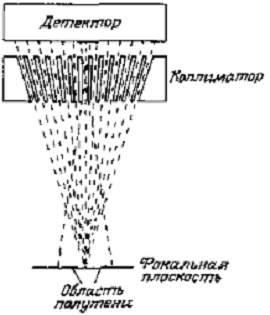
Рис. 11 Поперечный разрез фокусирующего
коллиматора большого объема (диаметр и толщина кристалла равны 12,5 см).
Коллиматор представляет собой свинцовый
усеченный конус очень больших размеров с множеством отверстий, диаметр каждого
из которых уменьшается в направлении к фокальной точке. Такая конструкция
позволяет получить максимальную чувствительность при данном пространственном
разрешении в фокальной плоскости. Благодаря применению кристаллов большого
размера и коллиматоров большой толщины двухкоординатные сканеры позволяют
эффективно регистрировать как высокоэнергетичные, так и низкоэнергетичные γ-кванты,
испускаемые такими, наиболее подходящими для работы с гамма-камерой, изотопами,
как 99mTc (140 КэВ).
Построение изотопного изображения осуществляется
с помощью механически связанного со сканером регистрирующего устройства,
например, печатающего отметчика с многоцветной лентой или фотографической
системы. В любом случае частота вывода отметок пропорциональна мгновенной
скорости счета.
Выбор параметров и режимов сканирования требует
большого внимания. Один или несколько одноканальных анализаторов должны быть
тщательно настроены на соответствующий фотопик, чтобы свести к минимуму влияние
рассеянных гамма-кантов на качество изображения.
Очень важными параметрами являются также
скорость счета сканирования и его шаг, поскольку этими параметрами определяется
информационная плотность регистрируемого изображения, которая может быть
подсчитана по формуле 1
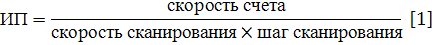

Рис. 12 Изображение, полученное с помощью
двухкоординатного радиоизотопного сканера и цитрата Ga
и показывающее раковую опухоль левой доли легкого
Двухкоординатный сканер, благодаря его
уникальным возможностям применяется, главным образом, при визуализации с
помощью высокоэнергетических изотопов, изучения небольших по размеру органов,
например, легких (см. рис. 12)
5.2 Гамма-камера
Сцинтилляционная камера (или гамма-камера) была
создана Ангером в 1958 году как позиционно-чувствительный детектор. В середине
60-х годов прошлого века она стала одним из основных клинических инструментов
для радионуклидной диагностики.
В гамма-камере Ангера используется стационарный
позиционно-чувствительный детектор в виде кристалла йодистого натрия большого
диаметра, перекрывающего ширину пациента. Главное преимущество гамма-камеры по
сравнению со сканером заключается в быстродействии, обусловленным получением
информации о распределении РФП одновременно по всему обозреваемому полю.
Позднее конструкция гамма-камеры неоднократно усовершенствовалась, стала
применяться цифровая обработка сигналов. Однако принципиальные особенности
конструкции Ангера сохранились и в современных камерах. В последнее время в
гамма-камерах в качестве позиционно-чувствительных детекторов начинают
применять матрицы из полупроводниковых детекторов, сочлененных с фотодиодами.
Многие эксперты считают такие камеры наиболее перспективными.

Рис. 13. Поперечный разрез блока детектирования
гамма-камеры Ангера: 1 - исследуемый объект; 2 - коллиматор; 3 - сцинтиллятор;
4 - выходное окно сцинтиллятора; 5 - световод; 6 - фотоэлектронные умножители;
7 - цепи передачи импульсов; 8 - светозащитный кожух
5.2.1 Принцип работы
гамма-камеры Ангера
В сцинтилляционной камере Ангера, схематическая
электронная диаграмма которой представлена на рис. 15, используется тонкий (~
6-10 мм) кристалл NaI(Tl) круглой формы диаметром 250-400 мм или прямоугольной
формы с линейными размерами примерно 400×500
мм. Кристалл находится в оптическом контакте со световодом и системой ФЭУ.

Рис. 14. Многоканальный фокусирующий коллиматор
сканера с коническими сходящимися каналами
Типовая гамма-камера, поперечный срез которой
представлен на рис. 13, обычно включает следующие компоненты: детектор,
коллиматор, система (сборка) фотоумножителей, предусилитель, усилитель, цепь
X-, Y- позиционирования, электронно-лучевая трубка или другое устройство для
визуализации и регистрации, например, жидкокристаллический дисплей.
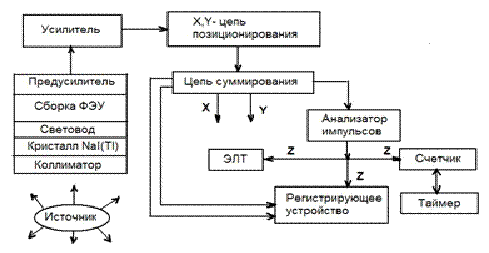
Рис. 15. Схематическая электронная диаграмма
гамма-камеры
Типовая геометрия измерения распределения РФП в
пациенте показана на рис. 16. Выходные импульсы от каждого ФЭУ взвешиваются
матрицей резистеров (или фиксированной емкостью в ранних конструкциях) в
соответствии с его позицией сборке. Далее для определения X и Y координаты
взаимодействия фотона в кристалле рассчитывается нормализованная сумма всех
позиционно-взвешенных сигналов.
Расчет проводится по формулам 2-4:
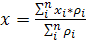 ,
,
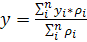 ,
,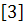
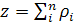 ,
,
где pi
- выходной сигнал i-го
фотоумножителя с координатами xi,yi.
Схема определения взвешивающего фактора для
камеры Ангера с семью ФЭУ и принцип определения X и Y позиционных импульсов,
возникающих при взаимодействии γ-квантов
в кристалле, иллюстрируется на рис.19. Все выходы ФЭУ связываются через емкости
с четырьмя выходными проводниками, создавая четыре зависящих от направления
сигнала: X+,X-, Y+,Y-. Величина емкости прямо пропорциональна локализации
конкретного ФЭУ относительно узлов формирования этих четырех сигналов.
Предположим, что γ-квант
провзаимодействовал в позиции (*) около ФЭУ 6. Наибольшее количество света в
этом случае получит фотокатод ФЭУ 6, количество же света упавших на фотокатоды
других ФЭУ будет обратно пропорционально их расстоянию до точки взаимодействия.
Из четырех зависящих от направления сигналов X- будет больше, чем X+ и Y+ будет
больше, чем Y-,так как взаимодействие произошло в левом квадранте. Привязку
сигнала к X-,Y-координатам можно провести по формулам 5-7
Рис. 16. Типовая геометрия измерения
распределения РФП в пациенте

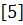
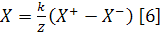

где: k
- константа;
k/Z
- коэффициент усиления.
Схема показывает также процесс отображения на
экране ЭЛТ (или ином дисплее) точек взаимодействия фотонов в кристалле.
Позиционные X и Y
сигналы поступают на вертикальную и горизонтальную отклоняющие пластины ЭЛТ.
Одновременно Z сигнал
анализируется амплитудным анализатором, и если его амплитуда находится в
пределах заданного окна, то электронный пучок ЭЛТ отпирается. В результате
пучок ударяет в точку, определяемую координатами X и Y. Сигналы открытия входа
регистрируются счетчиком для подсчета полного количества импульсов в
изображении.
Большинство современных камер имеет несколько
окон в амплитудном анализаторе и возможность получать отображение распределения
на дисплее для каждого окна. Это позволяет анализировать распределения
нескольких р/н. В современных гамма-камерах применяется, кроме того,
оцифровывание сигналов, компьютерная обработка изображений и другие
усовершенствования.
Рис. 17. Электронная схема получения
взвешивающего фактора для гамма-камеры с семью ФЭУ. Локализация точки
взаимодействия γ-кванта
достигается суммированием взвешенных выходных сигналов от ФЭУ по четырем
направлениям. Позиционные сигналы, представляющие X- и Y-координаты точки
взаимодействия, подаются на отклоняющие пластины электронно-лучевой трубки
(ЭЛТ). Z-сигнал производит открытие входа, если амплитуда импульса находится в
заданном окне
5.2.2 Многокристальные
и полупроводниковые гамма-камеры
В предыдущих разделах обсуждались особенности и
технические характеристики традиционной гамма-камеры с тонким кристаллом
NaI(Tl), свет от которого регистрировался сборкой ФЭУ.
В этом разделе рассмотрим другие конструкции
камер, некоторые из которых потенциально являются достаточно перспективными.
Рис. 18. Схематическое изображение
позиционно-чувствительного ФЭУ
Многокристальная гамма-камера состоит из матрицы
индивидуальных γ-детекторов,
кристаллов или твердотельных детекторов толщиной от 2 до 10 мм, упакованных в
единую конструкцию, образующую поле видимости гамма-камеры. Задача позиционной
электроники здесь заключается в простом определении - какой из детекторов
активирован? Дополнительным преимуществом такого устройства является
возможность работы при высокой скорости счета. Недостаток многокристальной
камеры состоит в относительно слабом внутреннем разрешении (> 1 см). В
настоящее время коммерческих предложений по ней нет.
Главной особенностью следующей разработки,
предложенной в середине 80-х годов прошлого века, является применение
позиционно-чувствительных ФЭУ (ПЧФЭУ) (рис. 18).
Такие ФЭУ имеют значительно большую площадь
фотокатода (6 × 6 см). Внутри
ПЧФЭУ расположена двумерная сетка динодов, пространственно организованных так,
что они идут от фотокатода к решетке перекрещивающихся анодных проволочек,
расположенных на расстоянии 2-3 мм друг от друга. Считывание электрического
заряда и расчет локализации сцинтилляции света в кристалле подобны таким же
операциям в гамма-камере Ангера. Преимущество этой системы в том, что ПЧФЭУ
обеспечивает определение локализации события в пределах 2-3 мм. Вместе с тем, у
нее существуют те же проблемы однородности и линейности, как и у гамма-камеры
Ангера. В следующей новой разработке применено сочетание многокристального
детектора и ПЧФЭУ. Камера имеет несколько реализаций - от переносного прибора
до стационарной камеры с большим поле обзора и предназначена для проведения
сцинтимаммографии. Недостатками этого варианта являются большая нелинейность в
периферийной области и сильное проявление эффекта мертвого времени.
Производство таких камер налажено в нескольких компаниях.
Альтернативой ФЭУ в последнее время успешно
выступают полупроводниковые светодиоды (англ. light-sensitive
semiconductor
photodiode (SPD)).
Преимущество SPD - малые
размеры, что позволяет их монтировать на каждом отдельном кристалле (в
многокристальном варианте), относительно большая активная площадь и небольшое
"мертвое" пространство. SPD
имеют также высокую квантовую эффективность, от 70 до 80 %, по сравнению с 20 %
у ФЭУ, однако коэффициент усиления SPD
на много порядков меньше, чем у ФЭУ. Кроме того, у них высокие токи утечки,
поэтому отношение сигнал-шум меньше, чем у ФЭУ, что приводит к худшему
энергетическому разрешению. Другой существенный недостаток SPD
- сбор электронно-дырочных пар из обедненной носителями зарядов области
полупроводника от 2 до 10 раз медленнее, чем распространение электронов через
диноды ФЭУ. Следствием является большие потери счета при высокой скорости входных
событий.
Несколько групп разработали SPD
системы гамма-камер. Эти камеры могут рассматриваться как настоящие плоские
панели, так как их полная толщина меньше 1 см. Компания Digirad
Corporation создала
коммерческую систему, состоящую из 4096 кристаллов CsI(Tl)
размером 3×3×6
мм, сочлененных с матрицей 64×64
SPD. Кристаллы CsI(Tl)
при работе в паре с SPD
имеют ряд преимуществ перед NaI(Tl),
в частности, более походящий к SPD
спектр света.
Полупроводники с прямым детектированием
излучения (англ. SDR) представляют большой потенциальный интерес для
разработчиков гамма-камер с высоким энергетическим разрешением. Германиевые и
кремниевые детекторы нашли широкое применение в гамма-спектроскопии. Но их
применение в гамма-камерах было затруднительно из-за необходимости охлаждения
до температуры жидкого азота. Ситуация изменилась с появлением SDR-детекторов
на базе диодов с обратно смещенными p-n-переходами. Они могут работать при
комнатной температуре, но для детектирования γ-излучения
с достаточно высокой эффективностью необходима широкая протяженность района,
обедненного носителями заряда (именно он является чувствительной областью),
высокое напряжение смещения и материал с высокой тормозной способностью.
Наиболее подходящим на сегодняшний день является теллурид-кадмий-цинк (СdZnTe
или CZT). Он может работать при комнатной температуре, имеет приемлемое
отношение сигнал-шум, энергетическое разрешение от 2 до 5 %. Однако глубина
района у CZT, обедненного носителями заряда, порядка 5 мм, что ограничивает его
применение, в основном, низкоэнергетическим γ-излучением.
Детекторы CZT сегодня достаточно дорогие,
поэтому они применяются в переносных гамма-камерах с небольшим полем обзора.
Заключение
Планарная сцинтиграфия - наиболее широко
используемая в клинической диагностике разновидность радиоизотопных
изображений. С расширением сферы применения компьютеров, работающих в реальном
масштабе времени, диагностическая сцинтиграфия начинает приобретать все более
возрастающее значение, особенно пи оценке функционального состояния сердца,
легких и почек.
В планарной сцинтиграфии, основанной на
получении двумерных проекций трехмерного распределения активности существенное
влияние на изображение оказывает эффект паразитного наложения активности от
окружающих исследуемый орган областей. Это ограничивает возможности определения
функций органа и снижает точность при количественной оценке.
Словарик терминов
ПЧД - позиционно-чувствительный детектор
Перфузионная сцинтиграфия легких -
радиологическое исследование, включающее визуальную и функциональную оценку
капиллярного кровообращения в легких с помощью гамма-излучающих меченых частиц.
После введения в вену меченных 99mTc микросфер альбумина с помощью гамма-камеры
производится серия сцинтиграмм, которые отражают распределение частиц
пропорционально легочному кровотоку. Перфузионная сцинтиграфия легких
проводится преимущественно для диагностики ТЭЛА и ее ветвей, а также других
заболеваний, сопровождающихся нарушением легочной перфузии (пневмонии, опухолей
легкого, обструктивных заболеваний, пневмосклероза и т. д.). Подвздошная
артерия(внутренняя)- отходит от общей подвздошной артерии и направляется вниз,
в полость малого таза, располагаясь по линии крестцово-подвздошного сустава. На
уровне верхнего края большого седалищного отверстия делится на передний и
задний стволы. Ветви, отходящие от этих стволов, направляются к стенкам и
органам малого таза и поэтому разделяются на внутренностные и пристеночные.
Цистеин - алифатическая серосодержащая
аминокислота. Оптически активна, существует в виде L- и D- изомеров.
Синхротронное излучение- электромагнитное
излучение, испускаемое заряженными частицами, движущимися с релятивистскими
скоростями по траекториям, искривлённым магнитным полем.
Химическое разделение мишени и продукта
позволяет определять несколько элементов из одной облученной мишени
FWHM-ширина на
полувысоте
Эманация в физике - материальное
"нечто", выделяющееся из активных препаратов тория и радия. Учение об
Э. тесно связано с новейшим открытием так называемых радиоактивных веществ
Информационная плотность-находится как число
отсчетов, измеренных на единице площади изображения, является важным параметром
для определения минимального размера визуально обнаруживаемого изменения и
контраста. Обычно в гамма камерах находится в диапазоне от 1000 до 3000
отсчетов/см2.
Список литературы
1.
Климанов В.А. Физика ядерной медицины./ В.А. Климанов, Уч. Пособие, часть
1.,М., НИЯУ МИФИ, 2012. - 308 с.
.
Беляев В.Н.;Климанов В.А. Физика ядерной медицины./ В.Н. Беляев, В.А. Климанов,
Уч. Пособие, часть 2.,М., НИЯУ МИФИ, 2012. - 248 с.
.
Уэбб С. Физика визуализации изображений в медицине./ Под ред. С. Уэбба. М.:, 1
т., 1991.