Определение растворимости соли электрометрическими методами
Министерство
образования и науки Украины
Харьковский
национальный университет
имени В. Н.
Каразина
Кафедра
физической химии
Курсовая
работа
Определение
растворимости соли электрометрическими методами
Студента третьего курса
Химического факультета
Группы Х - 133
Мустафы Нури Хамидовича
научный руководитель, д.х.н., доцент А. В.
Лебедь
Харьков 2013
Содержание
Введение
) Литературный обзор
) Экспериментальная часть
) Расчеты
Вывод
Список литературы
Введение
растворимость
соль электрометрический хлорид
В данной работе рассматривается явление
растворимости малорастворимых солей, а также экспериментальное определение их
растворимости электрометрическими методами (потенциометрия).
В литературном обзоре рассмотрены основные
понятия и термины, а также необходимое для экспериментальной части
оборудование: типы электрохимических цепей, типы электродов, потенциометр,
элемент Вестона (т. н. нормальный элемент).
В экспериментальной части путем проведения
лабораторной работы и расчётов определяется растворимость малорастворимой соли
на примере хлорида серебра с использованием концентрационной цепи с переносом.
1. Литературный обзор
Определение солей:
Соли - это сложные вещества, которые в водных
растворах диссоциируют на катионы металлов и анионы кислотных остатков.
ИЮПАК определяет соли как химические соединения,
состоящие из катионов и анионов. Есть ещё одно определение: солями называют
вещества, которые могут быть получены при взаимодействии кислот и оснований с
выделением воды.
Типы солей :
Если рассматривать соли как продукты протонов в
кислотах или гидроксогрупп в основаниях, то можно выделить следующие типы
солей:
Средние (нормальные) соли - продукты замещения
всех катионов водорода в молекулах кислоты на катионы металла (Na2CO3, K3PO4).
Кислые соли - продукты частичного замещения
катионов водорода в кислотах на катионы металла (NaHCO3, K2HPO4). Они
образуются при нейтрализации основания избытком кислоты (то есть в условиях
недостатка основания или избытка кислоты).
Основные соли - продукты неполного замещения
гидроксогрупп основания (OH-) кислотными остатками ((CuOH)2CO3). Они образуются
в условиях избытка основания или недостатка кислоты.
По числу присутствующих в структуре катионов и
анионов выделяют следующие типы солей :
Простые соли - соли, состоящие из одного вида
катионов и одного вида анионов (NaCl)
Двойные соли - соли, содержащие два различных
катиона (KAl(SO4)2·12 H2O).
Смешанные соли - соли, в составе которых
присутствует два различных аниона (Ca(OCl)Cl).
Растворимость - способность вещества
образовывать с другим веществом гомологические смеси с дисперсным
распределением компонентов. Обычно растворителем считают вещество, которое в
чистом виде существует в том же агрегатном состоянии, что и образовавшийся
раствор. Если до растворения оба вещества находились в одном и том же
агрегатном состоянии, растворителем считается вещество, присутствующее в смеси
в существенно большем количестве.
Растворимость определяется физическим и
химическим сродством молекул растворителя и растворяемого вещества,
соотношением энергий взаимодействия однородных и разнородных компонентов
раствора. Как правило, хорошо растворяются друг в друге подобные по физическим
и химическим свойствам вещества (эмпирическое правило "подобное
растворяется в подобном"). В частности, вещества, состоящие из полярных
молекул, и вещества с ионным типом связи хорошо растворяются в полярных
растворителях (воде, этаноле, жидком аммиаке), а неполярные вещества хорошо
растворяются в неполярных растворителях (бензоле, сероуглероде).
Растворимость данного вещества зависит от
температуры и давления, соответствующего общему принципу смещения равновесий.
Концентрация насыщенного раствора при данных условиях численно определяет
растворимость вещества в данном растворителе и также называется растворимостью.
Пересыщенные растворы содержат большее количество растворенного вещества, чем
это соответствует его растворимости, существование перенасыщенных растворов
обусловлено кинетическими затруднениями кристаллизации. Для характеристики
растворимости малорастворимых веществ используют произведение активностей ПА
(для растворов, близких по своим свойствам к идеальному - произведение
растворимости (ПР) ). Растворение твердых тел в жидкостях может сопровождаться
поглощением тепла, в этом случае повышение температуры приводит к увеличению
растворимости.
Произведение растворимости (ПР) - произведение
концентраций ионов малорастворимого электролита в его насыщенном растворе при
постоянной температуре и давлении. Произведение растворимости - величина
постоянная. При постоянной температуре в насыщенных водных растворах
малорастворимых электролитов устанавливается равновесие между твердым веществом
и ионами, образующими это вещество.
Электрохимические методы анализа - совокупность
методов качественного и количественного анализа, основанных на
электрохимических явлениях, происходящих в исследуемой среде или на границе
раздела фаз и связанных с изменением структуры, химического состава или
концентрации анализируемого вещества. Электрохимические методы анализа делятся на
пять основных групп: потенциометрию, вольтамперометрию,
кулонометрию,кондуктометрию и диэлектрометрию.
Потенциометрия объединяет методы, основанные на
измерении эдс обратимых электрохимических цепей, когда потенциал рабочего
электрода близок к равновесному значению. Потенциометрия включает редоксметрию,
ионометрию и потенциометрическое титрование.
Вольтамперометрия основана на исследовании
зависимости тока поляризации от напряжения, прикладываемого к электрохимической
ячейке, когда потенциал рабочего электрода значительно отличается от
равновесного значения. По разнообразию методов вольтамперометрия - самая
многочисленная группа из всех электрохимических методов анализа, широко
используемая для определения веществ в растворах и расплавах (например, полярография,
амперометрия).
Кулонометрия объединяет методы анализа,
основанные на измерении количества вещества, выделяющегося на электроде в
процессе электрохимической реакции в соответствии с Фарадея законами. При
кулонометрии потенциал рабочего электрода отличается от равновесного значения.
Различают потенциостатическую и гальваностатическую кулонометрию, причём
последняя включает прямой и инверсионный методы, электроанализ и
кулонометрическое титрование.
К кондуктометрии относятся методы, в которых
измеряют электропроводность электролитов (водных и неводных растворов,
коллоидных систем, расплавов, твёрдых веществ). Кондуктометрический анализ
основан на изменении концентрации вещества или химического состава среды в
межэлектродном пространстве; он не связан с потенциалом электрода, который
обычно близок к равновесному значению. Кондуктометрия включает прямые методы
анализа (используемые, например, в солемерах) и косвенные (например, в газовом
анализе) с применением постоянного или переменного тока (низкой и высокой
частоты), а также хронокондуктометрию, низкочастотное и высокочастотное
титрование.
Потенциометрия (от лат. potentia-сила, мощность
и греч. metreo- измеряю), электрохимический метод исследования и анализа
веществ, основанный на зависимости равновесного электродного потенциала Е от
термодинамической активности компонентов электрохимической реакции: αА
+ βВ
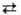 mМ
+ рP; Эта зависимость описывается уравнением Нернста :
mМ
+ рP; Эта зависимость описывается уравнением Нернста :
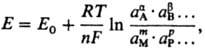
где Е0 стандартный потенциал, R-газовая
постоянная ( 8,312 Дж/(моль К)), Т - абсолютная температура, F-постоянная
Фарадея (96485 Кл/моль), n-число электронов, участвующих в реакции, α,
β,...,
- стехиометрический коэффициент при компонентах реакции А, В,..., М, Р
(которыми могут быть ионы и молекулы в жидкой, твердой или газовой фазе).
Активности твердых и газообразных компонентов и растворителей принимают за
единицу.
При потенциометрических измерениях составляют
гальванический элемент с индикаторным электродом, потенциал которого зависит от
активности хотя бы одного из компонентов электрохимической реакции, и
электродом сравнения и измеряют электродвижущую силу (эдс) этого элемента.
В потенциометрии используют гальванические
элементы без переноса, когда оба электрода помещают в один и тот же исследуемый
раствор, и с переносом, когда электроды находятся в разных растворах, имеющих
между собой электролитический контакт. Последний осуществляют таким образом,
что растворы могут смешиваться друг с другом только путем диффузии. Обычно их
разделяют пористой керамической или пластмассовой перегородкой или прочно
пришлифованной стеклянной муфтой. Элементы без переноса используют, в основном,
для измерения констант равновесия химических реакций, констант диссоциации
электролитов, констант устойчивости комплексных соединений, произведений
растворимости, стандартных электродных потенциалов, а также активностей и
коэффициентов активности ионов. Элементы с переносом используют для определения
"кажущихся" констант равновесия (поскольку при этом не учитывают
жидкостной потенциал), активностей и коэффициентов активности ионов, а также в
потенциометрических методах анализа.
Среди этих методов различают прямую
потенциометрию и потенциометрическое титрование.
Прямая потенциометрия применяется для непосредственного
определения ионов (например, Ag+ в растворе AgNO3) по значению Е
соответствующего индикаторного электрода (например, серебряного); при этом
электродный процесс должен быть обратимым. Исторически первыми методами прямой
потенциометрии были способы определения водородного показателя рН. Появление
мембранных ионоселективных электродов привело к возникновению ионометрии
(рХ-метрии), где рХ = - lg ах, ах - активность компонента X электрохимической
реакции. Иногда рН - метрию рассматривают как частный случай ионометрии.
Градуировка шкал приборов потенциометров по значениям рХ затруднена из-за
отсутствия соответствующих стандартов. Поэтому при использовании
ионоселективных электродов активности ( концентрации )ионов определяют, как
правило, с помощью градуировочного графика или методом добавок. Применение
таких электродов в неводных растворах ограничено из-за неустойчивости их
корпуса и мембраны к действию орг. растворителей.
К прямой потенциометрии относится также
редоксметрия - измерение стандартных и реальных окислительно -
восстановительных потенциалов и констант равновесия окислительно -
восстановительных реакций. Потенциал зависит от активностей окисленной и
восстановленной (a вос) форм вещества. Редоксметрию применяют также для
определения концентрации ионов в растворах. Методом прямой потенциометрии с
использованием металлических электродов изучают механизм и кинетику реакций
осаждения и комплексообразования.
Прямая потенциометрия обладает важными
достоинствами. В процессе измерений состав анализируемого раствора не меняется.
При этом, как правило, не требуется предварительного отделения определяемого
вещества. Метод можно легко автоматизировать, что позволяет использовать его
для непрерывного контроля технологических процессов.
Типы электродов :
По типу электродной реакции все электроды можно
разделить на две группы
Электроды первого рода
К электродам первого рода относятся электроды,
состоящие из металлической пластинки, погруженной в раствор соли того же
металла.
При обратимой работе элемента, в который включен
электрод, на металлической пластинке идет процесс перехода катионов из металла
в раствор либо из раствора в металл.
Электроды первого рода обратимы по катиону и их
потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам
первого рода относят также и водородный электрод).
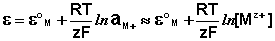
Электроды второго рода
Электродами второго рода являются электроды, в
которых металл покрыт малорастворимой солью этого металла и находится в
растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого
типа обратимы относительно аниона и зависимость их электродного потенциала от
температуры и концентрации аниона может быть записана в следующем виде:
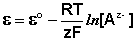
Электроды сравнения
Для определения электродного потенциала элемента
необходимо измерить ЭДС гальванического элемента, составленного из испытуемого
электрода и электрода с точно известным потенциалом - электрода сравнения. В
качестве примеров рассмотрим водородный, каломельный и хлорсеребряный
электроды.
Водородный электрод представляет собой
платиновую пластинку, омываемую газообразным водородом, погруженную в раствор,
содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии
с газообразным водородом; схематически электрод изображают следующим образом:
Рt, Н2 / Н+
Электрохимическое равновесие на электроде можно
рассматривать в следующем виде:
Потенциал водородного электрода зависит от
активности ионов Н+ в растворе и давления водорода;
потенциал стандартного водородного электрода (с
активностью ионов Н+ 1 моль/л и давлением водорода 101.3 кПа) принят равным
нулю. Поэтому для электродного потенциала нестандартного водородного электрода
можно записать:
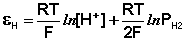 (III.49)
(III.49)
Каломельный электрод. Работа с водородным
электродом довольно неудобна, поэтому в качестве электрода сравнения часто
используется более простой в обращении каломельный электрод, величина
электродного потенциала которого относительно стандартного водородного
электрода точно известна и зависит только от температуры. Каломельный электрод
состоит из ртутного электрода, помещенного в раствор КСl определенной
концентрации и насыщенный каломелью Hg2Сl2:
Нg / Нg2Сl2, КСl
Каломельный электрод обратим относительно
анионов хлора, и уравнение Нернста для него имеет вид:
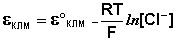
Хлорсеребряный электрод. В качестве электрода
сравнения используют также другой электрод второго рода - хлорсеребряный,
представляющий собой серебряную проволоку, покрытую хлоридом серебра и
помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим
относительно анионов хлора:
Аg / АgСl, КСl
Величина потенциала хлорсеребряного электрода
зависит от активности ионов хлора; данная зависимость имеет следующий вид:
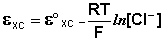
Чаще всего в качестве электрода сравнения
используется насыщенный хлорсеребряный электрод, потенциал которого зависит
только от температуры. В отличие от каломельного, он устойчив при повышенных
температурах и применим как в водных, так и во многих неводных средах.
Индикаторные электроды. Электроды, обратимые
относительно иона водорода, используются на практике для определения активности
этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим
методом, основанном на определении потенциала электрода в растворе с
неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве
индикаторного электрода может использоваться и водородный электрод, однако работа
с ним неудобна и на практике чаще применяются хингидронный и стеклянный
электроды.
Хингидронный электрод, относящийся к классу
окислительно-восстановительных электродов (см. ниже), представляет собой
платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который
предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 -
соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению
в равновесном окислительно-восстановительном процессе, в котором участвуют ионы
водорода:
С6Н4О2 + 2Н+ + 2е- --> С6Н4(ОН)2
Хингидронный электрод является т.н.
окислительно-восстановительным электродом; зависимость его потенциала от
активности ионов водорода имеет следующий вид:
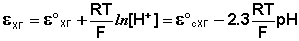
Стеклянный электрод, являющийся наиболее
распространенным индикаторным электродом, относится к т.н. ионоселективным или
мембранным электродам. В основе работы таких электродов лежат ионообменные
реакции, протекающие на границах мембран с растворами электролитов; ионоселективные
электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода
заключается в следующем. Мембрана, селективная по отношению к некоторому иону
(т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с
различной активностью этого иона. Разность потенциалов, устанавливающаяся между
двумя сторонами мембраны, измеряется с помощью двух электродов.
При соответствующем составе и строении мембраны
её потенциал зависит только от активности иона, по отношению к которому
мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод
в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик
заполняется раствором НСl с определенной активностью ионов водорода; в раствор
погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал
стеклянного электрода с водородной функцией (т.е. обратимого по отношению к
иону Н+) выражается уравнением
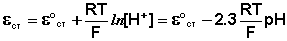
Необходимо отметить, что стандартный потенциал ε°ст
для каждого электрода имеет свою величину, которая со временем изменяется;
поэтому стеклянный электрод перед каждым измерением рН калибруется по
стандартным буферным растворам с точно известным рН.
Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в
случае окислительно-восстановительных электродов процессы получения и отдачи
электронов атомами или ионами происходят не на поверхности электрода, а только
в растворе электролита. Если опустить платиновый (или другой инертный) электрод
в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот
электрод проводником с другим электродом, то возможно либо восстановление ионов
Fe3+ до Fe2+ за счет электронов, полученных от платины, либо окисление ионов
Fe2+ до Fe3+ с передачей электронов платине. Сама платина в электродном
процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод,
состоящий из инертного проводника первого рода, помещенного в раствор
электролита, содержащего один элемент в различных степенях окисления,
называется окислительно-восстановительным или редокс-электродом.
Потенциал окислительно-восстановительного
электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H+ // Fe3+, Fe2+ / Pt
Зависимость потенциала редокс-электрода εRO
от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для
окислительно-восстановительной реакции, в которой не участвуют никакие другие
частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n -
число электронов, участвующих в элементарном акте
окислительно-восстановительной реакции):
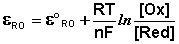
Из данного выражения следует уравнение для
потенциала металлического электрода (III.40), т.к. активность атомов металла
(восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для
окислительно-восстановительного потенциала фигурируют концентрации всех
участвующих в реакции соединений, т.е. под окисленной формой следует понимать
все соединения в левой части уравнения реакции
Ох + ne- --> Red
под восстановленной - все соединения в правой
части уравнения. Так, для окислительно-восстановительных реакций, протекающих с
участием ионов водорода
Ох + ne- + mH+ --> Red,
уравнение Нернста будет записываться следующим
образом:
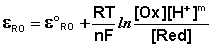
При составлении гальванических элементов с
участием редокс-электрода электродные реакции на последнем в зависимости от
природы второго электрода может быть либо окислительной, либо
восстановительной.
Например, если составить гальванический элемент
из электрода Pt / Fe3+, Fe2+ и второго электрода, имеющего более положительный
электродный потенциал, то при работе элемента редокс-электрод будет являться
анодом, т.е. на нем будет протекать процесс окисления:
+ --> Fe3+ + e-
Если потенциал второго электрода будет меньше,
чем потенциал электрода Pt / Fe3+, Fe2+, то на последнем будет протекать
реакция восстановления и он будет являться катодом:
+ + e- --> Fe2+
Знание величин электродных потенциалов позволяет
определить возможность и направление самопроизвольного протекания любой
окислительно-восстановительной реакции при одновременном наличии в растворе
двух или более окислительно-восстановительных пар. Восстановленная форма любого
элемента или иона будет восстанавливать окисленную форму другого элемента или
иона, имеющего более положительный электродный потенциал.
Типы электрохимических цепей:
) по источнику электрической энергии в цепи;
) по наличию или отсутствию в цепи границ двух
различных растворов (цепь с (без) переноса).
. Физические цепи - без переноса источника
электрической энергии - служит различие в физическом состоянии двух одинаковых
по химическому состоянию электродов. Эти электроды погружены в один и тот же раствор
и при работе цепи электрод, находящемся в менее устойчивом состоянии, переходит
в более устойчивое. Разновидность физической цепей - алитропические цепи, в
которых один из электродов сделан из метастабильной модификации данного
металла. Другая разновидность - гравитационные цепи.
. Концентрационные цепи - отличаются только
концентрацией компонентов Red
и Ox при одинаковых
электродах и растворах. Источником электрической энергии в них является
разность свободной энергии Гиббса за счет разной активности химических
компонентов.
∆E = ∆E0 - νRTln(a±)/nF
3. Химические цепи - источник электрической
энергии - свободная энергия химической реакции. Химическими цепями являются все
остальные разновидности гальванических элементов, в которых электроды разного
состава. Для электрохимических исследовании в зависимости от назначения
исследуются различные типы электродов, которые классифицируются по природе Red
и Ox форм.
Потенциометр
(от лат. potentia - сила и греч. metreo -
измеряю), прибор для измерения компенсационным методом эдс и напряжения, а
также величин, функционально с ними связанных.

Пример потенциометра
Компенсационный метод измерений - метод
измерений, основанный на компенсации (уравнивании) измеряемого напряжения или
эдс напряжением, создаваемым на известном сопротивлении током от
вспомогательного источника. К. м. и. применяют не только для измерений
электрических величин (эдс, напряжений, токов, сопротивления); он широко
применяется и для измерения др. физических величин (механических, световых,
температуры и т.д.), которые обычно предварительно преобразуют в электрические
величины.
К. м. и. является одним из вариантов метода
сравнения с мерой, в котором результирующий эффект воздействия величин на
прибор сравнения доводят до нуля (добиваются нулевого показания измерительного
прибора). К. м. и. отличается высокой точностью. Она зависит от
чувствительности нулевого прибора) (нуль индикатора), контролирующего
осуществление компенсации, и от точности определения величины, компенсирующей
измеряемую величину.
Нормальный элемент Вестона - ртутно-кадмиевый
элемент - гальванический элемент, ЭДС которого весьма стабильна во времени и
воспроизводима от экземпляра к экземпляру. Применяется в качестве источника
опорного напряжения (ИОН) либо эталона напряжения в метрологии, при
воспроизведении и измерении постоянных напряжений.

Различают насыщенные и ненасыщенные элементы (в
зависимости от концентрации электролита).
Насыщенный элемент - нормальный элемент, в
котором электролит представляет собой насыщенный (то есть в котором при рабочей
температуре сульфат кадмия более не растворяется; именно это и делает возможным
присутствие его нерастворённого гидрата в пастообразных компонентах электродов)
раствор сульфата кадмия. Ненасыщенный же элемент содержит раствор сульфата
кадмия, насыщенный при 4 °C; растворимость сульфата кадмия выше 3 °C растёт с
ростом температуры, таким образом, существование его гидрата в твёрдом виде в
ненасыщенном элементе в диапазоне рабочих температур невозможно.
Это обуславливает их основные преимущество и
недостаток друг перед другом, поскольку ЭДС элементов в основном зависит от
концентрации электролита. С одной стороны, так как в насыщенном элементе
концентрация электролита определяется растворимостью сульфата кадмия, взятого в
избытке, то при поддержании постоянной температуры концентрация сульфата
кадмия, изменившаяся в силу каких-либо причин (например, протекания тока через
элемент), автоматически восстанавливается из-за растворения или оседания
«буферного» сульфата кадмия, в отличие от ненасыщенного элемента, который при
протекании тока «заряжается» и «разряжается», меняя свою ЭДС, да и при хранении
концентрация электролита в нём несколько меняется. Это обуславливает гораздо
большую временную стабильность ЭДС насыщенного элемента. Но отсюда проистекает
и основной недостаток насыщенного элемента - намного большая зависимость ЭДС от
температуры; её приходится либо строго учитывать, либо термостатировать
насыщенный элемент, тогда как ненасыщенный элемент в большинстве случаев этого
не требует.
В связи с этим насыщенные элементы применяют в
основном в лабораторных условиях, а ненасыщенные - в промышленных и переносных
измерительных приборах.
Насыщенные элементы серийно выпускаются классов
точности (с пределом допускаемой основной относительной погрешности, выраженной
в процентах) 0,005, 0,002, 0,001, 0,0005 и 0,0002. Гарантированная стабильность
насыщенных элементов за год равна их классу. В силу повышенной температурной
зависимости ЭДС насыщенные элементы снабжаются термометрами (элементы класса
0,005, с точностью 0,2 °C) или термостатируются (остальных классов; например,
температуру элементов класса 0,0002 поддерживают с точностью 0,01 °C).
Теоретически ЭДС насыщенного элемента при 20 °C
составляет E(20 °C) = 1,018636 В - 6·10−4 * N - 5·10−5 * N2, где N
- нормальность серной кислоты в электролите (иногда встречающаяся цифра
1,018300 В соответствует устаревшему «международному» вольту); из-за этого и
иных производственных отклонений чистоты материалов реальные насыщенные
элементы, пригодные к применению по ГОСТ 1954-82, имеют E(20 °C) в диапазоне
1,018540…1,018730 В при эксплуатации и 1,018590…1,018700 В при выпуске из
производства. Конкретное значение указывается в аттестате или свидетельстве
после выпуска данного экземпляра НЭ или его периодической поверки в
метрологических органах.
Зависимость ЭДС насыщенного элемента от
температуры T (с точностью по ГОСТ не хуже 2 мкВ/°C отклонения в диапазоне
20…40 °C и не хуже 3 мкВ/°C в диапазоне 10…20 °C) выражается формулой:
(T) = E(20 °C) - 4,06·10−5 * ∆T -
9,5·10−7 * ∆T2 + 10−8 * ∆T3,
∆T = T - 20 °C.
. Экспериментальная часть
Определение растворимости малорастворимой соли
на примере хлорида серебра было проведено методом потенциометрии с
использованием концентрационной цепи с переносом.
Цепи, составленные из двух одинаковых
металлических электродов, погруженных в два раствора солей одного и того же
металла, но разной концентрации являются концентрационными цепями с переносом.
Под переносом имеется в виду использование в
цепи солевого (электролитического) мостика. Солевой мостик используется для
элиминирования диффузионного потенциала, замыкания цепи из двух растворов и
уравновешивания скорости перемещения ионов раствора. Солевой мостик может
применяться в виде стаканчика с концентрированным раствором соли, либо в виде U
- образной, закрытой перепонками, трубки, заполненной концентрированным
раствором соли (электролита,у которого подвижности катиона и аниона близки - KCl,
KNO3, NH4Cl,
NH4NO3
), и агар-агаром - растительным заменителем желатина.
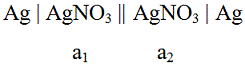
При условии a1
< a2 уравнения
электрохимических реакций и соответствующие скачки потенциалов на границах металл
- раствор следующие:
Ag → Ag+ + e; π
- = π0
+ ϴ Lg a1 (Ag+)+ + e → Ag; π
+ = π0
+ ϴ Lg a2 (Ag+),
Где ϴ
= 2,3 RT/F.
ЭДС цепи включает, помимо π
+ и π -
диффузионный потенциал π
д - скачок потенциала на границе раствор ( a1
) - раствор ( a2 ) :
E = π+
- π - + πд
= ϴ Lg (a2 / a1 ) + πд
Диффузионный потенциал возникает из-за разной
подвижности катионов и анионов растворенного вещества. Так, в данном случае,
подвижность ионов серебра меньше подвижности NO-3.
Поэтому при диффузии из более концентрированного раствора в более разбавленный
ионы NO-3 движутся
с более большей скоростью,
в результате слева от границы раздела жидкостей
возникает избыток отрицательно заряженных ионов, а справа - положительно
заряженных,и возникает скачок потенциала. Это приводит к замедлению движения
катионов, так что через некоторое время при значении потенциала πд
скорости выравниваются и устанавливается стационарный режим диффузии.
На практике обычно элиминируют диффузионный
потенциал. Для этого растворы соединяют солевым мостиком. Тогда
E = ϴ
Lg (a2
/ a1 )
Измерение ЭДС концентрационных цепей позволяет
определить растворимость труднорастворимых солей. Так, для определения
растворимости галогенидов серебра можно использовать цепь типа

Где Г = Cl-,
Br -, I-.
Тогда ЭДС цепи будет равно :
E = ϴ Lg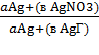
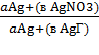 .
.
Активность ионов серебра в AgГ связана с
активностью Г- ионов через произведение растворимости :
a Ag+ · a Г-
= ПР,
a Ag+ = ПР/aГ-, = ϴ Lg 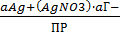
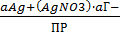
Активность ионов серебра можно
приравнять к средней ионной активности т.е.
aAg+ =
a±(AgNO3) = CAgNO3 · γ±(AgNO3)
а активность галогенид-ионов
aГ-
= a±(КГ)
= CКГ
· γ±(КГ)
В итоге получаем следующую формулу
для ЭДС :
Е = ϴ Lg 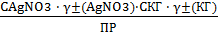
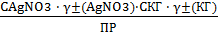
Откуда можно вычислить ПР и
растворимость
SAgГ = 

Прежде чем работать с ячейками, их нужно
тщательно промыть дистиллированной водой. Серебряные электроды, при
необходимости, нужно зачистить наждачной бумагой.
Левая ячейка заполняется раствором AgNO3
с концентрацией 0,01 моль/л.
Для этого носик ячейки помещается в стакан с
раствором, и ячейка заполняется раствором с помощью резиновой груши, конец
которой закреплен в верхнем боковом отверстии ячейки. После заполнения ячейки
боковое отверстие закрывают пробкой.
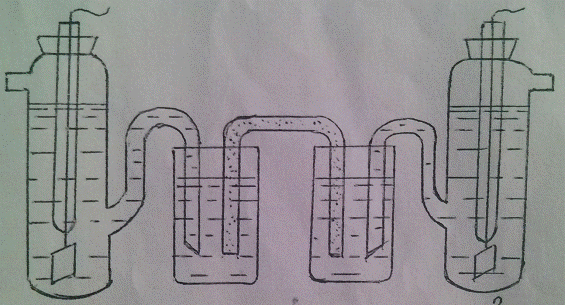
Схема ячейки для измерений
Правая ячейка заполняется раствором KCl
с добавленной к нему парой капель раствора AgNO3
для образования осадка соли AgCl.
Для измерения ЭДС берут три раствора KCl
с концентрациями 0,1, 0,2, 0,5 моль/л.С раствором соли KCl
каждой концентрации измерения проводят два раза. Перед каждым заполнением
ячейки новым раствором соли KCl
с известной концентрацией ячейку промывают дистиллированной водой, а затем
раствором соли, с которым будут работать.
Для получения раствора соли KCl
с требуемой концентрацией полезно использовать следующую формулу для приготовления
раствора:
C1V1
= C2V2
Если, к примеру, нам нужно получить 50 мл
раствора KCl с
концентрацией 0,2 моль/л из раствора хлорида калия с С = 0,5 моль/л то:
мл · 0,2 моль/л = 0,5 моль/л · x
мл.
x = 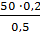
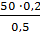 = 20 мл.
= 20 мл.
Значит для приготовления 50 мл
раствора KCl с
концентрацией 0,2 моль/л нужно взять 20 мл раствора KCl с С=0,5
моль/л в колбу на 50 мл и довести водой до метки.
Полуэлементы (заполненные и закрытые
левую и правую ячейки с электродами ) соединяют солевым мостиком с растворами
солей KNO3 либо NH4NO3.
Использование мостиков с солью, содержащей анионы Cl-
недопустимо, так как они будут образовывать с ионами Ag+ осадки
непосредственно в солевом мостике.
Измерение ЭДС на установке с
потенциометром состоит из двух последовательных операций :
1) Установка рабочего тока;
) Измерение ЭДС исследуемого элемента;
К потенциометру подключают нормальный элемент,
переключают род работы потенциометра на нормальный элемент и нажатием кнопки на
панели потенциометра замыкают цепь. Смотрят на показатели гальванометра и
вращением барабана выставляют значение ЭДС потенциометра для нормального
элемента (номинальное значение ЭДС элемента Вестона E = 1,018636 В ),замыкают
цепь. Операцию повторяют до тех пор, пока стрелка гальванометра не будет
показывать ноль, что будет свидетельствовать о компенсации ЭДС нормального
элемента и установке рабочего тока.
Затем к потенциометру подключают схему с
ячейками.
Вследствие малой концентрации ионов серебра в
правой ячейке c
KCl, электрод,
помещенный в неё, отрицательно заряжен, а электрод в растворе AgNO3
заряжен положительно. В соответствии с этим, клеммы электродов каждой ячейки
подключаются к соответствующим разъемам (x1
или x2) потенциометра.
После этого проводят измерение ЭДС исследуемого
элемента, и переключатель рода работы выставляют на разъемы с подключенными
ячейками. Измерение проводится аналогично установке рабочего тока, но вместо
барабанов для нормального элемента используют барабаны для определения ЭДС
подключенного элемента - выставлением значения ЭДС ([В]) стараются перевести
стрелку гальванометра на ноль.
Результатом проведения данной работы являются
следующие данные
|
CKCl, моль/л
|
E1 цепи,мВ
|
E2 цепи,мВ
|
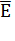 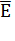 цепи, мВγ± KCl цепи, мВγ± KCl
|
|
|
0,1
|
399
|
400
|
399,5
|
0,770
|
|
0,2
|
408
|
410
|
409
|
0,718
|
|
0,5
|
440
|
440
|
440
|
0,649
|
CAgNO3 = 0,01 моль/л
= const;
γ±AgNO3 =0,897;
= 273 + 19 = 292 K;
R = 8,312 Дж/(моль
К);= 96485 Кл/моль;
E0 = 1,01868 В;
. Расчеты
1) 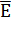
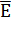 1 =
1 = 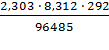
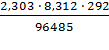 · Lg
· Lg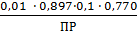
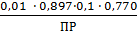 ;
;
,3995 = 0,0579 · Lg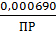
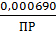 ;
;
,3995 = 0,0579 · Lg0,000690 -
0,0579 · LgПР;
,3995 = -0,1830 - 0,0579 · LgПР;
0,0579 · LgПР = 0.5825;
LgПР = -10,06;
ПР = 8,71 · 10-11;
Так как растворимость есть корень
произведения растворимости то:
SAgCl = 
 = 2,95 · 10-5,5;
= 2,95 · 10-5,5;
) 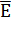
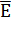 2 =
2 = 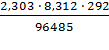
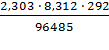 · Lg
· Lg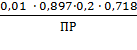
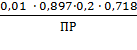 ;
;
,409 =
0,0579 · Lg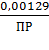
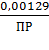 ;
;
,409 =
0,0579 · Lg0,00129 - 0,0579 · LgПР;
0,409 = - 0,1673 - 0,0579 · LgПР;
0,0579 · LgПР = 0.5763;
LgПР = -9,953;
ПР = 1,1143 · 10-10;
Так как растворимость есть корень
произведения растворимости то:
SAgCl = 
 = 1,0556 · 10-5;
= 1,0556 · 10-5;
) 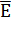
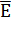 3 =
3 = 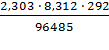
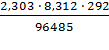 · Lg
· Lg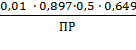
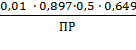 ;
;
,440 =
0,0579 · Lg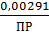
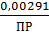 ;
;
,440 =
0,0579 · Lg0,00291 - 0,0579 · LgПР;
0,440 = -0,1468 - 0,0579 · LgПР;
0,0579 · LgПР = 0.5868;
LgПР =
-10,1354;
ПР = 7,32 · 10-11;
Так как растворимость есть корень
произведения растворимости то:
SAgCl = 
 = 2,7055 · 10-5,5;
= 2,7055 · 10-5,5;
Сравнения растворимости :
S1 = 2,95 ·
10-5,5;
S2 = 1,0556 ·
10-5;
S3 = 2,7055 ·
10-5,5;
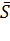
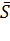 = 0,95512 · 10-5;
= 0,95512 · 10-5;
S табл =
1,3153 · 10-5;
Ƞ = 72,61 %;
Таким образом, было получено
значение растворимости хлорида серебра, отклонение значения растворимости от
табличного составляет около 27,39% при температуре в 19оС.
Вывод
В ходе данной работы была проведена актуализация
знаний, терминов и понятий, необходимых для нахождения растворимости
малорастворимой соли. В качестве метода определения был выбран
потенциометрический. Экспериментально было доказано, что растворимость является
постоянной величиной
Список литературы
1) Сивухин Д. Общий курс физики. Том
III. Электричество. 2004
) Карандеев К. Б., Специальные
методы электрических измерений. 1963
) Галюс 3., Теоретические основы
электрохимического анализа. 1974
) Бацанов С. С.. Экспериментальные
основы структурной химии. 1986
) Фомин В. М., Климова М.Н..
Методическое пособие для лабораторного практикума по физической химии для
студентов третьего курса химического факультета. 2003