Методи вирощування кристалів
МЕТОДИ ВИРОЩУВАННЯ КРИСТАЛІВ
Курсова робота
Зміст
Вступ
Розділ 1. Основні відомості про кристали
1.1 Структура кристалів
1.1.1 Сполучення елементів симетрії структур. Грати Браве
1.1.2 Кристалографічні категорії, системи та сингонії
1.2 Як утворюються розплави
1.3 Як кристали ростуть з розчинів
1.4 Як кристали ростуть з розплавів
1.5 Не тільки багатогранники
Розділ 2. Вирощування кристалів
2.1 Вирощування монокристалів з розплавів
2.2 Метод Вернейля
2.3 Метод Бріджмена
2.4 Метод Чохральського
2.5 Метод зонної плавки
2.6 Гідротермальне вирощування
2.7 Метод твердофазної рекристалізації
Висновки
Перелік посилань
Вступ
Повсюди нас оточують кристали. Ми ходимо по кристалах,
будуємо із кристалів, обробляємо кристали на заводах, створюємо прилади й
вироби із кристалів; проникаємо в таємниці будови кристалів. Ми дуже багато
говоримо про кристали, але що ж це таке? Кристали - це речовини, в яких
складові їх частки (атоми, іони, молекули) розташовані строго періодично,
утворюючи геометрично закономірну кристалічну структуру. Але кожну
кристалічну речовину можна відрізнити від інших кристалічних речовин за атомною
структурою.
За розмірами кристали бувають різними. Багато з них можна
побачити тільки в мікроскоп, а буває,що зустрічаються гігантські кристали масою
в кілька тонн.
Кристалічну структуру ми можемо зустрічати повсюди. Люди
навіть не задумуються про це.
Учені все глибше проникають у таємниці будови кристалів і
знаходять їм нові застосування. Особи, що присвячують своє життя вивченню
кристалів, часто сприймають їх живими. Мається на увазі, що вони говорять про
них, як про живі істоти. Металознавці говорять про утому металевого кристала,
про його старіння, здатність відпочивати, видавати звуки. Геологи говорять про
пам´ять мінералу, про його здатність розумно пристосовуватись до
зовнішніх умов. Учені не помиляються з приводу вміння кристалу розповідати свою
біографію або виявляти емоції, але атмосфера особистого відношення із природою
надає пошуку необхідне для них романтичне фарбування.
Правильна многогранна форма - перше, що впадає в око
спостерігача, але не вона є головною особливістю кристалічного тіла. Кристал
можна розбити на дрібні частинки, так що не залишиться й сліду від його краси,
і все ж таки кожний кусочок буде, як і раніше, кристалом.
вирощування кристал монокристал гідротермальний
Найголовніше в кристалі не зовнішня його форма, а
своєрідність його внутрішніх властивостей. Але спочатку звернемо увагу на
правильність форми кристала - на симетрію. За висловом кристалографа Є.С.
Федорова, " Кристали виблискують симетрією"
Залежно від геометричної симетрії, форми росту і від симетрії
фізичних властивостей кристали поділяються на категорії, системи та сингонії.
Кристали мають також фізичні властивості: електропровідність, теплопровідність,
діелектричну проникливість та інші.
Для всіх кристалів однокової речовини, при постійних умовах
температура плавлення однакова, а для різних речовин вона різна. Всі кристали
під час плавлення зберігають постійну температуру. Саме на ці властивості
кристалів заснований пристрій термометра. Нуль градусів за шкалою термометра -
це температура, при якій в звичайних умовах тануть, тобто плавляться, кристали
льоду. Температура плавлення кристала залежить від тиску, під яким цей кристал
перебуває.
Робота складається із вступу, з двох розділів, висновку та
переліку посилань. Перший розділ називається: основні відомості про кристали,
він складається з таких підпунктів: структура кристалів, сполучення елементів
симетрії структур. Грати Браве, кристалографічні категорії, системи та
сингонії, як утворюються розплави, як кристали ростуть з розчинів, як кристали
ростуть з розплавів, не тільки багатогранники. Другий розділ називається:
вирощування кристалів, він складається з таких підпунктів: вирощування
монокристалів розплавів, метод Вернейля, метод Бріджмена, метод Чохральського,
метод зонної плавки, гідротермальне вирощування, метод твердофазної
рекристалізації. До роботи також водять висновки та перелік посилань.
Розділ 1.
Основні відомості про кристали
1.1 Структура
кристалів
В усьому світі ми не знайдемо жодного атома або молекули,що
знаходилися б у спокої: всі вони рухаються, але ці рухи зовсім різноманітні.
Ось наприклад якщо взяти кристали, то форма їх абсолютно
правильна. Їх атоми, молекули, іони також не знаходяться у спокої, але частинки
не взаємодіють одна з одною, тому всі вони розташуванні правильним порядком і
кожна може коливатися біля певного положення.
Якби ми розглянули б кристал ззовні, то помітили, що
тягнуться безкінечні рівні ряди частинок. (див. рис. 1.1).
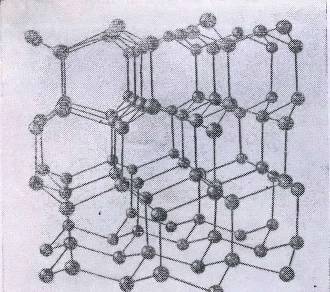
Рис. 1.1 Модель атомної решітки кристалу діаманта.
Ці правильні ряди частинок в просторі, трьохмірні решітки з
атомів утворюють кристалічну структуру. Також ми помітили б, що структура всіх
кристалічних речовин періодична і закономірна. У всіх кристалів частини
порядкуються симетричними правильними рядками, плоскими сітками, трьохмірними
решітками.
У твердій кристалічній речовині кожна частинка рухається
"вільно", коливається, але тільки на своєму місті у рядку. Вийти зі
свого положення частинки твердого тіла можуть, тільки тоді, коли наприклад
кристал нагріти, щоб він почав плавитися.
Характеристики твердого тіла: порядок, закономірність,
періодичність, симетрія роз положення атомів.
У всіх кристалах, твердих речовинах частинки розположенні
правильним, чітким порядком, побудовані симетричними, правильними, узорами, які
повторюються. Доки є цей порядок існує тверде тіло, кристал. Порушено порядок,
розсипався лад часток це означає, що кристал розплавився, перетворившись в
рідину, або випарувався, перейшовши в пар.
Порядок, лад атомів в різних тілах, різні строї атомів заліза
зовсім не схожий на будівництво кристала льоду. У кожному речовині є саме свій,
характерний візерунок і порядок розташування атомів. І від того, який цей
порядок, залежать властивості речовини. Одні і ті ж атоми, частинки одного
сорту, розташовуючись по-різному, утворюють речовини із зовсім різними
властивостями. Подивимося, наприклад, на атоми вуглецю.
Сажа, або кіптява - м'який чорний порошок, на дні каструлі
або в комині, що викидається чорними клубами диму з труб, - це вуглець.
Графіт, м'який стерженек олівця, залишаючий слід
на папері. У техніці графіт служить не тільки для олівців: цей матеріал
витримує дуже високі температури, і тому з нього роблять вогнетривкий посуд.
Графіт - кристал, складений з атомів вуглецю.
Є й інша форма кристалів вуглецю - алмаз. Алмаз
дуже твердий, він твердіше всіх каменів на Землі. Алмазом можна різати,
шліфувати, свердлити будь-які тверді камені і метали. Важко повірити, що алмаз
і графіт складені з одних і тих самих атомів вуглецю. Графіт м'який,
непрозорий, чорний. Алмаз - твердий, прозорий, іскристий всіма кольорами
веселки. Графіт-вогнетривкий, алмаз легко горить. У полум'ї кисню коштовний
діамант згорає повністю, залишається лише купка сажі або графіт. Алмаз, графіт
і сажа складаються з одних і тих самих атомів вуглецю, а різниця лише в тому,
який порядок розташування цих атомів. Розставлені вони одним строєм - і виникає
м'який чорний графіт. Перебудуються по - іншому і вийде твердий прозорий алмаз.
Структура кристала визначає властивості речовини і його форму. А правильна
багатогранна форма - це наслідок атомної структури. Плоскі грані кристала
відповідають плоским сіткам кристалічної решітки, гострі прямі ребра - рядам
атомів в решітці.
Кожна кристалічна речовина відрізняється від інших
кристалічних речовин за своєю атомною структурою. У різних речовинах різні
відстані між частинками в решітці. Але всі ці відстані дуже малі, це -
стомільйонний ні частки сантиметра (ангстрема). У всіх кристалічних речовинах
атоми, іони, молекули утворюють симетричні ряди, сітки і грати. Правильно
повторюється симетричне розташування частинок обов'язково для кристалів та є
їхньою характерною особливістю, відрізняючою їх від некристалів. Кристали
- це речовини, в яких складові їх частки (атоми, іони, молекули) розташовані
строго періодично, утворюючи геометрично закономірну кристалічну структуру.
Кристалічна структура виявлена не тільки в
природних многогранниках каменів, в кристалічних гірських породах і в металах,
але і в багатьох інших тілах, про яких нікому і в голову не приходило подумати,
що вони теж складаються з червоних металів. Глина не схожа на кристали, але й вона
складається з найдрібніших кристалічних частинок. Навіть у таких речовинах, як
звичайна сажа, людські кістки, волосся, волокна вовни, шовк, целюлоза і т.п.,
виявлено кристалічну будову.
1.1.1
Сполучення елементів симетрії структур. Грати Браве
Основне симетрична перетворення кристалічних структур - це
нескінченне повторення. Жодна точка не залишається на місці, всі вони
нескінченно повторюються з допомогою трансляцій. Кристалічна структура
складається з частинок або груп частинок, пов'язаних один з одним різними
перетвореннями симетрії. Поєднання трансляцій з кожним з елементів симетрії
генерує нові елементи симетрії, що нескінченно повторюються в просторі. Для
кожної структури характерний її набір елементарних трансляцій або трансляційна
група, яка визначає просторову решітку. Залежно від ставлення величин та взаємної
орієнтації трьох основних трансляцій відрізняються одна від одної по своїй
симетрії. Симетрія обмежує число можливих решіток. Всі кристалічні структури
описуються 14 трансляційними групами, відповідає 14 гратам Браве. Гратами
Браве називається нескінченна систематочок, яка утворюється
трансляційний повторенням однієї точки. 14 решіток Браве відрізняються один від
одного за формою елементарних комірок і по симетрії і поділяються на 6
сингоній. Підрозділ на сингоній було введено ще на початку XIX століття тільки
на підставі вивчення зовнішньої форми мінералів вирішуючи задачу про
симетричному розташуванні сферичних частинок (матеріальних точок) в просторі,
Браве в 1848 р. прийшов до такого ж поділу на сингоній. Симетрія кристалічного
простору обмежує число можливих решіток. Решітка повинна бути інваріантною
відношенню до всіх перетворень симетрії, можливим для даного кристалічного
простору.
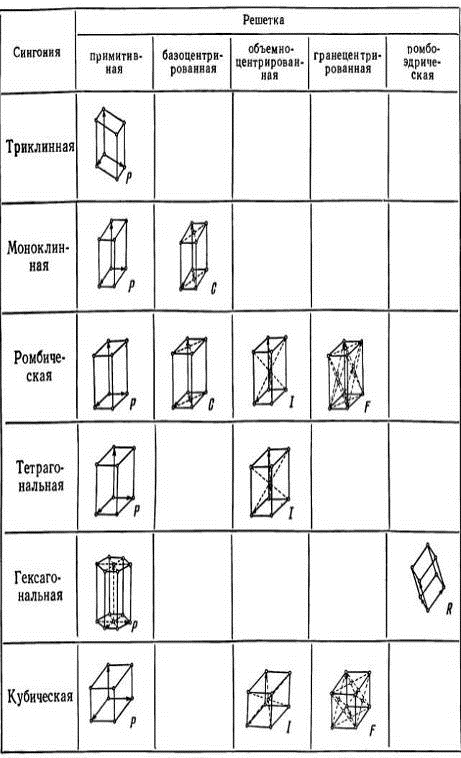
Рис. 1.2 Чотирнадцять решіток Браве
1.1.2
Кристалографічні категорії, системи та сингонії
Залежно від геометричної симетрії, форми росту і від симетрії
фізичних властивостей кристали поділяються на категорії, системи та сингонії.
Залежно від числа особливих (одиничних) напрямів і від наявних осей симетрії
кристали поділяються на три категорії:
вища категорія - немає особливих напрямів, є кілька осей
симетрії порядку вище ніж 2 (приклад - куб);
середня категорія - особливий напрям,
збігається з єдиною віссю симетрії порядку 3, 4 або 6, тобто вище ніж 2
(наприклад - три-, чотири-і шестигранна призма);
нижча категорія - кілька особливих напрямків, немає осей
порядку вище ніж 2 (приклад - так звана ромбічна призма (цеглинка), що має три
осі 2).
До вищої категорії відносяться кристали, у яких є кілька осей
симетрії порядку вище ніж 2; зокрема, обов'язково є чотири осі 3 і, крім того,
можуть бути по три осі и. Це високосиметричні кристали. У них немає особливих
напрямів. Будь-якому напрямку в кристалі вищої категорії відповідають інші
симетрично еквівалентні напряму. Властивості кристала в симетрично
еквівалентних напрямках повинні бути однаковими, тому анізотропія властивостей
у кристалів вищої категорії виражена найменш різко. Фізичні властивості
кристалів, описувані тензором другого рангу, тобто електропровідність,
теплопровідність, діелектрична проникність та інші, в цих кристалах ізотропні,
ізометричні.
До середньої категорії відносяться кристали, у яких є одне
особливий напрямок, а саме, одна вісь симетрії 3, 4 або 6 (проста або
інверсійна). Анізотропія фізичних властивостей у цих кристалів виражена значно
різкіше, ніж у кристалів вищої категорії.
До нижчої категорії відносяться кристали, у яких немає осей
симетрії порядку вище ніж 2 і є кілька особливих напрямів. Це найменш
симетричні кристали з найбільшою анізотропією властивостей.
У свою чергу, три категорії поділяються на сім систем за
ознакою їх характерною симетрії і по сполученням осей симетрії нижча категорія
ділиться на три системи:
тріклінную ("тричі похила") система - немає ні
осей, ні площин симетрії; моноклінна ("однонаклонная") - є
лише одна вісь симетрії другого порядку, або одна площина симетрії, або і вісь,
і площина;
ромбічна - у кристала є більше однієї осі другого порядку
або більше однієї площини симетрії.
Середня категорія поділяється також на три системи:
трігональная - одна основна вісь симетрії 3 або 3;
тетрагональная - " " " " 4 або 3;
гексагональна - " " " " 6
або 6.
Вища категорія складається з єдиної системи -
кубічної, яка характеризується наявністю чотирьох осей
симетрії третього порядку.
Замість підрозділів на сім систем можна поділяти категорії на
шість сингоній. Поняття сингоній збігається з поняттям системи для всіх систем,
крім тригональної і гексагональної. Поділ на сингоній визначає вибір
кристалографічної системи координат і характеризує її трійки базисних векторів
а'а2, a3 i або, інакше кажучи, метрики a, ft, с, а, р, у.
Кристалографічні осі координат завжди вибираються за осях
симетрії або по нормалі до площин симетрії. Якщо немає відповідних елементів
симетрії, як у моноклінної і триклинной сингоніях, осі координат вибираються по
ребрах кристалографічного багатогранника або по рядах кристалічної решітки.
Примітивні елементарні комірки, що відповідають кожній сингоній, показані в
першому стовпці табл. 9.1 і в табл. 1.3.

Рис. 1.3 Розділ кристалів на категорії сингонії та системи
Застигання магми - це процес росту
кристалів з розплавів. При нагріванні тверді речовини розплавляються. Але
виявляється, що кристали і аморфні речовини (скло) плавляться зовсім
по-різному. Кожне кристалічна речовина починає плавитися при зовсім різній
температурі. Нагріємо, наприклад, кристал олова і будемо при цьому вимірювати
температуру: 100, 200, 225° С - кристал не змінюється. Раптом при 231,9° С
кристал відразу починає плавитися. Скільки б разів ми не повторювали цей
дослід, нам не вдасться розплавити кристал олова при 231° С або більш низькій
температурі і навпаки, нам не вдасться зберегти його при 232° С або більш
високій температурі: він обов'язково почне плавитися при 231, 9° С, якщо тільки
дослід робити при атмосферному тиску, якщо в олові немає домішок і якщо немає
явища переохолодження. Будемо продовжувати нагрівати плавлячий кристал олова.
Незважаючи на нагрівання, температура олова більше не підвищується: у весь час
плавлення вона залишається рівною 231,9° С. І тільки коли плавлення
закінчиться, температура олова - тепер вже не кристала, а рідкого розплаву -
почне збільшуватися - якщо, звичайно, продовжувати нагрівання.
При температурі плавлення руйнується кристалічна структура,
розпадається правильний лад частинок.
Для всіх кристалів однокової речовини, при постійних умовах
температура плавлення однакова, а для різних речовин вона різна. Кристал
кам'яної солі починає плавитися точно при 804° С, кристал кварцу при 1470° С.
Всі кристали під час плавлення зберігають постійну температуру. Саме на ці
властивості кристалів заснований пристрій термометра. Нуль градусів за шкалою
термометра - це температура, при якій в звичайних умовах тануть, тобто плавляться,
кристали льоду. Температура плавлення кристала залежить від тиску, під яким цей
кристал перебуває (рис. 2).
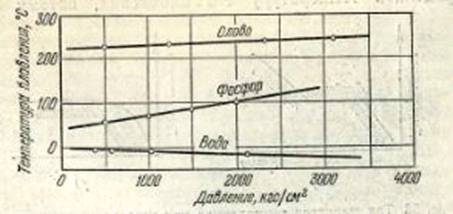
Рис. 1.4 Залежність температури плавлення кристалів від тиску
У дослідах з колосальними тисками аж до десятків тисяч
атмосфер вдалося міняти температури плавлення кристалів навіть на сотні
градусів. Наприклад, якщо підвищити тиск до 12 тисяч атмосфер, то температура
плавлення кристалів калію підвищиться з 62 до 179° С, а у кристалів аніліну
вона зросте ще сильніше: щоб розплавити під таким тиском кристал аніліну, його
доведеться нагрівати до 199° С, тоді як при атмосферному тиску він плавиться
вже при - 6° С. А ось у кристалів вісмуту при такому ж підвищення тиску
температура плавлення не збільшиться, а зменшиться: для плавлення достатньо
буде нагріти кристал вісмуту до 218° С, тоді як в нормальних умовах він
плавиться при 271° С Тиск впливає на температуру плавлення всіх кристалів, але
вплив для різних речовин особливий: в одних він сильніший, в інших слабший; у
деяких речовин при підвищенні тиску температура плавлення зростає, а в декого,
навпаки, знижується. Це особливо позначається в глибині Землі, де діють тиску в
мільйони разів більші, ніж на її поверхні. Тому в надрах Землі кристали
плавляться при інших температурах, ніж в лабораторіях. Але й там кристали
починають плавитися обов'язково при певній температурі, тільки температура ця
особлива для кожної області тиску.
На температуру плавлення впливають, крім тиску ще й інші
причини, наприклад домішки інших речовин в розплаві. Так, температури плавлення
чистого заліза і чистого кремнію дуже високі, а суміш оксидів цих елементів з
вапном плавиться при набагато нижчій температурі. На цьому заснований спосіб
виплавки заліза з руд, що містять кремнезем. У рудну суміш додають вапняк,
кремнезем, вапно і невелика частка заліза легкоплавкий шлак, який спливає і
виділяється від більш тугоплавкого чистого заліза.
1.3 Як
кристали ростуть з розчинів
Візьміть склянку гарячої води і всипте в нього синій порошок
мідного купоросу. Цей досвід можна виконати з будь-яким іншим кристалічним
розством, розчинним у воді гіпосульфітом, содою, борною кислотою, галуном,
англійською сіллю. Якщо ви дістанете не порошок, а крупні кристали, то спочатку
потовчіть їх в порошок. У склянку гарячої води всипте стільки порошку, скільки
зможе розчинитися. Помішуйте воду, так порошок буде розчинятися швидше. Коли
порошок зовсім перестане розчинятися і почне осідати на дно, злийте утворився
розчин в іншій стакан так, щоб на дно склянки з розчином не потрапило жодної
крупинки порошку. Для цього профільтрувати розчин через фільтрувальний папір
або через чисту ганчірочку. В отриманому розчині кількість речовини як раз
відповідає його розчинності при даній температурі. Розчин "наситився"
і більше він не може поглинути ні крупинки речовини. Такий розчин називається насиченим.
Тепер залиште склянку з розчином і дайте йому охолонути. При охолодженні
розчинність майже всіх речовин зменшується. Поки розчин був гарячим, у склянці
води було розчинено, скажімо, 12 ложок речовини, тоді як при вже не може
зберігатися пересиченим. Почнеться зростання кристалів, який буде йти до тих
пір, поки все зайве речовина не випаде у вигляді кристалів і розчин знову не
стане насиченим. У природних умовах, у кімнатній температурі в ньому могло б
розчинитися лише 10 ложок Цієї речовини. Таким чином, тепер в розчині виявилася
зайва речовина. Інакше кажучи, при високій температурі розчин був насиченим, а
охолонувши, він став пересиченим. Такий пересичений розчин не може довго
існувати, тому зайве речовина виділяється з розчину і осідає на дно склянки.
Розгляньте в лупу, і ви побачите, що цей осад складається з кристалів.
Розчинена речовина кристалізується з пересичених розчинів тому, що його
виявляється в розчині занадто багато - більше, ніж розчин може утримати в собі.
Якщо у вас вдома є тільки велика сіль, ви можете перекристалізовувати її в дрібну
столову сіль. Розчиніть сіль у воді, профільтруйте розчин через фільтрувальний
папір або чисту ганчірку і випарте цей розчин на повільному вогні. З розчину
осядуть дуже дрібні кристалики. Явище пересичення розчинів відкрив в 1803 р.
член Російської Академії наук Товій Єгорович Ловіц (1757-1804). Ловіц вказав,
що якщо розчин охолоджується в чистій закритій посудині і якщо при цьому немає
тряски, поштовхів, то розчин може деякий час, залишатися пересиченим, не
кристалізуючись. Але лише тільки в рідині виникає хоча б мікроскопічно
маленький кристалик, розчин відкритих водоймах, пересичений розчин не може
зберігатися без кристалізації.
1.4 Як
кристали ростуть з розплавів
Якщо нагріти кристал до температури плавлення, то він почне
плавитися. Охолодити до температури плавлення, рідкий розплав почне
кристалізуватися. Нагрійте чистий лід при атмосферному тиску до 0° С - він
розтане, тобто розплавиться і перетвориться у воду. Навпаки, охолодіть чисту
воду до 0° С - вона замерзне, перетвориться на кристали льоду. При нагріванні
до нуля градусів розсипається лад часток, руйнується кристалічна структура
льоду. А при охолодженні до нуля градусів безпосередньо частинки починають
збиратися правильним строєм: серед хаосу виникають зародки кристалічної
структури. Значить, температура плавлення кристалів даної речовини є в той же
час і температурою кристалізації його розплаву.
У масі застигаючого розплаву утворюється відразу багато
кристалічних зародків. Всі вони одночасно виростають в маленькі кристали. Поки
ці кристалики зовсім малі, вони ростуть вільно, кожен - правильним
багатогранником. Але, збільшуючись, кристали зустрічаються і починають заважати
один одному. Як тільки два зростаючих кристала зустрінуться один з одним,
зростання обох кристалів в цьому місці припиняється, адже жоден з них не може
відсунутися. З інших же сторін - там, де кристали ще не зіткнулися з сусідами -
вони продовжують рости. Так виходить, що кристал виростає в одну сторону
більше, ніж в іншу: утворюються не правильні багатогранники. Або ж, врешті-решт,
після запеклої "боротьби" виживають окремі кристалики.
Назва самої розповсюдженою, всім відомої гірської породи,
граніту, проходить від латинського слова "Гранум", тобто
"Зерно". У граніті легко розрізнити простим оком зерна димчастого або
безбарвного кварцу, рожевого, сірого, бузкового польового шпату, блискучі
лусочки слюди.
Так само застигає розплавлений метал. Заводський метал теж є
полікристал, тобто складається з багатьох монокристалічних зерен. Серед цих
зерен не зерен металу зазвичай абсолютно неправильні. Зустрічається правильних,
симетричних багатогранників форми всіх кристалічних Характерною властивістю
кристалів є їх багатогранна форма, тому, що якби це ж саме кристалічне зерно
росло не в тісноті, а так, щоб йому ніщо не заважало, то воно неодмінно набуло
б форму правильного багатогранника. Крива, не багатогранна форма - це не
звичайна, а вимушена форма кристала, йому довелося прийняти її тому, що не було
ні місця, ні матеріалу для утворення цієї вільно форми, властивої всім
кристалам, зростаючим без перешкоди. Дайте цьому кристалу рости вільної перед
вами знову виникне правильний симетричний багатогранник.
1.5 Не тільки
багатогранники
У природі кристали неправильної форми зустрічаються частіше,
ніж правильні багатогранники. У руслах річок через тертя кристалів про пісок і
камені кути кристалів стираються, багатогранні кристали перетворюються на
заокруглені камінчики - гальку. Від дії води, вітру, морозів кристали
розтріскуються, розсипаються в гірських породах кристалічні зерна заважають
один одному рости і набувають неправильні форми різні розчини і розплави
розчиняють, роз'їдають кристали, у результаті чого утворюються окатанниє,
"обсмоктавні", "поїдені" кристали. І все-таки властивості
всіх цих виродків і властивості чудових красенів багатогранників
однакові.
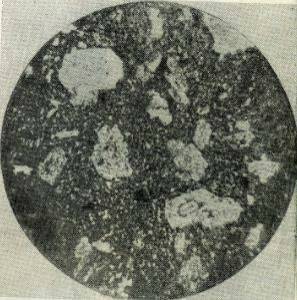

Рис. 1.4 Великі кристалічні зерна в мілко
кристалічній гірській породі. Збільшено в 60 разів.
Розділ 2.
Вирощування кристалів
2.1
Вирощування монокристалів з розплавів
Кристалізація відбувається при охолодженні нижче точки
насичення. Основними достоїнствами методу є те, що кристалізацію можна
проводити значно нижче температури плавлення одержуваного матеріалу. Недоліки:
забруднення елементами флюсу, необхідність у дуже точному регулюванні
температури, використання дорогих платинових і ін матеріалів тиглів.
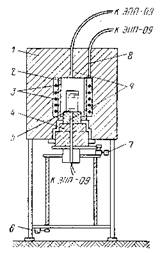
Рис. 2.5. Принципова схема установки для вирощування
кристалів з розплаву в розчині
- кристалізаційна піч,
- Циліндричний карборундовий екран,
- нагрівальні світові стрижні,
- під печі,
- тигель,
- пристрій для вертикального переміщення,
- пристрій для реверсивного обертання,
- термопередатчик,
- контрольні термопари.
До флюсів пред'являються такі вимоги: вони не повинні бути
летючими та токсичними, по можливості мінімально входити до складу
монокристалів (якщо не є їх компонентами), повинна бути помірна в'язкість
розплавів.
Наприклад, для вирощування кристалів феррограната (ЖИГ)
беруть шихту, що містить в мольна. %: 10 Y2O3, 20,4 Fe2O3, 36,8 PbO 27,1 PbF2,
5,5 B2O3. Склад кристалізується цільового продукту Y3Fe5O12 не відповідає за
співвідношенням концентрації основних компонентів складу розплаву, як і у
випадку кристалізації феритових кристалів з розчину, який був розглянутий нами
вище. Процеси росту монокристалів при реалізації їх технології підкоряються,
власне кажучи, тим же основним термодинамічним і кінетичним закономірностям, що
і синтез порошкових і плівкових матеріалів. Так найважливішим фактором є
високотемпературна фазова діаграма компонентів шихти в області ліквідусу і
солідусу. Зростання кристалів протікає через виникнення зародків, які можуть в
залежності від температури і хімічних потенціалів компонентів розчинятися або
рости далі, тобто можуть мати критичними розмірами і т.д.
За цим варіантом температура витримки розплаву 1250-1300оС
(15 годин), швидкість охолодження після цього до кристалізації 0,3-0,5 град /
год. Кристалізацію припиняють при 950-1000оС і видаляють залишився розплав,
отримані кристали очищають кип'ятінням в азотній кислоті. Швидкість обертання
тигля при вирощуванні 20 об / хв, обертання здійснюють 15 с в один бік і 15 с в
іншу з 5-секундною паузою.
2.2 Метод
Вернейля
Метод Вернейля реалізується шляхом просипкі маленьких порцій
порошкової шихти в трубчасту піч, та розплавляється підчас падіння в
киснево-водневому полум'я і живить краплю розплаву на поверхні затравки. Запал
при цьому витягується поступово вниз, а крапля перебуває на одному і тому ж
рівні по висоті печі. Переваги цього методу: відсутність флюсів і дорогих
матеріалів тиглів; відсутність необхідності точного контролю температури;
можливість контролю за зростанням монокристала. Недоліки: через високу
температуру росту кристали мають внутрішні напруги; стехіометрії складу може
порушуватися внаслідок відновлення компонентів воднем і випаровування летючих
речовин. Швидкість вирощування - кілька мм / год.
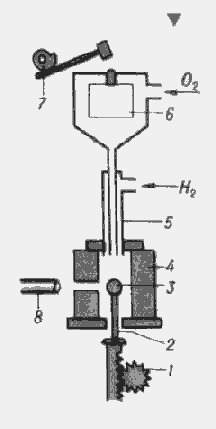
- механізм опускання кристала,
- кристалотримач,
- зростаючий кристал
- муфель, 5 - пальник, 6 - бункер,
- механізм струшування,
- Катетометри.
Рис.2.6. Схема установки для вирощування монокристалів по
методу Вернейля
2.3 Метод
Бріджмена
Метод Бріджмена - зароджуються в нижній частині тигля з
розплавом монокристали служать затравкою. Тигель опускається в більш холодну
зону печі. Нижня частина тигля - конічна. Швидкість вирощування - також кілька
мм / год.
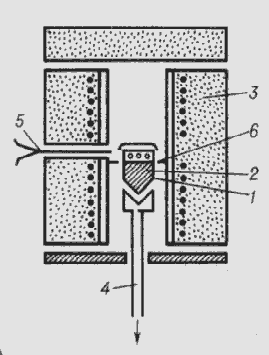
- тигель з розплавом,
- кристал,
- піч,
- холодильник,
- термопара,
- тепловий екран.
Рис. 2.7. Схема установки для вирощування монокристалівза
методом Стокаберга-Бріджмена
2.4 Метод
Чохральського
За методом Чохральського виробляють витягування вгору на
затравку монокристала з ванни з розплавом. Нагрівання зазвичай здійснюють за
допомогою НВЧ випромінювання. Для зняття виникаючих напруг використовують
додаткову піч, через яку проходить вирощуваний кристал і відпалювати.
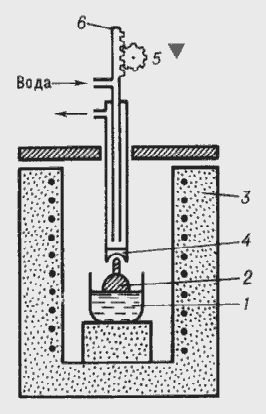
- тигель з розплавом,
- кристал,
- піч,
- холодильник,
,6 - механізм витягування.
Рис. 2.8 Схема установки для вирощування монокристалів за
методом Чохральського.
2.5 Метод
зонної плавки
Зонна плавка полягає в прогоні зони розплаву по довжині
заготовки монокристала, одночасно в зоні розплаву концентруються домішки і
відбувається очищення кристала, кінцеву частину якого потім видаляють.
Нагрівання здійснюється індукційним, радіаційно-оптичних чи іншим методом.
Швидкість вирощування за методами 4 і 5 близька до такої для 2 і 3 методів. При
реалізації трьох останніх способів необхідно регулювання газового середовища
вирощування.
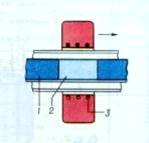
- тверда фаза,
- розплав,
- нагрівач, (стрілкою показаний напрям руху нагрівача)
Рис. 2.9. Схема пристрою для зонної плавки:
2.6
Гідротермальне вирощування
Вихідні оксиди або готовий складний оксид розчиняють у водних
розчинах кислот або лугів для реалізації гідротермального методу. Вирощування
проводять в автоклавах із захисними корозійностійкими вкладишами, наприклад,
для феритів при 375-725оС і тиску 1800-2000 атм. Через різницю температур у
верхній і нижній зонах автоклава вгорі виділяється кристал. Швидкість
вирощування - від часток мм до декількох мм на добу. Вирощувані монокристали
зазвичай мають високу якість і характерну кристалографічну огранювання, тобто
ростуть в умовах більш-менш близьких до рівноважних.
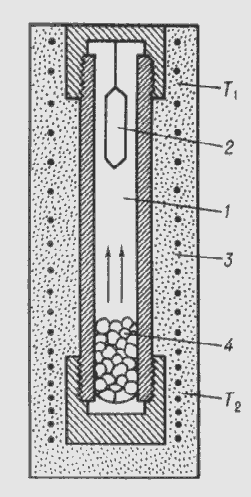
Рис. 2.10. Схема автоклава для гідротермального синтезу
- розчин,
- криcтал,
- піч,
(T1<T2).
2.7 Метод
твердофазної рекристалізації
Для вирощування кристалів шляхом твердофазної рекристалізації
призводять до зіткнення керамічну заготівлю та монокристалічний затравки, між
ними іноді поміщають речовина, що ініціює процес рекристалізації, зокрема, при
отриманні феритових кристалів - оксид заліза (тонкий шар). Якщо швидкість
рекристалізації перевищує швидкість виходу пір на поверхню, що отримується
кристал може бути досить пористим. Після отримання монокристалів їх точно
орієнтують в просторі і піддають механічній обробці: різанню, шліфуванню,
поліровці. Наприклад, монокристали ІЧ-оптики типу ВРХ (галогеніди талію)
обробляють через їх невеликий твердості на токарних верстатах в спеціальних
захисних боксах. На монокристали наносять захисні покриття і при необхідності
шари матеріалів різного функціонального призначення.
Висновки
В даній роботі була розказана мала доля того, що відомо про
кристали в наш час, але і ця інформація показала наскільки неординарні і
загадкові кристали по своїй сутності.
В ході даної роботи я спостерігала якими методами можна
вирощувати кристали.
В даний час відомі штучні способи вирощування кристалів. Їх
навіть можна вирощувати у звичайному стакані. Для цього потрібний лиш
спеціальний розчин та акуратність з якою потрібно слідкувати за кристалом, що росте.
У небі, надрах Землі, на вершинах гір, у піщаних пустелях, в
морях та океанах, у наукових лабораторіях, у клітинах живих і мертвих
організмах - усюди ми зустрінемо кристали. Ми також знаємо,що і на інших
планетах і на далеких зірках весь час неперервно виникають, ростуть і
руйнуються кристали. Метеорити також складаються з кристалів, навіть інколи в
їхній склад входять такі кристалічні речовини, які на Землі ще не зустрічалися
кристали повсюди.
Люди звикли використовувати кристали, робити з них прикраси,
любуватися ними. Кристали за їх міцності використовують в різноманітних ріжучих
апаратах. Людина використовує кристали майже у всіх областях мінеральної сфери,
їхня вартість і значення надзвичайно великі.
Тепер, коли вивченні методи штучного вирощування кристалів,
їхня область застосування розширилась, і, можливо, майбутнє нових технологій
належить кристалам і кристалічним агрегатам.
Перелік
посилань
1.
Шаскольская М.П. - Кристаллография. М.: Высшая школа, 2006. - 400 с.
.
Сиротин Ю.И., Шаскольская М.П. - Основы кристаллофизики М.: Наука, 2009. - 635
с.
.
Гончаренко С.У. - Фізика. К.: Освіта, 2012. - 319 с.
.
Шаскольская М.П. - Кристаллы. М.: Наука, 2008. - 208 с.
.
Трофимова Е.И. - Курс физики. М.: Академия, 2010. - 560 с.
.
Блудов М.І. - Бесіди з фізики. К.: Радянська школа, 2009. - 351 с.