Сравнительное исследование микробных сообществ щелочных слабоминерализованных гидротерм Байкальской рифтовой зоны и щелочных минерализованных гидротерм озера Моно-Лейк на острове Паоха
ВВЕДЕНИЕ
Актуальность проблемы. Системные исследования
мезофильных алкалофильных сообществ начались сравнительно недавно (Заварзин,
1993). Однако до последнего времени очень мало внимания уделялось изучению
организмов, способных существовать при высоких температурах и высоких значениях
рН (Wiegel, 1998).
Традиционными объектами исследования
микробиологов являлись гидротермы областей активного современного вулканизма и
молодого четвертичного вулканизма, с реакцией среды, близкой к нейтральной.
Термальные воды с рН>8.5 и температурой выше 45°C
широко распространены в природе (Басков, Суриков, 1989; Соломин, Крайнов,
1998). Физико-химические параметры щелочных термальных вод сильно отличаются от
нейтральных и кислых вод, что создает особые условия для существования
экстремофильных микроорганизмов. (Крайнов, Швец, 1980; Garrels,
Christ, 1959; Belkin
et al.,
1985). Микробные сообщества этих экосистем и факторы определяющие их
разнообразие изучены слабо. Сведения о видовом составе щелочных гидротерм были
разрознены (Компанцева, Горленко, 1988; Юрков и др., 1991; Бонч-Осмоловская и
др., 1999; Brock
et al.,
1971, Grant, Tindall,
1986; Duckworth
et al.,
1996; Marteinsson
et al.,
2001; Krienitz
et al.,
2003). Отсутствовали данные об интенсивностях продукционных и деструкционных
процессов
В настоящей работе впервые выполнено
сравнительное исследование видового состава и геохимической деятельности
микроорганизмов щелочных гидротерм с различной минерализацией и различным
химическим составом.
Целью настоящей работы являлось сравнительное
исследование микробных сообществ щелочных слабоминерализованых гидротерм
Байкальской рифтовой зоны (Б.р.з.) и щелочных минерализованых гидротерм озера
Моно-Лейк на острове Паоха.
Основные задачи исследования состояли в
следующем:
1. Изучение
состава микробных сообществ щелочных термальных источников в связи с изменением
физико-химических условий.
2. Изучение
активности продукционных и терминальных деструкционных процессов в фототрофных
и хемотрофных микробных сообществах в разных экологических зонах источников.
3. Исследование
экофизиологических особенностей термофильных микроорганизмов участвующих в
циклах углерода и серы в сообществах.
4. Изучение
участия микробных сообществ щелочных гидротерм в минералообразовании.
Научная новизна и практическая значимость.
Впервые исследованы микробные сообщества щелочных азотных гидротерм Б.р.з. и
минерализованного щелочного источника на острове Паоха озера Моно-Лейк
(Калифорния). Показано, что щелочные условия в комбинации с другими факторами
среды ограничивают распространение фототрофных сообществ, в минерализованных
щелочных источниках отсутствует термофильный цианобактериальный мат. В
фототрофных сообществах щелочных низкоминерализованных термальных источниках
доминируют цианобактерии, приспособленные к росту в щелочных условиях.
Алкалотолерантные аноксигенные фототрофные бактерии Chloroflexus
aurantiacus обнаружены только
в низкоминерализованных гидротермах при температурах от 65 до 35°С. Показано,
что микробные сообщества щелочных гидротерм обладают высокой продуктивностью,
сравнимой с микробными сообществами нейтральных гидротерм.
В щелочных минерализованных гидротермах рост
фототрофных сообществ начинается при температуре ниже 47°С. Термофильных
оксигенных и аноксигенных фототрофов в них не обнаружено. Из
высокотемпературной зоны источника (от 90 до 50°С) был выделен новый вид
анаэробной алкалотермофильной ферментирующей бактерии Anaerobranca
californiensis и показана
ее способность к восстановлению серы, тиосульфата, полисульфида, Fe(III),
Se(VI).
Показано участие термофильных фототрофных сообществ в травертинообразовании. В
лабораторных экспериментах установлено, что термофильная аноксигенная
фототрофная бактерия Chloroflexus
aurantiacus образует чехлы
накапливающие окисное железо в аэробных темновых условиях. Использование
закисного железа в качестве донора электронов при фотоавтотрофном росте этого
микроорганизма не наблюдалось. Полученные результаты принципиально важны для
развития представлений о функционировании циклов кальция, серы, железа, селена
в щелочных гидротермах.
Выделенные микроорганизмы могут быть
использованы при очистке горячих вод от неорганических соединений. Результаты
диссертации имеют значение для бальнеологической характеристики гидротерм
Байкальской рифтовой зоны.
Апробация работы. Результаты исследований
доложены автором на: Международной конференции "Thermophiles'98"
6-11 сентября 1998 г., Брест, Франция; Научной конференции "Проблемы
экологии и физиологии микроорганизмов: к 110-летию со дня рождения профессора
Е.Е. Успенского", 21 декабря 1999 г., Москва; Школе-конференции
"Горизонты физико-химической биологии", 28 мая-2 июня 2000 г.,
Пущино; Международной конференции "Central
Asian ecosystems
- 2000", 5-7 сентября 2000 г., Улан-Батор, Монголия; Международной
конференции "Экология Сибири, Дальнего Востока и Арктики", 5-8
сентября 2001, Томск; Региональной конференции "Природные ресурсы
Забайкалья и проблемы природопользования", 10-15 сентября 2001, Чита; ASM-meeting,
май 2002, США; I международном симпозиуме "Биокосные взаимодействия: Жизнь
и камень", 25-27 июня 2002 г., Санкт-Петербург; International
Geobiology
Course, 12 июня - 26 июля
2003 г., Каталина, Калифорния; Всероссийской конференции "Биоразнообразие
и функционирование микробных сообществ водных и наземных систем Центральной
Азии", 21-29 июля 2003 г., Улан-Удэ. Публикации. По теме диссертации
опубликовано 13 работ и 1 статья находится в печати.
Объем и структура диссертации. Материалы
диссертации изложены на 151 страницах, включая 21 таблицы и 30 рисунок.
Диссертация состоит из разделов "Введение", "Обзор
литературы", "Экспериментальная часть" (включающая главы
"Объекты и методы исследований", "Результаты и
обсуждение"), "Заключение", "Выводы" и "Список
литературы" (269 наименований).
Благодарности. Автор выражает глубокую
признательность научному руководителю д.б.н., проф. В.М. Горленко и сотрудникам
Лаборатории экологии и геохимической деятельности микроорганизмов ИНМИ РАН,
д.б.н., проф. Б.Б. Намсараеву и сотрудникам Лаборатории микробиологии ИОЭБ СО
РАН, проф. К. Nealson
и сотрудникам Geobiology
Laboratory
University
of Southern
California, сотрудникам
Института микробиологии РАН, родным и близким.
Исследование генотипических свойств проводилось
к.б.н. А.М. Лысенко (ИНМИ РАН). Анализ 16S
рРНК выполнила к.б.н. Т.П.Турова (ИНМИ РАН). Определение интенсивностей
микробных процессов проводилось совместно с В.И. Качалкиным (ИНМИ РАН) и к.б.н.
С.П. Бурюхаевым (ИОЭБ СО РАН). Определение видовой принадлежности цианобактерий
проводилось совместно с к.б.н. А.В. Брянской (ИОЭБ СО РАН). Исследования
тонкого строения клеток проводили совместно с Л.Л. Митюшиной (ИНМИ РАН). Пробы
керна Гаргинского травертина были предоставлены д. г.-м. н. А.М. Плюсниным (ИГ
СО РАН). Автор приносит искреннюю благодарность всем упомянутым участникам работы.
1. ОБЗОР ЛИТЕРАТУРЫ
.1 Характеристика основных типов щелочных
гидротерм
В настоящее время известно большое количество
классификаций термальных вод, использующие различные классификационные
признаки: температуру, рН, анионный и газовый состав, условия формирования
термальных вод (Посохов, 1975; Перельман, 1972; Басков, Суриков, 1989).
Поэтому, необходимо определить, какие именно источники в данной работе будут
считаться щелочными термальными.
В геологии принято считать воды термальными,
если их температура превышает 20°С (Басков, Суриков, 1989). С точки зрения
микробиологии важной температурной границей является температура 45°С
(Заварзин, Колотилова, 2001). Эта температура позволяет разделить местообитания
с доминированием мезофильных (с оптимумом около 30°С и максимумом до 45°С) и
термофильных (с оптимумом около 50°С) микроорганизмов (Wiegel,
1998). Поэтому, в данной работе к гидротермам будут отнесены источники с
температурой воды на изливе выше 45°С.
В данной работе значение рН отделяющее щелочные
воды от нейтральных составляет 8.0-8.5. Эта граница позволяет исключить из
рассмотрения широко распространенный тип углекислых термальных вод со
значениями рН от 4.5 до 8.5, в водах которых присутствует карбонат кальция. При
рН выше 8.5 воды становятся натриевыми, щелочность таких вод обуславливается
присутствием соды, либо присутствием силикатов или боратов (Перельман, 1966;
Соломин, Крайнов, 1998; Крайнов и др., 2001). С точки зрения микробиологии
значение рН 8.5 позволяет отделить местообитания с доминированием нейтрофильных
микроорганизмов от местообитаний с доминированием алкалофильных микроорганизмов
(оптимум рН выше 8.5) (Заварзин, Колотилова, 2001).
1.1.1 Основные типы щелочных гидротерм
Щелочные гидротермы широко распространены в
природе (рис. 1), но, в отличие от кислых гидротерм, гораздо менее изучены.
Существует несколько геохимических типов щелочных термальных вод, среди них
наиболее известными и геохимически значимыми являются азотные термальные воды и
сульфидные воды (Соломин, Крайнов, 1998).
Азотные термальные воды. По определению Крайнова
(Крайнов, Швец, 1980; Соломин, Крайнов, 1998) к щелочным азотным термальным
водам относятся азотные термальные воды массивов гранитоидных и вообще
кристаллических пород. Азотные термальные воды широко распространены в мире.
Большие области Центральной Азии, Индии, Восточной Сибири, Восточной Африки,
Южной Африки, Южной Америки, запада США, Европы, западные и восточные районы
Исландии (кроме центральных) относятся к провинции щелочных азотных термальных
вод (Крайнов, Швец, 1980). Геохимический облик этих вод определяется процессами
гидролитического разложения силикатов и потерей кислорода на окислительные
процессы, вследствие чего в их газовом составе начинает преобладать азот и
происходит частичное восстановление сульфатов с образованием гидросульфидных
ионов (Крайча, 1980).
Типичным примером азотных термальных вод могут
служить воды гидротерм Байкальской рифтовой зоны (Б.р. з.), ставших одним из
объектов нашего исследования. Температура воды на выходах достигает 81-83°С,
минерализация не превышает 1 г/л, рН до 10, состав HCO3-Na,
SO4-Na
с довольно высоким содержанием силикатов (до 100 мг/л). Гидрохимические данные
свидетельствуют об инфильтрационном происхождении гидротерм Б.р.з. (Барабанов и
др., 1968; Борисенко и др., 1978; Крайнов, Швец, 1980). Гидротермы формируются
в восстановительной обстановке вне зависимости от влияния магматических
процессов, что отличает гидротермы региона от гидротерм областей активного
вулканизма (Голубев, 1982). Даже по данным тех авторов, которые допускают
существование в гидротермах Б. р.з. магматогенных вод, доля последних не
превышает нескольких процентов (Ломоносов, 1974).
Другим характерным представителем азотных
термальных вод являются гидротермы зон рифтогенеза, характеризующихся
современным и позднечетвертичным магматизмом (Крайнов, Швец, 1980). Так, в зоне
рифта Восточной Африки формируются CO3(HCO3)-Na,
Cl-HCO3(CO3)-Na
термальные (до 97°С), щелочные (рН 811), минерализованные (до 50-60 г/л) воды,
содержащие до 300 мг/л и более фтора. Газовый состав этих вод характеризуется
высокой гелиеносностью (до 15-20 об. %). Химический состав этих вод обусловлен
взаимодействием с резкощелочными вулканическими породами, содержащими карбонаты
(в виде Na2CO3)
и соединения фтора. Примером могут служить термальные источники в районе озера
Богория (Кения) с рН 9, соленостью 3.5 мг/л и температурой от 35 до 100°С (Krienitz
et al.,
2003).
На западном побережье Северной Америки широко
распространены щелочные хлоридные азотные термальные воды (Басков, Суриков,
1989). Здесь известны источники хлоридного кальциевого-натриевого состава с
минерализацией до 15-20 г/л, вытекающие по зонам разломов из разнообразных
кристаллических (или сильнометаморфизированных вулканогенных и осадочных)
пород. Температура достигает 70-80°С. К особенностям данного типа вод относятся
преобладание среди анионов хлора и высокие содержания кальция, что приводит к
образованию характерных построек из карбоната кальция при смешении с
поверхностными водами, в частности на озере Моно Лейк (The
Mono Basin
Ecosystem, 1987).
Субаквальные гидротермы данного типа изучены
слабее наземных. Недавно у северного побережья Исландии во фьорде Эйджафьордур
на глубине 65-100 метров было обнаружено подводное гидротермальное поле.
Изливающиеся азотные воды имели рН 10, температуру 71°С, минерализацию 291 мг/л
и содержали 0.32 мг/л сульфида. В составе доминирует кремний (93.7 мг/л) и хлор
(44.7 мг/л), среди катионов натрий (79.2 мг/л). Гидротермальные постройки
сложены из силикатов, металлические сульфиды, характерные для черных
курильщиков, не были обнаружены (Marteinsson
et al.,
2001). Весьма вероятно также наличие термальных вод в крупных океанических
поднятиях, сложенных мощными вулканогенными толщами (Басков, Суриков, 1989). В
них могут быть встречены щелочные соленые воды хлоридного состава. Газовый
состав, возможно, азотный. Данная провинция субаквальных термальных вод
выделяется в порядке прогноза.
Сульфидные воды артезианских бассейнов. Среди
сульфидных вод щелочными (с рН до 9.5) являются только воды артезианских
бассейнов предгорных прогибов и межгорных впадин, имеющие минерализацию 5-50
г/л, HCO3-Cl-Na
или Cl-HCO3-Na
состав и высокие концентрации HS-
(Басков, Суриков, 1989; Соломин, Крайнов, 1998). Типичным примером могут
служить сульфидные воды Терско-Каспийского и Апшеронского бассейнов Кавказа.
Все эти воды формируются в молодых (чаще третичных) песчано-сланцевых и
карбонатных породах. Глубина формирования этих вод достигает 1-2.5 км,
температура может доходить до 70°С и выше, хотя в отдельных структурах,
например, Молдавском артезианском бассейне, эти воды могут быть холодными.
Процесс сульфатредукции активизируется в присутствии в породах органических
веществ и источников сульфатов, которыми достаточно часто являются гипсы
вмещающих пород. При высокой гипсоносности пород воды приобретают HCO3-SO4(Cl)-Na
и SO4-HCO3(Cl)-Na
состав. В местах с повышенной интенсивностью сульфатредукции концентрация
сульфидной серы могут достигать сотен мг/л (максимально до 1 г/л). Данный тип
щелочных термальных вод в рамках настоящей работы не был исследован.
.1.2 Свойства щелочных термальных вод
Состав. В исследованных нами пресноводных
гидротермах Б.р.з. содержание основных элементов (Ca
, Mg , Na
, K , Cl
, SO4 и HCO
) приведено в таблице 1 (см. раздел "Объекты и методы исследования").
В катионном составе термальных вод доминирует натрий, более активно чем кальций
переходящий в воду при гидролитическом разложении силикатов при повышенной
температуре (Крайнов, Швец, 1980). В анионном составе, как правило, доминирует
сульфат (Ломоносов, 1974; Соломин, Крайнов, 1998; Замана, 2000а,б). В составе
термальных вод также обнаружено высокое содержание гидрокарбонатных ионов, что
объясняется реакцией нейтрализации углекислым газом гидроксидной группы,
образующейся при гидролизе силикатов (Замана, Пиннекер, 1999).
При рН выше 9 и повышении температуры
растворимость и диссоциация на ионы ортокремниевой кислоты (H4SiO4)
резко возрастает (Го Окамото и др., 1963; Посохов, 1975; Крайнов, Швец, 1980).
Поэтому щелочные термальные воды содержат высокие содержания кремния (до 180
мг/л SiO2).
Накоплению в гидротермах кремния способствует также высокие давления, при
которых уменьшается устойчивость силикатов, и повышенное содержание в растворах
солей натрия, способствующее повышению растворимости кремнезема. Судя по
максимальной растворимости аморфного кремнезема в щелочных условиях (300-1000
мг/л), исследованые гидротермы Б. р. з. недонасыщены кремнием. Об этом же
свидетельствует и отсутствие в районе выхода гидротерм значительных отложений
кремнезема (Ломоносов, 1974).
В щелочных термальных водах обнаруживаются также
относительно высокие концентрации фтора, селена, вольфрама, молибдена,
германия, бора. Возрастание их концентраций обусловлено общими свойствами
анионогенных элементов. Степень диссоциации их кислот возрастает с ростом
щелочности среды по общей схеме
Н2А -> H+
+ HA-
-> 2H+ +A2-.
Натриевые соли образующихся при этом анионов
хорошо растворимы и могут накапливаться в значительных концентрациях (Крайнов,
Швец, 1980).
Щелочность. Щелочные термальные воды содержат
сильные катионогенные элементы (Na+,
K+) и анионы слабых
кислот (HCO3-,
CO32-,
HS-,
H2BO3-,
H3SiO4-
и др.). Гидролиз этих анионов сопровождается разложением воды и образование
ионов ОН-. При химическом анализе вод обычно предполагается, что
щелочность обуславливается ионами карбонатной системы (CO32-
+ H2O
-> HCO3-
+ OH-,
HCO3-
+ H2O
-> H2CO3
+ OH-),
но это не совсем верно для щелочных термальных вод. В азотных термальных водах
щелочность в основном связана с силикатными ионами, в сульфидных термальных
водах щелочность обуславливается присутствием боратов и карбонатов (Крайнов,
Швец, 1980; Соломин, Крайнов, 1998).
Влияние щелочных условий на миграцию элементов.
В щелочных водах более активно мигрируют анионогенные элементы (S,
Ge, Sn,
Sb, As,
V, Mo,
Se, U,
F, B,
Si и т.д.), тогда как
катионогенные элементы (Ba,
Cu, Zn,
Fe2+,
Mn2+,
Ni2+
и др.) в щелочных условиях часто образуют слаборастворимые соединения
(Перельман, 1972). Тем не менее, щелочные воды нельзя считать запретными для
миграции катионогенных элементов, так как они могут мигрировать в виде
комлексов с анионами этих вод (хлоридные, сульфатные, гидрокарбонатные и др.
комплексы). Также миграция элементов может происходить в виде гидросульфидных
комплексных соединений в сероводородсодержащих водах или в виде комплексных
соединений с органическим веществом. (Крайнов, Швец, 1980; Кирюхин и др., 1982;
Илялетдинов, 1984; Шпейзер, 1999; Ehrlih,
1981; Bender
et al.,
1994).
Влияние щелочных условий на переменновалентные элементы.
Термальные воды содержат большое число элементов с переменной валентностью,
которые могут служить донорами или акцепторами электронов для микроорганизмов.
Из уравнения Нернста следует, что увеличение рН среды приводит к уменьшению
окислительно-восстановительного потенциала (ОВП), при котором происходит
окисление соединений какого-либо элемента. Поэтому в щелочных водах окисление
происходит легче и энергичнее, чем в кислых. Например, двухвалентное железо
очень легко окисляется в трехвалентную форму в щелочных водах (Е0
< -100 мВ), но очень трудно в кислых (Е0 +771 мВ). То же верно и
для многих других элементов (Крайнов, Швец, 1980). Прогнозирование поведения
элементов при различном рН может быть сделано на основании Eh-pH
диаграмм, разработанных Гаррелсом и Крайстом (Garrels,
Christ, 1965).
Соответствие термодинамическим данным является необходимым условием любой
гипотезы, относящейся к круговоротам элементов с переменной валентностью
(Заварзин, 1972б). Хотя необходимо учитывать, что Eh-рН
диаграммы характеризуют равновесные условия и указывают, в каком направлении
пойдет реакция, если она начнется. Термодинамические данные не позволяют судить
о скорости реакции и не утверждают, что возможная реакция обязательно
произойдет в действительности (Перельман, 1966; Стащук, 1968).
Серные соединения в щелочных условиях. Среди
переменновалентных элементов сера играет важнейшую роль, как в определении
геохимического облика термальных вод, так и в функционировании микробного
сообщества гидротерм.
Щелочные условия оказывают большое влияние на
восстановленные соединения серы. При рН выше 7.7-8.5 доминирует
гидросульфид-ион, а не сероводород. Гидросульфид более устойчив к окислению,
чем недиссоциированный сероводород. Кроме того, гидросульфид менее токсичен для
клетки, так как анион сульфида с трудом проникает сквозь клеточную мембрану.
Молекулярная сера слабо устойчива при рН выше 8. В присутствии
гидросульфид-иона элементная сера образует полисульфид (Roy,
Trudinger, 1970; Schauder,
Kroger, 1993; Schauder,
Muller, 1993). Тиосульфат
устойчив при рН выше 4-5, при более низких значениях тиосульфат быстро
разрушается до серы и бисульфита, либо диоксида серы, элементной серы и
политионатов (-O3S-Sn-SO3-).
В щелочных условиях политионаты разрушаются с образованием тиосульфата, либо
сульфита, сульфата и элементной серы (Roy,
Trudinger, 1970).
Повышение температуры оказывает влияние на
полиморфные превращения элементной серы. При температуре 95°С сера переходит из
более устойчивой орторомбической формы в моноклинальную. При температуре 119°С
происходит плавление (Roy,
Trudinger, 1970). При
температурах выше 80°С сера диспропорционирует на гидросульфид и тиосульфат
согласно реакции S8 + 8OH-
-> 2S2O32-
+ 4HS-
+ 2H2O
(Roy, Trudinger,
1970; Belkin
et al.,
1985). Добавление дрожжевого экстракта (до 1 г/л) стимулирует абиогенное
восстановление, дальнейшее увеличение содержание дрожжевого экстракта не
оказывает влияния на восстановление серы. Абиогенная сероредукция сильно
зависит от рН среды. Повышение рН на 1 единицу приводит к 10-60-кратному
увеличению продукции сульфида (опыт проводился в диапазоне рН 5.5-8.0 при
температуре 98°С) (Belkin
et al.,
1985).
.2 Распространение и состав микробных сообществ
в зависимости от физико-химических факторов среды
В термальных источниках распространение эукариот
ограничено 45-55°С (Brock,
1967а; Castenholz,
1969; Wickstrom,
Castenholz, 1985). Поэтому
микробные сообщества гидротерм представляют значительный интерес с точки зрения
эволюции биосферы и, по мнению многих исследователей, являются аналогами
сообществ, доминировавших на ранних этапах развития жизни на Земле (Заварзин,
1972а, 1997, 2001; Baross,
Hoffman, 1985; Nisbet,
1986; Walter
et al.,
1998).
Микробные сообщества гидротерм можно разделить
на два типа: с доминированием фототрофных микроорганизмов и с доминированием
хемотрофных микроорганизмов. Хемотрофные сообщества часто развиваются в виде
обрастаний. Фототрофные сообщества в гидротермах, при отсутствии выедания со
стороны эукариотных организмов, могут обладать значительной биомассой и
образовывать микробные маты - органоминеральные структуры, отличающиеся от
бактериальных обрастаний своей оструктуренностью (слоистостью) (Cohen
et al.,
1989). Граница между фототрофными и хемотрофными сообществами определяется,
по-видимому, устойчивостью фотосинтетического аппарата к факторам окружающей
среды, в первую очередь к температуре (Brock,
1978). В источниках с рН 5-10 верхняя температурная граница распространения
фототрофного микробного мата расположена при 61-73°С. В кислых гидротермах с рН
1-5 развитые маты встречаются только при температурах ниже 55°С и образованы из
эукариотической водоросли Cyanidium
caldarium (Castenholz,
1969, 1984; Hiraishi
et al.,
1999). При более высоких температурах, либо при отсутствии света развиваются
хемотрофные сообщества.
.2.1 Микробные сообщества щелочных гидротерм
Фототрофные микробные сообщества были
исследованы на щелочных гидротермах Байкальской и Восточно-Африканской рифтовых
зон. Показано, что в микробных матах пресных источников Байкальской рифтовой зоны
присутствуют цианобактерии и аноксигенные фототрофные бактерии (АФБ). Так, по
изливу источника Котельниковский (рН 9.2-9.8, Т 60°С, сульфид 6 мг/л)
развивается три типа матов. При температуре 50-60°С доминируют нитчатая
цианобактерия Phormidium
sp. и термофильная
нитчатая АФБ Chloroflexus
aurantiacus, при 50-45°С
доминируют нитчатые цианобактерии Oscillatoria
sp. и Phormidium
sp., в меньшем
количестве представлены одноклеточные цианобактерии Synechococcus
sp. и Gloeocapsa
sp. При температуре
25-35°С на смешении термальных вод и вод озера Байкал развиваются обрастания Thiotrix
sp. Численность Chloroflexus
aurantiacus учтенная методом
посева не превышала 104 кл/мл, несерных пурпурных бактерий Rhodopseudomonas
palustris -105
кл/мл, Rh. gelatinosus
- 105 кл/мл (Горленко и др., 1985; Компанцева, Горленко, 1988).
Также из источников Б. р.з. (Республика Бурятия: источники Ильинский,
Аллинский, Кучигерский, Сеюйский, Гаргинский) с рН 8-9 были выделены культуры Meiothermus
ruber и, в меньшем
количестве, Thermus
flavus. Также
представлены спорообразующие формы и целлюлозолитические бактерии с оптимумом
развития при температуре 50°С и рН 8 (Храпцова и др., 1984).
На Большереченском источнике (Т 72-74°С, рН
9,25, сульфид 13.4 мг/л) в зоне излива фототрофные микробные маты отсутствуют.
Высказано предположение, что это связано с одновременным присутствием сульфида
и кислорода в воде источника. В микробных матах источника доминируют нитчатые
цианобактерии рода Phormidium,
также из матов был выделен ряд неизвестных ранее аноксигенных фототрофных
бактерий (Юрков, Горленко, 1989, 1990, 1991, 1992; Юрков и др., 1992). Более
подробная информация о микробном сообществе Большереченского источника
приведена в разделе "Результаты".
В зоне Восточно-Африканского рифта были
исследованы микробные сообщества развивающиеся по изливу гидротерм около озера
Богория (Кения, рН 8.5-9.5, Т 35-100°С, минерализация до 3.5 мг/л). В составе
матов доминируют цианобактерии Synechococcus
bigranulatus, Spirulina
subsalsa, Phormidium
terebriformis, Oscillatoria
willei (Krienitz
et al.,
2003). Также в значительном количестве присутствует Chloroflexus
sp. (Grant,
Tindall, 1986). Из
источников было выделено два штамма "Thermopallium
natronophilumT,
принадлежащих к порядку Thermotogales
(Duckworth
et al.,
1996).
Хемотрофные микробные сообщества в виде
обрастаний были обнаружены в источнике Боулдер спринг (Йеллоустон) при
температуре 90-93°С, рН 8.9 и содержании сульфида 3 мг/л. При исследовании
стекол обрастания были обнаружены миксотрофные сероокисляющие бактерии,
использующие ацетат (Brock
et al.,
1971). В источниках Накабуса (Япония) хемотрофные микробные обрастания
развивались при температурах 76-66°С, рН 8.5 и 8.7, содержании сульфида 2.5 и
0.9 мг/л. В составе сообщества по данным DGGE
доминировали представители Thermodesulfobacteria
sp., Thermus
sp., Staphylothermus
marinus, Sulphobococcus
zilligii. Представители Aquifex
доминировали в одном из источников Накабуса с рН 7.3, но в щелочных источниках
обнаружены в малом количестве (Nakagawa,
Fukui, 2002). . Также из
мата были выделены культуры Roseiflexus
castenholzii и Chloroflexus
aurantiacus (Hanada
et al.,
2002).
В пробах из гейзера Удачный (долина Гейзеров,
Камчатка) с рН 8.5, азотного типа, было зафиксировано литотрофное образование
метана при 60°С, в полученных накопительных культурах доминировали тонкие
палочки фенотипически сходные с Methanobacterium
thermoautotrophicum
(Бонч-Осмоловская и др., 1999).
Из субаквальных гидротерм изливающихся на
литорали фьорда Эйджафьордур (Исландия) с рН 10, температурой 71°С,
минерализацией 291 мг/л и содержанием сульфида 0.32 мг/л было выделено 50
штаммов аэробных бактерий. Все штаммы способны к росту при 60-65°С и рН 9.0, 20
штаммов способны расти при рН 10. По результатам анализа 16S-рРНК бактерии были
отнесены к видам Geobacillus
thermoleovorans, "G.
caldotenax", G.
flavothermus, G.
caldovelox, G.
thermodenitrificans,
G. caldoxylozilyticus
и Thermonema
sp. (Marteinsson
et al.,
2001). Примечательно, что типовые штаммы данных организмов не способны расти
при рН выше 8 (Назина, Григорьян - личное сообщение). Также был выделен
анаэробный организм, археобактерия Desulfurococcus
mobilis (Marteinsson
et al.,
2001). Анализ нативной ДНК с помощью 16S
рРНК-ориентированных праймеров показал, что большинство последовательностей
принадлежат эубактериям (45 клонов), археобактерии представлены 10 клонами (Korarchaeota).
Большинство эубактериальных клонов (31 клон) относятся к группе Aquificales,
из них к Hydrogenobacter
thermophilus принадлежит 15
клонов. Также были обнаружены последовательности принадлежащие к группам Nitrospira,
Firmicutes (Propionibacterium
acnes), б-Proteobacteria
(Caulobacter
crescentus), в-Proteobacteria
(Alcaligens
sp.). Представители
рода Thermus
не были обнаружены (Marteinsson
et al.,
2001).
микроорганизм щелочной минерализация геохимический
1.2.2 Микробные сообщества нейтральных гидротерм
Фототрофные микробные сообщества нейтральных
гидротерм исследованы более подробно чем сообщества щелочных гидротерм. Данные
сообщества могут быть разделены на два типа: маты с доминированием
цианобактерий (цианобактериальные маты) и маты с доминированием АФБ
("Аноксигенные маты").
Кастенхольц выделяет несколько основных типов
цианобактериальных матов в зависимости от особенностей их строения (Castenholz,
1984).
) Мат с "обычной вертикальной
последовательностью" доминирует в гидротермах с содержанием сульфида менее
1 мг/л в широком диапазоне температур (до 73°С). В верхнем слое толщиной 1-2 мм
доминируют термофильные цианобактерии, в нижнем слое, как правило, доминирует термофильные
нитчатые АФБ (Castenholz,
1984; Ramsing
et al.,
2000; Nubel
et al.,
2002). Благодаря различающемуся составу пигментов, поглощающих свет разных длин
волн, слои не затеняют друг друга, и фотосинтез может происходить до глубины
3-4 мм. Под матом расположена зона деструкции, с доминированием
сульфатредукторов или метаногенов. В микробном мате источника Октопус спринг
значительной численности достигает термофильная цианобактерия Synechococcus
lividus (до 1010
кл/мл), бродильщик Thermobacteroides
acetoethylicus (до 107
кл/мл) и метаноген Methanobacterium
thermoautotrophicum
(до 107 кл/мл). Меньшей численности достигают бродильщики Clostridium
thermohydrosulphuricum
и C. thermosulfurogenes
(до 103 кл/мл) (Bauld,
Brock, 1974; Wiegel
et al.,
1979; Zeikus
et al.,
1980; Ben-Bassat,
Zeikus, 1981; Schink,
Zeikus, 1983; Ward
et al.,
1998). Также из микробного мата были выделены АФБ Chloroflexus
aurantiacus, Heliotrix
oregonensis, Roseiflexis
castenholzii и Heliobacterium
modesticaldum, аэробные
хемоорганототрофные бактерии Thermomicrobium
roseum, Isosphaera
pallida, Thermus
aquaticus, Meiothermus
ruber, бродильщики Thermoanaerobacter
brockii, Th.
ethanolicus, Thermoanaerobacterium
thermosulfurigenes, Moorella
thermoautotrophica,
сульфатредуцирующая бактерия Thermodesulfotobacterium
commune (Ward
et al.,
1998). Анализ выделенной из природных образцов нативной ДНК с помощью 16S
рРНК-ориентированных праймеров и зондов разной степени специфичности показал,
что наибольшее число последовательностей принадлежит цианобактерии Synechococcus
lividus (около 30%), также
в мате обнаружены последовательности принадлежащие цианобактериям Oscillatoria
amphigranulata, Pseudoanabaena
galeata. Значительное
количество последовательностей принадлежит к некультивируемым видам. Интересно,
что генетические методы показали большее разнообразие популяций Synechococcus
и Chloroflexus чем считалось
ранее. В мате присутствует одновременно до 3-9 популяций, принадлежащих к
одному роду или виду (Bateson
et al.,
1989; Weller
et al.,
1992; Ferris
et al.,
1996; Ward
et al.,
1998; Nubel
et al.,
2002).
2) Особенностью
"перевернутых матов" является расположение слоя АФБ над слоем
цианобактерий. Образование этого типа мата связано с способностью некоторых АФБ
существовать в аэробных условиях. Heliotrix
oregonensis, не обладающий
хлоросомами и нуждающийся в более высокой интенсивности света чем
близкородственный Chloroflexus
aurantiacus, образует
поверхностный слой мата над слоем цианобактерий в слабощелочных бессульфидных
(Варм спрингс: рН 8.5, Т 35-56°С, сульфид - менее 1 мг/л, кислород - 6 мг/л)
гидротермах Орегона (США) (Castenholz,
1984; Pierson
et al.,
1984). Образование "перевернутого мата" также может быть связано с
большей толерантностью АФБ к сульфиду чем цианобактерий (Ward
et al.
1989). В источнике Йистихвер спринг (Исландия) при температуре 58-60°С, рН
около 8.5 и содержании сульфида 1.3-2 мг/л развивается микробный мат, в котором
Chloroflexus
sp. развивается над
слоем цианобактерии Chlorogloeopsis
sp. При этом Chloroflexus
sp. использует сульфид
содержащийся в воде источника и тем самым создает нишу для развития Chlorogloeopsis
sp. чувствительной к
сульфиду и осуществляющей оксигенный фотосинтез (Jorgensen
et al.,
1988). Аналогичный тип мата обнаружен в источнике Термофильный в кальдере Узон
при температуре 60-62°С и содержании сульфида 7.7-8.5 мг/л. В нем под слоем АФБ
Chloroflexus
aurantiacus расположен слой с
доминированием цианобактерий Phormidium
sp. и Synechococcus
lividus (Горленко,
Бонч-Осмоловская, 1989).
3) "Прозрачные
маты" развиваются при температурах около 45°С и отличаются от других
значительной толщиной (до 5-6 см). По мнению Кастенхольца (Castenholz,
1984) его развитие возможно благодаря тому, что кальцификация, отложение
кремния или резко изменяющаяся температура воды препятствовуют развитию
эукариотных организмов разрушающих мат. В составе мата доминируют цианобактерии
рода Phormidium,
образующие большие количества прозрачного полисахаридного геля и относительно
небольшое количество хлорофилла. Это позволяет свету проникать на глубину до
1.5 см и фотосинтез происходит на больших глубинах чем в матах с доминированием
Synechococcus
lividus (Castenholz,
1984).
Особенностью "аноксигенных матов"
является отсутствие, либо незначительное количество цианобактерий в составе
микробного мата. Существование подобных матов имеет эволюционное значение, так
как показывает, что образование древнейших строматолитов могло быть не
связанным с цианобактериями и оксигенным фотосинтезом (Ward
et al.,
1989). Вард с соавторами выделяют несколько типов "аноксигенных
матов" в зависимости от доминирующей в составе мата АФБ (Ward
et al.,
1989).
)"Мат Chloroflexus".
Микробные маты с доминированием Chloroflexus
aurantiacus развиваются в
сульфидсодержащих гидротермах (более 1 мг/л) при температурах выше 50°С. Это
источники Нью Пит Спринг (Йеллоустон) температура развития мата 52-58°С, рН
6.3, содержание сульфида 1 мг/л; Маммот спринг (Йеллоустон), температура
50-65°С, содержание сульфида 1.5-8 мг/л, рН 6.2-6.8; Бадстофухвер (Исландия) с
температурой развития мата 65-70°С, рН 8.3 и содержанием сульфида 1 мг/л (Giovannoni
et al.,
1987; Madigan
et al.,
1989; Ward
et al.,
1989; Skirnisdottir
et al.,
2000). Анализ нативной ДНК с помощью 16S
рРНК-ориентированных праймеров показал, что в мате развивающемся в источнике
Бадстофухвер цианобактерии представлены в небольшом количестве (2 клона из 123,
около 1%). 45% клонов было близко Chloroflexus
aurantiacus, который,
очевидно, является первичным продуцентом в этом мате. Следующими, по убыванию
встречаемости клонов, были группы: Aquificales
(Calderobacterium
hydrogenophilum, Thermocrinis
ruber), Thermus-
Deinococcus (Thermus
sp.), Meiothermus
(Meiothermus
ruber), Nitrospira
(Thermodesulfovibrio
sp.), Thermotogales
(Fervidobacterium
gondwanalandicum), Stigonematales
(Chlorogloeopsis
sp.), Proteobacteria
(Craurococcus
roseus, Thiobacillus
hydrothermalis). 4
выделенных клона не могли быть отнесены к каким-либо известным группам (Skirnisdottir
et al.,
2000).
2) "Мат
Chromatium". Мат с
доминированием Chromatium
tepidum развивается при
более низких температурах и обнаружен в источнике Роландс велл (Йеллоустон),
температура развития мата 52-55°С, рН 6.3, содержание сульфида 1.3 мг/л (Madigan
et al.,
1989; Ward
et al.,
1989).
3) "Мат
Chlorobium". Мат с
доминированием Chlorobium
tepidum обнаружен в
источнике Травелодж стрим (Новая Зеландия), температура 42-56°С, рН 5.3-7.1,
содержание сульфида 9-27 мг/л (Ward
et al.,
1989; Castenholz
et al.,
1990).
Доминирование в составе микробного мата в одних
случаях аноксигенных, а в других случаях оксигенных фототрофных бактерий
Кастенхольц связывает с различным содержанием сульфида в воде гидротерм. По его
мнению, содержание сульфида выше 0.96-1.92 мг/л при рН 6-10 и температуре выше
55°С полностью исключает развитие цианобактерий и создает условия для
доминирования АФБ (Castenholz,
1984). Тем не менее, эта гипотеза не объясняет, почему в источниках с высоким
содержанием сульфида и высокой температурой (Термофильный и Ийстихвер спринг)
цианобактерии развиваются в большом количестве под слоем АФБ и чисто
"аноксигенного" мата не возникает.
В термофильных хемотрофных сообществах
первичными продуцентами являются хемолитоавтотрофные микроорганизмы циклов серы
и железа (Бонч-Осмоловская, Заварзин, 1989; Jannasch,
Mottl, 1985; Moyer
et al.,
1995; Kashefi
et al.,
2002). При температуре 65-93°С, рН от 6.7 до 8.3, содержании сульфида свыше 1
мг/л развивается микробное сообщество с доминированием микроаэрофильных
хемолитотрофных микроорганизмов, часто образующих космы белого цвета с
выпадением глобул элементной серы на поверхности. Анализ нативной ДНК с помощью
16S
рРНК-ориентированных праймеров показал, что в исследованных гидротермах 27-74%
последовательностей принадлежит представителям группы Aquifex-Hydrogenobacter,
способных к аэробному хемолитотрофному росту используя водород и соединения
серы в качестве доноров электронов. Второй по значимости группой являются
представители Proteobacteria.
В меньших количествах представлены последовательности принадлежащие Thermodesulfobacterium,
Thermodesulfovibrio,
Thermus, Thermotogales,
зеленым несерным бактериям. До 30% эубактериальных последовательностей
принадлежит неизвестным группам организмов. Из представителей археобактерий
были обнаружены последовательности близкие к представителям родов Pyrobaculum,
Pyrodictium, Thermophilum,
Archaeoglobus, Desulfurococcus
и последовательности принадлежащие к группе Korarchaeota
(до 77% клонов археобактерий) (Barns
et al.,
1994; Barns
et al.,
1996; Blank
et al.,
2002; Huber
et al.,
1998; Hugenholtz
et al.,
1998; Skirnisdottir,
2000; Reysenbach
et al.
1994; Yamamoto
et al.,
1998; Reysenbach
et al.,
2000а).
О сообществе "Thermothrix"
известно немного. Было показано, что в гидротермах с температурой 65-85°С, рН
около 7 и содержанием сульфида свыше 1 мг/л развивается сообщество основанное
на жизнедеятельности Thermothrix
thiopara или Thermotrix
azorensis Эти бактерии,
относящиеся к fi-Proteobacteria,
окисляют глубинный сероводород до элементной серы, которая откладывается на
поверхности бактериальных обрастаний, приобретающих вид белых "косм"
(Бонч-Осмоловская и др., 1987; Бонч-Осмоловская, Заварзин, 1989; Caldwell
et al.,
1976; Odintsova
et al.,
1996). Обращает на себя внимание то, что физико-химические факторы среды, при
которых развивается сообщество "Thermothrix",
совпадают с условиями развития сообществ с доминированием представителей группы
Aquifex-Hydrogenobacter.
Не ясно, какие именно факторы среды способствуют развитию того или иного типа
сообществ.
В субаквальных гидротермах рН флюида, как
правило, не превышает 4.5 (Von
Damm, 1995). Тем не
менее, при смешении с морскими водами возникает резкий градиент
физико-химических условий. рН изменяется от 3-5 до 6-7 и температура от 300°N
(в наиболее высокотемпературных глубоководных гидротермах) до 4-20°С. Поэтому в
гидротермальных системах создаваются условия для развития нейтрофильных
термофильных микроорганизмов (Sievert
et al.,
1999; Takai
et al.,
2001). Литотрофные термофильные микроорганизмы полученные в настоящее время в
чистых культурах включают метаногены, сульфат-, тиосульфат-, сероредукторы и
денитрификаторы, а также факультативные анаэробы. Наибольшим количеством видов
представлены метаногены, представители родов Methanococcus
и Methanopyrus.
Сульфатредуцирующие археи представлены родом Archaeoglobus.
Органотрофные термофильные бактерии представлены родами Thermococcus,
Pyrococcus, Staphylothermus,
Hyperthermus, Pyrodictium
(Бонч-Осмоловская, 2002). Анализы нативной ДНК с помощью 16S
рРНК-ориентированных праймеров показали, что в субаквальных гидротермах
присутствуют представители филогенетических групп эубактерий: e-Proteobacteria,
в-Proteobacteria, Desulfurobacterium,
Aquificales. Археи
представлены:
Archaeoglobales, Thermococcales, Thermopasmales (Reysenbach et al., 2000б;
Takai et al., 2001). В функционировании хемотрофных
микробных сообществ важную роль играет окисление восстановленных соединений
серы поступающих с флюидом на границе с кислород содержащими океаническими
водами (Jannasch,
Mottl, 1985; Karl
et al.,
1980). Большое количество окислов железа, вероятно бактериального
происхождения, в районах субаквальных гидротерм может свидетельствовать о
высокой роли окисления железа в функционировании сообщества (Намсараев и др.,
1991; Горшков и др., 1992; Juniper
et al.,
1988; Puteanus
et al.,
1991; Duhig
et al.,
1992; Stoffers
et al.,
1993; Bogdanov
et al,.
1997; Iizasa
et al,.
1998; Little
et al.,
1999; Trewin, Knoll,
1999; Preat
et al.,
2000; Emerson,
Moyer, 2002). Также
заметную роль может играть окисление метана (Гальченко, 2002; Teske
et al.,
2002).
.3 Активности продукционных и терминальных
деструкционных процессов в фототрофных и хемотрофных микробных сообществах
гидротерм
.3.1 Микробные сообщества щелочных гидротерм
Определение интенсивностей продукционных и
терминальных деструкционных процессов в фототрофных микробных сообществах
щелочных гидротерм ранее не проводилось.
Хемотрофные микробные обрастания были
исследованы в источнике Боулдер спринг (Йеллоустон) с температурой 90-93°С, рН
8.9 и содержанием сульфида 3 мг/л. Было обнаружено, что добавление раствора
сульфида натрия (13 мг/л сульфида) в пробу значительно стимулировало
потребление 14С-ацетата. Стимулирующий эффект также оказывали сульфиды
алюминия, кальция и сурьмы, легко гидролизующиеся в растворе. Слаборастворимые
сульфиды не оказывали стимулирующего эффекта (сульфиды цинка, меди, свинца и т.
д.). Тиосульфат и элементная сера не стимулировали потребление ацетата, сульфит
и метабисульфит стимулировали (Brock
et al.,
1971).
В пробах ила на подводных термальных выходах в
слабоминерализованном щелочном озере Танганьика (Восточно-Африканский рифт, рН
(озеро) 8.5-9.2, рН (гидротермальные воды) 7.7-8.8, глубина термальных выходов
от 0 до 6 м, температура на изливе 66-103°С) была измерена интенсивность
сульфатредукции в зависимости от рН. Было обнаружено, что оптимум процесса
находится при рН 7, процесс полностью ингибируется при рН 8.8-9.2 (Elsgaard
et al.,
1994).
В пробах из гейзера Удачный (долина Гейзеров,
Камчатка) с рН 8.5, азотного типа (72.2% в газовом составе), была определена
скорость темновой продукция при 60 и 85°С (до 107.07 мкгС/л сут). Также было
показано наличие слабого процесса метаногенеза при 70°С (0.072 мкгС/л сут) и
активное образование ацетата из СО2, снижающееся с повышением температуры (до
25.41 мкгС/л сут) (Бонч-Осмоловская и др., 1999).
.3.2 Микробные сообщества нейтральных гидротерм
Продукционные процессы в цианобактериальных
матах. Значения продуктивности цианобактериальных матов нейтральных гидротерм
близки к значениям продуктивности других высокопродуктивных экосистем.
Содержание хлорофилла а может достигать 700-800 мг/м2, что сравнимо
с аналогичными данными полученными для микробных матов соленых озер и
гиперсоленых лагун (до 551 мг хл а/м2, до 75.4 мг бхл а/м2)
и несколько уступает значениям полученных в матах мелководных нейтральных гидротерм
бухты Кратерной с температурой до 34°C
(до 1.6 г хл а/м2, до 1 г бхл а/м2) (Brock,
1967б; Castenholz,
1969; Bauld, 1984; Gerdes
et al,
1985; Tarasov
et al.,
1990).
Максимальная фотосинтетическая продукция может
достигать нескольких грамм углерода на метр в сутки. Например, 2.3 гС/м2
сут в "зеленом" мате источника Термофильный (Камчатка), 4.32-5.4 гС/м2
сут в источнике Октопус спринг (Йеллоустон) (Горленко, Бонч-Осмоловская, 1989; Revsbech,
Ward, 1984; Ferris
et al.,
1997), что сравнимо с значениями полученными в матах бухты Кратерной (до 3.7
гС/м2 сут), и несколько уступает значениям фотосинтетической
продукции в микробных матах гиперсоленого озера Солар лейк (до 12 гС/м2
сут), гиперсоленых лагун Шарк бей и Спенсер Галф (до 6.13 гС/м2 сут)
(Jorgensen, Cohen,
1977; Guerero,
Mas, 1989; Skyring
et al.,1989;
Tarasov et
al., 1990).
Максимальная темновая продукция в
цианобактериальных матах нейтрального источника Термофильный достигает 0.29
гС/м2 сут, что значительно уступает темновой продукции в матах бухты
Кратерной (до 29.7 гС/м2 сут) (Tarasov
et al.,
1990).
Максимальная фотосинтетическая продукция
отмечена при температурах 55-45°С (Горленко, Бонч-Осмоловская, 1989; Doemel,
Brock, 1977; Castenholz,
1984; Revsbech,
Ward, 1984).
Максимальная скорость роста мата, определенная внесением в качестве маркера
биологически инертного силиката карбида, также отмечена при температурах около
50°С и составляет 18-45 мкм/сут (Doemel,
Brock, 1977). Необходимо
учитывать, что эта скорость может отражать сукцессионную фазу после нарушения
целостности микробного мата и может не соответствовать скорости роста
ненарушенного мата (Nold
et al.,
1996).
Наибольшая активность продукционных процессов в
микробном мате отмечена в верхнем слое до глубины 2 мм, что в большинстве
случаев соответствует максимальной глубине проникновения солнечного света (Bauld,
Brock, 1973; Castenholz,
1984; Pierson
et al.,
2000). Исключение составляет мат, развивающийся в источнике Йистихвер
(Исландия), где оксигенный фотосинтез отмечен на глубине до 14 мм (Jorgensen,
Nelson, 1988). Глубина
проникновения света определяется содержанием пигментов в верхнем слое мата в
связи с затенением нижних слоев и нехваткой света для фотосинтеза (Brock,
Brock, 1969; Bauld,
Brock, 1973).
Максимальное содержание белка также отмечено в верхних 2 мм мата (Doemel,
Brock, 1977). При
удалении верхнего слоя скорость оксигенного фотосинтеза уменьшается более чем в
10 раз (Ferris
et al.,
1997). В течение дня, в ходе оксигенного фотосинтеза, происходит подщелачивание
поверхностного слоя цианобактериального мата. В микробном мате источника
Хантерс спринг (Орегон, США) рН в поверхностном слое повышается до 9, тогда как
в нижних слоях мата в ходе деструкционных процессов происходит подкисление до
6.3 (Revsbech,
Ward, 1984). Интересно,
что в "аноксигенных матах" подщелачивание поверхностного слоя не
наблюдается, значения рН с глубиной практически не изменяются (Giovannoni
et al.,
1987; Castenholz
et al.,
1990).
Соотношение оксигенного и аноксигенного
фотосинтеза может колебаться в широких пределах. На примере микробных матов
источника Термофильного было показано, что доля аноксигенного фотосинтеза
уменьшается с понижением температуры от 76-40% при 62-56°С до 1-10% при
температурах ниже 50°С. Доля оксигенного фотосинтеза, соответственно, возрастает
(Горленко, Бонч-Осмоловская, 1989).
Соотношение аноксигенного и оксигенного
фотосинтеза также зависит и от времени суток. Так, на примере
цианобактериального мата с доминированием Synechococcus
lividus (55-50еС)
развивающегося в источнике Октопус спринг, было показано, что в течение дня
фотосинтетическая фиксация углекислоты осуществляется Synechococcus
lividus (Doemel,
Brock, 1977). Тем не
менее, присутствующий в мате Chloroflexus
aurantiacus способен к
фотоавтотрофному росту на сульфиде, хотя условия для этого создаются только в
течение ограниченного периода времени утром, когда свет уже проникает в мат, а
содержание сульфида все еще довольно высоко (Madigan,
Brock, 1975; Revsbech,
Ward, 1984).
В мате цианобактерии осуществляют оксигенный
фотосинтез с высокой скоростью, но скорость деления клеток не высока в обычных
условиях (Nold
et al.,
1996). Основным продуктом фотосинтеза цианобактерий в микробном мате являются
полисахариды (67-84% меченого углерода обнаруживается в составе полисахаридной
фракции) расходуемые цианобактериями в ходе темновых реакций (Konopka,
1992; Nold
et al.,
1996; Ferris
et al.,
1997). Также, значительная часть фотосинтетически фиксированного углерода
выделяется клетками наружу. По разным оценкам доля внеклеточной продукции составляет
от 12 до 46% (Горленко, Бонч-Осмоловская, 1989; Bauld,
Brock, 1974). Среди
выделяемых цианобактериями соединений доминирует гликолят (до 60% от
внеклеточной продукции). Далее гликолят быстро поглощается Chloroflexus
aurantiacus (Ward
et al.,
1984).
Внесение закисного железа (1 мМ) стимулирует
оксигенный фотосинтез (до 500%) и темновую фиксацию (до 175%), но не
стимулирует аноксигенный фотосинтез, как было показано на примере железистого
источника Чоколейт пот (Йеллоустон, 54°C,
рН 6, Fe(II)
5.1 мг/л). Интересно, что стимулирование фиксации 14С-бикарбоната выше в пробах
мата из более высокотемпературных зон с доминированием Synechococcus
sp., чем в зонах с
умеренной температурой и доминированием Oscillatoria
sp. (Pierson
et al.,
1999; Pierson
et al.,
2000).
Деструкционные процессы в цианобактериальных
матах. Биомасса цианобактериальных матов намного меньше, чем биомасса других
экосистем, хотя значения продуктивности близки. Поэтому скорость деструкционных
процессов в цианобактериальных матах должна быть очень велика (Guerrero,
Mas, 1989). Измерение
процесса деструкции с помощью силиката карбида показало, что деструкция
проходит в 2 этапа. Первый протекает в течение 2-4 недель, в течение которого,
вероятно, разрушаются легко разрушаемые вещества. Второй этап протекает в
течение года, на этой стадии, вероятно, разрушаются трудно разрушаемые вещества
(Doemel, Brock,
1977).
Популяция Chloroflexus
aurantiacus является наиболее
многочисленной в микробном мате среди организмов осуществляющим аеробную
деструкцию органического вещества. Эта способность скорее всего проявляется в
ходе ночной миграции на поверхность микробного мата. Также в процессе аэробной
деструкции участвуют Isosphaera
pallida, представители
родов Thermus
и Meiothermus, протеобактерии,
грамположительные бактерии (Santegoeds
et al.,
1996).
В течение суток в микробном мате происходят
значительные колебания содержания кислорода и темновое сбраживание полиглюкозы
цианобактериями рассматривается как важный механизм обеспечивающий поток
углерода через сообщество (Richardson,
Castenholz, 1987). В темновых
анаэробных условиях Synechococcus
lividus переключается на
ферментативный метаболизм, что подтверждается уменьшением содержания меченой
полиглюкозы и увеличением содержания меченых продуктов брожения (Nold
et al.,
1996). Ацетат и пропионат являются основными продуктами брожения (ацетат в
соотношении 3:1 к пропионату, остальные кислоты в незначительных концентрациях)
накапливающимися в мате ночью, при этом в образовании ацетата участвуют как
цианобактерии, так и ацетогены (Anderson
et al.,
1987; Nold
et al.,
1996). При этом накопление ацетата происходит в верхних 3-4 мм мата (Ward
et al.,
1984). В дальнейшем ацетат и другие продукты брожения на свету поглощается Chloroflexus
aurantiacus (Anderson
et al.,
1987). В основном ацетат включался в состав клеточного материала, только
небольшая часть использовалась для образования СО2 (Sandbeck,
Ward, 1982).
Основные продукты брожения, ацетат и водород,
используются терминальными деструкторами. Направление процесса терминальной
деструкции контролируется содержанием сульфата. При содержании сульфата в среде
в 16.6 мг/л (Октопус спринг) сульфатредукция не подавляет метаногенез, который
развивается с высокой скоростью (Ward,
1978). Схожие результаты были получены в источниках с содержанием сульфата от
11.5 до 21.1 мг/л (Sandbeck,
Ward. 1982). В
источнике Термофильный с содержанием сульфата около 30 мг/л сульфатредукция
доминировала, а расход органического вещества через метаногенез составлял от 10
до 78% от расхода через сульфатредукцию (Горленко, Бонч-Осмоловская, 1989). В
исландском источнике Граендалса с содержанием сульфата 84 мг/л и йеллоустонских
источниках Бэс лейк и Пейнтед пул с содержанием сульфата около 718 мг/л
сульфатредукция являлась единственным терминальным процессом деструкции (Ward
et al.,
1984). В микробных матах источника Термофильный наибольшие скорости
терминальных процессов были отмечены в "зеленом" мате при
температурах ниже 50°C.
Максимальная скорость сульфатредукции составляла 1.44 tS/м2
сут, максимальная скорость метаногенеза составляла 0.42 гС/м2 сут
(Горленко, Бонч-Осмоловская, 1989).
Процесс метаногенеза обнаружен в микробном мате
источника Октопус спринг в диапазоне от 68 до 30°C,
с оптимумом около 45°C
(Ward, 1978). Ацетат не
служит важным субстратом для метаногенеза в связи с активным потреблением его Chloroflexus
aurantiacus. Автотрофный
метаногенез играет намного большую роль, в микробном мате источника Октопус
спринг 70-80% метана образуется из СО2 (Sandbeck,
Ward, 1982). В
микробных матах источника Термофильный образование метана из 14С-ацетата
составляет только 11% от общего метаногенеза (Горленко, Бонч-Осмоловская,
1989).
Продукционные и деструкционные процессы в
аноксигенных матах. В данном типе матов абсолютные значения продукционных и
терминальных деструкционных процессов не определялись. Различными
исследователями проводилось стимулирование фотоассимиляции 14С-бикарбоната
внесением сульфида. Диурон не ингибировал ассимиляцию. Внесение сульфида (0.56
мМ) в пробы "мата Chloroflexus",
развивающегося в источнике Маммот спринг, стимулирует фиксацию на 400%.
Светозависимое потребление 14С-ацетата также стимулируется внесением сульфида
на 200%. Также было показано, что в данном мате происходит образование
сульфида, при этом процесс подавлялся молибдатом, ингибитором сульфатредукции (Giovannoni
et al.,
1987). Внесение сульфида (0.7-1.1 мМ) в пробы "мата Chlorobium",
развивающегося в источнике Травелодж спринг, стимулирует фиксацию на 100% (Castenholz
et al.,
1990).
Хемотрофные микробные сообщества нейтральных
гидротерм. Максимальные значения продуктивности хемотрофных термофильных
сообществ значительно уступают продуктивности фототрофных термофильных
сообществ и продуктивности хемотрофных мезофильных сообществ. Скорость темновой
фиксации углекислоты в "белом" мате с доминированием Thermothrix
thiopara источника
Термофильный составляет 0.017 гС/м2 сут (Горленко, Бонч-Осмоловская,
1989). В источнике Пульсирующий (Камчатка) максимальная темновая фиксация
углекислоты составляет 212 мкгС/л сут (Бонч-Осмоловская и др., 1999).
Несмотря на ключевую роль хемосинтетической
продукции в функционировании глубоководных гидротермальных сообществ,
количественная сторона этой "роли" остается слабо изученной (Гебрук,
Галкин, 2002). Бактериальная продукция в бактериальных обрастаниях на
отложениях дна в пределах активных полей в среднем составляет около 11 мг С/м2
сут. Суммарная бактериальная продукция с учетом всех зон на одном поле
составляет в среднем 275 мг С/м2 сут (Леин, Пименов, 2002).
В источнике Термофильный скорость
сульфатредукции в "белом" мате составляет 0.038 tS/м2
сут, скорость метаногенеза 0.0129 мгС/м2 сут. Интересно, что
скорость сероредукции составляет 0.096 tS/м2
сут, эта величина превышает сульфатредукцию в той же зоне в 2.3 раза. Таким
образом, в присутствии элементной серы сероредукция успешно конкурирует с
другими процессами. Обращает на себя внимание несбалансированность
продукционных и деструкционных процессов в "белом" мате. В отличие от
"зеленого" мата с доминированием цианобактерий, где продукция
органического вещества значительно превышает деструкцию, в "белом"
мате деструкция превышает продукцию в 5 раз (Горленко, Бонч-Осмоловская, 1989).
В источнике Пульсирующий скорость автотрофного
метаногенеза достигает 0.26 мкгС/л сут и скорость ацетогенеза 9.58 мкгС/л сут.
Также была отмечена высокая потенциальная способность к литотрофному
восстановлению сульфатов и серы, железа, образованию метана, анаэробному
окислению СО, сопряженному с образованием водорода. Литотрофный ацетогенез был
незначителен (Бонч-Осмоловская и др., 1999).
Высокая активность терминальных деструкционных
процессов была обнаружена в подводных гидротермах. Скорость сероредукции в
грунте бухты Матупи (Новая Гвинея) достигает 57 tS/л сут
(Бонч-Осмоловская и др., 1993). В илу вулканической воронки с глубины 40 м
залива Пленти (Новая Зеландия) с температурой 85°С скорость сульфатредукции
достигает 1655.2 мк^/л сут, метаногенеза из СО2 достигает 5.84
мкгС/л сут, из ацетата - 16.3 мкгС/л сут (Намсараев и др., 1994). В
глубоководных гидротермах Гуаймас Калифорнийского залива с глубины 2010 м
(50-70еС) скорость сульфатредукции достигает 1024 мкгё/л сут (Jorgensen
et al.,
1990).
.4 Экофизиология термофильных микроорганизмов
щелочных гидротерм
.4.1 Температурные и рН границы развития микроорганизмов
Существуют различные классификации
микроорганизмов по отношению к температуре (Заварзин, Колотилова, 2001; Castenholz,
Pierson, 1995; Wiegel,
1998). Как правило, к термофилам относят микроорганизмы с оптимумом развития
при температурах свыше 50°С. Среди них выделяют еще несколько групп. Собственно
термофилы с оптимумом при 50°С и максимальной температурой роста выше 60°С. К
экстремальным термофилам относятся микроорганизмы с минимальной температурой
роста обычно свыше 35°С, оптимумом развития выше 65°С и максимальной
температурой роста выше 70°С. К гипертермофилам относятся микроорганизмы с
минимальной температурой роста обычно свыше 60°С, оптимумом развития выше 80°С
и максимальной температурой роста при температурах выше 85°С (Wiegel,
1998). По данным Штеттера и соавторов (Bluhl
et al.,
1997) верхний температурный предел развития гипертермофильных микроорганизмов
составляет 113°С.
Существуют различные классификации
микроорганизмов по отношению к рН (Заварзин, Колотилова, 2001; Krulwich,
Guffanti, 1989; Wiegel,
1998). По Вигелю, к алкалофилам относят микроорганизмы с оптимумом рН выше 8.5
и максимальным рН развития выше 10. Выделяют также группы факультативных
алкалофилов с минимальным рН развития менее 8 и облигатных алкалофилов с
минимальным рН выше 8. К алкалотолерантам относятся организмы с оптимумом рН
менее 8.5 и максимальным рН развития выше 9 (Wiegel,
1998). Необходимо учитывать, что при измерении рН в щелочной области при
высоких температурах необходимо вносить поправки, либо калибровать электрод при
температуре измерения. Ошибка измерения может достигать одной единицы рН (Wiegel,
1998).
.4.2 Микроорганизмы - первичные продуценты
Цианобактерии. Большинство термофильных (и
мезофильных) цианобактерий более активно развивается в щелочных условиях. При
культивировании на слабо забуференных средах происходит подщелачивание среды в
ходе оксигенного фотосинтеза (Holm-Hansen,
1968; Castenholz,
1969). Так, скорость фотосинтеза нитчатой цианобактерии Phormidium
molle не меняется при
изменении рН от 7.3 до 9.6 и падает при рН 10.4 (Герасименко, 2002).
Максимальная постоянная температура, при которой
могут существовать цианобактерии - 74°С, верхний температурный предел развития Synechococcus
lividus (Castenholz,
1969, 1984). Броком было показано, что фиксация 14С-бикарбоната в процессе
фотосинтеза популяцией Synechococcus
sp. может происходить
при температуре 73°С (Brock,
1967). Другие виды цианобактерий могут существовать в культуре при
температурах: Synechococcus
elongatus до 70°С, Mastigocladus
laminosus до 64°С, Phormidium
laminosum, P.
tenue, P.
valderiae до 57°С, Oscillatoria
terebriformis до 53°С, Oscillatoria
tenue до 47°С. Отмечено
развитие в природе следующих видов цианобактерий: Synechococcus
minervae до 60°С, Oscillatoria
okenii до 60°С, Oscillatoria
amphibia до 57°С, Oscillatoria
animalis до 55°С, Pleurocapsa
minor до 54°С, Calothrix
sp. до 54°С, Synechococcus
aquaticus до 50°С. Нижний
температурный предел развития большинства термофильных цианобактерий составляет
30-35°С (Castenholz,
1969).
Микроаэрофильные условия и присутствие
восстановителей в небольших количествах оказывают стимулирующее воздействие на
рост цианобактерий (Герасименко, Заварзин, 1982; Герасименко и др., 1987;
Герасименко, 2002). Но высокое содержание сульфида подавляет оксигенный
фотосинтез цианобактерий (Пиневич, Аверина, 2000). Наиболее токсичен сульфид
при низких значениях рН из-за более высокой способности недиссоциированного
сероводорода к проникновению через клеточные мембраны (Howsley,
Pearson, 1979). В этих
условиях цианобактерии переключаются с оксигенного на аноксигенный фотосинтез,
используя сульфид в качестве донора электронов для фотосистемы I, либо защищают
фотосистему II от ингибирования сульфидом (Венецкая и др. 1987; Castenholz,
Utkilen, 1984; Cohen,
1984; Cohen
et al.
1975; Cohen
et al.,
1986). Тиосульфат и элементная сера не могут служить донорами электронов для
аноксигенного фотосинтеза у цианобактерий (Castenholz,
1976). Вероятно, древние цианобактерии существовали в сульфидсодержащих
условиях. При этом использование воды, как донора электронов, первоначально
могло быть способностью позволяющей переносить временное отсутствие сульфида (Cohen,
1984).
Железо может служить донором электронов для
мембран связаных комплексов фотосистемы II
(Dismukes
et al.,
2001). Коэном было показано, что цианобактерии Oscillatoria
sp. и Microcoleus
chtonoplastes осуществляют
Fe(II)-зависимую фотоассимиляцию СО2. Процесс ингибируется диуроном, что
свидетельствует о том, что железо донирует вторую фотосистему. Конечный продукт,
оксид железа, выделяется в среду подобно выделению элементной серы в
сульфидзависимом аноксигенном фотосинтезе (Cohen
et al.,
1986). Пирсон было показано, что в железистом нейтральном источнике Чоколейт
пот (Йеллоустон) происходит образование чехлов окисного железа вокруг нитей
цианобактерий (Pierson
et al.,
2000). Эксперименты со стимулированием закисным железом фиксации
14С-бикарбоната показали, что наибольшее стимулирование (до 500%
фотоассимиляции, до 175% темновой фиксации) происходит при добавлении 1 мМ
закисного железа (56 мг/л). Стимулирование фиксации железом выше в пробах мата
из более высокотемпературных зон с доминированием Synechococcus
sp., чем в зонах с
умеренной температурой и доминированием Oscillatoria
sp. (Pierson
et al.,
1999).
Большинство цианобактерий является облигатными
фотоавтотрофами. Относительно небольшое количество цианобактерий способно
существовать как аэробные гетеротрофы в темноте, но скорость роста при этом
значительно уступает росту в фотоавтотрофных условиях. Анаэробный метаболизм в
темноте ограничен брожением и используется для поддержания существования в
неблагоприятных условиях (Stal,
1995). Способность к восстановлению серных соединений при брожении была
показана у мезофильных цианобактерий, но у термофильных цианобактерий не
известна (Oren, Shilo,
1979; Moezelaar
et al.,
1996).
Аноксигенные фототрофные бактерии (АФБ).
Известно всего девять видов термофильных АФБ (Castenholz,
Pierson, 1995; Hanada
et al.,
1995a, b;
Hanada et
al., 2002). Из них
способны существовать в культуре, или показано существование в природе, при рН
выше 8.5 только термофильные нитчатые зеленые бактерии. Также для несерных
пурпурных бактерий Rhodopseudomonas
palustris и Rh.
gelatinosus было показано
существование в природе при рН 9.2-9.8 и температуре выше 50°С, но они не были
способны к росту при высоких температурах в лабораторных условиях. Высказано
предположение, что бактерии либо переживают неблагоприятные условия,
периодически активируясь при снижении температуры, либо в мате существуют условия,
при которых возрастает верхний предел их толерантности к температуре. Оба
организма имели оптимум рН около 7 и не проявляли тенденции к алкалофилии
(Горленко и др., 1985; Компанцева, Горленко, 1988). Аналогичное явление было
обнаружено для культур несерных пурпурных бактерий родов Blastohloris,
Phaeospirillum, Rhodoplanes,
Rhodopseudomonas, Rubrivivax
выделенных из матов развивающихся при 55-65еС (источник Накабуса, Япония), но
растущих в лабораторных условиях при температурах не выше 43-48еС (Okamura
et al.,
2003).
Термофильные нитчатые АФБ широко распространены
в гидротермах с температурой до 72°С и рН от 6.2 до 10.4. В настоящее время
известно четыре вида: Chloroflexus
aurantiacus, Chloroflexus
aggregans, Roseiflexus
castenholzii, Heliothrix
oregonensis. Культивируемые
организмы обладают оптимумом рН 7-8, Chloroflexus
aggregans и Roseiflexus
castenholzii были обнаружены
только в источниках с рН не выше 8, но Chloroflexus
aurantiacus и Heliothrix
oregonensis были обнаружены в
источниках с рН до 10.4 (H.
oregonensis с pH
8.5) (Юрков и др., 1991; Pierson,
Castenholz, 1974; Castenholz,
Pierson, 1995; Hanada
et al.,
1995a, b;
Hanada et
al., 2002; Blanck
et al.,
2002; №>bel
et al.,
2002).
Наиболее изученным представителем этой группы
является Chloroflexus
aurantiacus. Его оптимум роста
52-60°N, максимальная
температура роста ~70°С (Pierson,
Castenholz, 1974). Chloroflexus
aurantiacus не способен к
фиксации молекулярного азота (Heda,
Madigan, 1986). Наиболее
быстро рост всех выделенных штаммов происходит фотогетеротрофно (Castenholz,
Pierson, 1995). Ряд
штаммов способны к медленной сульфидзависимой фотоавтотрофии с образованием
молекулярной серы (Кеппен, Красильникова, 1986; Madigan,
Brock, 1975; Giovannoni
et al.,
1987). Тиосульфат, сульфит, молекулярная сера не могут использоваться в
качестве доноров электронов, но могут использоваться в качестве акцепторов
электронов восстанавливаясь до сероводорода на среде с органическими
соединениями в темноте (Кондратьева, Красильникова, 1988). Также в темноте
организм способен расти в аэробных условиях за счет дыхания и в анаэробных
условиях за счет сбраживания углеводов или пирувата (Красильникова и др., 1986;
Красильникова, Кондратьева, 1987). Красильникова и Кондратьева (1987) сообщают,
что Chloroflexus
aurantiacus в темноте в
анаэробных условиях в присутствии глюкозы восстанавливает окисное железо. Ранее
активность железоредуктазы и редукция железа мембранными фракциями была
показана у мезофильных АФБ (Moody
et al.,
1985; Dobbin
et al.,
1996). Образование чехлов окисного железа наблюдалось у мезофильного штамма Chloroflexus
aurantiacus в микроаэрофильных
условиях при развитии на среде с 0.01% триптона и порошком металлического
железа (Горленко, 1981). При этом бактериальные нити выползали из чехлов, что
приводило к накоплению большого количества чехлов, неотличимых от чехлов Leptothrix.
Окисление железа, скорее всего, не является источником энергии для фиксации
СО2, а связано с действием перекиси водорода, образующейся в процессе окисления
органического субстрата (Дубинина, 1977). Это может являться одним из
механизмов участия бактерий в генезисе железистых минералов древних осадочных
месторождений ганфлинтского типа. Способность Chloroflexus
aurantiacus к использованию
восстановленного железа как донора электронов для фотосистемы I
не была исследована. Ранее было показано, что мезофильные АФБ способны
использовать закисное железо как донор электронов (Widdel
et al.,
1993; Ehrenreich
et al.,
1994).
Heliothrix
oregonensis не был выделен в
чистую культуру. Клетки более толстые, чем у Chloroflexus
aurantiacus (1.5 мкм и 0.5-1.0
мкм соответственно), хлоросомы отсутствуют. Бактериохлорофилл а - единственный
пигмент. Проявляет себя как фотогетеротроф толерантный к кислороду или даже
нуждающийся в кислороде. Растет в диапазоне температур от 35 до 56-60°С с
оптимумом в пределах 40-55°С. Устойчив к высоким интенсивностям света до 32
клюкс. Heliothrix
oregonensis найден
преимущественно в микробных матах щелочных источников с рН около 8.5, в которых
он образует верхний слой оранжевого цвета (Pierson
et al.,
1984, 1985).
Chloroflexus
aggregans и Roseiflexus
castenholzii гораздо менее
изучены чем Chloroflexus
aurantiacus. Основные
характеристики этих организмов очень похожи. Эти бактерии способны к
фототрофному росту на органических субстратах, а также к гетеротрофному
аэробному росту в темноте. Отличия заключаются в следующем: клетки Chloroflexus
aggregans более толстые (до
1.5 мкм), скорость скольжения нитей по поверхности примерно в 100 раз выше,
есть способность к быстрому образованию аггрегатов в жидкой среде (за 20-30
минут), не способен к использованию ацетата, цитрата, этанола и глицил-глицина
(Hanada et
al., 1995b).
Roseiflexus
castenholzii не обладает
хлоросомами и бактериохлорофиллом с и содержит только бактериохлорофилл а (Hanada
et al.,
2002).
Хемолитоавтотрофные алкалотермофильные
микроорганизмы в настоящее время не известны (Кевбрин, личное сообщение; Wiegel,
1998). Единственным известным хемолитоавтотрофным термофильным
алкалотолерантным организмом является метаногенная археобактерия Methanothermobacter
thermoautotrophicum
(ранее Methanobacterium
thermoautotrophicum,
синоним M. thermoalcaliphilum)
способная существовать при рН 9 и обладающая оптимумом рН 7.7.7.8 (Zeikus,
Wolfe, 1980; Blotevogel
et al.,
1986).
.4.3 Микроорганизмы - деструкторы
Аэробные и факультативно аэробные органотрофные
микроорганизмы. Валидно опубликованные алкалофильные термофильные аэробные
микроорганизмы в настоящее время не известны. Недавно Мартинссон с соавторами
обнаружили в щелочных субаквальных гидротермах Эйджафьордур аэробные
органторофные микроорганизмы способные существовать в лабораторных условиях при
рН 10 и температуре 60-72°С. По результатам анализа 16S-рРНК (на основании
анализа 400-500 пар нуклеотидов, сходство 95-99%) изоляты были отнесены к видам
Geobacillus
thermoleovorans, "G.
caldotenax", G.
flavothermus, G.
caldovelox (Marteinsson
et al.,
2001). Тем не менее, типовые штаммы данных организмов не способны расти при рН
выше 8 (Назина, Григорьян - личное сообщение).
Известные микроорганизмы являются либо
"самыми "алкалофильными" среди термофилов, либо самыми
"термофильными" среди алкалофилов" (Wiegel,
1998). Оптимумом рН выше 8.5 обладает Bacillus
sp. штамм 221,
способный расти до рН 10 и максимальной температурой роста 57°С, являющийся
алкалофилом, но не термофилом (Horikoshi,
1990, Wiegel, 1998).
Среди термофильных микроорганизмов известен ряд аэробных алкалотолерантных
бактерий (археобактерии неизвестны). Это представители рода Bacillus
(B. pallidus,
B. thermocloaceae,
B. thermoaerophilus),
рода Meiothermus
(M. chliarophilus,
M. ruber,
M.silvanus),
"Geobacillus
caldotenax", Thermus
oshimae, Sphaerobacter
thermophilus, Thermomicrobium
roseum, Isosphaera
pallida, Rubrobacter
xylanophilus (Wiegel,
1998). Храпцова и соавторы выделили из термальных источников Бурятии ряд
алкалитолерантных термофильных аэробных микроорганизмов с оптимумом роста при
50°С и рН 8.0 (Храпцова и др., 1984).
О способности к использованию неорганических
соединений термофильными аэробными органотрофными микроорганизмами известно
мало. Meiothermus
ruber способен к
окислению тиосульфата с образованием сульфата, причем добавление тиосульфата не
стимулировало рост (Chung
et al.,
1997). Способность к окислению тиосульфата, а также восстановлению элементной
серы и ряда металлов была обнаружена у представителей рода Thermus,
кроме Thermus
oshimae (Kieft
et al,
1999; Skirnisdottir
et al.,
2001).
Анаэробные органотрофные микроорганизмы. В
настоящее время в этой группе известно семь видов анаэробных алкалотермофильных
микроорганизмов. К ним относятся археи Methanohalophilus
zhilinae, Thermococcus
alcaliphilus, бактерии рода Clostridium
(C. paradoxum,
C. thermoalcaliphilum),
Anaerobranca
gottschalkii, Thermosyntropha
lipolytica, Desulfotomaculum
alkaliphilum (Mathrani
et al.,
1988; Li
et al.,
1993, 1994; Keller
et al.,
1995; Svetlitshnyi
et al.,
1996; Wiegel, 1998; Pikuta
et al.,
2000). К анаэробным термофильным алкалотолерантным микроорганизмам относятся
археи Methanobacterium
thermoflexum, Thermococcus
fumicolans, бактерии Anaerobranca
horikoshii, Thermobrachium
celere, Caloramator
indicus, Thermoanaerobacter
ethanolicus (Wiegel,
Ljundgahl, 1982; Kotelnikova
et al.,
1993; Engle
et al.,
1995; Chrisostomos
et al.,
1996; Godfroy
et al.,
1996; Wiegel, 1998). Все
организмы являются органогетеротрофами, о способности к использованию
неорганических соединений известно немного. Desulfotomaculum
alkaliphilum способен
восстанавливать сульфат, сульфит, тиосульфат, но не элементную серу и нитрат (Pikuta
et al.,
2000). Thermococcus
alcaliphilus способен
восстанавливать полисульфид и элементную серу (Keller
et al.,
1995).
.5 Участие микробного сообщества щелочных
гидротерм в минералообразовании
При выходе гидротермальных вод на поверхность и
протоке по руслу источника создаются градиенты по концентрациям, растворимости
компонентов, температуре, рН и давлению (Крайнов, Швец, 1980). В ходе этого
создается система геохимических барьеров, на которых происходит резкое
уменьшение интенсивности миграции ряда элементов и образование минералов (Перельман,
1972; Аверкин, 1987). Микробное сообщество играет важную роль в процессе
минералообразования в гидротермальных системах, участвуя в создании
геохимических барьеров (Заварзин, 1984).
Миграция катионогенных элементов, в первую
очередь железа, в щелочных водах затруднена. Поэтому, наибольшую роль среди
минералов, образующихся по изливу щелочных термальных вод, играют соединения
анионогенных элементов: силикаты и карбонаты (Перельман, 1972).
Силикаты. Щелочные термальные воды содержат
высокие концентрации кремния (около 100 мг/л). При постепенном охлаждении воды
по изливу и снижении рН избыток кремневой кислоты относительно равновесной
величины остается во взвешенном состоянии в виде коллоида и практически не
осаждается. Поэтому осаждение кремнезема (H4SiO4
-> SiO2
+ 2H2O)
происходит при испарении и охлаждении раствора (Го Окамото и др., 1963; Walter,
1976). Примером отложения силикатов из щелочного гидротермального раствора
является образование гидротермальных построек у северного побережья Исландии
(Эйджафьордур). Здесь происходит смешение термальных вод (pH
10, 71 °С) с содержанием кремния 93.7 мг/л и холодных нейтральных океанических
вод. Образующиеся постройки сложены из силикатов. Характерно, что металлические
сульфиды, часто встречающиеся в кислых черных курильщиках, в них не были
обнаружены (Marteinsson
et al.,
2001).
Образование гейзеритов (силикатных построек на
выходах гидротерм) отмечалось на многих источниках с нейтральными и щелочными
водами (Walter, 1976; Konhauser
et al.,
2001; Blanck
et al.,
2002; Inagaki
et al.,
2003). Ранее доминировало мнение о преимущественно абиогенном образовании
гейзеритов. Так, Уолтер описал механизм образования кремнистых гейзеритов с
колончатыми ламинациями при разбрызгивании воды из потока и осаждении ее в виде
капель на поверхности камней. При испарении капель на поверхности остаются
тонкие бляшки кремнезема. Ламинация в образующемся кремнистом гейзерите очень
тонкая и регулярная (Walter,
1976).
Электронно-микроскопические наблюдения показали
наличие микрофоссилий в гейзеритах. Тем не менее, роль микробного сообщества в
образовании силикатных пород остается во многом невыясненной. Считается, что
микробные обрастания и маты служат центрами нуклеации при образовании
силикатных минералов, а далее процесс минералообразования происходит
автокаталитически (Герасименко, Крылов, 1983; Oehler,
Schopf, 1971; Ferris
et al.,
1986; Cook, Stackes,
1995; Jones, Renaut,
1996, 1997; Jones
et al.,
1997 a,b.;
Konhauser, Ferris,
1996; Fortin, Ferris,
1998; Konhauser
et al.,
2001; Inagaki
et al.,
2003). Недавние исследования показали, что роль микробного сообщества в
образовании гейзеритов может быть больше, чем считалось ранее. Культура Thermus
sp. осаждала
кремнезем во время экспоненциальной фазы роста, при этом в клетках синтезировался
белок (Sip - silica
induced protein),
появлявшийся только в присутствии коллоидного кремния. Функция этого белка
неизвестна, высказано предположение, что осаждение кремния необходимо для
закрепления клеток на поверхности субстрата в потоке воды (Inagaki
et al.,
2003).
Карбонаты. Образование травертинов - карбонатных
пород на выходах источников отмечается многими исследователями. Механизм
образования травертинов хорошо изучен. При выходе вод на поверхность давление
падает, происходит вскипание углекислого газа, который улетучивается из
гидротермальных вод. В результате вода становится пересыщенной по кальциту и
происходит его выпадение из раствора (Аверкин, 1987; Плюснин и др., 2000; Chafetz,
Folk, 1984; Fouke
et al.,
2000). Образующиеся травертины могут достигать 85 метров в толщину и занимать
площади до нескольких сотен километров (Chafetz,
Folk, 1984).
Микробное сообщество гидротерм играет важную
роль в образовании травертин. Считается, что большинство травертин образовано в
результате совместного воздействия биогенных и абиогенных факторов. Роль
факторов зависит от множества переменных: содержания растворенного СО2,
температуры воды, морфологии травертин, интенсивности света и т.д. В травертине
слои биогенно осажденного кальцита могут перемежаться со слоями абиогенного
кальцита (Chafetz,
Folk, 1984). Биогенно
осаждаемый кальцит может составлять до 90% от всего осаждаемого кальцита.
Наибольший вклад в осаждение карбоната кальция вносят цианобактерии, удаляющие
СО2 из раствора и нарушающие карбонатное равновесие (Орлеанский, Герасименко,
1982; Заварзин, 2002; Chafetz,
Folk, 1984; Chafetz
et al.,
1991; Spiro, Pentecost,
1991; Pentecost,
1994, 1995).
Образование травертинов на источниках Б.р.з.
Судя по максимальной растворимости аморфного кремнезема в щелочных условиях
(300-1000 мг/л), исследованые гидротермы Б. р. з. недонасыщены кремнием. Об
этом же свидетельствует и отсутствие в районе выхода гидротерм значительных
отложений кремнезема (Ломоносов, 1974).
На выходах Аллинского и Гаргинского источников
происходит образование травертинов с низкими содержаниями SiO2
(до 3.6%). В термальных водах источников натрий доминирует над кальцием,
сульфат-ион доминирует над гидрокарбонат-ионом, а также содержится значительные
концентрации растворенной кремнекислоты, поэтому факт образования из таких вод
карбонатно-кальциевых травертинов представляет значительный интерес (Борисенко
и др., 1976). По мнению Плюснина образование травертинов на Гаргинском
источнике не может происходить в ходе декомпрессии углекислого газа при выходе
на поверхность, так как содержания углекислого газа, карбоната, гидрокарбоната
и кальция слишком низки. Поэтому в образовании травертина большую роль может
играть деятельность цианобактериального мата развивающегося на поверхности
травертина (Плюснин и др., 2000).
Образование строматолитов в древних гидротермах.
Современные процессы образования гейзеритов и травертинов по изливу гидротерм
могут служить актуалистической моделью образования древних строматолитов
(Герасименко, 2002; Walter,
1976; Walter
et al.,
1976). Строматолиты - органоседиментарные структуры образованные при
связывании, улавливании и отложении карбонатного осадка в результате роста и
метаболической активности микроорганизмов, в основном цианобактерий (Walter,
1983). Строматолиты доминировали на протяжении всего докембрийского этапа
развития биосферы. Резкое сокращение количества строматолитов происходит в
фанерозое в связи с появлением и экспансией скелетных организмов вытеснивших
микробные маты в отдельные неблагоприятные экологические ниши (Семихатов и др.,
1999). Сохранность микрофоссилий в карбонатных породах низка (Головенок, 1989; Chafetz,
Folk, 1984), хотя
иногда в них могут сохраняться органостенные микрофоссилии или
кальцифицированные останки (Knoll,
1985, 1996). Лучшая сохранность микрофоссилий обеспечивается при окремнении
микроорганизмов (Головенок, 1989). Древнейшие раннеархейские микрофоссилии
(серии Варравуна в Австралии, Онвервахт и Фиг три в Южной Африке, 3.5 млрд.
лет) окремнены и заключены в кремнеземный матрикс. Так, в химическом составе
строматолитов серии Онвервахт доминирует кремнезем: SiO2
(95.68-98.90%), Fe2O3
(0.5-3.96%),
C неорг (0.07 -
0.11%), C орг (0.05 -
0.11%), M2O3
(0.06 - 0.1%) (Walsh,
1992). Раннеархейские строматолиты были образованы нитчатыми и одноклеточными
прокариотами. Вероятно, строматолитобразующими организмами были фотоавтотрофы
(показано по фракционированию углерода), обладавшие фототаксисом и
образовывавшие слизистый чехол (Walter,
1983). Размеры микрофосилий в строматолитах серии Онвервахт: диаметр сфероидов
от 4 до 10 мкм, толщина филаментов от 0.2 до 2.5 мкм, длина до 200 мкм, -
близки к размерам микроорганизмов в составе микробного мата (Walsh,
1992).
Считается, что большинство известных
строматолитов были образованы микробными матами развивающимися в гиперсоленых
лагунах в эвапоритовой обстановке (Семихатов и др., 1999). При этом, накопление
кремния объясняется выносом кремнезема из древних областей сноса в процессе
выветривания. В докембрийских морях кремневые губки и радиолярии не известны,
поэтому кремнезем мог накапливаться до стадии насыщения, особенно в мелководных
бассейнах, где шло интенсивное выпаривание вод. Затем, в процессе диагенеза
первоначально гидратированный кремнезем становился дегидрированным, переходя в
кремни (Головенок, 1989; Заварзин, 1993; Весталл, Велш, 2002).
В последние годы появляются данные о том, что
древнейшие строматолиты могут иметь гидротермальное происхождение. Анализ
строматолитов серии Онвервахт зеленокаменного пояса Барбертон (ЮАР) и серии
Варравуна кратона Пилбара (Австралия) возрастом около 3.5 млрд. лет показал,
что вулканическая и гидротермальная активность оказали серезное влияние на
породы. При этом морфология строматолитов дает основания для предположения о
том, что они были сформированы в результате силификации микробного мата
развивавшегося по изливу термального источника (Весталл, Велш, 2002; Westall,
Marchesini, 2002).
Окремнение микроорганизмов в современных
гидротермах. Актуалистические исследования микробных матов гидротерм
показывают, что современное сообщество фоссилизируется с образованием
микрофоссилий схожих с древними (Golubic,
1976; Knoll, Golubich,
1979; Knoll, 1996).
Было показано, что замещение микроорганизмов кремнеземом происходит очень
быстро при коагуляции геля кремниевой кислоты.
Исследования с применением сканирующего
электронного микроскопа цианобактериальных матов источников Камчатки показали,
что замещение органического вещества происходит с сохранением мельчайших
морфологических деталей. При этом сначала замещаются сами микроорганизмы, а
затем кремнезем заполняет пространство между ними (Крылов, Тихомирова, 1988).
Прямое сопоставление современных микроорганизмов
и микрофоссилий затруднено, так как существует значительное морфологическое
сходство между многими филогенетически удаленными группами микроорганизмов.
Трудности биологической интерпретации увеличиваются и в связи со сложными
посмертными процессами изменения клетки (Сергеев, 1992). Например, у нитчатых
микроорганизмов могут разрушаться клеточные перегородки и, в результате,
образуются полые нити похожие на пустые чехлы. Часто происходит распад трихомов
на отдельные клетки, а сами клетки меняют форму. Наиболее отчетливо этот
процесс наблюдался в погибших нитях цианобактерии Mastigocladus
laminosus образующей до 20
различных форм сохранности (Герасименко, Крылов, 1983).
По мнению Нолла, актуалистические исследования
современных микробных сообществ, аналогичных существовавшим в докембрии, должны
стать одним из основных направлений исследования докембрия в ближайшее
десятилетие. При этом, исследования должны включать в себя изучение развития
микробных сообществ, вариации состава и сохранности микроорганизмов (Knoll,
1996).
Щелочные гидротермы широко распространены в
природе, но, в отличие от кислых и нейтральных гидротерм, гораздо менее изучены
(Соломин, Крайнов, 1998). Геохимический их облик имеет ряд особенностей:
щелочность обусловлена не ионами карбонатной системы, а силикатными и даже
боратными ионами; в водах более активно мигрируют анионогенные элементы, тогда
как катионогенные элементы часто образуют слаборастворимые соединения; более
быстро происходит окисление переменновалентных элементов (Перельман, 1972;
Крайнов, Швец, 1980).
Ранее исследователями было показано, что по
изливу щелочных термальных вод развиваются микробные сообщества с
доминированием цианобактерий, либо хемотрофных микроорганизмов (Горленко и др.,
1985; Юрков и др., 1992; Marteinsson
et al.,
2001; Krienitz
et al.,
2003). Сообщества с доминированием АФБ не были обнаружены, хотя, согласно
имеющимся представлениям, должны быть широко распространены в сульфидсодержащих
термальных водах (Castenholz,
1984).
Зависимость активностей продукционных и
терминальных деструкционных процессов от условий среды была исследована на
примере хемотрофных сообществ щелочных гидротерм (Бонч-Осмоловская и др., 1999;
Brock et
al., 1971; Elsgaard
et al.,
1994). Тогда как данные об интенсивностях продукционных и терминальных
деструкционных процессов в фототрофных сообществах щелочных гидротерм
отсутствуют.
Известно небольшое количество алкалофильных и
алкалотолерантных видов термофильных микроорганизмов (около 30 видов) (Castenholz,
1969; Wiegel, 1998).
Данные об использовании ими неорганических соединений ограничены, известно об
участии в цикле серы, но данные об участии в циклах железа и селена
отсутствуют.
Процессы минералообразования в щелочных условиях
отличаются от нейтральных (Перельман, 1972). Поэтому изучение роли микробного
сообщества щелочных гидротерм в минералообразовании вызывает несомненный
интерес.
Отсюда - задачи настоящей работы:
5. Изучение
состава микробных сообществ щелочных термальных источников в связи с изменением
физико-химических условий.
6. Изучение
активности продукционных и терминальных деструкционных процессов в фототрофных
и хемотрофных микробных сообществах в разных экологических зонах источников.
7. Исследование
экофизиологических особенностей термофильных микроорганизмов участвующих в
циклах углерода и серы в сообществах.
8. Изучение
участия микробных сообществ щелочных гидротерм в минералообразовании.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 Объекты исследования
Были исследованы слабоминерализованные (до 1
г/л) азотные гидротермы Б.р.з. расположенные в Курумканском и Баргузинском
районах Республики Бурятия и минерализованные (до 25 г/л) азотные гидротермы
острова Паоха, расположенного на озере Моно Лейк (Калифорния, США). Полевые
исследования на источниках Б.р.з. проводились в летне-осенний период с 1998 по
2002 год. Пробы на острове Паоха были отобраны В.М. Горленко летом 2000 г.
Химический состав термальных вод приведен в таблице 1. Здесь и далее
слабоминерализованные источники перечисляются в порядке повышения рН воды на
изливе источника.
Гаргинский источник находится в Курумканском
районе Республики Бурятия в долине реки Гарга (левого притока реки Баргузин).
Термальная вода выходит на склоне долины реки из пещеры сечением около 1 м2
и по ложбине стекает к реке, находящейся приблизительно в 100 м от выхода
источника. Выделяющийся газ на 99.27 % состоит из азота (Ломоносов, 1974). По
химическому составу вода сульфатно-натриевая, с низкой минерализацией, равной
1.08 г/л, температура 75°С, рН 7.7. Содержание радона 40 эман. рН воды
источника более низкий по сравнению с другими исследованными нами гидротермами
Байкальской рифтовой зоны. По мнению Замана это может быть объяснено
радиолитическим разложения воды (Замана, 2000).
По изливу источника образуется травертин в форме
купола, состоящего из нескольких ступеней. Максимальная мощность отложений
составляет 2.5 м. Купол имеет овальную форму, длиной 50 м, шириной до 25 м, и
занимает почти всю площадь родниковой воронки. По составу травертин близок к
чисто карбонатно-кальциевым, в нем также фиксируется относительно высокое
содержание SiO2
(3.61%) и MnO (1.27%).
Возраст травертин средневерхнеплейстоценовый, и
составляет 19245-25725 лет (Плюснин, 2000).
Уринский источник расположен в Баргузинском
районе Республики Бурятия в бассейне реки Уро (левого притока реки Баргузин) по
левому берегу ручья Лиственничного в 1.3 км от его устья. Координаты источника
53°39' с.ш., 110°07' в.д. Ближайший населенный пункт - деревня Большое Уро,
находится в 25-28 км от источника. Термальные воды выходят из-под груд
биотитовых гранитов на площади около 200 м2. Воды источника
гидрокарбонатно-сульфатно-натриевого типа.
Температура вод на изливах от 69 до 25°С, рН
8.8-9.1, Eh от -72 до
+199 мВ. Выделяющийся газ на 98 % состоит из азота (Власова и др., 1962).
Сеюйский источник находится в Курумканском
районе Республики Бурятия у северо-восточного замыкания Баргузинской долины на
правом берегу реки Сеи, в 4 км от ее устья. Ближайший населенный пункт -
поселок Майский, находится в 50 км от источника. Выход терм расположен у
подножья террасы высотой 10-12 метров, сложенной мелкозернистым песком. Выход
источника приурочен к озеру размером 4*7 метров и глубиной до 1.5 метров, со
дна которого бьют многочисленные грифоны с температурой воды до 55°С
(Ломоносов, 1974). Выделяющийся газ на 98% состоит из азота. Воды источника
гидрокарбонатно-сульфатно натриевого типа. Температура воды на поверхности
озера 49.7°С, рН 9.5-9.6, Eh
-45 мВ. Минерализация 0.4 г/л.
Аллинский источник расположен по берегам реки
Алла в районе ее выхода из Баргузинского хребта в 7 км на запад от села Алла
Курумканского района Республики Бурятия. Выходы расположены у подножия террас,
на каменистых отмелях, либо на дне боковых проток. Выходы термальных вод
периодически меняют свое местоположение. Основными причинами являются изменение
русла реки при наводнениях, засыпка грунтом и илом выходов термальных вод. Воды
источника гидрокарбонатно-сульфатно натриевого типа. Выделяющийся газ на 98%
состоит из азота (Власова и др., 1962). Большереченский источник находится на
территории Баргузинского государственного биосферного заповедника (Республика
Бурятия) в долине реки Большой, на расстоянии 25-28 км от Байкала,
географические координаты: 54°25' с.ш. и 109°50' в. д. Максимальная температура
воды зарегистрирована на выходе источника №6, согласно обозначению источников
по Мартынову (Мартынов, 1960). Этот наиболее крупный источник стал основным объектом
нашего исследования. Источник принадлежит к азотному типу термальных вод.
Выделяющийся газ на 88% состоит из азота, содержит 0.9% метана, 0.5% CO2,
0.116% гелия (Ломоносов, 1974). Температура воды на выходе 74°С, по данным
наших измерений в различные годы (июль-сентябрь: 1986, 1989, 1996, 2001 г.)
колебалась незначительно, не более 1-2° С. По химическому составу вода
источника относится к гидрокарбонатно-хлоридно-сульфатно-натриевому типу.
Изливающиеся воды содержат также растворенный сульфид в количестве 12-13.4
мг/л. рН воды в различные годы оставался в пределах от 9.25 до 9.8. Источник
Паоха расположен на острове Паоха, на озере Моно-лейк. Озеро расположено в
центральной части штата Калифорния, США, к востоку от хребта Сьерра-Невада.
Озеро расположено в замкнутом бассейне. В результате испарительного
концентрирования содержание солей в воде озера достигает 82-92 г/л. рН воды
озера 9.5. По берегам озера на острове Паоха расположено большое количество
горячих источников. Воды источников минерализованые, щелочные, содержат метан,
поступающий из меторождения природного газа расположенного под дном озера, и
сероводород. Термальные воды содержат высокие конценрации фтора, бора, лития,
йода, ртути и мышьяка (Oremland
et al.,
1987, 2000; Oxburgh
rt al.,
1991; The
Mono Basin...,
1987).
Термальные воды источника Паоха обладают
температурой 84-94°С, минерализацией 25 г/л, рН 9.7. Содержание сероводорода 55
мг/л. Воды хлоридного кальциевого-натриевого состава.
2.2 Методы полевых исследований
Пробы воды, почв для микробиологического анализа
отбирали в стерильную посуду. Пробы мата для химических анализов и для
радиоизотопных экспериментов отбирали пробочным сверлом площадью 1 см2.
Введение радиоизотопов и фиксацию проб для химических и микробиологических
определений проводили сразу после отбора проб. До проведения анализов пробы
хранили в темноте в холодильнике.
В местах отбора проб измеряли температуру, рН,
окислительно-восстановительный потенциал (Eh),
минерализацию. Температуру измеряли сенсорным электротермометром Prima
(Португалия), рН определяли потенциометрически при помощи портативного рН-метра
(рНер2, Португалия). Для определения окислительно-восстановительного потенциала
использовали портативный измеритель redox-потенциала
ORP (Португалия).
Минерализацию воды определяли при помощи портативного тестер-кондуктометра TDS-4
Кислород в воде источника определяли методом
Винклера (Резников и др., 1970). Концентрацию сульфида определяли
колориметрически с парафенилендиамином на полевом спектрофотометре ПФЭК-П-2 (Tbper,
Schlegel, 1964).
Концентрации тиосульфата и сульфита определяли йодометрическим методом
(Резников и др., 1970). Концентрацию сульфата определяли турбидиметрическим
методом (Резников и др., 1970). Содержание железа определяли роданидным
(Резников и др., 1970) и феррозиновым (Stookey,
1970) методами. Содержания карбонатов в полевых условиях определяли титрованием
(Резников и др., 1970).
2.3 Методы лабораторных исследований
.3.1 Методы культивирования и изучения роста
бактерий в зависимости от физико-химических факторов
Учет численности жизнеспособных клеток
микроорганизмов проводили методом 10-ти кратных разведений на элективных
средах. Выделение, учет численности и культивирование цианобактерий проводили
на жидкой среде Кастенхольца (Castenholz,
1969). Выделение и учет численности аноксигенных фототрофных бактерии (АФБ)
вели на агаризованной (0.2%) модифицированной среде Пфеннига (Pfennig,
1965), содержащей в литре дистиллированой воды: KH2PO4
- 0.5 г, NH4O
- 0.5 г, MgSO4*7H2O
- 0.5 г, KCl - 0.5 г, NaCl
- 0.5 г, CaCl2*2H2O
- 0.05 г/л, NaHCO3
- 1.5 г/л, раствор микроэлементов по Пфеннигу - 1мл (Pfennig,
Lippert, 1966), витамин В12
- 20 мкг, ацетат-Na
- 1 г, дрожжевой экстракт -0.1 г, Na2S2Os*5H2O
- 1 г, Na2S*9
Н2О - 0.3 г. рН среды доводили 0.1 М растворами HCl
и NaOH до 8.0-8.5 при
25°С, температура инкубации 30 и 50°С.
Опыт по культивированию Chloroflexus
aurantiacus в присутствии
железа проводился на среде для АФБ со следующими изменениями: раствор фолиевой
кислоты (0.02 г/л) и рибофлавина (0.05 г. л) - 1мл, раствор тиамина (0.05 г/л)
и пантотеновой кислоты (0.05 г/л) - 1 мл, раствор никотиновой кислоты (0.05
г/л), биотина (0.02 г/л), ПАБК (0.05 г/л), пиридоксина (0.1 г/л) - 1мл, NaHCO3
- 2 г/л, FeSO4*7Н2О - 2.8 г, из состава среды удалены Na2S2O3*5H2O,
Na2S*9
Н2О, ацетат-Na
и дрожжевой экстракт. рН устанавливался 7.2. Инокулят был подготовлен на среде
с 100 мг/л дрожжевого экстракта. Эксперимент проводился в 3 повторностях. Среда
по 30 мл анаэробно разливалась в пузырьки по 50 мл, продувалась азотом. Культивирование
проводилось при 50°С. Анаэробный рост в темноте проверялся на среде
аналогичного состава содержащей 100 мг/л дрожжевого состава в пузырьках на 50
мл заполненых наполовину, культивирование проводилось под ватными пробками при
50°С. рН устанавливали 7.5 при 25°С.
Выделение и культивирование штаммов Meiothermus
ruber проводилось на
среде для АФБ со следующими изменениями: NaHCO3
- 0.5 г, дрожжевой экстракт - 0.5 г, из состава среды удалены ацетат-Na
и Na2S*9
Н2О. рН устанавливали 7.5-8.5 при 25°С. Температура инкубации 50°С.
Культивирование проводили в колбах заполненых средой наполовину, под ватными
пробками, и на агаризованой (0.2%) среде того же состава.
Выделение и культивирование "Anaerobranca
californiensis"
проводилось на среде для АФБ со следующими изменениями: MgSO4*7H2O
- 0.2 г, Na2SO4
- 0.5 г, NaCl - 25 г, NaHCO3
- 5 г, Na2CO3
- 5 г, дрожжевой экстракт - 2 г, цистеин - 0.25 г, пептон - 1 г, из состава
среды удалены CaCl2*2H2O
и ацетат-Na. рН
устанавливали 9.3-9.7 при 25°С.
Температура инкубации 58°С. Культивирование
проводили в полностью заполненных пузырьках, либо на чашках Петри с Gel-Grotm
(1.2%) (ICN
Biochemicals, Ohio,
USA) со средой того же
состава, в последнем случае культивирование проводилось в анаэростате в
атмосфере азота.
Штаммы Anaerobranca
horikoshii (DSM
9786) и A. gottschalkii
(DSM 13577)
культивировали на среде использовавшейся для культивирования "A.
californiensis" со
следующими изменениями. Для A.gottschalkii:
глюкоза - 2 г, NaCl
- 10 г, из состава среды уделен Na2S*9H2O.
Для A. horikoshii:
NaCl - 0.5 г, фумарат -
1.5 г, Ш2Ш3 - 1.8 г, NaHCO3
-1.8 г, Na2S*9H2O
- 0.125г. рН в обоих случаях устанавливали 9.3-9.7 при 25°С. Температура
инкубации 58°С.
Выделение и культивирование Ectothorhodospira
shaposhnikovii проводилось
на среде для АФБ со следующими изменениями: NaCl
- 10 г, Na2CO3
- 5 г, NaHCO3
- 5 г, дрожжевой экстракт - 1 г. рН устанавливали 9.3-9.7 при 25°С. Температура
инкубации 25°С.
Выделение и культивирование штаммов термофильных
сульфатредуцирующих бактерий проводили на модифицированной среде Постгейта
(Кузнецов, Дубинина, 1989), содержащей в литре дистиллированой воды: KH2PO4
- 0.5 г, NH4Cl
- 1 г, CaCl2*2H2O
- 0.3 г, Na2SO3
- 0.7 г, MgCb *6H2O
- 0.3 г, NaCl - 1 г, NaHCO3
- 0.5 г, Na2S*9H2O
- 0.1 г, раствор микроэлементов по Пфеннигу - 1мл (Pfennig,
Lippert, 1966), витамин В12
- 20 мкг, дрожжевой экстракт - 0.5 г, лактат натрия - 3.5 г. рН среды доводили
0.1 М растворами HCl
и NaOH до 8 при 25°С.
Температура инкубации 58°С. Культивирование проводили в полностью заполненных
пузырьках, либо на агаризованой (0.2%) среде того же состава.
Определение видовой принадлежности цианобактерий
проводили на основании морфологических признаков по определителю Голлербах и
др. (1953). Идентификацию аноксигенных фототрофных бактерий проводили по
совокупности фенотипических признаков (морфологии клеток, содержанию хлорофилла
и каротиноидов, способности к гетеротрофному и автотрофному росту на сульфиде,
способности к росту аэробно в темноте, отношению к температуре и рН среды).
Температурные диапазоны развития бактерий устанавливали в градиентном
термостате по описанной ранее методике (Юрков и др., 1991). Диапазон рН
определялся с разными концентрациями бикарбоната и карбоната натрия. Для ряда
бактерий определение температурного оптимума и оптимума рН проводили в
краткосрочных опытах с помощью 14 С-бикарбоната по описанной ранее методике
(Горленко, Кикина, 1979). Диапазон развития при разной минерализации среды
определялся с разными концентрациями хлорида натрия, бикарбоната и карбоната натрия.
Способность к использованию различных источников углерода проверяли на средах
содержащих 0.1 г/л дрожжевого экстракта, в которую вносили испытуемые источники
углерода в концентрации 2 г/л. Способность к использованию неорганических
соединений проверяли на средах, содержащих 0.1 г/л дрожжевого экстракта, в
которые были внесены испытуемые соединения в конечной концентрации 0.5-10 мМ.
Биомассу бактерий определяли по изменению оптической плотности культуры при
длине волны 650 нм на фотометре КФК-3. Спектр поглощения клеток АФБ определяли
в ацетон-метанольных экстрактах (7:2) и in
vivo в 50% растворе
глицерина. Клетки предварительно разрушали с помощью ультразвука. Биохимические
свойства бактерий, удельную скорость роста, численность бактерий определяли общепринятыми
методами (Герхардт, 1984).
.3.2 Методы электронной микроскопии
Для приготовления ультратонких срезов
бактериальные клетки фиксировали по Ryter&Kellenberger
(1958) и заключали в смесь эпоксидных смол (эпон). Срезы получали на ультратоме
LKB "Ultrotome
Nova" и помещали
на медные сеточки покрытые коллодиевой пленкой и напыленные углеродом.
Препараты окрашивали по Reynolds
(1963). Тотальные препараты для электронной микроскопии получали обработкой
клеток 1%-ной фосфовольфрамовой кислотой (ФВК), нейтрализованной щелочью до рН
7.
Анализ вертикальной структуры микробных
сообществ с применением стекол обрастания и электронной сканирующей микроскопии
проводился по описанной ранее методике (Юрков, Горленко, 1989). Сколы
травертина просматривались под электронным сканирующим микроскопом, образцы
прикреплялись к металлическому держателю с помошью углеродного клея.
Исследуемая площадь на каждом образце составляла 0.05 мм2.
Тотальные препараты, ультратонкие срезы, стекла
обрастания и образцы травертина просматривали под электронным микроскопом JEM-100C
или JEM-7 при
ускоряющем напряжении 80 кВ и инструментальном увеличении от 8000 до 50000.
.3.3 Методы гено- и хемосистематики
Выделение и очистка ДНК проведены А.М. Лысенко
по стандартным методам (Marmur,
1961). Содержание ГЦ в ДНК определяли по температуре плавления ДНК (Tm)
и рассчитывали по формуле Оуэна (Owen
et al.,
1969), гомологию ДНК-ДНК изучали методом оптической реассоциации (De
Ley, 1970) на приборе
"Pye-Unicam
SP 1800"
(Англия). Амплификацию и секвенирование генов 16S
рРНК выделенных чистых культур проводился компанией MWG
Biotech (High
Point, North
Carolina) с использованием
следующих праймеров 5' -GTTTGATCCTGGCTCAG-3',
5' -ACGGYTACCT-TGTTACGACTT-3'
и использованием специального набора TA
cloning kit
(Invitrogen,
Carlsbad, California).
Анализ последовательностей генов 16S
рРНК выделенных штаммов был выполнен Т.П. Туровой с использованием программного
обеспечения Ribosomal
Database
Project. Укорененное
филогенетическое дерево исследуемых бактерий было создано с помощью пакета
программ TREECON
(Van de
Peer, De
Wachter, 1994).
.3.4 Методы определения скорости микробных
процессов
Пробы воды и почвы для радиоизотопных работ
отбирали в стерильные флаконы, которые закрывали пробками и обжимали
алюминиевыми крышками. Радиомеченные вещества вводили в пробу с помощью шприца.
При этом лишний объем воды из флакона вытесняли через иголку. Инкубацию
проводили на свету и в темноте, поместив в воду источника на месте отбора пробы
на 6-24 ч. Радиоактивность меченных соединений определяли на жидкостном
сцинтилляционном счетчике Rackbetta
(Швеция).
Для определения световой и темновой продукции
использовали NaH14СO3 (Иванов, 1956; Кузнецов, Романенко,
1963). В пробы вносили радиометку с активностью 25 мкк. Пробы фиксировали 10 N NaOH.
Диурон (3-(3,4-дихлорофенил)-1,1-диметилмочевина) в конечной концентрации 7 дМ
применяли для ингибирования оксигенного фотосинтеза. В ряде экспериментов
проводилось стимулирование продукционных процессов цитратом железа в конечной
концентрации 0-5 г/л железа. Пробы обрабатывали на установке УЗДН-2 с частотой
22 МГц и мощностью 0,4 мА в течение 2 минут. Фильтровали через мембранные
фильтры с диаметром пор 0,2 мкм. Фильтры промывали тремя объемами воды с рН
2-3, высушивали и измеряли радиоактивность. При определении интенсивности
сульфатредукции использовали метод Иванова (1956). Для этого в пробу вносили
0,1-0,2 мл Na235SO4
с активностью 0,1-1 мКюри и инкубировали в течение 0,4-2 суток. Фиксацию
интенсивности сульфатредукции производили путем введения в пробу 10-25 %
раствора ацетата Cd.
Интенсивность метаногенеза измеряли с помощью №14НСО2
(Лауринавичус, Беляев, 1978). Пробы фиксировали 10 N
NaOH. Образовавшийся
меченный метан продували и сжигали до 14СО2 при температуре 7000С.
Образовавшийся после сжигания 14СН4 14СО2 улавливали
сцинтилляционным раствором, одним из основных компонентов которого был
Р-дифенилэтиламин.
Для расчета интенсивности микробных процессов
применяли следующую формулу:
А = гЩ
R-t
где А - интенсивность процесса, C
- концентрация субстрата, r
- радиоактивность продукта реакции, R
- радиоактивность введенного в пробу меченного субстрата, t
- время инкубации.
Результаты определения скоростей
микробиологических процессов радиоизотопным методом и балансовые уравнения
реакции позволяют рассчитать количество использованного бактериями
органического углерода:
Сульфатредукция Коэффициент расчета расхода С
Сорг + SO42-
- S2-
+ CO2 24 г С32 г S0,75
Метаногенез
Н2 + 4CO2
- СН4 + Н2О + 3CO2
г С 12 г С4
2.3.5 Методы определения содержания пигментов в
микробных матах
Определение содержания хлорофилла а в микробных
матах гидротерм Б.р.з. проводилось спектрофотометрически в этанольных
экстрактах. Для расчетов содержания хлорофилла а использовали формулу:
мг (хл a)
= 11.9*OD665*(v/l),
где OD665
- оптическая плотность при длине волны 665 нм, v
- объем экстракта в мл, l
- длина кюветы (A
manual..., 1969).
Присутствие бактериохлорофилла с в образцах микробных матов определялось по
наличию длинноволнового максимума на спектрах in
vivo при 740 нм.
3. Исследование
микробных сообществ щелочных гидротерм
В данном разделе рассматриваются микробные
сообщества исследованных нами термальных источников Б.р.з. и минерализованного
озера Моно Лейк в порядке повышения рН воды на изливе источников.
.1 Гаргинский источник
.1.1 Распространение и видовой состав микробных
сообществ в связи с изменением физико-химических условий среды
Выход источника покрыт серым песком. Температура
воды на выходе составляет 75°С, в воде источника присутствует менее 0.1 мг/л
сульфида, рН воды на выходе 7.7.
Таблица 2. Физико-химические условия в
биологических зонах Гаргинского источника
|
Биологическая
зона
|
Описание
микробного мата
|
Т,
°С
|
H2S, мг/л
|
Eh
|
рН
|
SO4 (в мате), мг/л
|
|
Зона
излива
|
Видимых
обрастаний нет
|
75-57
|
<0.1
|
|
7.7
|
|
|
I
|
Тонкий
налет на дне русла
|
57-54
|
|
|
8.4
|
256
|
|
II
|
Желто-зеленый
двуслойный мат толщиной до 1 см
|
53-45
|
|
|
8.5
|
260
|
|
III
|
Оранжевый,
двуслойный мат толщиной до 5 мм
|
44-30
|
|
|
8.8
|
260
|
|
IV
|
Оранжево-бурый
мат толщиной до 1 см
|
44-30
|
|
|
9.1
|
400
|
На расстоянии 3 метров от выхода (при
температуре 74-70°С) дно русла покрыто черным осадком MnO.
Микробные маты появляются на расстоянии 7-10 метров от выхода, при температуре
57°С (таб. 2, рис. 2а). По нашим наблюдениям расположение русла в этой области
периодически изменяется. Вероятно, это связано с литификацией микробных матов,
либо с хемогенным осаждением карбоната кальция. Далее по изливу источника рН
воды повышается с 7.7 до 9.1 в результате дегазации СО2 и фотосинтетической
активности микробных сообществ.
Во время наблюдений проведенных в 1997, 1999,
2000, 2001, 2002 годы расположение микробных матов было различным в связи с
периодическими изменениям русла источника и литификацией микробного мата, тем
не менее типы микробных сообществ в различных температурных зонах источника
были неизменными. На выходе источника (Т 75°С) и в зоне выпадения черного
осадка MnO видимых
микробных обрастаний нет, что может быть объяснено высокой скоростью
минералообразования в источнике (рис. 2б).
При температуре 57°С, рН 8.4 и при практическом
отсутствии сульфида в воде по дну русла источника появляется тонкий зеленый
налет (Зона I). Доминирует цианобактерия Phormidium
angustissimum. В меньшем
количестве встречются цианобактерии Anabaena
contorta и Synechococcus
lividus и аноксигенная
фототрофная бактерия Chloroflexus
aurantiacus (таб.3). Из проб
мата была выделена культура сульфатредуцирующей бактерии. По краям мата,
выступающим над поверхностью воды, происходит выпадение карбоната кальция.
При температуре 54-45°С и рН 8.4 развивается
желто-зеленый двуслойный мат толщиной до 1 см (Зона II).
На участках не покрытых термальными водами поверхность мата желто-зеленая.
Верхний желто-зеленый слой пронизан газовыми полостями с доминированием Phormidium
angustissimum (рис. 2г). В
нижнем темно-зеленом слое также доминирует Phormidium
angustissimum, в меньшем
количестве встречаются Anabaena
contorta, Anabaena
minutissima, Synechococcus
lividus и нитчатые зеленые
бактерии Chloroflexus
aurantiacus. На участках мата
покрытых термальными водами поверхность мата темно-зеленая. Видовой состав
аналогичен, хотя доминирует цианобактерия Anabaena
contorta (рис 2д). На
участках мата периодически подвергающихся воздействию более высокой температуры
в поверхностных слоях мата отмечается большое количество пустых чехлов нитчатых
цианобактерий рода Phormidium
(температура поверхностных слоев может доходить до 65°С, тогда как температура
внутри мата составляет 50-35°С). Из проб микробных матов зоны II
был выделен штамм аноксигенной фототрофной бактерии Chloroflexus
aurantiacus. На выступающих
над поверхностью мата участках выпадает карбонат кальция. Площадь
литифицированных участков в разные годы различается. Можно предположить, что с
течением времени площадь литифицированных участков увеличивается и они
сливаются в сплошную поверхность. Затем, при сдвиге русла источника, по
литифицированной поверхности происходит образование нового микробного мата.
При температуре 44-30°С и рН 8.8 развивается
двуслойный мат толщиной до 5 мм (Зона III).
Поверхность мата ярко оранжевого цвета, в ней доминируют Phormidium
angustissimum и Anabaena
minutissima. Толща мата
светло-зеленого цвета. В ней встречается Chloroflexus
aurantiacus. В этой зоне
наибольшее видовое разнообразие цианобактерий. Встречаются также Phormidium
valderie
f. tenue,
Phormidiun
molle, Oscillatoria
tambi f.
uralescens, Lyngbia
aestuarii, Anabaena
contorta, Gloeocapsa
minuta и Microcystis
pulverea. Из проб микробных
матов был выделен штамм аноксигенной фототрофной бактерии Chloroflexus
aurantiacus. На выступающих
над поверхностью мата участках выпадает карбонат кальция.
Зона IV. Кроме проб отобранных из русла
источника были отобраны пробы мата находящегося в стороне от основного русла. В
этой зоне поступление воды из источника ограничено, при прохождении через мат
вся вода испаряется с поверхности или просачивается в породу под матом (рис.
2в). Температура воды понижается с 44 до 30°С. Содержание сульфата в воде
возрастает до 400 мг/л (по сравнению с 270 мг/л в основном русле), что,
вероятно, связано с концентрированием в результате испарения и уменьшением
вымывания из мата. Толщина мата около 1 см. Поверхность оранжево-бурого цвета,
толща мата обесцвеченная. В поверхностном слое доминирует Phormidium
angustissimum. В толще мата
также доминирует Phormidium
angustissimum, но обесцвеченный
и с более толстыми чехлами. Также в мате встречаются Anabaena
contorta и Anabaena
minutissima. Литификация
микробного мата не происходит. Микробный мат высыхает и образует тонкие
постепенно разрушающиеся корки
Таким образом, по изливу источника происходит
смена микробных сообществ, вызванная изменением физико-химических параметров
среды обитания. С уменьшением температуры состав фототрофного сообщества
расширяется и достигает максимального разнообразия при 40°C.
При уменьшении поступления воды источника происходит снижение видового
разнообразия фототрофного сообщества. Во всех зонах цианобактерии доминируют в
составе микробного мата. Особенностью видового состава микробного сообщества
источника является доминирование цианобактерий рода Anabaena
в
некоторых точках. Аноксигенные фототрофные бактерии встречаются в меньшем
количестве, чем цианобактерии.
Таблица 3. Распространение цианобактерий в
микробных матах Гаргинского источника

Примечание: "++" - доминирующий вид,
"+" - вид присутствует.
.1.2 Биогеохимическая активность
Исследование содержания пигментов в микробных
матах источника было проведено в 1997 и 2000 годах. Анализ спектров in
vivo микробных матов
показывает, что в них доминирует хлорофилл а, что указывает на преобладание
цианобактерий в составе мата. Измерение содержания хлорофилла а в этанольных
экстрактах показывает, что с понижением температуры содержание пигмента в матах
постепенно возрастает. В зоне I содержание хлорофилла а 7-108 мг/м2,
тогда как в зонах II и III достигает 429 мг/м2 и 420 мг/м2
соответственно. В зоне IV - 32 мг хл а/м2. В различные годы
содержание хлорофилла а колеблется в широком диапазоне. Так, указанное
максимальное содержание хлорофилла было зафиксировано в 1997 году, тогда как в
2000 году содержание хлорофилла не превышало 35 мг/м2. Подобные
колебания могут быть объяснены литификацией и захоронением микробного мата.
Определение скоростей
продукционно-деструкционных процессов было проведено в 1997, 2000, 2001, 2002
годах. Результаты экспериментов с использованием 14 С-бикарбоната показали, что
с понижением температуры скорость фотосинтеза в матах постепенно возрастает
(таб. 4, рис. 3).
В зоне излива источника фотосинтез не
обнаруживается. Далее по изливу источника в зоне I
при температуре 57-54°С скорость оксигенного фотосинтеза составляла в различные
годы от 0.01 гС/м2 до 0.303 гС/м2. Скорость аноксигенного
фотосинтеза (от 0.032 до 0.2 гС/м2 сут) практически равна скорости
оксигенного фотосинтеза. Доля оксигенного фотосинтеза колеблется от 24 до 60%,
доля аноксигенного колеблется от 40 до 76%. В цианобактериальных матах,
развивающихся в зоне II
при температуре от 53 до 45°С, скорость оксигенного фотосинтеза составляет от
0.13 до 1.27 гС/м2 сут. Скорости аноксигенного фотосинтеза в
значительно ниже (от 0.047 до 0.459 гС/м2 сут). Доля оксигенного
фотосинеза составляет от 69 до 90%. Доля аноксигенного от 10 до 31%. При
понижении температуры до 44°N
в зоне III скорость оксигенного фотосинтеза понижается и составляет 0.86 гС/м2
сут. Скорость аноксигенного фотосинтеза составляет 0.102 гС/м2 сут.
Доля оксигенного фотосинтеза составляет 89%, доля аноксигенного 11%. В зоне IV
при температуре 44 до 30°С скорость оксигенного фотосинтеза падает до 0.128
гС/м2 сут, скорость аноксигенного фотосинтеза составляет 0.112 гС/м2
сут. Доля оксигенного фотосинтеза составляет 53%, аноксигенного 47%.
Скорость темновой фиксации в зоне излива
составляет 0.19 гС/м2
сут. С дальнейшим понижением температуры постепенно возрастает и достигает
максимума в зоне III при 40°С (1.2
гС/м2 сут).
Скорость сульфатредукции в микробных матах вдоль
русла источника была исследована с применением 35S - сульфата.
В зоне излива источника происходит образование сероводорода за счет
сульфатредукции со скоростью 0.013 tS/м2
сут. Процессы идут, видимо, за счет доноров электронов, поступающих с водой
(Н2, органическое вещество). По изливу скорость сульфатредукции в микробных
матах постепенно возрастает (рис. ) и
достигает максимума при 45°С (2.13 tS/м2
сут). При дальнейшем понижении температуры до 40°С
скорость сульфатредукции падает до 0.293 tS/м2
сут. В зоне IV при температуре 36°С скорость сульфатредукции составляет
1.19 tS/м2
сут.
Скорость водородного метаногенеза незначительна.
В зоне излива достигает 169 мкгС/м2
сут и достигает максимума (398 мкгС/м2
сут) при 45°С.
Доминирующим процессом терминальной деструкции в
микробных матах источника является сульфатредукция. Максимальная величина
расхода органического вещества через сульфатредукцию составляет 1.6 гС/м2 сут, тогда как
через метаногенез расходуется максимум 1.4
мгС/м2 сут.
С понижением температуры продуктивность систем
резко возрастает. Как следствие, суммарная деструкция также ускоряется, хотя и
не так быстро, как продукция органического вещества. В зоне II, где
скорости этих процессов максимальны, через метаногенез и сульфатредукцию
минерализуется до 60% органического
вещества. Большая часть оставшегося органического вещества микробных матов,
очевидно, используется в процессах кислородного дыхания или захоранивается в
процессе литификации мата. Обращает на себя внимание значительное превышение
деструкции над продукционными процессами в зоне IV, где
расход органического вещества составляет 370%.
Это может быть объяснено временным снижением скоростей продукционных
процессов в микробном мате вследствие уменьшения дебита поступающей в мат воды
и последующим дисбалансом системы.
Таким образом, в Гаргинском источнике наиболее
продуктивными являются сообщества развивающиеся при температуре 53-45°С (зона II). Доминирующим
продукционным процессом является оксигенный фотосинтез. Высокой скорости
достигает темновая фиксация углекислоты. Доминирующим процессом терминальной
деструкции является сульфтредукция, роль метаногенеза незначительна.
.2 Уринский источник
.2.1 Распространение и видовой состав микробных
сообществ в связи с изменением физико-химических условий среды
В Уринском источнике, в воде которого
отсутствует сульфид, невозможно выделить несколько биологических зон
последовательно сменяющих друг друга вдоль русла источника. Термальные воды
изливаются между глыбами биотитовых гранитов в нескольких, хаотично
расположенных местах. Поэтому мы выделяем 8 типов микробных сообществ и
объединяем их в 4 группы согласно температуре их обитания (таб.5).
Таблица 5. Физико-химические условия в
биологических зонах Уринского источника.
|
Группа
|
Точка
|
Описание
микробного мата
|
Т,
еС
|
H2S, мг/л
|
Eh
|
рН
|
|
Зона
излива
|
8
|
Микробные
обрастания
|
66-69
|
<
0.1
|
-33
|
8.8
|
|
65-60еС
|
5
|
Двуслойный
желто-зеленый мат
|
64
|
|
70
|
8.8
|
|
6
|
Белые
космы
|
63
|
|
28
|
8.8
|
|
7
|
Ярко-оранжевые
обрастания
|
61
|
|
-130
|
8.8
|
|
45-50еС
|
2
|
Оранжевый
трехслойный мат
|
47.6
|
|
178
-196
|
9.7
*
|
|
1
|
Изумрудно-зеленый
двуслойный мат
|
46.5
|
|
138
*
|
8.8,
9.1 *
|
|
40-35еС
|
4
|
Двуслойный
желто-зеленый мат
|
40
|
|
199
|
9.7
*
|
|
3
|
Темно-коричневые
космы
|
38.5
|
|
168
|
9.2
|
Примечание: * - на поверхности мата.
Зона излива
В зоне излива при температуре 66-69°С
значительные микробные обрастания отсутствуют (ст. Уро-8). Дно источника
покрыто серым песком, микробные обрастания обнаруживаются только на поверхности
занесенного человеком органического вещества (остатки макарон). Обрастания
оранжевого цвета, занимают незначительную площадь.
В составе обрастаний обнаружены Chloroflexus
aurantiacus и цианобактерии Phormidium
laminosum (таб. 6).
Группа 65-60°С.
При температуре 64°С у одного из выходов вдоль
русла источника развивается двуслойный плотный мат желто-зеленого цвета
толщиной около 1 см (ст. Уро-5). Верхний слой желто-зеленого цвета толщиной
около 1 мм. В нем доминируют Phormidium
laminosum и встречаются Synechococcus
lividus, Oscillatoria
sp., (2.5-3 мкм
толщиной), Pleurocapsa
sp. и Chloroflexus
aurantiacus. Нижний слой
толщиной 1 см многослойный, зеленого цвета с прожилками. В воде источника мат
теряет зеленый цвет и образует розовый многослойный хрящ толщиной около 1 см.
Из проб микробных матов был выделен штамм аноксигенной фототрофной бактерии Chloroflexus
aurantiacus. При температуре
63°С у одного из выходов источника в русле развиваются длинные белые космы со
слабо-розовым оттенком (ст. Уро-6.). Thermothrix
sp. при
микроскопировании не обнаружен. В обрастаниях преобладают пустые чехлы нитчатых
цианобактерий (рис. 4д). Среди цианобактерий доминирует Phormidiym
laminosum, встречается Mastigocladus
laminosus, реже Phormidium
fragile, Oscillatoria
limosa, Synechococcus
lividus .
На дне русла в большом количестве встречаются
остатки пищи (ст. Уро-7). По остаткам макарон и по дну ручья при температуре
61°С развивается ярко-оранжевый налет Chloroflexus
aurantiacus и цианобактерии Phormidiym
laminosum. Из проб микробных
обрастаний был выделен штамм аноксигенной фототрофной бактерии Chloroflexus
sp. Анализ спектра in
vivo микробного мата
показывает доминирование хлорофилла а.
Группа 45-50°С. При температуре 47°С вдоль русла
источника развивается трехслойный мат оранжевого цвета (ст.Уро-2). Верхний слой
желтого цвета толщиной около 2 мм. В составе доминирует Phormidium
laminosum и Synechococcus
lividus, в меньшем
количестве встречается Mastigocladus
laminosus, Chloroflexus
aurantiacus, диатомеи. Между
верхним и средним слоями в большом количестве небольшие полости. Средний слой
толщиной 4 мм светло-зеленого цвета, доминирует Phormidium
laminosum, часто встречается
Synechococcus
lividus, в небольших
количествах Mastigocladus
laminosus. Нижний слой
темно-зеленого цвета толщиной 3 мм. Под нижним слоем находится серая масса
толщиной около 7 мм.
При температуре 46°С в русле источника
развивается двуслойный мат изумрудно-зеленого цвета толщиной около 2 мм (ст.
Уро-1). Верхний слой темный, толщиной 1 мм. Доминирует Phormidium
laminosum (до 90 % по
объему), в большом количестве встречается Synechococcus
lividus, Oscillatoria
limosa, Phormidium
fragile, Chloroflexus
aurantiacus. Единично
встречаются Mastigocladus
laminosus и Calothrix
elenkinii. Нижний слой
светлый, толщиной 1 мм, видовой состав и соотношение видов аналогично верхнему
слою.
Группа 40-35°С.
При температуре 40°С развивается широкое поле
матов. Мат двуслойный. Верхний слой толщиной 2-3 мм желтого цвета (ст. Уро-4).
Доминирует Phormidium
laminosum, часто встречается
Phormidium
phragile, реже Oscillatoria
chalybea, Oscillatoria
limosa, Anabaena
sp., Calotrix
Elenkinii и Mastigocladus
laminosus. Нижний слой
толщиной 5-6 мм темно-зеленого цвета. Доминируют Mastigocladus
laminosus и Phormidium
laminosum. Часто встречаются
Gloecapsa
minor. Редко встречается
Oscillatoria
limosa, Phormidium
fragile и Calotrix
parietina.
Уро-3. При температуре 38°С развиваются
темно-коричневые, почти черные космы толщиной 2-3 мм. Доминирует Oscillatoria
limosa (рис. 4а).
Встречаются Mastigocladus
laminosus и Phormidium
laminosum.
Таким образом, с уменьшением температуры в
Уринском бессульфидном источнике состав фототрофного сообщества расширяется и
достигает максимального разнообразия при 40-35°C.
Исключение составляет станция Уро-3. В этой точке видовое разнообразие фототрофного
сообщества резко снижается, что может быть объяснено затенением микробного мата
нитями Oscillatoria
limosa с высоким
содержанием пигмента. Во всех зонах цианобактерии доминируют в составе
микробного мата. Аноксигенные фототрофные бактерии встречаются в меньшем
количестве, чем цианобактерии. Особенностью видового состава микробного
сообщества источника является присутствие цианобактерий Mastigocladus
laminosus, не встречающихся
более в других источниках.
Таблица 6. Распространение фототрофных бактерий
в биологических зонах Уринского источника

.2.2 Биогеохимическая активность
Исследование содержания пигментов и определение
скоростей продукционно-деструкционных процессов в микробных матах источника
было проведено в 1997, 2000 и 2002 годах. Анализ спектров in
vivo микробных матов
показывает, что в них доминирует хлорофилл а, что указывает на преобладание
цианобактерий в составе мата. Максимальное содержание хлорофилла а
обнаруживается при температуре 45-50°С (892 мг/м2), при более
высоких температурах (60-65°С) обнаруживается 35-82 мг/м2. При
температуре 35-40°С содержание хлорофилла а достигает 463 мг/м2
(таб. 7).
Результаты экспериментов с использованием 14
С-бикарбоната показали, что с понижением температуры скорость фотосинтеза в
матах постепенно возрастает (рис. 5). Доля оксигенного фотосинтеза
увеличивается, а аноксигенного падает. В зоне излива источника скорость
оксигенного фотосинтеза составляет 0.01-0.07 гС/м2 сут, скорость
аноксигенного 0.05-0.14 гС/м2 сут. Доля оксигенного фотосинтеза
колеблется от 26 до 36%, доля аноксигенного от 64 до 74%.
При температуре 65-60°С скорость оксигенного
фотосинтеза составляет от 0.002 до 0.16 гС/м2 сут, аноксигенного от
0.0076 до 1.16 гС/м2 сут. Доля оксигенного фотосинтеза колеблется от
2 до 92%, доля аноксигенного от 8 до 98%. При температуре 45-50°С скорость
оксигенного фотосинтеза составляет от 0.89 до 2.64 гС/м2 сут,
аноксигенного от 0.14 до 0.6 гС/м2 сут. Доля оксигенного фотосинтеза
колеблется от 80 до 94%, доля аноксигенного от 6 до 20%. При температуре
35-40°С скорость оксигенного фотосинтеза составляет от 0.04 до 3.35 гС/м2
сут, аноксигенного от 0.04 до 0.51 гС/м2 сут. Доля оксигенного
фотосинтеза колеблется от 50 до 94%, доля аноксигенного от 6 до 50%. Высокая
скорость аноксигенного фотосинтеза в высокотемпературных микробных матах может
быть объяснена достаточно высокими величинами скорости сульфатредукции.
Скорость темновой фиксации в зоне излива
составляет 0.31 гС/м2 сут. С понижением температуры возрастает и
достигает максимума при 45-50°С (1.95 гС/м2 сут). При понижении
температуры до 35-40°С скорость темновой фиксации падает до 0.2-0.45 гС/м2
сут.
Скорость сульфатредукции в микробных матах по
изливу источника была исследована с применением радиоактивного 35S
- сульфата. В зоне излива источника происходит образование сероводорода за счет
сульфатредукции со скоростью 0.1-1.7 гё/ м2 сут. Процессы идут,
видимо, за счет доноров электронов, поступающих с водой (Н2, органическое
вещество) и за счет органического вещества накопленного в отложениях на дне
русла. По изливу скорость сульфатредукции в микробных матах возрастает и
достигает максимума при 65-60°С (0.0082-5.53 tS/м2
сут). При дальнейшем понижении температуры скорость сульфатредукции падает до 0.0041-1.49 г S/м2 сут, с небольшим
максимумом при 45°С. Скорость
водородного метаногенеза незначительна. В зоне излива достигает 131-562 мкгС/м2 сут, с
понижением температуры падает до 14-18.3 мкгС/м2
сут при 35-40°С. Таким образом,
доминирующим процессом терминальной деструкции в микробных матах Уринского
источника является сульфатредукция. Максимальная величина расхода органического
вещества через сульфатредукцию составляет 4.15
гС/м2 сут, тогда как через метаногенез расходуется максимум 2.2 мгС/м2 сут.
По изливу с понижением температуры
продуктивность систем резко возрастает. Как следствие, суммарная деструкция
также ускоряется, хотя и не так быстро, как продукция органического вещества. В
зонах с температурами 35-40, 45-50°С
где скорости продукционно-деструкционных процессов максимальны, через
метаногенез и сульфатредукцию минерализуется до 61%
органического вещества. Большая часть оставшегося органического вещества
микробных матов, очевидно, минерализуется в процессах кислородного дыхания или
захоранивается. Обращает на себя внимание значительное превышение деструкции
над продукционными процессами в зоне излива и при температурах 65-60°С, где расход органического
вещества составляет до 400% от
продукции. Это дисбаланс может быть объяснен прекращением поступления доноров
электронов при инкубировании изолированной пробы и занижением скорости темновой
фиксации углекислоты, тогда как процесс сульфатредукции в пробе, скорее всего,
продолжается за счет деструкции накопленного органического вещества. Таким
образом, в Уринском источнике наиболее продуктивными являются сообщества
развивающиеся при температуре 45-50°С.
Следует отметить, что в этой зоне микробные маты Уринского источника обладают
наибольшим содержанием хлорофилла а из всех исследованных нами источников (892 мг/м2). Доминирующим
процессом терминальной деструкции является сульфтредукция, при этом в Уринском
источнике было обнаружено максимальное значение скорости сульфатредукции из
всех исследованных источников (до 5.53 tS/м2
сут). Роль метаногенеза в деструкции органического вещества незначительна.
3.3 Сеюйский источник
.3.1 Распространение и видовой состав микробных
сообществ в связи с изменением физико-химических условий среды
Выход источника приурочен к озеру размером 4*7
метров и глубиной 1.5 метра. Температура воды в озере 49.7°, содержание
сульфида 5 мг/л, рН воды на изливе 9.6. На дне озера и по поверхности воды
озера развиваются микробные обрастания. Далее по изливу развиваются
многослойные микробные маты, происходит уменьшение температуры и содержание
сульфида.
Таблица 8. Физико-химические условия в
биологических зонах Сеюйского источника.
|
Биологическая
зона
|
Описание
микробного мата
|
Т,
еС
|
H2S, мг/л
|
О2,
мг/л
|
Eh
|
рН
|
|
Озеро
|
Обрастания
на дне озера
|
49,
7
|
5
|
0.4
|
-45
|
9.6
|
|
I
|
Тонкий
двуслойный темно-зеленый мат
|
49-47
|
1.95
|
17
|
9.6
|
|
II
|
Толстый
многослойный мат
|
47-43
|
0.6
|
2.56
|
146
|
9.7
|
По дну озера, образованного на выходе источника,
развиваются микробные обрастания темно-зеленого цвета. В составе мата
доминирует Phormidium
valderie
f. pseudovalderianum,
также присутствуют Synechococcus
lividus и Chloroflexus
aurantiacus. (рис. 6г, таб.
9).
Кроме того, на поверхности озера находится
буро-зеленый плавающий мат, температура которого на поверхности составляет
30-40°С (рис. 6а). В прогибах этого мата обнаруживается белесый налет,
образованный в результате развития редко встречаемых бесцветных серобактерий Thiophysa
sp (рис. 6ж). При
температуре 49-47еС в протоке изливающегося из озера источника развивается
двухслойный мат толщиной до 3 мм (Зона I). Верхний слой оливкового цвета,
толщиной около 1 мм. Нижний слой темно-зеленого цвета, толщиной до 2 мм. В
составе мата доминирует Phormidium
valderie
f. pseudovalderianum,
в небольшом количестве представлены колониальные цианобактерии. Из проб
микробных матов был выделен штамм аноксигенной фототрофной бактерии Chloroflexus
aurantiacus.
При температуре 47-43°С развивается обширное
поле микробных матов площадью до 40 м2 (Зона II). Толщина матов
достигает 13 см. Поверхность мата покрыта небольшими пурпурными пятнами.
Видовой состав микроорганизмов, формирующих пурпурные пятна, определить не
удалось. Но при микроскопировании были обнаружены крупные (1.5*3 мкм)
палочковидные бактерии неизвестной физиологии.
Из проб микробных матов был выделен штамм
аноксигенной фототрофной бактерии Chloroflexus
aurantiacus. В мате
различается до 6 слоев (2000 год). В разных точках зоны и в различные годы
может выделяться меньшее число слоев, но общие закономерности структуры мата
остаются неизменными.
Первый слой (0-6 мм), темно-зеленого цвета. В
верхнем слое мата доминирует Phormidium
Woronichinii, редко встречаются
Lyngbya aestuarii,
единично Gloeocapsa
minuta и Gloeocapsa
minor. Часто
Phormidium valderie f. Pseudovalderianum, Gloeocapsa punctata. и
Oscillatoria sp. Много диатомовых
водорослей.
По
объему
биомассы
в
этом
слое
80% составляет
Phormidium Woronichinii, 10% Phormidium valderie f. pseudovalderianum, 5%
Lyngbya aestuarii и
5% - диатомовые
водоросли.
Второй слой (6-17 мм), зеленого цвета, с
полостями. В составе мата доминирует Phormidium
Woronichinii, часто встречается
(до 20% биомассы) Phormidium
valderie
f. pseudovalderianum,
единично Lyngbya
aestuarii, Calothrix
sp1, Gloeocapsa
minor.
Третий слой (17-27 мм), темно-зеленого цвета.
Видовой состав и соотношение между видами аналогично второму слою.
Четвертый слой (27-32 мм), темно-зеленого цвета.
Доминирует Phormidium
Woronichinii, его цвет
становится интенсивнее, возрастает доля Phormidium
valderie
f. pseudovalderianum
(до 30%). Обнаруживаются также Gloeocapsa
minor, Calothrix
sp1, Gloeocapsa
punctata,. Gloeocapsa
minima, редко Calothrix
sp2, Lyngbya
aestuarii.
Пятый слой (32-57 мм), светло-зеленого цвета.
Видовой состав и соотношение между видами аналогично четвертому слою.
Шестой слой (57-67 мм), серая плотная масса, по
нижней поверхности покрыта слоем серы. При микроскопировании серобактерии не
обнаружены, но в большом количестве обнаруживаются палочковидные бактерии,
размерами около 0.5*3 мкм, вероятно деструкторы. Под матом на глубине ниже 67
мм ил черного цвета.
Ниже по течению источника развивается обширное
поле низкотемпературного (35-40°С) цианобактериального мата буро-зеленого
цвета, по поверхности которого вырастают белесые скопления нитей серобактерий Thiothrix
sp.
Таким образом, с уменьшением температуры в
Сеюйском сульфидсодержащем источнике состав фототрофного сообщества расширяется
и достигает максимального разнообразия при 47-43°C.
В этой зоне развивается цианобактериальный мат толщиной до 13 см. Во всех зонах
цианобактерии доминируют в составе микробного мата. Аноксигенные фототрофные
бактерии встречаются в меньшем количестве, чем цианобактерии. Особенностью
видового состава микробного сообщества источника является массовое развитие
бесцветных серобактерий Thiophysa
sp. и Thiothrix
sp.
Таблица 9. Фототрофные бактерии в биологических
зонах Сеюйского источника

.3.2 Биогеохимическая активность
Исследование содержания пигментов и определение
скоростей продукционно-деструкционных процессов в микробных матах источника
было проведено в 2000 и 2002 годах (рис. 7, таб. 10). Анализ спектров in
vivo микробных матов
показывает, что в них доминирует хлорофилл а, что указывает на преобладание
цианобактерий в составе мата. Максимальное содержание хлорофилла а
обнаруживается в зоне II источника при температуре 45еС (169 мг/м2),
при более высоких температурах обнаруживается 28-61 мг/м2.
Результаты экспериментов с использованием 14
С-бикарбоната показали, что с понижением температуры скорость фотосинтеза в
матах постепенно возрастает. Доля оксигенного фотосинтеза увеличивается, а
аноксигенного падает. В матах на дне озера скорость оксигенного фотосинтеза
составляет 0.065-0.22 гС/м2 сут, скорость аноксигенного 0.18-1.18
гС/м2 сут. Доля оксигенного фотосинтеза колеблется от 6 до 55%, доля
аноксигенного от 45 до 94%. В зоне I скорость оксигенного фотосинтеза
составляет 1.09-1.17 гС/м2 сут, аноксигенного 0.1-0.67гС/м2
сут. Доля оксигенного фотосинтеза колеблется от 63 до 91%, доля аноксигенного
от 9 до 37%. В зоне II
скорость оксигенного фотосинтеза составляет от 1.1 до 3.65 гС/м2
сут, аноксигенного от 0.16 до 5.48 гС/м2 сут. Доля оксигенного
фотосинтеза колеблется от 40 до 94%, доля аноксигенного от 6 до 60%.
Скорость темновой фиксации в матах на дне озера
составляет 0.21-4.4 гС/м2 сут. С понижением температуры скорость
темновой фиксации падает до 0.1 гС/м2 сут при 47 С в зоне I
и снова возрастает достигая максимума при 45°С (12.1 гС/м2 сут).
Наибольшая скорость темновой фиксации наблюдается в самом нижнем серосодержащем
слое мата.
Скорость сульфатредукции в микробных матах по
изливу источника была исследована с применением радиоактивного 35S
- сульфата. В матах на дне озера происходит образование сероводорода за счет
сульфатредукции со скоростью 0.096-1.29 tS/м2
сут. Процессы идут, видимо, за счет доноров электронов, поступающих с водой (Н2,
органическое вещество). По изливу скорость сульфатредукции в микробных матах
падает до 0.06-0.38 tS/м2
сут при 47°С и возрастает до 0.86 г S/м2
сут в зоне II.
Скорость водородного метаногенеза незначительна.
В матах на дне озера достигает 17.2-191 мкгС/м2 сут, с понижением
температуры возрастает до 250 мкгС/м2 сут в зоне II.
Скорость ацетокластического метаногенеза незначительна. В матах на дне озера
достигает 0.27-4.08 мкгС/м2 сут, в зоне II
- 0.39 мкгС/м2 сут.
Таким образом, доминирующим процессом
терминальной деструкции в микробных матах источника является сульфатредукция.
Максимальная величина расхода органического вещества через сульфатредукцию
составляет 0.97 гС/м2 сут, тогда как через метаногенез расходуется
максимум 833 мкгС/м2 сут. По изливу с понижением температуры
продуктивность систем резко возрастает. Как следствие, суммарная деструкция
также ускоряется, хотя и не так быстро, как продукция органического вещества. В
зоне II, где
скорости продукционных процессов максимальны, через метаногенез и
сульфатредукцию минерализуется до 30% органического вещества. Большая часть
оставшегося органического вещества микробных матов, очевидно, минерализуется в
процессах кислородного дыхания или захоранивается. Обращает на себя внимание значительное
превышение деструкции над продукционными процессами в матах на дне озера, где
расход органического вещества составляет до 129% от продукции. Как и в случае с
Уринским источником этот дисбаланс может быть объяснен занижением скорости
темновой фиксации при инкубировании пробы, тогда как процесс сульфатредукции
продолжается за счет деструкции органического вещества.
Таким образом, в сульфидсодержащем Сеюйском
источнике наиболее продуктивными являются сообщества развивающиеся при
температуре 47-43°С (зона II).
В этой зоне обнаружена максимальная скорость оксигенного, аноксигенного
фотосинтеза и темновой фиксации углекислоты из всех исследованных нами
источников (3.65; 5.48; 12.1 гС/м2 сут соответственно). Высокая
скорость аноксигенного фотосинтеза при доминировании в составе мата
цианобактерий может быть объяснена использованием ими сульфида в качестве
донора электронов. Высокая интенсивность темновой фиксации может быть объяснена
деятельностью бесцветных серобактерий. Обращает на себя внимание относительно
низкое содержание хлорофилла а в цианобактериальных матах источниках на фоне
значительной толщины мата и высокой скорости оксигенного фотосинтеза (169 мг/м2).
Доминирующим процессом терминальной деструкции является сульфтредукция, роль
метаногенеза незначительна.
Таблица 10. Изменение некоторых
микробиологических показателей по изливу Сеюйского источника

.4 Аллинский источник
.4.1 Распространение и видовой состав микробных
сообществ в связи с изменением физико-химических условий среды
Нами был исследован источник, изливающийся
непосредственно в правую боковую протоку реки на каменистой отмели около
подножья террасы высотой в 15-20 м. Максимальная температура на выходе 70-79°С,
рН 9.0-9.9, содержание сульфида 12 мг/л. Минерализация 0.5 г/л.
Физико-химические параметры источника изливающегося на дне протоки, скорее
всего, определяются смешиванием термальных вод с речными водами (таб. 11).
Температура речной воды обычно составляет 2-7°С, рН речной воды 8.3.
Таблица 11. Физико-химические условия в
биологических зонах Аллинского источника.
|
Биологическая
зона
|
Описание
микробного мата
|
Т,
°С
|
H2S, мг/л
|
Eh
|
рН
|
|
Зона
излива
|
Обрастания
отсутствуют
|
<70-79
|
12
|
-185
|
9.3-9.9
|
|
Зона
I
|
Тонкий
оливковый
|
50-65
|
7.8
|
-60
|
9.2-9.9
|
|
Зона
II
|
Зеленый
с пятнами серы
|
45-24
|
2.6
|
-12
|
9.2-9.9
|
|
Зона
III
|
Космы
Thiothrix
|
35-20
|
|
20
|
9.2-9.7
|
|
Зона
IV
|
Темно-коричневые
космы
|
55
|
|
|
|
|
Зона
V
|
Желто-зеленый
мат
|
45
|
15.6
|
|
9.6
|
В зоне излива при температуре от 79-70°С до 65°С
видимые микробные обрастания отсутствуют, дно покрыто песком и мелким гравием.
Тем не менее при посевах проб песка из этой точки была выделена культура Chloroflexus
aurantiacus.
Микробные маты оливкового цвета начинаются при
65°С, толщина мата до 5 мм (Зона I).
В 1999 году, когда уровень речных вод был минимальным и, вероятно, содержание
сульфида в воде было максимальным, микробный мат в этой зоне состоял из одного
слоя, в его составе доминировал Chloroflexus
aurantiacus (рис. 8а,б, таб.
12). В остальные годы микробный мат не обнаруживался, либо состоял из двух
слоев. В верхнем слое мата преобладают Chloroflexus
aurantiacus, цианобактерии
почти не наблюдаются. В нижнем слое мата доминирует Synechococcus
elongatus, в меньшем
количестве встречается Phormidium
laminosum. При
микроскопировании в пробах мата обнаруживаются диатомовые водоросли, вероятнее
всего они были занесены течением реки. Из проб мата были выделены культуры Chloroflexus
aurantiacus и Meiothermus
ruber.
При температуре ниже 45°С развивается микробный
мат зеленого цвета с толщиной до 2 см (Зона II).
При 40°С в толще мата появляться хорошо различимый слой пурпурных бактерий. При
температурах ниже 35°С поверхность мата покрывается белым слоем тионовых
бактерий и элементной серы. Под ним находится зеленый слой цианобактерий, еще
ниже пурпурный. В составе мата доминирует Phormidium
Woronichinii, в меньшем
количестве встречается аноксигенная фототрофная бактерия Oscillohloris
sp., цианобактерии Phormidium
laminosum, диатомеи и серная
бактерия Thiothrix
sp. Единично
встречается цианобактерии Gloeocapsa
minuta, Microcystis
firma, Phormidium
frigidum, Oscillatoria
amphibia. В пурпурном слое
в большом количестве встречается серная пурпурная бактерия Chromatium
sp. Из проб мата были
выделены культуры мезофильных аноксигенных фототрофных бактерий Heliobacterium
sp., Chromatium
sp., Thiocapsa
sp., несерные
пурпурные бактерии Rhodopseudomonas
palustris и Rhodobacter
sp., использующие
сульфид и откладываюшие внеклеточную серу, и культуры сульфатредукторов.
При температуре ниже 35°С (Зона III)
в русле протоки в виде длинных белых нитей, прикрепляющихся к камням,
развивается обрастания серных бактерий Thiothrix
sp., Beggiatoa
sp. и цианобактерий Phormidium
Woronichinii (рис. 8д).
Также был исследован источник изливающийся из
склона правобережной террасы на высоте около 1.5 метров над уровнем протоки.
Температура воды на выходе достигает 55°С, рН около 9.6, содержание сульфида
около 15.6 мг/л (таб. 11).
При температуре 55°С развивается тонкий (толщина
до 0.5 см) микробный мат темно-коричневого цвета (Зона IV). Мат литифицируется.
В составе мата доминирует Synechococcus
elongatus, в меньшем
количестве встречается Chloroflexus
aurantiacus и цианобактерии Phormidium
Woronichinii, Phormidium
laminosum.
На 30 см ниже зоны IV
при температуре 45°С развивается микробный мат желто-зеленого цвета толщиной до
0.5 см (Зона V). В верхнем слое
толщиной до 1 мм доминирует Chloroflexus
- подобный организм, по способности к доминированию в аэробных условиях может
быть близким к аноксигенной фототрофной бактерии Heliothrix
oregonensis. В более глубоких
слоях мата доминируют цианобактерии Phormidium
Woronichinii и Synechococcus
elongatus. Также в составе
мата обнаружены цианобактерии Lyngbya
holsatica, Gloeocapsa
minuta, Calothrix
sp., Lyngbya
Martensiana
f. minor,
единично Microcystis
firma, гетеротрофная
бактерия Isosphaerapallida
(рис. 8г).
Цианобактерии обнаруживаются в значительном
количестве, либо доминируют в микробных матах Аллинского источника. Но обращает
на себя внимание доминирование, либо массовое развитие термофильной АФБ Chloroflexus
aurantiacus в
высокотемпературной зоне источника. Также, обращает на себя внимание массовое
развитие пурпурных АФБ в мезофильной зоне источника с образованием визуально
различимого слоя в мате, и развитие Chloroflexus
- подобного организма в поверхностном слое мата развивающегося в зоне V. Столь
массовое развитие АФБ в исследованных нами источниках обнаружено только в
Аллинском источнике.
Таблица 12. Фототрофные бактерии в биологических
зонах Аллинского источника
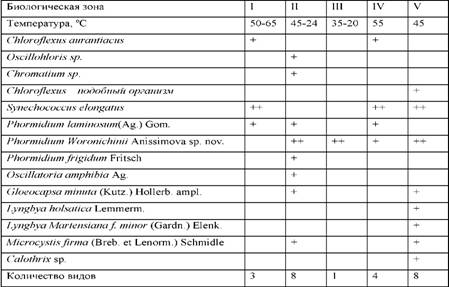
3.4.2 Биогеохимическая активность

Скорость водородного метаногенеза незначительна.
В зоне излива скорость составляет 0.39 мкгС/м2
сут. В зоне I достигает 0.28-0.41 мкгС/м2 сут, с
понижением температуры возрастает до 1.7 мкгС/м2
сут в зоне II и падает до 0.79 мкгС/м2 сут.
Доминирующим процессом терминальной деструкции в
микробных матах источника является сульфатредукция. Максимальная величина
расхода органического вещества через сульфатредукцию составляет 3.09 гС/м2 сут, тогда как
через метаногенез расходуется максимум 6.8
мкгС/м2 сут.
Таким образом, в сульфидсодержащем Аллинском
источнике микробное сообщество обладает относительно высокой продуктивностью
(содержание хлорофилла а до 351.39 мг/м2).
Представляет интерес обнаружение аноксигенного фотосинтеза протекающего с
значительной скоростью (0.279 гС/м2
сут) при температуре около 70°С.
Темновая фиксация углекислоты достигает значительной величины (1.69 гС/м2 сут).
Доминирующим процессом терминальной деструкции является сульфатредукция (до 4.12 tS/м2
сут), роль метаногенеза незначительна.
.5 Большереченский источник
.5.1 Распространение и видовой состав микробных
сообществ в связи с изменением физико-химических условий среды
Источник N 6 выходит двумя грифонами в 3.5 м
один от другого (рис.10а). Температура, содержание сульфида, рН и дебет воды в
грифонах одинаковые. Вышедшие на поверхность воды сходятся в один ручей через
5.5 м. При слиянии рукавов происходит смешение горячих вод с более высоким
содержанием сульфида из короткого рукава и остывающих вод с пониженным
содержанием сульфида из более длинного рукава, в котором вода успевает остыть и
лишиться части растворенного сульфида. Таким образом, по изливу источника
появляются зоны с различными комбинациями температуры и содержания сульфида,
что позволяет детально исследовать влияние лимитирующих факторов среды на
микробное сообщество. Во время четырех наблюдений, проведенных в различные годы
наших исследований, типы микробных сообществ в различных температурных зонах
источника N 6 были неизменными. Из каждой температурной зоны отбиралось до 5
проб из точек с различной температурой.
Микроскопирование проб показало, что в зоне
излива (зона I) при температуре
от 74 до 54°С и содержании сульфида 6 - 13.4 мг/л видимые микробные пленки не
развиваются. Отсутствие микробных матов в этой части русла источника может быть
объяснено влиянием сразу нескольких ограничивающих рост микроорганизмов
факторов: высокой температурой, высоким значением рН и высокой концентрацией
сульфида. В зоне II
при температуре от 62 до 51°С и содержании сульфида от 3 до 5.9 мг/л
развивается тонкий рыхлый желто-зеленый микробный мат толщиной 1-2 мм. В этой
зоне происходит разбавление воды из короткого рукава источника остывающими
водами из более длинной протоки. При смешении создаются условия для развития
мата, в котором представлены аноксигенные фототрофные бактерии Chloroflexus
aurantiacus, нитчатые
цианобактерии рода Phormidium
и Oscillatoria, и одноклеточные
цианобактерии Synechoccus
elongatus (рис. 10б,в,г).
В зоне III
при температуре 54-37°С и содержании сульфида 2.8 мг/л развивается толстый
хрящеватый микробный мат толщиной до 1 -1.5 см. Мат расположен на берегу русла
ручья, при этом в толще мата создается значительный градиент температур: от
37°С на поверхности до 54°С в глубине. По результатам исследования под световым
и сканирующим электронным микроскопом стекол обрастания инкубированных в толще
мата (рис. 10е, 11) верхнюю микрозону занимают Synechococcus
elongatus, тогда как Phormidium
sp. дислоцируются в
более глубоких слоях мата (рис. 10ж, 11). Chloroflexus
aurantiacus обнаруживается
примерно в равном количестве во всей толще мата (рис. 11). В пробах мата при
посеве на элективные среды также обнаружены несерные пурпурные бактерии Rhodopseudomonas
palustris, Rubrivivax
gelatinosus, Blastohloris
viridis, Blastohloris
sulfoviridis, Rhodomicrobium
vannielii, цианобактерия Synechocystis
minuscula, Chloroflexus
aurantiacus, гелиобактерии и
эритробактерии (табл. 15).
В зоне IV
при температуре 51-39°С и содержании сульфида 2.9 мг/л в русле ручья
развивается тонкий микробный мат толщиной до 3 - 4 мм. Доминируют
Phormidium valderiae f. medium, Synechococcus elongatus и
Chloroflexus aurantiacus. В пробах
этого
мата
при
посеве
на
элективные
среды
также
обнаружены
несерные
пурпурные
бактерии
Rhodopseudomonas palustris, Rubrivivax gelatinosus, Blastohloris viridis,
Blastohloris sulfoviridis, Rhodomicrobium vannielii, цианобактерия
Synechocystis minuscula, Chloroflexus aurantiacus, гелиобактерии
и
эритробактерии
(табл.
15).
Образцы этого мата имеют in
vivo спектр поглощения,
указывающий на преобладание в сообществе цианобактерий. Этот мат занимает
максимальную площадь по изливу (до 10-12 метров в длину) и может считаться
типичным для Большереченского источника.
Микробные маты развивающиеся в зонах III и IV
отличаются по толщине и структуре. Тем не менее, физико-химические условия
среды в данных зонах практически совпадают. Видовой состав обнаруженных и
выделенных нами из проб мата организмов также одинаков, что свидетельствует о
сходстве микробных сообществ в этих двух зонах. Различия между структурами
матов могут быть объяснены различным расположением матов относительно русла
ручья и, следовательно, различием в температурном режиме и в режиме увлажнения.
В низкотемпературной зоне V
в диапазоне температур 38-25°С мат приобретает более рыхлую структуру, легко
разрушающуюся при отборе. Доминирует Phormidium
valderiae
f. medium.
Цианобактерии также представлены одноклеточными Synechocystis
sp. и мезофильной
нитчатой Oscillatoria
subcapitata не встречающейся в
зонах с более высокими температурами. В большом количестве встречаются
диатомовые водоросли (рис.10д). Также здесь появляются видимые микробные
обрастания фототрофных пурпурных серобактерий Allochromatium
sp., развивающиеся
отдельными пурпурными пятнами, и обрастания бесцветных серобактерий Thiothrix
sp. При посеве проб
мата на элективные среды обнаруживаются пурпурные серобактерии Thiocapsa
roseopersicina, и
мезофильные нитчатые зеленые бактерии Oscillohloris
sp. (103
кл/мл), не встречающиеся при более высоких температурах. Термофильный Chloroflexus
aurantiacus, встречается в
значительно меньшем количестве, чем в высокотемпературных зонах. Также в пробах
мата присутствует ряд несерных пурпурных бактерий, гелиобактерий и
эритробактерий, обнаруженных в пробах мата из более высокотемпературной зоны IV
(табл. ).
Таким образом, с уменьшением температуры в
Большереченском сульфидсодержащем источнике состав фототрофного сообщества
расширяется и достигает максимального разнообразия при 54-37°C
и содержании сульфида около 2.8 мг/л. Во всех зонах цианобактерии доминируют в
составе микробного мата. АФБ достигают значительной численности (до 107
кл/мл), но ни в одной из зон источника не доминируют. Особенностью микробного
сообщества Большереченского источника является отсутствие видимых микробных
обрастаний в зоне I (74-54еС) источника при содержании сульфида 12 мг/л. Скорее
всего, это вызвано комбинированым воздействием высокого содержания сульфида,
высокого рН и высокой температуры.
.5.2 Биогеохимическая активность
Измерения содержания хлорофилла а в экстрактах
микробных матов показывают, что с понижением температуры содержание пигмента в
матах постепенно возрастает. Максимальное содержание хлорофилла а обнаруживается
при температуре 40°С (555 мг / м2), в то время как при более высоких
температурах обнаруживается 55244 мг хл а/ м2. При дальнейшем
понижении температуры содержание пигмента падает до 240 мг / м2 при
32°С.
Результаты экспериментов с использованием 14 С-бикарбоната
показали, что с понижением температуры скорость фотосинтеза в матах постепенно
возрастает, вместе с увеличением в них содержания хлорофилла а. В зоне излива
источника фотосинтез не обнаруживается, несмотря на присутствие в отобранных
пробах грунта цианобактерии Synechococcus
elongatus. Далее по изливу
источника в зоне II при температуре 62-51°С скорость аноксигенного фотосинтеза
(0.105 гС/м2 сут) существенно превышает скорость оксигенного
фотосинтеза (0.004 гС/ м2 сут) (рис.). В цианобактериальных матах,
развивающихся в зонах III-IV
при температуре 54-37°С, скорость оксигенного фотосинтеза (0.737 гС/ м2
сут) превышает скорость аноксигенного фотосинтеза (0.556 гС/ м2
сут), что, вероятно, связано с доминированием оксигенных цианобактерий в
составе фототрофного сообщества. В этой зоне суммарная скорость фотосинтеза
максимальна и достигает 1.3 гС/ м2 сут. При дальнейшем понижении
температуры, в зоне V при
температурах ниже 39°С, скорость оксигенного фотосинтеза падает до 0.071 гС/ м2
сут и аноксигенный фотосинтез снова преобладает (0.882 гС/ м2 сут).
В зоне излива скорость темновой фиксации
углекислоты составляет 0.181 гС/ м2 сут. При 62°С скорость темновой
фиксации углекислоты понижается и достигает 0.0775 гС/ м2 сут, с
дальнейшим понижением температуры постепенно возрастает и достигает максимума
при 32°С (0.806 г С/ м2 сут) (рис.12). Этот показатель отражает
суммарную активность хемотрофных микроорганизмов.
Скорости терминальных процессов деструкции в
микробных матах и осадках по изливу источника были исследованы с применением
радиоактивного S35
- сульфата, 14С-бикарбоната и С14-ацетата. В зоне излива источника
происходит образование сероводорода за счет сульфатредукции со скоростью 0.08 tS/м2
сут. В этой же точке обнаружен слабый процесс метанобразования со скоростью
0.726 мкгС/ м2 сут. Процессы идут, видимо, за счет доноров
электронов, поступающих с водой (Н2, органическое вещество). По изливу скорость
сульфатредукции в микробных матах постепенно возрастает (рис.12) и достигает максимума при 40°С (0.367
г S/ м2 сут). При
дальнейшем понижении температуры до 32°С
скорость сульфатредукции падает до 0.053 г
S/м2
сут.
Скорость водородного и ацетокластического
метаногенеза по изливу незначительна и достигает максимума (1.188 мкгС/ м2 сут)при 51°С в толстом мате зоны IV. Скорость водородного метаногенеза по
изливу изменяется (рис.12). В зоне
излива достигает 0.381 мкгС/ м2
сут, с понижением температуры возрастает и достигает максимума при 51°С (0.555
мкгС/м2 сут), далее по изливу падает до 0.398-0.432 мкгС/ м2 сут при 32-39°С. Скорость ацетокластического
метаногенеза по изливу колеблется в более широких пределах (рис.12). В зоне излива скорость
ацетокластического метаногенеза составляет 0.345
мкгС/ м2 сут, при 62°С
повышается до 0.645 мкгС/ м2
сут, затем в температурном диапазоне 51-39°С
падает до 0.151-0.271 мкгС/ м2
сут, и снова повышается при 32°С С
до 0.639 мкгС/ м2 сут.
По изливу с понижением температуры до 39°С продуктивность систем резко
возрастает. Как следствие, суммарная деструкция в этой же зоне также
ускоряется, хотя и не так быстро, как продукция органического вещества.
Следовательно, с понижением температуры возрастает диспропорция между этими
процессами. В зоне IV, где скорости этих процессов
максимальны, через метаногенез и сульфатредукцию минерализуется 21% органического вещества. Большая
часть оставшегося органического вещества микробных матов, очевидно,
минерализуется в процессах кислородного дыхания. Нельзя исключить заметную роль
в минерализации органического вещества сероредуцирующих микроорганизмов,
поскольку в пробах грунта и матов обнаружена элементная сера (Табл. 14). Содержание серы в матах постепенно
увеличивается с понижением температуры по изливу от 0.174-0.685 tS/м2 при 54-39°С до 1.064-1.167 гё/ м2 при 39-25°С. Ее содержание соизмеримо с сульфатной серой в
протекающей воде источника. Таким образом, в сульфидсодержащем Большереченском
источнике наиболее продуктивными являются сообщества развивающиеся при
температуре 33-39°С, температуре
более низкой чем в источниках Гаргинский, Уринский и Сеюйский с меньшим
содержанием сульфида. Также обращает на себя внимание относительно невысокая
продуктивность микробных сообществ источника по сравнению с другими
исследованными нами источниками (кроме Аллинского). Доминирующим процессом
терминальной деструкции является сульфтредукция, роль метаногенеза
незначительна.
.5.3 Влияние температуры и рН на микробное
сообщество
На примере Большереченского источника с
температурой на изливе 84° С и рН 9.8 было исследовано влияние температуры и рН
на развитие фототрофных микроорганизмов. В острых опытах установлено, что
цианобактерии наиболее активно фиксируют углерод бикарбоната при рН 9 - 9.5
(рис. 13). Это вполне согласуется с тем, что у поверхности мата рН в дневные
часы доходит до 9.4, как было показано на примере слабощелочного (рН 8.2)
источника Октопус спринг (Revsbech,
Ward, 1984). Все
исследованные аноксигенные фототрофные бактерии, напротив, являются
нейтрофилами (рис. 13), хотя некоторые из них способны активно расти при рН 8.0
- 9.5 (Брянцева и др., 2000). Склонность к росту при нейтральных значениях рН
может быть объяснена низкой карбонатной буферностью воды низкоминерализованного
источника. Отметим также то, что аноксигенные фототрофные бактерии развиваются
в микробных матах в нижних микрозонах в непосредственной близости к зоне
активных деструкционных процессов, ведущих к подкислению среды.
При посеве проб из микробных матов
Большереченского источника при разных температурах было обнаружено, что
диапазон развития мезофильных микроорганизмов в культурах был уже
температурного диапазона их обнаружения в микробных матах (Таб. 17). Это может
свидетельствовать о сезонных колебаниях температуры воды источника и
устойчивости обнаруженных мезофильных бактерий к повышенной температуре.
Известно, что снижение температуры изливающейся воды термальных источников
может возникать из-за смешания термальных и метеорных вод в период обильных
дождей (Ломоносов, 1974).
.6 Источник "Паоха" (Моно Лейк)
.6.1 Распространение и видовой состав микробных
сообществ в связи с изменением физико-химических условий среды
В отличие от источников Б.р.з. источник
"Паоха" обладает повышенной минерализацией (25 г/л). Температура воды
на изливе составляет 94°С, рН 9.7, содержание сульфида - 55 мг/л.
В зоне излива при температуре от 94 до 47 °С
видимые микробные обрастания отсутствуют. Их отсутствие вызвано одновременным
воздействием нескольких экстремальных факторов: температуры, солености,
высокого рН и содержания сульфида. Из этой зоны нами была выделена культура Anaerobranca
californiensis
sp. nov.
Зона I.
При температуре 47°С по руслу источника появляется микробный мат пурпурного
цвета (рис. 14б). В составе мата доминируют цианобактерии Phormidium
sp. и пурпурные
бактерии Ectothiorhodospira
shaposhnikovi., Спектр
поглощения клеток и филогенетическое положение выделенного штамма E.
shaposhnikovii приведены
на рис. 15). В меньшем количестве обнаружены цианобактерии Aphonotecae
sp., диатомеи (рис.
14г,д,е).
.6.2 Биогеохимическая активность
Измерения содержания хлорофиллов и определение интенсивностей
микробных процессов в источнике не производилось.
3.7 Биогенное минералообразование в микробных
матах щелочных термальных источников
Участие микробного сообщества в
минералообразовании изучалось на примере Гаргинского источника, где по изливу
образуется травертин в форме купола. Максимальная мощность отложений составляет
2.5 м. По составу травертин близок к чисто карбонатно-кальциевым, в нем также
обнаружено относительно высокое содержание SiO2
(3.61%) и MnO (1.27%).
Возраст травертина средневерхнеплейстоценовый, и составляет 19245-25725 лет
(Плюснин и др., 2000).
По нашим наблюдениям, процесс
травертинообразования тесно связан с деятельностью микробного мата. Так,
наибольшая активность процесса обнаруживается в зонах с постоянным доступом воды
источника и превышением продукции над деструкцией (зоны I,
II, III). Здесь происходит формирование щелочного геохимического барьера в ходе
оксигенного фотосинтеза в цианобактериальном мате, на котором и происходит
осаждение карбоната кальция. Если же доступ воды из источника уменьшается (зона
IV), то деструкция в
мате (0.89 гС/м2 сут) значительно превышает продукцию (0.24 гС/м2
сут). При этом мат высыхает, образуя тонкие постепенно разрушающиеся корки, и
литификации микробного мата не происходит. Таким образом, микробное сообщество
играет важную роль в травертинообразовании в Гаргинском источнике.
Образцы высохшего микробного мата, поверхности
травертина и керна травертина Гаргинского источника были исследованы нами с
применением электронной микроскопии. Образцы керна были любезно предоставлены
А. М. Плюсниным. В образцах травертина и микробного мата были обнаружены
современные микрофоссилии (МФ) в виде нитей и сфер (рис. 16). Среди останков
нитей доминируют образцы диаметром от 2.5 мкм до 4.5 мкм (30 единиц, 60%). Нити
толщиной до 2.5 мкм встречаются в меньшем количестве (17 единиц, 34%). Нити
толщиной до 10 мкм обнаружены в 3 случаях (6%). Диаметр сфер составляет около
10 мкм. Наибольшее количество МФ было обнаружено в высохшем мате (Рис.16). В
более глубоких слоях травертина количество МФ уменьшается. Так, в образце
сухого мата обнаружено 28 нитей и 67 сфер. В поверхностном слое травертина 19
нитей и 4 сферы. На глубине 5-18 см - 2 нити, на глубине 28-36 см - 5 нитей, на
глубине 41-55 см - 1 нить, на глубине 83 см - МФ не обнаружены.
4. Исследование чистых
культур, выделенных из микробных сообществ щелочных гидротерм
.1 Термофильная аноксигенная фототрофная
бактерия Chloroflexus
aurantiacus
При исследовании микробных сообществ нами было
установлено широкое распространение в них бактерий Chloroflexus
aurantiacus, достигающих
значительной численности и даже входящих в число содоминант на некоторых
станциях. Всего было исследовано 10 штаммов этих микроорганизмов: BG-28,
Garga-2, Га9-8
(Гаргинский источник), ВG-39 (Уринский источник), BR(L)
(Большереченский источник), ВG-6, A19-1
(Аллинский источник). Также культуры Chloroflexus
aurantiacus были выделены из
проб мата источника Змеиный (47°С), расположенного на территории Забайкальского
национального парка (Z-1)
и из источника Термофильный кальдеры Узон, Камчатка (UZ-2
и Green).
.1.1 Морфология и ультраструктура
Все культуры имели нитчатое строение (рис. 17) и
были способны к скользящему движению. Нити неопределенной длины состояли из
плотно соприкасающихся клеток цилиндрической формы. Длина клеток колеблется от
0.4 до 3 мкм, толщина клеток 0.40.7 мкм. Наиболее короткие клетки имел штамм BR(L),
нити которых иногда состояли из почти квадратных клеток. Клетки размножались
бинарным делением. Кроме того, была отмечена фрагментация трихома на группы
клеток и отделение их от материнской нити. На ультратонких срезах видны
хлоросомы, характерные для представителей зеленых бактерий (Рис. 17), а также
электронно-прозрачные включения, являющиеся, очевидно, гранулами полибетаоксимасляной
кислоты.
4.1.2 Пигменты
Цвет клеточной суспензии в анаэробных условиях
варьировал от оливково-зеленого до зеленого, в аэробных условиях оранжевый или
оранжево-зеленый. Все культуры имели идентичные спектры поглощения в анаэробных
условиях. На спектрах in
vivo (рис. 18) пики
460-461 и 739-741 нм указывают на присутствие в клетках бактериохлорофилла с.
Пики 797-798 и 866 нм указывают на присутствие бактериохлорофилла а, а плечо
497-505 нм на наличие каротиноидных пигментов.
Ацетон-метанольные спектры (рис. 18)
подтверждают преобладание бактериохлорофилла с и наличие бактериохлорофилла а у
всех культур. Бактериохлорофилл с имел в коротковолновой части спектра максимум
436-437 нм и в длинноволновой - 666-670 нм. Бактериохлорофилл а определялся по
поглощению при 769-771 нм.
.1.3 Физиология
Все культуры являются умеренными термофилами с
диапазоном развития 35-60°С и оптимумом развития при 40-55°С (Рис. 19).
Несмотря на наличие общих черт, температурные характеристики выделенных культур
имеют ряд отличий. Культура Garga-2
и BG-28 имеют оптимум
роста 55°С, BR(L)
и BG-6 имеют оптимум
роста при 50°С, BG-39
и Z-1 при 45°С, Green
при 40°С. Наиболее активный рост был отмечен при рН 8.0-8.5. Наилучший рост
штаммов Garga-2, BR(L),
Green, BG-6,
BG-28, Z-1
и UZ-2 наблюдался в
пробирках в микроаэробной зоне (1 см от поверхности плотной среды с 1%
агар-агаром), в отличие от них штамм BG-39
на всем протяжении времени культивирования сохранил анаэробный характер роста
(3-4 см от поверхности плотной среды).
Микроорганизмы могли развиваться
фотогетеротрофно анаэробно на свету и гетеротрофно аэробно в темноте. Также
были способны медленно расти на минеральной среде с комплексом витаминов и 1.5
мМ сульфида. При росте в фотоавтотрофных условиях наблюдалось выпадение элементной
серы вне клеток. Добавление сульфида в концентрации 0.5 мМ всегда стимулировало
рост в анаэробных условиях. Сульфит не использовался в процессе фотосинтеза, но
мог служить акцептором электронов для термофильных сульфидогенов, входящих в
состав микробных сообществ исследованных источников. Толерантность штаммов Chloroflexus
aurantiacus к сульфиду и
сульфиту определялась при росте бактерий на средах с органическим веществом на
свету. Штаммы BR(L),
Green и Garga-2
наиболее активно росли при концентрации сульфида 2-3 мМ, сульфита - 4 мМ.
Рост Chloroflexus
aurantiacus в присутствии
закисного железа (0.56 г/л) исследовался на примере известного штамма OK-70f1
и штамма A19-1, выделенного
нами из Аллинского источника.
При культивировании штаммов на минеральной среде
с комплексом витаминов анаэробно на свету и в темноте рост отсутствовал,
образования заметных чехлов на нитях не происходило, соотношение
восстановленного и окисного железа в опыте и контроле не изменялось. При
пересеве на среду, содержащую дополнительно 100 мг/л дрожжевого экстракта, рост
обнаруживался. И в опыте и в химическом контроле медленно образовывался осадок
темного цвета, вероятно магнетит, т.к. взвесь притягивалась магнитом.
При культивировании на среде содержащей 100 мг/л
дрожжевого экстракта и закисное железо (0.56 г/л) аэробно в темноте было
обнаружено образование чехлов окисного железа сходных с чехлами железобактерий Leptothrix
(Дубинина, личное сообщение) (рис. 17). Толщина чехлов Chloroflexus
aurantiacus была в 2-3 раза
больше чем в отсутствие солей железа. После окраски желтой кровяной солью была
обнаружена специфическая реакция на окисное железо - синее окрашивание. Все
железо в среде находилось в окисном виде. В контроле с убитыми формалином
клетками чехлы не образовывались, при этом окисное железо было распределено
аморфно по дну флакона. Таким образом, исследованные штаммы Chloroflexus
aurantiacus наиболее активно
функционируют в ходе фотогетеротрофного роста. Также они способны использовать
сульфид в качестве донора электронов в ходе фотоавтотрофного роста, в отличие
от восстановленного железа, которое не может служить донором электронов при
аноксигенном фотосинтезе. Это косвенно подтверждается незначительным
стимулированием in
situ фиксации
14С-бикарбоната пробами микробного мата содержащего Chloroflexus
aurantiacus в присутствии
диурона (неопубликованные данные). Образование чехлов окисного железа при
аэробном гетеротрофном росте, видимо, происходит при реакции солей железа с
перекисью водорода, как это было установлено для некоторых железобактерий.
Таким образом можно ожидать, что при определенных экологических условиях Chloroflexus
aurantiacus может участвовать
в процессах осаждения окислов железа.
.1.4 Генотипические свойства и филогенетическое
положение
По культуральным признакам, морфофизиологическим
свойствам, пигментому составу и тонкому строению (присутствию хлоросом) все
исследованные культуры были близки к известному виду термофильных нитчатых
зеленых бактерий Chloroflexus
aurantiacus. Была проведена
ДНК-ДНК гибридизация выделенных штаммов с известным штаммом C.aurantiacus
OK-70fl
(Pierson, Castenholz,
1974). В результате было установлено, что штаммы BR(L),
Garga-2, BG-39,
BG-28, Z-1
и UZ-2 имеют от 87% до
96% гомологии с реперным штаммом OK-70fl.
Более низкую степень гомологии имеют штаммы BG-6
(67%) и Green (56%), но
эти величины сходства недостаточны для создания нового вида. По содержанию ГЦ
пар выделенные штаммы (ГЦ от 53.7 до 55.5%) близки с реперным штаммом
(54.9-55.6%). Таким образом, выделенные нами штаммы Chloroflexus
aurantiacus как щелочных, так
и нейтральных истосников могут быть отнесены к известному виду Chloroflexus
aurantiacus (табл. 18).
4.2 Органотрофная аэробная термофильная бактерия
Из зоны I Аллинского источника с температурой
50-65°С, а также из Столбовского нейтрального сульфидного источника (о-в
Кунашир, 55°С) были выделены два штамма (BG-7
и G-6) аэробной
тиосульфат окисляющей гетеротрофной бактерии. Клетки представляют собой палочки
диаметром 0.5 мкм, длиной 5-7 мкм, образуют неподвижные нити разной длины (рис.
20). Рост на поверхности твердой среды в чашке Петри происходил в виде
ярко-красных, круглых, блестящих, компактных колоний. Рост жидкой культуры в
виде слабой мути у поверхности. В метанольном экстракте обнаруживается три
максимума поглощения при 443, 478 и 500 нм. Температурный диапазон роста
35-70°С с оптимумом роста 60°С. Для идентификации культуры было определено
содержание ГЦ пар и проведена ДНК-ДНК гибрилизация с реперным типовым штаммом Meiothermus
ruber штамм 21 (табл.
18). Сходство состава ГЦ и высокая степень ДНК-ДНК гибридизации между штаммом BG-7
и типовым штаммом "Логинова 21" (88%) показывают, что выделенная
культура является Meiothermus
ruber.
Таблица 19. Содержание ГЦ пар и уровень ДНК-ДНК
гибридизации с типовым штаммом выделенной культуры Meiothermus
ruber
|
Штамм
|
ГЦ,
мол %
|
ДНК-ДНК
гибридизация, %
|
|
Meiothermus ruber, 21
|
61,0
|
100%
|
|
BG-7
|
60,6
|
88%
|
У трех штаммов Meiothermus
ruber (BG-7;
G-6 из Столбовского
нейтрального сульфидного источника (о-в Кунашир); Логинова 21, типовой) была
исследована способность окислять тиосульфат. Установлено, что все три штамма
окисляют тиосульфат после достижения лагфазы с образованием единственного
продукта -сульфата (Рис. 21). Прибавка биомассы на среде с тиосульфатом не
превышала 10%. Аналогичные данные были получены ранее Chung
et al
(1997). Таким образом, установлено вероятное участие Meiothermus
ruber в окислительной
фазе цикла серы в микробных матах термальных источников в широком диапозоне рН
от 9.5 до 7.0 и температуре от 60 до 45°С.
.3 Термофильные сульфатредуцирующие бактерии
Из микробных матов источников Алла и Гарга были
получены 4 накопительные культуры микроорганизмов, способных восстанавливать
сульфат до сероводорода. Были очищены и более подробно изучены две культуры - Garga
и Al-4. Garga
был изолирован из зоны I Гаргинского источника с температурой 57°С. Al-4
был выделен из зоны I Аллинского
источника с температурой 60°С. Микроорганизмы имели сходную морфологию и
представляли собой вибрионы и слабоизвитые спириллы с полярным жгутиком (Рис.
22). Размер клеток 0.7*1-1.5 мкм. Клетки размножаются бинарным делением.
Бактерии являются строгими анаэробами. Наиболее благоприятным источником
углерода для них является лактат-Na,
рост на ацетате у них отсутствовал. В качестве акцептора электронов могли
служить сульфат и сульфит, но не тиосульфат, элементная сера и полисульфид.
Температурный диапазон развития 40-70°С, оптимум 60°С. Диапазон рН штамма Garga
от 6 до 8.5, оптимум 7.2. Диапазон рН штамма Al-4
от 6 до 9.5, оптимум 8 (Рис. 23). По морфофизиологическим свойствам и
способности к термофилии выделенные бактерии сходны с представителями рода Thermodesulfovibrio.
Таким образом, сульфатредуцирующие бактерии могут участвовать в
восстановительной фазе цикла серы в микробных матах термальных источников в
диапазоне рН от 8.4 до 9.0-9.9 и температуре от 40 до 70°С. Как было отмечено
нами ранее, сульфатредукторы являются основными терминальными деструкторами во
всех исследованных матах, в том числе и в бессульфидных гидротермах.
4.4 Алкалотермофильная органотрофная бактерия
"Anaerobranca
californiensis"
При посеве проб грунта из зоны с температурой
45-94°С источника на острове Паоха была выделена чистая культура
сероредуцирующей бактерии, штамм Paoha-1.
.4.1 Морфология и ультраструктура
Клетки штамма Paoha-1
представляют собой прямые палочки, иногда ветвящиеся, 0.26-0.31 мкм в диаметре
и 2.4-5.0 мкм длиной (Рис. 24). Иногда клетки образовывали ответвления
(бранки). Жгутики расположены перитрихально. На ранней экспоненциальной стадии
роста клетки подвижные, на стационарной стадии роста подвижность теряется.
Споры не обнаружены.
Исследование ультраструктуры клеток штамма Paoha-1
выявило строение, характерное для грамположительных бактерий: отсутствие
наружной мембраны, тонкая клеточная стенка, хотя клетки окрашиваются как
Грам-отрицательные. Бинарное деление клеток осуществляется путем врастания
клеточной перегородки. Наружный слой клеточной стенки имеет нерегулярное
строение и высокую электронную плотность. Цитоплазма гранулярная и имеет включения
с низкой электронной плотностью. Строение клеточной стенки и размер клеток Anaerobranca
californiensis схожи с A.
horikoshii (Engle
et al.,
1995), но отличаются от A.
gottshalkii, клетки которой
имеют большие размеры и толстую клеточную стенку (Prowe,
Antranikian, 2001)
.4.2 Физиологические характеристики
Paoha-1 является
облигатным анаэробом, способна существовать без добавления редуктантов.
Культура нечувствительна к кислороду и может храниться в аэробных условиях при
комнатной температуре в течение нескольких месяцев. Температурный диапазон
роста и продукции сульфида из тиосульфата штамма Paoha-1
45-70°С, оптимум при 58oC.
Диапазон рН 8.6-10.4, оптимум pH
9.0 - 9.5 (измерение проводилось при 25oC).
При температурах от 47°C
до 58°C и рН 9.5 продукция
сульфида в зависимости от концентрации NaCl
имела широкий оптимум от 5 г/л (85 мМ) до 60 г/л (1М), тогда как при 70°C
оптимум наблюдался при 25 г/л (430 мМ) NaCl.
Оптимум концентрации не проводилось Na+
(NaCl + карбонаты)
находился от 310 до 775 мМ в зависимости от температуры. Для сравнения, оптимум
роста A. horikoshii
и A. gotschalki
наблюдался при 8.5 мМ Na+
и 230 мМ соответственно (Engle
et al.,
1995; Prowe, Antranikian,
2001).
Штамм Paoha-1
способен расти гетеротрофно на различных субстратах, наилучший рост наблюдается
на пептоне, триптоне, соетоне, гидролизате казеина, дрожжевом экстракте.
Способен к медленному росту на фруктозе, сахарозе, мальтозе, крахмале,
гликогене, декстрозе, целлобиозе и глицерине в присутствии дрожжевого экстракта
(0.01%) как фактора роста. Гликоген, глюкозу и целлюлозу не использует. Пируват
используется, но ацетат и лактат не поддерживают рост. Таким образом,
метаболизм Anaerobranca
californiensis сходен с A.
horikoshii (Engle
et al.,
1995). Как и другие ранее описаные анаэробные алкалотермофилы Paoha-1
нуждается в добавлении дрожжевого экстракта, который не может быть заменен
витаминами (Wiegel, 1998).
Рост без добавления тиосульфата или других неорганических соединений был
слабым, возможно из-за ингибирования восстановленными продуктами брожения.
Диссимиляторная редукция фумарата, сульфата,
сульфита и нитрата не обнаружена. Способен восстанавливать тиосульфат,
полисульфид и элементную серу до сульфида. Обладает высокой толерантностью к
сульфиду (до 40 мМ). Способен восстанавливать тиосульфат с образованием
сульфита и сульфида в соотношении 1:1. Таким образом, при восстановлении
тиосульфата штаммом Paoha-1
происходит восстановление только сульфанового атома серы, как было показано
ранее для мезофильного бродильщика Proteus
vulgaris (Barret,
Clark, 1987). Нами было
также показано, что типовые виды двух других известных видов A.
horikoshii и A.
gotschalkii способны
восстанавливать тиосульфат с образованием сероводорода на среде с пептоном (для
A. horikoshii)
или глюкозой (для A. gotschalkii)
как источниками углерода.
Таблица 19. Образование сульфида из различных
серных соединений и восстановление цитрата железа тремя известными видами рода
Anaerobranca
|
Anaerobranca californiensis
|
Anaerobranca gottschalkii
|
Anaerobranca horikoshii
|
|
S2-, мг/л
|
|
Полисульфид
|
480
|
10-20
|
130-185
|
|
S0
|
288
|
140-185
|
165
|
|
S2O3
|
110
|
76
|
66
|
|
Fe2+, мг/л
|
|
Fe(III)-цитрат
|
210-360
|
380-420
|
310-350
|
В дальнейших экспериментах было установлено, что
штамм Paoha-1 на среде
с пептоном и дрожжевым экстрактом также способен восстанавливать цитрат железа
(III), гидроокись
железа (III), селенат натрия (Se(VI)).
Восстановление селенита (Na2SeO3)
приводило к образованию промежуточного продукта - элементного селена Se°
или полиселенита (красный аморфный осадок) и далее к образованию конечного
продукта Se(II)
в виде бесцветного селенида натрия (Na2Se).
Штамм Paoha-1
восстанавливал Fe(III)-цитрат с большей скоростью чем элементную серу или
тиосульфат. В эксперименте происходило внеклеточное образование минерала
темного цвета, притягивающегося магнитом (вероятно магнетита). В химическом
контроле был обнаружено незначительное содержание восстановленного железа, что
подтверждает gottschalkii
способны восстанавливать цитрат железа, селенит и элементную серу (Таб. 21).
Можно сделать вывод, что способность к восстановлению этих неорганических
соединений общее свойство всех известных представителей Anaerobranca.
Штамм Paoha-1 также
восстанавливал гидроокись железа на среде содержащей триптон (2 г/л) и
дрожжевой экстракт (1 г/л).
Таким образом, впервые была показана способность
бродильных алкалитермофильных анаэробных бактерий активно восстанавливать
соединения железа и селена.
.4.3 Генотипические свойства и филогенетическое
положение
Результаты анализа сиквенса 16S
рРНК (1527 нуклеотидов) штамма Paoha-1
показали, что штамм принадлежат к группе Clostridium/Bacillus
грам-положительных бактерий, роду Anaerobranca.
Коэффициенты сходства сиквенсов штамма Paoha-1
и других представителей рода Anaerobranca
составили 98.4 - 98.8% с A.
horikoshii и 97.0-97.2% с A.
gottschalkii. На
филогенетической дендрограмме показано эволюционное положение штамма Paoha-1
по отношению к близкородственным бактериям.
Результаты анализа нуклеотидного состава ДНК
показали, что содержание ГЦ пар в ДНК штамма Paoha-1
составляло 30.3 мол%, что было очень близким к A.
gottschalkii (30.9 мол%), и
отличалось от A. horikoshii
(33 - 34.3 мол%) (таб 20).
Результаты ДНК-ДНК гибридизации выявили низкий
процент гомологии ДНК для штамма Paoha-1
и типовых штаммов A. gottschalkii
(38%) и A. horikoshii
(29%), что свидетельствует о его таксономической обособленности от этих видов.
Уровень гомологии ДНК между типовыми штаммами A.
horikoshii и A.
gottschalkii по нашим данным
составляет 51%.
По совокупности фенотипических и генотипических
признаков штамм Paoha-1
является новым видом рода Anaerobranca.
В таблице 20 приведены различительные признаки видов данного рода.
Основными свойствами различающимися у трех видов
рода Anaerobranca
являются: свойства клеточной стенки, отношение к солености, способность с
сбраживанию глюкозы, способность использовать фумарат как акцептор электронов.
На основании проведенных исследований мы предлагаем отнести выделенный штамм к
новому виду бактерий под названием "Anaerobranca
californiensis".
.4.4 Диагноз вида Anaerobranca
californiensis
Ca.li.for.ni.en.sis
- из Калифорнии. Клетки представляют собой прямые палочки, иногда ветвящиеся.
Размер клеток 0.26-0.31*2.4-5.0 мкм. При росте на твердой среде образует
колонии 3-5 мм в диаметре, серого цвета. Клеточная стенка тонкая,
Грам-положительная, наружная мембрана отсутствует, хотя клетки окрашиваются как
Грам-отрицательные. Облигатный анаэроб. Температурный диапазон роста 45-70°C,
оптимум 58°C. Диапазон рН
8.6-10.4, оптимум pH
9.0 - 9.5. Рост происходит в диапазоне от 0 до 6% NaCl
с оптимумом при 1-2.5%.
Микроорганизм способен расти гетеротрофно на
различных субстратах, наилучший рост наблюдается на пептоне, триптоне, соетоне,
гидролизате казеина, дрожжевом экстракте.
Способен к медленному росту на фруктозе, сахарозе,
мальтозе, крахмале, гликогене, декстрозе, целлобиозе и глицерине в присутствии
дрожжевого экстракта (0.01%) как фактора роста. Гликоген, глюкозу и целлюлозу
не использует. Пируват используется, но ацетат и лактат не поддерживают рост.
Диссимиляторная редукция фумарата, сульфата,
сульфита и нитрата не обнаружена.
Способен восстанавливать полисульфид и
элементную серу до сульфида. Обладает высокой толерантностью к сульфиду (до 40
мМ). В присутствии тиосульфата (20 мМ) образует сульфид в количестве 10 мМ. Также
способен восстанавливать цитрат железа (III),
гидроокись железа (III),
селенат натрия (Se(VI)).
Выделен из щелочного термального источника (pH
9.7, минерализация 25 г/л, температура 90°C)
расположенного на озере Моно Лейк, остров Паоха (Калифорния, США).
Содержание ГЦ составляет 30.3%. Уровень ДНК-ДНК
гибридизации с типовым штаммом A.
horikoshii составляет 38%, с
типовым штаммом A. gottschalkii
- 29%. Типовой штамм Paoha-1
депонирован в Немецкой коллекции микробных культур (DSMZ)
под номером 14826, в коллекции ИНМИ РАН под номером Uniqem-229.
Номер в ГенБанк AY064217.
ЗАКЛЮЧЕНИЕ
Главным физико-химическим фактором среды,
оказывающим влияние на состав и распространение микробных сообществ в
гидротермах, является температура (Горленко и др., 1985, Горленко,
Бонч-Осмоловская, 1989; Brock,
1967). С уменьшением температуры по изливу исследованных нами источников
разнообразие микроорганизмов расширяется.
В щелочных гидротермах микробные сообщества
кроме высокой температуры подвергаются комбинированному воздействию и других
экстремальных факторов: высокого рН и, в ряде случаев, высокого содержания
сульфида и минерализации. В исследованных гидротермах фототрофные сообщества
появляются при более низкой температуре чем в слабощелочных и нейтральных
гидротермах. Для сравнения, в Уринском источнике с рН 8.8 цианобактериальный
мат начинается с температуры 64°С, тогда как в слабощелочном Октопус спринг с
73°С (Brock, 1967). При
этом, наблюдается обратная зависимость между верхним температурным пределом
распространения микробного мата и содержанием сульфида в источнике (рис. 27).
Чем выше содержание сульфида, тем ниже максимальная температура распространения
микробного мата по изливу источника. Также было обнаружено, что термофильная
цианобактерия Mastigocladus
laminosus, широко
распространенная в нейтральных гидротермах, практически не встречается в
микробных матах щелочных источников. Вместо нее в широком диапазоне условий
среды доминируют цианобактерии Phormidium
spp. и Anabaena
spp., являющиеся более
толерантными к высоким значениям рН.
Важной особенностью щелочных гидротерм является
доминирование цианобактерий в составе микробных матов при содержании сульфида в
воде более 1 мг/л. Ранее считалось, что при такой концентрации сульфида в
составе микробного мата обязательно доминируют аноксигенные фототрофные
бактерии (АФБ) (Castenholz,
1976, 1977; Ward
et al.,
1989). Наши исследования показали, что это правило не может быть применено к
щелочным гидротермам. Так, на диаграмме рН-Т, построенной с помощью
литературных и собственных данных, указаны области распространения различных
типов сообществ при содержании сульфида более 1 мг/л (рис. 28). АФБ доминируют
в слабокислых и нейтральных условиях, но в щелочных условиях, как было показано
нами, доминируют цианобактерии.
Это явление может быть объяснено снижением
токсичности сероводорода при повышении рН (Заварзин, 1972; Howsley,
Pearson, 1979). На
диаграмме рН-S2-
показано, как происходит последовательная смена типов сообществ с повышением рН
в сульфидсодержащих гидротермах при температуре около 60°С (рис. 29). При рН
менее 7 большинство молекул сероводорода находится в недиссоциированном
состоянии и способно легко проникать через клеточную стенку. В составе
сообщества доминирует Chloroflexus
aurantiacus. При рН более 7
начинает доминировать менее токсичный гидросульфид-ион, и в составе микробного
мата появляются цианобактерии. Они располагаются под слоем Chloroflexus
aurantiacus, который защищает
цианобактерии от воздействия высоких концентраций растворенного в воде
сульфида. При рН более 8.5 весь сероводород переходит в гидросульфид-ион и, как
было показано нами, в составе мата доминируют цианобактерии. Сравнение
оптимумов рН цианобактерий, АФБ и хемотрофных бактерий выделенных из
Большереченского источника указывает на то, что доминирующие в микробном мате
цианобактерии более приспособлены к высоким рН, чем АФБ. Цианобактерии,
подщелачивающие среду в ходе оксигенного фотосинтеза являются алкалофилами,
тогда как АФБ и хемотрофные бактерии являются нейтрофилами и алкалотолерантами
(рис. 13).
Нами был обнаружен аноксигенный мат с
доминированием Chloroflexus
aurantiacus в Аллинском
источнике, но необходимо учитывать, что его развитие происходило в области
смешения сульфидсодержащих щелочных термальных вод с рН 9.0-9.9 и речных вод с рН
8.3, что опять же подтверждает предположение о контроле распространения
микробных сообществ различными формами сульфида. Повышение устойчивости
гидросульфид-иона при щелочной реакции среды также может быть причиной
отсутствия массового развития термофильных серобактерий при температуре около
70°С.
Минерализация также является фактором среды,
ограничивающим распространение микробных матов и оказывающим влияние на видовой
состав сообщества. В минерализованном источнике Паоха комбинированное
воздействие факторов среды исключает развитие термофильного цианобактериального
мата и термофильной АФБ Chloroflexus
aurantiacus.
Цианобактериальный мат обнаружен при температурах ниже 47°С и доминируют в нем
цианобактерии родов Phormidium,
Oscillatoria и мезофильная галоалкалофильная
пурпурная бактерия Ectothiorhodospira
shaposhnikovii.
Микробные сообщества щелочных гидротерм обладают
высокой продуктивностью, сравнимой с другими высокопродуктивными экосистемами.
Максимальное содержание хлорофилла а составляет 892 мг/м2. Скорость
оксигенного фотосинтеза достигает 3.5 гС/м2 сут, что сравнимо со
скоростями оксигенного фотосинтеза в источниках Термофильный (2.3 гС/м2
сут) и Октопус Спринг (4 гС/м2 сут). Скорость аноксигенного
фотосинтеза достигает высоких значений в микробных матах источников (5.5 гС/м2
сут) несмотря на то, что в составе микробных матов доминируют цианобактерии.
Это может быть объяснено переключением цианобактерий на аноксигенный
фотосинтез. Максимальная скорость темновой фиксации - 12.1 гС/м2 сут.
Максимальная суммарная продукция достигает 21 гС/м2 сут.
Комбинированное воздействие высокой температуры,
рН и сульфида оказывает влияние и на активность биогеохимических процессов по
изливу источников. В источниках Гаргинский, Сеюйский и Уринский с невысокими
содержаниями сульфида продуктивность микробных матов очень высока, а оптимум
продукционных процессов находится при температуре 45-50°С. Тогда как в
Большереченском источнике с высоким содержанием сульфида и наиболее высокими
значениями рН наибольшая продуктивность наблюдается при температурах 33-39°С, а
значения продуктивности уступают значениям обнаруженным в бессульфидных
источниках.
Процессы терминальной деструкции также обладают
высокой интенсивностью. Максимальное значение сульфатредукции достигает 5.5 tS/м2
сут. Скорость метаногенеза невысока, до 1.5 мгС/м2 сут.
Соответственно, через процесс сульфтаредукции расходуется на 2-3 порядка больше
органического вещества, что обуславливается высоким содержанием сульфата в
термальных водах.
Высокая интенсивность процесса сульфатредукции
приводит к тому, что даже если в водах отсутствует растворенный сульфид, то все
равно создаются условия для активной деятельности микроорганизмов цикла серы.
Аноксигенные фототрофные бактерии, участвующие в данном цикле, достигают высокой
численности в микробных матах щелочных источников (до 107 кл/мл).
Термофильная алкалотолерантная АФБ Chloroflexus
aurantiacus достигает
значительной численности в микробных матах слабоминерализованных щелочных
гидротерм. В отдельных случаях этот организм даже доминирует в мате. Нами было
выделено 10 штаммов Chloroflexus
aurantiacus из различных
источников. ДНК-ДНК гибридизация с известным штаммом OK-70fl
показала, что все они принадлежат к одному виду. Тем не менее, ряд их свойств
(температурный оптимум, отношение к кислороду) отличается друг от друга, что
свидетельствует о приспособленности штаммов к условиям местообитаний в
различных источниках.
Исследованные культуры способны к
фотоавтотрофному росту, используя сульфид в качестве донора электронов, но
лучше растут в фотогетеротрофных условиях. Кроме того большинство штаммов Chloroflexus
aurantiacus хорошо растут в
присутствии органических субстратов в аэробных или микроаэробных условиях.
Наиболее вероятно они выполняют в сообществе функцию первичного деструктора.
Ранее было показано, что наряду с сульфидом,
восстановленное железо может служить донором электронов при аноксигенном
фотосинтезе у некоторых мезофильных АФБ (Widdel
et al.,
1993; Ehrenreich
et al.,
1994). Наши исследования показали, что изученные штаммы Chloroflexus
aurantiacus не способны к
фотоавтотрофному росту на восстановленном железе. Но зато в ходе аэробного
темнового гетеротрофного роста вокруг нитей образовывались толстые чехлы из
окисленного железа. Это может являться одним из механизмов образования
ожелезненных микрофоссилий в древних породах, сформированных цианобактериальным
матами, в которых кислород поступал в результате оксигенного фотосинтеза.
В щелочных водах миграция катионогенных
элементов, в первую очередь железа, затруднена, поэтому обнаружение у
выделенной нами термофильной алкалофильной бактерии Anaerobranca
californiensis способности
к восстановлению железа представляет большой интерес. Данная способность может
быть обусловлена эволюционно. Нами также было показано, что и другие
алкалофильные представители рода Anaerobranca
тоже обладают способностью к железоредукции.
Участие микробного сообщества в карбонатном
минералообразовании изучалось на примере Гаргинского источника. В воде
источника натрий доминирует над кальцием, сульфат-ион доминирует над
гидрокарбонат-ионом, а также содержится значительные концентрации растворенной
кремнекислоты, поэтому факт образования из таких вод карбонатно-кальциевого
травертина представляет значительный интерес (Борисенко и др., 1976). Образование
травертина не могло происходить в ходе декомпрессии углекислого газа при выходе
на поверхность, так как содержания в воде источника углекислого газа,
карбоната, гидрокарбоната и кальция слишком низки (Плюснин и др., 2000).
Образование травертина наиболее активно происходит в зоне развития микробного
мата и, по нашим наблюдениям, тесно связано с его состоянием. Наибольшая
активность процесса обнаруживается в зонах с постоянным доступом воды источника
и превышением продукции над деструкцией (зоны I,
II, III). Здесь происходит формирование щелочного геохимического барьера в ходе
оксигенного фотосинтеза в цианобактериальном мате, на котором и происходит
осаждение карбоната кальция. Таким образом, микробное сообщество играет ведущую
роль в травертинообразовании в Гаргинском источнике.
Сравнение нейтральных углекислых источников
(рис. 30) с высоким содержанием кальция и карбонатов, и сульфатно-натриевого
Гаргинского источника, с низким содержанием кальция и карбонатов, показывает,
что микробное сообщество играет ведущую роль в травертинообразовании в
Гаргинском источнике, формируя щелочной барьер, на котором происходит осаждение
карбоната кальция. При рН выше 8.4 образования травертина не происходит в связи
с отсутствием кальция. В этой области происходит образование кремневых корок
типа гейзерита около выходов источников, наблюдавшееся нами на Большереченском,
Аллинском и Уринском источниках.
Образцы высохшего микробного мата, поверхности
травертина и керна травертина Гаргинского источника были исследованы нами с
применением электронной микроскопии. В них были обнаружены современные
микрофоссилии (МФ) в виде сфер и нитей. Наибольшее количество МФ было
обнаружено в высохшем мате. С увеличением глубины в травертине количество
микрофоссилий уменьшается в ходе диагенеза.
1. Высокие
значения рН, температуры и содержания сульфида ограничивают распространение
фототрофных микробных матов, которые в щелочных гидротермах развиваются при
более низкой температуре, чем в нейтральных.
2. Особенностью
щелочных сульфидсодержащих гидротерм, в отличие от нейтральных гидротерм,
является отсутствие образования аноксигенных микробных матов. В составе
микробных матов щелочных гидротерм доминируют алкалофильные цианобактерии Phormidium
spp.
3. Микробные
сообщества пресных и минерализованных щелочных гидротерм отличаются по видовому
составу. Термофильная аноксигенная фототрофная бактерия Chloroflexus
aurantiacus достигает
значительной численности в микробных матах пресных щелочных гидротерм, но
отсутствует в минерализованных щелочных гидротермах. В составе сообщества
минерализованных гидротерм значительной численности достигает галоалкалофильная
аноксигенная фототрофная бактерия Ectothiorhodospira
shaposhnikovii.
4. Продуктивность
микробных сообществ щелочных гидротерм сравнима с продуктивностью нейтральных
гидротерм. Наиболее продуктивными являются сообщества, развивающиеся в
температурном диапазоне 35-50°С. Доминирующим процессом терминальной деструкции
является сульфатредукция, роль метаногенеза в деструкции органического вещества
незначительна.
5. Показана
экофизиологическая приспособленность термофильной аноксигенной фототрофной
бактерии Chloroflexus
aurantiacus к условиям
местообитаний в различных источниках и их экологических зонах.
6. Показано,
что чистые культуры аноксигенной фототрофной бактерии Chloroflexus
aurantiacus могут откладывать
окисное железо на поверхности клетки в ходе аэробного темнового роста.
Восстановленное железо не является донором электронов для фотоавтотрофного
роста у исследованных штаммов.
7. Выделен
новый вид алкалотермофильной бактерии с бродильным метаболизмом Anaerobranca
californiensis, способной
к неспецифическому восстановлению широкого ряда неорганических соединений:
тиосульфата, элементной серы, полисульфида, железа, селена.
СПИСОК ЛИТЕРАТУРЫ
1.
Аверкин
Ю.А. Динамика отложения компонентов из гидротермального раствора при выкипании
СО2 // Геохимия. 1987. № 11. С.1580-1585.
2.
Барабанов
Л.Н., Дислер В.Н. Азотные термы СССР/ Отв. Ред. Д.г-м.н. В.В.Иванов. - М:
Геоминвод ЦНИИ КиФ, 1968.-120с.
3.
Басков
Е.А., Суриков С.Н. Гидротермы Земли. - Л.: Недра, 1989. - 245 с.: ил.
4.
Бильдушкинов
С.С., Некрасова В.К., Герасименко Л.М. Роль фотосинтезирующих микроорганизмов в
газовом обмене цианобактериального сообщества // Микробиология, 1985. Т.54.
с.517-512.
5.
Бонч-Осмоловская
Е.А., Горленко В.М., Карпов Г.А., Старынин Д.А. Анаэробная деструкция
органического вещества в цианобактериальных матах ист. Термофильного //
Микробиология. 1987. Т. 56. № 6. С. 1022-1028.
6.
Бонч-Осмоловская
Е.А., Заварзин Г.А. Термофильные бактерии, восстанавливающие серу, и
формирование ими геохимического барьера // Кальдерные микроорганизмы. М.:
Наука. 1989.
7.
Бонч-Осмоловская
Е.А., Мирошниченко М.Л., Пикута Е.В., Сорокин Д.Ю., Намсараев Б.Б.
Бактериальная сероредукция в мелководных гидротермах Юго-Западной части Тихого
океана // Микробиология. 1993. Т.62. С.564-573.
8.
Бонч-Осмоловская
Е.А., Мирошниченко М.Л., Слободкин А.И., Соколова Т.Г., Карпов Г.А., Кострикина
Н.А., Заварзина Д.Г., Прокофьева М.И., Русанов И.И., Пименов Н. В. Биоразнообразие
анаэробных литотрофных прокариот в наземных гидротермах Камчатки //
Микробиология. 1999. Т.68. С.398-406.
9.
Бонч-Осмоловская
Е. А. Термофильные микроорганизмы в морских гидротермальных системах. С.
131-140.// Биология гидротермальных систем. Под ред. А.В. Гебрук, К.Н. Несис,
А.П. Кузнецов, А.М. Сагалевич. М., КМК Press,
2002, 543 с.
10. Борисенко
И.М., Замана Л.В. Минеральные воды Бурятской АССР. - Улан-Удэ: Бурятское
книжное изд-во, 1978. -162 с.
11. Борисенко
И.М., Очиров Ю.Ч., Сусленкова Р.М. Состав травертинов из отложений некоторых
минеральных источников Забайкалья. Труды геологического института БФ СО АН
СССР, Улан-Удэ, 1976, Выпуск 7 (15), с.36-52.
12.Брянцева
И.А., Горленко В.М., Турова Т. П., Кузнецов Б.Б., Лысенко А. М., Быкова С.А.,
Гальченко В.Ф., Митюшина Л.Л., Осипов Г.А. Heliobacterium
sulfidophilum
sp. nov.
и Heliobacterium
undosum sp.
nov.:
сульфидокисляющие гелиобактерии из термальных сероводородных источников //
Микробиология. 2000. Т. 69. №3. С.396-406.
13. Венецкая
С.Л., Герасименко Л. М., Миллер Ю.М. Роль Chloroflexus
aurantiacus в газовом обмене
термофильного цианобактериального сообщества // Микробиология. 1987. Т.56.
С.865-871.
14. Весталл
Ф., Велш М. Ископаемые бактерии и бактериальные биопленки. С. 68-83. // Бактериальная
палеонтология. ПИН РАН, МГУ. Под ред. А.Ю. Розанова. - М.: ПИН РАН, 2002. - 188
с.
15. Гальченко
В. Ф. Микроорганизмы в гидротермальных сообществах. С. 113-130. // Биология
гидротермальных систем. Под ред. А. В. Гебрук, К. Н. Несис, А.П. Кузнецов, А.М.
Сагалевич. М., КМК Press, 2002,
543 с.
16. Гебрук
А. В., Галкин С.В. Гидротермальный биотоп и гидротермальная фауна: общие
положения. С. 13-24. // Биология гидротермальных систем. Под ред. А.В. Гебрук,
К.Н. Несис, А.П. Кузнецов, А.М. Сагалевич. М., КМК Press,
2002,
543 с.
17. Герасименко
Л.М., Заварзин Г.А. Обмен Н2, СО2, О2, СН% в цианобактериальных сооществах //
Микробиология. 1982. Т.51. С.718-722.
18. Герасименко
Л.М., Карпов Г.А., Орлеанский В.К., Заварзин Г.А. Роль циано-бактериального
фильтра в трансформации газовых компонентов гидротерм на примере кальдеры Узон
на Камчатке // Журн. Общ. Биол. 1983. №6. с.842-851.
19. Герасименко
Л.М., Крылов И.Н. Посмертные изменения цианобактерий в
водорослево-бактериальных пленках термальных источников Камчатки // Докл. АН
СССР. 1983. Т.272. №1. С.201-202.
20. Герасименко
Л.М., Миллер Ю.М., Капустин О.А., Заварзин Г.А. Потребление водорода
термофильной цианобактерией Mastigocladus
laminosus // Микробиология.
1987. Т.56. С.553-558.
21.
Герасименко
Л. М. Актуалистическая палеонтология цианобактериальных сообществ //
Автореферат диссертации. 2002. ИНМИ
РАН. Москва.
22. Герхардт
Ф. и др. (под ред.). Методы общей бактериологии. В 3 т. М.: Мир. 1983.
23.
Головенок
В.К. Докембрийские кремневые конкреции: морфология, генезис, значение для
познания древнего органического мира // Конкреции докембрия. Л., Наука. 1989.
С.94-102.
24. Голубев
В. А. Тепловые и химические характеристики гидротермальных систем Байкальской
рифтовой зоны // Сов. геология. 1982. №10. С.100-108.
25. Голлербах
М.М., Косинская Е.К., В.И. Полянский. Определитель пресноводных водорослей
СССР. Вып. 2. Синезеленые водоросли. - М.: Советская наука, 1953.
26. Го
Окамото, Окура Т., Гото К. Свойства кремнезема в воде // Геохимия литогенеза. -
М.: Иностранная литература. 1963. - 459 с.
27. Горленко
В. М. Биология пурпурных и зеленых бактерий и их роль в круговороте углерода и
серы. Дис. ... д-ра биол. наук. М.: ИНМИ АН СССР, 1981. С. 696.
28. Горленко
В.М., Бонч-Осмоловская Е.А. Формирование микробных матов в горячих источниках и
активность продукционных и деструкционных процессов // Кальдерные
микроорганизмы. М: Наука. 1989.
29. Горленко
В.М., Дубинина Г. А., Кузнецов С.И. Экология водных микроорганизмов. М.: Наука,
1977.
30. Горленко
В.М., Кикина О.Г. Определение оптимальных условий роста микроорганизмов с
помощью 14С-бикарбоната // Микробиология. 1979. Т. 48. В. 3. С. 430-433.
31.Горленко
В.М., Компанцева Е. И., Пучкова Н.Н. Влияние температуры на распространение
фототрофных бактерий в термальных источниках //
Микробиология.
1985. Т. 54. №5. С. 848-853.
32. Горленко
В.М., Старынин Д.А., Бонч-Осмоловская Е.А., Качалкин В.И. Продукционные
процессы в микробных сообществах горячего источника Термофильного //
Микробиология. 1987. Т. 56. С. 872-878.
33. Горшков
А.И., Дриц В.А., Дубинина Г.А., Богданова О.А., Сивцов А. В. Роль бактериальной
деятельности в формировании гидротермальных Fe-Mn-образований
северной части бассейна Лау (юго-западная часть Тихого океана) // Изв. Акад.
Наук. Сер. геол. 1992. №9. с.84-93.
34. Дубинина
Г.А. Биология железобактерий и их геохимическая деятельность. Дис. ... д-ра.
Биол. наук. М.: ИНМИ АН СССР, 1977.
35. Заварзин
Г. А. Бактерии и состав атмосферы. М.: Наука. 1972. (а)
36. Заварзин
Г. А. Литотрофные микроорганизмы - М.: Наука, 1972. (б)
37. Заварзин
Г. А. Эпиконтинентальные содовые водоемы как предполагаемые реликтовые биотопы
формирования наземной биоты // Микробиология. 1993. Т.62. Вып.5. с.789-800.
38. Заварзин
Г.А. Становление биосферы // Микробиология. 1997. Т.66. с.725-734. Заварзин
Г.А. Биоразнообразие как часть биосферно-геосферной системы возникновения
порядка из хаоса // Методология биологии: новые идеи (синергетика, семиотика,
коэволюция). Отв. Ред. О.Е.Баксанский. - М.: Эдиториал УРСС, 2001.
39. Заварзин
Г.А. Микробный геохимический цикл кальция // Микробиология. 2002. Т.71. с.5-22.
40. Заварзин
Г.А., Колотилова Н. Н. Введение в природоведческую микробиологию: Учебное
пособие. - М.: Книжный дом "Университет", 2001. -256 с.
41. Замана
Л. В. О происхождении сульфатного состава азотных терм Байкальской рифтовой
зоны // Доклады АН. 2000. Т.372. №3. С.361-363.(а)
42. Замана
Л.В. Петрогенная геохимическая модель азотных терм Байкальской рифтовой зоны //
Фундаментальные проблемы воды и водных ресурсов на рубеже третьего тысячелетия:
Материалы Международной научной конференции. 3-7 сентября 2000 г.- Томск:
Изд-во НТЛ, 2000. с.199-203. (б)
43. Иванов
М. В. Применение изотопов для изучения интенсивности процесса редукции
сульфатов в озере Беловодь // Микробиология. 1956. Т. 25. №3. С. 305309.
44. Илялетдинов
А.Н. Микробиологические превращения металлов. - Алма-Ата. Наука. 1984.
45. Кеппен
О. И., Красильникова Е.Н. Рост Chloroflexus
aurantiacus в фотоавтотрофных
условиях. /Микробиология. 1986. Т.55.Вып.5. С.879-882.
46. Кирюхин
В.К., Крайнов С.Р., Швец В.М. Гидрогеохимическое значение и методы изучения
органических форм миграции элементов. С. 33-38. В сборнике
"Гидрогеохимические методы поисков рудных месторождений". -
Новосибирск: Наука, 1982.
47. Компанцева
Е.И., Горленко. В.М. Фототрофные сообщества в некоторых термальных источниках
озера Байкал // Микробиология. 1988. Т. 57. №5. С. 841846.
48. Кондратьева
Е.Н., Красильникова Е.Н. Использование тиосульфата Chloroflexus
aurantiacus // Микробиология.
1988. Т.57. Вып. 3. С.357-360.
49. Крайнов
С.Р., Швец В.М. Основы геохимии подземных вод. - М.: Недра, 1980.
50. Крайча
Я. Газы в подземных водах. - М.: "Недра", 1980.
51. Красильникова
Е.Н., Кеппен О.И., Горленко В.М., Кондратьева Е.Н. Рост Chloroflexus
aurantiacus на средах с
разными органическими соединениями и пути их метаболизма // Микробиология.
1986. Т.55. Вып.3. С.425-429.
52. Красильникова
Е.Н., Кондратьева Е.Н. Рост Chloroflexus
aurantiacus в анаэробных
условиях в темноте и метаболизм органических субстратов // Микробиология. 1987.
Т.56.Вып.3. С.357-360.
53. Красильникова
Е. Н., Кондратьева Е.Н. Использование Chloroflexus
aurantiacus разных соединений
серы // Микробиология. 1988. Т.57.Вып.3. С.507-508.
54. Крылов
И. Н., Тихомирова Н.С. К образованию кремнистых микрофоссилий // Палеонтол.
журнал. 1988. №3. С.3-9.
55. Кузнецов
С.И., Романенко В.И. Микробиологическое изучение внутренних водоемов. - Л.:
Изд-во АН СССР, 1963. - 129 с.
56. Лауринавичус
К. С., Беляев С. С. Определение интенсивности микробиологического образования
метана радиоизотопным методом // Микробиология. 1978. Т. 47. №6. С.1115-1117.
57. Леин
А. Ю., Пименов Н. В. Роль бактериальной продукции на активных гидротермальных
полях в общем балансе органического углерода в океане. С. 320328. // Биология
гидротермальных систем. Под ред. А.В. Гебрук, К.Н. Несис, А.П. Кузнецов, А.М.
Сагалевич. М., КМК Press, 2002,
543 с.
58. Ломоносов
И. С. Геохимия и формирование современных гидротерм Байкальской рифтовой зоны.
- Новосибирск.: Наука, 1974.
59. Мартынов
П. И. Некоторые данные о горячих источниках Баргузинского заповедника.// Тр.
Баргузинского гос. заповедника. 1960. Вып.2. С. 147-154.
60. Намсараев
Б.Б., Дубинина Г.А., Бонч-Осмоловская Е.А., Старынин Д. А., Грабович М. Ю.,
Качалкин В. М., Нестеров А. И., Горленко В. М. 1991. Участие бактерий
круговорота углерода, серы и железа в деструкции органического вещества в
бентосных сообществах бухты Кратерной. Мелководные газогидротермы и экосистема
бухты Кратерной (вулкан Ушишир, Курильские о-ва). Кн. 1. Функциональные
характеристики. Ч.1. (ред. А.В. Жирмунский, В.Г. Тарасов), с.154-171.
Владивосток, ДВО РАН.
61. Намсараев
Б. Б., Бонч-Осмоловская Е. А., Мирошниченко М.Л., Пикута Е.В., Качалкин В. И.,
Миллер Ю. М., Пропп Л. И., Тарасов В. Г. Микробиологические процессы
круговорота углерода в мелководных гидротермах Западной окраины Тихого океана
// Микробиология. 1994. Т.63. с.100-111.
62. Орлеанский
В. К., Герасименко Л.М. Лабораторное моделирование термофильного
циано-бактериального сообщества // Микробиология. 1982. Т.51. №4. С.538-542.
63. Перельман
А.И. Геохимия ландшафтов. М.: "Высшая школа". 1966.
64. Перельман
А.И. Геохимия элементов в зоне гипергенеза. М., "Недра", 1972, 288 с.
65. Перельман
А. И. Геохимия природных вод. М.: "Наука". 1982.
66. Пиневич
А. В., Аверина С. Г. Оксигенная фототрофия: Руководство по эволюционной
клеточной биологии. СПб.: Изд-во С.-Петерб. Ун-та, 2002. 236 с.
67. Плюснин
А. М., Суздальницкий А.П., Адушинов А. А., Миронов А.Г. Особенности
формирования травертинов из углекислых и азотных термальных вод в зоне
Байкальского рифта // Геология и геофизика. 2000. Т.41. №4. С.564-570.
68. Посохов
Е. В. Общая гидрогеохимия. Л., "Недра", 1975. 208 с.
69. Резников
А.А., Муликовская Е.П., Соколов И.Ю. Методы анализа природных вод. 3-е изд. -
М.: Недра, 1970.
70. Семихатов
М.А., Раабен М.Е., Сергеев В.Н., Вейс А.Ф., Артемова О.В. Биотические события и
положительная изотопная аномалия карбонатного углерода 2.3-2.06 млрд. лет назад
// Стратиграфия. Геол. корреляция. 1999. Т.7. №5. с.3-27.
71. Сергеев
В.Н. Окремненные микрофоссилии докембрия и кембрия Урала и Средней Азии. Тр.
ГИН РАН; Вып. 474. - М.: Наука, 1992. - 139 с.
72. Соломин
Г.А., Крайнов С.Р. Щелочные составляющие природных и сточных щелочных вод,
геохимические процессы их нейтрализации кислыми и околонейтральными подземными
водами // Геохимия. 1998. №2. С.183-201.
73. Стащук
М.Ф. Проблема окислительно-восстановитеьного потенциала в геологии. - М.:
Недра. 1968.
75.Храпцова
Г.И., Цаплина И.А., Серегина Л.М., Логинова Л.Г. Термофильные бактерии горячих
источников Бурятии // Микробиология. 1984. Т.53. Вып.1. с. 137-141.
76. Шпейзер
Г.М., Васильева Ю.К., Гановичева Г.М., Минеева Л.М., Родионова В.А., Ломоносов
И. С., Ванг Янсинь. Органические вещества в минеральных водах горноскладчатых
областей Центральной Азии // Геохимия. 1999. №3. с. 302-311.
77. Юрков
В.В., Горленко В.М. Применение электронной сканирующей микроскопии для анализа
вертикальной структуры микробных сообществ альгобактериальных матов на стеклах
обрастания // Микробиология 1989. Т. 58. Вып. 4. С. 676-678.
78. Юрков
В.В., Горленко В.М. Новый вид пресноводных аэробных бактерий Erythrobacter
sibiricus
sp. nov.,
содержащих бактериохлорофилл а //
Микробиология.
1990. Т. 59. №1. С. 120-125.
.Юрков
В. В., Горленко В.М. Новый род пресноводных аэробных бактерий Roseococcus
gen.nov.,
содержащих бактериохлорофилл а // Микробиология. 1991. Т 60. №5. С. 902-907.
80. Юрков
В.В., Горленко В.М. Новый штамм RB-5
пурпурной несерной бактерии Rhodopseudomonas
blastica, выделенный из
сульфидного щелочного источника // Микробиология. 1992. Т. 61. №1. С. 103-108.
81. Юрков
В.В., Горленко В.М., Митюшина Л.Л., Старынин Д.А. Влияние лимитирующих факторов
на структуру фототрофных сообществ в Большереченских термальных источниках //
Микробиология. 1991. Т. 60. №6. С.129-138.
82. A
manual on methods for measuring primary production in aquatic environments. IBP
Handbook No. 12. // Ed. Richard A. Vollenweider. Oxford etc.: Blackwell. 1969.
83. Anderson
K.L., Tayne T.A., Ward D.M. Formation and fate of fermentation products in hot
spring cyanobacterial mats // Appl. Environ. Microbiol. 1987.
V.53. p.2343-2352.
84. Barns
S.M., Fundyaga R.E., Jeffries M.W., Pace N.R. Remarkable archaeal diversuty detected
in a Yellowstone national park hot spring environment //Proc. Natl. Acad. Sci.
USA. 1994.
V.91. p.1609-1613.
85.
Barns S.M., Delwiche C.F., Palmer
J.D., Pace N.R. Perspectives on archaeal diversity, thermophily and monophyly
from environmental rRNA sequences // Proc. Nat. Acad. Sci. USA. 1996.
V. 93. p.
9188-9193.
86.
Baross J.A., Hoffman S.E. Submarine
hydrothermal vents and associated gradient environments as sites for the origin
and evolution of life // Origins of life. 1985. V.
15.
p. 327-345.
87.Barret
E.L., Clark M.A. Tetrationate reduction and production of hydrogen sulfide from
thiosulfate // Microbiological reviews. June 1987. p.192-205.
88. Bateson
M.M., Wiegel J., Ward D.M. Comparative analysis of 16S ribosomal RNA sequences
of thermophilic fermentative bacteria isolated from hot spring cyanobacterial
mats // Syst. Appl. Microbiol. 1989. V.12.
p.1-7.
89.
Bauld J. Microbial mats in marginal
marine environments: Shark Bay, Western Australia, and Spencer Gulf, South
Australia // Eds. Cohen Y., Castenholz R.W., Halvorson H.O. MBL lectures in
biology. V.3. Microbial mats: Stromatolites. Alan R. Liss, Inc. NewYork. 1984,
p. 39-58.
90.
Bauld J., Brock T.D. Ecological
studies of Chloroflexus, a gliding photosynthetic bacterium // Arch. Microbiol.
1973. V.92. p.267-284.
91. Bauld
J., Brock T.D. Algal excretion and bacterial assimilation in hot spring algal
mats // J. Phycol. 1974. V.10.
p.101-106.
92.
Belkin S., Wirsen C.O., Jannasch
H.W. Biological and abiological sulfur reduction at high temperatures // Appl.
Environ. Microbiol. 1985. V.49. p.1057-1061. Ben-Bassat A., Zeikus J.G.
Thermobacteroides acetoethylicus gen. nov. and spec. Nov., a new chemoorganotrophic,
anaerobic thermophilic bacterium // Arch. Microbiol. 1981. V.128. p.365-370.
93. Bender
J., Rodriguez-Eaton S., Ekanemesang U.M., Philips P. Characterization of
metal-binding bioflocculants produced by the cyanobacterial component of mixed
microbial mats // Appl. Environ. Microbiol. 1994. V.60.
p.2311-2315.
94. Bergey's
manual of systematic bacteriology. V. 3 // Ed. James T. Staley. Baltimore etc.:
Williams&Wilkins. 1989
95. Bergey's
manual of systematic bacteriology / D.R. Boone, R.W. Castenholz (eds) v.1; G.M.
Garrity, editor-in-chief. - 2nd ed. 2001. Springer-Verlag. New York,
Berlin, Heidelberg.
96. Blank
C.E., Cady S.L., Pace N.R. Microbial composition of near-boiling
silica-depositing thermal springs throughout Yellowstone National Park // Appl.
Environ. Microbiol. 2002. V.68.
p.5123-5135.
97. B^chl
E., Rachel R., Burggraf S., Hafenbradl D., Jannsch H.W., Stetter K.O. Pyrolobus
fumarii, gen. and sp. nov., represents a novel group of archaea, extending the
upper temperature limit for life to 113eC // Extrmophiles. 1999.
V.1. p.14-21.
98. Blotevogel
K.H., Fisher U., Mocha M., Janssen S. Methanobacterium thermoalcaliphilum spec.
Nov., a new moderately alkaliphilic and thermophilic autotrophic methanogen //
Arch. Microbiol. 1986. V.142. p.211-217.
99. Bogdanov
Y.A.,
Lisitzin
A.P.,
Binns R.A.,
Gorshkov
A.I.,
Gurvich E.G.,
Dritz V.A.,
Dubinina
G.A.,
Bogdanova
O.Y.,
Sivkov A.V.,
Kuptsov V.M.
Low-temperature
hydrothermal
deposits
of Franklin
Seamount, Woodlark
Basin, Papua
New Guinea
// Mar. Geol.
1997.
V.142. p.99-117.
100.Brock T.D.
Micro-organisms adapted to high temperatures // Nature. 1967.
V. 214. P.882-885.
(a)
101.Brock T.D.
Relationship between standing crop and primary productivity along a hot spring
thermal gradient // Ecology. 1967. V. 48. P. 566-571. (б)
102.Brock, T. D.
Thermophilic microorganisms and life at high temperatures. Springer-Verlag, New
York, N.Y. 1978.
103.Brock T.D.,
Brock M.L. The measurement of chlorofill, primary productivity,
photophosphorylation, and macromolecules in benthic algal mats // Limnology and
Oceanography. 1967. V.12.
p.600-605.
104.Brock T.D.,
Brock M.L. Effect of light intensity on photosynthesis by thermal algae adapted
to natural and reduced sunlight // Limnol. Oceanogr. 1969.
V.14. p.334-341.
105.Brock
T.D., Brock M.L., Bott T.L., Edwards M.R. Microbial life at 90°C: the sulfur
bacteria of Boulder spring // J. Bacteriol. 1971. V.107.
p.303-314.
106. Caldwell
D.E., Caldwell S.J., Laycock J.P. Thermotrix thioparus gen. Et sp. nov. A
facultatively anaerobic facultative chemolithotroph living at neutral pH and
high temperature // Can. J. Microbiol. 1976. V.22.
p.1509-1517.
107. Castenholz
R.W. Thermophilic blue-green algae and the thermal environment //Bacteriol.
Rewiews. 1969. V. 33. No 4. P. 476-504.
108. Castenholz
R.W. The effect of sulfide on the blue-green algae pf hot springs. I. New
Zealand and Iceland // J.Phycol.
1976.
V.12. p.54-68.
109. Castenholz
R.W. The effect of sulfide on the blue-green algae pf hot springs. II.
Yellowstone National Park // Microbial
Ecology. 1977. V.3.
p.79-105.
110. Castenholz
R.W. Composition of hot spring microbial mats: a summary // In Cohen, Castenholz
and Halvorson (Eds), Microbial Mats: Stromatolites. 1984.
Alan R. Liss, New York. P.101-119.
111. Castenholz
R.W., Utkilen H.C. Physiology of sulfide tolerance in a thermophilic
Oscillatoria // Arch. Microbiol. 1984. V.
138.
P. 299-305.
112. Castenholz
R.W., Bauld J., Jorgenson B.B. Anoxygenic microbial mats of hot springs:
thermophilic Chlorobium sp. // FEMS Microbiology Ecology. 1990. V.74. P.
325-336.
113. Castenholz
R.W., Pierson B.K. Ecology of thermophilic anoxygenic phototrophs // In Blankenship,
Madigan, Bauer (eds): Anoxygenic photosynthetic bacteria. 1995. Kluwer Academic
publishers. Netherlands. P.87-103.
114. Chafetz
H.S., Folk R.L. Travertines: depositional morphology and the bacterially
constructed constituents // Journ. Sedim. Petrol. 1984. V.54. p.289-316.
115. Chafetz
H.S., Rush P.F., Utech N.M. Microenvironmental controls on mineralogy and habit
of CaCO3 precipitates: an example from an active travertine system //
Sedimentology. 1991. V.38.
p.107-126.
116. Chrisostomos
S, Patel B.K., Dwivedi P.P., Denman S.E. Caloramator indicus sp. nov., a new
thermophilic anaerobic bacterium isolated from the deep-seated nonvolcanicaly
heated waters of an Indian artesian aquifer // Int. J. Syst. Bacteriol. 1996.
V.46. p.497-501.
117. Chung
A.P., Rainey F., Nobre M.F., Burghardt J., da Costa M.S. Meiothermus cerbereus
sp. nov., a new slightly thermophilic species with high levels of 3-hydroxy
fatty acids // Int. J. Syst. Bacteriol. 1997. V.47.
p.1225-1230.
118. Cohen
Y., Padan E., Shilo M. Facultative anoxygenic photosynthesis in the
cyanobacterium Oscillatoria limnetica // J. Bacteriol. 1975. V. 123. P.
855-861.
119. Cohen
Y., Jorgensen B.B., Revsbech N.P. Poplawski R. Adaptation to hydrogen sulfide
of oxygenic and anoxygenic photosynthesis among cyanobacteria // Appl. Environ.
Microbiol. 1986. V.51, p. 398-407.
120. Cohen
Y. The Solar lake cyanobacterial mats: strategies of photosynthetic life under
sulfide // In Cohen, Castenholz and Halvorson (Eds), Microbial Mats:
Stromatolites, Alan R. Liss, New York. 1984. P.133-148.
121. Cohen
Y., Gorlenko V.M., Bonch-Osmolovskaya E.A. Interaction of sulphur and carbon
cycles in microbial mats. In: Evolution of the global biogeochemical sulphur
cycle. Brimblecombe P., Lein A.Yu. (eds.). SCOPE Published by John Wiley &
Sons Ltd.
1989. P. 191-238.
122. Cook
T.L., Stackes D.S. Biogeological mineralization in deep-sea hydrothermal
deposits // Science. 1995. V.267.
p.1975-1979.
123. De
Ley J., Cattoir H., Reynaerts A. The quantitative measurement of DNA
hybridization from renaturation rates // Eur. J. Biochem. 1970.
V.12. p.133-142.
124. Dismukes
G.C., Klimov V.V., Baranov S.V., Kozlov Yu.N., DasGupta J., Tyryshkin A. The
origin of atmospheric oxygen on Earth: The innovation of oxygenic
photosynthesis // Proc. Nac. Acad. Sci. 2001. V.98.
p.2170-2175.
126. Doemel
W.N., Brock T.D. Structure, growth and decomposition of laminated
algal-bacterial mats in alkaline hot springs // Appl. Environ. Microbiol. 1977,
34: 433-452.
127. Duckworth
A.W., Grant W.D., Jones B.E., van Steenbergen R. Phylogenetic diversity of soda
lake alkaliphiles // FEMS Microbiol. Ecol. 1996. V.19.
p.181-191.
128. Duhig
N.C., Davidson G.J., Stolz J. Microbial involvement in the formation of
Cambrian sea-floor silica-iron oxide deposits, Australia // Geology. 1992.
V.20. p.511-514.
129. Ehrenreich
A., Widdel F. Anaerobic oxidation of ferrous iron by purple bacteria, a new
type of phototrophic metabolism // Appl. Environ. Microbiol. 1994.
V.60. p.4517-4526.
130. Ehrlih
H.L. Geomicrobiology. Marcell Dekker, Inc., 1981. New York, N.Y.
131. Ehrlih
H.L. Microbes as geologic agents: their role in mineral formation //
Geomicrobiol. J. 1999. V.16.
P.135-154.
133.Emerson
D., Moyer C.L. Neutrophilic Fe-oxidizing bacteria are abundant at the Loihi
Seamount hydrothermal vents and play a major role in Fe oxide deposition //
Appl. Environ. Microbiol. 2002. V.68.
p.3085-3093.
134. Elsgaard
L., Prieur D., Mukwaya G.M., Jorgensen B.B. Thermophilic sulfate reduction in
hydrothermal sediment of lake Tanganyika, East Africa // Appl. Environ.
Microbiol. 1994. V.60.
p.1473-1480.
135. Engle
M., Li Y., Woese C., Wiegel J. Isolation and characterization of a novel
alkalitolerant thermophile, Anaerobranca horikoshii gen. nov., sp. nov. // Int.
J. Syst. Bacteriol. 1995. V.45.
p.454-461.
136. Ferris,
F. G., Beveridge T. J., Fyfe W. S. Iron-silica crystallite nucleation by
bacteria in a geothermal sediment. Nature. 1986. V.320.
p. 609-611.
137. Ferris
M.J., Ruff-Roberts A.L., Kopczynski E.D., Bateson M.M., Ward D.M.
Enrichment
culture and microscopy conceal diverse thermophilic Synechococcus populations
in a single hot spring microbial mat habitat // Appl. Environ. Microbiol. 1996.
V.62. p.1045-1050.
138. Ferris
M.J., Nold S.C., Revsbech N.P., Ward D.M. Population structure and
physiological changes within a hot spring microbial mat community following
disturbance // Appl. Environ. Microbiol. 1997. V.63. p.1367-1374.
139. Fortin
D., Ferris F.G. Precipitation of iron, silica, and sulfate on bacterial cell
surfaces // Geomicrobiol. J. 1998. V.15.
#4.
P.309-324.
140. Fouke
B.W., Farmer J.D., Des Marais D.J., Pratt L., Sturchio N.C., Burns P.C.,
Discipulo M.K. Depositional facies and aqueous-solid geochemistry of travertine
depositing hot springs (Angel terrace, Mammoth hot springs, Yellowstone
national park, U.S.A.) // J. Sedimentary Research. 2000. V.70. p.565-585.
141.Garrels
R.M., Christ C.L. Solutions, minerals and equilibria. Harper&Row, New York.
1965.
142. Gerdes
G., Krumbein W.E., Holtkamp E. Salinity and water activity related zonation of
microbial communities and potential stromatolites of the Gavish Sabkha // Eds.
Friedman G.M., Krumbein W.E. Ecological studies. V.53. Hypersaline ecosystems:
The Gavish Sabkha. Berlin etc. Springer-Verlag.1985. P. 238-266.
143. Giovannoni
S.J., Revsbech N.P., Ward D.M., Castenholz R.W. Obligately phototrophic
Chloroflexus: primary production in anaerobic hot spring microbial mats //
Arch. Microbiol. 1987. V.147.
p.80-87.
144. Godfroy
A., Meunier J.R., Guezennee J., Lesongeur F., Raguenes G., Rembault A., Barbier
G. Thermococcus fumicolans sp. nov., a new hyperthermophilic archaeon isolated
from a deep-sea hydrothermal vent in the north Fiji Basin // Int. J. Syst.
Bacteriol. 1996. V.46.
p.1113-1119.
145. Golubic
S. Organisms that build stromatolites // In Stromatolites, Developments in
sedimentology. 1976. V.20. M.R.Walter (ed.) Elsevier.
Amsterdam-Oxford-New-York. P.113-126.
146. Grant
W.D., Tindall B.J. The alkaline saline environment // In: Halophilic Bacteria
(Rodriguez, Valera F.,Ed.) p. 31-67. CRC Press. USA. 1986.
147. Guerrero
R., Mas J. Multilayered microbial communities in aquatic ecosystems: growth and
loss factors // In Microbial mats: phisiological ecology of benthic microbial
communities. 1989. ASM. Washington
148. Hanada
S., Hiraishi A., Shimada K., Matsuura K. Isolation of Chloroflexus aurantiacus
species and related thermophilic phototrophic bacteria from Japanese hot
springs using an improved isolation procedure // J. Gen. Appl. Microbiol. 1995.
V. 41. P.
119-130.
(a)
149. Hanada
S., Hiraishi A., Shimada K., Matsuura K. Chloroflexus aggregans sp. nov., a
filamentous phototrophic bacterium which forms dense cell aggregates by active
gliding movement // Int. J. Syst. Bacteriol. 1995. V.45.
p.676-681 (b)
150. Hanada
S., Takaichi S., Matsuura K., Nakamura K. Roseiflexus castenholzii gen. nov.,
sp. nov., a thermophilic, filamentous, photosynthetic bacterium that lacks
chlorosomes //
Int.
J. Syst. Evol. Microbiol., 2002. V.52, p.187-193.
.Heda
G.D., Madigan M.T. Utilization of amino acids and lack of diazotrophy in the
thermophilic anoxygenic phototroph Chloroflexus aurantiacus // J. Gen.
Microbiol. 1986. V.132. p.2469-2473.
152. Hiraishi
A., Umezawa T., Yamamoto H., Kato K., Maki Y. Changes in quinone profiles of
hot spring microbial mats with a thermal gradient // Appl. Environ. Microbiol.
1999. V.65. p.198-205.
153. Holm-Hansen
O. Ecology, physiology, and biochemistry of blue-green algae // Annu. Rev.
Microbiol. 1968. V.22. p.47-70.
154. Horikoshi
K. Microorganisms in alkaline environments. 1990. Kodansha. Tokyo.
155. Howsley
R, Pearson H.W. pH dependent sulfide toxicity to oxygenic photosynthesis in
cyanobacteria // FEMS Micro. Letters. 1979. V.6. p. 287-292. 156.Huber R., Eder
W., Heldwein S., Wanner G., Huber H., Rachel R., Stetter K.O. Thermocrinis
ruber gen.nov., sp.nov., a pink-filament-forming hyperthermophilic bacterium
isolated from Yellowstone national park // Appl. Envir. Microbiol. 1998.
V.64. p.3576-3583.
156. Hugenholtz
P., Pitulle C., Hershberger K.L., Pace N.R. Novel division level bacterial
diversity in a Yellowstone hot spring // J. Bacteriol. 1998.
V.180. p.366-376.
157. Iizasa
K., Kawasaki K., Maeda K., Matsumoto T., Saito N., Hirai K. Hydrothermal
sulfide-bearing Fe-Si oxyhydroxide deposits from the Coriolis Troughs, Vanuatu
backarc, southwestern Paciffic // Mar. Geol. 1998. V.145.
p.1-21.
158. Inagaki
F., Motomura Y., Ogata S. Microbial silica deposition in geothermal hot waters
// Appl. Microbiol. Biotechnol. 2003. V.60. p.605-611.
159. Jannasch
H.W., Mottl M.J. Geomicrobiology of deep-sea hydrothermal vents // Science. 1985.
V.229. p.717-725.
160. Jones
B., Renaut R.W. Influence of thermophilic bacteria on calcite and silica
precipitation in hot springs with water temperature above 90°C: evidence from
Kenya and New Zealand // Can. J. Earth Sci. 1996. V.33. p.72-83.
161. Jones,
B., Renaut R. W. Formation of silica oncoids around geysers and hot springs at
El Tatio, northern Chile // Sedimentology. 1997. V.44.
p.287-304.
162. Jones,
B., Renaut R. W., Rosen M. R. Vertical zonation of biota in microstromatolites
associated with Hot Springs, North Island, New Zealand // Palaios 1997. V.12.
p.220-236. (а)
164.Jones,
B., Renaut R. W., Rosen M. R. Biogenicity of silica precipitation around
geysers and hot-spring vents, North Island, New Zealand // J. Sediment. Res.
1997. V.67. p.88-104. (б)
.Jorgensen
B.B., Nelson D.C. Bacterial zonation, photosynthesis and spectral light
distribution in hot spring microbial mats of Iceland // Microb. Ecol. 1988.
V.16. p.133-148.
166. Jorgensen
B.B., Zawacki L.X., Jannsch H.W. Thermophilic bacterial sulfate reduction in
deep-sea sediments at the Guaymas Basin hydrothermal vent site (Gulf of
California) // Deep-Sea Res. 1990. V.37. p.695-710.
167. Juniper
S.K., Fouquet Y. Filamentous iron-silica deposits from modern and ancient
hydrothermal sites // Can. Mineral. 1988. V.26. p.859-869.
168. Karl
D.M., Wirsen C.O., Jannasch H.W. Deep-sea primary production at the Galapagos
hydrothermal vents // Science. 1980. V.207.
p.1345-1347.
169. Kashefi
K., Holmes D.E., Reysenbach A., Lovley D.R. Use of Fe(III) as an electron
acceptor to recover previously uncultured hyperthermophiles: isolation and
characterization of Geothermobacterium ferrireducens gen. nov., sp. nov. //
Appl. Environ. Microbiol. 2002. V.68.
p.1735-1742.
170.Kashefi
K., Lovley D.R. Reduction of Fe(III) Mn(IV) and toxic metals at 100°C by
Pyrobaculum islandicum // Appl. Environ. Microbiol. 2000.
V.66. p.1050-1056.
171.Keller
M., Brown F.-J., Dirmeier R., Hafenbradl D., Burggraf S., Rachel R., Stetter
K.O. Thermococcus alkaliphilus sp. nov., a new hyperthermophilic archaeum
growing on polysulfide at alkaline pH // Arch. Microbiol. 1995.
V.164. p.390 - 395.
172.Kieft
T.L., Fredrickson J.K., Onstott T.C., Gorby Y.A., Kostandarites H.M., Bailey
T.J., Kennedy D.W., Li S.W., Plymale A.E., Spadoni C.M., Gray M.S.
Dissimilatory reduction of Fe(III) and other electrone acceptors by a Thermus
isolate // Appl. Environ. Microbiol. 1999. V.65.
p.1224-1221.
173.Knoll
A.H., Golubic S. Anatomy and taphonomy of a Precambrian algal stromatolite //
Precambr. Res. 1979. V.
10.
#1/2. P. 115-151.
174.Knoll A.H.
The distribution and evolution of microbial life in the late Proterozoic era //
Ann. Rev. Microbiol. 1985. V.39.
p. 391-417.
175.Knoll A.H.
Archean and Proterozoic paleontology // In: Jansonius J.&McGregor D.C.
(eds.), Palynology: principles and applications; American association of
stratigraphic palynologists foundation. 1996. V.1.
p.51-80.
176.Konhauser
K.O., Ferris F.G. Diversity of iron and silica precipitation by microbial mats
in hydrothermal waters, Iceland: implications for Precambrian iron formations
// Geology. 1996. V.24. p.323-326.
177.Konhauser
K.O., Phoenix V.R., Bottrell S.H., Adams D.G., Head I.M. Microbial-silica
interactions in Icelandic hot spring sinter: possible analogues for some
Precambrian siliceous stromatolites // Sedimentology. 2001.
V.48. p.415-433.
178.Konopka A.
Accumulation and utilization of polysaccharide by hot-spring phototrophs during
a light-dark transition // FEMS Microb. Ecol. 1992. V. 102. P.27-32.
179.Kotelnikova
S.V., Obraztsova A.Y., Gongadze G.M., Laurinavichius K.S. Methanobacterium
thermoflexum sp. nov. and Methanobacterium defluvii sp. nov., thermophilic rod-shaped
methanogens isolated from anaerobic digestor sludge // Syst. Appl. Microbiol. 1993.
V.16. p.427-434.
180.Krienitz L.,
Ballot A., Kotut K., Wiegand C., Putz S., Metcalf J.S., Codd G.A., Pflugmacher
S. Contribution of hot spring cyanobacteria to the mysterious deaths of Lesser
Flamingos at Lake Bogoria, Kenya // FEMS Microbiol. Ecol. 2003. V.43.
p.141-148.
181.Krulwich
T.A., Guffanti A.A. Alkalophilic bacteria // Annu. Rev. Microbiol. 1989.
V.43. p.435-463.
182. Li
Y., Mandelco L., Wiegel J. Isolation and characterization of moderately
thermophilic anaerobic alkaliphile Clostridium paradoxum sp. nov. // Int. J.
Syst. Bacteriol. 1993. V.43. p.450 - 460.
183. Li
Y, Engle M., Mandelco L., Wiegel J. Clostridium thermoalkaliphilum sp. nov., an
anaerobic and termotolerant facultative alkaliphile // Int. J. Syst. Bacteriol.
1994.
V.44. p.111
- 118.
184. Little
C.T.S., Herrington R.J., Heymon R.M., Danelian T.D. Early Jurrasic hydrothermal
vent community from the Franciscan Complex, San Rafael Mountains, California //
Geology. 1999. V.27.
p.167-170.
185. Madigan
M.T., Brock T.D. Photosynthetic sulfide oxidation by Chloroflexus aurantiacus,
a filamentous, photosynthetic, gliding bacterium // J. Bacteriol. 1975. V.122.
p.782-784.
186. Madigan
M.T., Takigiku R., Lee R.G., Gest R., Hayes J.M. Carbon isotope fractionation
by thermophilic phototrophic sulfur bacteria: evidence for autotrophic growth
in natural populations // Appl. Environ. Microbiol. 1989. V.55. p.639-644.
187. Marmur
J. A procedure for the isolation DNA from microorganisms // J. Molecular. Biol.
1961.
V.3. p.208-218.
188. Marteinsson
V.T., Kristjansson J.K., Kristmannsdottir H., Dahlkvist M., Saemundsson K.,
Hannington M., Petursdottir S.K., Geptner A., Stoffers P. Discovery and
description of giant submarine smectite cones on the seafloor in Eyjafjordur,
Northern Iceland, and a novel thermal microbial habitat // Appl. Environ.
Microbiol. 2001. V.67. p.827-833.
189. Mathrani
I.M., Boone D.R., Mah R.A., Fox G.E., Lau P.P. Methanohalophilus zhilinae sp.
nov., an alkaliphilic, halophilic, methylotrophic methanogen // Int. J. Syst.
Bacteriol. 1988. V.38.
p.139-142.
190. Moezelaar
R., Bijvank S.M., Stal L.J. Fermentation and sulfur reduction in the
mat-building cyanobacterium Microcoleus chtonoplastes // Appl. Environ.
Microbiol. 1996. V.62. p.1752-1758.
191. Moody
M.D., Dailey H.A. Ferric iron reductase of Rhodopseudomonas sphaeroides // J.
Bacteriol. 1985. V.163.
p.1120-1125.
192. Moyer
C.L., Dobbs F.C., Karl D.M. Phylogenetic diversity of the bacterial community
from a microbial mat at an active, hydrothermal vent system, Loihi seamount,
Hawaii // Appl. Environ. Microbiol. 1995. V.61.
p.1555-1562.
193. Nakagawa
T., Fukui M. Phylogenetic characterization of microbial mats and streamers from
a Japanese alkaline hot spring with a thermal gradient // J. Gen. Appl.
Microbiol. 2002. V.48.
p.211-222.
194. Nisbet
E.G. RNA, hydrothermal systems, zeolites and the origin of life // Episodes. 1986.
V. 9. p.
83-89.
195. Nold
S.C., Kopczynsky E.D., Ward D.M. Cultivation of aerobic chemoorganotrophic
proteobacteria and gram-positive bacteria from a hot spring microbial mat //
Appl. Envir. Microbiol. 1996. V.62.
N.2. p. 3917-3921.
196. Nubel
U., Bateson M.M., Vandieken V., Wieland A., Kuhl M., Ward D.M. Microscopic
examination of distribution and phenotypic properties of phylogenetically
diverse Chloroflexaceae-related bacteria in hot spring microbial mats // Appl.
Environ. Microbiol.
2002. V.68. p.4593-4603.
197. Oehler
J.H., Schopf J.W. Artificial microfossils: experimental studies of
permineralisation of blue-green algae in silica // Science. 1971.
V.174. p.1229-1231.
198. Odintsova
E., Jannasch H., Mamone J., Langworthy T. Thermotrix azorensis sp. nov., an
oblogately chemolithoautotrophic, sulfur-oxidizing, thermophilic bacterium //
Int. J. Syst. Bacteriol. 1996. V.46.
p.422-428.
199. Okamura
K., Hisada T., Hiraishi A. Isolation and characterisation of phototrophic
purple nonsulfur bacteria from hot spring Chloroflexus mats // Abstracts of 11th
International symposium on phototrophic prokaryotes. August 24-29,
2003. Tokyo, Japan. P. 154.
200. Oremland,
R.S., Dowdle P.R., Hoeft S., Sharp J.O., Schaefer J.K., Miller L.G., Blum J.S.,
Smith R.L., Bloom N.S., Wallschlaeger D. Bacterial dissimilatory reduction of
arsenate and sulfate in meromictic Mono lake, California // Geohim. Cosmochim.
Acta. 2000.
V.64. p.3073-3084.
201. Oremland,
R.S., Miller L.G., Whiticar M.J. Sources and flux of natural gases from Mono
Lake, California // Geohim. Cosmochim. Acta. 1987. V.51.
p.2915-2929.
202. Oren,
A., Shilo M. Anaerobic heterotrophic dark metabolism in the cyanobacterium
Oscillatoria limnetica: sulfur respiration and lactate fermentation // Arch.
Microbiol. 1979.
V.122. p. 77-84.
203. Owen
R.J., Hill L.R. Lapage S.P. Determination of DNA base composition from melting
profiles in dilute buffers. Biopolymers. 1969. V. 7. P. 503-516.
204. Oxburgh,
R., Broecker W.S., Wannikhof R.H. The carbon budget of Mono lake // Global.
Biogeochem. Cycles. 1991. V.5.
p.359-372.
205. Pentecost
A. Formation of laminate travertines at Bagno Vignone, Italy // Geomicrobiol.
J. 1994.
V.12. P.239-252.
206. Pentecost
A. Significance of the biomineralizing microniche in a Lyngbia (Cyanobacterium)
travertine // Geomicrobiol. J. 1995. V.13.
p.213-222.
207. Pfennig
N., Lippert K. D. Uber das Vitamin B12 - Bedurfnis phototropher Schwefelbackterien
// Arch. Mikrobiol 1966.V.55. p.245 - 256.
208. Pierson
B.K., Castenholz R.W. A phototrophic gliding filamentous bacterium of hot
springs, Chloroflexus aurantiacus gen. and sp. nov. // Arch. Microbiol. 1974.
V.100. p.5-24.
209.Pierson
B.K., Giovannoni S.J., Castenholz R.W. Physiological ecology of a gliding
bacterium containing bacteriochlorophyll a //Appl. Environ. Microbiol. 1984.
V.47. p.576-584.
210. Pierson
B.K., Giovannoni S.J., Stahl D.A., Castenholz R.W. Heliothrix oregonesis, gen.
nov., sp. nov., a phototrophic filamentous gliding bacterium containing
bacteriochlorophill a // Arch. Microbiol. 1985. V.142. p.164-167.
211. Pierson
B.K., Parenteau M.N., Griffin B.M. Phototrophs in high-iron-concentration
microbial mats: Physiological ecology of phototrophs in an iron-depositing hot
spring// Appl. Environ. Microbiol. 1999. V.65. p.5474-5483.
212. Pierson
B.K., Parenteau M.N. Phototrophs in high iron microbial mats: microstructure of
mats in iron-depositing hot springs // FEMS Microb. Ecol. 2000.
v.32. p.181-196.
213. Pikuta
E., Lysenko A., Suzina N., Osipov G., Kuznetsov B., Tourova T., Akimenko V.,
Laurinavichius K. Desulfotomaculum alkaliphilum sp. nov., a new alkaliphilic,
moderately thermophilic, sulfate-reducing bacterium // Int. J. Syst. Microbiol.
2000. V.50.p.25-33.
214. Preat
A., Mamet B., De Ridder C., Boulvain F., Gillan D. Iron bacterial and fungal
mats, Bajocian stratotype (mid-Jurrasic, northern Normandy, France) //
Sediment. Geol. 2000. V.137. p.107-126.
215. Prowe
S.G., Antranikian G. Anaerobranca gottschalkii sp. nov., a novel
thermoalkaliphilic bacterium that grows anaerobicaly at high pH and temperature
// Int. J. Syst. Evol. Microbiol. 2001. V.51.
p.457-465.
216. Puteanus
D, Glasby D.P., Soffers P., Kunzendorf H. Hydrothermal iron-rich deposits from
the teahitia-mehitia and MacDonald hot-spot areas, Southwest Pacific // Mar.
Geol. 1991.
V.98. p.389-409.
217. Ramsing
N.B., Ferris M.J., Ward D.M. Highly ordered vertical structure of Synechococcus
populations within the one-millimeter-thick photic zone of a hot spring
cyanobacterial mat // Appl. Environ. Microbiol.2000.V.66.p.1038-1049.
218. Reysenbach
A.L., Wickham G.S., Pace N.R. Phylogenetic analysis of the hyperthermophilic
pink filament community in Octopus spring, Yellowstone national park // Appl.
Environ. Microbiol. 1994. V.60.
p.2113-2119.
219. Reysenbach
A.L., Ehringer M., Hershberger K. Microbial diversity at 83 degrees C in
Calcite springs, Yellowstone National Park: another environment where
Aquificales and "Korarchaeotd" coexist // Extremophiles. 2000.
V.4. p.61-67. (а)
220. Reysenbach
A.-L., Longnecker K., Kirshtein J. Novel bacterial and archaeal lineages from
an in situ growth chamber deployed at a Mid-Atlantic ridge hydrothermal vent //
Appl. Environ. Microbiol. 2000. V.66.
p.3798-3806. (б)
221. Reynolds
J. The use of lead citrate of high pH as electrone opaque in electrone
microscopy //J. Cell. Biol. 1963. V.
17.
№1. P.208-218.
222. Revsbech
N.P., Ward D.M. Microelectrode studies of interstitial water chemistry and
photosynthetic activity in a hot spring microbial mat // Appl. Environ.
Microbiol. 1984. V.
48. №2. P. 270-275.
223. Richardson
L.L., Castenholz R.W. Enhanced survival of the cyanobacterium Oscillatoria
terebriformis in darkness under anaerobic conditions // 1987. Appl. Environ.
Microbiol. V. 53. P.2151-2158.
224. Roy
A.B., Trudinger P.A. The biochemistry of inorganic compounds of sulphur.
Cambridge University Press. 1970. Cambridge.
225. Ryter
A., Kellenberger E. Etude an microscope electronique des plasmes contenant de
l'acide deoxyribonucleique des nucleodes des bacteries en croissances active //
Z. Naturforsch. 1958. B.
13b. S. 597-605.
226. Ruff-Roberts
A.L., Kuenen J.G., Ward D.M. Distribution of cultivated and uncultivated
cyanobacteria and Chloroflexus-like bacteria in hot spring microbial mats //
Appl. Envir. Microbiol.
1994. V.60. p.697-704.
227. Sandbeck
K.A., Ward D.M. Fate of immediate methane precursors in low-sulfate, hot-spring
algal-bacterial mats // Appl. Environ. Microbiol. 1981.
V.41. p.775-782.
228. Sandbeck
K.A., Ward D.M. Temperature adaptations in the terminal processes of anaerobic
decomposition of Yellowstone and Islandic hot spring mats. // Appl. Environ.
Microbiol. 1982. V.44.
P.844-851.
229. Santegoeds
C.M., Nold S.C., Ward D.M. Denaturating gradient gel electrophoresis used to
monitor the enrichment culture of aerobic chemoorganotrophic bacteria from a
hot spring cyanobacterial mat // Appl. Envir. Microbiol. 1996.
V.62. N.11. p. 3922-3928.
230. Schauder
R., Kroger A. Bacterial sulfur respiration // Arch. Microbiol. 1993.
V.159. p.
491-497.
231. Schauder
R., Muller E. Polysulfide as a possible substrate for sulfur-reducing bacteria
// Arch Microbiol, 1993. V.160, p.377-382
232. Schink
B., Zeikus J.G. Clostridium thermosulfurogenes sp. nov., a new thermophile that
produces elemental sulphur from thiosulphate // J. Gen. Microbiol. 1983.
V.129. p.1149-1158.
233.Skirnisdottir
S., Hreggvidsson G.O., Hjorleifsdottir S., Marteinsson V.T., Petursdottir S.K.,
Holst O., Kristjansson J.K. Influence of sulfide and temperature on species
composition and community structure of hot spring microbial mats // Appl.
Environ. Microbiol.
2000. V.66. P. 2835-2841.
234. Skirnisdottir
S., Hreggvidsson G., Holst O., Kristjansson J. Isolation and characterization
of a mixotrophic sulfur-oxidizing Thermus scotoductus // Extremophiles. 2001.
V. 5. P.45-51.
235. Sievert
S.M., Brinkhoff T., Muyzer G., Ziebis W., Kuever J. Spatial heterogenity of
bacterial populations along an environmental gradient at a shallow submarine
hydrothermal vent near Milos island (Greece) // Appl. Environ. Microbiol. 1999.
V.65. p.3834-3842. Spiro B., Pentecost A. One day in the life of a stream - a
diurnal inorganic carbon mass balance for a travertine-depositing stream
(Waterfall beck, Yorkshire) // Geomicrobiol. J. 1991. V.9. #1. P.1-12.
236. Stal
L. Physiological ecology of cyanobacteria in microbial mats and other
communities // New Phytol. 1995. V.
131.
P.1-32.
237. Stoffers
P., Glasby G.P., Stuben D., Renner R.M., Pierre T.G., Webb J., Cardile C.M.
Comparative mineralogy and geochemistry of hydrothermal iron-rich crusts from
the Pitcairn, Teahitia-Mehetia, and MacDonald hot-spot areas of the SW Pacific
// Mar. Georesour. Geotechnol. 1993. V.11.
p.45-89.
238. Stookey
L.L. Ferrozine - a new spectrophotometric reagent for iron // Analytical
chemistry 1970. V.42. p.779-781.
239. Svetlytshni
V., Rainey F., Wiegel J. Thermosyntropha lipolytica gen. nov., sp. nov., a
lipolytic anaerobic organoheterotrophic alkalitolerant thermophile utilizing
short- and long chain fatty acids in syntrophic co-culture with a metanogen //
Int. J. Syst. Bacteriol. 1996. V.46.
p.1131-1137.
240. Takai
K., Komatsu T., Inagaki F., Horikoshi K. Distribution of archaea in a black
smoker chimney structure // Appl. Environ. Microbiol. 2001. V.67. p.3618-3629.
241. Tarasov
V.G., Propp M.V., Propp L.N., Zhirmunsky A.V., Namsaraev B.B., Gorlenko V.M.,
Starynin D.A. Shallow-water gasohydrothermal vents of Ushishir volcano and the
ecosystem of Kraternaya bight (The Kurile islands) // Marine ecology. 1990.
V.11(1). p.1-23.
242. Teske
A., Hinrichs K-U., Edgcomb V., Gomez A. d.V., Kysela D., Sylva S.P., Sogin
M.L., Jannasch H.W. Microbial diversity of hydrothermal sediments in the
Guaymas basin: evidence for anaerobic methanotrophic communities // Appl.
Environ. Microbiol. 2002. V.68. p.1994-2007.
243. The
Mono Basin Ecosystem. Effect of Changing Lake Level. Ed. by Mono Basin
Ecosystem Study Committee Board Environmental Studies and Toxicology Commission
on Physical Sciences, Mathematics, and Resources National Resources Council.
National Academy Press. Washington, D.C. 1987
244. Trewin,
N.H., Knoll A.H. Preservation of Devonian chemotrophic filamentous bacteria in
calcite veins // Palaios. 1999. V.14. p.288-294.
245. Truper
H.G., Schlegel H.G. Sulphur metabolism in Thiorhodaceae. I. Quantative
measurements on growing cells of Chromatium okenii. //Antonie van Leeuwenhoek
J. Microbiol. And Serol. 1964. V.30.
№3.
P. 225-238.
246. Van
de Peer Y., De Wachter R. TREECON for Windows: a software package for the
construction and drawing of evolutionary trees for the Microsoft Windows
environment // Comput. Appl. Biosci. 1994. V.10.
p.569-570.
247. Von
Damm K.L. Controls on the chemistry and temporal variability of seafloor
hydrothermal fluids // In S.Humphris, R. Zierenberg, L.Mullineaux, R. Thomson
(ed.), Seafloor hydrothermal systems: physical, chemical, biological, and
geological interactions. American Geophysical Union. Washington. D.C. 1995.
248. Walsh
M.M. Microfossils and possilble microfossils from the Early Archean Onwervaht
Group, Barberton Mountain Land, South Africa // Precambr. Res. 1992.
V.54. p.271-293.
250.Walter
M.R. Archean stromatolites: evidence of the Earth's earliest benthos. In
Earth's earliest biosphere: it's origin and evolution / ed by J.W. Schopf.
Princeton. 1983.
251. Walter
M.R. Geyserites of Yellowstone national park: an example of abiogenic
"stromatolites" // In Stromatolites, Developments in sedimentology.
1976. V.20. M.R.Walter (ed.) Elsevier. Amsterdam-Oxford-New-York. P.87-112.
252. Walter
M.R., Bauld J., Brock T.D. Microbiology and morphogenesis of columnar
stromatolites (Conophyton, Vacerrilla) from hot springs in Yellowstone national
park // In Stromatolites, Developments in sedimentology. 1976. V.20. M.R.Walter
(ed.) Elsevier. Amsterdam-Oxford-New-York. P.273-310.
253. Walter
M.R., McLoughlin S., Drinnan A.N., Farmer J.D. Palaeontology of Devonian
thermal spring deposits, Drummond Basin, Australia // Alcheringa. 1998. V. 22.
p. 285314.
254. Ward
D.M. Thermophilic methanogenesis in a hot spring algal-bacterial mat (71-30°C)
// Appl. Environ. Microbiol. 1978. V.35. P.1019-1026.
255. Ward
D.M., Beck E., Revsbech N.P., Sandbeck K.A., Winfrey M.R. Decomposition of hot
spring microbial mats. // In Microbial mats: Stromatolites, 1984. P 191-214
256. Ward
D.M., Ferris M.J., Nold S.C., Bateson M.M. A natural view of microbial
biodiversity within hot spring cyanobacterial mat communities // Microbiol.
Mol. Biol. Rev. 1998. V.
62.
p.1353-1370.
257. Ward
D.M., Weller R., Bateson M.M. 16S rRNA sequences reveal numerous uncultured
microorganisms in a natural community // Nature (London). 1990. V.344. p.63-65.
258. Ward
D.M., R. Weller, J. Shiea, R.W. Castenholz and Y. Cohen. Hot spring microbial
mats: anoxygenic and oxygenic mats of possible evolutionary significance // In
Y. Cohen and E. Rosenberg (ed.), Microbial mats: physiological ecology of
benthic microbial communities. ASM, Washington, D.C., 1989,
p. 3-15.
259. Weller
D., Doemel W., Brock T.D. Requirement of low oxidation-reduction potential for
photosynthesis in a blue-green alga (Phormidium sp.) // Arch. Microbiol. 1975.
V.104. p.7-13.
260. Weller
R.M., Bateson M.M., Heimbuch B.K., Kopczynsky E.D., Ward D.M.
Uncultivated
cyanobacteria, Chloroflexus-like inhabitants, and spirochete-like inhabitants
of a hot-spring microbial mat // Appl. Envir. Microbiol. 1992. V.58. p.
39643969.
.Westall
F., Marchesini D. Fossil bacteria and biofilms from the early Archaean (3.3-3.5
b.y.) Barberton and Pilbara greenstone belts: the first extremophile life on
Earth and its relevance to the search for life on Mars // Abstracts of Int.
Conference "Instruments, methods and missions for astrobiology V".
Moscow. PIN RAS, May 24-25. 2002. P.
99.
262. Wickstrom
C.E., Castenholz R.W. Dynamics of cyanobacterial and ostracod interactions in
an Oregon hot spring // Ecology. 1985. V.66.
p.1024-1041.
263. Widdel
F., Schnell S., Heising S., Ehrenreich A., Assmus B., Schink B. Ferrous iron
oxidation by anoxygenic phototrophic bacteria // Nature (London). 1993. V.362.
p.834-835.
264.Wiegel
J. Anaerobic alkalithermophiles, a novel group of extremophiles //. 1998. V.2.
P. 257-267.
265. Wiegel
J., Ljungdahl L.G. Thermoanaerobacter ethanolicus gen. nov., sp. nov., a new
extreme thermophilic, anaerobic bacterium // Arch. Microbiol. 1982.
V.128. p.343-348.
266. Wiegel
J., Ljungdahl L.G., Rawson J.R. Isolation from soil and properties of the
extreme thermophile Clostridium thermohydrosulphuricum // J. Bacteriol. 1979.
V.139. p.800-810.
267. Yamamoto
H., Hiraishi A., Kato K., Chiura H.X., Maki Y., Shimizu A. Phylogenetic
evidence for the existence of novel thermophilic bacteria in hot-spring
sulfur-turf microbial mats in Japan // Appl. Environ. Microbiol. 1998.
V.64. p.1680-1687.
268. Zeikus
J.G., Ben-Bassat A., Hegge P.W. Microbiology of methanogenesis in thermal,
volcanic environments // J. Bacteriol. 1977. V.143.
p.432-440.
269. Zeikus
J.G., Wolfe R.S. Methanobacterium thermoautotrophicus sp. nov., an anaerobic,
autotrophic, extreme thermophile // J. Bacteriol. 1980.
V.109. p.707-713.