Молекулярні механізми міжклітинних взаємодій олігодендроцитів і нейронів в нормі та за умов олігодендрогліоми головного мозку
Міністерство освіти та науки
України
Дніпропетровський
національний університет ім. Олеся Гончара
Факультет біології, екології
та медицини
Кафедра біофізики та біохімії
Аналітичний огляд
з курсу «Молекулярні
механізми міжклітинних комунікацій»
на тему «Молекулярні
механізми міжклітинних взаємодій олігодендроцитів і нейронів в нормі та за умов
олігодендрогліоми головного мозку»
Виконавець:
студент гр. БХ-14м-6
Жданкін А. Є.
Дніпропетровськ 2014
Зміст
Вступ
. Загальна характеристика складних контактів
. Основні компоненти контактних взаємодій
олігодендроцитів та нейронів
.1 Загальна характеристика компонентів адгезивної
міжклітинної комунікації олігодендроцитів та нейронів
.2 Адгезивні білкові молекули
.3 Адаптерні білкові компоненти
.4 Компоненти цитоскелету нейронів та олігодендроцитів
.5 Щілинні контакти олігодендроцитів та нейронів
.6 Інші типи контактів
. Зміни олігодендрогліально-нейронних взаємодій при
новоутвореннях головного мозку
3.1 Загальна характеристика
неоплазій, що виникають у головному мозку ссавців
.2 Сучасна класифікація неоплазій
головного мозку
.3 Патологія міжклітинних контактів
гліоцитів і нейронів при дисембріогенетичних новоутвореннях
.4 Порушення структури міжклітинних
контактів олігодендроцитів та нейронів у дорослому організмі за умов
олігодендрогліоми
Висновки
Список використаних джерел
Вступ
Відомо, що функціонування багатоклітинного організму
забезпечується завдяки узгодженій роботі систем органів. В основі цього лежить
комунікативна взаємодія клітин між собою та з екстрацелюлярним матриксом. В
залежності від типу такої взаємодії науковцями виділено різні типи міжклітинних
контактів, які можна класифікувати за певними ознаками.
В залежності від виду контактуючих клітин виділяють
гомофільні та гетерофільні контакти. Перші полягають у взаємодії однакових за
походженням та структурно-функціональними особливостями клітин (наприклад,
контактна взаємодія між однотиповими гепатоцитами печінки). Гетерофільні
контакти утворюються між різними клітинами. Так, прикладом гетерофільного
міжклітинного контакту є взаємодія нейрогліальної молекули клітинної адгезії
(NgCAM чи L1CAM) гліоцитів з відповідними адгезивними молекулами
нейронів [1].
Згідно з структурно-функціональною класифікацією умовно
виділяють наступні типи контактів: прості (паралельні, зубчасті і пальцеподібні
контакти - інтердигітація) та складні (якірні, замикаючі/щільні,
комунікативні/шілинні й контакти для передачі сигналів) контакти. Перший тип -
це неспеціалізовані контакти-з'єднання плазматичних мембран двох сусідніх
клітин на відстані 10-20 нм, за якого взаємодіють шари глікокаліксу обох
клітин. Контактуючі поверхні можуть розташовуватися паралельно або утворювати
взаємні впинання, коли вирости цитоплазматичної мембрани і цитоплазми однієї
клітини занурюються у відповідні заглиблення сусідньої (зубчастий і
пальцеподібний контакти) [1, 2].
Складні контакти - побудовані зі специфічних структур, які
забезпечують комплексну взаємодію клітин між собою чи з міжклітинним матриксом.
Характеристика складних контактів надається нижче, у першому розділі роботи.
1. Загальна характеристика складних контактів
Складні контакти можуть бути щільними
замикаюми (ізолюючими), якірними (зчеплювальними) та комунікаційними.
Щільний замикаючий контакт
характерний для клітин епітеліальної вистилки травного тракту і епітелію залоз.
При формуванні щільного контакту зовнішні шари мембран на окремих ділянках
максимально зближуються, внаслідок чого стають непроникними для макромолекул та
іонів; також спостерігається утворення одного суцільного пласта, який пояском
оточує апікальні ділянки клітин [2].
Якірні, або зчеплювальні контакти
утворюються за участю фібрилярних елементів цитоскелету (рис. 1).

Рис. 1. Специфічні адгезивні (якірні)
контакти пірамідальних нейронів гіпокампу - основа функціональної активності
цього типу клітин
До цих міжклітинних з’єднань належать
зчеплювальні стрічки, фокальні контакти та бляшки зчеплення, які пов’язуються з
актиновими мікрофіламентами всередині клітини, а також десмосоми та
напівдесмосоми, які з’єднуються з іншими елементами цитоскелету - проміжними
філаментами [2, 3].
Зміцнення контакту між клітинами
досягається шляхом формування десмосом - утворень цитоплазми двох сусідніх
клітин, кожна з яких формує товсту пластинку прикріплення діаметром до 0,5 мкм.
Між пластинками знаходиться міжклітинна щілина шириною 25-30 нм, заповнена
електронно-щільною речовиною, утвореною молекулами інтегральних глікопротеїнів
- десмоглеїнів. З боку гіалоплазми в зоні десмосоми розташовується
електронно-щільний шар білка - десмоплакіну, в який вплітаються проміжні
елементи цитоскелету. Десмосоми є характерними контактами епітеліальних,
ендотеліальних клітин, кардіоміоцитів та інших клітин. На відміну від
десмосоми, що складається з двох пластинок прикріплення, напівдесмосома має
лише одну таку пластинку і утворюється в місцях контакту епітеліальних клітин
із базальною мембраною. На відміну від щільного контакту, всі типи
зчеплювальних контактів є проникними для водних розчинів і не відіграють ніякої
ролі в обмеженні дифузії [2].
Комунікаційні, чи щілинні,
міжклітинні контакти є функціональними зв’язками клітинами. Через щілинні
з’єднання клітини здійснюється прямий обмін хімічними речовинами між клітинами.
До них належать нексуси та різні групи синапсів. Нексус - це спеціалізований
клітинний контакт, який відзначається безпосереднім хімічним зв’язком між
цитоплазмами клітин, коли плазмалеми сусідніх клітин зближені до відстані 2-3
нм і пронизані особливими часточками - конексонами, кожна з яких складається з
6 субодиниць із циліндричним каналом по центру [2, 3].
У складі різних щілинних контактів
нараховується від кількох одиниць до декількох тисяч конексонів. Через
конексони утворюються наскрізні канали, які сполучають між собою внутрішні
середовища контактуючих клітин. Нексуси містяться переважно в серцевій м’язовій
тканині й забезпечують тісний метаболічний зв’язок між цитоплазмами
контактуючих кардіоміоцитів (рис. 2).
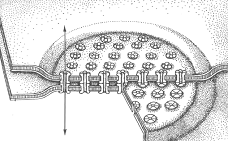
Рис. 2. Загальний вигляд конексонів
серця
Синапси - це спеціалізовані контакти
між нейронами або між нейронами та м’язами, які служать для передачі збудження
або гальмування в один бік від однієї клітини до іншої (рис. 3).
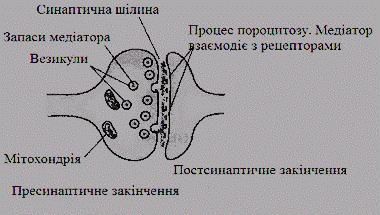
Рис. 3. Загальна схема будови синапсу
Синапси утворюються на термінальних
ділянках відростків нейронів - дендритів та аксонів. Один нейрон за
посередництвом синапсів може з’єднуватися з 10 000 нейронів. Міжнейронні
синапси підрозділяються на електричні та хімічні (рис. 4).
Рис. 4. Електронна фотографія
хімічного синапсу
Мембрани клітин, що утворюють синапс,
розділені міжклітинним простором - синаптичною щілиною шириною 20-30 нм, через
яку передається інформація у вигляді медіаторів. Таким чином, різні типи
міжклітинних контактів пристосовані до особливих функцій певних клітин [2, 3].
2. Основні компоненти контактних взаємодій олігодендроцитів
та нейронів
.1 Загальна характеристика компонентів адгезивної
міжклітинної комунікації олігодендроцитів та нейронів
Дослідженнями закордонних вчених показано, що переважаючим
типом контактів, які виникають між олігодендроцитами та нейронами, є власне
адгезивні контакти. Власне адгезивні контакти (фокальні контакти фібробластів,
зчеплювальні стрічки епітеліальних клітин, бляшки злипання гліальних клітин
тощо) побудовані з трьох основних білкових компонентів: адгезивного білка, який
або знаходиться на поверхні плазматичної мембрани олігодендроцитів чи нейронів
і причленовується до неї за допомогою так званого якоря
(глікозилфосфатидилінозитолу чи гідрофобної амінокислотної прив'язки), або
пронизує мембрану наскрізь один чи декілька разів (в цьому випадку він має
трансмембранний та цитоплазматичний домени); адаптерного білка, що з'єднує
цитоплазматичний домен адгезивного білка з цитоскелетними структурами,
розташованими у цитоплазмі клітини; компонентів цитоскелету, які, приймаючи
сигнал від адгезивного білка через адаптерний протеїн, модулюють
структурно-функціональну активність клітинних субкомпонентів [4, 5].
.2 Адгезивні білкові молекули
На поверхні олігодендроцитів відкриті наступні адгезивні
білки: нейрогліальнa молекулa клітинної адгезії (NgCAM чи L1CAM),
мієлін-асоційований глікопротеїн (МАГ), основний білок мієліну (ОБМ),
мієлін-асоційований олігодендроцитарний основний білок (МООБ) (рис. 5),
протеоліпідний білок (ПЛП або ліпофілін), білок DМ-22 (ізоформа ліпофіліну),
С-ізоформа нейрональної молекули клітинної адгезії (NCAM-C, Мr = 120
kDa) (експресується і на поверхні нейронів), білок Вольфграма (БВ),
N-кадгерин-катенінові комплекси, білки родини нейрофасцинів (NF), білки родин
PAR, TASE, інтегрини α1 і β1 та інші. Одні з них приймають участь
в утворенні як гомофільних контактів типу «олігодендроцит-олігодендроцит»
(білок DМ-22, білок Вольфграма, нейрофасцини, N-кадгерин) так і гетерофільних -
«олігодендроцит-нейрон» (NgCAM, NCAM-C, МАГ, ліпофілін, ОБМ, МООБ),
«олігодендроцит-астроцит» (деякі катенінові комплекси) тощо, інші - контактують
із позаклітинним матриксом (колагеном Q, протеогліканами нервової системи,
фібронектином, еластичними волокнами, синаптичним ламініном (S-ламініном) та
ін.) [6-17].

Рис. 5. Електронна фотографія білкової сітки на поверхні
олігодендроцита, утвореної з молекул-глікопротеїнів МООБ, МАГ, NCAM-C та NgCAM
Дві ізоформи мієлін-асоційованого глікопротеїну (МАГ 1 та МАГ
2) утворюють адгезивні контакти з NG-2-протеогліканом
(хондроїтин-4-сульфат-протеогліканом), зв'язаним з екстрацелюлярною поверхнею
мембрани олігодендроцитів. NG-2-протеоглікан, у свою чергу, має у центральній
частині корового білка два сайти зв'язування хондроїтин-4-сульфату (по 200
амінокислотних залишків кожний), гомологічні за будовою до кальцій-зв'язуючих
доменів кадгеринів, а також колаген-зв'язуючі домени.
МАГ, ОБМ та МООБ приймають у часть у формуванні мієлінової
оболонки аксонів. При цьому здійснюється контакт N-кінцевих позаклітинних
доменів цих білків з нервовим волокном нейрону. У структурі МАГ міститься 10
глікозильованих сайтів (мають олігосахаридні ланцюжки), за допомогою яких
здійснюється нековалентна взаємодія (утворення водневих зв'язків,
електростатичні взаємодії) з глікокаліксом нервового волокна. Основна експресія
МАГ у мишей та щурів спостерігається у перші постнатальні дні [9, 12-24].
Основний білок мієліну (ОБМ) за допомогою електростатичних
взаємодій (містить великий відсоток позитивно заряджених амінокислотних
залишків лізину, аргініну і гістидину) утворює стабільні комплекси зі
сфінголіпідами мієліну, підвищуючи стабільність останнього. Внаслідок цього
формується адгезивний контакт «олігодендроцит-мієлінова оболонка-аксон» [24,
25].
Білки родини нейрофасцинів, зокрема олігодендроцитспецифічний
нейрофасцин р155, забезпечують агрегацію фосфоліпідних рафтів (ділянок) у
єдиний бішаровий комплекс у межах зони компактного мієліну. Нейрофасцин 155
підтримує структуру паранодального сегменту мієлінової оболонки, утворюючи
гетерофільний адгезивний контакт типу «плазматична мембрана
олігоденроциту-поверхня аксолеми нейрона» [26-36].
Глікозильована частина молекули нейрофасцину р155 взаємодіє з
гангліозидом GM1, який виступає зв'язуючою ланкою з міжклітинним
матриксом. Доведено, що при підшкірному, внутрішньом'язовому та
інтраперитонеальному введенні лабораторним щурам препарату гангліозиду GM1
останній відновлює нейрохімічні параметри дофамінергічних нейронів після
порушення системи передачі нервового імпульсу, викликаної гіпоксично-ішемічним
ушкодженням головного мозку [24]. M1 взаємодіє з колагеном 6,
фібронектином, цереброгліканами, N-сіндеканом, нейроканом
(гепаран-сульфат-зв'язуючим протеогліканом) та NG-2-протеогліканом, позитивно
впливає на проліферацію й диференціацію олігодедро- і нейробластів. Нейрокан,
навпаки, пригнічує ці ефекти [26].
Іншими дослідженнями показано, що нейрогліальна та нейрональна
молекули клітинної адгезії впливають на проліферацію нейробластів, забезпечуючи
їх тісний зв'язок з олігоденроглією. При цьому комплементарні глікозидні групи
цих білків взаємодіють одне з одним з утворенням зчеплювальних стрічок. NCAM-C
не має трансмембранного домену, а причленовується нековалентно до плазматичної
мембрани за допомогою глікозилфосфатидилінозитолу. Прикріплення NgCAM до
плазмалеми здійснюється аналогічним чином [1, 36].
Взаємодіючи з ізоформами NCAM-A та NCAM-B, NCAM-C утворює
фокальні контакти типу «нейрон-нейрон», а також підтримує
структурно-функціональну стабільність синапсів. Максимальна концентрація
нейрональних молекул клітинної адгезії спостерігається на пізньому
ембріональному та ранніх етапах постнатального розвитку [1, 5, 28].
Важливе значення у життєдіяльності олігодендроглії та
нейронів посідають адгезивні контакти клітин з екстрацелюлярним матриксом. У
контактах цього типу приймають участь такі білки: інтегрини α1 і β1 (інтегральні білки, що мають
позаклітинний, трансмембранний і цитоплазматичний домени), тензин,
тензин-асоційована адгезивна кіназа Src, талін, вінкулін та α-актинін. Останній передає
сигнал на актинові філаменти клітини [6-10].
Інтегрини α1 і β1 утворюють одне з одним гетеродимерні
комплекси, що взаємодіють з компонентами позаклітинного матриксу. Так, α1-мономер сполучається з колагеновими
волокнами, а β1- чи β2-мономери використовуєються для
адгезії з фібронектином, протеогліканами, ламініном, гепарином тощо. β1-інтегрин, вбудований у клітинну
мембрану олігодендроцитів і астроцитів, взаємодіє з колагеном Q, нейроканом,
протеогліканом NG-2 та іншими позаклітинними структурами. Він є регулятором
кількості гліальних клітин [10, 32].
При активації інтегрини змінюють свою конформацію, при цьому
сигнал передається через цитоплазматичний домен на білки злипання - тензін,
талін і вінкулін. Тензін фосфорилюється під дією кінази Src, активується і
передає сигнал на наступні компоненти каскаду. Сигнал від вінкуліна далі
передається на α-актинін, потім - на актинові філаменти.
Кінцевий результат процесу - реалізація клітинної відповіді на ключові стимули,
що походять з екстрацелюлярного матриксу [6, 7, 18].
.3 Адаптерні білкові компоненти

Рис. 6. Модель третинної структури β-катеніну
Адаптерні білки олігодендроцитів кодуються спеціальними
групами генів, що можуть активуватися/інактивуватися у відповідь на дію
різноманітних білкових факторів росту та інтерлейкінів. Так, гени групи Wnt, що
кодують синтез β-катеніну та інших адгезивних молекул,
активуються під дією фактору росту нейронів (ФРН), інсуліноподібних факторів
росту-1 та 2 (ІФР-1 і ІФР-2), протизапальних цитокінів (ІL-4, IL-10) тощо. Ці
гени задіяні у процесах диференціювання стовбурових клітин та відповідають за
регенераційні процеси в організмі (регенераційна активність цих генів в
організмі ссавців дуже низька) [10, 20].
Експресія генів Wnt у олігодендроцитах недостатньо інтенсивна
у порівнянні з подібною експресією у клітинах ендотелію судин мозку, однак
синтезовані білкові продукти є достатньо хімічно стабільними [8, 21].
.4 Компоненти цитоскелету нейронів та олігодендроцитів
Цитоскелет нейронів та олігодендроцитів добре розвинений і
представлений такими елементами як мікротрубочки (нейротубули - полімери білків
α-
і β-тубулінів з молекулярними
масами 53 та 57 кДа відповідно) діаметром 20-30 нм, мікрофіламенти (комплекси
олігомерів F-актину) і проміжні філаменти (нейрофіламенти) товщиною 6-8 нм.
Мікротрубочки (мікротубули) побудовані з протофіламентів, які мають вигляд
волоконець з потовщеннями. Вони мають відношення до переміщення мітохондрій,
лізосом і вакуолей у клітині [27, 31].
Мікрофіламенти - білкові нитки
діаметром 5-7 нм, розміщені в цитоплазмі поодиноко у вигляді сітки або
впорядкованими пучками. Основним білком мікрофіламентів є актин, який може
виступати в мономерній формі (глобулярний актин) або полімеризуватися в довгі
ланцюги (фібрилярний актин). По периферії цитоплазми мікрофіламенти формують
згущену зону - кортикальну сітку, яку відносять до субмембранної
опорно-скоротливої системи плазматичної мембрани нейронів [20, 34].
Прикріплення мікрофіламентів до
плазматичної мембрани здійснюється завдяки їх зв’язку з мембранними
інтегральними білками (інтегринами, або якірними білками). У випадку
олігодендроцитів актинові філаменти приєднуються до інтегріну β1 та β-катеніну. Кортикальна сітка
перешкоджає різкій деформації клітини і забезпечує плавну зміну її форми
завдяки актинрозчинним ферментам [7, 9, 32].
Проміжні філаменти названі так тому, що їх товщина середня
між товщиною мікрофіламентів і мікротубул (приблизно 10 нм). Вони утворені
білковими нитками, сплетеними подібно до каната, трапляються в різних типах
клітин і розміщуються у вигляді тривимірних сіток в різних ділянках цитоплазми-
навколо ядра, по периферії цитоплазми, уздовж відростків нейронів та клітин
олігодендроглії [17, 24, 26].
До складу проміжних філаментів аксонів (нейрофіламентів IV
типу) у нейронів входять комплекси нейроспецифічних білкових одиниць з
молекулярними масами 210 (NF H), 160 (NF M) та 70 кДа (NF L) відповідно.
Навколо білкової трубки, утвореної останньою субодиницею, відбувається
агломерація перших двох субодиниць. Утворений таким способом опорно-скоротливий
апарат нейрофіламентів відіграє важливу роль у підтримуванні форми клітин та їх
відростків [9, 22, 37].
При імпрегнації солями срібла структури цитоскелету нейронів
мають вигляд тонких розгалужених ниток і отримали назву нейрофібрил. В
перикаріоні цитоскелет формує щільну сітку (рис. 7), а у відростках -
розміщується поздовжньо. Присутня у всіх нейронах центросома (димер центріолей
клітинного центру) забезпечує координовані процеси збирання та розбирання
мікротрубочок [5, 11].
Рис. 7. Щільна сітка нейрофібрил нейронів (показана зеленим
кольором). Синім кольором позначені ядра клітин, а червоним - зону тигроїду
До складу компонентів цитоскелету (філаменти V типу)
перікаріону входять три білки - ламініни А, В і С (молекулярні маси 60-70 кДа),
за структурою подібні до синаптичного ламініну (S-ламініну), проте є
низькомолекулярними. Вони утворюють так звану ядерну ламіну (сітку ядерних
нейрофібрил), а також забезпечують полімеризацію білків ядерних порових
комплексів (ЯПК). Ядерна ламіна взаємодіє з трансмембранними білками та
периферичним хроматином ядра. Вона є динамічною структурою. Під час мітотичного
поділу, коли оболонка ядра розпадається, білки ламіни фосфорилюються і
переходять у деполімеризовану форму. У ранній телофазі ці поліпептиди
дефосфорилюються і знову утворюють довгі фібрили, після чого беруть участь в
організації нової ядерної оболонки [5].
Проміжні філаменти цитоскелету олігодендроцитів, на відміну
від нейронів, мають свої особливості. До їх складу входить особливий білок -
гліальний фібрилярний протеїн (ГФП), дещо подібний за амінокислотним складом та
молекулярною масою до гліального фібрилярного кислого білка плазмових
астроцитів, однак відрізняється дещо меншою кількістю глутамінової та
аспарагінової амінокислот. Полімерна форма ГФП утворює складну поздовжню сітку
у цитоплазмі олігодендроцитів, що пронизуючи відростки останніх (рис. 8).
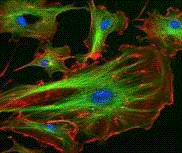
Рис. 8. Асоціація проміжних філаментів олігодендроцитів з
мікротрубочками (позначено зеленим кольором). Актинові філаменти забарвлені у
червоний колір
До складу проміжних філаментів олігодендроцитів входять також
віментинові філаменти та деякі специфічні компоненти, як наприклад фактор
диференціації Olig-2. Віментинові філаменти - негативний регулятор процесів
утворення мієлінової оболонки олігодендроцитами (у ЦНС) чи шванівськими
клітинами (у ПНС). Olig-2, білки родини TASE та біологічно активні пептиди з
груп нейрогенінів та нейрегулінів, навпаки, здійснюють позитивний вплив на
мієліноутворюючу функцію клітин [5, 22, 35].
.5 Щілинні контакти олігодендроцитів та нейронів
Щілинні контакти були вперше виявлені
у збудливих тканинах, таких як м'язова та нервова, де формуютьелектричні
синапси, згодом було з'ясовано, що вони існують і в епітеліальній та сполучній
тканинах багатоклітинних тварин. За біологічним значенням вони аналогічні до
плазодесм рослин, проте останні можуть пропускати макромолекули, такі як білки
та РНК [5, 18].
Щілині контакти між нейронами та
олігодендроцитами потрібні для транспортування поживних речовин з
олігодендроциту до нейрона. Вони мають форму круглих зон діаметром 0,5-5 мкм, у
яких зосереджено від кількох до кількох тисяч міжклітинних каналів, побудованих
з білків конексинів [1, 5].
Конексини - це білки із молекулярною
масою 25-50 кДа, що перетинають мембрану чотири рази. Шість таких молекул
формують гексагональний циліндр - напівканал або конексон, який має діаметр
приблизно 7-8 нм і просвіт шириною в 1,5 нм. Два конексони у мембранах сусідніх
клітин з'єднуються між собою кінець в кінець формуюючи повний канал. Щілинний
контакт складається із великої кількості таких каналів. Оскільки конексони
утримують мембрани на певній відстані одна від одної між ними зберігається
щілина сталої ширини (2-4 нм) [1].
Щілинні контакти нейронів і гліоцитів
відрізняються властивостями через те, що вони побудовані із різних комбінацій
конексинів. Більшість клітин експресують більше одного гену конексинів,
продукти яких можуть сполучатись між собою, утворюючи гомодимерні, тобто ті, що
складаються із однакових субодиниць, або гетеромерні конексони, проте дозволена
тільки обмежена кількість комбінацій. Крім того конексон може контактувати на
сусідній клітині із ідентичним або відмінним за білковим складом напівканалом
[2, 5, 22, 30].
Специфічним конексином для
олігодендроцитів та мієлінової оболонки є конексин 32 (Cx 32) (рис. 9). У
нейронах відкрито інший конексин - Сх 43, який пізніше було ідентифіковано на
поверхні астроцитів та багатьох інших клітин організму [1, 5].

Рис. 9. Просторова структура
конексину С 32
Щілинні контакти є достатньо
динамічними структурами і можуть швидко утворюватись, руйнуватись та
змінюватись. Дослідження із флуоресцентно міченими конексинами показали, що
нові конексони постійно додаються на периферії щілинного контакту, а старі
забираються із середини та руйнуються. Час півжиття одного конексона становить
кілька годин. Нові конексони додаються шляхом злиття мембранних везикул із
плазмалемою, після чого вони мігрують в її площині поки не досягнуть периферії
нексуса і не сполучаться із конексонами на сусідній клітині. Таким чином у плазматичні
мембрані постійно існує невелика кількість неспарених конексонів, які за
нормальних умов підтримуються у закритій конформації.
Проникність конексонів може
регулюватись. У нейронах вони часто є потенціал-керованими. Канали щільних
контактів швидко закриваються під впливом збільшення цитозольного pH. До схожих
наслідків призводить із підвищення концентрації кальцію, це пояснюється тим, що
за нормальних умов в цитоплазмі клітини підтримується низький рівень цього
іону. При ушкодженні клітини її мембрана може «протікати», внаслідок чого
всередину проникають катіони Na+ та Ca2+, а назовні -
цінні метаболіти. Якщо б клітина за таких умов залишалась з'єднаною із
сусідніми, то вони б також зазнали негативних змін [1, 5, 28].
.6 Інші типи контактів
Поряд з вищеперерахованими
адгезивними, щілинними контактами олігодендроглії та нейронів виділяють так
звані мінорні контакти цих клітин. До них відносять щільні замикаючі контакти
та олігодендрогліально-нейрональні «синапси» [9, 23, 27].
Як було зазначено вище, щільні
замикаючі контакти характерні для епітелію шлунково-кишкового тракту та
залозистого епітелію. Однак контакти подібного типу виявлені також у ендотелії
гемато-енцефалічного бар'єру та на поверхні деяких клітин нейроглії [1, 2, 26].
В утворенні щільних контактів
ендотеліоцитів, гліоцитів і епітеліоцитів гемато-енцефалічного бар'єру
приймають участь спеціальні інтегральні білки, що утворюють так звану «зону
злипання» між плазматичними мембранами двох контактуючих клітин (zonula
occludens). До таких білків відносять протеїни ZO-1, ZO-2, клаудин-5, окклюдин,
нетрін-1. ZO-1, ZO-2 та окклюдин відповідають за формування базової структури
самого контакту. Окклюдин підтримує також стабільність зони злипання. Клаудин-5
визначає клітинну специфічність гемато-енцефалічного бар'єру, в той час як
нетрін-1 контролює клітинну бласттрансформацію та диференціацію [13].
На поверхні плазмалеми астроцитів і
олігодендроцитів мозку миші також виявлені подібні білкові структури, які
відповідають за формування щільних замикаючих контактів типу
«астроцит-астроцит», «астроцит-епітеліоцит», астроцит-ендотеліоцит»,
«астроцит-олігодендроцит» та «олігодендроцит- олігодендроцит» [22, 28].
Між олігодендроцитами і нейронами
замикаючих контактів не виявлено. Проте між деякими типами нейронів (гранулярні
нейрони мозочка, клітини Пуркін'є і мюллерівські клітини, пірамідальні нейрони
СА3-зони гіпокампу) іноді зустрічаються щільні контакти типу «сома першого
нейрона-сома другого нейрона». Однак це лише окремий виняток з правил.
Окремі дослідження свідчать, що між
олігодендроцитами і нейронами виявлено специфічні структури, які за будовою
дещо нагадують класичний нейрональний синапс хімічного типу. Проте більшість
науковців впевнені, що це «утворення» є лише окремим випадком чи адгезивних
контактів, чи взаємодій типу «ліганд-рецептор» [5].
На поверхні плазмалеми нейронів є
специфічні рецептори, які взаємодіють з біологічно активними речовинами
олігодендроцитів. Ця взаємодія найчастіше носить специфічний характер.
Наприклад, олігодендроцити виділяють спеціальні нейротрофічні фактори, які
впливають на живлення і розвиток нейронів. Для кожного трофічного фактору існує
свій рецепторний комплекс [5, 37].
Олігодендроцити синтезують також
деякі загальні для багатьох клітин ростові фактори (фактор росту нейронів),
інтерлейкіни, фактор некрозу пухлин (ФНП-α і β),
фактор
трансформації росту-β (ФТР-β)
тощо. Ці сполуки
взаємодіють з відповідними рецепторами нейронів [37]. Наприклад, ФТР-β
взаємодіє зі
специфічним трансмембранним високомолекулярним рецептором ФТР-β-Р, який за структурою є
протеогліканом. Самі нейрони теж здатні до синтезу вищеперерахованих сполук,
які можуть модулювати функції олігодендроглії [5].
Нині проводяться нові дослідження,
пов'язані з вивченням ліганд-опосередкованих взаємодій нервової тканини та
нейроглії.
3. Зміни
олігодендрогліально-нейронних взаємодій при новоутвореннях головного мозку
.1 Загальна характеристика неоплазій,
що виникають у головному мозку ссавців
Існують доброякісні та злоякісні
пухлини як різних частин тіла, так і головного мозку. Навіть доброякісні
пухлини мозку являють собою величезну небезпеку. Проростаючи і руйнуючи
тканини, пухлина викликає здавлювання мозку, черепних нервів і кровоносних
судин, що живлять мозок, серйозно пошкоджує структури головного мозку, сприяє
його набряку та підвищення внутрішньочерепного тиску. За умов відсутності
кореційного впливу людина чи тварина помирає [38].
Первинними пухлинами мозку
називаються пухлини, що розвиваються з речовини головного мозку, його корінців,
оболонок, мозкової або нервової тканини, клітин гіпофіза (гліоми, менінгіоми,
невриноми і аденоми). Пухлина гіпофіза супроводжується порушеннями менструацій,
вироблення гормонів надниркових залоз, щитовидної залози [38, 39].
Вторинні пухлини утворюються з кісток
черепа або походять з пухлин внутрішніх органів. Найчастіше в мозок метастазує
рак легенів, іноді - рак шлунка, кишечника, грудей і нирок. Менінгіома
головного мозку - найбільш поширена доброякісна пухлина мозку. Вона виникає з
оболонок мозку, характеризується дуже повільним ростом. Зазвичай ця пухлина
спостерігається у літніх людей, у жінок в два рази частіше, ніж у чоловіків.
Злоякісні пухлини, наприклад, медулобластома, ростуть набагато швидше. Крім
того, вони руйнують і прилеглі тканини. У дорослих особин пухлини розвиваються
в півкулях і корі головного мозку, у дітей - в задній черепній ямці [40].
Існує кілька видів первинних пухлин
головного мозку. Серед дорослих найпоширенішими (близько 50%) є астроцитоми,
звані також гліомами, які характеризуються високою інтенсивністю переродження з
доброякісної форми у злоякісну. Вони розрізняються за ступенем вираженості
проявів і звичайно підрозділяються на астроцитоми низького ступеня, що росте
повільно; анапластичні астроцитоми (астроцитоми проміжного ступеня) та
астроцитоми високого ступеня, або гліобластоми (багатоформні пухлини, що
проліферують та метастазують досить швидко) [41].
Наступним за поширеністю різновидом
пухлин головного мозку є менінгіоми, які вражають мозкові оболонки. Ці пухлини
майже завжди доброякісні (тобто рідко виявляють ознаки злоякісних змін). Проте
доброякісні пухлини можуть стати причиною серйозних проблем, оскільки,
збільшуючись в розмірі, чинять тиск на життєво важливі структури головного
мозку. До інших пухлин дорослих, які також майже завжди носять доброякісний
характер, відносяться гіпофізарні аденоми (вражають гіпофіз) та неврилемома
(які вражають периневричні скупчення нервових клітин мозку) [38].
Причини утворення первинних пухлин
головного мозку є недостатньо вивченими. Існують дані, що свідчать про можливе
існування для деяких з них генетичного етіологічного фактору. Інші потенційні
онкогенні чинники включають вплив деяких хімічних речовин, супресію імунної
системи тощо. Причиною вторинних пухлин головного мозку, очевидно, завжди є
первинні пухлини, що розвиваються в іншій частині організму, поза межами
головного мозку [39].
.2 Сучасна класифікація пухлин
головного мозку
Виділяють наступні положення сучасної
класифікації новоутворень головного мозку за клітинним складом їх основних
комонентів:
А) нейроепітеліальні пухлини -
епендимома, гліома (різновиди останньої - астроцитома та олігодендрогліома) -
розвиваються безпосередньо з тканини мозку (рис. 10);
Б) пухлини мозкових оболонок -
менінгіоми - розвиваються з тканин мозкових оболонок;
В) гіпофізарні новоутворення -
аденоми гіпофізу - формуються з клітин залозистого епітелію цієї залози;
Г) новоутворення черепномозкових
нервів - невриноми - спочатку виникають у структурі окремих нервових волокон,
що складають даний черепнор-мозковий нерв, а потім поширюються на інші його
частини. Можуть метастазувати у різні відділи головного мозку або у відповідні
іннервовані органи;
Д) метастази з позамозкових структур
організму - потрапляють у мозок з інших органів або тканин шляхом метастазування;
Е) дисембріогенетичні новоутворення -
виникають у процесі ембріогенезу. Не є широко розповсюдженою формою неоплазій,
однак характеризуються високою мортальністю ембріонів [38, 39].
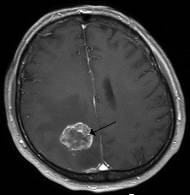
Рис. 10. Злоякісна гліома у головному
мозку людини (позначена стрілкою)
.3 Патологія міжклітинних контактів
гліоцитів і нейронів при дисембріогенетичних новоутвореннях
Досліди з вивчення диембріогенетичних
новоутворень були здійснені на ембріонах щурів лінії Wistar. Вагітних самиць
опромінювали малими дозами рентгенівського випромінювання у чітко визначені
терміни протягом чотирьох днів. Після закінчення експозиції частину тварин
декапітували одразу, інших - через певні проміжки часу після опромінення [40].
Були детально вивчені зміни
міжклітинних контактів у межах пухлин головного мозку ембріонів на різних
стадіях ембріогенезу. По-перше, стовбурові клітини 5-6-денних ембріонів, які
повинні були б диференціюватися у гліальні клітини або нейрональні клітини,
втрачають адгезивні контакти. При цьому повністю блокується експресія
нейрональних молекул клітинної адгезії, які утворюють гомо- та гетерофільні
контакти між клітинами. Відбувається протеолітична деградація основних
компонентів міжклітинного матриксу, що врешті-решт, призводить до загибелі
зародків. По-друге, на 7-8-денних ембріонів ембріонального розвитку
спостерігається блокада диференціації стовбурових клітин у нейрони з наступним
переродженням їх у ракові. Репресуються гени, відповідальні за синтез молекул
N-кадгерин-катенінового комплексу, що унеможливлює виникнення адгезивного
контакту між нормальною та раковою клітинами. Для 10-11-денних ембріонів була
описана репресія генів нейронального анкірину (анкірину В), анкіринів G,
серцевинних білків нейрокану і бревікану [41].
Аналіз головного мозку 16-17-денних
ембріонів виявив основні осередки розвитку астрогліом та олігодендрогліом і
шляхи їх метастазування. Найбільша кількість осередків астрогліом була виявлена
у межах великих півкуль, довгастого та середнього мозку. Олігодендрогліоми
лоалізувалися у межах лобної долі півкуль, гіпокампу, проміжного мозку,
гіпоталамусу, таламусу та мозочка. У таких трансформованих клітин не
ідентифікувалися адгезивні молекули NgCAM, NCAM-B i C. Дефектні олігодендроцити
не експресували МАГ, МООБ. Порушувалася експресія генів, які відповідають за
початок процесів мієлінізації аксонів. Це призводило до затримки подальшого
розвитку щурячих ембріонів з їх наступною елімінацією [39].
У пухлинних клітин порушувалася
структура щілинних контактів. Так, в дефектних олігодендроцитів снтезувалися
дефектні ізоформи мієлін-специфічного конексину Сх 32. При цьому у
нейробласт-дедиференційованих ракових клітин відбувалася оверекспресія
специфічних ракових антигенів глікопротеїнової природи, не здатних до утворення
нормальних адгезивних чи щілинних контактів. Блокувалася експресія конексину Сх
43 та відбувалася дезагрегація інтегринових комплексів і компонентів
цитоскелету. Процеси синаптичної передачі між нейронами гальмувалися [41].
.4 Порушення структури міжклітинних
контактів олігодендроцитів та нейронів у дорослому організмі за умов
олігодендрогліоми
Відомо, що олігодендрогліома є одним
з новоутворень, які відносяться до групи гліом - неоплазій, що виникають при
переродженні зрілих гліальних клітин або їх попередників (прекурсорів). За умов
олігодендрогліоми відбувається переродження олігодендроцитів з наступною їх
трансформацією у ракові пухлини. На відміну від інших пухлин мозку
олігодендрогліома практично завжди носить злоякісний характер і характеризується
високою летальністю, проте має відносно повільний перебіг метастазування [41].
Моделі олігодендрогліоми були добре
досліджені на дорослих щурах та конгенних лініях мишей. Описані випадки цього
захворювання і у людини.
У людей олігодендрогліоми найчастіше
виникають з клітин-попередниць олігодендроцитів та розвиваються, як правило, у
віці після 40-50 років. Локалізуються найчастіше у лобній долі великих півкуль
мозку, вздовж стінок шлуночків мозку та проростають у кору (рис. 11) [42].
Клітини олігодендрогліоми є
дедиференційованими, тобто втрачають свою клітинну спеціалізацію при
малігнізації. Порушується їх мітотичний контроль внаслідок руйнування молекул
циклінів (особливо цикліну В) та циклін-залежних протеїнкіназ, оскільки останні
контролюють процеси клітинного поділу. Як наслідок - підвищення мітотичного
індексу (МІ) трансформованих олігодендроцитів у 20 разів при порівнянні з
нормальними клітинами [40].
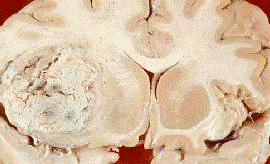
Рис.11. Олігодендрогліома,
локалізована у лобній долі мозку (позначена стрілкою)
У малігнізованих олігодендроцитів
(МО-клітин) повністю редуковані або вкорочені клітинні відростки, які не
приймають участі у висококординованих взаємодіях з нейронами та іншими
спеціалізованими клітинами мозку (рис. 12).
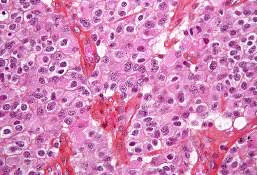
МО-клітини відзначаються необоротним
порушенням або повною втратою всіх міжклітинних контактів. В першу чергу,
редукуються адгезивні контакти типу «олігодендроцит-олігодендроцит», потім -
«олігодендроцит-нейрон», «олігодендроцит-астроцит», далі порушуються їх зв'язки
з кровоносними судинами та іншими структурами мозку [42].
Характерною особливістю МО-клітин є
руйнування мієлін-асоційованих контактів з аксонами нейронів. Натомість
активується експресія специфічних ракових антигенів, які витісняють молекули
МАГ, ОБМ з поверхні плазматичної мембрани. Ці антигени не здатні утворювати
зв'язки з ліпідними рафтами мієлінової оболонки. Паралельно у МО-клітин
активується експресія протеїназ, що гідролізують ОБМ, МАГ, МООБ, нейрофасцин
р155 спочатку до невеликих неактивних олігопептидів, а потім - до окремих
амінокислотних залишків. Глікозидази «зрізають» олігосахаридні ланцюжки МАГ, МООБ,
NgCAM та ін., внаслідок чого останні позбавляються своєї функціональної
активності. Молекула ОБМ стає доступною для протеолітичної дії кальпаїнів. У
МО-клітинах активуються ферменти hedgehog-сигнального шляху, які є позитивними
модуляторами процесів демієлінізації [25, 41].
Руйнуються також адаптерні білки, які
забезпечують функціонування адгезивних контактів. Наприклад, кількість білків
родини TASE, нейрофасцинів, β- і γ-катенінів у МО-клітин
зменшується у 10 разів у порівнянні з нормальними клітинами. Зникають
кальцій-залежні N-кадгеринові містки між нейронами внаслідок здавлювання
пухлиною нервової тканини в ураженій ділянці [40].
За умов олігоденрогліоми відбувається
демієлінізація аксонів в ураженій ділянці мозку. Процеси ремієлінізації у цій
ділянці зводяться до мінімуму. При цьому знижується кількість сфінгомієліну,
глактоцереброзидів, сфінгозинфосфорилхоліну та інших фосфосфінголіпідів
мієліну. Порушується також експресія нейрональних ізоформ анкірину (рис. 13),
локалізованих у ділянках перехватів Ранв'є. Це відбувається внаслідок
проростання пухлини у зону білої речовини мозку з наступним здавлюванням
аксонів [42].
У малігнізованих олігодендроцитів
відмічена редукція компонентів основної системи цитоскелету, що свідчить про
втрату здатності до підтримки постійної форми. Під дією лізосомальних протеїназ
деградують компоненти гліального фібрилярного білка, віментинові, актинові,
тубулінові філаменти. Натомість у деяких клітин може відмічатися здатність до
амебоїдного руху внаслідок експресії мінорних компонентів цитоскелету, які в
нормальних олігодендроцитах зазвичай не утворюються [39].
Рис. 13. Структура молекули
нейронального анкірину, експресія якого порушується при здавлюванні перехватів
Ранв'є олігодендрогліомою
При олігодендроглії немає адгезивного
зв'язку між МО-клітинами та екстрацелюлярним матриксом. Внаслідок дисоціації
інтегринових комплексів білки тензин, талін і вінкулін переходять в неактивну
форму з наступним розпадом на окремі субодиниці. Src-протеїнкіназа
розщеплюється під дією нелізосомальних цистеїнових протеїназ - кальпаїнів (рис.
14) та інших протеолітичних ферментів. При цьому спостерігається зникнення
асоціації МО-клітин з вуглеводними компонентами NG-2-протеоглікану, серцевинний
білок якого також може деградувати під дією протеолітичних ферментів,
продукованих трансформованими клітинами. Активність кальпастатину в МО-клітинах
знижена [42].

Рис. 14. Тривимірна модель кальпаїну
II
У процесі подальшої трансформації
пухлини спостерігається зникнення асоціації МО-клітин з вуглеводними
компонентами NG-2-протеоглікану, серцевинний білок якого також може деградувати
під дією протеолітичних ферментів, продукованих трансформованими клітинами
[40].
Основою лікування олігодендрогліоми є
хірургічне втручання. При операції пухлина може бути повністю вилучена з
ураженої ділянки мозку. Однак все залежить від своєчасного скринінгу та
правильної постановки діагнозу. В післяопераційний період проводиться хіміотерапія
і променева терапія. Середній період без рецидивів для олігодендрогліоми при
повному комплексному лікуванні становить приблизно 5 років, а показник
10-річного виживання пацієнтів складає приблизно [40].
Відновлення нормальних міжклітинних
контактів нейронів і олігодендроглії є можливим лише за умови повної елімінації
трансформованих клітин з мозку.
міжклітинний
олігодендроцит нейрон неоплазія
Висновки
На основі усього вищезазначеного
матеріалу можна підсумувати, що міжклітинні взаємодії посідають провідне
значення у забезпеченні нормального функціонування кожної клітини, кожної
тканини, кожного органу і усього організму в цілому.
Серед основних контактів
олігодендрогліальних клітин та нейронів основне місце відводиться адгезивним і
щілинним контактам. До складу власне адгезивних контактів входить достатньо
велика група адгезивних і адаптерних білків, а також компонентів цитоскелету.
Важливе місце займають контакти олігодендроцитів і нейронів з міжклітинним
матриксом. Щілинні контакти (нексуси) призначені для транспорту молекул з
однієї клітини в іншу. До їх складу входить специфічний для мієліноутворюючої
тканини конексин 32. На нейронах експресується і конексин 43, який
розповсюджений у багатьох типах тканин. На поверхні олігодендроцитів,
астроцитів відкриті й щільні контакти, які є мало розповсюдженими у власне
нервовій чи гліальній тканині, однак вони у великій кількості поширені у
гемато-енцефалічному бар'єрі, епітеліальній тканині та ендотелії судин.
Олігодендроцити взаємодіють з
нейронами також за допомогою спеціальних олігодендрогліально-нейрональних
«синапсів», які насправді є одним з різновидів рецепторно-опосередкованої
взаємодії.
Структура міжклітинних контактів може
порушуватися за умов різних патологій нервової системи, однією з яких є олігодендрогліома
- новоутворення, яке складається з дедиференційованих попередників
олігодендроцитів. За умов цієї хвороби втрачаються всі олігодендро-нейронні
контакти, що унеможливлює міжклітинну взаємодію. Внаслідок цього малігнізовані
олігодендроцити (МО) не здатні до побудови складних зв'язків з іншими клітинами
мозку.
Повноцінне відновлення порушених
міжклітинних контактів можливе лише за умови своєчасної корекції та повної
ліквідації хвороби.
Список використаних джерел
1. Cho W. Membrane-protein interactions in cell
signaling and membrane trafficking. / W. Cho, R.V. Stahelin // Annual Review of
Biophysics and Biomolecular Structure. - 2005. - 34. - Р. 119-151.
2. Ченцов Ю.С. Общая цитология [Текст], 3-е изд.
М., 1995.
. Mapping the human membrane proteome: a
majority of the human membrane proteins can be classified according to function
and evolutionary origin / M.S. Almén, K.J. Nordström,
R. Fredriksson
[et al.] // BMC Biol. - 2009. - 7: 50.
. Hulpiau P. Molecular evolution of the
cadherin superfamily / P. Hulpiau, van F. Roy // Int. J. Biochem. Cell Biol. -
2009. - 41(2). - Р. 349-69.
. Offermanns Stefan. Encyclopedia of Molecular
Pharmacology / Stefan Offermanns; Walter Rosenthal // Springer. - 2010. - pp.
306.
. Takada Y. The integrins / Y. Takada, X. Ye,
S. Simon // Genome Biol. - 2009. - 8 (5). - Р. 215.
. Dissecting the molecular architecture of
integrin adhesion sites by cryo-electron tomography / I. Patla, T. Volberg, N.
Elad [et al.] // Nat. Cell Biol. - 2010. - 12 (9). - Р. 909-15.
. Abel Lajtha. Handbook of neurochemistry and
molecular neurobiology: Neural protein metabolism and function / Lajtha Abel;
L. Banik Naren; Banik Naren. - 2010. - pp. 41.
. Multi-scale modelling of cancer cell
intravasation: the role of cadherins in metastasis / I. Ramis-Conde, M. A.
Chaplain, A. R. Anderson [et al.] // Phys Biol. - 2009. - 6 (1). - Р. 16008.
. McCall-Culbreath K.D. Collagen receptor
integrins: rising to the challenge / K.D. McCall-Culbreath, M.M. Zutter // Curr
Drug Targets. - 2008. - 9 (2). - Р. 139-49.
. N-cadherin-catenin complexes form prior to
cleavage of the proregion and transport to the plasma membrane / K. Wahl,
James; J. Kim Young, M. Cullen Janet [et al.] // J. Biol. Chem. (United
States). - 2009. - 278 (19). - Р. 17269-17276.
12. Phosphoproteomic
analysis of the developing mouse brain / B.A. Ballif, J. Villén, S.A.
Beausoleil [et al.]
// Mol. Cell Proteomics. - 2005. - 3 (11). - Р. 1093-1101.
. Netrin-1-alpha3beta1 integrin interactions
regulate the migration of interneurons through the cortical marginal zone / A.
Stanco, C. Szekeres, N. Patel [et al.] // Proc. Natl. Acad. Sci. U.S.A. - 2009.
- 106 (18). - Р. 7595-600.
. Integrin beta cytoplasmic domain interactions
with phosphotyrosine-binding domains: a structural prototype for diversity in
integrin signaling / D.A. Calderwood, Y. Fujioka, J.M. de Pereda [et al.] //
Proc. Natl. Acad. Sci. U.S.A. - 2003. - 100 (5). - Р. 2272-2277.
. The junctional adhesion molecule (JAM) family
members JAM-2 and JAM-3 associate with the cell polarity protein PAR-3: a
possible role for JAMs in endothelial cell polarity / K Ebnet, M Aurrand-Lions,
A Kuhn [et al.] // J. Cell. Sci. - 2004. - 116 (Pt 19). - Р. 3879-3891.
. Expression of the neural stem cell markers
NG2 and L1 in human angiomyolipoma: are angiomyolipomas neoplasms of stem
cells? / S.D. Lim, W. Stallcup, B. Lefkove [et al.] // Mol. Med. - 2007. - 13
(3-4). - Р. 160-165.
. Brain maturation of the adolescent rat cortex
and striatum: changes in volume and myelination / L. Mengler, A. Khmelinskii,
M. Diedenhofen [et al] // Neuroimage. - 2014. - Vol. 84. - № 20. - Р. 35-44.
18. Molecular evolution of myelin basic protein, an
abundant structural myelin component / S. Nawaz, J. Schweitzer, O. Jahn [et al] // Glia. - 2013.
- Vol. 61. - № 8. - Р. 1364-77.
19. Hafidi A. Macroglia distribution in the developing and adult inferior
colliculus / A. Hafidi, D. Galifianakis // Brain Res Dev Brain Res. - 2003. -
Vol. 143. - № 2. - Р. 167-77.
20. Lipidome and proteome map of
myelin membranes / G. Gopalakrishnan, A. Awasthi, W. Belkaid [et al] // J
Neurosci Res. - 2013. - Vol. 91. - № 3. - Р. 321-34.
21. Butt A.M. Oligodendrocytes and the control of myelination in vivo:
new insights from the rat anterior medullary velum / A.M. Butt, M. Berry // J
Neurosci Res. - 2000. - Vol. 59. - № 4. - Р. 477-88.
22. Harauz G. Myelin Management by
the 18.5-kDa and 21.5-kDa Classic Myelin Basic Protein Isoforms / G. Harauz, J.
M. Boggs // J. Neurochem. - 2013. - Vol. 125. - № 3. - Р. 334-61.
23. Myelin basic protein cleaves cell adhesion
molecule L1 and promotes neuritogenesis and cell survival / D. Lutz, G. Loers,
R. Kleene [et al.] // J Biol Chem. - 2014. - Vol. 289. - № 12. - Р.
13503-13518.
24. Identification of the Low Density
Lipoprotein (LDL) Receptor-related Protein-1 Interactome in Central Nervous
System Myelin Suggests a Role in the Clearance of Necrotic Cell Debris / А.
Fernandez-Castaneda, S. Arandjelovic, T. L. Stiles [et al.] // J. Biol. Chem. -
2013. - Vol. 288. - № 7. - Р. 4538-48.
25. Sonic Hedgehog Signaling Is a
Positive Oligodendrocyte Regulator during Demyelination / J. Ferent, C. Zimmer,
P. Durbec [et al.] // J. Neurosci. - 2013. - Vol. 33. - № 5. - Р. 1759-72.
26. Myelin basic protein profile of central nervous
system in experimentally induced demyelination and remyelination [Deneysel
demiyelinasyon ve remiyelinasyonda merkezi sinir sistemini n miyelin temel
protein profili] / G. F. Yarim, M. Yarm, G. Çiftci
[et al.] //
Turkish Journal of Biochemistry. - 2013. - Vol. 38. - № 4. - P. 451-456.
27. Myelin basic protein binds microtubules to a
membrane surface and to actin filaments in vitro: effect of phosphorylation and
deimination / J.M. Boggs, G. Rangaraj, Y.M. Heng [et al.] // Biochim Biophys
Acta. - 2011. - Vol. 1808. - № 3. - Р. 761-73.
28. Sox9 and Sox10 influence survival and migration
of oligodendrocyte precursors in the spinal cord by regulating PDGF receptor
alpha expression / M. Finzsch, C.C. Stolt, P. Lommes [et al.] // Development. -
2008. - Vol. 135. - № 4. - Р. 637-646.
29. Regulation of cell proliferation by nucleocytoplasmic dynamics of
postnatal and embryonic exon-II-containing MBP isoforms / H. Ozgen, N. Kahya,
J. C. de Jonge [et al.] // Biochimica et Biophysica Acta - Molecular Cell
Research. - 2014. - Vol. 1843. - № 3. - P. 517-530.
30. Atypical protein kinase C and
par3 are required for proteoglycan-induced axon growth inhibition / S.I. Lee,
W. Zhang, M. Ravi [et al.] // J Neurosci. - 2013. - Vol. 33. - № 6. - Р.
2541-54.
31. Hafidi A. Differential
expression of MAG, MBP and L1 in the developing lateral superior olive / A.
Hafidi, J.A. Katz, D.H. Sanes // Brain Res. - 1996. - Vol. 736. - № 1-2. - Р.
35-43.
32. Hippocampal expression analyses reveal selective
association of immediate-early, neuroenergetic, and myelinogenic pathways with
cognitive impairment in aged rats / W.B. Rowe, E.M. Blalock, K.C. Chen [et al.]
// J. Neurosci. - 2007. - Vol. 27. - № 12. - Р. 3098-3110.
33. GDNF, NGF and BDNF as therapeutic
options for neurodegeneration / S.J. Allen, J.J. Watson, D.K. Shoemark [et al.]
// Pharmacology and Therapeutics. - 2013. - Vol. 138. - № 2. - Р. 155-175.
34. Demyelination initiated by oligodendrocyte
apoptosis through enhancing endoplasmic reticulum-mitochondria interactions and
Id2 expression after compressed spinal cord injury in rats / S.-Q. Huang,
C.-L.Tang, S.-Q. Sun [et al.] // CNS Neuroscience and Therapeutics. - 2014. -
Vol. 20. - № 1. - Р. 20-31.
35. Interactions of Sox10 and Egr2 in Myelin Gene
Regulation / Erin A. Jones, Sung-Wook Jang, Gennifer M. Mager [et al.] //
Neuron Glia Biol. - 2007. - Vol. 3. - № 4. - Р. 377-387.
36. The roles of cell adhesion molecules on the formation of peripheral
myelin / Y. Takeda, Y. Murakami, H. Asou [et al.] // Keio J Med. - 2001. - Vol.
50. - № 4. - Р. 240-248.
37. Neurogenin2 gene-regulated Schwann cells
differentiate into neurons / X.-L. Xu, Q.-S. Xie, H.-S. Pan [et al.] // Chinese
Journal of Tissue Engineering Research. - 2013. - Vol. 17. - № 49. - P.
8590-8595.
38. Glioblastoma Angiogenesis and Tumor Cell
Invasiveness Are Differentially Regulated by {beta}8 Integrin / J H Tchaicha, S
B Reyes, J Shin [et al] // Cancer Res. - 2011. - 71 (20). - Р. 6371-81.
. Jensen, M. Targeting the neural cell adhesion
molecule in cancer / M Jensen, F Berthold // Cancer Lett. - 2007. - 258 (1). -
Р. 9-21.
. Oncogenic signaling is dominant to cell of
origin and dictates astrocytic or oligodendroglial tumor development from
oligodendrocyte precursor cells / N. Lindberg, Y. Jiang, Y. Xie [et al.] // J.
Neurosci. - 2014. - Vol. 34. - № 44. - Р. 14644 - 14651.
41. Clinicopathological
significance of Sox17 and β-catenin protein of Wnt in oligodendroglioma / Li J, G.
Abulajiang, N. Miao [et al.] // Zhonghua Bing Li Xue Za Zhi. - 2014. - Vol. 43.
- № 8. - Р. 546 - 550.
42. Farewell to
oligoastrocytoma: in situ molecular genetics favor classification as
oligodendroglioma or astrocytoma / F. Sahm, D. Reuss, C. Koelsche [et al.] //
Acta Neuropathol. - 2014. - Vol. 43. - № 8. - Р. 546-550.