Гидролиз белков
Содержание
Введение
.Действие
гидролитических ферментов
.1
Гидролиз пектиновых веществ
.2
Гидролиз крахмала
.3
Гидролиз целлюлоз и гемицеллюлоз
.3.1
Целлюлолитические микроорганизмы и ферменты
.Гидролиз
белков
.1
Преимущества ферментативного способа получения белковых гидролизатов
.Значение
гидролиза
Заключение
Список
литературы
Введение
Гидролиз (греч. hydor вода + lysis разложение) -
разложение веществ, проходящее с обязательным участием воды.
Живые организмы осуществляют гидролиз различных
органических веществ в ходе реакций катаболизма при участии ферментов[12].
Реакции гидролиза подвергаются самые различные
вещества. Так в процессе пищеварения высокомолекулярные вещества (белки, жиры,
полисахариды и др.) подвергаются ферментативному гидролизу с образованием
низкомолекулярных соединений (соответственно, аминокислот, жирных кислот и
глицерина, глюкозы и др.).
Без этого процесса не было бы возможным усвоение
пищевых продуктов, так как высасываться в кишечнике способны только
относительно небольшие молекулы. Так, например, усвоение полисахаридов и
дисахаридов становится возможным лишь после полного их гидролиза ферментами до
моносахаридов [4].
Человек получает энергию как за счёт
многостадийного процесса окисления пищи - белков, жиров и углеводов, так и за
счёт гидролиза некоторых сложных эфиров, амидов, пептидов и гликозидов.
Гидролиз - также основа синтеза мочевины.
Среди многочисленных способов проведения
гидролиза выделяют основные - кислотный и ферментативный гидролиз.
Ферментативный гидролиз в настоящее время представляется более
перспективным[8].
.Действие гидролитических ферментов
Гидролазы - класс ферментов, катализирующих
реакции гидролиза. К гидролазам относятся многие пищеварительные ферменты.
Некоторые гидролазы используются в пищевой промышленности.
Большинство промышленно важных ферментов
относятся к классу гидролаз, потребность в которых исчисляется десятками тысяч
тонн. К гидролазам относятся пектолитические, амилолитические,
протеолитические, цитолитические и другие ферменты[10].
1.1 Гидролиз
пектиновых веществ
Гидролиз пектиновых веществ происходит под
действием пектолитических ферментов. Эти ферменты имеют наибольшее значение в
консервной промышленности.
Пектиновые вещества __ высокомолекулярные
соединения углеводной природы, полисахариды, состоящие из остатков
галактуроновой или глюкуроновой кислот, соединенных связями α-1,4.
При
этом образуется цепочка полигалактуроновой кислоты.
В составе этой цепочки могут быть ответвления в
виде остатков метилового спирта СН3О-, часть водородных атомов карбоксильных
групп может быть замещена катионами металлов. К этой же цепи могут
присоединяться остатки сахаров: галактозы, арабинозы, рамнозы в виде
полисахаридной цепочки. Сахаридный комплекс образует нейтральную фракцию
пектиновых веществ, а полигалактуроновая цепочка с метоксильными группами -
кислую фракцию[11].
К пектиновым веществам относят протопектин,
пектин, пектиновые кислоты.
Протопектин или нерастворимый пектин -
нерастворимое в воде природное соединение растительного происхождения со
сложным химическим составом, недостаточно хорошо изучено. Возможно это
соединение пектина с другими веществами: целлюлозой, гемицеллюлозой, белками.
Пектин или растворимый пектин - водорастворимые
полигалактуроновые кислоты, карбоксильные группы которых в различной степени
соединены с остатками метилового спирта, т.е. этерифицированы. Молекулярная
масса от 25 до 360000. Растворяется в горячей воде. В присутствии сахара и
кислот образует студни. Это свойство используется при приготовлении джемов,
повидла.
Пектиновые кислоты - высокомолекулярные
полигалактуроновые кислоты, не содержащие этерифицированных групп. Плохо
растворяются в воде, студни не образуют. Пектиновые кислоты могут образовывать
соли с ионами многовалентных металлов, в результате образуются нерастворимые
соединения, которые выпадают в осадок[8].
Пектиновые вещества уменьшают выход соков из
плодово-ягодного сырья, затрудняют их осветление.
Гидролиз пектиновых веществ происходит под
действием пектолитических ферментов: протопектиназы, пектинэстразы,
полигалактуроназы.
Протопектиназа расщепляет в протопектине связи
между метоксилированной полигалактуроновой кислотой и связанными с ней арабаном
и галактаном. В результате образуется метоксилированная полигалактуроновая
кислота, которая представляет собой растворимый пектин.
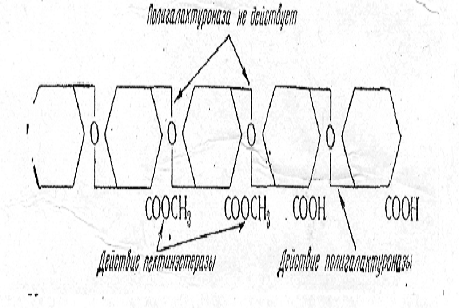

Пектинэстераза (пектаза) принадлежит к группе
эстераз и гидролизует эфирные связи растворимого пектина, отщепляя метоксилъные
группы от метоксилированной полигалактуроновой кислоты.
При этом образуется метиловый спирт (СН3ОН) и
полигалактуроновая кислота.
Полигалактуроназа (пектиназа) действует на
растворимый пектин, катализируя расщепление α-1,4-глюкозидных
связей между остатками галактуроновой кислоты, которые не содержат метоксилъных
групп. В результате образуются галактуроновая и полиуроновые кислоты. По
характеру гидролиза и механизму действия различают эндо- и
экзополигалактуроназы.
Эндополигалактуроназа действует «беспорядочно»,
разрывает цепь внутри молекулы субстрата, приводит к резкому снижению вязкости
растворов, количество восстанавливающих (альдегидных) групп незначительное.
Экзополигалактуроназа действует с конца цепи,
отщепляя по молекуле галактуроновой кислоты. Под действием этого фермента
вязкость снижается незначительно, но высвобождается большое количество
восстанавливающих групп[14].
Полнота ферментативного гидролиза пектина
зависит от действия каждого из ферментов, расщепляющих пектин. Кроме
вышеуказанных ферментов в состав пектолитического комплекса входят также и
другие, которые недостаточно полно изучены.
Полигалактуроназа содержится, в основном, в
различных видах грибов и бактерий, пектинэстераза - плесневых грибах, высших
растениях и бактериях.
Оптимальные условия действия пектолитических
ферментов; рН 3,7-4,0, температура 40-50 °С[11].
.2 Гидролиз крахмала
Гидролиз крахмала осуществляется
амилолитическими ферментами.
Крахмал - полисахарид, состоящий в свою очередь
из двух полисахаридов, которые отличаются степенью полимеризации и типом
строения - амилозой. Структурной единицей крахмала, а, следовательно, амилозы и
амилопектина, является глюкоза, остатки которой соединены между собой α-1,4
и
α-1,6-
глюкозидными
связями[1].
Амилоза имеет линейное строение (рисунок 3),
связь между остатками глюкозы α-1,4 (между
1-м и 4-м углеродными атомами). Растворима в горячей воде без набухания.
Образует растворы невысокой вязкости. Молекулярная масса от 60 до 600. С йодом
дает синее окрашивание.
Амилопектин представляет собой разветвленную
цепь, состоящую из большого числа глюкозных остатков (около 2500, рисунок 5 А).
Главная цепочка состоит из 25-30 остатков, а боковые _ из 15-18. В амилопектине
остатки глюкозы на линейных участках связаны α-1,4- связью,
а в местах ветвления - связью α-1,6. В
воде не растворяется. При нагревании образует клейстер. С йодом дает фиолетовое
окрашивание.
Содержание амилозы и амилопектина в крахмале
различно и зависит от сорта растения. Например, в картофельном крахмале амилозы
содержится 19-22 %, а амилопектина - 81-78 %.
Гидролиз крахмала осуществляется амилазами (α-амилазой,
β-амилазой,
глюкоамилазой и другими амилолитическими ферментами).
α- амилаза
(декстриногенамилаза) - по механизму действия относится к эндоферментам, т.е.
действует на молекулу субстрата изнутри, беспорядочно, что приводит к быстрому
снижению вязкости раствора крахмала. Гидролизует связи α-1,4
в
полисахаридах, содержащих три и более остатков D-глюкозы[2].
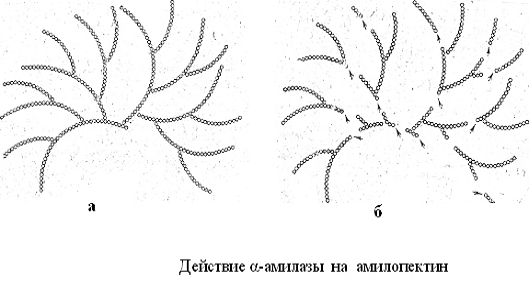



Амилоза под действием α-амилазы
(рисунок 3) сначала распадается на декстрины среднего размера, которые затем
расщепляются на низкомолекулярные декстрины и мальтозу. При длительном действии
фермента амилоза практически полностью превращается в мальтозу и небольшое количество
глюкозы.
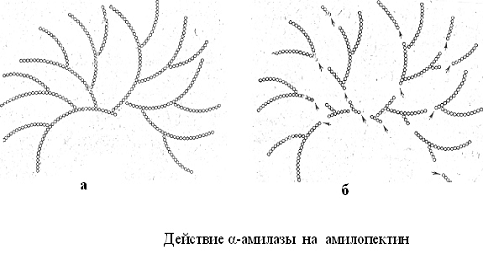
Действие α-амилазы
на амилопектин (рисунок 4) приводит к образованию мальтозы и низкомолекулярных
декстринов.
Оптимальные условия действия фермента: рН 5,7,
температура 70 °С.


β-амилаза
(сахарогенамилаза) __ экзофермент, катализирует гидролиз связей α
-1,4 в
полисахаридах, последовательно отщепляя остатки мальтозы от нередуцирующего
(где отсутствует свободная альдегидная группа) конца цепей. β-амилаза
расщепляет амилозу полностью (если количество молекул глюкозы в ней четное) в
мальтозу, если нечетное, то наряду с мальтозой образуется мальтотриоза (рисунок
5А).
В амилопектине β-амилаза
действует лишь на свободные нередуцирующие концы глюкозных цепочек с
образованием мальтозы и высокомолекулярных декстринов (рисунок 5 Б). Действие
ее прекращается при приближении к разветвлению (где имеется связь α-1,6)
на
расстоянии одной молекулы глюкозы. Образовавшиеся декстрины гидролизуются
дальше α-амилазой
до декстринов меньшей молекулярной массы. Степень гидролиза пектина, таким
образом, составляет около 50 %.
Оптимальные условия действия β-амилазы:
рН 4,7, температура 63 °С.
Таким образом, ни α-, ни
β-амилаза
не могут полностью гидролизовать крахмал, при совместном действии обоих амилаз
степень гидролиза крахмала составляет 95 %[5].
Глюкоамилаза __ экзофермент, гидролизует связи α-1,4
и α-1,6
в полисахаридах, последовательно отщепляя по одному остатку глюкозы с
нередуцирующих концов цепей. Связи α-1,4 в
крахмале разрушаются быстрее, чем α-1,6. Оптимальные
условия: рН 4,5-4,6, температура 55-60°С.
В консервной промышленности гидролиз крахмала
проводят для увеличения выхода соков из крахмалсодержащего сырья[3].
.3 Гидролиз целлюлоз и гемицеллюлоз
Целлюлоза - высокомолекулярный полисахарид.
Представляет собой длинную неразветвленную цепь остатков глюкозы, соединенных
связями β-1,4.
Нерастворима
в воде. Входит в состав клеточных стенок растений, прочно связана в
растительных материалах с другими соединениями: крахмалом, гемицеллюлозой,
пектином.
Оптимальным является ферментативный гидролиз. Но
провести глубокий ферментативный гидролиз целлюлозы невозможно из-за ее
нерастворимости и содержания большого количества примесей.
Ферментативный гидролиз целлюлозы осуществляют
целлюлазы (эндо- и экзоглюканазы). Продукты гидролиза - глюкоза и целлобиоза.
Гемицеллюлозы также принадлежат к группе
полисахаридов. Они не растворимы в воде, но растворимы в щелочах и легче
гидролизуются кислотами, чем целлюлоза. Гемицеллюлозы делят на две группы:
гексозаны и пентозаны, состоящие из остатков различных моносахаридов и их
производных[7].
Гексозаны __ высокомолекулярные соединения.
Могут быть линейные или разветвленные. Основным представителем является β-глюкан,
в котором остатки глюкозы соединены β-1,3 и
β-1,4-глюкозидными
связями.
Пентозаны имеют ветвистое строение, состоят из
остатков пентоз (сахаров с пятью атомами углерода) - ксилозы, арабинозы, а
также небольшого количества галактуроновой кислоты. Основной тип связей - β-1,4,
в
местах ветвления - β-1,3. Представителями
пентозанов являются ксиланы, арабаны и арабиноксиланы.
Гумми-вещества близки по составу к
гемицеллюлозам. Это продукты незавершенного гидролиза или синтеза гемицеллюлоз.
Состоят из глюкозы, галактозы, ксилозы, арабинозы и остатков уроновых кислот.
Растворимы в горячей воде, дают растворы с высокой вязкостью.
Гидролиз всех вышеназванных соединений
происходит под действием трех групп цитолитических ферментов: β-глюканаз
(например, эндо-β-1,3-глюканаза;
экзо-β-1,4-глюканаза),
β-ксиланаз
и β-глюкозидазы
(экзофермент, расщепляет с нередуцирующего конца β-1,4-связь,
с образованием глюкозы). Ферменты действуют поэтапно. На первом этапе гидролиза
эндоферменты действуют беспорядочно и уменьшают молекулярную массу
гемицеллюлоз. На втором этапе гидролиза действуют экзоферменты, которые
производят осахаривающее действие.
В результате гидролиза некрахмальных
полисахаридов образуются глюкоза, арабиноза, ксилоза, уроновые кислоты,
декстрины. Глубина ферментативного гидролиза всего комплекса гемицеллюлоз
находится в зависимости от состава ферментов, т.е. от наличия всех составляющих
гемицеллюлазного и пентозаназного комплекса ферментов, а также от химического
строения гемицеллюлоз. Оптимальные условия действия цитолитических ферментов:
рН 4,5-5,0, температура 35- 40 °С.
Гидролиз некрахмальных полисахаридов в
консервной промышленности необходим для снижения вязкости соков[9].
.3.1 Целлюлолитические микроорганизмы и ферменты
В природе имеются так называемые
целлюлолитические микроорганизмы, содержащие набор ферментов - целлюлаз,
способных к расщеплению не только аморфной, но и кристаллической целлюлозы до
глюкозы. Попадая на поверхность целлюлозосодержащего материала и прикрепляясь к
ней, микроорганизм выделяет целлюлазы, под действием которых субстрат целлюлаза
в непосредственной близости от грибка-паразита расщепляется до конечного
продукта - глюкозы. Микроорганизм поглощает глюкозу в качестве основного
продукта питания, размножается, растет, захватывая все большие участки
поверхности, выбрасывает все новые и новые порции ферментов, пока не истощится
доступная целлюлоза.
Однако эти процессы протекают весьма медленно. Для того чтобы пень в лесу
полностью сгнил, нужны годы. Если же отделить от микроорганизма ферменты
целлюлазы, сконцентрировать их и добавить к целлюлозе, процесс значительно
ускорится. При этом образующаяся глюкоза не потребляется грибками, а
накапливается в реакционной смеси. Кроме того, если в качестве субстрата
использовать не чистую целлюлозу, а целлюлозосодержащие отходы промышленности
или сельского хозяйства, то можно решить и еще одну важную проблему -
утилизацию отходов. Полученная глюкоза в зависимости от ее чистоты и
экономической эффективности процесса может найти применение в медицине, пищевой
промышленности, тонкой химической технологии или технической микробиологии.
Глюкозу, как известно, можно сбраживать в этанол и затем употреблять как
«жидкое топливо» в качестве заменителя части нефтепродуктов.
Целлюлоза на нашей планете - самое «крупнотоннажное» из всех возобновляемых
видов сырья. Если даже малую долю этих отходов превращать ферментативным путем
в полезные продукты, это даст ощутимый (и возобновляемый!) источник пищевых
углеводов и заменителей нефти. Поэтому данной проблемой в последние годы столь
упорно занимаются и исследователи, и технологи всего мира[13].
2. Гидролиз белков
Ферментативный гидролиз белков происходит под
действием протеолитических ферментов (протеаз). Они классифицируются на эндо- и
экзопептидазы. Ферменты не имеют строгой субстратной специфичности и действуют
на все денатурированные и многие нативные белки, расщепляя в них пептидные
связи -СО-NH-[18].
Эндопептидазы (протеиназы) - гидролизуют
непосредственно белок по внутренним пептидным связям. В результате образуется
большое количество полипептидов и мало свободных аминокислот.
Оптимальные условия действия кислых протеиназ:
рН 4,5-5,0, температура 45-50 °С .
Экзопептидазы (пептидазы) действуют, главным
образом, на полипептиды и пептиды, разрывая пептидную связь с конца. Основные
продукты гидролиза - аминокислоты. Данную группу ферментов делят на амино-,
карбокси-, дипептидазы.
Аминопептидазы катализируют гидролиз пептидной
связи, находящейся рядом со свободной аминогруппой.
R R1
H2N - СН - С - - NH - СН - С ....
О
Карбоксипептидазы осуществляют гидролиз
пептидной связи, находящейся рядом со свободной карбоксильной группой.
СООН
СО -NH- С - Н
R
Дипептизады катализируют гидролитическое
расщепление дипептидов на свободные аминокислоты. Дипептидазы расщепляют только
такие пептидные связи, по соседству с которыми находятся одновременно свободные
карбоксильная и аминная группы.
дипептидаза
NH2CH2CONHCH2COOH + Н2О 2CH2NH2COOH
Глицин-глицин Гликокол
Оптимальные условия действия: рН 7-8, температура
40-50 оС. Исключение составляет карбоксипептидаза, проявляющая максимальную
активность при температуре 50 оС и рН 5,2.
Гидролиз белковых веществ в консервной
промышленности необходим при производстве осветленных соков[7].
.1 Преимущества ферментативного способа
получения белковых гидролизатов
При производстве биологически активных веществ
из белоксодержащего сырья наиболее важным является его глубокая переработка,
предусматривающая расщепление белковых молекул до составляющих мономеров.
Перспективным в этом отношении является гидролиз белкового сырья с целью
производства белковых гидролизатов - продуктов, содержащих ценные биологически
активные соединения: полипептиды и свободные аминокислоты. В качестве сырья для
производства белковых гидролизатов могут быть использованы любые полноценные по
аминокислотному составу природные белки, источниками которых являются кровь и
ее составные компоненты; ткани и органы животных и растений; отходы молочной и
пищевой промышленности; ветеринарные конфискаты; пищевые и малоценные в пищевом
отношении продукты, получаемые при переработке различных видов животных, птицы,
рыбы; отходы производства мясокомбинатов и клеевых заводов и др. При получении
белковых гидролизатов для медицинских и ветеринарных целей служат, в основном,
белки животного происхождения: крови, мышечной ткани и внутренних органов,
белковые оболочки, а также белки молочной сыворотки[15].
Проблема гидролиза белков и ее практическая
реализация с давних пор привлекают внимание исследователей. На основе гидролиза
белков получают различные препараты, широко применяемые в практике: как
кровезаменители и для парентерального питания в медицине; для компенсации
белкового дефицита, повышения резистентности и улучшения развития молодняка
животных в ветеринарии; как источник аминокислот и пептидов для бактериальных и
культуральных питательных сред в биотехнологии; в пищевой промышленности,
парфюмерии. Качество и свойства белковых гидролизатов, предназначенных для
различного применения, обусловлены исходным сырьем, способом гидролиза и
последующей обработкой полученного продукта.
Варьирование способов получения белковых
гидролизатов позволяет получать продукты с заданными свойствами. В зависимости
от содержания аминокислот и наличия полипептидов в диапазоне соответствующей
молекулярной массы может быть определена область наиболее эффективного
использования гидролизатов. К белковым гидролизатам, получаемым для различных
целей, предъявляются разные требования, зависящие в первую очередь от состава
гидролизата. Так, в медицине желательно применение гидролизатов, содержащих
15...20% свободных аминокислот; в ветеринарной практике для повышения
естественной резистентности молодняка преимущественным является содержание в
гидролизатах пептидов (70...80%); для пищевых целей важными являются
органолептические свойства получаемых продуктов. Но основным требованием при
использовании белковых гидролизатов в различных областях является
сбалансированность по аминокислотному составу[19].
Гидролиз белка можно осуществить тремя путями:
действием щелочей, кислот и протеолитических ферментов. При щелочном гидролизе
белков образуются остатки лантионина и лизиноаланина, которые являются
токсичными для организма человека и животных. При таком гидролизе разрушаются
аргинин, лизин и цистин, поэтому для получения гидролизатов его практически не
используют. Кислотный гидролиз белка является широко распространенным способом.
Чаще всего белок гидролизуют серной или соляной кислотой. В зависимости от
концентрации используемой кислоты и температуры гидролиза время процесса может
изменяться от 3 до 24-х часов. Гидролиз серной кислотой проводят 3...5 часов
при температуре 100...130 оС и давлении 2...3 атмосферы; соляной - в течение
5...24 ч при температуре кипения раствора под небольшим давлением.
При кислотном гидролизе достигается большая
глубина расщепления белка и исключается возможность бактериального загрязнения
гидролизата. Это особенно важно в медицине, где гидролизаты применяются, в
основном, парентерально и необходимо исключить анафилактогенность, пирогенность
и другие нежелательные последствия. В медицинской практике широко применяются
кислотные гидролизаты: аминокровин, гидролизин Л-103, ЦОЛИПК, инфузамин, геммос
и другие.
Недостатком кислотного гидролиза является полное
разрушение триптофана, частичное оксиаминокислот (серина и треонина),
дезаминирование амидных связей аспарагина и глутамина с образованием аммиачного
азота, разрушение витаминов, а также образование гуминовых веществ, отделение
которых затруднительно. Кроме того, при нейтрализации кислотных гидролизатов
образуется большое количество солей: хлоридов или сульфатов. Последние являются
особенно токсичными для организма. Поэтому кислотные гидролизаты нуждаются в
последующей очистке, для чего в производстве обычно используется ионообменная
хроматография[3].
Во избежание разрушения лабильных аминокислот в
процессе получения кислотных гидролизатов, некоторые исследователи использовали
мягкие режимы гидролиза в атмосфере инертного газа, а также добавляли к
реакционной смеси антиоксиданты, тиоспирты или производные индола. Кислотный и
щелочной гидролиз имеют, кроме указанных, еще существенные ограничения,
связанные с реактивностью среды, что приводит к быстрой коррозии оборудования и
вызывает необходимость соблюдения жестких требований техники безопасности для
операторов. Таким образом, технология кислотного гидролиза достаточно трудоемка
и требует использования сложной аппаратуры (ионообменные колонки,
ультрамембраны и т.п.) и дополнительных этапов очистки получаемых препаратов.
Проведены исследования по разработке
электрохимической ферментативной технологии получения гидролизатов.
Использование этой технологии позволяет исключить из процесса применение кислот
и щелочей, т. к. рН среды обеспечивается в результате электролиза
обрабатываемой среды, содержащей незначительное количество соли. Это, в свою
очередь, позволяет автоматизировать процесс и обеспечить более тонкий и
оперативный контроль технологических параметров[16].
Как известно, в организме белок под действием
пищеварительных ферментов расщепляется до пептидов и аминокислот. Аналогичное
расщепление можно провести и вне организма. Для этого к белковому веществу
(субстрату) добавляют ткань поджелудочной железы, слизистую оболочку желудка
или кишечника, чистые ферменты (пепсин, трипсин, химотрипсин) или ферментные
препараты микробного синтеза. Такой способ расщепления белка называется
ферментативным, а полученный гидролизат - ферментативным гидролизатом.
Ферментативный способ гидролиза является более предпочтительным, по сравнению с
химическими методами, т. к. проводится в "мягких" условиях (при
температуре 35...50оС и атмосферном давлении). Преимуществом ферментативного
гидролиза является то обстоятельство, что во время его проведения аминокислоты
практически не разрушаются и не вступают в дополнительные реакции (рацемизация
и другие). При этом образуется сложная смесь продуктов распада белков с
различной молекулярной массой, соотношение которых зависит от свойств
применяемого фермента, используемого сырья и условий проведения процесса. Полученные
гидролизаты содержат 10...15% общего азота и 3,0...6,0% аминного азота.
Технология его проведения относительно проста.
Таким образом, по сравнению с химическими
технологиями ферментативный способ получения гидролизатов обладает
существенными достоинствами, главными из которых являются: доступность и
простота проведения, незначительная энергозатратность и экологическая
безопасность[7].
3.Значение гидролиза
Очень важное значение в промышленности основного
органического и нефтехимического синтеза имеет такой процесс, как гидролиз.
Применяя его в отношении жиров, целлюлозы и углеводов давно получают мыло,
глицерин, этиловый спирт и другие ценные продукты. В области органического
синтеза рассматриваемые операции используются главным образом для производства
спиртов С2-С5, фенолов, простых эфиров, окисей, многих ненасыщенных соединений,
карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов,
амидов), а также ацетальдегида и других соединений.
Перечисленные вещества имеют очень важное применение
в качестве промежуточных продуктов органического синтеза, мономеров и фенолов,
эфиров акриловой и метакриловой кислот, меламинов, хлоролефинов,
акрилонитрилов, пластификаторов и смазочных материалов. Также используют для
растворителей (спирты, простые и сложные эфиры, хлоролефины), пестицидов,
поверхностно-активных веществ и т.д.
Очень часто рассматриваемые реакции являются
промежуточным этапом в многостадийных синтезах других продуктов целевого
назначения. Производство перечисленных выше продуктов имеет большие масштабы
как у нас в стране, так и за рубежом[17].
Заключение
Рассмотренные примеры ферментативного гидролиза
доказывают его огромную роль в процессах жизнедеятельности организма: На нём
основываются процессы питания и выделения, поддержания гомеостаза (постоянства
среды) и перераспределения энергии. Без этого процесса не было бы возможным
усвоение пищевых продуктов, так как высасываться в кишечнике способны только
относительно небольшие молекулы. Образующиеся в процессе переваривания пищи
вещества-мономеры, вступают в ряд реакций. Во многих из них они окисляются, и
энергия, выделяющаяся при этом окислении, используется для синтеза АТФ из АДФ -
основного процесса аккумулирования энергии в живых организмах. Эта энергия
необходима для роста и нормального функционирования организма.
Преимуществами ферментативного гидролиза
являются:
лучшие выходы целевого продукта (моносахаридов);
мягкие условия проведения процесса (низкие
температуры, атмосферное давление);
данный способ перспективен с точки зрения
создания самостоятельных малоотходных технологий;
снижение экологической опасности различных
производств, перерабатывающих растительное сырьё и образующих большое
количество отходов[14].
Список литературы
Кашкин,
П.Н. Ферменты / П.Н. Кашкин. - СПб.: Медицина, -2011г. - 236c.
Арзамасцева,
А.П. Фармацевтическая химия. / А.П.Арзамасцева.- М: ГЭОТАР-МЕД, - 2009г. -
626с.
Березов,
Т.Т. Биологическая химия. / Т.Т. Березов, Б.Ф. Коровкин. - М: Медицина, -
2008г.- 317с.
Бирюков,
В.В. Основы промышленной биотехнологии. / В.В. Бирюков. - М: Колосс, - 2007г. -
196 с.
Габриелян,
О.С. Химия. / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин, Г.Г.
Лысова, - 2008г.- 167с.
Лабинская,
А.С.Микробиология с техникой микробиологических исследований / А. С Лабинская -
М: Медицина, -2007г. - 394 с.
Нечаев,
А.П. Пищевая химия. / А.П. Нечаева, С.Е Траубенберг, А.А Кочеткова - Издание
3-е, - 2009г.- 56с.
Страйер,
Л.М. Биохимия / Л.М. Страйер - М., -2011г.- 241с.
Л.О.
Шнайдман - Ярославль: Пищевая промышленность, -2010г. - 440с.
Смирнов,
М.И. Ферменты / М.И. Смирнов- М: Медицина, - 2008 г.- 145с.
Арзамасцева,
А.П. Химия. / А.П. Арзамасцева. - М: ГЭОТАР - МЕД, - 2009г. - 626с.
Шевницына,
Л.В. Неорганическая химия - Учебное пособие. / Т.Б.Белова, - 2007г. -86с.
Бекер
М. Е. Биотехнология / Лиепиньш Г. К., Райпулис Е. П. - М,- 2000г. -58-76 с.
Холькин
Ю.И. Технология гидролизных производств.- М.: Промышленноссть, - 2009г. -496 с.
Блинов
Н. П. Химическая микробиология. М., Высшая школа, - 2009г.-365-390 с.
Воробьева
Л. И. Промышленная микробиология. М., МГУ, - 2009г.-
-51
с. гидролиз
пектиновый крахмал белковый
Маринченко
В. А. Технология, - 2001г. - 416 с.
Шлегель
Г. Общая микробиология: Учебник для вузов. - М.: Мир, -2007г. - 293-295 с.