Вторичные метаболиты
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
«ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ
ИМЕНИ ИМПЕРАТОРА ПЕТРА I»
Кафедра ботаники, защиты растений, биохимии и микробиологии
Курсовая работа
по биохимии растений
Тема: Вторичные метаболиты
Выполнила:
студентка ТТ-2-1б
Калинина Яна
Геннадьевна
Проверил:
доцент
Мараева Ольга
Борисовна
ВОРОНЕЖ 2013
Введение
Метаболиты вторичные - соединения, часто сложного состава, не являющиеся
основными промежуточными соединениями метаболизма клетки, образуются в его
тупиковых ветвях. Метаболиты вторичные растений являются, например, алкалоиды.
Микроорганизмы образуют вторичные метаболиты, как правило, в период замедления
или прекращения активного роста и размножения культур. В качестве вторичных
метаболитов микроорганизмы образуют некоторые пигменты, антибиотики, витамины.
Большое значение имеет синтез вторичных метаболитов микроорганизмами в процессе
формирования гумуса почвы.
Каким бы путем ни осуществлялся фотосинтез, в конечном итоге он завершается
накоплением энергетически богатых запасных веществ, составляющих основу для
поддержания жизнедеятельности клетки и в конечном итоге всего многоклеточного
организма. Эти вещества являются продуктами первичного метаболизма. Помимо
главнейшей своей функции первичные метаболиты - основа для биосинтеза
соединений, которые принято называть продуктами вторичного метаболизма.
Последние, часто называемые условно "вторичными метаболитами",
целиком "обязаны" своим существованием в природе продуктам,
образующимся в итоге фотосинтеза. Следует заметить, что синтез вторичных
метаболитов осуществляется за счет энергии, освобождающейся в митохондриях в
процессе клеточного дыхания.
1. Обзор литературы
1.1 Признаки вторичных метаболитов
По химической структуре молекулы отличить вторичные
метаболиты от первичных можно далеко не всегда. На рис. 1 приведены некоторые
примеры первичных и вторичных метаболитов.
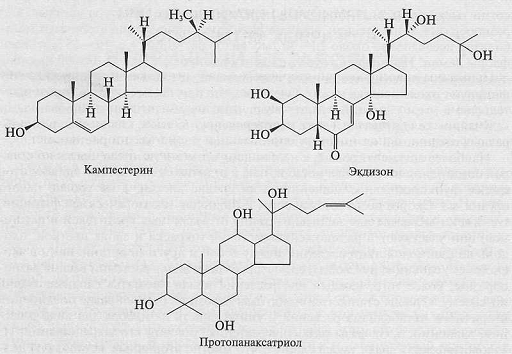
Рис. 1. Структуры кампестерина (первичный метаболит),
экдизона и протопанаксатриола (вторичные метаболиты)
Фитостерины (ситостерин, кампестерин, стигмастерин) -
обязательные компоненты мембран растительной клетки, и, следовательно, -
типичные первичные соединения. Экдистероиды (гормоны линьки насекомых) -
вторичные метаболиты, они присутствуют лишь у некоторых видов растений. Эти
вещества, как полагают, участвуют в защите растений от насекомых.
Протопанаксатриол является агликоном гинзенозидов - вторичных метаболитов
женьшеня, присутствующих только в роде Рапах и в большой степени отвечающих за
его биологическую активность. В то же время структуры молекул этих соединений
похожи и отличаются только числом и расположением метальных и гидроксильных
групп. Структуры белковых аминокислот (первичные метаболиты) и небелковых
аминокислот (типичные вторичные метаболиты) часто отличаются лишь наличием или
отсутствием метильной, гидроксильной либо другой функциональной группы.
На основе анализа литературы можно сформулировать
четыре признака вторичных метаболитов:
) присутствие не во всех растениях;
) наличие биологической активности;
) относительно низкий молекулярный вес;
) небольшой набор исходных соединений для их синтеза.
Это именно признаки вторичных метаболитов, поскольку
каждый из них, в общем-то, не обязателен. Ряд вторичных метаболитов найден
практически во всех растениях (например, многие фенилпропаноиды); достаточно
много вторичных метаболитов без выраженной биологической активности (хотя не
исключен вариант, что ее просто не обнаружили); известны высокомолекулярные
вторичные метаболиты (например, каучук и гуттаперча). Однако совокупность
указанных признаков достаточно четко очерчивает крут вторичных метаболитов
растений.
Наиболее обоснованно отнести соединение к первичным
или вторичным метаболитам можно только после выяснения его роли в
жизнедеятельности растения, т.е. на основе его функциональной значимости.
Функциональное определение вторичного метаболизма в первом приближении можно
дать как метаболизм соединений, имеющих значение на уровне клетки.
1.2 Принципы классификации вторичных метаболитов
Принципы классификации вторичных метаболитов, как и
названия индивидуальных соединений, изменялись по мере их изучения. Сейчас
можно встретить элементы по крайней мере четырех вариантов классификации.
•Эмпирическая (тривиальная) классификация. Самый
«древний» принцип классификации, основанный на определенных свойствах вторичных
метаболитов. Например, алкалоиды - соединения, имеющие щелочные свойства;
сапонины - вещества, образующие при встряхивании пену; горечи - соединения с
горьким вкусом; эфирные масла - ароматные летучие вторичные метаболиты.
Подобный принцип классификации имеет много недостатков, однако его элементы
встречаются до сих пор в силу традиции и длительного употребления.
Вторичные метаболиты получали (и получают) свои названия,
как правило, также эмпирически. Чаще всего названия происходят от растения, из
которого впервые было выделено соединение. Например, алкалоиды папаверин (мак),
берберин (барбарис), кокаин (кокаиновый куст). Довольно часто названия связаны
с мифологией, историей, личностями и т.д. Например, алкалоид морфин получил
свое название в честь бога сна. Подобный способ классификации и формирования
названий соединений часто приводит к недоразумениям. Например, биологически
активные тритерпеновые гликозиды женьшеня практически одновременно начали
изучать в Японии и в России. Японские исследователи предложили их называть
гинзенозидами - по видовому названию женьшеня, тогда как русские исследователи
- панаксозидами, т.е. по родовому названию. Позже, когда стало ясно, что одни и
те же соединения называются по-разному, пришлось публиковать «таблицы
соответствия» гинзенозидов и панаксозидов.
•Химическая классификация. Этот вариант классификации
основан на признаках химической структуры вторичных метаболитов и на данный
момент времени наиболее разработан и распространен. Однако и эта классификация
не лишена недостатков. Например, алкалоиды по такой классификации - соединения,
имеющие атом азота в гетероцикле. По этому признаку гликоалка-лоиды картофеля
или томатов - типичные алкалоиды, однако по способу синтеза, структуре и ряду
свойств эти соединения являются изопреноидами.
•Биохимическая классификация. Эта классификация
базируется на способах биосинтеза вторичных метаболитов. Например, согласно
этой классификации упомянутые выше гликоалкалоиды относятся к тритерпеновым
псевдоалкалоидам, так как синтезируются, как и стероидные гликозиды, по
изопреноидному пути. Это, по-видимому, наиболее объективный вариант
классификации. Однако поскольку биохимия вторичного метаболизма еще
недостаточно разработана, такая классификация находится в периоде становления.
•Функциональная классификация. Основана на функциях
вторичных метаболитов в интактном растении. Этот вариант принципиально
отличается от предыдущих и должен существовать параллельно с ними. Согласно
функциональной классификации в одну группу соединений могут попадать химически
разные структуры. Например, фитоалексины (вторичные метаболиты, имеющие
защитные функции и синтезирующиеся в ответ на атаку патогена) представлены в разных
видах фенольными соединениями, изопреноидами, полиацетиленами и др. Разработка
функциональной классификации вторичных метаболитов только начинается, но она
имеет принципиальное значение для физиологии растений.
Наличие разных вариантов классификации вторичных
метаболитов приводит к определенным сложностям. В частности, при использовании
разных признаков, используемых при химической классификации, возможно
«перекрытие» групп вторичных метаболитов. Например, в «фармакогнозии» в
качестве действующих веществ многих лекарственных растений выделяют гликозиды
(соединения, молекула которых состоит из агликона и углеводного фрагмента) в
отдельную группу. В то же время по структуре агликона эти гликозиды могут быть
отнесены к фенольным соединениям, изопреноидам или другим группам вторичных
метаболитов. Еще больше проблем возникает, когда соединение содержит ряд
признаков, характерных для разных групп вторичных метаболитов (например,
пренилированные фенольные соединения). В ряде случаев появляющиеся проблемы можно
снять, корректируя химическую классификацию биохимической.
1.3 Основные группы вторичных метаболитов
В настоящее время известно более десятка групп
(классов) вторичных метаболитов. При этом некоторые группы насчитывают по
несколько тысяч индивидуальных соединений, тогда как другие - лишь единицы. Так
же неравномерно распределены группы в растительном мире. Например, изопреноиды
и фенольные соединения присутствуют во всех видах растений, тогда как некоторые
группы (например, тиофены или ацетогенины) характерны лишь для единичных видов.
Хорошо известны три самые большие группы вторичных
метаболитов - алкалоиды, изопреноиды (терпеноиды) и фенольные соединения.
Каждая из этих групп состоит из несколько тысяч соединений и подразделяется на
многочисленные подгруппы. Известно также около десятка менее многочисленных
групп вторичных метаболитов: растительные амины, небелковые аминокислоты,
цианогенные гликозиды, глюкозинолаты, полиацетилены, беталаины, алкиламиды,
тиофены и др. Количество соединений, входящих в эти группы, колеблется от
единиц до нескольких сотен.
Вторичные метаболиты в растении практически никогда не
присутствуют в «чистом виде», они, как правило, входят в состав сложных смесей.
Такие смеси в зависимости от их состава и нахождения в растении часто носят
собственные, исторически сложившиеся названия.
Эфирные масла, как правило, представляют из себя смесь
легко испаряющихся изопреноидов (моно- и сесквитерпенов).
Смолы представлены главным образом дитерпенами.
Камеди состоят преимущественно из полисахаридов, но в
их состав часто входят алкалоиды, фенольные соединения.
Слизи - это смесь водорастворимых олиго- и
полисахаридов, Сахаров, а также небольших количеств фенольных соединений,
алкалоидов или изопреноидов.
1.4 Закономерности строения вторичных метаболитов
При анализе структур вторичных метаболитов создается
впечатление, что их огромное разнообразие происходит по определенной схеме. Как
правило, имеется определенная «базовая» структура, на основе которой образуются
многочисленные варианты. При этом можно отметить несколько способов
возникновения таких вариантов.
• Модификации базовой структуры: обычно это либо
присоединение, либо замена функциональных групп, изменение степени окисленности
молекулы; в качестве функциональных групп часто используются гидроксильные,
метильные либо метоксильные группы.
• Образование конъюгатов: присоединение к базовой
структуре «унифицированных блоков»; чаще всего различных сахаров (моно- или
олигосахариды), органических кислот или некоторых групп вторичных метаболитов.
• Конденсация: объединение нескольких одинаковых или
различных базовых структур, например образование пренилированных фенольных
соединений или димерных индольных алкалоидов.
Для разных групп вторичных метаболитов характерны
специфические изменения структуры. Например, для алкалоидов характерно
метоксилирование, но не гликозилирование; для изопреоидов, наоборот, типично
гликозилирование, но не метоксилирование; у фенольных соединений наблюдаются
оба типа этих модификаций.
Определенные модификации молекул, по-видимому, имеют
существенное функциональное значение. Многие из них (в частности,
гликозилирование) значительно изменяют биологическую активность молекулы. Очень
часто гликозилирование является универсальным способом перевода активной
(функциональной) формы вторичного метаболита в неактивную (запасную). По этой
причине, видимо, нецелесообразно выделять все гликозиды в отдельную группу
вторичных метаболитов.
1.5. Фитохимия вторичного метаболизма
•Алкалоиды. Название этой группы веществ происходит от
арабского alcali - щелочь и греческого eidos - подобный. В настоящее время
известно около 10 000 индивидуальных алкалоидов.
В случае алкалоидов достаточно удачно совпали
эмпирическая и химическая классификация. Согласно химической классификации,
алкалоиды - это соединения, содержащие один или несколько атомов азота в
молекуле, что и придает им щелочные свойства. По химической структуре алкалоиды
обычно разделяют на две подгруппы: протоалкалоиды, которые содержат азот не в
гетероцикле, и истинные алкалоиды, содержащие азот в гетероцикле. В
распределение алкалоидов на подгруппы внесла коррективы биохимическая
классификация. Гликоалкалоиды, а также ряд других алкалоидов (например,
алкалоиды аконита) по типу синтеза и по структуре фактически являются
изопреноидами. Поэтому было решено выделить их в особую группу - изопреноидных
псевдоалкалоидов.
Наиболее широко алкалоиды распространены среди
покрытосеменных растений. Особенно богаты ими семейства маковых, пасленовых,
бобовых, кутровых, мареновых, лютиковых. Во мхах, папоротниках, голосеменных
алкалоиды встречаются относительно редко.
Разные органы и ткани растения могут содержать разные
алкалоиды. Обычно их концентрация невелика и составляет десятые и сотые доли
процента. При содержании алкалоидов около 1 - 3 % растение считается богатым
алкалоидами (алкалоидоносным). Только немногие растения, например
культивируемые формы хинного дерева, могут накапливать до 15 - 20% алкалоидов.
Протоалкалоиды встречаются довольно часто в растениях разных семейств, но, как
правило, не накапливаются в значительных количествах.
Алкалоиды накапливаются, как правило, в вакуолях, а в
периплазматическое пространство практически не поступают. Возможно, это
является следствием «бережного отношения» растения к азотсодержащим
соединениям. Транспорт алкалоидов в вакуоли проходит с участием специфичных
переносчиков (видимо, ABC-транспортеров).
Во всяком случае в изолированные вакуоли эффективно поступают только
«собственные» алкалоиды, т.е. характерные для данного растения. В вакуолях
алкалоиды обычно находятся в виде солей. Синтез алкалоидов проходит
преимущественно в пластидах, либо в цитозоле.
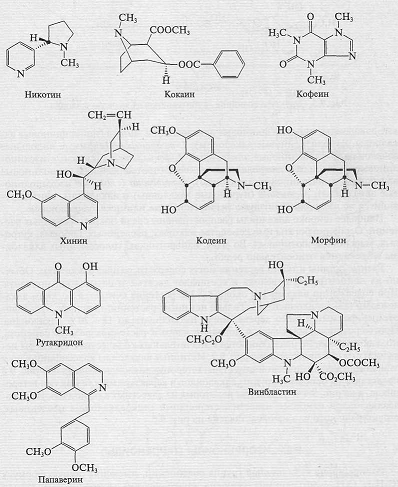
Рис. 2. Структуры некоторых алкалоидов
•Изопреноиды - обширная группа соединений, имеющих
общую формулу (С5Н8)n. С5Н8 - это
единица изопрена, таким образом изопреноиды являются соединениями,
«составленными» из нескольких изопреновых единиц. Их биосинтез действительно
идет соединением пятиуглеродных фрагментов, поэтому название этой группы
веществ совпадает с их биохимической классификацией.
Классификация изопреноидов основана на количестве
изопреновых единиц, входящих в состав молекулы. Соединения на основе только
одной изопреновой единицы в растениях обнаружили лишь сравнительно недавно.
Поэтому исторически сложилось, что монотерпенами назвали соединения, содержащие
две изопреновые единицы и, следовательно, имеющие общую формулу (С5Н8)2, т.е.
С10Н16. Изопреноиды, содержащие три изопреновые единицы, назвали
сесквитерпенами, общая формула C15H24.Соответственно дитерпены построены
из четырех, тритерпены - из шести и тетратерпены - из восьми пятиуглеродных
фрагментов. Когда же обнаружили соединения, состоящие из одного и пяти
изопреновых единиц, то их пришлось назвать соответственно гемитерпенами и
сестертерпенами. Политерпеноиды каучук и гута имеют в своем составе от 100 до
5000 единиц изопрена.
Моно- и сесквитерпеноиды - как правило,
легкоиспаряющиеся жидкости, часто с разнообразным запахом. Известно более 3000
этих соединений. Их классификация основана на наличии или отсутствии кольцевой
структуры в молекуле, типе кольца, а также наличии и количестве двойных связей
в молекуле. Моно- и сесквитерпены могут быть алифатическими (углеводород с
незамкнутой цепочкой атомов), циклическими с различным количеством циклов (от
одного до трех), а также содержать различные функциональные группы (гидрокси-,
карбокси-, кето-группы). Они составляют основу эфирных масел. Моно-и
сесквитерпеноиды часто обладают бактерицидным действием.
Дитерпеноиды также насчитывают несколько тысяч
структур. Они являются главными компонентами смол у голосеменных (ель, сосна,
пихта, кедр). Часто дитерпеноиды смол обладают бактерицидными свойствами.
Тритерпеноиды представлены несколькими группами
соединений. Прежде всего это соединения первичного метаболизма - фитостерины,
однако большинство тритерпеноидов являются типичными вторичными метаболитами.
Тритерпеноиды обладают широким спектром биологической активности. К ним
относятся сердечные, стероидные, тритерпеновые гликозиды, экдистероиды.
Тетратерпеноиды представлены в растениях главным
образом каротиноидами, некоторые из них участвуют в основном обмене
(фотосинтез), однако большинство (около 500) - это типично вторичные
метаболиты.
Изопреноидные вторичные метаболиты, в отличие от
алкалоидов, обычно после синтеза выводятся из клетки. Помимо клеточной стенки,
они могут иногда накапливаться в вакуолях. Синтез изопреноидов может проходить
в двух компартментах - в пластидах или в цитозоле. При этом существуют два
независимых пути синтеза изопреноидов: мевалонатный - в цитоплазме,
альтернативный - в пластидах. «Пластидный» синтез изопреноидов часто
осуществляется в лейкопластах - специализированных «изопреноидных» пластидах,
которые имеют ряд морфологических особенностей (например, отсутствие рибосом,
особое расположение внутренних мембран). Для них характерны тесные контакты с
ЭР («ретикулярный футляр»), что косвенно указывает на взаимодействие пластид и
ЭР при синтезе изопреноидов.
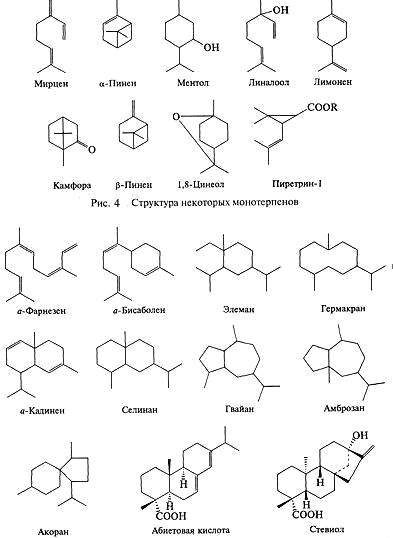
Рис. 3. Структура некоторых сесквитерпеноидов и дитерпеноидов
•Фенольные соединения - вещества ароматической
природы, содержащие одну или несколько гидроксильных групп у ароматического
кольца. Фенолами называют соединения с одним атомом гидроксила, полифенолами -
с двумя и более. Многие фенольные соединения участвуют в основном обмене (в
частности, в процессах фотосинтеза и дыхания), однако большинство из них -
типичные представители вторичного метаболизма.
Фенольные соединения классифицируются в зависимости от
числа ароматических колец и количества присоединенных к ним атомов углерода.
Фенольные соединения принято разделять на три большие подгруппы: с одним и
двумя ароматическими кольцами, а также полимерные фенольные соединения. Иногда
в особую группу выделяют димерные фенольные соединения.
Отличительной чертой фенольных соединений является
формирование огромного числа соединений за счет модификаций молекулы и
образования конъюгатов с разнообразными структурами. Из модификаций для
фенольных соединений характерны образование гликозидов, метилирование и метоксилирование.
За счет гидроксильных и карбоксильных групп фенольные соединения могут
связываться с сахарами, органическими кислотами, растительными аминами,
алкалоидами. Помимо этого растительные фенолы могут соединяться с
изопреноидами, образуя большую группу пренилированных фенолов. Такие свойства
фенольных соединений обеспечивают огромное разнообразие структур, характерное
для растительных фенолов.
Фенольные соединения накапливаются как в вакуолях, так
и в периплазматическом пространстве. При этом в вакуолях обычно содержатся
гликозилированные фенольные соединения, тогда как в периплазматическом
пространстве - метаксилированные соединения или агликоны. Синтез фенольных
соединений происходит в хлоропластах и цитозоле. Показано существование двух
независимых путей синтеза ароматических соединений (шикиматные пути) - в
цитозоле и в пластидах.
Многие соединения других классов вторичных метаболитов
также накапливаются в вакуолях. Подобную локализацию имеют, например,
цианогенные гликозиды, глюкозинолаты, беталаины.
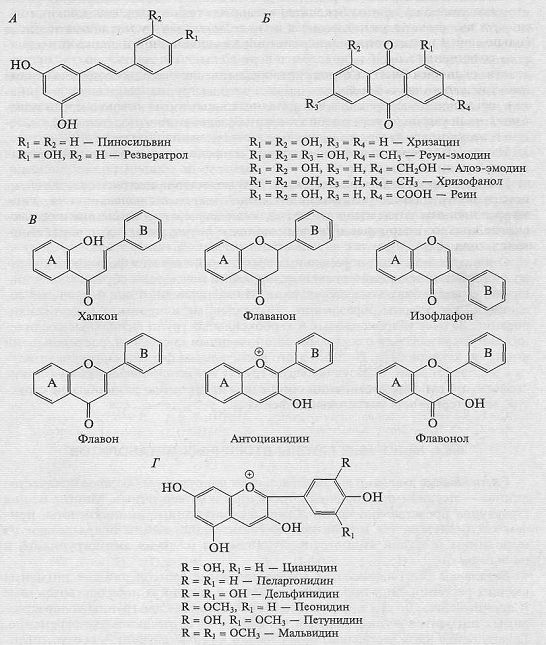
Рис. 4. Фенольные соединения с двумя ароматическими
кольцами: стильбены (А), антрахиноны (Б), основные группы флавоноидов (В),
антоцианидины (Г)
•Минорные группы вторичных метаболитов
Растительные амины. В высших растениях присутствует
большое количество аминов - первичных, вторичных, третичных и четвертичных.
Многие из них структурно представляют собой декарбоксилированные аминокислоты,
причем как белковые, так и небелковые. Растительные амины подразделяют на моноамины
(с одной аминогруппой), диамины (с двумя аминогруппами) и полиамины.
До сих пор не найдены растения, где две группы
водорастворимых пигментов - антоцианы и беталаины - встречаются одновременно.
Группу беталаинов составляют бетацианины и бетаксантины - соответственно
красно-фиолетовые и желтые соединения. Бетацианины представляют собой гликозиды
и ацилгликозиды всего двух агликонов.
Цианогенные гликозиды. Цианогенные гликозиды являются β-гликозидами 2-гидроксинитрилов
(цианогидринов). К настоящему времени в высших растениях обнаружено несколько
десятков подобных соединений. Основные структурные вариации обусловлены природой
заместителей R1 и R2. В качестве углеводного фрагмента как правило, выступает D-глюкоза. При гидролизе циано-генных
гликозидов специфичной гликозидазой выделяется синильная кислота.
Небелковые аминокислоты. Под этим термином
подразумеваются природные аминокислоты, их амиды, иминокислоты, которые в норме
не входят в состав белков. Сейчас известно более 400 небелковых аминокислот.
Многие из них можно рассматривать как модификации белковых. Наиболее часто
встречаются варианты удлинения или сокращения углеродной цепи (добавление или
удаление СН2- или СН3-фрагментов), гидрирование и дегидрирование,
гидроксилирование, аминирование. Встречаются и необычные (например,
селен-содержащие) аминокислоты. Небелковые аминокислоты преимущественно весьма
токсичны, поскольку могут включаться в белки вместо «нормальных» аминокислот и
нарушать их функции.
Необычные липиды. К ним относятся прежде всего
«необычные» жирные кислоты, которые отличаются от «обычных» длиной углеродной
цепи, иным расположением и количеством двойных связей, наличием дополнительных
функциональных групп и циклов. Чаще всего необычные жирные кислоты
обнаруживаются в масле семян. Во многих видах высших растений обнаружены
соединения с одной или несколькими тройными связями. Такие соединения получили
название ацетиленовых производных, или полиацетиленов. Известно несколько сотен
таких структур. В отличие от необычных жирных кислот, ацетиленовые производные
могут находиться во всех органах и частях растения. К необычным липидам
относятся также цианолипиды, при гидролизе которых выделяется синильная
кислота.
Серосодержащие вторичные метаболиты. К ним относятся
прежде всего ти-огликозиды (S-гликозиды).
Наиболее известны гликозиды горчичных масел (глюкозинолаты). Эти гликозиды
характерны для растений семейства крестоцветных. Они обладают сильным
антимикробным действием и обуславливают острый или жгучий вкус горчицы, хрена,
редьки. Механизм действия глюкозинолатов весьма сходен с действием цианогенных
гликозидов: после отщепления сахара мирозиназой образуются изотиоцианаты,
обуславливающие жгучий вкус и раздражающее действие. Другую группу
серосодержащих вторичных метаболитов составляют аллицины чеснока и лука,
которые синтезируются из цистеина. Они также ответственны за жгучий вкус и
антимикробные свойства этих растений.
1.6 Биохимия вторичного метаболизма
Пути биосинтеза вторичных метаболитов
Пути синтеза большинства вторичных метаболитов
установлены достаточно хорошо. В настоящее время интенсивно изучается
энзимология вторичного метаболизма. На основании имеющейся информации можно
сформулировать некоторые закономерности биосинтеза этих соединений.
Предшественниками синтеза служит относительно небольшое количество первичных
метаболитов. Многие группы вторичных метаболитов могут синтезироваться
несколькими путями. Часто этапы синтеза дублированы в разных компартментах
клетки (например, пластиды - цитозоль). Синтез четко спланирован и
обслуживается набором специальных ферментов, в большинстве случаев весьма
специфичных.
•Биосинтез алкалоидов. Образование этих веществ тесно
связано с общим обменом азота клетки. Для большинства алкалоидов показано, что
схемы их синтеза унифицированы, т. е. имеют сходную последовательность реакций.
В процессе биосинтеза молекула аминокислоты практически полностью включается в
структуру алкалоида. Синтез алкалоидов разных групп включает одинаковые типы
реакций: декарбоксилирование, окислительное дезаминирование, альдольная
конденсация, но для каждой группы алкалоидов эти реакции осуществляют
«собственные» ферменты. На первом этапе синтеза происходит декарбоксилирование
аминокислоты при участии соответствующей декарбоксилазы. Образовавшиеся
биогенные амины подвергаются окислительному дезаминированию с участием
аминооксидаз. Полученные в результате аминоальдегиды или аминокетоны в результате
серии последовательных реакций образуют ключевые гетероциклические соединения.
Затем происходит модификация базовой структуры с участием разнообразных реакций
- гидроксилирования, метилирования и др. В формировании окончательной структуры
алкалоида могут принимать участие дополнительные углеродные единицы, например
ацетат (в виде ацетил-СоА) или монотерпеновая единица (для сложных индольных
алкалоидов). В зависимости от сложности алкалоида его биосинтез включает от
трех-четырех до десяти-пятнадцати реакций.
Для целого ряда алкалоидов не только установлена схема
синтеза, но охарактеризованы и выделены ферменты. Оказалось, что некоторые
ферменты синтеза не очень специфичны (в качестве субстратов могут использовать
различные соединения), однако в цепочке синтеза обязательно присутствуют
высокоспецифичные ферменты, которые используют только один субстрат (или ряд
очень близких субстратов) и выполняют очень специфичную реакцию.
Например, при синтезе изохинолинов гидроксилирование
базовой структуры по каждому положению выполняют разные ферменты. По мере
продвижения к заключительным этапам синтеза сродство ферментов к субстрату
обычно повышается: например, для ряда ферментов синтеза бербериновых алкалоидов
Кт составляет менее 1 мкМ. В качестве примера на рис. 5 представлена схема
синтеза изохинолиновых алкалоидов.
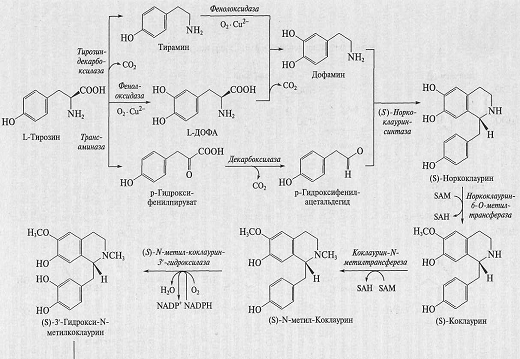
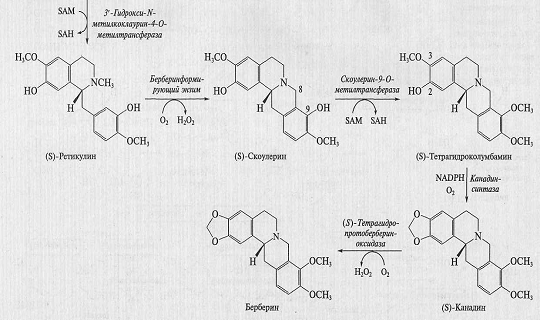
Рис. 5. Схема биосинтеза изохинолиновых алкалоидов
•Биосинтез изопреноидов. Если при синтезе алкалоидов
сходная цепочка превращений используется для различных исходных соединений
(аминокислот), то синтез колоссального числа изопреноидов происходит из
единственного предшественника - изопентенилдифосфата (ИПДФ). Под действием
фермента изопентенилдифосфатизомеразы, которая сдвигает двойную связь, ИПДФ
превращается в диметилаллилдифосфат (ДМАДФ). Далее ИПДФ присоединяется к ДМАДФ
по двойной связи и образуется С10-соединение - геранилдифосфат.
Он служит источником всех монотерпеноидов.
Затем к геранилдифосфату присоединяется еще один ИПДФ
и образуется С15-соединение фарнезилдифосфат - исходное вещество для синтеза
сесквитерпеноидов. Далее фарнезилдифосфат может либо присоединить еще одну
молекулу ИПДФ с образованием геранилгеранилдифосфата (С20-соединение - источник
дитерпеноидов), либо димеризоваться с образованием сквалена (С30-соединение -
исходное соединение для всех тритерпеноидов). Наконец, геранилгеранилдифосфат
может димеризоваться с образованием фитоина - С40-соединения, источник
тетратерпеноидов. Кроме того, к геранилгеранилдифосфату может последовательно
присоединиться большое количество ИПДФ, формируя в конечном итоге
полиизопреноиды - каучук и гуттаперчу. В результате описанных реакций
образуется полный гомологический ряд С5-соединений разной длины. Далее эти
алифатические молекулы могут «свернуться» в циклические структуры, причем
количество циклов, их размер и типы сочленения могут быть самыми разными. На
рис. 9.13 представлена общая схема синтеза изопреноидов.
Синтез базовых изопреноидных структур осуществляют
всего два типа ферментов - пренилтрансферазы, которые «наращивают» длину
изопреноидов, и циклазы, которые формируют соответствующий циклический скелет
молекулы. При этом каждый тип структуры формирует специфическая циклаза. Так
как типов циклических структур изопреноидов довольно много, то и количество
циклаз должно быть внушительным. К настоящему времени их известно более ста.
После формирования базовой структуры (или одновременно с этим), происходит ее
модификация и «оснащение» функциональными группами.
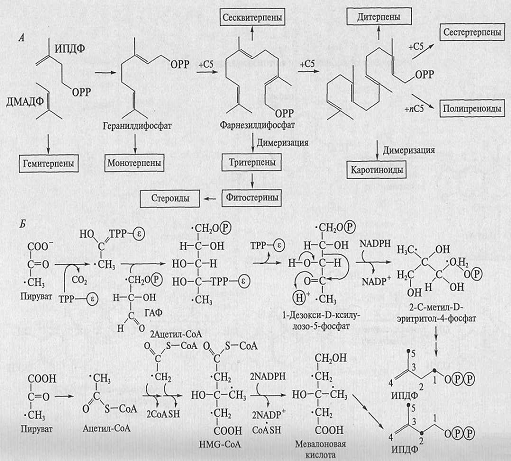
Рис. 6. Общая схема биосинтеза изопреноидов (А) и два
пути синтеза изопентенилдифосфата (Б) в растениях
Точками показаны меченые атомы в исходных соединениях
и в образовавшихся ИПДФ.
Таким образом, биосинтез изопреноидов можно представить
себе как своеобразный биохимический «моделист-конструктор». Вначале из
унфицированых С5-модулей изготовляются гибкие линейные конструкции разной
длины. Они представляют собой практически идеальный материал для
«биохимического конструирования» и формирования множества вариантов циклических
структур.
Растения используют оба варианта образования
изопреноидов: в цитозоле синтез идет по классическому пути, а в пластидах - по
альтернативному. При этом возможно не только дублирование синтеза изопреноидов
в разных ком-партментах клетки, но и разделение по типу синтезируемых структур.
Тритерпеноиды (включая стероиды) синтезируются в цитозоле из мевалоната, тогда
как дитерпеноиды (включая фитол хлорофилла) и тетратерпеноиды (прежде всего
каротиноиды) - в пластидах по альтернативному пути. Моно- и сесквитерпены,
вероятно, могут образовываться разными вариантами в зависимости от структуры
молекулы и вида растения.
•Биосинтез фенольных соединений. К настоящему времени
известно два пути образования фенольных соединений - шикиматный (через
шикимовую кислоту) и ацетатно-малонатный. Основной путь шикиматный, это
практически единственный способ формирования ароматического кольца. В качестве
исходных соединений для синтеза выступают фосфоенолпируват (ФЕП) и эритрозо-4-фосфат.
При их конденсации возникает семиуглеродная кислота
(2-кето-3-дезокси-7-фосфоарабогептановая), которая затем циклизуется в
5-дегидрохин-ную кислоту. Из дегидрохинной кислоты образуется шикимовая
кислота, которая имеет шестичленное кольцо, одну двойную связь, и ее легко
перевести в соединения ароматического ряда. Из шикимовой кислоты возможно
образование оксибензойных кислот - n-оксибензойной, протокатеховой, галловой. Однако основной путь
использования шикимовой кислоты - образование через префеновую кислоту
ароматических аминокислот фенилаланина и тирозина. Фенилаланин (возможно, в
ряде случаев и тирозин) - основной предшественник синтеза фенольных соединений.
Дезаминирование фенилаланина осуществляет фермент фенилаланинаммиаклиаза (ФАЛ).
В результате образуется коричная кислота, гидроксилирование которой приводит к
образованию пара-кумаровой (оксикоричной) кислоты. После дополнительного
гидроксилирования и последующего метилирования из нее образуются остальные
оксикоричные кислоты.
Оксикоричные кислоты представляют центральное звено
синтеза всех фенольных соединений клетки. Opтo-кумаровая
кислота является предшественником кумаринов. После ряда реакций укорочения
алифатической части молекулы образуются С6-С2- и С6-С1 - соединения - это
второй путь образования оксибензойных кислот (первый - непосредственно из
шикимовой кислоты). Оксикоричные кислоты могут образовывать различные
конъюгаты, прежде всего с сахарами, однако основная масса оксикоричных кислот
активируется путем взаимодействия с СоА. Два магистральных пути использования
СоА-эфиров оксикоричных кислот - синтез лигнинов и синтез флавоноидов. Для
синтеза лигнинов СоА-эфиры оксикоричных кислот восстанавливаются до спиртов,
которые выступают в качестве мономеров синтеза. При синтезе флавоноидов СоА-производное
оксикоричной кислоты взаимодействует с тремя молекулами малонил-СоА с
образованием халкона. Реакцию катализирует фермент халконсинтаза.
Образовавшийся халкон легко преобразуется в флаванон. Из флаванонов за счет
реакций гидроксилирования, окисления - восстановления образуются другие группы
флавоноидов. Затем может происходить модификация молекулы - гликозилирование,
метоксилирование и др.
Ацетатно-малонатный путь синтеза фенольных соединений
широко распространен у грибов, лишайников и микроорганизмов. У растений он
является минорным. При синтезе соединений по этому пути ацетил-СоА
карбоксилируется с образованием малонилацетил-СоА. Затем происходит каскад
аналогичных реакций, в результате наращивается углеродная цепь и возникает
поли-β-кетометиленовая цепочка. Циклизация
поликетидной цепи приводит к образованию различных фенольных соединений. Таким
способом синтезируются флороглюцин и его производные, некоторые антрахиноны. В
структуре флавоноидов кольцо В формируется по шикиматному пути (из оксикоричной
кислоты), тогда как кольцо А - по ацетатно-малонатному.
В клетке работают два шикиматных пути синтеза
флавоноидов - один в пластидах, другой в цитозоле. В этих компартментах
находится полный набор изоферментов шикиматного пути, а также ферментов фенольного
метаболизма, в том числе ФАЛ и халконсинтазы. Таким образом, в растительной
клетке существует две параллельные цепочки синтеза фенольных соединений
(аналогично изопреноидам).
•Синтез минорных классов вторичных соединений.
Образование этих веществ также изучено достаточно полно. Для многих
азотсодержащих соединений исходными веществами являются аминокислоты. Например,
синтез цианогенных гликозидов начинается с декарбоксилирования соответствующей
аминокислоты, затем последовательно формируются альдоксим, нитрил и α-гидроксинитрил. На последнем этапе
синтеза образуется цианогенный гликозид за счет гликозилирования α-гидроксинитрила при помощи
УДФ-глюкозы. Синтез обычно осуществляет комплекс ферментов: например, для
дуррина этот комплекс состоит из четырех ферментов. Гены ферментов клонированы.
Трансгенное по двум генам растение арабидопсиса приобрело способность к синтезу
цианогенных гликозидов. Синтез беталаинов начинается от тирозина, который
гидроксилируется и образуется диоксифенилаланин (ДОФА). ДОФА служит источником
для двух фрагментов молекулы бетацианинов - беталамовой кислоты и цикло-ДОФА.
Объединение этих двух соединений приводит к формированию бетацианинов. При
синтезе бетаксантинов беталамовая кислота конденсируется с пролином.
Серосодержащие вторичные метаболиты обычно синтезируются из серосодержащих
аминокислот.
2. Методы исследования
Большое практическое применение имеет броматометрическое определение
фенола. Определение фенола основано на том, что в анализируемый раствор
вводится избыток бромат-бромидной смеси, которая в кислой среде выделяет
свободный бром. Образующийся бром реагирует с фенолом:
С6Н5ОН + ЗВг2 С6Н2Вг3ОН + 3HBr
При добавлении к этому раствору иодида калия избыточный, не
прореагировавший бром окисляет иодид до йода, который титруют стандартным
раствором тиосульфата натрия:
Br2 + 2I = 2Br + I2+ 2S2O = 2I + S4O
Реактивы
. Тиосульфат натрия 0,02 М раствор (или стандартизированный)*
. Бромат-бромидная смесь.
. Серная кислота 1М раствор
. Крахмал, 0,5% раствор
. Иодид калия, KI (к)
Посуда:
. Колба мерная 500 мл
. Колба коническая 250-300 мл
. Мерный цилиндр 20 мл
. Пипетки 20 и 25 мл
. Бюретка 25 мл
Выполнение работы
Бромат-бромидный раствор можно приготовить по навеске: 0,334 г. KBrO3 и
1,2 KBr растворяют в дистиллированной воде и доводят до метки в мерной колбе
вместимостью 500 мл, в этом случае концентрация приблизительно равна 0,024 М.
Для получения такой же концентрации раствор можно приготовить из фиксанала
KBrO3 - KBr 0,1 Н но в этом случае содержимое запаянной ампулы нужно растворить
в 4 л дистиллированной воды.
Для анализа отбирают аликвоту (10 мл) раствора, содержащего 0,02-0,4 г/л
фенола**, пипеткой в коническую колбу для титрования. Прибавляют 12 мл
(пипеткой) бромат-бромидной смеси, 10 мл 1М раствора серной кислоты, закрывают
пробкой и оставляют на 30 мин. Затем прибавляют 1 г иодида калия, взвешенного
на технических весах, и снова закрывают пробкой. Через 5 мин титруют
выделившийся йод раствором тиосульфата натрия, прибавляя в конце титрования,
когда окраска раствора станет светло-желтой, 2-3 мл раствора крахмала.
Титрование продолжают до исчезновения синей окраски раствора. Проводят три
титрования и рассчитывают средний объем V1 из сходящихся результатов.
3. Практическое задание
. К вторичным метаболитам относятся антибиотики, алкалоиды, гормоны роста
растений и токсины.
2. Биосинтез белка происходит в рибосомах.
3. Фотосинтез происходит в листе, в клетках листа, в хлоропластах,
которые содержат зеленый пигмент хлорофилл.
4. Единицей фотосинтеза является квантосома.
. Анаэробная фаза дыхания - последовательность реакций, которая
называется гликолиз.
. В процессе гликолиза происходит преобразование молекулы гексозы до двух
молекул пировиноградной кислоты:
С6Н12О6→2С3Н4О2 + 2H2.
Этот окислительный процесс может протекать в анаэробных условиях.
Заключение
В результате выполненной курсовой работы я узнала, что
такое вторичные метаболиты, а также особенности вторичных метаболитов, к
которым относятся: относительная низкая молекулярная масса (исключением
являются, например, высокомолекулярные полиизопреноиды: каучук, гуттаперча,
чикль); не обязательное присутствие в каждом организме (некоторые вторичные
метаболиты широко распространены, так например многие фенилпропаноиды
встречаются практически во всех растениях); как правило, являются
биологически-активными веществами; синтезируются из первичных метаболитов.
Указанные признаки не являются обязательными, однако в
совокупности достаточно чётко очерчивают круг вторичных метаболитов.
У растений вторичные метаболиты участвуют во взаимодействии растения с
окружающей средой, защитных реакциях (например, яды). К ним относятся следующие
классы: алкалоиды, изопреноиды, фенольные соединения, минорные соединения
(насчитывают 10-12 групп, в частности: небелковые аминокислоты, биогенные
амины, цианогенные гликозиды, гликозиды горчичных масел (изотиоцианаты),
беталаины, цианолипиды, ацетогенины, ацетиленовые производные, аллицины,
ацетофеноны, тиофены, необычные жирные кислоты, и пр.)
синтез
фенольный алкалоиды биохимический
Список использованной литературы
1. «Микробиология:
словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.
2. Лекарственное
сырьё растительного и животного происхождения. Фармакогнозия: учебное
пособие/под ред. Г.П.Яковлева. СПб.: СпецЛит, 2006. 845 с.
. Шабарова
З. А., Богданов А. А., Золотухин А. С. Химические основы генетической
инженерии. - М.: Изд-во МГУ, 2004, 224 с.
4. Чебышев
Н.В., Гринева Г.Г., Кобзарь М.В., Гулянков С.И. Биология.М., 2000