Биологическая характеристика Escherichia coli
Курсовая работа
Биологическая характеристика Escherichia coli
Введение
Эшерихиоз (escherichiosis)
(колибактериоз) - Протекающая в острой форме бактериальная инфекционная болезнь
молодняка сельскохозяйственных животных, включая птиц (в основном до
2-недельного возраста) проявляющаяся профузным поносом, признаками тяжелой
интоксикации и обезвоживания организма.
Протекает в энтеритной, септической
и энтеротоксемической формах. Установлено более 150 типов. У домашних животных
и человека известно более десяти серотипов кишечной палочки, вызывающей
колибактериоз.
Общепризнанно, что кишечная палочка
обитает в кишечнике животных. Как правило, она не вызывает заболевания.
Материалом для выделения кишечной
палочки являются объекты внешней среды (вода, почва, смывы с разных предметов),
при заболеваниях - испражнения, рвотные массы, моча, дуоденальное содержимое
или кровь, а также пищевые продукты, подозреваемые как источник заражения.
Материал засевают на дифференциально-диагностические среды с последующим
выделением чистой культуры E.coli. Идентификацию проводят путём изучения морфологических,
биохимических и антигенных признаков. Заключительным этапом является
определение биовара кишечной палочки, особенно серогруппы и серовара.
1.
Историческая справка
кишечный палочка патогенность заболевание
Кишечные палочки
(Бактерии группы кишечных палочек) В
1885 г. Эшерих открыл микроорганизм, который получил название Escherichia coli
(кишечная палочка). Этот микроорганизм является постоянным обитателем толстого отдела
кишечника человека и животных. Кроме Е. coli, в группу кишечных бактерий входят
эпифитные и фитопатогенные виды, а также виды, экология (происхождение) которых
пока не установлена. К бактериям группы кишечных палочек относят роды
Escherichia (типичный представитель Е. coli), Citrobacter (типичный
представитель Citr. coli citrovorum), Enterobacter (типичный представитель Ent.
aerogenes), которые объединены в одно семейство Enterobacteriaceae благодаря
общности морфологических и культуральных свойств. Они характеризуются
различными ферментативными свойствами и антигенной структурой.
Впервые заболевание у телят
установлено в 1891 году К. Иейсеном в Дании. В специальной литературе известно
много синонимов, под которыми описывалась патология: колибациллез, колисепсис,
колиэнтерит, коли-диарея, «белый понос телят», токсическая диспепсия. Патология
имеет глобальное распространение, сопровождается большими убытками. В Германии
заболеваемость колибактериозом телят в тридцатые годы достигала 42-48%., среди
жеребят -19,7%. Во Франции в отдельные годы на некоторых фермах летальность
животных составляла 40 - 55%. В США потери от колибактериоза определяются
цифрой в 10%, к обшей заболеваемости телят. Заболевание молодняка с разными
показателями наблюдаются во всех странах Европы, Азии и т.д. (Я.Е. Коляков,
1970).
В России заболевание регистрируется
во всех регионах. В хозяйствах Амурской области в 1946-1969 годы среди телят,
павших в первый день жизни, количество положительных лабораторных заключений на
колибактериоз составляло 28,7%, к числу исследованных проб, среди телят в
возрасте. 2-3 дней - 34%., 4-7 дней - 22,5%., 8-14 дней - 19,4%., 15-21 день -
14,3%. Исследовано 3829 проб патологического материала (Ю.П. Мозжухин, 1971). В
Приморье за 1967-1970 годы на колибактериоз проведено 746 экспертиз, из которых
от 38%, до 55%, каждый год были положительными (Е.А. Кирьянов, 1974).
Летальность при отдельных вспышках болезни среди телят достигала 46,6%., а в
среднем за год - 32%. (Е.А. Кирьянов, 1977, 1979). В Хабаровском крае при
исследовании 258 проб, обработанных в 1972-1975 годы, число положительных
подтверждений на колибактериоз телят составило 12,4%. Случаев колибактериоза
среди поросят в эти годы не диагностировано (Е.А. Кирьянов, М.Ф. Соснин, 1978).
На Сахалине в 1972-1976 годы количество положительных случаев диагностики
колибактериоза телят находилось в пределах 2.1 - 46.2%. (Е.А. Кирьянов, В.Г.
Курдюков и др., 1981). В Амурской области в 1972-1976, годы на колибактериоз,
телят исследовано 1696 объектов, частота положительных результатов по годам
колебалась в пределах 15,4-27,9%., среди поросят - 17,3-35%. Исследовано 287
трупов (Е.А. Кирьянов, И.Ф. Тютрин, 1981). Колибактериоз в зоне Дальнего
Востока в анализируемые годы также регистрировался среди норок, птиц, кроликов.
2. Биологическая
характеристика
.1 Морфологические
свойства
E.coli - это мелкие (длиной 2 - 3 мкм., шириной 0,5 - 0,7 мкм.)
грамотрицательные палочки с закруглёнными концами. Ультраструктура сходна с
другими грамотрицательными бактериями. В мазках они располагаются беспорядочно,
не образуют спор, перетрихи (жгутики отходят по периметру бактерии). Кишечные
палочки подвижны. Некоторые штаммы имеют микрокапсулу, пили.
Кишечная палочка не образует спор.
2.2 Культуральные
свойства
Температурный оптимум для роста
эшерихий 37°С, pH 7,2…7,4, факультативный анаэроб к питательным средам неприхотлив.
При посеве на мясопептонный бульон
(МПБ), мясопептонный агар (МПА):
На МПБ дают обильный рост при
значительном помутнении среды; осадок небольшой, сероватого цвета,
легкоразбивающийся. Образуют пристеночное кольцо, пленка на поверхности бульона
обычно отсутствует.
На МПА колонии прозрачные с
серовато-голубым отливом, легко сливающиеся между собой (см. Приложение 2).
При посеве на дифференциальные
среды:
на среде Эндо образуют плоские
красные колонии средней величины с темным металлическим блеском (Е. coli). (см.
Приложение 3)
на среде Левина кишечные палочки
дают окрашенные в цвет индикатора колонии, так как способны разлагать лактозу,
входящую в эти среды.
на средах Хисса кишечная палочка
может образовывать газ. На селективно-дифференциальных средах колонии принимают
цвет, соответствующий окраске среды.
на среде Плоскирева - соответственно
красные с жёлтым оттенком или бесцветные.
на кровяном агаре (КА) могут давать
полный гемолиз.
2.3 Биохимические
свойства
Кишечная палочка продуцирует
многочисленные сахаролитические ферменты, быстро ферментирует глюкозу и другие
углеводы, чаще всего с кислото- и газообразобразованием. Почти все биотипы
кишечной палочки постоянно ферментируют манитол, арабинозу, мальтозу с
образованием кислоты; свыше 90% штаммов - лактозу, сорбит; непостоянно -
сахарозу, раффинозу, рамнозу, ксилозу, дульцит, салицин; как правило, не
ферментируют адонит и инозит. E.coli не утилизирует цитрат аммония, малонат натрия, не растёт на сраде
с цианистым калием, не редуцирует нитраты и нитриты, не расщепляет мочевину, не
разжижает желатину, большинство штаммов образует индол и не выделяет H2S. Кишечная палочка даёт положительню
реакцию с метилротом и отрицательную реакцию Фогеса-Проскауэра: (Для постановки
реакции Фогес-Проскауэра к 2,5 куб. см культуры бактерий добавляют в начале 1
куб. см 6%-ного спиртового раствора альфа-нафтола, а затем 0,4 куб. см 40%-ного
водного раствора КОН, пробирку тщательно встряхивают и спустя 3-5 мин.
учитывают результаты. При наличии в культуре ацетилметилкарбинола она
окрашивается в розовый цвет - положительная реакция, окраска культуры в желтый
цвет свидетельствует об отрицательной реакции, при сомнительной реакции культура
окрашивается в светло-оранжевый цвет.). E.coli не синтезирует ферменты
цитохромоксидазу и фенилаланиндезаминазу, непостоянно декарбоксилирует лизин,
орнитин и дегидролизует аргинин. Свертывают молоко.
2.4 Антигенная структура
По антигенным, а главное, токсиногенным
свойствам, различают два варианта E.coli:
условно-патогенные кишечные палочки;
патогенные палочки, вызывающие
диарею.
Кишечная палочка содержит О-, К- и
Н-антигены. О(соматические) - антигены у E.coli, связаны с
липополисахаридом (ЛПС) клеточной стенки. Иммунохимическая специфичность
О-антигена определяется составом гексасахаридов в повторяющихся звеньях
концевого участка полисахаридной цепи, которая другим концом связана через
2-кето-3-дезоксиоктонат (КДО) с липидом А. Например, структура ЛПС одного из
штаммов кишечной палочки представлена следующим образом:
Количество сахаров в одном и том же
концевом звене, так же как и число детерминантных звеньев у разных серогрупп
эшерихий, неодинаковое. Специфичность О-антигенов кишечной палочки обычно определяется
в реакции агглютинации с О- или ОВ-агглютинирующими сыворотками на предметном
стекле, реже другими методами.
К-антигенами обозначают
поверхностные антигены, которые связаны с капсулой и с ЛПС кишечной палочки. Их
подразделяют на A-, B- и L-антигены, отличающиеся друг от друга чувствительностью к высокой
температуре и химическим агентам. Наиболее высокой устойчивостью к нагреванию
(до 100°С в течение 2½ час), спирту и 1 н. раствору HCl обладает А-антиген,
наименее устойчив L-антиген. У большинства кишечных палочек К-антигены представляют
собой кислые полисахариды, содержащие уроновые кислоты. Некоторые К-антигены
содержат только белок. E.coli, имеющие К-антигены, не агглютинируются гомологичной
О-коли-сывороткой. Эта особенность присуща живым культурам и утрачивается после
их кипячения или автоклавирования. Наличие К-антигенов устанавливается также в
реакции адсорбции агглютининов и при иммуноэлектрофоретическом исследовании.
H-жгутиквые, или флагеллярные, антигены присущи активно-одвижным
штаммам. Они связаны с белком-флагеллином и определяют иповую иммунохимическую
специфичность кишечной палочки. H-антигены трмолабильны. Они полностью разрушаются при кипячении в
течение 2½
часов.
У E.coli описано около 170
О-антигенов, 97 К-антигенов и 50 Н-антигенов. Штаммы кишечной палочки,
снабжённые ресничками, содержат белковые реснитчатые антигены. Их обнаруживают
в реакции гемагглютинации.
Кишечные палочки обозначаются по
антигеннм формулам: на первом месте ставится номер О-антигена, на втором -
К-антигена, на третьем - Н-антигена. Тип К-антигена указывается в скобках.
Например, К(В) или К(L). Номера О-, К- и Н-антигенов разделяются двоеточиями. По
антигенным формулам устанавливается принадлежность исследованного штамма к
определённой серологической группе.
Эпизоотические вспышки
колибактериоза наиболее часто вызывают патогенные штмпы эшерихий следующих
серогрупп:
у телят - 08, 09, 015, 020, 026,
035, 078, 086, 0101, 0115, 0117, 0119, 0141, реже 02, 033, 041, 055, 0103,
0127, 0137;
у поросят - 06, 026, 033, 0101,
0136, 0139, 0141, 0142, 0149, 0152, 0157;
у ягнят - 04, 08, 09, 015, 020, 028,
035, 041, 078, 0101, 0137;
у птиц - 01, 02, 08, 015, 018,
026,055, 078, 0111, 0113, 0128, 0141.
2.5 Плазмиды
Кишечные палочки могут содержать
различные плазмиды: профаг, фактор фертильности, колициногенный фактор, фактор
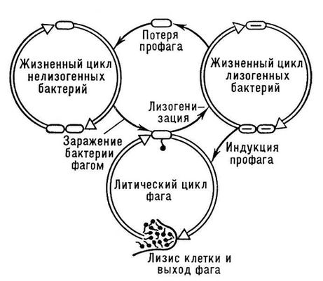
резистентности, антигенный фактор, энтеротоксигенный фактор и другие. Профаги
могут вызывать изменения отдельных признаков кишечной палочки, например,
О-антигена (лизогения (от греч. lýsis - разложение, распад и…geneia - происхождение, создание),
генетически обусловленная способность бактерий лизироваться с выделением
бактериофага через ряд поколений после непосредственного заражения им. Теория
лизогении разработана в 1950 французскими учёными А. Львовым и А. Гутман,
показавшими, что лизогенное состояние связано с присутствием в клетках бактерий
потенциально инфекционной структуры - профага. В каждом поколении лизогенных
бактерий подвергается лизису очень небольшая часть клеток (~1 клетка на
миллион) с освобождением от 70 до 150 частиц так называемого умеренного фага.
Частота перехода профага в инфекционное состояние (индукция профага) может быть
увеличена рядом агентов (например, ультрафиолетовыми лучами). После заражения
бактериальной клетки умеренным фагом процесс инфекции может развиваться по
одному из двух направлений: по пути литического цикла, который так же, как и
при заражении бактерий вирулентными фагами, заканчивается лизисом клеток и
выходом потомства фага в окружающую среду; по пути лизогенизации, когда в
результате биосинтетических процессов в клетке вырабатывается иммунитет к
инфицирующему фагу, фаговая ДНК включается в ДНК бактерии и в дальнейшем
реплицируется вместе с ней как её составная часть (профаг), а бактерия выживает
и становится лизогенной. Судьба клетки решается на первых этапах инфекции и
зависит главным образом от времени формирования иммунитета. Если состояние
иммунитета наступает раньше, чем развитие инфекции достигнет стадии, необратимо
ведущей к лизису, то может щсуществиться лизогенизация. В геноме бактерий могут
содержаться одновременно профаги нескольких разных фагов (пол и лизогения). В
этом случае клетка обладает иммунитетом в отношении всех этих фагов. В
результате лизогенизации может произойти изменение некоторых свойств бактериальной
клетки (так называемая лизогенная конверсия), обусловленное приобретением
бактерией новой генетической информации. Искусственно полученные лизогенные
бактерии по своим свойствам не отличаются от лизогенных бактерий, найденных в
естественных условиях. У небольшой части потомства лизогенной клетки происходит
«исцеление» - потеря профага. Утратившие профаг клетки дают начало нелизогенным
линиям. Частота этого процесса может быть увеличена, например, действием
ультрафиолетовых лучей. Таким образом, лизогения. - сложная форма вирусной
инфекции у бактерий, при которой от момента заражения бактерий фагом до лизиса
клетки проходит большое число клеточных поколений).
F-плазмиды определяют половую полярность и вызывают образование
половых ресничек (sex-pili). Col-плазмиды контролируют образование колицинов, подавляющих рост
филогенетически родственных бактерий. R-плазмиды ответственны за резистентность E.coli к антибиотикам.
Плазмида К88 контролирует синтез одноимённого антигена и нитей, определяющих
адгезивные свойства энтеропатогенных и энтеротоксигенных кишечных палочек;
плазмиды могут быть двух типов. Один из них определяет синтез термолабильного,
другой - термолабильного и термостабильного энтеротоксина.
2.6 Токсинообразование
Кишечная палочка образует
эндотоксин, связанный с ЛПС (липополисахаридом), который является частью
О-антигена. Биологическая активность эндотоксина выражается неодинаково у
разных серогрупп кишечной палочки. Токсические свойства эндотоксина определяются
целой молекулой ЛПС, поскольку один липид или полисахарид малотоксичны.
Эндотоксин поражает свёртывающую систему крови, вызывает феномен Щвартцмана и
другие явления, обладает пирогенными, адъювантными, протективными и митогенными
свойствами. В небольших дозах стимулирует, а в больших угнетает фагоцитарную
реакцию.
Многие серогруппы E.coli продуцируют
эндотоксины. Полагают, что одни серогруппы кишечной палочки вызывают
холероподобную диарею у людей, другие только у животных (поросят, телят).
E.coli продуцируют два типа энтеротоксина. Термостабильный энтеротоксин
инактивируется только после кипячения в течение 30 мин, медленно диализируется
через целлофан, сохраняет активность при кислых значениях рН и после обработки
трипсином и проназой. Молекулярный вес 103-104.
Антигенными свойствами не обладает. Термолабильный энтеротоксин инактивируется
после 30-минутного прогревания при 60°С, рН 4,0-5,0, под действием проназы и не
диализируется. Антигенная специфичность термолабильных энтеротоксинов,
продуцируемых разными серогруппами, и холерогена одинакова. Они стимулируют
активность аденилатциклазы и вызывают накопление циклического
аденозинмонофосфата (цАМФ), что приводит к нарушению секреции и развитию острой
диареи
2.7 Резистентность
Устойчивость E.coli к воздействию внешних факторов - обычная для аспорогенных
бактерий. Во внешней среде (воде, почве) она выживает в зависимости от
конкретных условий в течение нескольких месяцев. При нагревании во взвесях
погибает при 55° через час, при 60° - через 15 мин, в 1% растворе фенола -
через 10 мин, в растворе сулемы 1:1000 - через 2 мин. Кишечная палочка обладает
избирательной чувствительностью к бриллиантовому зелёному и солям тетратионовой
кислоты. На этом основано применение ряда селективных сред. Многие штаммы E.coli высокочувствительны к
мономицину, канамицину, гентамицину.
2.8 Патогенность
Кишечные палочки - комменсалы
толстого кишечника - могут вызвать гнойно-воспалительные процессы в органах и
тканях при резком снижении резистентности организма.
Вирулентность кишечной палочки
проявляется в адгезивности кишечной палочки, то есть прилипании к ворсинкам
эпителия кишки, размножения в просвете тонкой и толстой кишки, пенетрации в
клетки эпителия и во внутриклеточном размножении, а также в подавлении
фагоцитарной активности макрофагов и полиморфно-ядерных лейкоцитов. Кишечные
палочки - возбудители колиэнтеритов у молодняка и холероподобных заболеваний у
взрослых животных - размножаются на поверхности эпителиальных клеток кишки.
Кишечные палочки - возбудители дизентериеподобных заболеваний - проникают в
клетки эпителия и размножаются в них. Проявление вирулентности кишечной палочки
зависит от дозы бактерий, проникших в кишечник. Вирулентность кишечной палочки
определяется в тканевых культурах, опытах на лабораторных животных при
воспроизведении экспериментальных колиэнтеритов, пневмонии и других процессов.
Пенетрационная способность устанавливается кератоконъюнктивальной пробой Шереня
путём введения культуры E.coli на конъюнктиву глаза морской свинки.
E.coli может причинять значительный вред животному. Штаммы, обитающие в
толстой кишке и являющиеся условно-патогенными, могут попасть за пределы
желудочно-кишечного тракта и при снижении иммунитета и их накопления стать
причиной различных неспецифических гнойно-воспалительных заболеваний (циститов,
холециститов, коли-сепсиса и других). Такие болезни называются парентеральными
эшерихиозами.
Диареегенные штаммы E.coli, которые попадают в
организме извне, могут вызывать вспышки энтеральных (эпидемических)
эшерихиозов.
Чаще всего от эпидемических
эшерихиоза страдают новорожденные животные, у которых иммунная система ещё
полностью не сформировалась; у них есть только IgG, полученные от матери
через плаценту (а от грамотрицательных бактерий защищают IgM); кислотность
желудочного сока низкая; нормальная микрофлора только формируется.
Но диареегенные эшерихии способны
поражать животных и более старшего возраста, а также взрослых. Причём эшерихиоз
может протекать, например, по типу холеры (энтеротоксигенные штаммы),
дизентерии (энтероинвазивные штаммы), геморрагического колита
(энтерогеморрагические штаммы). Иногда кишечные палочки вызывают колисепсис,
перитонит, эндотоксический (септический шок). Кроме того, E.coli может быть причиной
пищевой токсикоинфекции.
2.9 Патогенез
Своеобразие этой инфекции
заключается в том, что возникновение и развитие заболевания определяются
своеобразием защитных реакций у животных раннего возраста и в значительно
меньшей степени зависят от свойств микроба-возбудителя и дозы инфекта. Большое
значение в патогенезе возникновения болезни имеют изменения ферментативной
деятельности желез желудочно-кишечного тракта, возникновение дисбактериоза,
снижение антагонистических, ферментативных и витаминообразующих свойств
микрофлоры кишечника Возникновение токсикоза при колиэнтерите обусловлено рядом
причин. Наряду с колитоксином, выделяемым патогенными серологическими типами
кишечных палочек и продуктами распада микробных тел, из кишечника всасываются
токсические продукты, образующиеся из пищи в связи с нарушениями процессов
переваривания и скорости продвижения ее в просвете кишечника. Эти токсические
продукты и антигены кишечных палочек оказывают воздействие на нервные окончания
и непосредственно на нервные центры, на стенки сосудов и ткани. Второй фактор,
который имеет огромное влияние на клинические проявления токсикоза, - это
изменение массы циркулирующей крови, что обусловлено резким спазмом артериол
при значительном расширении капилляров и мелких вен. Одновременно в связи с
расширением сосудов брюшной полости происходит перераспределение массы крови,
депонирование ее в брюшной полости и создание малокровия в сосудах головного
мозга, кожи, почек. Возрастающая проницаемость сосудов приводит к появлению
отека тканей за счет перехода белков и жидкой части крови в межклеточные
пространства. Нарастанию сгущения крови и ухудшению кровообращения способствуют
также большие потери воды и солей с частым жидким стулом, рвотой,
повышенным испарением с поверхности кожи, а также с дыханием. Все это приводит
к нарушению кровообращения, ухудшению снабжения тканей кислородом, падению
сердечной деятельности и снижению мочеобразования.
Повышение уровня калия у таких
больных кратковременно и быстро сменяется прогрессирующим снижением его уровня
в сыворотке крови на фоне усиленной потери калия с мочой и калом.
Определенную роль в развивающейся
картине токсикоза играет почти постоянное и длительное падение функции коры
надпочечников с уменьшением продукции и секреции глюкокортикоидных гормонов,
регулирующих тонус сосудов, белковый и углеводный обмен, восстанавливающих
нарушенную проницаемость клеток
2.10 Экология
Резервуаром кишечной палочки в
природе является человек, животное толстая кишка которого заселяется разными
биотипами этого микроба.
Количество E.coli в 1 г испражнений
колеблется от нескольких миллионов до 1-3 млрд. особей. На протяжении жизни
происходит многократная смена биоваров кишечной палочки в кишечнике.
Определённую роль в этом процессе играет режим питания, перенесённые инфекции,
лечение химиопрепаратами, антибиотиками и другие факторы.
3. Лабораторная
диагностика
) исследуемая культура +
физиологический раствор;
) культура + нормальная кроличья
сыворотка, разведенная в соотношении 1:10.
Культуры, выросшие на МПА, проверяют
с сыворотками К 88, 987 Р и А 20, культуры со среды Минка - с сыворотками К 99
и F41. При
положитель РА культуры относят к возбудителям эшерихиоза и на этом заканчивают
их дальнейшее изучение. При отсутствии эшерихий с адгезивными антигенами
культуру идентифицируют на основании изучения ферментативных признаков. Для Е. coli характерно расщепление
глюкозы и лактозы с образованием кислоты и газа, выделение индола, отсутствие
уреазы и неспособность утилизировать цитраты.
У культур, идентифицированных как Е.
coli,
устанавливают О-серогрупповую принадлежность как косвенный показатель
патогенности или изучают патогенность в биопробе на белых мышах, цыплятах.
О-Серогруппу эшерихий устанавливают
следующим образом. Культуры, выращенные на скошенном МПА при 37 0С в
течение 18…20 ч, смывают физиологическим раствором, переносят в сухие
стерильные пробирки, прогревают в водяной бане при 100 0С 1 ч для
разрушения поверхностных термолабильных L- и В-антигенов или автоклавируют
при 120°С 2 ч для разрушения термостабильного А-антигена. Прогретую взвесь
бактерий центрифугируют при 2000…3000 мин-1 10…15 мин и осадок
используют в качестве антигена для постановки РА на стекле. Оставшуюся часть
антигена разводят стерильным физиологическим раствором до концентрации клеток 5
• 108/мл и ставят пробирочную РА.
Определение серогрупповой
принадлежности культур начинают с постановки РА на стекле с групповыми
поливалентными сыворотками: на чистое обезжиренное стекло наносят по капле
поливалентные сыворотки. В каждую каплю петлей вносят осажденную
центрифугированием культуру и хорошо смешивают, результат учитывают в течение 3
мин. Положительная реакция характеризуется образованием мелкозернистого агглютината
и просветлением жидкости. При отрицательном результате вся капля остается
мутной.
Антиген, агглютинирующийся одной из
поливалентных групповых сывороток, исследуют в РА на стекле с моновалентными
сыворотками, разведенными в соотношении 1:10 и входящими в состав данной
поливалентной сыворотки. Затем с моновалентной сывороткой, давшей положительную
реакцию, ставят РА в пробирках в объеме 1 мл. Сыворотку разводят
физиологическим раствором 1:25 до титра, указанного на этикетке: сначала
готовят исходное разведение - к 2,4 мл физиологического раствора добавляют 0,1
мл сыворотки, в остальные пробирки разливают по 0,5 мл физиологического
раствора, из исходного разведения переносят 0,5 мл смеси во вторую,
перемешивают, из второй - в третью и т.д., из последней пробирки удаляют 0,5 мл
смеси, из первой - 1,5 мл. Во все пробирки добавляют по 0,5 мл антигена.
Одновременно ставят контроли: 1) антиген + физиологический раствор (для
исключения самоагглютинации); 2) сыворотка, разведенная 1:25 без антигена (для
исключения флокуляции). Все пробирки встряхивают, выдерживают в термостате при
37°С 16… 18 ч и затем при комнатной температуре - 6…8 ч. Читают реакцию при
помощи агглютиноскопа.
Результаты учитывают по
общепринятому методу и обозначают в крестах (++++, +++, ++, +, -).
Для ускоренного метода диагностики и
повышения частоты положительных результатов применяется метод люминесцирующих
антител - модификация метода Кунса и Каштана (Coons, Kaplan, 1950). Мазок
приготовляется либо непосредственно из кала (разведение в 5-10
раз-физиологическим раствором), либо после предварительного подращивания в
течение 3-24 часов на среде Эндо или в жидком бульоне. После обработки
специфической флюоресцирующей сывороткой при положительном результате в
препарате при осмотре в люминесцентном микроскопе обнаруживается яркое свечение
бактериальных клеток.
4. Лечение и
профилактика
Лечение. Все мероприятия проводятся примерно так же, как и при
сальмонеллезе. Сыворотка против кишечной палочки не всегда эффективна ввиду
того, что она не всегда соответствует типу возбудителя колибактериоза. Наиболее
эффективное воздействие оказывает пероральное использование хлортетрациклина
гидрохлорида (по 0,01-0,02 г.), окситетрациклина (по 0,025 г.) или мицерина (по
0,01 г. на 1 кг живой массы).
Для лечения больных животных широко
используют антибиотики (О. 3. Исхаков и др., 1984):
. Ампициллин, Препарат применяют
перорально индивидуально или групповым способом по 20 мг на кг живой массы 3
раза в день;
. Биовит. Антибиотик назначают с
кормом, водой, молозивом 2 раза в сутки в дозе 0,25 г. па кг живой массы. Курс
профилактики -5-20 дней;
. Витатетрин. С лечебной целью дают
индивидуально по 40 мг на кг живой массы с интервалом в 12 ч. Курс лечения 5-7
дней;
. Гентамицин. Антибиотик вводят
внутримышечно в дозе 1,5 мг на кг живой массы в течение 5-7 дней;
. Левомицетин. Назначают перорально
по 20 мг на I кг живой массы;
. Микс-10. Дают с кормом в дозе 3-4
кг на 1 т корма. Курс лечения 7-10 дней;
. Норомандомиксин. Дозы телятам 100
мг на 1 кг живой массы. Антибиотик дают через рот. Курс лечения 7 дней;
. Оримицин. Вводится внутримышечно,
подкожно, внутри-брюшинно или медленно внутривенно в дозе 4-30 мг на кг массы
животного 2 раза в сутки. Объем вводимого раствора 10-20 мл. Курс лечения 5-7
дней;
. Полимиксина М сульфат. Дают внутрь
2-3 раза в день в виде водного раствора по 4 мг на кг живой массы;
. Солвоветин. Вводится внутримышечно
через 12 часов в дозе 0,15 мл на кг живой массы. Инъекции повторяют 5-7 дней;
. Спектам В. Спектам вводят внутрь
за 20-30 минут до выпойки молозива. Доза - 40-60 мг па кг живой массы животного
2 раза в день, 3 дня подряд.
Кроме антибиотиков, при
колибактериозе показано применение сульфаниламидных препаратов:
сельфапиридазина, фтазина, сульфадиметоксина, сульфамонометоксина, энтеро-септола,
интестопана, мексаформа, невигрома и др. (Р.М. Салимов, 1985; В.А. Фортушный,
1985; В.И. Проданов, 1974; В.В. Митюшин, 1985; Л.И. Гершкович, 1966; В.А.
Гу-мул и др., 1985). В последнее время для терапии телят, больных
колибактериозом, предложены лерс и стартин, обеспечивающие лечебный эффект до
88 проц. (Н.И. Овсянов с соавторами, 1984; И.Д. Колесниченко с соавторами,
1985).
Меры борьбы и
профилактика. При установлении
диагноза больных телят изолируют, подвергают лечению. Родившимся телятам
выпаивают но 80-100 мл гипериммунной сыворотки и по 10 мл колипротектана.
Колипротектан дают в течение двух дней до 60 мл. Подстилку и навоз удаляют из
помещения каждый день. Навоз складируют в отведенном месте для биотермического
обеззараживания. Каждодневно также подвергают дезинфекции станки или клетки в
телятнике-профилактории. Дезинфицируют инвентарь, навозные желоба, навозные
проходы.
В секции, где содержатся больные
телята, производят удлинение разрыва между переносными клетками. Обеззараживают
воздушную среду помещения. Персонал, работающий в телятнике, обеспечивается
спецодеждой и обувью. Посещение профилактория, телятника посторонними лицами не
допускается. Центральной задачей борьбы с колибактериозом является создание
нормальных условий кормления и содержания коров, а также обеспечение
выращивания молодняка. В этой связи кормление коров должно осуществляться на
основе биологически полноценных рационов. Животным в обязательном порядке
устраивается активный моцион. Организация активного моциона коров служит мощным
фактором, профилактирующим накопление плазмид, обладающих патогенностью п
лекарственной устойчивостью.
Не меньшее значение в системе
предупреждения распространения патогенных эшерихий имеет правильная организация
отелов и выращивания новорожденных телят. Для отела коров на каждой ферме
оборудуют двухсекционные родильные обеления из расчета 10-15%, мест от общего
поголовья коров. В каждой такой секции сооружается по несколько боксов. Перед
отелом проводят туалет и дезинфекцию кожного покрова коровы. Продезинфицированный
бокс заправляют подстилкой хорошего качества. Отел принимают на чистую
мешковину. Теленку в первый час после рождения с целью профилактики
колибактериоза выпаивают 80-100 мл гипериммунной сыворотки, затем молозиво.
Выращивание родившихся телят
организуют в боксах. Для этого профилакторий делят на 4 изолированные секции с
отдельными входами, автономной вентиляцией и канализацией. В каждой секции
устанавливают индивидуальные клетки. Секции заполняют за 3-4 дня. При
использовании их соблюдают принцип «все пусто - все занято». Содержат в
индивидуальных клетках 10 дней, затем из профилактории их переводят на
групповое содержание. Стараются, чтобы телята в телятнике размещались
посекционно в одной, двух групповых клетках. Освободившиеся в профилактории
клетки и секцию подвергают механической очистке и дезинфекции. После этого в
течение пяти дней секцию не занимают, дают ей «биологический отдых».
В хозяйствах проводят специфическую
профилактику колибактериоза. Для этого глубоко стельных коров и нетелей
вакцинируют гидроокись-алюминиевой, формол-тномерсаловой вакциной против
колибактериоза телят и ягнят. Коров и нетелей иммунизируют за 1,5-2 месяца до
отела внутримышечно двукратно с перерывом в 10-15 дней. Вакцинацией коров
обеспечивается высокая концентрация антител в молозиве, которые защищают
родившегося теленка от влияния патогенных эшерихий. Применение вакцины коровам
снижает заболеваемость телят колибактериозом в 1,5-3 раза, смертность - в 5-10
раз (В.В. Кольчак, 1983).
Кроме этого, с целью профилактики
болезни показано применение телятам сыворотки крови коров, взятой в том же
хозяйстве, а также нормальных глобулинов, колифага. Положительное действие
оказывает выпаивание ацидофильно-бульонной культуры, ацидофильного молока.
Хороший эффект дает применение колибактерина, бифидумбактерина. Бифидумбактерин
назначают по 2-3 дозы 2-3 раза в день в течение 3-4 суток Г.В. Гнатенко с
соавторами (1983), глубоко стельных коров рекомендуют обрабатывать
стрептомицином. Препарат в дозе 500 ЕД на 1 кг живой массы вводится
внутримышечно по 2 раза в день 3 дня подряд. По их данным, заболеваемость
телят, полученных от обработанных коров, снижается до 7,1%., нет летальных
исходов. При отсутствии такой обработки заболеваемость телят достигает 80%.,
летальность - до 61%.
Заключение
Кишечная палочка, Escherichia coli, - мы не раз слышали
это название в телерепортажах об эпидемиях недавних лет в некоторых российских
городах (Иваново, Смоленск, Челябинск). Когда незнакомый с микробиологией
человек слушает радио или смотрит подобные сюжеты по телевидению, у него
создаётся впечатление, что кишечная палочка может принести человеку только
вред, и что от неё нужно избавляться всеми возможными способами.
Но если присмотреться к этому
микроорганизму повнимательнее, то мы увидим, что кишечная палочка может
приносить много пользы человечеству, а её вредные влияния можно существенно
ограничить надлежащими санитарно-гигиеническими мероприятиями и правильным
лечением. Она является очень удобным объектом для приведения генно-инженерных и
других исследований, призванных в будущем помочь в лечении пациентов с
различными заболеваниями.
В нашей стране эти исследования
ведутся не так активно, как в США, из-за недостатка финансирования таких работ,
но если эта проблема будет в ближайшее время преодолена, то у российских учёных
есть все шансы для открытия новейших методик лечения, связанных с
использованием кишечной палочки (немалую роль здесь играет и огромный энтузиазм
отечественных учёных, в том числе и заинтересованность современной научной
молодёжи).
Список использованной
литературы
1. Борисов Л.Б.
Энтеропатогенные кишечные палочки и их фаги, Л., 1976.
2. БСЭ, стр.
366-368.
. Гнатенко Г.В.,
Тупииа Л.Г. Ракицкий Д.Т. Опыт борьбы с колибактериозом телят. - Ветеринария,
Киев: «Урожай», 1983, вып. 57
. Гумул В.А.,
Афанасьев Л.А., Мауланов А. 3. Клиника и лечение колибактериоза телят. -
Вестник с-х науки Казахстана, 1985, №2.
. Кауфман Ф.
Семейство кишечных бактерий, пер. с англ., М., 1959.
. Кирьянов Е.А.
Патогенная микрофлора жвачных животных. - В кн.: Борьба с болезнями
сельскохозяйственных животных в Забайкалье и на Дальнем Востоке. Сб. науч.
трудов Благовещенского СХИ, Благовещенск, 1974.
. Кирьянов Е.А.
Болезни телят и их профилактика в колхозах п совхозах Приморского края. -
Владивосток, 1977.
. Кирьянов Е.А.,
Соснин М.Ф. Эпизоотическая ситуация и проблемы здоровых стад животных в
Приамурье. - Повышение продуктивности сельскохозяйственных животных на Дальнем
Востоке. Сб. науч. тр. Приморского СХИ, вып. 47, Уссурийск, 1978.
. Кирьянов Е.А.,
Галиулина Р.В. Профилактика болезней молодняка сельскохозяйственных животных. -
Владивосток, 1979.
. Кирьянов Е.А.,
Тютрин И.Ф. Этюды по инфекционной патологии сельскохозяйственных животных. -
Воспроизводство стада и ветеринарное здравоохранение в условиях интенсивного
животноводства Дальнего Востока. Сб. науч. тр. Приморского СХИ, Уссурийск,
1981.
. Кольчак В.В.
Колибактериоз телят и меры борьбы с ним в хозяйствах Амурской области (метод,
рекомендации). - Новосибирск: СО ВАСХНИЛ, 1983,
. Коляков Я - Е-,
Гительсон С. С, Каврук Л.С. Колибактериоз телят. - М: «Колос», 1970.
. Лурия С.,
Дарнелл Дж., Общая вирусология, пер. с англ., М., 1970; Равин В.К., Лизогения,
М., 1971.
. Медицинская
микробиология, вирусология и иммунология, под ред. Л.Б. Борисова и А.М.
Смирновой, с. 269-273, М., Медицина, 1994.
. Медицинская
энциклопедия, стр. 252.
. Методы
санитарно-микробиологического исследования объектов окружающей среды, под ред.
Г.И. Сидоренко, М., 1978.
. Микробиология и
иммунология, под ред. А.А. Воробьёва, с. 289-293, М., Медицина, 1999.
. Минкевич И.Е.
Бактерии группы кишечной палочки как санитарно-показательные микроорганизмы,
Л., 1949.
. Мозжухин Ю.П. К
эпизоотологии колибактериозов телят и поросят в Амурской области. - В кн.:
Материалы XIX научной конференции. Благовещенск, 1971
. Овсянов Н.И.,
Овладеева М, А., Наумова К.Н. Препарат лерс при диарее телят. - Земля
сибирская, дальневосточная, 1984, №2
. Острые кишечные
инфекции, под ред. Т.В. Перадзе, с. 73, Л., 1973.
. Поздеев О.К.
Медицинская микробиология, с. 351-357, М., Гэотар-мед, 2002.
. Проданов В.И.
Материалы к изучению желудочно-кишечных заболеваний новорожденных телят. - В
кн.: Профилактика и лечение болезней молодняка сельскохозяйственных животных.
М.: «Колос», 1974
. Салимов Р.М.
Лекарственные препараты при колибак-
териозе. - Земля сибирская, дальневосточная, 1985
. Табачник А.Л.,
Гиршович Е.С., Темпер Р.М. Энтеротоксигенные E.coli, Журн. микр., эпид. и
иммун., №3, с. 31, 1977.
. Фортушный В.А.
Сульфагин при колибактериозе теляг. - Ветеринария, 1985, №9