Оценка агрохимических показателей светло-серой лесной почвы и рекомендации по применению агрохимикатов
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
"ОМСКИЙ
ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ
ИМЕНИ
П. А. СТОЛЫПИНА"
Кафедра
агрохимии
КУРСОВАЯ
РАБОТА
По
АГРОХИМИИ
"Оценка
агрохимических показателей светло-серой лесной почвы и рекомендации по
применению агрохимикатов"
Выполнила:
студентка 32 группы
ф-та агрохимии,
почвоведения и
экологии: Погуляй
И.О.
Руководитель:
Болдышева Е.П.
Омск
- 2014
Оглавление
Введение
1. Агрохимическое обследование почв
и его роль в диагностике питания
. Методы определения и оценка
основных агрохимических показателей почв
.1 Кислотность почв в агрохимии
.1.1 Актуальная кислотность почвы,
значение, методы определения
.1.2 Обменная кислотность почвы,
значение, метод определения
.1.3 Гидролитическая кислотность
почвы, значение, метод определения
2.2 Сумма поглощенных оснований,
емкость поглощения почвы, степень насыщенности почв основаниями
.3 Оценка основных агрохимических
показателей почвы
3. Почвенная диагностика питания
сельскохозяйственных культур
3.1 Диагностика азотного питания
почвы, значение, методика проведения, определения
3.2 Диагностика фосфорного питания
почвы, значение, методика проведения, определения
3.3 Диагностика калийного питания
почвы, значение, методика проведения, определения
3.4 Оценка показателей эффективного
плодородия почвы
. Рекомендации по рациональному
использованию мелиорантов, основных видов и форм минеральных удобрений
Заключение
Список использованной литературы
агрохимический почва кислотность
плодородие
Введение
Агрохимия в настоящее время по праву занимает
центральное место среди агрономических дисциплин, так как применение удобрений
- самое эффективное средство развития и совершенствования растениеводства.
Значение агрохимии усиливается в связи с тем, что она изучает в сумме все
воздействия на растения и приемы их выращивания./1/
Агрохимия - наука о взаимодействии растений
почвы и удобрений в процессе выращивания сельскохозяйственных культур, о
круговороте веществ в земледелии и использовании удобрений для увеличения
урожая, улучшения его качества и повышения плодородия почвы./3/
Главная задача агрохимии - управление
круговоротом и балансом химических элементов в системе почва - растение и
выявление тех мер воздействия на химические процессы, протекающие в почве и
растении, которые могут повышать урожай или изменять его состав. Цель агрохимии
- создание наилучших условий питания растений с учетом знания свойств различных
видов и форм удобрений, особенностей их взаимодействия с почвой, определение
наиболее эффективных форм, способов, сроков применении удобрений. Изучая
биологические, химические, физико-химические свойства почв, агрохимия познает
ее плодородие. Этот раздел агрохимии тесно связал с наукой о почве -
почвоведением./1/
Целью данной курсовой работы является
определение типа почвы по данному почвенному образцу №6, оценка агрохимических
показателей почвенного образца №6 и рекомендации по применению агрохимикатов.
Диалектическая сущность агрохимии - это исследование процесса взаимного влияния
трех систем почва - удобрение - растение, результатом которого является урожай
и его качество./3/
1. Агрохимическое
обследование почв и его роль в диагностике
питания
Агрохимические обследования проводятся в целях
получения информации о содержании в почве элементов питания растений и как
следствии уровня ее плодородия. Агрохимическое обследований позволяет более
рационально использовать удобрения, и минимизировать их негативное воздействие
на окружающую среду. В результате создаются агрохимические картограммы
содержания элементов, агрохимические очерки и аппликационные карты внесения
удобрений. Кроме того, можно провести почвенно-агрохимическое обследование.
Получить и почвенную карту, и карту внесения удобрений. Как правило, при
проведении агрохимического анализа почва исследуется на меньшее количество
показателей, но в случае определенных условий можно добавить необходимые
определения. Гранулометрический состав (механический состав, почвенная
текстура)- это относительное содержание в почве твердых частиц разного размера.
Этот анализ позволяет классифицировать почвы на глинистые, суглинистые и тд. От
этого параметра зависят тепловой, воздушный, водный режимы почв, а также
физические, физико-химические и биологические свойства. Реакция почвенного
раствора (рН)- зависит от содержания в растворе свободных ионов водорода (Н+) и
гидроксила (ОН-). В свою очередь концентрация этих ионов зависит от содержания
в растворе органических и минеральных кислот, оснований, кислых и основных
солей, а также от степени диссоциации этих соединений. Реакция почвенного
раствора очень важный параметр, влияющий на развитие растений и
микроорганизмов. Реакция раствора в различных почвах изменяется от сильнокислой
(верховые болота, подзолистые почвы) до сильнощелочной (содовые солонцы).
Многие почвы (черноземы, каштановые и др.) характеризуются реакцией, близкой к
нейтральной. Гумус (перегной)- часть органического вещества почвы,
представленная совокупностью специфических и неспецифических органических
веществ почвы, за исключением соединений, входящих в состав живых организмов и
их остатков. Гумус играет большую роль в создании плодородия, прежде всего как
носитель запасов элементов питания. Большая роль принадлежит гумусу и в
формировании структуры, определяет он и режимы и свойства почвы. Азот, фосфор,
калий- важнейшие биофильные элементы, им принадлежит важнейшая роль в питании
растений
Почвенные образцы отбирают весной до посева или
осенью сразу после уборки урожая (до внесения удобрений). Если это не удалось
сделать до внесения удобрений, то при малых их дозах образцы берут через 2-3
мес. При небольших дозах навоза или компоста образцы следует брать осенью, а
при больших - на следующий год.
Образцы почв на пашне отбирают из пахотного
слоя, а на орошаемых землях и при сильной пестроте почвенного профиля в других
случаях (близкое залегание карбонатов, гипса и т. д.) - и из подпахотных
горизонтов (не более 15% количества образцов из пахотного слоя). На лугах и
пастбищах образцы берут из слоя наибольшей биологической активности (до глубины
15-16 см) и незначительное количество (10- 15%) из слоя 20-40 см. Частота
взятия смешанных почвенных образцов зависит от почвенных условий. В
сельскохозяйственных районах лесной зоны с дерново-подзолпстыми почвами и в
других зонах с волнистым сильнорасчлененным рельефом, с разнообразными
почвообразующими породами и неоднородным почвенным покровом один смешанный
образец берут с площади 1 - 3 га, в лесостепной и степной зонах в условиях
расчлененного рельефа 3 - 6 га, в степных районах с равнинным и
слаборасчлененным рельефом и однородным почвенным покровом 5 - 10 га. В
хозяйствах или севооборотах с очень, интенсивным применением удобрений (посевы
ценных технических культур, виноградники, чайные плантации) частоту взятия
образцов увеличивают в 1,5 раза. Смешанный почвенный образец составляют из 20
почвенных индивидуальных проб, которые отбирают буром. Удобнее пользоваться для
этих целей буром-тростью. Скважины располагают, как правило, по диагонали
участка. Почвенные образцы тщательно перемешивают и из смеси берут средний
образец массой 300-350г. Смешанные почвенные образцы необходимо отбирать с
преобладающей на участке почвенной разности. Если их две, нужно брать два
смешанных образца. При значительной комплексности почв, чередовании пятен разных
типов и подтипов, образование которых связано с элементами микрорельефа,
смешанные образцы (по два-три) составляют из проб, взятых отдельно с этих типов
и разностей. Каждый смешанный образец помещают в отдельную коробку или мешочек.
Туда же вкладывают этикетку (6 ×
5 см), на которой указывают наименование хозяйства, место взятия образца (поле,
севооборот), культуру, номер образца, глубину его взятия, дату и ставят
подпись. Одновременно в дневнике указывают особенности почвенного покрова,
состояние посевов, микрокомплексность и другие особые условия. Отобранные в
поле смешанные образцы немедленно просушивают в затемненном от солнца и
проветриваемом помещении. Просушенные образцы вместе с этикеткой отправляют в
лабораторию для анализа. /4/
2. Методы определения и оценка основных
агрохимических
показателей почв
.1 Кислотность почв в агрохимии
Реакция почвы оказывает большое влияние на
развитие растений и почвенных микроорганизмов, на скорость и направленность
происходящих в ней химических и биохимических процессов. Усвоение растениями
питательных веществ, деятельность почвенных микроорганизмов, минерализация
органических веществ, разложение почвенных минералов и растворение трудно
растворимых соединений, коагуляция и пептизация коллоидов и другие физико-химические
процессы в сильной степени зависят от реакции почвы. Она оказывает влияние на
эффективность вносимых в почву удобрений. Удобрения, в свою очередь, могут
изменять реакцию почвенного раствора, подкислять или подщелачивать ее./5/
Реакция почвенного раствора зависит от
соотношения в нем ионов водорода (Н+) и гидроксила (ОН-).
Концентрацию ионов водорода в растворе принято выражать символом рН, который
обозначает отрицательный логарифм концентрации водородных ионов. В природных
условиях реакция почвенного раствора колеблется от рН 3 - 3,5 (в сфагновых
торфах) до рН 9 - 10 (в солонцовых почвах), но чаще всего она не выходит за
пределы рН 4 - 8. Щелочную реакцию раствора имеют почвы сухих степей,
полупустынь и пустынь - южные черноземы и каштановые почвы (рН 7,5), сероземы
(рН до 8,5) и солонцы (рН 9 и более)./3/ Близкая к нейтральной (рН 6,5 - 7)
реакция раствора у обыкновенного и мощного черноземов. Выщелоченные черноземы и
серые лесные почвы имеют слабокислую реакцию (рН 5,5 - 6,5), а дерново-подзолистые
и некоторые торфяные почвы - кислую или сильнокислую (рН 4 - 5 и ниже).
Кислые почвы занимают в нашей стране
значительные площади и широко используются для выращивания зерновых, кормовых,
овощных и технических культур. Многие сельскохозяйственные культуры и полезные
почвенные микроорганизмы отрицательно относятся к повышенной кислотности. В
связи с этим важное значение имеет выяснение природы почвенной кислотности и
разработка способов ее устранения.
Различают следующие виды кислотности: актуальную
(или активную) кислотность и потенциальную (скрытую) кислотность, которая
подразделяется, в свою очередь, на обменную и гидролитическую./3/
.1.1 Актуальная кислотность почвы, значение,
методы определения
Актуальная кислотность - это кислотность
почвенного раствора, обусловленная повышенной концентрацией в нем ионов Н+
по сравнению с ионами ОН-./5/
В почве постоянно образуется СО2. При
растворении углекислого газа в почвенной влаге образуется Н2СО3,
которая диссоциирует на ионы Н+ и НСОз. В результате
повышается концентрация ионов водорода в растворе, он подкисляется. Поэтому чем
выше концентрация СО2 в почвенном воздухе, тем больше его
растворяется в почвенной влаге и тем сильнее подкисляется раствор./4/
Однако образующаяся в почвенном растворе
угольная кислота нейтрализуется поглощенными основаниями (Са, Mg, Na), а также
карбонатами кальция и магния. При взаимодействии угольной кислоты с карбонатом
кальция или с поглощающим комплексом, насыщенным кальцием, образуется
растворимая соль бикарбонат кальция:
СаСО3 + Н2СО3 =
Са(НСО3)2;
 .
.
Если в почве в поглощенном состоянии содержится
натрий, то в растворе может образоваться бикарбонат или карбонат натрия:
(ППК) Na + Н2СО3 = (ППК) Н
+ NaHCО3;
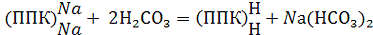 .
.
Углекислые соли кальция и натрия в растворе
подвергаются гидролитическому распаду, и образуются очень слабая угольная
кислота и сильные основания:
Са(НСО3)2 + 2Н2О
= Са(ОН)2 + 2Н2СО3;3 + Н2О
= NaOH + H2CO3;2CО3 + 2H2О
= 2NaOH + H2CО3.
В растворе повышается концентрация гидроксильных
ионов, он подщелачивается. Особенно сильно подщелачивает раствор карбонат
натрия, затем бикарбонат натрия и слабее - карбонаты кальция и магния. Поэтому
в почвах, содержащих в поглощенном состоянии много натрия (солонцы, солончаки),
в растворе образуются углекислые соли натрия, и почвенный раствор становится
щелочным. Когда в почве находятся карбонаты кальция и магния и среди
поглощенных катионов преобладает кальций (сероземы, черноземы), то в почвенном
растворе образуется главным образом бикарбонат кальция, который слабее
подщелачивает эти почвы, и реакция раствора у них слабощелочная или нейтральная
(рН 7-8).
В кислых и сильнокислых дерново-подзолистых
почвах и торфяно-болотных почвах, содержащих в поглощенном состоянии мало
кальция и значительное количество ионов водорода и алюминия, почвенный раствор,
кроме угольной кислоты, подкисляют растворимые органические кислоты, а также
соли алюминия, в результате гидролиза которых образуются кислота и слабое
основание. В этом случае происходит подкисление почвенного раствора до рН 4,5 и
ниже. Таким образом, актуальная кислотность - это кислотность почвенного
раствора, создаваемая ионами водорода, водорастворимыми органическими кислотами
и гидролитически кислыми солями. Она определяется измерением рН водной
суспензии или водной вытяжки из почвы. Актуальная кислотность оказывает
непосредственное влияние на развитие растений и почвенных микроорганизмов./5/
.1.2 Обменная кислотность почвы, значение, метод
определения
Кроме актуальной кислотности, существует
потенциальная (скрытая) кислотность почвы, которая обусловлена наличием ионов
водорода или алюминия в поглощенном состоянии. Часть поглощенных почвой ионов
водорода может быть вытеснена в раствор катионами нейтральных солей. Так, если
почву обработать растворами KCl, то катионы калия поглотятся почвой, а из
поглощающего комплекса перейдут в раствор ионы водорода./5/
(ППК) Н + КСl = (ППК) К + НСl.
В результате такого вытеснения ионов водорода
почвенный раствор подкисляется. Этот вид кислотности почвы называют обменной.
Кроме поглощенного водорода, в сильнокислых минеральных почвах находится
поглощенный алюминий, также способный переходить в раствор при взаимодействии
почвы с нейтральными солями:
Аl + 3KCl =  AlCl3.
AlCl3.
В растворе хлористый алюминий подвергается
гидролитической диссоциации с образованием слабого основания и сильной кислоты:
3
+ 3Н2О = Al(ОН)3 + 3НCl.
Кислота, образующая при вытеснении из почвы
алюминия во время обработки ее раствором нейтральной соли, и обменнопоглощенный
водород, который переходит в солевую вытяжку, составляют обменную кислотность
почвы. Следовательно, обменная кислотность - это кислотность, обусловленная
обменнопоглощеными ионами водорода и ионами алюминия, которые извлекаются из
почвы при обработке ее раствором нейтральной соли./5/
В настоящее время на основе многочисленных
исследований можно считать наиболее вероятным, что при взаимодействии кислых
почв с растворами нейтральных солей в солевую вытяжку переходят ионы как
водорода, так и алюминия. Соотношение между ними зависит от условий образования
почв, состава поглощающего комплекса и других причин. Обменная кислотность
характерна для дерново-подзолистых почв и красноземов, а также для почв
северной части черноземной зоны. В почвах, имеющих слабокислую реакцию водной
вытяжки, обменная кислотность незначительна, а в щелочных вообще отсутствует.
Обменная кислотность регулирует реакцию почвенного раствора.
Обменная кислотность приобретает особенно
большое значение при внесении в почву больших количеств растворимых минеральных
удобрений. Легко переходя в активную форму и подкисляя почвенный раствор, ионы
водорода отрицательно влияют на развитие чувствительных к кислотности растений
и почвенных микроорганизмов. Особенно токсичен для многих растений переходящий
в раствор алюминий. Поэтому при внесении в кислые почвы извести необходимо
добиваться нейтрализации не только актуальной, но и обменной кислотности./3/
В результате взаимодействия раствора хлорида
калия с подзолистой почвой образуется соляная кислота и хлорид алюминия.
Часть полученной вытяжки титруют раствором
щелочи и устанавливают суммарное количество перешедших в нее ионов водорода и
алюминия, соответствующее общей обменной кислотности почвы.
В оставшейся части вытяжки фторидом натрия или
калия осаждают ионы алюминия в виде комплексной нейтральной соли - криолита Na3AlF6:
АlCl3 + 6NaF = Na3AlF6
+ 3NaCl.
Титрованием вытяжки щелочью после осаждения
алюминия находят обменную кислотность, обусловленную только ионами водорода
(без алюминия). /4/
По разности между первым и вторым титрованием
определяют содержание подвижного алюминия (в мг∙экв).
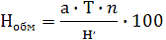 , (1)
, (1)
 , (2)
, (2)
где Нобм - обменная кислотность, мг∙экв/100
г почвы; а - количество щелочи пошедшее на титрование, мл; b - количество
щелочи на второе титрование, мл; Т - поправка к титру щелочи - 1,0050; n -
концентрация щелочи - 0,01; н, - навеска почвы в граммах соответствующая объему
фильтрата взятого для титрования.
Отдельные сельскохозяйственные культуры
чувствительны к повышенным дозам извести, устанавливаемым по величине
гидролитической кислотности. Поэтому, например, в севооборотах со льном и
картофелем приходится применять меньше дозы извести, которые можно определять
по величине общей обменной кислотности:
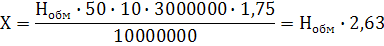 (3)
(3)
где, Х - доза СаСО3, т/га; Н - общая обменная
кислотность, мг∙экв/100г почвы; 50 - количество миллиграммов СаСО3,
соответствующее 1 мг∙экв; 10 - коэффициент для пересчета на 1 кг почвы;
3000000 - примерная масса пахотного слоя подзолистой почвы, кг; 1,75 - поправка
на неполноту извлечения подвижного алюминия однократной обработкой хлоридом
калия; 1000000000 - коэффициент для перевода миллиграммов извести в тонны./4/
.1.3 Гидролитическая кислотность почвы,
значение, метод определения
При обработке почвы раствором нейтральной соли
не все поглощенные ионы водорода переходят в раствор, т. е. в этом случае не
выявляется вся потенциальная кислотность. Более полно ионы водорода из
почвенного поглощающего комплекса можно вытеснить, действуя на почву нормальным
раствором гидролитически щелочной соли, например уксуснокислого натрия (CH3COONa).
В водном растворе эта соль гидролитически расщепляется и образует
слабодиссоциирующую уксусную кислоту и сильное основание, поэтому раствор
становится щелочным (рН около 8,2):
CH3COONa
+ Н2О ↔ СН3СООН + NaOH
→
СН3СООН + Na+
+ ОН-.
Щелочная реакция раствора этой соли и является
главной причиной более полного вытеснения поглощенного водорода из почвы.
При взаимодействии раствора уксуснокислого
натрия с почвенным поглощающим комплексом ионы водорода вытесняются в раствор в
обмен на катионы натрия и связываются с оставшимися гидроксильными ионами;
образуются труднодиссоциирующие молекулы Н2О:
(ППК) + Н + ОН2СООН
+ Na+
+ ОН- → (ППК) Na
+ СН3СООН + Н2О.
Чем больше ионов натрия поглотит почва и больше
гидроксильных ионов будет связано, тем больше в растворе образуется уксусной
кислоты. Количество ее можно определить титрованием раствора щелочью. Этот вид
кислотности почвы, выявляемый посредством гидролитически щелочной соли, получил
название гидролитической кислотности. Она включает менее подвижную часть поглощенных
ионов водорода, труднее обменивающихся на катионы почвенного раствора. Часть
ионов водорода, связанная с почвенными коллоидами, способна к обмену на
основания при слабокислой реакции (рН 5,5 - 6) и может вытесняться из
почвенного поглощающего комплекса в раствор катионами нейтральной соли. Эти
ионы водорода (наряду с обменно-поглощенными ионами алюминия) обусловливают
обменную кислотность почвы. Другая часть поглощенных ионов водорода, труднее
диссоциирующая, способна обмениваться на основания только в условиях
нейтральной и щелочной сред. Эти ионы водорода труднее замещаются на основания,
они вытесняются в раствор только гидролитически щелочной солью./5/
Кислотность, обнаруживаемая при обработке почвы
раствором CH3COONa, значительно больше, чем обменная. В этом случае
определяется общая кислотность почвы, включающая актуальную и всю потенциальную
кислотность - как обменную, так и "собственно гидролитическую"
(которая не вытесняется КС1, но вытесняется 1 н. раствором CH3COONa).
Следовательно, под гидролитической кислотностью почвы подразумевается
кислотность, обнаруживаемая в растворе после обработки почвы уксуснокислым
натрием и включающая все содержащиеся в почве ионы водорода, не только
легкоподвижные (обменные), но и менее подвижные, способные к замене на
основании лишь при щелочной реакции./3/
Гидролитическую кислотность выражают в мг∙экв/100
г почвы. Иногда результаты определения гидролитической кислотности бывают
меньше, чем при определении обменной кислотности. Это связано с тем, что анионы
уксусной кислоты сорбируются некоторыми почвами, в которых преобладают коллоиды
с сильно выраженными базоидными свойствами (красноземы), а взамен вытесняются
ионы ОН-, в результате кислотность почвенной вытяжки уменьшается.
В подобных случаях, очевидно, обычный метод
определения гидролитической кислотности оказывается непригодным./5/
Гидролитическая кислотность в почвах появляется
в самом начале обеднения их основаниями. При дальнейшей потере оснований
появляется также обменная и актуальная кислотность. Черноземы, за исключением
южных, имеют гидролитическую кислотность, хотя обменной кислотности в них может
и не быть. Если в почве есть обменная кислотность, то она входит как часть в
кислотность гидролитическую. Выщелоченные черноземы, более обедненные основаниями,
характеризуются как гидролитической, так и небольшой обменной кислотностью. Еще
более обедненные основаниями дерново-подзолистые почвы имеют значительную
гидролитическую кислотность и сильно выраженную обменную кислотность, а также
они имеют актуальную кислотность./4/
Вследствие того что гидролитическая кислотность
включает менее подвижную часть ионов водорода, она (при отсутствии обменной
кислотности) не вредна для растений. Знание величин ее очень важно при решении
ряда практических вопросов применения удобрений (известкование, внесение
фосфоритной муки).
Принцип метода. Почву обрабатывают раствором
ацетата натрия CH3COONa. При взаимодействии почвы, обладающей
потенциальной кислотностью, с этой солью ноны натрия вытесняют из почвенного
поглощающего комплекса как ионы водорода, вызывающие обменную кислотность, так
и ионы водорода, обусловливающие гидролитическую кислотность. Схемы реакций
можно представить в следующем виде:
CH3COONa
+ Н2О → СНзСООН + NaOH.
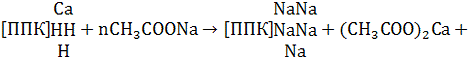
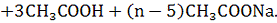
Как видно, в результате реакции частъ ионов
натрия переходит из раствора в поглощающий комплекс; одновременно равновесие
гидролиза ацетата натрия смещается вправо, что приводит к образованию
дополнительного количества уксусной кислоты (эквивалентного количеству натрия,
пошедшего на вытеснение ионов водорода), которое и определяют титрованием
щелочью. По затраченной на титрование щелочи судят о степени кислотности почвы.
Таким образом, гидролитическая кислотность - это
сумма активной и потенциальной, т. е. всей почвенной, кислотности, которую и
необходимо знать, чтобы правильно рассчитать дозу извести для ее нейтрализации.
Результаты этого определения используют как для установления возможной
эффективности известкования, так и для прогноза действия фосфоритной муки.
 (4)
(4)
где, Нг - гидролитическая кислотность, мг∙экв
на 100 г почвы; а - количество 0,1 н. щелочи, израсходованной на титрование;
1,75 - коэффициент, поправка на неполноту вытеснения ионов водорода при
однократной обработке почвы ацетатом натрия; n - концентрация щелочи 0,1 н.; Т
- поправки к титру - 0,99.; н, - навеска почвы, соответствующая объему
фильтрата, взятого для титрования, г./4/
2.2 Сумма поглощенных
оснований, емкость поглощения почвы, степень насыщенности почв основаниями
Реакция почвенного раствора зависит не только от
размеров обменной и гидролитической кислотности, но и от степени насыщенности
почвы основаниями. Если величину гидролитической кислотности почвы обозначить
буквой Н, а суммарное количество поглощенных оснований (Са, Mg, К, Na и др.) -
буквой S, то сложение их дает общую емкость поглощения почвы (Г) в мг∙экв.
на 100 г:
S
+ Н = Г. (5)
Сумма поглощенных оснований (S), выраженная в
процентах от емкости поглощения (Т), называется степенью насыщенности почвы
основаниями и обозначается V%:
 (6)
(6)
Степень насыщенности показывает, какая часть
общей емкости приходится на поглощенные основания и какая - на гидролитическую
кислотность. Величина степени насыщенности основаниями - важный показатель для
характеристики поглотительной способности и степени кислотности почвы./4/
Для определения степени насыщенности почвы
основаниями определяют сумму поглощенных оснований.
Почву обрабатывают определенным количеством
титрованного раствора соляной кислоты. Часть ее расходуется на вытеснении и
нейтрализацию поглощенных оснований по схеме
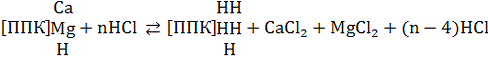
Остаток кислоты учитывают титрованием щелочью
титрованием щелочью такой же концентрации. Сума поглощенных оснований
эквивалента количеству соляной кислоты, израсходованной на их вытеснение; ее
находят по разности между взятым количеством этой кислоты и ее остатком (расчет
ведут обычно в эквивалентах).
 (6)
(6)
где, S - сумма поглощенных оснований, мг∙экв/100г;
a - количество соляной кислоты, взятое для вытеснения оснований, содержащихся в
10 г почвы, мл; b - количество щелочи, пошедшей на титрование, мл; n -
концентрация - 0,1 моль/л; Т - поправка к титру = 1; н, - навеска почвы в
граммах соответствующая объему фильтрата взятого для титрования.
Общее количество способных к обмену поглощенных
катионов в почве называется емкостью поглощения. Ее выражают в мг∙экв/100
г почвы. Величина емкости поглощения характеризует обменную поглотительную
способность почвы. Емкость поглощения катионов зависит от механического состава
почвы, общего содержания в ней мелкодисперсной фракции и ее состава. Разные по
размеру минеральные частицы почвы отличаются по их способности к
физико-химическому поглощению катионов../4/
Величина емкости поглощения зависит от
содержания в почве гумуса. гумусовые вещества обладают гораздо более высокой
поглотительной способностью, чем глинистые материалы. Чем выше содержание
гумуса в почве, тем больше емкость поглощения катионов. У более богатых гумусом
черноземов она значительно выше, чем у дерново-подзолистых почв. Верхние
горизонты почвы, содержащие больше органического вещества, обладают и большей
емкостью поглощения, чем нижние горизонты./5/
В богатых гумусом черноземах емкость поглощения
катионов в большой степени обусловлена их органической частью, тогда как в
дерново-подзолистых почвах - минеральной. Емкость поглощения катионов зависит
также от реакции почвы и соотношения в ней отрицательно заряженных коллоидов
(ацидоидов) и амфотерных коллоидов (амфолитоидов). Кислая реакция, наоборот,
уменьшает отрицательный заряд почвенных коллоидов, и емкость поглощения
катионов снижается. Если почва богата полутораоксидами, которые при рН ниже 7-
8 имеют положительный заряд, то они будут вступать в соединения с отрицательно
заряженными коллоидами (ацидоидами), например с кремниевой кислотой и гуминовой
кислотой, и частично связывать их отрицательные заряды, тем самым снижая
величину емкости поглощения катионов. При большом содержании в почве амфотерных
коллоидов (гидратов полуторных окислов) и при кислой реакции способность почвы
к поглощению анионов увеличивается. Чем уже соотношение в почве ацидоидов и
амфо-литоидов и выше кислотность почвенного раствора, тем ниже емкость
поглощения катионов. В поглощающем комплексе кислых почв наряду с основаниями
Са, Mg, К содержатся ионы водорода. Чем большая доля общей емкости поглощения
приходится на водород, тем почвы более кислые, или, точнее, не насыщены
основаниями. Определение степени насыщенности почв основаниями позволяет точнее
решать вопрос о необходимости (очередности) известкования, так как этот
показатель характеризует относительную долю гидролитической кислотности (т. е. ионов
водорода, соответствующих ее значениям) в почвенном поглощающем комплексе
Абсолютные величины гидролитической кислотности ряда почв могут быть близки
между собой, что, казалось бы, свидетельствует об одинаковой нуждаемости их в
известковании; однако, если учесть степень насыщенности этих почв основаниями,
может оказаться, что потребность их в извести различна./4/
При расчетах доз извести, кроме гидролитической
кислотности, нужно учитывать обменную кислотность почвы, содержание в ней
подвижного алюминия, емкость поглощения катионов почвой, степень насыщенности
почвы основаниями, ее гранулометрический состав, содержание в ней органического
вещества, отношение сельскохозяйственной культуры к известкованию и другие
факторы.Наиболее правильный ответ на вопрос о необходимости известкования той
или иной почвы и дозах внесения извести можно получить при сочетании
приведенных выше методов с полевым опытом по изучению эффективности
известкования./4/
2.3 Оценка основных
агрохимических показателей почвы
По полученным данным лабораторных анализов
среднего почвенного образца №6 , можно сделать следующие выводы из таблицы 1.
Таблица 1. Агрохимические показатели почвенного
образца №6.
|
№
почвенного образца
|
pНводная
|
рНсолевая
|
мг∙экв/100г
|
V,%
|
|
колориметрически
|
Нобмен
|
Alобмен
|
Нг
|
S
|
Е
|
|
|
6
|
5.7
|
5.35
|
0.02
|
0
|
3.7
|
15.8
|
19.5
|
При проведении анализов и по итогам их
результатов можно сделать вывод, что данный почвенный образец относится к
почвам, имеющим рН среды от слабо кислой до близкой к нейтральной. Поскольку рН
водной вытяжки - величина неустойчивая, сильно изменяющаяся в течение
вегетационного периода, на практике определяют рН почвы не только в водной, но
и в солевой вытяжке. Если почва обладает обменной кислотностью, то в солевой
вытяжке обнаруживается больше ионов водорода, в связи с чем показатель рН
солевой вытяжки ниже, чем рН водной.
Градация кислотности почв по показателю рН.
< 4 - очень сильнокислые
,1 - 4,5 - сильнокислые
,6 - 5 - кислые
,1 - 5,5 - слабокислые
,6 - 6 - близкие к нейтральным
,1 - 7 - нейтральные
,1 - 7,5 - слабощелочные
,6 - 8 - щелочные
> 8 - сильнощелочные
По данным анализа рНв>рНс,
отсюда следует, что данная почва обладает обменной кислотностью.
Почва требует мелиорации если рНс
вытяжки ≤ 5,5. Данный почвенный образец нуждается в мелиорации.
Нобм= 0.2786мг∙экв/100г этот
показатель устанавливает необходимость и очередность известкования кислых почв.
С помощью Нобм можно рассчитать дозу извести. ДCaCO3 = Нобм∙2,63=0.73
т/га.
По гидролитической кислотности данный почвенный
образец относится к слабокислой, Нг=3.7 мг∙экв/100г.
Градация почв по гидролитической кислотности мг∙экв/100г.
> 6 - очень сильнокислая
,1 - 6 - сильнокислая
.1 - 5 - среднекислая
,1 - 4 - слабокислая
,1 - 3 - близко к нейтральным
< 2 - нейтральная.
По сумме поглощенных оснований данный почвенный
образец относится к повышенному значению, т. к. результаты лабораторных
анализов показали, что S=15.8 мг∙экв/100г.
Группировка почв по сумме поглощенных оснований
мг∙экв/100г.
< 5,0 - очень низкая
5,1 - 10,0 - низкая
,1 - 15,0 - средняя
,1 - 20,0 - повышенная
,1 - 30,0 - высокая
> 30,0 - очень высокая.
Зная сумму поглощенных оснований,
гидролитическую кислотность и емкость поглощения катионов можно узнать степень
насыщенности почв основаниями. В данной почве V= 80%, отсюда следует, что степень
насыщенности основаниями данного почвенного образца - высокая.
По всем полученным данным лабораторных анализов
можно сделать вывод, к какому типу почвы относится данный образец.
Почвенный образец № 6 относится к типу светло -
серых лесных почв.
3. Почвенная диагностика питания
сельскохозяйственных культур
.1 Диагностика азотного питания почвы, значение,
методика проведения, определения
Азот - один из основных элементов, необходимых
для растений. Он входит в состав всех простых и сложных белков, которые
являются главной составной частью цитоплазмы растительных клеток, и в состав
нуклеиновых кислот (рибонуклеиновая - РНК и дезоксирибонуклеиновая - ДНК),
играющих исключительно важную роль в обмене веществ в организме. Азот
содержится в хлорофилле, фосфатидах, алкалоидах, ферментах и во многих других
органических веществах растительных клеток./5/
Условия азотного питания сильно влияют на рост и
развитие растений. При недостатке азота рост их резко ухудшается. Особенно
сильно сказывается недостаток азота на развитии листьев: они бывают мелкие,
имеют светло-зеленую окраску, преждевременно желтеют, стебли становятся тонкими
и слабо ветвятся. Ухудшаются также формирование и развитие репродуктивных
органов и налив зерна. /1/
Общее содержание азота в почвах зависит от
содержания в них органических веществ: больше всего азота в наиболее богатых
гумусом мощных черноземах, а меньше - в бедных гумусом дерново-подзолистых
почвах и сероземах (таблица 2). Разложение органических азотистых соединений в
почве в общем виде может быть представлено схемой:
белки, гуминовые вещества → аминокислоты,
амиды → аммиак → нитриты →
нитраты.
Распад азотистых органических веществ почвы до
аммиака называется аммонификацией.
Таблица 2. Содержание азота в пахотном слое
различных почв.
|
Почва
|
Азот
общий
|
|
%
|
т/га
|
|
Дерново-подзолистая
|
0,05
- 0,20
|
1,5
- 6,0
|
|
Серая
лесная
|
0,20
- 0,35
|
6
- 10,5
|
|
Выщелоченный
чернозем
|
0,30
- 0,45
|
9
- 13,5
|
|
Мощный
чернозем
|
0,40
- 0,50
|
12
- 15
|
|
Обыкновенный
чернозем
|
0,25
- 0,45
|
7,5
- 13,5
|
|
Каштановая
|
0,15
- 0,25
|
4,5
- 7,5
|
|
Серозем
|
0,10
- 0,20
|
3
- 6
|
|
Краснозем
|
0,20
- 0,30
|
6
- 9
Нитрификация - осуществляется группой
специфических бактерий, для которых это окислений является источником энергии.
Денитрификация - процесс восстановления
нитратного азота до газообразных форм (NO, N2O, N2), в
результате чего происходят потери азота из почвы из почвы, что крайне
нежелательно для сельскохозяйственного производства.
Определение нитратного азота
дисульфофиноловым
методом Грандваль-Ляжу.
Содержание нитратов в почве служит показателем
обеспеченности растений минеральным азотом и характеризует степень выраженности
процесса нитрификации. По наличию нитратного азота судят об окультуренности
почвы, ее биологической активности, мелиоративном состоянии.
Нитраты обладают высокой подвижностью и при
обильном атмосферном увлажнении или поливах могут перемещаться с гравитационной
влагой за пределы пахотного слоя./1/
В основе метода лежит взаимодействие нитратов с
дисульфофеноловой кислотой с образованием тринитрофенола (пикриновой кислоты),
который при подщелачивании раствора дает окрашенное в желтый цвет
нитросоединение в количестве, эквивалентном держанию нитратов:
HNО3
+ C6H3(HSО3)2OH
→ C6H2(NO)3OH + 2H2SО4
+ Н2О;
С6Н2(NO2)зОН
+ NaOH →
C6H2(NO2)3ONa
+ Н2O.
Дисульфофеноловым методом определяют только азот
нитратов и даже при большом содержании нитратов получают правильные результаты.
Вместе с тем установлено, что на точность опыта влияют хлориды (занижают
количество нитратов), аммиачные соли, кислотность почвенных вытяжек. /4/
Для расчета содержания нитратов используют
формулу
 
где, Х - содержание нитратов, мг/кг абсолютно
сухой почвы; а - количество мл образцового раствора по графику (соответствующее
оптической плотности испытуемого раствора); b - разведение (отношение общего
объема фильтрата к объему фильтрата, взятого для выпаривания); 1000 -
коэффициент для пересчета результата на 1 кг почвы; н, - навеска почвы, г;
0,226 - коэффициент пересчета на азот.
.2 Диагностика фосфорного питания почвы,
значение, методика проведения, определения
Запасы фосфора в необрабатываемых почвах зависят
от содержания его в материнской породе, так как иного источника его не
существует. Положение изменяется при внесении фосфорных удобрений, которые
используются растениями далеко не полностью, и это обусловливает постепенное
накопление усвояемых фосфатов в пахотном слое культурных почв. Концентрация
фосфора в почвенном растворе колеблется от 0,1 до 1 мг на 1 л, но последняя
величина бывает очень редко./5/
Развитие почвообразовательного процесса связано
с постепенным переносом корневой системой фосфатов из нижележащих горизонтов в
верхние. Поэтому общее содержание Р2О5 в профиле почвы
обычно резко убывает с глубиной. Но этого естественного процесса обогащения
фосфатами пахотного слоя недостаточно для удовлетворения потребностей
сельскохозяйственных культур при высокой их урожайности и длительном
возделывании. Органические фосфаты в почве минерализуются различными микробами.
Часть фосфора в почве (как и азота) находится в составе тел самих
микроорганизмов. Усвоение фосфора растениями зависит от их биологических
особенностей (вида), условий питания, реакции почвы, наличия в почвенном
растворе различных катионов и анионов. Преобладающее количество этого элемента
в почве находится в минеральной форме (фосфаты калия, магния, алюминия, железа
и др.). Органические соединения фосфора имеют небольшой удельный вес в
фосфатном балансе почвы, они представлены нуклеиновыми кислотами, фитином,
фосфатидами. Под термином "подвижные соединения фосфора" принято
понимать не только почвенные фосфаты, непосредственно растворимые воде и,
следовательно, доступные для растений, но и те их формы, которые, будучи
нерастворимыми в воде, сравнительно легко могут переходить в разбавленные
растворы кислот или щелочей, что указывает на их большую доступность для
растений по сравнению с другим соединениями, менее поддающимися растворяющему
действию указанных вытяжек./5/
Показатели содержащая подвижного фосфора в почве
используют лишь для сравнительной оценки фосфатного режима разных почв
способности их удовлетворять потребность растений в этом элементе,
корректировки доз фосфорных удобрении и некоторых других целей. Подвижный
фосфор из почв разных типов извлекают различными растворителями (минеральные и
органические кислоты, щелочи, буферные смеси и др.). Для количественного
определения фосфора в вытяжках из почвы применяют колориметрический
молибденовый метод, основанный на способности фосфора в кислой среде
образовывать с оксидами молибдена фосфорно-молибденовую гетерополикислоту. При
добавлении восстановителя к раствору, содержащему указанную гетерополикислоту,
входящий в ее состав шестивалентный молибден восстанавливается до
пятивалентного, в результате чего образуется соединение (фосфорно-молибденовая
синь), окрашивающее раствор в сине-голубой цвет. По интенсивности окраски в
сравнении с окраской образцовых растворов определяют концентрацию фосфора в
испытуемом растворе. Анализы почв на содержание подвижного фосфора позволяют
установить потребность растений в фосфорных удобрениях./5/
Метод Ф. В. Чирикова в модификации ЦИНАО
Фосфор извлекают из почвы 0,5 н. раствором
уксусной кислоты при соотношении почвы и раствора 1:25. Фосфор определяют в
вытяжке в виде синего фосфорно-молибденового комплекса фотоэлектроколориметрически.
Содержание фосфора в почве находят по рабочей шкале образцовых растворов в
миллиграммах Р2О5 на 1 кг почвы./4/
Метод Б.П. Мачигина в модификации ЦИНАО
Метод основан на извлечении подвижных форм
фосфора и калия из почвы 1% раствором карбоната аммония при соотношении почвы к
раствору 1:20. Фосфор и калий извлекают при температуре 250 С
.Окрашенные вытяжки перед определением фосфора обесцвечивают, окисляя их
перманганатом калия.
Метод А.Т. Кирсанова в модификации ЦИНАО
Метод основан на извлечении фосфора и калия из
почвы 0.2 Н раствором НСI
при соотношении почвы к раствору 1:5 с последующим определением фосфора
калориметрически в виде синего фосфорно - молибденового комплекса и калия на
пламенном фотометре.
3.3 Диагностика калийного питания почвы, значение,
методика проведения, определения
Калий главным образом находится в минеральной
части почвы - в органической части его очень мало. Калий в почве содержится: 1)
в составе кристаллической решетки первичных и вторичных минералов (основное его
количество); 2) в обменном и необменно-поглощенном состоянии в коллоидных
частицах (значительная часть); 3) в составе пожнивно-корневых остатков и
микроорганизмов; 4) в виде минеральных солей почвенного раствора (карбонатов,
нитратов, хлоридов и др.), что составляет очень малую долю от валового калия.
Наилучшим источником питания растений являются
растворимые соли калия. Непосредственным резервом являются обменные катионы и
малорастворимые соли. Ближайшим резервом питания служат гидрослюды,
вермикулиты, вторичные хлориты, монтмориллонит, необменные катионы и
малорастворимые соли. Потенциальным резервом являются полевые шпаты, слюды,
пироксены и первичные хлориты./5/
Валовой, или общий, калий объединяет в своем
составе разные формы калийных соединений, которые можно классифицировать
следующим образом:
водорастворимый калий (легкодоступный для
растений); 2) обменный калий (хорошо доступный растениям); 3) подвижный калий
(сумма водорастворимого и обменного калия), извлекаемый из почвы солевой
вытяжкой; 4) необменный гидролизуемый калий (труднообменный или резервный),
дополнительно извлекаемый из почвы кипящим раствором сильной кислоты (обычно
0,2 н. или 10 %-ный раствор НСl) и служащий ближайшим резервом для питания
растений; 5) кислоторастворимый калий, объединяющий все четыре предыдущие формы
калия и извлекаемый из почвы кипящим раствором сильной кислоты (0,2 н. или 10
%-ный раствор НСl); 6) необменный калий (разница между валовым и
кислоторастворимым калием).
По степени подвижности, а следовательно, и
доступности для растений находящиеся в почве соединения калия подразделяют на
следующие основные формы: водорастворимый калий; обменный калий; труднообменный
и фиксированный калий; необменный калий и калий нерастворимых алюмосиликатов;
калий органической части почвы (микроорганизмов, органических остатков).
Основной показатель, характеризующий способность почв обеспечивать растения
калием, - содержание в них обменного калия. Для его извлечения применяют
солевые или кислотные вытяжки./2/
Метод Ф. В. Чирикова в модификации ЦИНАО
Калий извлекают из почвы 0,5 н. раствором
уксусной кислоты при соотношении почвы и раствора 1:25. Содержание калия
устанавливают непосредственно в почвенной вытяжке на пламенном фотометре,
используя светофильтр, пропускающий аналитические линии калия 766,5 и 769,9 им.
Содержание калия в почве находят по рабочей шкале образцовых растворов в
миллиграммах К2О на 1 кг почвы./4/
Метод Б.П. Мачигина в модификации ЦИНАО
Метод основан на извлечении подвижных форм
фосфора и калия из почвы 1% раствором карбоната аммония при соотношении почвы к
раствору 1:20. Фосфор и калий извлекают при температуре 250 С
.Окрашенные вытяжки перед определением фосфора обесцвечивают, окисляя их
перманганатом калия.
Метод А.Т. Кирсанова в модификации ЦИНАО
Метод основан на извлечении фосфора и калия из
почвы 0.2 Н раствором НСI
при соотношении почвы к раствору 1:5 с последующим определением фосфора
калориметрически в виде синего фосфорно - молибденового комплекса и калия на
пламенном фотометре.
3.4 Оценка показателей эффективного плодородия
почвы
По данным лабораторных анализов данного
почвенного образца №6, можно оценить данную почву следующим образом.
Таблица 3. Содержание подвижных форм основных
элементов питания светло - серой лесной почвы.
|
№почвенного
образца
|
Диагностический
слой, см
|
N-NO3
|
P2O5
|
K2O
|
|
|
Метод
Грандваль-Ляжа
|
Метод
Кирсанова А.Т.
|
Метод
Чирикова Ф.В.
|
Метод
Мачигина Б.П.
|
Метод
Мачигина Б.П
|
В
Метод Чирикова Ф..
|
Метод
Кирсанова А.Т.
|
|
№6
|
0-20
|
-
|
145
|
325
|
13
|
40
|
130
|
220
|
|
0-40
|
5.23
|
-
|
-
|
-
|
-
|
-
|
-
|
Анализируя полученные данные можно сказать что,
содержание N-NO3
низкое
(5.23 мг/кг), P2
O5
по методу Кирсанова А.Т. повышенное (145 мг/кг) по методу Чирикова Ф.В. очень
высокое (325 мг/кг) и по методу Мачигина Б.П. очень низкое (13 мг/кг). K2O
по методу Кирсанова А.Т. очень высокое (220 мг/кг) по методу Чирикова Ф.В.
высокое (130 мг/кг) и по методу Мачигина Б.П. очень низкое (40 мг/кг).
Таблица 4. Группировка почв по содержанию азота.
|
№
группы
|
Содержание
азота
|
|
1
|
Очень
низкое
|
<
5
|
|
2
|
Низкое
|
5 - 10
|
|
3
|
Среднее
|
10 - 15
|
|
4
|
Высокое
|
15 - 20
|
|
5
|
Очень
высокое
|
> 20
|
Таблица 5. Группировка почв по содержанию
подвижного фосфора, определяемого по методу Чирикова.
|
№
группы
|
Рекомендуемый
цвет окраски
|
Содержание
подвижного фосфора
|
Р2О5,
мг/кг почвы
|
|
1
|
Бирюзовый
|
Очень
низкое
|
Менее
20
|
|
2
|
Светло-голубой
|
Низкое
|
21
- 50
|
|
3
|
Голубой
|
Среднее
|
51
- 100
|
|
4
|
Светло-синий
|
Повышенное
|
101
- 150
|
|
5
|
Синий
|
Высокое
|
151
- 200
|
|
6
|
Темно-синий
|
Очень
высокое
|
Более
200
|
Таблица 6. Группировка почв по содержанию
обменного калия, определяемого по методу Чирикова.
|
№
группы
|
Рекомендуемый
цвет окраски
|
Содержание
Обменного калия
|
К2О,
мг/кг почвы
|
|
1
|
Желтый
|
Очень
низкое
|
Менее
20
|
|
2
|
Светло-оранжевый
|
Низкое
|
21
- 40
|
|
3
|
Оранжевый
|
Среднее
|
41
- 80
|
|
4
|
Светло-коричневый
|
Повышенное
|
81
- 120
|
|
5
|
Коричневый
|
Высокое
|
121
- 180
|
|
6
|
Очень
высокое
|
Более
180
|
4. Рекомендации по рациональному использованию
мелиорантов, основных видов и форм минеральных удобрений
На первом этапе систему удобрения в севообороте
можно назвать планом применения органических и минеральных удобрений, в котором
предусматриваются их виды, дозы, время внесения и способы заделки под отдельные
культуры в зависимости от почвенно-климатических и других условий. Составить
такой план в хозяйстве должен специалист - агроном по удобрениям. Для этого
необходимо иметь контрольные цифры из организационно-хозяйственного плана по
динамике урожайности сельскохозяйственных культур за предшествующие 3 - 5 лет и
на перспективу, севообороты (или хотя бы реально возможное чередование культур
по полям), агрохимические картограммы, почвенную карту и план накопления
органических удобрений. Часто такой документ разрабатывается для хозяйства
научно-исследовательским учреждением.
Следует правильно использовать терминологию,
связанную с внесением удобрений. Обычно различают три приема внесения
удобрений: основное удобрение (допосевное, предпосевное), рядковое
(припосевное) и подкормку (послепосевное удобрение)./2/
Вносить удобрения (срок внесения) можно осенью,
весной, летом, в определенные месяцы и т.д. Способ внесения - сплошной (разбросной),
местный (гнездовой, очаговый, рядковый), локально-ленточный, в запас,
механизированный, наземный и др. Способ заделки - под плуг, культиватор,
дисковую борону и пр.
Удобрения следует вносить в почву так, чтобы они
в наибольшей степени были доступны для растений в течение вегетационного
периода, находились в зоне развития корневой системы, способствовали ее росту и
минимально фиксировались почвой. /5/ Основное (допосевное) удобрение. Этот
способ обеспечивает питание растений на протяжении всей вегетации, особенно в
период интенсивного роста, когда отмечается наибольшее потребление питательных
веществ растением. Основное удобрение включает большую часть питательных
веществ от общей нормы. Его можно вносить или осенью, или весной.
Похожие работы на - Оценка агрохимических показателей светло-серой лесной почвы и рекомендации по применению агрохимикатов
|