Физика атомов и молекул
Реферат
тема: "Физика
атомов и молекул"
Москва
2014
Содержание
Введение
. Принципы симметрии волновых
функций
. Принцип Паули
. Орбитали и оболочки
. Периодическая система элементов
Менделеева
. Рентгеновские спектры
. Вынужденное излучение
. Лазеры
. Основные формулы физики атомов и
молекул
Список использованной
литературы и источников
Введение
Периодическая система элементов Менделеева была
получена на основании анализа свойств химических элементов. При создании этой
системы она не имела под собой серьезных физических обоснований. Только в
рамках квантовой механики удалось описать периодичность свойств химических
элементов и создать базу для объяснения физических и химических свойств атомов
и молекул. Одним из основных инструментов для описания свойств атомов и молекул
является уравнение Шредингера.
При описании атомов и молекул важную роль играет
понятие спина электрона. Это чисто квантовое понятие, не имеющее аналога в
классической физике. В этой главе с позиций квантовой механики рассмотрим
простейшие свойства атомов и молекул, структуру периодической таблицы
Менделеева и различные вопросы, связанные с излучением атомов и молекул.
1. Принципы симметрии волновых функций
Для изучения магнитных моментов атомов Штерн и
Герлах пропускали поток атомов через сильное неоднородное поле. Атомы,
обладающие собственным магнитным моментом, в таком поле должны были
отклоняться, и по величине отклонения можно оценить величину магнитного
момента. Сила, действующая на атом, определяется формулой
 ,
,
где 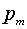 - собственный магнитный момент
атома,
- собственный магнитный момент
атома, 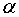 - угол
между векторами
- угол
между векторами  и В. Схема
опыта Штерна и Герлаха показана ниже.
и В. Схема
опыта Штерна и Герлаха показана ниже.
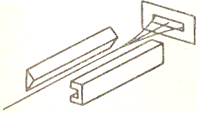
Предполагалось, что векторы
магнитных моментов атомов распределены хаотически по всем направлениям. В этом
случае на экране, где располагалась фотопленка, должен наблюдаться непрерывный
спектр распределения атомов. Результаты опытов оказались неожиданными. Вместо
непрерывного спектра получились отдельные линии - спектр оказался дискретным.
При этом для различных элементов распределение интенсивностей атомов оказалось
различным.
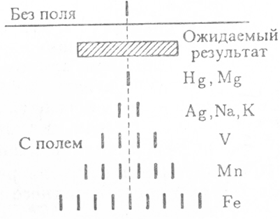
Помещая пучок атомов водорода в s-состоянии,
когда орбитальный магнитный момент атома равен нулю, в магнитное поле, Штерн и
Герлах заметили, что пучок расщепляется на два пучка. Это можно объяснить
только тем, что электрон обладает собственным магнитным моментом. Ученые пришли
к выводу, что электрон обладает также собственным механическим моментом и
обладает свойствами волчка.
Спином называют собственный
механический момент импульса, не связанный с движением электрона в
пространстве. Собственный момент импульса - величина постоянная для всех
электронов. Это внутренняя характеристика электрона, аналогичная массе или
заряду. Спин электрона - чисто квантовая величина, у нее нет аналога в
классической механике. Сначала полагали, что спин возникает из-за вращения
электрона вокруг своей оси, но позже от такой трактовки отказались, т.к. она
приводила к неразрешимым противоречиям.
По законам квантовой механики спин
квантуется и принимает значения
 ,
,
где s - спиновое
квантовое число. Выяснилось, что для электрона s=1/2.
Проекция спина на направление магнитного поля также квантуется и определяется
выражением
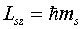 ,
,
где ms - магнитное
спиновое квантовое число. Для электрона ms = 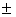 1/2. На
рисунках спин электрона символически изображают стрелкой.
1/2. На
рисунках спин электрона символически изображают стрелкой.
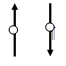
С механическим моментом импульса
связан магнитный момент, который определяется соотношением
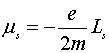 .
.
Позже выяснилось, что все
элементарные частицы обладают спином, причем поведение частиц, особенно в
коллективах, часто определяется величиной спина. Появление спина из уравнения
Шредингера не вытекает. Учет релятивистских эффектов приводит к замене
уравнения Шредингера уравнением Дирака. Из уравнения Дирака вытекает
существование спина элементарных частиц и новые законы квантования для этих
частиц.
С учетом спина положение электрона в
атоме характеризуется уже не тремя, а четырьмя квантовыми числами:
главным n,
орбитальным l,
магнитным ml,
магнитным спиновым ms.
В зависимости от величины спина
элементарные частицы разделяют на фермионы и бозоны.
Фермионами называются частицы с
полуцелым спином (названы по имени Э. Ферми). Это электроны, протоны, нейтроны
(для них s=1/2).
Бозонами называются частицы с целым
спином (по имени Ш. Бозе). Это фотоны, π - мезоны (для них s=1), составные
частицы - ядра и т.д.
Системы, состоящие из многих частиц,
описываются Ψ
- функциями,
содержащими координаты этих частиц. Для определения пси-функций надо решить
соответствующее уравнение Шредингера (или Дирака). В зависимости от вида частиц
(фермионы или бозоны) ансамбли частиц ведут себя совершенно по-разному.
Рассмотрим некоторые свойства
ансамблей одинаковых микрочастиц, т.е. частиц, имеющих одинаковые массы,
заряды, спины и другие характеристики. Такие частицы называют тождественными. В
классической физике частицы можно перенумеровать и следить за их движением
(каждая частица имеет свою траекторию). В квантовой механике из-за принципа
неопределенности частицы не имеют траекторий. Кроме этого в квантовой механике
справедлив следующий фундаментальный принцип.
Принцип неразличимости частиц:
Невозможно экспериментально различить тождественные частицы. Смысл этого
принципа можно понять из следующей схемы. Пронумерованные электроны (показаны
как черный и белый шары) по одному распределены в двух ящиках. Для задач
квантовой статистики требуется знать, сколько различных состояний описывают эти
системы.
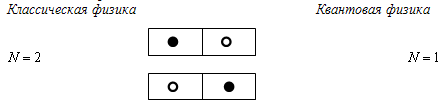
В классической физике имеем два
различных состояния, в квантовой - одно, т.к. с позиций квантовой механики эти
электроны и эти состояния неразличимы. По аналогичной схеме могут располагаться
электроны на различных энергетических уровнях.
Из принципа неразличимости
тождественных частиц следует равенство вероятностей существования двух состояний
 .
.
Отсюда вытекает
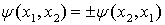 ,
,
т.е. волновые функции могут быть
симметричными или антисимметричными. Частицы с полуцелым спином описываются
антисимметричными волновыми функциями и подчиняются статистике Ферми - Дирака.
Эти частицы называют фермионами. Частицы с нулевым или целым спином описываются
симметричными функциями и подчиняются статистике Бозе-Эйнштейна. Это бозоны.
Теоретическое обоснование такого разделения частиц дал Паули. Для изучения
свойств таких частиц существует специальная наука - статистическая физика.
. Принцип Паули
Построение периодической системы элементов
Менделеева основано в значительной мере на принципе Паули.
Принцип Паули: Системы фермионов
встречаются в природе только в состояниях, описываемых антисимметричными
волновыми функциями.
Для распределения электронов в атоме
принцип Паули можно дать в упрощенной формулировке: В одном и том же атоме не
может быть более одного электрона с одинаковым набором четырех квантовых чисел.
Покажем эквивалентность этих формулировок. Предположим, что два электрона в
атоме находятся в одном и том же квантовом состоянии описываемом функцией 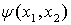 . Эта
функция должна быть антисимметричной
. Эта
функция должна быть антисимметричной
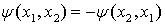 .
.
Но электроны находятся в одинаковых
квантовых состояниях
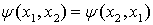 ,
,
следовательно
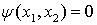 .
.
Максимальное число электронов,
находящихся в состоянии, определяемом главным квантовым числом п, равно
 .
.
Совокупность электронов в атоме,
имеющих одно и то же главное квантовое число п, называют электронной
оболочкой. Для обозначения различных электронных оболочек используются
обозначения

В каждой электронной оболочке
электроны распределяются по подоболочкам (слоям), соответствующим различным
значениям орбитального квантового числа l.
Принцип Паули позволяет объяснить
периодическую систему элементов Д. И. Менделеева и многие особенности поведения
квантовых ансамблей. Детально эти вопросы изучаются в атомной физике.
Представим структуру распределения
электронов вокруг ядра в атоме. На ближней к ядру орбите (правильнее - уровне)
может быть не более 2-х электронов, которые отличаются числом ms (спины
направлены в противоположных направлениях), на следующей орбите - не более 8-ми
электронов и т.д. Внутренние электроны сильнее всего связаны с ядром. Для
внешних электронов связь слабее. Кроме этого, внешние орбиты могут оказаться
незаполненными (незанятые комнаты в гостинице). Основные химические свойства
элементов определяются поведением внешних электронов - их называют валентными.
На каждом уровне электрон обладает
определенной энергией En, п -
номер уровня. Радиусы орбит rn также
квантуются. Для водорода, например, мы получили значения E1=13,55 эВ,
r1=0,528∙10
-10 см.
Рассмотрим кратко электронную структуру атома,
используя химические представления и соответствующую терминологию.
Атомной орбиталью (орбиталью)
называют объем пространства в атоме, в котором с вероятностью 0,95 находится
электрон. Это не совсем правильное определение, но для наших целей оно вполне
пригодно. Орбиталь является химическим эквивалентом электронной оболочки.
Следовательно, каждому главному квантовому числу 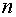 соответствует своя оболочка.
соответствует своя оболочка.
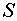 -орбитали имеют сферическую
симметрию, находящиеся в ней электроны называют
-орбитали имеют сферическую
симметрию, находящиеся в ней электроны называют  -электронами. Плотность электронов
-электронами. Плотность электронов 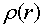 как функция
радиуса имеет вид сферической оболочки и рассматривалась в предыдущей главе.
как функция
радиуса имеет вид сферической оболочки и рассматривалась в предыдущей главе.
Атомную орбиталь схематически удобно
изображать в виде квадрата, называемого квантовой ячейкой, а каждый электрон -
вертикальной стрелкой, обозначающей одно из направлений спина. Таким образом,
каждую атомную структуру можно представить в виде совокупности ячеек. Покажем,
например, электронную структуру атома калия К (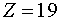 ). Электронная формула калия имеет
вид
). Электронная формула калия имеет
вид
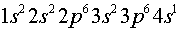
Его электронная структура показана
ниже.
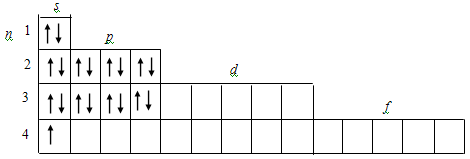
Отметим, что в данном случае после
заполнения 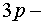 уровня
электроны не застраивают 3d-уровень, а переходят на орбиталь 4s. Это связано с
экранированием ядра и взаимодействием электронов между собой. Для систем
энергетически выгодней (ниже энергия) поместить электрон на уровень 4s. Для
теоретического анализа электронной структуры многоэлектронных атомов необходимо
решить уравнение Шредингера для задачи многих тел. Это очень сложная в
математическом плане задача и она допускает только численное решение.
уровня
электроны не застраивают 3d-уровень, а переходят на орбиталь 4s. Это связано с
экранированием ядра и взаимодействием электронов между собой. Для систем
энергетически выгодней (ниже энергия) поместить электрон на уровень 4s. Для
теоретического анализа электронной структуры многоэлектронных атомов необходимо
решить уравнение Шредингера для задачи многих тел. Это очень сложная в
математическом плане задача и она допускает только численное решение.
В таблице показано подразделение
возможных состояний электрона в атоме на оболочки и подоболочки.
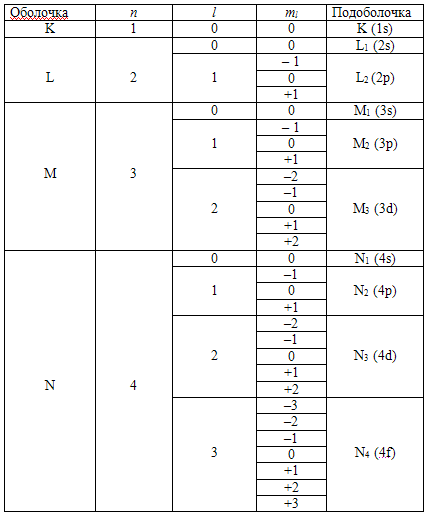
Из этой таблицы видно, как
располагаются электроны вокруг ядра. Отметим, что каждому состоянию
соответствуют два электрона с противоположными значениями спинов 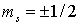 .
.
4. Периодическая система элементов Менделеева
Принцип Паули позволяет объяснить систему
элементов Д. И. Менделеева. Периодичность свойств элементов вытекает из правил
заполнения оболочек вокруг ядра электронами. Рассмотрим более детально схему
построения периодической системы.
Пусть Z
- порядковый номер химического элемента. Он равен числу протонов в ядре или
числу электронов в нейтральном атоме. Будем рассматривать атомы, находящиеся в
основном (невозбужденном) состоянии.
Атом водорода Н содержит один электрон в
состоянии 1s,
т.е.
для него n=1,
l=0,
ml
=0, ms
= 1/2.
Атом гелия Не содержит два электрона в состоянии
1s,
но с антипараллельной ориентацией спинов. Электронная конфигурация атома Не
записывается как 1s2
(два s
- электрона).
Атомом гелия заканчивается заполнение К - оболочки и завершается первый период
системы элементов.
Атом лития (Li)
содержит три электрона (Z=3).
Для атома лития К - оболочка целиком заполнена и третий электрон должен
располагаться в L
- оболочке, т.е. должно быть п = 2, l
= 0. Электронная конфигурация для атома Li:
1s22s.
Атомом лития начинается второй период таблицы Менделеева.
Для атома бериллия Ве (Z=4)
имеем электронную конфигурацию 1s22s2.
У следующих шести элементов идет заполнение подоболочки 2р. Второй
период заканчивается неоном, для которого подоболочка 2р полностью
заполнена.
Атом натрия Na
содержит 11 электронов (Z=11)
и открывает новую М - оболочку. Его электронная конфигурация 1s22s22p63s.
Ниже в таблице приведены распределения электронов по различным уровням для ряда
атомов.

Изменение главного квантового числа п
приводит к изменению не только энергии электрона, но и радиуса орбиты, с ростом
п увеличивается радиус. Полное заполнение электронной оболочки дает
наиболее стабильное состояние атома. Поэтому в конце каждого периода
располагаются инертные газы He,
Ne, Ar.
В первом элементе каждого периода электрон слабо
связан с ядром (ядро экранировано электронами внутренних оболочек), поэтому эти
элементы легко могут отдать свой электрон - это одновалентные металлы K,
Na, которые обладают
одинаковыми химическими свойствами. Повторение характера заполнения электронных
оболочек приводит к периодичности физических и химических свойств элементов.
Так с позиций квантовой механики можно описать
все элементы периодической системы Менделеева. Взаимодействие электронов между
собой приводит к появлению некоторых особенностей в периодической таблице
(лантаниды, актиниды и пр.), которые мы здесь обсуждать не будем.
волновой атом орбиталь рентгеновский
5. Рентгеновские спектры
Источником рентгеновского излучения обычно
является рентгеновская трубка, в которой ускоренные электрическим полем
электроны бомбардируют анод. Возникающее при этом электромагнитное излучение
имеет длину волны λ ~
10 -12 - 10 - 8 м.
Спектр рентгеновского излучения представляет
собой наложение непрерывного и линейчатого спектров. При этом непрерывный
спектр ограничен со стороны коротких длин некоторым значением λmin.
Непрерывный рентгеновский спектр обсуждался в главе 6.

Линейчатый спектр рентгеновского излучения
связан с переходами электронов, расположенных на глубинных электронных
оболочках. Частота рентгеновского излучения определяется законом Мозли:
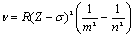 .
.
Здесь σ -
постоянная экранирования, которая учитывает влияние электронного облака, R -
постоянная Ридберга, Z - заряд ядра. Закон Мозли
подобен обобщенной формуле Бальмера.
Серии рентгеновского излучения
обозначают буквами K, L, M, N, O. При
переходе от легких элементов к тяжелым структура спектра не изменяется, он
просто смещается в сторону коротких волн. Образование рентгеновских серий
схематически показано ниже
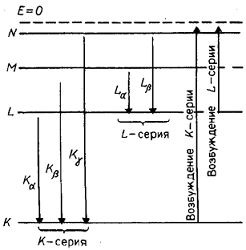
Для линии Кα серии К
имеем σ=1 и закон
Мозли принимает вид
 .
.
Рентгеновские лучи имеют короткую
длину волны и для изучения их дифракции обычные макроскопические дифракционные
решетки непригодны. Роль дифракционной решетки может выполнять атомная решетка
кристалла. В главе, посвященной дифракции была получена формула Брегга - Вульфа
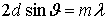 .
.
Рассматривая дифракцию рентгеновских
лучей, можно определить расстояние между атомными плоскостями. Поворачивая
кристалл, можно определить тип его кристаллической структуры. Для исследования
атомной структуры различных кристаллов и соединений созданы специальные разделы
физики: рентгеноструктурный и рентгеноспектральный анализ.
. Вынужденное излучение
Поглощая фотон, электрон может
перейти на более высокий энергетический уровень. Существует общий физический
принцип, согласно которому в состоянии равновесия любая физическая система
стремится к состоянию с минимальной энергией. В соответствии с этим принципом,
возбужденный электрон вернется в исходное состояние, испустив при этом фотон с
частотой, определяемой формулой
 .
.
Проанализируем различные способы
излучения. Для простоты рассмотрим переходы электронов между двумя уровнями

Спонтанным излучением называют
процесс испускания фотона без каких-либо внешних воздействий. Спонтанное
(самопроизвольное) излучение определяется вероятностью перехода или временем
жизни атома в возбужденном состоянии. Спонтанное излучение некогерентно.
Эйнштейн предположил, что кроме
поглощения и спонтанного излучения фотонов существует вынужденное излучение.
Вынужденным излучением называют
процесс испускания фотона под влиянием внешнего воздействия. В качестве такого
внешнего воздействия чаще всего выступает внешнее излучение с частотой
 .
.
При этом атом излучает фотон,
неотличимый от падающего, т.е. вынужденное излучение является когерентным.
Направление фотона, вынужденного излучения совпадает с направлением фотона
вынуждающего излучения. Существование вынужденного излучения является основой
для создания лазеров.
Рассмотрим вынужденное излучение
более подробно. В статистической физике справедлив принцип детального
равновесия, согласно которому при термодинамическом равновесии скорости
протекания прямого и обратного процессов одинаковы. Движущиеся в среде фотоны
участвуют в двух процессах: 1) переводят электроны из основного состояния в
возбужденное; 2) вызывают вынужденное излучение, при котором электроны
переходят из возбужденного состояния в основное, испуская фотон. При обычных
условиях преобладает первый процесс и интенсивность излучения уменьшается.
Заселенностью энергетического уровня
называют число электронов, находящихся на этом уровне. При равновесии
заселенность нижних энергетических уровней гораздо выше, чем высших и
определяется принципом детального равновесия.
Используя принцип детального
равновесия, выведем формулу Планка для плотности энергии излучения. Для этого
рассмотрим переходы электрона между уровнями т и п.
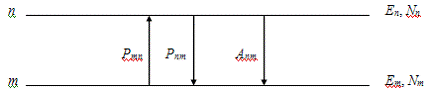
Будем считать, что энергии электрона
на этих уровнях 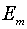 и
и  , причем
, причем 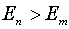 , а число
атомов в состояниях т и п соответственно
, а число
атомов в состояниях т и п соответственно  и
и 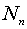 . Пусть Ртn -
вероятность вынужденного перехода электрона из уровня Еm на уровень Еn, а Рпm -
вероятность обратного перехода. Вероятности вынужденных переходов
пропорциональны спектральной плотности энергии вынуждающего излучения
. Пусть Ртn -
вероятность вынужденного перехода электрона из уровня Еm на уровень Еn, а Рпm -
вероятность обратного перехода. Вероятности вынужденных переходов
пропорциональны спектральной плотности энергии вынуждающего излучения 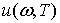
 .
.
Величины Впт и
Втп называются коэффициентами Эйнштейна. Для них должно
выполняться условие
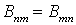 .
.
Равновесие в системе будет
существовать при выполнении условия
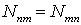 .
.
Здесь 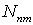 - число атомов, в которых электроны
переходят из уровня п на уровень т за единицу времени. Можно
записать
- число атомов, в которых электроны
переходят из уровня п на уровень т за единицу времени. Можно
записать
 .
.
Число атомов, в которых совершаются
вынужденные переходы, определяется формулами
 .
.
Пусть Апт -
вероятность спонтанного перехода электрона из уровня Еп на
уровень Ет за единицу времени. Тогда
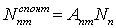 .
.
Из условия равновесия получим
 .
.
Отсюда получим выражение для
плотности энергии
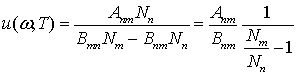 .
.
Распределение атомов по состояниям с
различной энергией определяется законом Больцмана
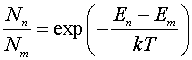
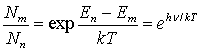 .
.
Следовательно,
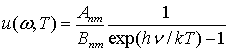 .
.
Для определения множителя Апт
/Bnm
воспользуемся тем, что при малых частотах должна выполняться формула
Релея-Джинса
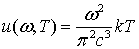 .
.
Полагая
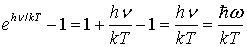 ,
,
Получим
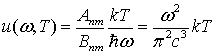 .
.
Следовательно
 .
.
Подставляя это значение в формулу
для плотности энергии, получим формулу Планка
 .
.
. Лазеры
Используя свойства вынужденного
излучения, можно создать оптические квантовые генераторы излучения - лазеры.
Лазеры позволяют во много раз усиливать интенсивность излучения и формировать
коротковолновые электромагнитные волны с совершенно новыми свойствами.
Для того, чтобы среда усиливала
падающее на нее излучение необходимо, чтобы верхние уровни были заселены
больше, чем нижние. Такое состояние называют состоянием с инверсией
заселенности. Эти состояния являются термодинамически неравновесными. Процесс
создания таких неравновесных состояний называют накачкой.
Среды с инверсной населенностью
обладают многими необычными свойствами. Используя закон Больцмана
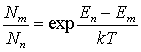
и учитывая условие Еп-Ет
>0 для среды с инверсной населенностью (Nn>Nm) получим Т<0,
т.е. абсолютная температура такой среды является отрицательной.
В средах с инверсией заселенности
преобладает вынужденное излучение и интенсивность света при прохождении такой
среды возрастает. Такая среда называется активной. Если к такой среде формально
применить закон Бугера
 ,
,
то коэффициент поглощения α для такой
среды будет отрицательным.
Как технически осуществляется
процесс накачки? Существуют различные типы лазеров и различные методы создания
инверсной населенности. Рассмотрим метод, который был использован при создании
первого лазера. Рабочим телом этого лазера был цилиндр из рубина диаметром 1
см, длиной 5 см. Торцы цилиндра были тщательно отполированы, покрыты серебром и
представляли собой параллельные зеркала, причем одно из зеркал способно было
пропускать около 8% излучения.
Рубин представляет собой окись
алюминия Al2O3, в котором
некоторые из атомов алюминия заменены атомами хрома. При возбуждении атомы
хрома переходят в возбужденное состояние. Обратный переход происходит в два
этапа.

Переход из метастабильного состояния
в основное запрещен правилами отбора и время жизни атома в метастабильном
состоянии в 105 раз больше, чем в обычном возбужденном состоянии.
Конструктивно процесс накачки
осуществляется с помощью импульсной лампы. При этом основная часть электронов
переходит на уровень 2. Спонтанный переход электронов с уровня 2 на уровень 1
приводит к образованию фотонов, которые движутся в различных направлениях.
Фотоны, движущиеся параллельно оси кристалла, остаются и приводят к образованию
каскада, остальные фотоны выходят из кристалла. После многократных отражений
поток фотонов усиливается и наконец мощный импульс выходит через полупрозрачную
грань рубина.
Такой лазер работает в импульсном
режиме и после каждого импульса накачки выпускает серию импульсов излучения.
Существуют лазеры непрерывного
действия, например, лазеры, работающие на смеси атомов неона и гелия. В газовых
лазерах инверсия населенности уровней осуществляется электрическим разрядом,
возбуждаемым в газах. Электроны, образующиеся в разряде, при столкновении
возбуждают атомы гелия, которые переходят в возбужденное состояние 3.

Возбужденные атомы гелия
сталкиваются с атомами неона. При этом электроны неона переходят на один из
возбужденных уровней, близких к уровню гелия. Переход атома неона из
возбужденного состояния 3 в состояние 2 приводит к лазерному излучению.
Характерные свойства лазерного
излучения:
1) строгая
монохроматичность (Δλ ~
10 -10 см);
2) высокая
временная и пространственная когерентность;
3) большая
плотность энергии;
4) узость
пучка.
КПД лазеров составляет от 0,01% до 75%. Применение:
обработка материалов (отверстия, шлифовка), сварка, дефектоскопия, бескровный
хирургический нож, кинетика химических реакций, разделение изотопов,
управляемый термоядерный синтез, голография, военное дело, измерительная
техника и т.д.
. Основные формулы физики атомов и молекул
. Связь между механическим и магнитным моментами
импульса
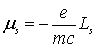 .
.
1.
Длина волны де Бройля
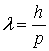 .
.
2. Принцип неопределенности
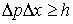 .
.
3. Закон Мозли
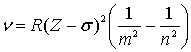 .
.
Список использованной литературы и
источников
. Трофимова Т.И. Курс физики, М.:
Высшая школа, 1998, 478 с.
. Трофимова Т.И. Сборник задач по
курсу физики, М.: Высшая школа, 1996, 304 с.
. Волькенштейн В.С. Сборник задач по
общему курсу физики, СПб.: "Специальная литература", 1999, 328 с.
. Трофимова Т.И., Павлова З.Г.
Сборник задач по курсу физики с решениями, М.: Высшая школа, 1999, 592 с.
. Все решения к "Сборнику задач
по общему курсу физики" В.С. Волькенштейн, М.: Аст, 1999, книга 1, 430 с.,
книга 2, 588 с.
. Красильников О.М. Физика.
Методическое руководство по обработке результатов наблюдений. М.: МИСиС, 2002,
29 с.
. Супрун И.Т., Абрамова С.С. Физика.
Методические указания по выполнению лабораторных работ, Электросталь: ЭПИ
МИСиС, 2004, 54 с.