|
номер задания
|
m (H2O), г
|
m (в-ва), (г)
|
d (р-ра), г/см3
|
растворенное
вещество
|
351
|
19
|
1,14
|
Ni2
(SO4) 3
|
По условию задачи 19г сульфата никеля (Ni2 (SO4) 3)
растворено в 351г воды. Найдем массу раствора:
m (раствор) = m (H2O) + m (Ni2 (SO4) 3) = 351 +
19 = 370г.
Далее составляем пропорцию:
В 370 г раствора содержится 19 г Ni2 (SO4) 3,В 100 г
раствора содержится х г Ni2 (SO4) 3.
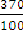 =
= 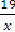
х = 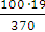 = 5,14г (содержится в
100 г раствора).
= 5,14г (содержится в
100 г раствора).
Таким образом, процентная концентрация
данного раствора сульфата никеля C% (Ni2 (SO4) 3) = 5,14%.
Для расчета молярной концентрации
требуется найти, сколько моль содержится в 1л раствора (1000 мл).
Используя плотность раствора, рассчитаем,
сколько весят 1000 мл:
m (раствор) = d (раствор) · V (раствор) = 1,14 ∙
1000 = 1140 г.
Рассчитаем массу сульфата никеля (III) в 1140г раствора.
Составляем пропорцию:
В 370 г раствора содержится 19 г сульфата
никеля (III),
В 1140 г раствора содержится х г сульфата
никеля (III).
/1140=19/х
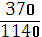 x = 1140х19/370
= 58,54г
x = 1140х19/370
= 58,54г
Таким образом, в 1000 мл раствора содержится 58,54г сульфата
никеля (III). Используя молярную массу сульфата
никеля (III), которую можно определить по таблице
элементов, найдем количество вещества, содержащееся в 1000мл г раствора:
М (Ni2 (SO4) 3) = (2 ∙ 59 + 3·32 + 12·16) г/моль = 406
г/моль,
n (Ni2 (SO4) 3) = m (Ni2
(SO4) 3) / M (Ni2 (SO4) 3)
= 58,54/406 = = 0,144 моль
Таким образом, молярная концентрация данного раствора сульфата
никеля (III) СM (Ni2 (SO4) 3) = 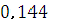
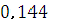 моль/л. Найдем моляльную концентрацию данного раствора.
Моляльность раствора показывает количество (число моль) растворенного вещества
в 1 кг растворителя. Для вычисления моляльности раствора надо знать число
килограмм растворителя в растворе.
моль/л. Найдем моляльную концентрацию данного раствора.
Моляльность раствора показывает количество (число моль) растворенного вещества
в 1 кг растворителя. Для вычисления моляльности раствора надо знать число
килограмм растворителя в растворе.
m (H2O) = m (раствор) - m (соль)
m (растворитель) = 1,14 - 0,05854 = 1,08 кг.
Рассчитаем моляльную концентрацию
Сm (Ni2 (SO4) 3) = 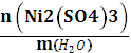
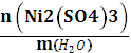 =
= 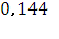 0,144 =0,133моль/кг воды
0,144 =0,133моль/кг воды
Титр вещества (T) -
показывает, сколько грамм вещества содержится в 1 мл раствора. Составим
пропорцию:
В 1000мл раствора содержится 58,54г сульфата никеля (III),
В 1 мл раствора содержится х г сульфата никеля (III).
1000/1=58,54/х
x = 58,54/1000 = 0,0585 г/мл
Следовательно, Т = 0,0585 г/мл
Задание 4
На основании значений стандартных энтальпий образования и
абсолютных стандартных энтропий веществ вычислить величину ΔGх. р. и сделать вывод о самопроизвольности протекания заданной реакции в
стандартных условиях. Если в задании даны значения ΔGºобр., то ΔGх. р. рассчитывается непосредственно, не используя формулу Гиббса. Во
всех заданиях значения ΔНºобр. и ΔGºобр. заданы в кДж/моль, а значения Sºабс. - в Дж/моль·К. Реакции необходимо предварительно уравнять.
СН3ОН (ж.) +3O2 (г.) → 4Н2О
(г.) + 2СО2 (г.)
ΔНºобр.: - 201,17 - 241,83 - 393,51
Sºабс.: 126,8 205,03 188,72
213,65
Используем следствие из закона Гесса:
ΔHх. р. = ΔHºобр. (Н2О (ж.)) ·4
моль + ΔHºобр. (СО2 (г.)) ·2
моль - - ΔHºобр. (СН3ОН (ж.)) ∙2 моль.
ΔHх. р. = - 241,83∙ 4 +
(-393,51) ∙ 2 - (-201,17) ∙ 2 =
= - 967,32 - 787,02 + 402,34 = - 1352 кДж.
Изменение энтропии при проведении химической реакции ΔSх. р. равно сумме Sºабс. продуктов реакции (с
учетом коэффициентов реакции) за вычетом суммы энтропий реагентов (с учетом
коэффициентов реакции).
ΔSх. р. = Sºабс. (. (Н2О (ж.)) ·4 моль + Sºабс. (СО2 (г.)) ·2 моль -
Sºабс. (СН3ОН (ж.)) ∙2
моль. - Sºабс. (O2 (г.)) ·3 моль
ΔSх. р. = 188,72 · 4 + 213,65·2 -
126,8∙2 - 205,03 ∙ 3 =
= 754,88 + 427,3 - 253,6 - 615,09 = 313,49 Дж/К. = 0,313
кДж/К
Для определения принципиальной возможности протекания реакции
при заданной температуре используем формулу Гиббса, связывающую свободную
энергию Гиббса при данной температуре T с энтропией и энтальпией реакции:
ΔGх. р. = ΔHºх. р. - T · ΔSºх. р.
Находим ΔGх. р при Т = 298К
ΔGх. р. = - 1352 - 298 · 0,313 = -
1352 - 93,27 = - 1445,27 кДж.
ΔGх. р. < 0, следовательно,
заданная реакция самопроизвольно протекает в стандартных условиях.
Задание 5
Составьте молекулярные уравнения реакций, которым
соответствуют следующие ионно-молекулярные уравнения в таблице.
Таблица
|
номер задания
|
реакция 1
|
реакция 2
|
|
91
|
H+ + OH - = H2O
|
Pb2+ + S2 - = PbS
|
H+ + OH - = H2O
Для получения воды необходимо взять два растворимых вещества,
одно из которых содержит ион водорода H+, а другое - гидроксид-анион OH-. Ион водорода образуется
при диссоциации, например, соляной кислоты (HCl), а гидроксид-анион -
при диссоциации гидроксида калия (KOH). Составим молекулярное уравнение реакции:
HCl + KOH = KCl + H2O.
Pb2+ + S2 - = PbS
Для получения сульфида свинца (PbS) необходимо взять два
растворимых вещества, одно из которых содержит ион свинца Pb2+, а другое - cульфид-анион S2-. Катион свинца
образуется при диссоциации Pb (NO3) 2, а cульфид-анион - при
диссоциации Na2S. Составляем молекулярное уравнение реакции между указанными
веществами:
Pb (NO3) 2 + Na2S = PbS + 2NaNO3
уравнение реакция химическое соединение
Задание 6
Составьте ионные и молекулярные уравнения гидролиза солей,
приведенных в вашем задании, а также напишите выражения для констант гидролиза:
нитрат свинца (II), карбонат калия.
Составляем уравнения гидролиза нитрата свинца (II).
2. Известно, что катиону Pb2+ соответствует слабое
основание, а иону NO3 - сильная кислота. Таким образом, гидролиз идет по катиону.
. Уравнение гидролиза: Pb2+ + HOH ↔ (PbOH) + + H+. Закономерно, что
положительный катион Pb2+ притягивает к себе из молекулы воды отрицательную
частицу OH - и образуется составной катион с зарядом +1. Связывание катионом Pb2+ частиц OH - приводит к накоплению в
растворе избытка ионов H+ и, следовательно, в результате гидролиза в
растворе создается кислая среда.
Запишем выражение для константы гидролиза:
Kг = 

4. При составлении уравнения в молекулярной форме,
учитываем, что всем положительным ионам соответствуют имеющиеся в растворе в
свободном виде отрицательные ионы NO3-. С учетом зарядов ионов составляем
электронейтральные молекулы:
Pb (NO3) 2 + H2O
=Pb (OH) NO3 + HNO3
Составляем уравнения гидролиза карбоната калия.
. Диссоциация соли: K2CO3= 2K+ + CO32-.
2. Известно, что катиону K+ соответствует сильное
основание, а иону CO32 - слабая кислота. Таким образом, гидролиз идет по аниону.
. Уравнение гидролиза: CO32 - + HOH ↔ HCO3 - + OH-. Закономерно, что
отрицательный ион CO32 - притягивает к себе из молекулы воды положительную частицу H+ и образуется составной
анион с зарядом - 1. Связывание анионом CO32 - частиц H+ приводит к накоплению в
растворе избытка ионов ОH - и, следовательно, в результате гидролиза в
растворе создается щелочная среда.
Запишем выражение для константы гидролиза:
Кг = 

4. При составлении уравнения в молекулярной форме,
учитываем, что всем отрицательным ионам соответствуют имеющиеся в растворе в
свободном виде положительные ионы K+. С учетом зарядов ионов составляем
электронейтральные молекулы:
K2CO3+ HOH ↔ KHCO3 + KOH.
Задание 7
Составить уравнения ОВР, идущих по схемам, представленным в
таблице.
Таблица
|
номер задания
|
Схемы ОВР
|
|
133
|
Cr + HNO3
(конц.) → Cr (NO3)
3 + NO + H2O (при
нагревании) SiO2 + C + Cl2 → SiCl4 + CO (при нагревании) As + HNO3 (конц.)
+ H2O → H3AsO4 + NO
|
Cr + HNO3 (конц.) → Cr (NO3)
3 + N O + H2O (при > t)
1. Элемент Cr здесь будет восстановителем, а элемент N - окислителем:
Cr → Cr3+
N5+ → N2+
2. Хром отдает три электрона, в то время как азот
принимает три электронов:
Cr - 3ē → Cr3+
N5+ + 3ē → N2+
3. Число отданных электронов равно числу принятых
Cr - 3ē → Cr3+
N5+ + 3ē → N2+
4. Складывая полуреакции, получим:
Cr + N5+ → Cr3+ + N2+
5. Перед HNO3 необходимо поставить 4, т.к. часть молекул HNO3 не принимает участия в
окислении, но необходима для связывания ионов хрома. Для уравнивания атомов
водорода и кислорода необходимо поставить коэффициент 2 перед H2O.
Cr + 4HNO3 (конц.) → Cr
(NO3) 3 + NO + 2H2O
6. Проверяем коэффициенты, пересчитывая каждый тип
атомов слева и справа от знака равенства.
SiO2 + C + Cl2 → SiCl4 + CO (при нагревании)
. Элемент C здесь будет восстановителем, а элемент Cl - окислителем:
C0 → C2+
Cl0 → Cl1-
2. Углерод отдает два электрона, а два атома хлора
принимают два электронов:
C - 2ē → C2+
Cl + 1ē →Cl1-
. Умножим на коэффициенты, учитывающие стехиометрию
молекул. Чтобы получить равенство отданных и принятых электронов умножим первое
уравнение на 2, а второе - на 1:
2 C - 2ē → C2+
2Cl2 + 4ē →4Cl1-
4. Складывая полуреакции, получим:
C + 2Cl2→ 2C2+ + 4Cl1-
5. Подставляя полученные коэффициенты в схему ОВР
получаем:
SiO2 + 2C +2Cl2 →
SiCl4 + 2CO
6. Проверяем коэффициенты, пересчитывая каждый тип
атомов слева и справа от знака равенства.
As + HNO3 (конц.) + H2O
→ H3AsO4 + NO
1. Элемент As здесь будет восстановителем, а элемент N - окислителем:
As → As 5+
N5+ → N2+
2. Мышьяк отдает пять электронов, в то время как азот
принимает три электронов:
As - 5ē → As 5+ , N5+ + 3ē → N2+
. Чтобы получить равенство отданных и принятых
электронов умножим первое уравнение на 3, а второе - на 5:
As - 5ē → As 5+
5 N5+ + 3ē → N2+
. Складывая полуреакции, получим:
As + 5N5+ → 3 As 5++ 5N2+
. Подставляя полученные коэффициенты в схему ОВР
получаем:
3As + 5HNO3 (конц.) + 2H2O
→3H3AsO4 + 5NO
Для уравнивания атомов водорода и кислорода необходимо
поставить коэффициент 2 перед H2O.
. Проверяем коэффициенты, пересчитывая каждый тип
атомов слева и справа от знака равенства.
Задание 8
Для своего варианта в таблице подобрать металл в пару к
заданному Me1. Концентрацию соли выбираемого металла Me2 принять равной 0,1
моль/л. Подобрав металл, составить схему Г.Э. и выполнить пункты 1-3
предыдущего задания (т.е. заданий 140-150):
. Написать электронные уравнения анодного и катодного
процессов, происходящих при работе гальванического элемента.
2. Рассчитать ЭДС гальванического элемента.
. Записать суммарное уравнение ОВР.
Таблица