Синтез гран-триамминонитрозокомплекса рутения
Оглавление
Введение
1. Литературный обзор
2. Экспериментальная часть
. Результаты и обсуждение
. Основные результаты и
выводы
Введение
Яркой особенностью координационной химии рутения
является способность к образованию нитрозокомплексов при взаимодействии самых
разнообразных солей рутения с рядом азотсодержащих реагентов. Группировка (RuNO)3+,
степень окисления металла в которой принята равной +2, может входить в состав
как катионных, так и анионных октаэдрических комплексов. Эта группировка
обладает высокой устойчивостью к различным химическим воздействиям и может быть
разрушена только в очень жестких условиях. Такая повышенная стабильность
определяет неизменный интерес исследователей всего мира к этим соединениям на
протяжении всего прошлого столетия и в настоящее время.
Новые направления в химии нитрозокомплексов
рутения обусловлены двумя открытиями, датированными последним десятилетием XX
века. Первое - это участие оксида азота(II)
и соединений, его содержащих, во многих физиологических процессах. Исследования
биологической активности некоторых комплексов нитрозорутения показали, что
препараты на их основе оказались менее токсичными и более эффективными, чем
используемые в настоящее время в медицинской практике.
Другое активно развивающееся в настоящее время
направление в химии нитрозокомплексов связано с наличием двух донорных атомов в
молекуле монооксида азота. В стабильном состоянии эта молекула координирована к
переходному металлу атомом азота. При облучении исходного нитрозокомплекса
жестким лазерным излучением способ координации NO
меняется. Способность нитрозокомплексов к обратимому фотоиндуцированному
переходу в долгоживущее метастабильное состояние открывает перспективу для
синтеза гибридных материалов, сочетающих в одной кристаллической решетке два
или более физических свойства, таких как проводимость, магнетизм, особые
оптические свойства и т.д. Объекты, в которых магнитные свойства могут обратимо
меняться под действием света, представляют большой научный и практический
интерес, в частности, в качестве материалов для записи информации. Комбинация
этих свойств в одной кристаллической решетке и их синергизм могут привести к
новым физическим явлениям и новым приложениям в молекулярной электронике.
Среди огромного разнообразия нитрозокомплексов
рутения особый интерес представляют амминокомплексы, как наиболее устойчивые и
наименее токсичные. Перспектива масштабного применения таких комплексов в
качестве биологически активных препаратов и предшественников для получения
полифункциональных фотомагнитных материалов и порошков металлических сплавов
требует от исследователей разработки методов синтеза этих соединений с высокими
выходами и подробного изучения их свойств.
1. Литературный
обзор
В настоящее время в литературе описаны пять
нитрозокомплексов триамминового ряда. Первый комплекс состава [Ru(NO)(NH3)3Cl2]Cl
× H2O
синтезирован по следующей методике. Раствор Na2[Ru(NO)(NO2)4OH]
× 2H2O
нагревали с концентрированным раствором NH3
в течение 3-5 ч, после чего к полученной смеси добавляли концентрированную
соляную кислоту и выпаривали досуха. Авторы отмечают, что такая процедура
приводит к образованию смеси комплексов гран-[Ru(NO)(NH3)2Cl3],
[Ru(NO)(NH3)3Cl2]Cl
× H2O
и [Ru(NO)(NH3)3Cl(H2O)]Cl2.
Реакционную массу растворяли в воде и отделяли труднорастворимый гран-[Ru(NO)(NH3)2Cl3],
а оставшийся маточный раствор, содержащий [Ru(NO)(NH3)3Cl2]Cl
и [Ru(NO)(NH3)3Cl(H2O)]Cl2,
испаряли досуха. Сухой остаток помещали в кварцевую лодочку и выдерживали при
215 °С
в атмосфере азота, полученный продукт перекристаллизовывали из 1 М HCl.
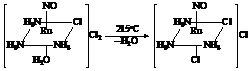
Дальнейшее нагревание полученного комплекса (до
260 °С)
приводит к потере одной молекулы аммиака и образованию ос-[Ru(NO)(NH3)2Cl3]:
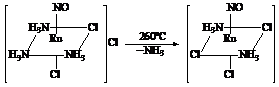 .
.
По мнению авторов, образующийся комплекс должен
иметь транс-конфигурацию, что обусловлено большим транс-влиянием
хлора по сравнению с аммиаком. За счет этого молекула аммиака на координате Cl-Ru-NH3
должна быть менее прочно связанной, чем на координате H3N-Ru-NH3,
и при нагревании отщепляться в первую очередь.
Для полученного [Ru(NO)(NH3)3Cl2]Cl
× H2O
был сделан элементный анализ на металл, азот и галоген, результаты которого
хорошо согласуются с вычисленным содержанием элементов для данного состава.
Результаты измерения молярной электропроводности раствора этого соединения
показали, что оно является двухионным электролитом. В электронном спектре
поглощения раствора хлорида дихлоротриамминнитрозорутения наблюдаются 3 полосы
поглощения: l1 = 242 (e
= 2950), l2 = 343 (e
= 80) и l3
= 242 нм (e = 120 л/моль·см). Авторы обращают внимание на
расщепление полос n (Ru-NH3)
и r (NH3)
в ИК-спектре полученного соединения, что они объясняют неравноценностью
координат H3N-Ru-NH3
и Cl-Ru-NH3,
однако подробного описания спектра не приводят.

Второй комплекс нитрозорутения триамминового
ряда [Ru(NO)(NH3)3(H2O)Cl]Cl2
(в транс-положении к NO
находится молекула Н2О) описан в работе. Водный раствор (NH4)2[Ru(NO)Cl5]
нагревали с концентрированным раствором NH3
на водяной бане в течение 15-20 мин. Затем раствор упаривали до минимального
объема, охлаждали и отделяли осадок транс-[Ru(NO)(NH3)4OH]Cl2.
К маточному раствору добавляли концентрированную соляную кислоту и
отфильтровывали осадок [Ru(NO)(NH3)3Cl(H2O)]Cl2,
выход которого составлял ~ 45 %.
Выделенный продукт исследован методами ИК-спектроскопии, рентгенофазового и
рентгеноструктурного анализа (пр. гр.
Pna21; а
=
13,151(2),
b
=
6,852(1),
c
=
10,361(1)
Å; Z =
4).
Авторы отмечают, что попытка получения соединения состава [Ru(NO)(NH3)3Cl2]Cl
обработкой полученного аквакомплекса [Ru(NO)(NH3)3Cl(H2O)]Cl2
концентрированной соляной кислотой при нагревании в течение получаса не
увенчалась успехом.
Второй метод синтеза этого нитротриамминокомплекса
сводился к нитрованию хлороакватриаммина, сопровождающемуся отщеплением протона
от координированной молекулы воды. К водному раствору [RuNO(NH3)3(H2O)Cl]Cl2
добавляли NaNO2
и нагревали в течение 1 ч. Маточный раствор упаривали до минимального объема и
отфильтровывали [RuNO(NH3)3(NO2)(ОH)]Cl
×
0,5H2O.
Для очистки комплекс переосаждали из водного раствора спиртом. Выход целевого
продукта составил 50-60 %.
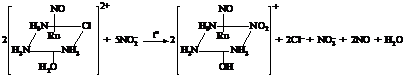
триамминовый
нитрозокомплекс хлороакватриаммин протон
Полученный [RuNO(NH3)3(NO2)(ОH)]Cl
×
0,5H2O
исследован методами ИК-спектроскопии, рентгенофазового и рентгеноструктурного
анализа (пр. гр.  ;
а
=
6,5752(7),
b
=
11,0900(18),
c
=
12,296(2)
Å; a = 79,692(13), b =
85,088(11), g = 87,395(11)°; Z
=
4).
;
а
=
6,5752(7),
b
=
11,0900(18),
c
=
12,296(2)
Å; a = 79,692(13), b =
85,088(11), g = 87,395(11)°; Z
=
4).
Четвертым триамминонитрозокомплексом рутения
является [RuNO(NH3)3(H2O)Cl](NO3)2.
Получить данный комплекс можно взаимодействием [RuNO(NH3)3(NO2)OH]Cl*0,5H2O
с 3 M HNO3 при нагревании на водяной бане с выходом 60-65%:
[RuNO(NH3)3(NO2)OH]Cl
+ 5HNO3 = 3[RuNO(NH3)3(H2O)Cl](NO3)2
+ 2NO↑ + H2O
Одним из важнейших результатов работы является
вывод о том, что наличие хлорид-ионов в разбавленных азотнокислых растворах
нитрозокомплексов рутения препятствует координации нитрит-иона и приводит к
образованию нитрозохлорокомплексов рутения. Другим способом получения [RuNO(NH3)3(H2O)Cl](NO3)2
является обмен внешнесферными анионами при взаимодействии [RuNO(NH3)3(H2O)Cl]Cl2
с 8 М HNO3 при комнатной температуре:
[RuNO(NH3)3(H2O)Cl]Cl2
+ 2HNO3 = [RuNO(NH3)3(H2O)Cl](NO3)2
+ 2HCl
Пятым триамминонитрозокомплексом рутения
является гран-[RuNO(NH3)3Cl2]Cl,
получаемый по следущей методике: навеску KNa3[Ru(NO2)6]
растворили в концентрированном аммиаке. Из полученного раствора с небольшим
выходом были выделены оранжевые кристаллы гран-Na[Ru(NH3)3(NO2)3]*3H2O:
3[Ru(NO2)6]
+ 3NH3 = гран-Na[Ru(NH3)3(NO2)3]
+ 2NaNO2 + KNO2.
Полученные кристаллы затем обрабатывали соляной
кислотой, в результате чего получилось незначительное количество гран-[RuNO(NH3)3Cl2]Cl:
3Na[Ru(NH3)3(NO2)3]
+ 10HCl = 3[RuNO(NH3)3Cl2]Cl + NaCl + 5H2O
+ 4NO↑ + 2NaNO3.
. Экспериментальная
часть
Исходные реагенты, аппаратура и методы измерений
В качестве исходного рутенийсодержащего
соединения был взят 0,5 М раствор хлорида рутения(III) в 0,5 M
соляной кислоте, приготовленный О.А. Плюсниной в лаб. химии редких платиновых
металлов ИНХ СО РАН.
Рентгенофазовый анализ измельченных кристаллов
проведен на дифрактометре ДРОН-УМ1 (R=192мм, CuKα-излучение,Ni-фильтр,
детектор сцинтилляционный с амплитудной дискриминацией). Образцы наносили
тонким слоем на гладкую сторону стандартной кварцевой кюветы.
ИК спектры поликристаллических образцов в
таблетках KBr записывали на спектрофотометре Scimitar FTS 2000 в области
4000-400см-1.
1.Синтез
Na2[RuNO(NO2)4OH]*2H2O.
Налила в стаканчик ~50 мл 0,5 M
RuCl3 в 0,5 M
HCl. Добавляла 21,447 г NaNO2 мелкими порциями, после чего поставила
раствор на водяную баню. В ходе реакции выделялись оксиды азота. После того,
как раствор поменял цвет с темно-коричневого на красный, выключила баню и
оставила раствор на неделю под тягой. Получилась смесь Na2[RuNO(NO2)4OH]
c NaNO2,
которую сначала промыла ацетоном, затем отфильтровала на фильтре Шотта (40 пор)
при пониженном давлении. Масса полученной соли равна 6,7028 г, выход составил
~65%.
.Синтез Na4[Ru(NO2)6]*nH2O
(n=1 ; 2).
.Синтез гран-Na[Ru(NH3)3(NO2)3]*2H2O.
Перенесла 0,8630 г смеси Na4[Ru(NO2)6]*H2O
и Na4[Ru(NO2)6]*2H2O
в стаканчик, добавила 5 мл концентрированного NH3 и поставила
раствор на магнитную мешалку. Через 2,5 ч. смесь растворилась, после чего
стакан с раствором оставила под тягой на неделю. Из раствора выделились желтые
кристаллы, которые отфильтровала на стеклянном фильтре (40 пор) ~80% раствором
C2H5OH, затем ацетоном. Масса кристаллов Na[Ru(NH3)3(NO2)3]*2H2O
составила 0,5858 г, выход ~95%.
. Синтез гран-[RuNO(NH3)3Cl2]Cl.
Перенесла 0,4683 г Na[Ru(NH3)3(NO2)3]*2H2O
в стакан, добавила 10 мл H2O, затем такой же объём концентрированной
HCl. Вещество плохо растворяется в кислоте, в ходе реакции раствор не шипел.
Смесь поставила на водяную баню и нагревала 3 ч. Через неделю перенесла
полученные красно-бордовые блестящие кристаллы с помощью ~1 мл H2O
на стеклянный фильтр (40 пор) и отфильтровала вещество ~80% раствором C2H5OH,
затем ацетоном. Выход составил ~95% (0,3648 г).
. Взаимодействие гран-[RuNO(NH3)3Cl2]Cl
с NaNO2.
Перенесла 0,2367 г [RuNO(NH3)3Cl2]Cl
и 0,1585 г NaNO2 в стакан, добавила 10 мл H2O и поставила
раствор на водяную баню на 7 ч. Раствор был красного цвета, газ не выделялся.
Через неделю под тягой получились с незначительным выходом коричневые кристаллы
[RuNO(NH3)3Cl2][RuNO(NH3)2(NO2)2OH]Cl.
Отфильтровала их на фильтре Шотта (40 пор) минимальным объемом H2O,
затем ~80% раствором C2H5OH и ацетоном.
. Результаты и
обсуждение
В результате выполнения курсовой работы в 4
стадии нами был получен граневой изомер нитрозотриамминокомплекса рутения.
Процессы, происходящие в ходе проведенных синтезов, можно описать следующими
реакциями:
3
+ HCl + 7NaNO2 = Na2[RuNO(NO2)4OH]
+ 4NaCl + NaNO3 + NO↑;
Na2[RuNO(NO2)4OH]
+ 5NaNO2 = 2Na4[Ru(NO2)6] + 2NO↑
+ NaNO3 + H2O;
Na4[Ru(NO2)6]
+ 3NH3 = Na[Ru(NH3)3(NO2)3]
+ 2NaNO2;
Na[Ru(NH3)3(NO2)3]
+ 10HCl = 3[RuNO(NH3)3Cl2]Cl + NaCl + 5H2O
+ 4NO↑ + 2NaNO3;
2[RuNO(NH3)3Cl2]Cl
+ 3NaNO2 =
= [RuNO(NH3)3Cl2][Ru(NO)(NH3)2(NO2)2OH]Cl
+ 3NaCl + N2↑ + H2O.
Индивидуальность и чистота промежуточных
соединений подтверждены методами ИК спектроскопии и РФА. ИК спектр целевого
продукта гран-[RuNO(NH3)3Cl2]Cl
приведен на рис. 1. Дифрактограмма полученного комплекса (рис. 2) полностью
совпадает с теоретической, рассчитанной по данным монокристального
рентгеноструктурного исследования [8].
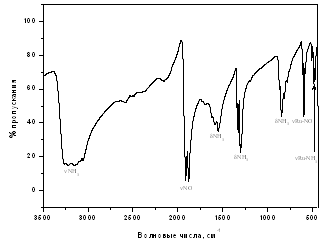
Рис. 1. ИК-спектр полученного комплекса
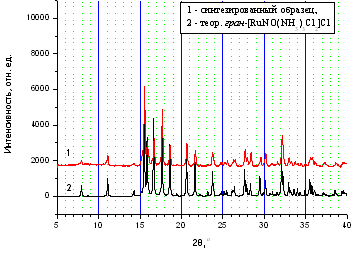
Рис. 2. Дифрактограмма
полученного комплекса в сравнении с теоретической для гран-[RuNO(NH3)3Cl2]Cl.
При взаимодействии Na4[Ru(NO2)6]
c NH3(конц)
можно ожидать образование двух продуктов: гран-[Ru(NH3)3(NO2)3]
и цис-[RuNO(NH3)2(NO2)2OH]
в зависимости от соотношения скоростей реакций, схема которых приведена на рис.
3. В курсовой работе Басалгина П.А. приведена методика, по которой он кипятил K4[Ru(NO2)6]
в NH3(конц).
Поскольку в продуктах реакций образующихся нитроамминов с соляной кислотой не
обнаружилось триамминокомплекса с транс-координатой NH3-Ru-NO,
поэтому автор делает вывод, что в продуктах реакции K4[Ru(NO2)6]
в NH3(конц)
не было гран-[Ru(NH3)3(NO2)3].
Следовательно, при кипячении гексанитрокомплекса рутения в водном аммиаке
скорость взаимодействия [Ru(NO2)6]4-
с водой оказывается существенно выше, чем скорость замещения нитрит-иона на
аммиак. Дополнительными экспериментами было показано, что увеличение
продолжительности кипячения K4[Ru(NO2)6]
в NH3(конц)
все же приводит к образованию триамминокомплекса с заметным выходом, однако
этот комплекс имеет осевое строение. У нас получился гран-[Ru(NH3)3(NO2)3],
так как реакцию проводили при комнатной температуре, при которой протекает
более медленная реакция.
Рис. 3. Схема возможных реакций, протекающих при
взаимодействии гексанитрорутенат-иона с аммиаком и последующей обработке
продуктов соляной кислотой
Следующим этапом нашей работы было исследование
продуктов реакции, образующихся при взаимодействии [RuNO(NH3)3Cl2]Cl
с NaNO2.
Продукт этой реакции был исследован нами методами ИК спектроскопии (рис. 4) и
рентгеноструктурного анализа (рис. 5).

Рис. 4.
ИК-спектр
[RuNO(NH3)3Cl2][Ru(NO)(NH3)2(NO2)2OH]Cl.
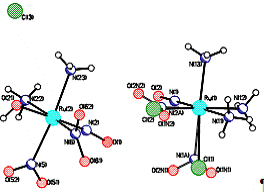
Рис. 5. Строение комплексных частиц в [RuNO(NH3)3Cl2][Ru(NO)(NH3)2(NO2)2OH]Cl
В результате взаимодействия гран-[RuNO(NH3)3Cl2]Cl
с NaNO2
нами было выделено в твердую фазу соединение, содержащее две разных комплексных
частицы: [RuNO(NH3)3Cl2][Ru(NO)(NH3)2(NO2)2OH]Cl,
Таким образом, часть исходного комплекса гран-[RuNO(NH3)3Cl2]Cl
в выбранных условиях не прореагировала с NaNO2,
а другая часть под действием NaNO2
разрушилась, причем замещению подверглись не только координированные
хлорид-ионы, но и аммиак в транс-положении к NO.
Предположительно, первым продуктом реакции является комплекс [RuNO(NH3)2Cl2OH],
поскольку в щелочной среде наиболее стабильно положение OH-группы
напротив NO.
По-видимому, замещение хлорид-ионов на нитрит-ионы в этом комплексе происходит
намного быстрее, чем в исходном гран-[RuNO(NH3)3Cl2]+,
в результате чего мы имеем с одной стороны динитрокомплекс, а с другой -
комплекс, вообще не содержащий нитрогрупп.
Основные результаты и выводы
1. При взаимодействии Na4[Ru(NO2)6]*nH2O
(n=1;2) с
концентрированным аммиаком при комнатной температуре образуется гран-Na[Ru(NH3)3(NO2)3]*2H2O
с выходом ~95%.
2. Реакция гран-Na[Ru(NH3)3(NO2)3]*2H2O
с HCl(конц) приводит
к образованию гран-[RuNO(NH3)3Cl2]Cl с
выходом ~95%.
. Взаимодействие гран-[RuNO(NH3)3Cl2]Cl
с NaNO2
привело к образованию двойного комплекса [RuNO(NH3)3Cl2][Ru(NO)(NH3)2(NO2)2OH]Cl,
строение которого установлено методами ИК-спектроскопии и РСА.