Редуцирующие сахара
Оглавление
Введение
Сахар.
Редуцирующие сахара
Инвертный
сироп
Редуцирующий
сахар
Значение
сахаров для организма
Методы
определения сахара в кондитерских изделиях
Экспериментальная
часть
Приготовление
медного щелочно-цитратного раствора(реактива Бенедикта)
Проведение
анализа
Обсуждение
результатов исследования
1. Определение
содержания редуцирующих сахаров в мармеладе
2. Определение
содержания редуцирующих сахаров в пастиле
3. Определение
содержания редуцирующих сахаров в карамели
Выводы
Список
литературы
Приложение
1
Введение
Йодометрией называют метод объемного анализа, в
основе которого лежат реакции:+ 2е → 2I―
I― ―2e
→ I2
Методом йодиметрии можно определять как окислители,
так и восстановители.
Определение окислителей. Методом йодиметрии
можно определять те окислители, которые количественно окисляют I―
в свободный I2. Чаще всего определяют перманганаты, бихроматы, соли меди (II),
соли железа (III), свободные галогены и др. Индикатором в методе йодиметрии
служит раствор крахмала. Это чувствительный и специфический индикатор,
образующий с йодом адсорбционное соединение синего цвета.
Определение восстановителей. Из числа восстановителей
этим методом чаще всего определяют сульфиты, сульфиды, хлорид олова (II) и др.
Рабочим раствором является раствор йода I2. Метод йодиметрии широко применяется
в химическом анализе. Этим методом определяют соединения мышьяка (III); медь
(II) в солях, рудах ; многие органические лекарственные препараты - формалин,
анальгин, аскорбиновую кислоту и др.
Цель работы: определение редуцирующих сахаров в различных кондитерских
изделиях.
Задачи:
Отработка методики количественного определения
редуцирующих сахаров в рабочем растворе.
Установить соответствие нормальным содержаниям
редуцирующих сахаров в кондитерских изделиях содержащихся в ГОСТ
Основным сырьем для производства кондитерских
товаров служат сахар, инвертный сироп, мука, жиры, молоко. Кроме того, при
производстве кондитерских изделий используются фрукты и ягоды, орехи,
какао-бобы, мед, пряности также многие другие продукты.
В формировании потребительских свойств
кондитерских изделий большая роль придается продуктам, которые придают им
структуру, внешний вид, вкус и цвет: студнеобразователям, эмульгаторам,
пенообразователям, красителям, ароматизаторам.
редуцирующий сахар
кондитерский потребительский
Сахар. Редуцирующие сахара
Продукт представляет собой чистый углевод -
сахарозу, характеризуется приятным сладким вкусом и высокой усвояемостью.
Обладает большой физиологической ценностью, возбуждающе действует на ЦНС,
способствуя обострению органов зрения, слуха; является питательным веществом
для серого вещества мозга; участвует в образовании жира, белково-углеводных
соединений и гликогена. При избыточном употреблении сахара развиваются
ожирение, сахарный диабет, кариес. Суточная норма - 100 г, в год - 36,5 кг, но
ее следует дифференцировать в зависимости от возраста и образа жизни.
Инвертный сироп
Инвертный сироп служит заменителем патоки, так
как обладает антикристаллизационными свойствами. Получают инвертный сироп
нагреванием водного раствора сахара с кислотой, при этом происходит процесс
инверсии, заключающийся в расщеплении сахарозы на фруктозу и глюкозу. Для
инверсии используются кислоты: соляная, лимонная, молочная, уксусная.
Редуцирующий сахар
Все моносахариды, в случае с сиропом глюкоза и
фруктоза, и некоторые дисахариды, в том числе мальтоза и лактоза, относятся к
группе редуцирующих (восстанавливающих) сахаров, т. е. соединений, способных
вступать в реакцию восстановления.
Две обычные реакции на редуцирующие сахара -
реакция Бенедикта и реакция Фелинга - основаны на способности этих сахаров
восстанавливать ион двухвалентной меди до одновалентной. В обеих реакциях
используется щелочной раствор сульфата меди(II) (CuSO4), который
восстанавливается до нерастворимого оксида меди(1) (Cu2O).
Реакция Фелинга наиболее часто используется для
доказательства восстанавливающих свойств сахаров, она заключается в
восстановлении моносахаридами гидроксида меди (II) в закись меди (I). При
проведении реакции используется реактив Фелинга, представляющий собой смесь
сульфата меди с сегнетовой солью (калий, натрий виннокислый) в щелочной среде.
При смешивании сульфата меди со щелочью образуется гидроксид меди.
CuSO4 + 2NaOH -> Cu(OH)2↓ + Na2SO4
В присутствии сегнетовой соли выделившийся
гидроксид не выпадает осадок, а образует растворимое комплексное соединение
меди (II), которое восстанавливается в присутствии моносахаридов с образованием
закисной меди (I). При этом альдегидная или кетон- группа моносахарида
окисляется до карбоксильной группы. Например, реакция глюкозы с реактивом
Фелинга.
СН2ОН - (СНОН) 4 - СОН + Сu(ОН) 2 ===> СН2ОН
- (СНОН) 4 - СООН + Сu2О↓+ Н2О
Значение сахаров для организма
Фруктоза.
Фруктоза менее распространена, чем глюкоза, и
также быстро окисляется. Часть фруктозы в печени превращается в глюкозу, но для
своего усвоения она не требует инсулина. Этим обстоятельством, а также
значительно более медленным всасыванием фруктозы сравнительно с глюкозой в
кишечнике, объясняется лучшая переносимость ее больными сахарным диабетом.
Глюкоза.
Глюкоза - составная единица, из которой
построены все важнейшие полисахариды - гликоген, крахмал, целлюлоза. Она входит
в состав сахарозы, лактозы, мальтозы. Глюкоза быстро всасывается в кровь из
желудочно-кишечного тракта, затем поступает в клетки органов, где вовлекается в
процессы биологического окисления. Метаболизм глюкозы сопровождается
образованием значительных количеств аденозинтрифосфорной кислоты (АТФ),
являющейся источником уникального вида энергии. АТФ во всех живых организмах
играет роль универсального аккумулятора и переносчика энергии. В медицине
препараты аденозина применяют при спазмах сосудов и мышечной дистрофии, и это
доказывает важность для организма АТФ и глюкозы.
Во время бодрствования организма энергия глюкозы
восполняет почти половину его энергетических затрат. Оставшаяся
невостребованной часть глюкозы преобразуется в гликоген - полисахарид, который
хранится в печени.
Методы определения сахара в кондитерских
изделиях
Поскольку контроль содержания уровня сахара в
организме необходим, существует целый ряд различных методов определения
количества как общих, так и редуцирующих (инверсных) сахаров в кондитерских
изделиях,
что является важной частью контроля качества производства данной продукции.
Иодиметрический метод
Метод основан на восстановлении щелочного
раствора меди некоторым количеством раствора редуцирующих сахаров и определении
количества образовавшегося оксида меди (1) или невосстановившейся меди
йодометрическим способом.
Метод применяется для всех видов кондитерских
изделий и полуфабрикатов, кроме мучных кондитерских изделий, полуфабрикатов для
тортов и пирожных и восточных сладостей.
Метод применяется при возникновении разногласий
в оценке качества.
Перманганатный метод
Метод основан на восстановлении соли железа
(III) оксидом меди (I) и последующем титровании восстановленного оксида железа
(И) перманганатом.
Поляриметрический метод
Метод основан на измерении вращения плоскости
поляризации света оптически активными веществами.
Метод применяется для определения массовой доли
общего сахара в шоколаде, пралине, какао- напитках, шоколадных пастах, сладких
плитках, шоколадных полуфабрикатах без добавлений и с добавлением молока.
Экспериментальная часть
Приготовление и стандартизация раствора
С(Na2S2O3)=0,1 моль/дм3
Реактивы:
Навеска Na2S2O3×5H2O
Навеска K2Cr2O7
% р-р KI
M раствор HCl
% р-р Крахмала
Дистиллированная вода
Приборы:
. Мерная колба 100см3;
. Коническая колба для титрования 250 см3
. Пипетка 10 мл
. Бюретка на 25 мл
Ход работы:
Рабочий раствор тиосульфата натрия готовят по
навеске, исходя из заданной концентрации раствора и его объема. Для
приготовления 200 мл 0,1 м раствора тиосульфата натрия отвешивают в бюксе на
технических весах 5 г тиосульфата натрия. Взятую навеску растворяют в 200 мл
дистиллированной воды и добавляют 0,02 г соды. Раствор хранят в склянке из
темного стекла.
Определение точной концентрации раствора
тиосульфата натрия проводится по 2-3 точным навескам дихромата калия
полумикрометодом (бюретка объемом 25 мл, цена деления 0,1 мл). Навеску
дихромата калия рассчитывают с учетом объема мерной колбы, пипетки, бюретки и
концентрации приготовленного раствора тиосульфата натрия. Учитывая, что на
титрование аликвоты раствора дихромата калия должно пойти 10 мл 0,1 М тио
сульфата натрия и соотношение объема мерной колбы и пипетки
: 10, рассчитываем массу дихромата
калия:(K2Cr2O7) = C(Na2S2O3) ×V(Na2S2O3)
×М(1/6
K2Cr2O7)
×100/10
= 0,1×
10 49×10
= 490 мг = 0,49 г.
Точная навеска дихромата калия лежит в пределах
0,47-0,51 г.Пробирку с дихроматом калия взвешивают на аналитических весах,
отсыпают дихромат через воронку в мерную колбу на 100 мл и взвешивают пробирку
с дихроматом калия. По разности взвешиваний находят навеску дихромата калия.
Дистиллированной водой смывают дихромат калия с воронки в колбу, взбалтывают со
держимое колбы до полного растворения дихромата калия
и только после этого доливают воду до метки.
Раствор хорошо перемешивают. Пипетку на 10 мл промывают раствором дихромата
калия
и отбирают 1/10 часть его в колбу для титрования
объемом на 250 мл, добавляют 5 мл 10 % раствора KI и 5 мл 2 М раствора HCl.
Колбу закрывают часовым стеклом и оставляют на 5 мин в темном месте. Затем к
раствору добавляют 50 мл воды и титруют раствором тиосульфата натрия, добавляя
его по каплям и хорошо перемешивая раствор. Когда окраска раствора из бурой
перейдет в бледно-желтую, добавляют 50 капель раствора крахмала
(2-3 мл) и продолжают титрование до перехода
синей окраски раствора в бледно-зеленую, почти бесцветную. При втором и
последующих титрованиях крахмал добавляется возможно ближе к концу титрования.
Отсчет объема раствора тиосульфата натрия ведется с точностью до ±0,005 мл.
Титрование аликвотной части раствора дихромата калия проводят 3-4 раза и
вычисляют среднее значение объема тиосульфата натрия (Vср.), относительное
отклонение от среднего не более 0,5 %. По экспериментальным данным рассчитывают
титр тиосульфата натрия по дихромату калия.
Расчетная часть
V1=9, 6 мл=10, 3 мл=9, 8 млср=9,9 мл
М(1/6 K2Cr2O7)=49 г/моль
М(Na2S2O3×
5H2O)=248 г/моль(Na2S2O3)=158,11 г/мл(K2Cr2O7)= C(Na2S2O3) ×
V(Na2S2O3)
×
М(1/6 K2Cr2O7) × 100/10=0,1
×10 ×49 ×10=490 мг =0,49 г
T (Na2S2O3/ K2Cr2O7) = 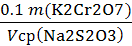
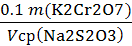 , г/мл(Na2S2O3) =
, г/мл(Na2S2O3) = 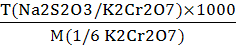
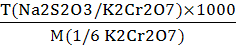 , моль/л(Na2S2O3) =
, моль/л(Na2S2O3) = 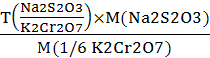
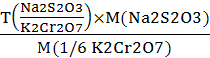 , г/мл(Na2S2O3/ K2Cr2O7) =
, г/мл(Na2S2O3/ K2Cr2O7) = 
 =0,005050 г/мл(Na2S2O3)=
=0,005050 г/мл(Na2S2O3)=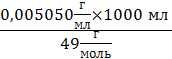
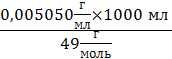 =0,1030 моль/л(Na2S2O3) =
=0,1030 моль/л(Na2S2O3) = 
 = 0,01629 г/мл
= 0,01629 г/мл
Приготовление медного
щелочно-цитратного раствора(реактива Бенедикта)
Реактивы:×5H20
Лимонная кислота C6H8O7CO3
Дистиллированная вода
Оборудование
Мерная колба 250 см3
Химический стакан
Ход работы.
,77 г сернокислой меди растворяют в
25 см3 дист. воды.
,5 г лимонной кислоты растворяют
отдельно в 13 см3 дист. воды.
,9 г Углекислого безводного натрия
так же отдельно растворяют в 125 см3 горячей дист. воды.
Раствор лимонной кислоты осторожно
вливают в раствор углекислого натрия. После прекращения выделения углекислого
газа смесь растворов переносят в мерную колбу вместимостью 250 см3 , вливают в
колбу раствор сернокислой меди и доводят содержимое колбы дист. водой до
метки, перемешивают
При проведении эксперимента
альдегидные группы окисляются, а катионы меди восстанавливаются. Реактив
Бенедикта склонен образовывать гидратированные оксиды, поэтому продукт реакции
не всегда имеет красное окрашивание: он может быть также жёлтым или зелёным.
Если содержание сахара мало, то осадок образуется только при охлаждении. Если
восстанавливающие сахара отсутствуют, то раствор остаётся прозрачным. Растворы
с содержанием сахара, равным 0,08 % дают заметный положительный результат, в то
время как для реактива Фелинга эта величина равна 0,12 %
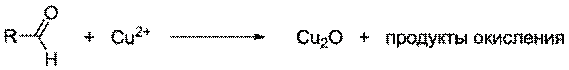
Приготовление рабочего исследуемого
раствора.
Навеску измельченного исследуемого
изделия берут из расчета, чтобы количество редуцирующих сахаров 1 см3 раствора
было около 0,005 г
Массу навески вычисляют по формуле
m= b×V×100/P
где b-оптимальная концентрация
редуцирующих сахаров г/ см3вместимость мерной колбы, см3- предполагаемая
массовая доля редуцирующих сахаров в исследуемом изделии, %
Согласно ГОСТ 6442-89 Мармелад может
содержать не более 20% редуцирующих сахаров от массы изделия.
Согласно ГОСТ 6441-96 Изделия
кондитерские пастильные могут содержать от 10% до 25% редуцирующих сахаров от
массы изделия.
Согласно ГОСТ 6477-88 Карамель может
содержать не более 20 % редуцирующих сахаров от массы изделия.
Навеску в стакане растворяют в
дистиллированной воде нагретой до 60˚-70˚С
Если изделие растворяется без
остатка, то полученный раствор охлаждают и переносят в мерную колбу
вместимостью 250 см3 доводят той же водой до метки и хорошо перемешивают.
Если изделие имеет в своем составе
вещества нерастворимые в воде- то после переноса навески в мерную колбу,
помещают ее на водяную баню на 10-15 минут, затем фильтруют, охлаждают и
доводят дистиллированной водой до метки.
Проведение анализа
В коническую колбу вместимость 250
см3 вносят пипетками 25см3 щелочного цитратного раствора меди, 10 см3
исследуемого раствора и 15 см3 дистиллированной воды. Колбу подсоединяют к
обратному холодильник и в течение 3-4 минут доводят до кипения и кипятят 10
минут, во время кипячения наблюдаем качественную реакцию глюкозы с гидрооксидом
меди: поскольку глюкоза содержит в своем составе пять гидроксильных групп и
одну альдегидную группу, она относиться к альдегидоспиртам. Ее химические
свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с
гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем
к раствору глюкозы несколько капель раствора Бенедикта. Осадка гидроксида меди
не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза
растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем
раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок
Cu2O, который с течением времени образует более крупные кристаллы Cu2O красного
цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН2ОН - (СНОН) 4 - СОН + Сu(ОН) 2
===> СН2ОН - (СНОН) 4 - СООН + Сu2О↓+ Н2О
Колбу быстро охлаждают до комнатной
температуры.
В остывшую жидкость прибавляют 10
см3 KI р-р 30%, и 25 см3 раствора H2SO4 концентрации 4 моль/дм3. Серную
кислоту приливают осторожно во избежание ее выплескивания из колбы за счет
выделившегося углекислого газа. После этого сразу титруют выделившийся йод
раствором тиосульфата натрия до светло-желтой окраски жидкости.
Затем приливают 2-3см3 1% раствора
крахмала и продолжают титровать окрасившуюся в грязно синий цвет жидкость до
появления молочно-белого окрашивания. Фиксируют количество тиосульфата, которое
пошло на титрование. Опыт повторяют 3 раза.
Контрольный опыт проводится в тех же
условиях, для чего берут 25 см3 щелочного цитратного раствора меди и 25 см3
дистиллированной воды.
Разность между объемом тиосульфата
натрия в см3 ,затрачееным при контрольном опыте и при определении, умноженная
на поправочный коэффициент K=1,2, дает количество меди, выраженное в см3 0,1
моль/дм3 раствора тиосульфата натрия ,по которому находят количество
миллиграммов инверсного сахара во взятых 10 см3 раствора навески исследуемого
изделия по таблице 1, предоставленной в ГОСТе 5903-89
Массовую долю редуцирующих сахаров
(Х) в процентах вычисляют по формуле
Х=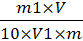
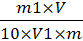
Где m-навески изделия, г-масса
инверсного сахара определенная по табл.1, мгвместимость мерной колбы, см3-объем
исследуемого раствора, взятый для анализа, см3
Обсуждение результатов исследования
Определение содержания редуцирующих
сахаров в мармеладе.
Объем тиосульфата натрия пошедшего
на титрование
|
Титрование
|
1
|
2
|
3
|
|
Объем,
мл
|
17
|
16,6
|
16
|
|
Среднее
значение, мл
|
|
16,5
|
|
Объем тиосульфата натрия при контрольном опыте
31см3иск1 = (31-17)1.21= 16,9 см3иск2 = (31-16,6)1.21= 17,4 см3иск3 =
(31-16)1.21= 18,2 см3инв1 =46,14 мг ( в соответствии с таблицей в приложении
1)инв2 =47,34 мг ( в соответствии с таблицей в приложении 1)инв3 =49,74 мг ( в
соответствии с таблицей в приложении 1)=6, 25 г=250 см3=10 см3
ω1 = 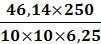
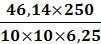 =
= 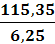
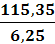 = 18,5 %
= 18,5 %
ω2 = 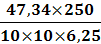
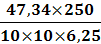 =
= 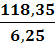
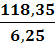 = 18,9 %
= 18,9 %
ω3 = 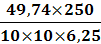
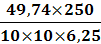 =
= 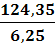
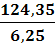 = 19,9 %
= 19,9 %
ωсредн = 19,1 %
Объем тиосульфата натрия пошедшего
на титрование
|
Титрование
|
1
|
2
|
3
|
|
Объем
|
17,8
|
17,7
|
17,5
|
|
Среднее
значение, мл
|
|
17,7
|
|
иск1 = (31-17,8)1,21= 16 см3иск2 =
(31-17,7)1,21= 16,1 см3иск3 = (31-17,5)1,21= 16,3 см3инв1 =43,53 мг ( в
соответствии с таблицей в приложении 1)инв2 =43,82 мг ( в соответствии с
таблицей в приложении 1)инв3 =44,11 мг ( в соответствии с таблицей в приложении
1)=5, 25 г =250 см3=10 см3
ω1 = 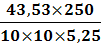
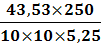 = 20,7 %
= 20,7 %
ω2 = 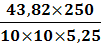
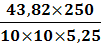 = 20,9 %
= 20,9 %
ω3 = 
 = 21 %
= 21 %
ωсредн = 20,86 %
Определение содержания редуцирующих
сахаров в карамели
Объем тиосульфата натрия пошедшего
на титрование
|
Титрование
|
1
|
2
|
3
|
|
Объем
|
18,3
|
18,5
|
18,1
|
|
Среднее
значение, мл
|
|
18,3
|
|
иск1 = (31-18,3)1,21= 15,4 см3иск2 =
(31-18,5)1,21= 15,1 см3иск3 = (31-18,1)1,21= 15,6 см3инв1 =41,79 мг ( в
соответствии с таблицей в приложении 1)инв2 =40,92 мг ( в соответствии с
таблицей в приложении 1)инв3 =42,37 мг ( в соответствии с таблицей в приложении
1)=5, 25 г=250 см3=10 см3
ω1 = 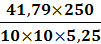
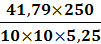 = 19,9 %
= 19,9 %
ω2 = 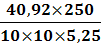
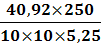 = 19,5 %
= 19,5 %
ω3 = 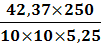
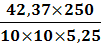 = 20,2 %
= 20,2 %
ωсредн = 19,9 %
|
Объекты
исследования
|
Установленное
содержание ред. сахаров, %
|
Нормальное
содержание ред. сахаров по ГОСТ,%
|
|
Мармелад
|
19,1
|
Не
более 20
|
|
Пастила
|
20,86
|
От
10 до 25
|
|
Карамель
|
19,9
|
Не
более 20
|
Выводы
В результате проведенного исследования удалось
установить массовую долю редуцирующих сахаров в различных видах кондитерских
изделий методом йодометрического титрования. Согласно результатам, содержание
редуцирующих сахаров во всех предоставленных для анализа изделиях соответствуют
государственному стандарту, и следовательно могут быть допущены до реализации.
Список литературы
ГОСТ
6477-88 Карамель. Общие технические условия.
ГОСТ
6441-96 Изделия кондитерские пастильные.
ГОСТ
6442-89 Мармелад. Технические условия.
В.П.
Васильев Аналитическая химия - М.: Дрофа 2004 г.
Скуг
Д., Уэст Д. Основы аналитической химии. -- М.: Мир, 1979. Т. 1,2.
Основы
аналитической химии / Под ред. академика Ю. А. Золотова. -- М.: Высшая школа,
2002. Кн. 1, 2.
Алексеев
В. И. Количественный анализ. -- М.: Химия, 1972.
Кондитерские
изделия [Электронный ресурс]: #"731712.files/image023.gif">