Практичне використання діаграм стану дво- та трикомпонентних систем
МІНІСТЕРСТВО ОСВІТИ, НАУКИ, МОЛОДІ ТА
СПОРТУ УКРАЇНИ
ДВНЗ «ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ
ТЕХНІЧНИЙ УНІВЕРСИТЕТ»
Кафедра “Прикладної екології та
охорони навколишнього середовища»
КУРСОВА РОБОТА
З фізичної хімії тугоплавких
неметалевих і силікатних матеріалів
на тему:«Практичне використання
діаграм стану дво- та трикомпонентних систем»
Студентки 4 курсу ТТМ-09 групи
Піряник М.С.
м. Донецьк, 2012 р.
Реферат
Пояснювальна записка - 44 сторінок, рисунків -15 , посилань -
8.
Метою курсової роботи: є розуміння необхідності використання
теоретичного курсу в практичній роботі. Використання знання про будову речовин,
природу хімічного зв'язку в різних силікатних сполуках і матеріалах для
розуміння властивостей матеріалів і механізмів, що протікають в склі, кераміці
і в'яжучих. В роботі розглянуто особливості будови діаграм стану
двокомпонентних систем: Na2O - P2O5, В2O3
- ZnO та трикомпонентної системи MgO-Al2O3-SiO2.
Показано особливості будови двокомпонентних та трикомпонентних діаграм,
розглянуто шляхи первинної кристалізації, приведено точки хімічних сполук,
описано поля первинної кристалізації, точки евтектики та перитектики, показано
правила роботи з діаграмами. Наведено практичне використання діаграм станів
дво- та трикомпонентних систем шляхом рішення задач.
ДІАГРАМА, ЛІКВАЦЯ, БУДОВА, СТАН, ЛІКВІДУС, СИСТЕМА,
ПОЛІМОРФНІ МОДИФІКАЦІЇ, БІНОДАЛЬНА КРИВА, ІЗОТЕРМА, КАНОДА, ПОГРАНИЧНІ КРИВІ,
КРИСТАЛІЗАЦІЯ, ТОЧКИ ХІМІЧНИХ СПОЛУК.
Abstract
Note - 44 pages, drawings -15, links - 8. The aim of the
course work is to understand the need for a theoretical course in practice. Use
knowledge of the structure of matter, the nature of the chemical bond in
different silicate compounds and materials for understanding the properties of
materials and mechanisms that occur in the glass, ceramics and knitting. The
paper deals with the structural features of the phase diagrams of binary
systems: Na2O - P2O5, B2O3
- ZnO and ternary system MgO-Al2O3-SiO2. The
features of the structure of two-component and three-component diagrams,
examined ways of primary crystallization, are points of chemical compounds,
describes the fields of primary crystallization of the eutectic and peritectic
points, shows the rules the chart. The practical use of the phase diagrams of
binary and ternary systems by solving problems. , PHASE SEPARATION, STRUCTURE,
CONDITION, LIQUIDUS, SYSTEM, POLYMORPHS, BINODAL CURVE, ISOTHERM, KANODA,
BOUNDARY CURVES, CRYSTALLIZATION, POINT CHEMICALS.
Зміст
Вступ
. Діаграма стану двокомпонентної системи Na2O
- P2O5
.1 Загальна характеристика системи Na2O - P2O5
.2 Елементи будови діаграми стану двокомпонентної
системи
.3 Визначення шляхів кристалізації системи
1.4 Застосування правила важеля аналітичним шляхом в
двокомпонентних системах
1.5 Практичне застосування двокомпонентної діаграми
стану Na2O - P2O5 у промисловості
. Діаграма стану двокомпонентної системи В2O3
- ZnO
.1 Загальна характеристика системи В2O3
- ZnO
.2 Елементи будови діаграми стану двокомпонентної
системи
.3 Визначення шляхів кристалізації в системі
.4 Процес ліквації в системі ZnO - В2O3
.5 Процеси поліморфних перетворень в системі
.6 Застосування правила важеля графічним методом в
двокомпонентній системі
.7 Застосування правила важеля графічним методом в
двокомпонентній системі
.8 Практичне застосування двокомпонентної діаграми
стану ZnO - В2O3 у промисловості
. Діаграма стану системи MgО - Al2O3
- SiO2
.1 Загальна характеристика системи
.2 Елементи будови дiаграми стану
.3 Визначення вмісту компонентів по трикутнику
концентрацій
.4 Визначення шляху кристалізації розплаву при
ліквації
.5 Визначення характеру процесу, що відбувається в
точці евтектики
.6 Шляхи кристалізації розплаву, визначення
температури початку кристалізації розплаву
3.7 Практичне застосування двокомпонентної діаграми
стану MgO -Al2O3 - SiO2 у промисловості
4. Практичне застосування діаграм стану, шляхом
вирішення задач
4.1 Вирішення задачі по двокомпонентним системам
Задача № 68
Задача № 69
.2 Вирішення задачі по трикомпонентним системам
Задача № 67
Задача № 68
Висновки
Перелік посилань
Вступ
Сучасний курс «Фізична хімія тугоплавких неметалевих та
силікатних матеріалів» спрямований на вдосконалення прийомів пізнавальної
діяльності студента, розвиток і формування творчого підходу до вирішення
професійних завдань. Розділ фізичної хімії, що допомога при вивченні фізичної і
хімічної будови, структури, складу, фізичних і хімічних властивостей речовин, в
основі яких лежить кремній, в поєднанні з киснем та іншими елементами на 90%,
що складає земну кору. Основним завданням цієї науки є дослідження речовин
найбільш поширених в природі і, відповідно - в практиці. Останнє зумовлює
наступні дослідження або розробку на основі вивчення силікатів аналогів різних
мінералів, або - зовсім нових речовин, по тим чи іншим якостям перевершують
будь-які існуючі в природі - створення таких найважливіших матеріалів, як
цемент, кераміка, скло, вогнетриви, емалі, покриття, барвники, що
використовуються в будівництві, металургії, в хімічній, оптичній, радіо- і
електротехнічній, авіаційній, медичній, космічній та інших галузях
промисловості. В узагальненому сенсі хімія силікатів зайнята дослідженням солей
кремнієвих кислот. У природі силікати представлені у вигляді мінералів, входять
до складу більшості гірських порід, що складають основну частину земної кори. Хімія
силікатів проводить фундаментальні дослідження великого класу хімічних сполук
охоплює широке коло питань, які дуже важливі для технологів. Зокрема це -
діаграми стану, які представляють собою характеристику певної системи, на якій
показані криві солідуса й ліквідусу, коноди, евтектики, що дозволяють
заздалегідь впливати на процес синтезу з метою одержання кінцевого продукту з
тими або іншими властивостями.
При дослідженні рівноважних систем кінцевою метою
фізико-хімічного аналізу є встановлення залежності між параметрами системи, що
характеризують її стан, і, зокрема, визначення сполук рівноважних фаз при тих
або інших параметрах стану.
Діаграма стану в багатьох випадках дає можливість пояснити й
удосконалити процеси, що протікають при утворенні даного матеріалу, установити
й пояснити вплив фазової сполуки продукту на його властивості і якість, тобто
допомагає вибору правильної технології й сполуки для одержання матеріалів із
заздалегідь заданими властивостями.
Діаграма стану сплавів має величезне практичне значення.
Користуючись діаграмами стану, можна встановити температури початку і кінця
твердіння і плавлення, встановити зони перегріву і перепалу; легко і швидко
вибрати правильний режим термічної обробки матеріалу.
Наприклад, система MgO-Al2O3-SiO2
дуже широко використовується в технології термостійких керамічних і
склокристалічних матеріалів, а також у якості основи для отримання
форстеритових, периклазових, шпінельних, корундових і мулітових вогнетривів.
Система Na2O - P2O5 має суттєве значення для хімії
фосфатного і силікатофосфатного скла. Діаграма стану системи В2O3
- ZnO широко застосовується у виробництві цинково-боратного скла.
Враховуючи все вище сказане - метою роботи є вивчення діаграм
стану дво- та трикомпонентної системи, пояснення їх практичного використання.
Задачами курсової роботи є детальний розгляд діаграм стану
систем Na2O - P2O5, В2O3 -
ZnO та MgO-Al2O3-SiO2, а також практичне
рішення задач на основі теоретичних знань добутих при вивченні курсу «Фізична
хімія тугоплавких неметалевих та силікатних матеріалів».
кристалізація розплав ліквація діаграма
1. Діаграма стану двокомпонентної системи Na2O - P2O5
.1 Загальна характеристика системи Na2O - P2O5
Ця система має суттєве значення для хімії фосфатного і
силікатофосфатного скла, та інших матеріалів подібного типу. Морей і Інгерсон
вивчили систему в концентраційних межах, які обмежені сполуками NaРО3 і
Na2P2O7 (рис.1.1). В більш широких межах (від
40% до 80% Na2O) ця система вивчена Туркдоганом і Меддоксом [1].

Рисунок 1.1 - Діаграма стану системи NaРО3 - Na2P2O7
по (Морею і Інгерсону)
Вихідний компонент, поліфосфат натрію має триполіморфні форми
і наступні перетворення, що зображено на рисунку 1.2:
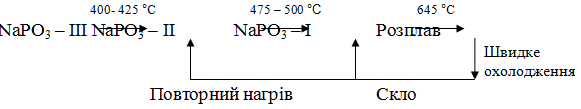
Рисунок 1.2 - Поліморфні перетворення полі фосфату натрію
За даними температури поліморфних перетворенні рівні
відповідно 404, 510 і 627 °С. Форми III і II погано розчинні у воді і
відповідають солі Мадрелла, форма I розчинна краще і може бути віднесена до
триметафосфату Nа3Р3O9. Скло, отримане при
охолодженні розплаву, може дати суміші форм II і I при повторному нагріві нижче
300 °С і форму I - вище 300 ° С [1].
Сполуку NaРО3 отримують кристалізацією
відповідного скла, яке існує у двох формах. Перша форма, відрізняється меншими
значеннями показника світлопереломлення, яке отримують кристалізацією скла
поблизу температури плавлення. Друга форма отримана кристалізацією скла при
температурі приблизно 550°С [1].
Сполуку Na5P3O10 також
отримано у двох формах. Першу високотемпературну форму отримують швидким
охолоджуванням від 600°С до кімнатної температури, другу форму - шляхом
охолодження закристалізованого розплаву в печі, що супроводжується розсипанням
в порошок. Сполука NaРО3 має поліморфне перетворення при 1474°С. Сполука
Na5P3O10 плавиться при 622°С з розкладанням на
Na2P4O7 і рідину, яка містить 49,5 мас.% Na2P4O7.
Евтектика (між NaРО3 і Na3P3O10)
плавиться при 552 °С і містить 31 мас.% Na4P2O7.
Розглянемо двокомпонентну систему з евтектикою, на прикладі
двокомпонентної діаграми стану Na2O - P2O5. На
рисунку 1.2 зображена діаграма двокомпонентної системи, до складу якої входять
осі температур та осі, що відповідають масовій долі речовини у відсотках, дві точки
евтектики, криві ліквідусу, криві солідуса, точки, що характеризують процес,
плавлення або кристалізації, які описують ці процеси (плавлення, кристалізації)
речовин у системі [2].
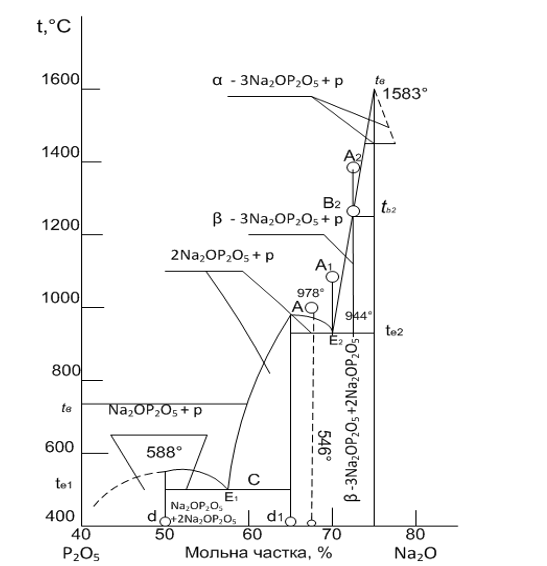
Рисунок 1.2 - Діаграма стану двокомпонентної системи Na2O
- P2O5 .
Криві ліквідусу падають до точки перетину Е1 і Е2,
які мають назву точки евтектики. Всі суміші крім евтектичної, плавляться в
інтервалі температур від лінії солідусу і лінії ліквідусу. Вище лінії ліквідусу
існує одна фаза - розплав, а нижче лінії солідуса - дві тверді фази. Евтектична
суміш плавиться не в інтервалі температур, а при визначеній температурі,
мінімальної для даної ділянки діаграми стану. На нашій діаграмі мінімальною
температурою, тобто евтектичною температурою, для Е1 при якій
відбувається процес плавлення в системі, є температура 588 °С, а для Е2
мінімальна температура складатиме 944 °С. Найбільш легкоплавкі суміші
двокомпонентної системи розташовуються поблизу евтектики [2].
У вивченій області концентрацій утворюється одна сполука, яка
плавиться інконгруентно - триполіфосфат натрію Na5Р3О10
(5:3), для якого знайдені дві поліморфні форми. За даними, форма I виходить в
умовах повільного охолоджування розплаву не нижче 500 °С, так як при цій
температурі вона переходить у форму II. Повторне нагрівання в інтервалі 500 -
620 °С викликає перетворення у форму I, яка вже не переходить в форму II при
охолодженні. Таким чином, при кімнатній температурі можна одержати тільки одну
з цих форм. За даними, β-форма Na5Р3О10
переходить в α-форму близько 529 °С. Евтектика між
NaРО3 і Na5Р3О10 утворюється при
550 °С і 33 мас.% Na4Р2О7 та 546 °С і 36.5
мас.% Na2О; перитектика - при 620 °С і 50 мас.% Na4Р2О7
і 620 °С і 38.5 мас.% Na2О. Розглянемо діаграму плавкості частини
системи, обмеженою сполуками NaРО3 і Na3РО4.
(рис. 1.3).
Сполуки утворюють евтектику при 952 °С і 67.6 мол.% Na4Р2О7.
Ортофосфат натрію 3Na2О×Р2О5 має
оборотне поліморфне перетворення при 340 °С і плавиться при 1512 °С. У
пірофосфату натрію встановлено кілька поліморфних переходів при: 409 °С (V ®IV), 522 °С (III® II), 565 °С (II®I ).
Сполука Na4P2O7 плавиться
при 998 °С. Незважаючи на те що зафіксовано велику кількість поліморфних форм
Na3PO4, частіше спостерігаються тільки дві форми з
температурою перетворення близько 300-330 °С. Це зворотній перехід, і
високотемпературна кубічна фаза може бути стабілізована домішками Na2SO4.
Пірофосфат натрію Na3PO4 також відрізняється великою
кількістю оборотних фазових перетворень, але структурні дані отримані тільки
для низькотемпературної форми [2].

Рисунок 1.3 - Діаграма стану плавкості системи NaPO3
- Na3PO4
Розглянемо схему перетворення сполуки складу NaO2×Р2О5, що
зображено на рисунку 1.4
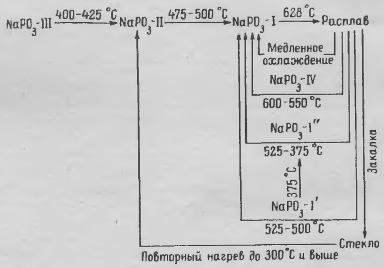
Рисунок 1.4 - схема перетворення сполуки складу NaO2×Р2О5
Форми ІІ і I є нестійкими, оскільки при тривалих ізотермічних
витримках переходять у форму I. Багато фазові переходи в системі залежать від
тиску парів води і навіть від механічної обробки [1].
В області, збагаченої P2O5, крива
ліквідусу не простежується через труднощі експерименту - високої стійкості скла
до кристалізації і надзвичайно високій гігроскопічності (рис. 1.2). На діаграмі
видно утворення хімічних сполук - метафосфату (1:1), пірофосфату (2:1) і
ортофосфату (3:1). Всі хімічні сполуки мають по декілька поліморфних
модифікацій. Області склоутворення починаються від чистої сполуки P2O5.
Найбільш важливі сполуки які плавляться конгруентно, містять
P2O5 і оксид Na2O в співвідношенні 1:1 (це -
метафосфати, наприклад, NaPO3,). Межі областей склоутворення близькі
за складом до складу цих сполук, тому саме вони й повинні визначати структуру
фосфатного скла [2].
Найбільш легкоплавкі суміші двокомпонентної системи
розташовуються поблизу евтектики, це суміш 2Na2O×P2O5 і
Na2O×P2O5 - для точки евтектики Е1,
а для Е2 - β3Na2O×P2O5 і
2Na2O×P2O5.
Діаграма стану що зображена на рисунку 1.2, є двокомпонентна
система з хімічною сполукою, що плавиться без розкладання (конгруентно).
На рис. 1.2 показана діаграма стану подвійної системи, в якій
компоненти Р2О5 і NaO2 утворюють між собою
хімічну сполуку складу d1. У цьому випадку на кривій ліквідусу
з'являється максимум, що відповідає плавленню даної сполуки. Речовина Р2О5
з хімічною сполукою складу d1 утворюють евтектику Е1,
речовина NaO2 з хімічною сполукою складу d1 - евтектику Е2.
Всю діаграму можна розглядати як систему, що складається з двох найпростіших, з
одною евтектикою кожна: одна - між речовинами Р2О5 і d1
та друга - між NaO2 з d1. Фазові перетворення при
охолодженні будуть визначатися положенням точки заданого складу суміші на лінії
концентрацій. Склади, розташовані вліво від точки складу d1,
закінчать кристалізацію при температурі евтектики Е1 з виділенням
кристалів Р2О5 і хімічною сполукою складу d1 а
склади, що знаходяться праворуч від цієї точки, - при температурі евтектики Е2
з виділенням кристалів NaO2 і d1. Вертикаль проведена
відточення складу хімічної сполуки d1 до лінії ліквідусу, характеризує
плавлення суміші, що відповідає складу d1. Суміш буде плавитися при
певній температурі, що відповідає максимуму на кривій ліквідусу. При цьому
розплав буде мати той же хімічний склад, що і вихідна хімічна сполука. Таке
плавлення називається конгруентним. Вертикаль хімічної сполуки ділить діаграму
на дві самостійні подвійні системи. Суміш складу С при охолодженні від точки А
почне виділяти по досягненні кривої ліквідусу кристали сполуки d1 і
повністю почне кристалізуватися при температурі евтектики Е2 з
виділенням кристалів d1 і NaO2. Співвідношення між цими
фазами визначиться із співідношння відрізків NaO2-С і NaO2 -
d1.
Однофазна область, що розташована вище лінії ліквідусу,
відповідає дво- варіантному стану системи. Тут у визначених межах можна довільно
міняти два параметри - температуру і концентрацію, не змінюючи числа та природи
фаз в системі. Криві tе1E1, E1E2, E2tв
і двофазні області між кривими ліквідусу і солідусу відносяться до
одноваріантного стану системи. Довільна зміна одного параметра, наприклад
температури, тягне за собою зміну складу рідкої фази, що знаходиться в
рівновазі з кристалами Na2O і P2O5. У точці Е1
на евтектичній лінії в рівновазі перебувають три фази: кристали Na2O
і P2O5, і рідка фаза, тобто система інваріантна.
У подвійних системах лінії постійних температур, проведені
від ліній ліквідусу до вертикалей, які відповідають складам чистих компонентів
Na2O і P2O5, називаються конодами. Кінці конод
вказують на склади співіснуючих при даній температурі фаз [2].
.3 Визначення шляхів кристалізації системи
На рисунку 1.5 представлений тип діаграми стану
двухкомпо-нентной системи Na2O - P2O5 з двома
евтектиками. Розглянемо шлях кристалізації розплаву складу А. Перш за все
визначимо, що кінцевими фазами кристалізації будь-якого бінарного складу в цій
системі будуть сполуки Na2O×P2O5 і Na2O×P2O5, а
кристалізація всіх подібних складів буде закінчуватися при евтектичній
температурі t1 в точці евтектики.
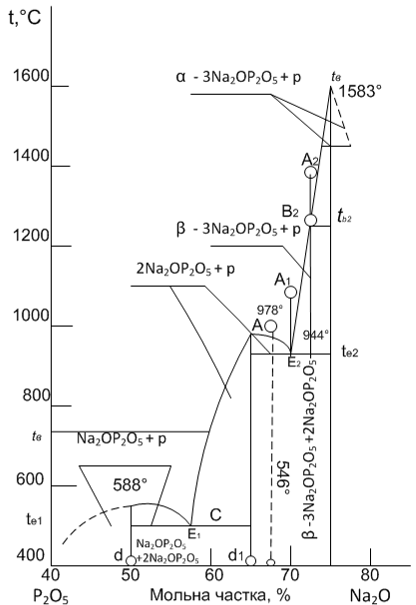
Рисунок 1.5 - Діаграма стану двокомпонентної системи Na2O
- P2O5 .
При зниженні температури від точки А до В буде відбуватися
тільки охолодження розплаву. При досягненні температури ліквідусу tb
рідка фаза (розплав) складу В виявиться насиченою по відношенню до компоненту Р2О5
і останній при подальшому охолодженні буде кристалізуватися з розплаву. Склад
рідкої фази буде змінюватися при цьому по кривій ліквідусу від точки В до точки
Е1 (система моноваріантна). При досягненні евтектичної температури t1
рідина, що відповідає евтектичному складу Е1, кристалізується з
одночасним виділенням кристалів Na2O і P2O5
оскільки точка Е1 належить одночасно обом кривим ліквідусу отже,
рідина складу Е1 насичена по відношенню до обох компонентів. При
цьому поки не зникне вся рідка фаза, температура t1 і склад (Е1)
рідкої фази будуть залишатися постійними, оскільки система при цих параметрах
інваріантна (температура при відведенні від системи теплоти буде підтримуватися
постійною за рахунок виділення теплоти кристалізації). Кристалізація
закінчиться в точці евтектики Е1. Таким чином, для складу, що
виражається точкою А, шлях зміни складу рідкої фази при охолодженні можна
схематично зобразити таким чином: А ® В ®Е1 [2].
Якщо взяти інший склад розплаву, наприклад, А2, то
шлях кристалізації визначається аналогічно вже розглянутого, тільки в якості
первісної твердої фази буде кристалізуватися компонент P2O5,
а склад рідкої фази буде змінюватися від точки tb, по кривій
ліквідусу tBE2. Цей розплав також остаточно твердіє при
евтектичній температурі te2 з одночасним виділенням кристалів Na2O
і P2O5. Якщо вихідний розплав точно відповідає
евтектичному (наприклад, розплав складу А1 або тверда суміш складу d1),
то при досягненні евтектичної температури він буде відразу весь
кристалізуватися, виділяючи евтектичну суміш кристалів Na2O і P2O5,
якщо охолоджувати розплав [2].
Розглянемо процес кристалізації точки А в системі Na2O
- P2O5. Процентний склад точки А складає 60% Na2O,
і 40% P2O5. При кристалізації розплаву відбувається
перехід від однофазного стану (розплав) до двофазного, утворення кристалів Na2O×P2O5 і
2Na2O×P2O5. В області рівноважного
співіснування рідкої і твердої фаз при зниженні температури співвідношення між
утвореними фазами безперервно змінюється. У процесі кристалізації збільшується
кількість твердої фази і зменшується відносний вміст рідкої. В результаті
утворюється точка В з відсотковим вмістом 40% Na2O×P2O5 і
60% 2Na2O×P2O5. У практичних цілях важливо вміти
визначити кількісне співвідношення між фазами в будь-який момент кристалізації
розплаву або нагрівання суміші. Це нам дозволяє регулювати фазовий склад
одержуваних матеріалів і правильно встановлювати необхідну температуру їх
випалювання або термообробки. Так, властивості керамічних матеріалів, багато в
чому визначаються кількістю склоподібної фази, що утворюється при застиганні
розплаву. Чим більше рідкої фази утворюється в процесі спікання, тим міцніше і
більш морозостійкий керамічний матеріал. Однак значна кількість рідкої фази може
викликати, деформацію виробів при випалі. Отже, в матеріалі потрібно отримати
таку оптимальну кількість рідкої фази, яка визначить кінцеву температуру
випалу. Ще важливіше знати співвідношення між фазами у виробництві
склокристалічних матеріалів - ситалів, властивості яких безпосередньо
взаємопов'язані з природою і кількісним відношенням фаз [4].
1.4 Застосування правила важеля аналітичним шляхом в
двокомпонентних системах
Відносна кількість фаз при будь-якій температурі визначається
за допомогою правила важеля: якщо одна фаза розпадається на дві, то
співвідношення між ними обернено пропорційно відрізкам, що з'єднують склад
вихідної фази зі складом отриманих фаз. За правилом важеля можна встановити
температуру, при якій утворюється задана кількість рідкої фази. При даній
температурі і кількості розплаву визначають склад вихідної суміші. Крім
графічних способів розрахунку по діаграмі стану, існує і аналітичний спосіб.
При використанні аналітичного способу необхідно розрізняти два наступних
випадки: 1) при кристалізації перший компонент системи частково виділяється з
розплаву і частково залишається в розплаві (первинна кристалізація), а другий
залишається в рідкій фазі. 2) у склад твердої фази , що виділяється, входять
обидва компоненти [4].
Приклад розрахунку складу суміші аналітичним способом
показаний в розділі вирішення задач по двокомпонентним системам.
.5 Практичне застосування двокомпонентної діаграми стану Na2O
- P2O5 у промисловості
Оксид фосфору P2O5 - найважливіший
компонент для виробництва скла та склокристалічних матеріалів різного
призначення. Система Na2O-P2O5 має велике
значення у виробництві фосфатного та силікатофосфатного скла. Окремі компоненти
системи також є дуже важливою складовою частиною багатокомпонентних систем, які
представляють інтерес у виробництві багатьох матеріалів.

Рисунок 1.5 - Фосфатне лазерне скло.
Основна складова частина (70 - 80% по масі) фосфатного
ультрафіолетового скла - P2O5.
Діаграма стану Na2O - P2O5
грає важливу роль у виробництві фосфатного лазерного скла (рис. 1.6). Фосфатне
скло призначене для виготовлення активних елементів твердотільних лазерів, що
генерують випромінювання на довжинах хвилі 0,9; 1,06; 1,35 мкм, що працюють в
режимах вільної генерації. Лазерна ефективність фосфатного скла вище, ніж в
силікатному. Фосфатне скло має високий коефіцієнт підсилення, більший перетин
індуцированого випромінювання, більш вузька лінія генерації, стійкість до дії
УФ випромінювання. Однак, скло на фосфатній основі володіє меншою механічною і
термічною міцністю, ніж силікатне скло.
Фосфатне скло має хімічну стійкість не меншу, ніж віконне
скло, і хороші виробничі властивості. Вони не повинні кристалізуватися в
температурному інтервалі виробітку. Фосфатне скло пропускає більше 80% біологічних
ультрафіолетових променів.
Склад скла, що містять значний надлишок P2O5
щодо складів мета фосфатів, називають ультра фосфатними складами, це скло
практично нецікаве через низьку хімічну стійкість. Розплави, у яких не вистачає
P2O5, щодо складів метафосфатів, називаються
пірофосфатними, вони легко кристалізуються.
Зростання температур, при відповідній в'язкості, відбувається
при концентрації Na2O, більшою ~ 1 мол.%, чим менше в'язкість, тим
при більш високій концентрації лугу починаються ці зміни.
Фосфатне теплопоглинальне скло в порівнянні з силікатним має
переваги в тому, що воно безбарвне або слабко пофарбоване в жовтуватий або
сіруватий тон і при майже повному поглинання ІЧ променів (90 ... 92%)
пропускають 80 ... 85% променів видимої області спектра.
Пентаксид фтору широко використовується в
органічному синтезі в реакціях дегідратації і конденсаціі. Додатки фториду та
пентаксиду фосфору зменшують прозорість скла, дозволяють отримувати
«глушенные», непрозорі скло вироби. Фосфатні скляні розплави застосовують в
основному для виробництва оптичного, електровакуумного скла.
2. Діаграма стану двокомпонентної системи В2O3
- ZnO
.1 Загальна характеристика системи В2O3
- ZnO
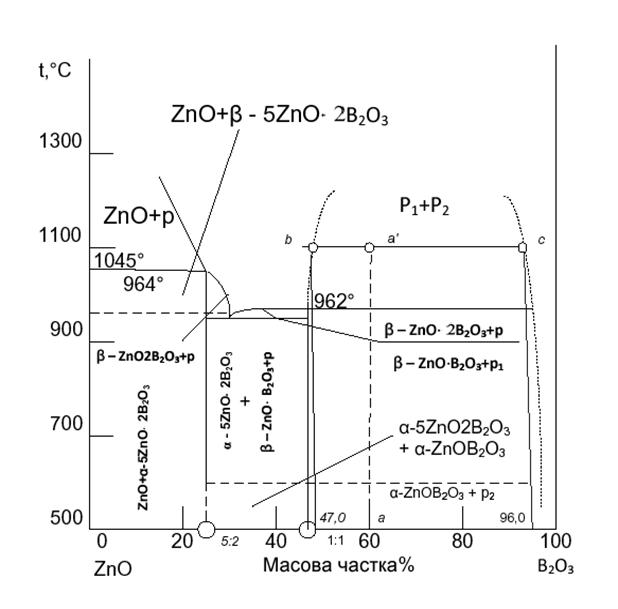
Рисунок 2.1 - Діаграма стану системи В2O3-ZnO
На рисунку 2.1 зображено діаграму стану системи В2O3-ZnO,
що широко застосовується у виробництві цинково-боратного скла. Діаграмма стану
В2O3-ZnO вивчалась Інгерсоном, Мореєм, Тетлом, Тороповим
та Коноваловим. Склообразні тверді речовини на основі типового скло утворюючого
оксиду В2O3 отримують в основному охолодженням
високотемпературних розплавів. Розплави неорганічного скла характеризуються
безперервною зміною структури, що залежить від зовнішніх факторів (температури,
тиску). Для твердого скла характерна відносна стабільність та незмінність
структури при зміні зовнішніх умов. Основними фазами в цинк-боратній системі є
4ZnO ×3В2O3
та α-5 ZnO×В2O3.
У всіх системах R2O3-RO зі сторони В2O3
( починаючи приблизно з 3-5% RO) існує область стабільного розшарування у
рідкому стані. Утворюються стійкі хімічні сполуки, серед яких частіше за все
існують борати з загальною формулою RO×2В2O3 [5].
В практичних складах оптичного скла у поєднанні з іншими
оксидами використовуються ВаO, ZnO. У системах на основі В2O3
як і в силікатній системі, найбільша область скло утворення [5].
2.2 Елементи будови діаграми стану двокомпонентної систем
Діаграма стану ZnO - В2O3 зображена на
плоскості, на вертикальній віссі якої, відкладається температура, на
горизонтальній - масова доля у відсотках. Один кінець горизонтальної віссі
відповідає 100% ZnO, а інший - В2O.
Проміжні точки на горизонтальній осі виражають любе
співвідношення двох компонентів. На вертикальній осі відповідно вмісту 100%
компонентів, нанесено, їх температури плавлення.
Крива ліквідус показує при якій температурі і при якому
складі розплаву починається кристалізація компонентів ZnO і В2O3
, в залежності від складу вихідного розплаву [2].
Крива солідус показує для кожної температури склад твердої
фази, яка може знаходитися в рівновазі з рідкою.
До складу системи ZnO - В2O3 входить
точка евтектики Е, точка перитектики, має область ліквації. Сполука ZnO - В2O3
плавиться інконгруентно при температурі 964 °С, розкладаючись на β-5ZnO - 2В2O3
та рідину. Має дві поліморфні форми: α-5ZnO - 2В2O3
та β-5ZnO - 2В2O3.
У нашій системі ZnO - В2O3 (рис. 2.2) спостерігається
явище ліквації, коли одна рідка фаза розпадається на дві не змішувані між собою
рідини. Це обумовлено обмеженою розчинністю в рідкому стані, коли лише невелика
кількість однієї рідини може розчинятися в іншій і навпаки. Випадок повного
лікваціонного розподілу - утворення двох не змішуваних шарів рідини, різних за
складом і властивостями [5].
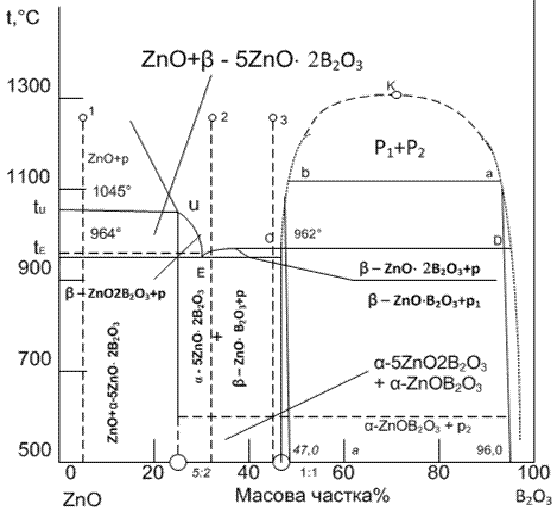
Рисунок 2.2 - Діаграма стану системи ZnO - В2O3
На діаграмі стану такої системи (рис. 2.2) на лінії ліквідусу
з'являється горизонтальна ділянка СD в області якої не спостерігається
евтектичного зниження температури ліквідусу. Над ділянкою СD формується так
званий «купол» ліквації, що обмежує область співіснування двох не змішуваних
рідких фаз. Вище критичної точки К можливе існування лише однорідної рідини.
При охолодженні розплаву, склад якого розташовується між точками С і D, на
лінії СКD одна рідка фаза розпадається на дві, і склади цих фаз при зниженні
температури сповзають уздовж ліній КСD і КD. Так для розплаву суміші β-ZnO×B2O3 +
p склади співіснуючих фаз при температурі 1100 °C, будуть відповідати точкам b
і а. Кількісні співвідношення між рідкими фазами визначаються за допомогою
правила важеля.
В області купола ліквації система одно варіанта, оскільки в
рівновазі знаходяться дві фази. При довільній зміні одного з параметрів,
наприклад температури, змінюється склад відповідної рідини [2].
.3 Визначення шляхів кристалізації в системі
При температурі 1100 °С починають виділятися кристали В2O3
з рідини D більш багатшою речовиною В2O3. Однак при цьому
між рідинами відбувається перерозподіл речовини таким чином, що склади їх знову
приходять в точки С і D. Змінюється лише їх кількісне співвідношення так, що
відносний вміст рідини D зменшується. Поки співіснують обидві рідини, кристали
В2O3 виділяються при постійній температурі 962 °C. На
лінії СD система інваріантна, і до зникнення однієї з фаз не можна міняти ні
температуру, ні складу цих рідин без зміни фазового стану системи. Тільки тоді,
коли зникне вся рідина D температура буде знижуватися. Після охолодження до
температури евтектики розплав повністю твердіє. Нижче цієї температури в
рівновазі знаходяться кристали ZnO і В2O3 або евтектична
суміш + кристали В2O3 [5].
Практично процес кристалізації можна розглядати більш
спрощено, вважаючи, що при температурі спочатку кристалізується рідина D і лише
після її зникнення - рідина С. Описана ліквація називається стабільною, тому як
відповідає умовам термодинамічної рівноваги і проявляється тільки в
надліквідусній області.
При температурі 1100 °С відбувається поступовий розпад рідини
D на кристали В2O3 і рідина С. Отже, на лінії СD і в
цьому випадку будуть співіснувати дві рідкі фази, не змішувані між собою, і
такі склади також будуть проявляти ліквацію при їх кристалізації. Нижче процес
кристалізації йде звичайним шляхом [5].
Для точки 1 (склад ZnO + α-5ZnO×2В2O3)
фазові перетворення при охолодженні відповідають тим, які спостерігаються в
найпростіших системах. З розплаву спочатку виділяються кристали ZnO, а
залишкова рідина збагачується компонентом В2O3 (або α-5ZnO×2В2O3).
При температурі відбудеться повна кристалізація суміші з виділенням кристалів
ZnO та α-5ZnO×2В2O3 або,
точніше, кристалів ZnO і евтектичної суміші ZnO + α-5ZnO×2В2O3. Склад
α-5ZnO×2В2O3 +
β-ZnO×В2O3 в
процесі кристалізації від стану 2 (рис.2.2) спочатку виділяє тверду речовину β-ZnO×В2O3,
при цьому залишкова рідина збагачується компонентом ZnO (по лінії ліквідусу від
точки и до точки Е), а потім при tE виділяється суміш твердих
речовин ZnO та α-5ZnO×2В2O3.
При нагріванні суміші зі складом, що лежать між вертикаллю В2O3
і точкою и, реакція при tu піде у зворотному напрямку і β-ZnO×В2O3 +
+ розплав ® α-5ZnO×2В2O3.
Точка и, як і точка Е, відповідає інваріантному стану системи. У ній в
рівновазі перебувають три фази - α-5ZnO×2В2O3, β-ZnO×В2O3 і
розплав [5].
Розглядаючи фазові перетворення у різних складів в процесі
охолодження розплаву, слід підкреслити, що точки складу отриманих фаз завжди
розташовуються по обидві сторони від точки складу вихідного розплаву. Ця
закономірність дозволяє використовувати правило важеля не тільки при
температурах вище солідуса системи, тобто для знаходження співвідношення між
рідкою і твердою фазами, але і в підсолідусній частини діаграм стану, де
існують лише тверді фази [5].
2.4 Процес ліквації в системі ZnO - В2O3
Висвітлювання природи лікваційних явищ в силікатних системах,
засноване переважно на принципах кристалохімії, вперше було розпочато Б.
Уорреном і А. Пінкусом. Причиною незмішуваності вони вважали утворення
катіоном-модифікатором самостійних катіон-кисневих угруповань, які
відрізняються від кремнекисневих.
Виникнення двох різних угруповань з утворенням двох рідин
відбувається лише при достатньо великій енергії зв’язку катіона з киснем.
Основною причиною виникнення незмішуваності слід вважати
електростатичну силову взаємодію між іонами розплаву, яка викликає схильність
двох різних катіонів організувати самостійні кисневі поліедри. Для настання
фазового розшарування необхідне виконання певних умов: по-перше, певна сила
взаємодії катіон - кисень, а по-друге - структурна несумісність виникаючих
катіон-кисневих угруповань, до того ж характеристика останніх залежить в свою
чергу від ступеню поляризації аніонів (кисню).
Різні комбінації або взаємні накладання цих двох факторів -
силового і структурного - призводять до більшого чи меншого ступеню
розшарування або тенденції до розшарування. Встановити залежність між розміром
області ліквації та вказаним сумарним ефектом на цей момент не постає можливим,
тому для оцінки розплавів, схильних до розшарування використовують лише
енергетичні параметри катіонів [1].
Явище ліквації досить часто зустрічається в системах, що
утворені оксидом бору з різними основами, що ми бачимо на прикладі системи ZnO
- В2O3.
В результаті ліквації відбувається розділення розплаву на дві
рідини, одна з яких збагачена іонами металу, а друга близька за складом до
чистого В2O3. Кінетика фазового перетворення
визначається швидкістю зародження та швидкістю подальшого розвитку (зростанню
розмірів, зміни складу) неоднорідностей складу та структури, що призводить до
зменшення вільної енергії системи. Зародження неоднорідностей відбувається
флуктуаційним шляхом та супроводжується невеликими тимчасовими збільшеннями
вільної енергії системи. Воно не може бути описано звичайним рівнянням дифузії.
Друга стадія фазового перетворення - розвиток неоднорідностей, що
супроводжується зниженням вільної енергії, - підпорядковується рівнянню дифузії
для багатокомпонентних систем. Отже, можна казати про флуктуаційну та дифузійну
стадії фазового перетворення.
Слід позначити, що в більшості випадків області ліквацій
(стабільної та метастабільної) не включають склади, що відповідають стабільним
кристалічним фазам. Причина полягає в тому, що підвищеним значенням вільної
енергії розплаву (що призводять до фазового розділення) повинні відповідати і
підвищені значення вільної енергії решітки кристалу того ж хімічного складу, що
і розплав. В той самий час неможливо повністю виключити можливість існування
вказаних вище кристалічних фаз, оскільки виграш енергії, пов’язаний з
ранжуванням розташування складових кристалу атомів, може в деяких, відносно
рідких, випадках забезпечувати потрібну стабільність цих фаз [2].
Серед методів дослідження лікваційних явищ можна позначити
електронну мікроскопію, що дає змогу вивчати рельєф скла, збільшений в десятки
або сотні тисяч раз, розсіювання рентгенівськіх променів під малими кутами,
розсіювання видимого світла.
.5 Процеси поліморфних перетворень в системі
На рисунку 2.2 показана діаграми стану двокомпонентної
системи ZnO-В2O3 у якої один з компонентів - компонент В2O3
- має кілька поліморфних форм: α і β. Енантіотропні поліморфні
перетворення можуть здійснюватися як у твердому стані, так і в присутності
рідкої фази. Якщо температура повного плавлення сумішей значно змінюється в
залежності від кількості якій додається речовина, то на температуру
поліморфного перетворення одного з компонентів складу суміші не впливає. Тому
перехід між модифікаціями зображується ізотермою, що відповідає температурі
поліморфного перетворення.
В даному випадку перехід α-ZnO×В2O3 и β-ZnO×В2O3
при температурі 962 °C відбувається в присутності рідкої фази. Однак якщо
поліморфним перетворенням піддаються не чисті сполуки, а тверді розчини, то
температура поліморфних перетворень не залишається постійною і залежить від
складу твердого розчину. У цьому випадку лінія поліморфного перетворення не
буде виражатися ізотермою [2].
.6 Визначення шляхів кристалізації хімічних сполук, плавкими
інконгруентно
В двокомпонентній системі бувають випадки, коли вихідні
компоненти утворюють хімічні сполуки, в нашому випадку це сполука α-5ZnO×2В2O3 яка
плавиться з розкладанням, або інкоіґруентно.

Рисунок 2.3 -Діаграма стану системи ZnO - В2O3
При такому плавленні сполука α-5ZnO×2В2O3
виділяє рідку фазу і тверда речовина, що відрізняється за складом від вихідної
сполуки, тобто розпадається на дві фази. Остаточне плавлення суміші, що
відповідає складу α-5ZnO×2В2O3
відбувається при більш високій температурі по досягненні кривої ліквідусу [2].
Діаграма системи з хімічною сполукою, що плавиться інкоіґруентно
характеризується евтектикою Е між компонентами ZnO та α-5ZnO×2В2O3 і
наявністю слабко вираженого перегину і на кривій ліквідусу.
При температурі 964 °С сполука α-5ZnO×2В2O3
розкладається на рідину складу и (перитектика) і тверда речовина β-5ZnO×2В2O3.
Співвідношення між ними можна визначити за правилом важеля. Конода і tu
- називається перитектичною. При продовженні кривої Еu (пунктирна лінія, рис.
2.3) утворюється «прихований максимум», який відповідав би температурі
плавлення речовини α-5ZnO×2В2O3
якби воно не розкладалось. Тому іноді таку діаграму називають діаграмою зі
скритим максимумом. Вертикаль хімічної сполуки піднімається в даному випадку не
до лінії ліквідусу, а лише до перитектичної коноди [2].
.7 Застосування правила важеля графічним методом в
двокомпонентній системі
Для двокомпонентних систем застосування правила важеля
зводиться до розгляду відповідних конод, кінці яких показують крапки складів
фаз, що знаходяться в рівновазі, причому сама конода вертикаллю початкового
складу ділиться на два відрізки, довжини яких (у зворотній пропорційності)
характеризують кількості рівноважних фаз [2].
Припустимо, що початковий розплав складу а'
(рис.2.4) охолоджений до температури 1100°С. При цій температурі в рівновазі
знаходяться рідка фаза, і тверда фаза. Початковий склад можна виразити точкою а',
що лежить на перетині коноди вc з вертикаллю початкового складу а'.
За правилом важеля вміст при температурі 1100 oC
рідкої фази і кристалічної фази визначиться з вираження:
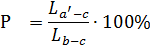
Де,  Р - кількість рідкої фази, яка відповідає фігуративній
точці в. '-c - довжина відрізка ,що відповідає вмісту рідкої
фази;в-c - довжина відрізка,що відповідає вмісту всієї системи.
Р - кількість рідкої фази, яка відповідає фігуративній
точці в. '-c - довжина відрізка ,що відповідає вмісту рідкої
фази;в-c - довжина відрізка,що відповідає вмісту всієї системи.

Рисунок 2.4 - Діаграма стану системи ZnO - В2O3
.8 Практичне застосування двокомпонентної діаграми стану ZnO
- В2O3 у промисловості
Діаграма стану ZnO - В2O3 грає немало
важну роль у виробництві оптичного стекла. Завдяки знанням в області
двохкомпонентної системи ZnO - В2O3, можна визначити
температури плавлення і склоутворення. Взагалі оксид бору виступає, як один із
найважливіших оксидів у виробництві оптичного та інших видів скла. Сам оксид
надзвичайно гігроскопічний і дуже важко кристалізується. Склообразний борний
ангідрит отримують шляхом простого плавлення борної кислоти при температурі
1200-1300 °С у вакуумі вище 500 °С. Кристалізація у вигляді безводних кристалів
В2О3 відбувається тільки при підвищеному тиску.
Завдяки відмінним електроізоляційним якостям і порівняльній
легкоплавкості боратне скло широко застосовуються в електротехніці.
Боратне скло-найбільш перспективне, так як відрізняється
низькою електропровідністю і малими діелектричними втратами, високою механічною
міцністю, а також термічної і кліматичної стійкістю. Боратне скло має
структуру, відмінну від структури силікатного скла, і здатне витримувати
помірні концентрації катіонів (наприклад, натрій до 0,1%), не збільшуючи
електропровідність. Боратне скло відповідає вимогам герметизації
напівпровідникових приладів: вільно від лужних металів, ущільнюється
(спаюється) при температурі до 800 °С, має регульовані коефіцієнти
температурного розширення. Боратне скло складається з бората цинку, окису
цинку, окису кадмію, окису алюмінію, окису кремнію. Крім того, вони можуть
включати окис берилію і в невеликих окис титану, цирконію, ніобію, лантану,
церію, скандію, гафнію, галію, індію та їх суміші. Ці склади стійки до
розскловання в широкому діапазоні температур і володіють повною змішуваністю
складових частин.
Завдяки відмінним електроізоляційним якостям і порівняльній
легкоплавкості боратне скло широко застосовуються в електротехніці. Деякі види
боратного скла представляють інтерес для оптотехніки.
3. Діаграма стану системи MgО - Al2O3 -
SiO2
.1 Загальна характеристика системи
Сучасний вид трикомпонентної діаграми стану MgО - Al2O3
- SiO2, запропонований Е. Осборном і А. Муаном на підставі
узагальнення дослідних даних цієї системи представлений на рисунку 3.1[1].системі
окрім вже розглянутих бінарних сполук - силікатів магнію (2MgO - SiO2,
MgO - SiO2) і алюмінію (ЗА12О3·2SiO2)
існує ще одна бінарна сполука - магнезіальна або благородна шпінель MgO·Al2O3,
що має велике значення в технології кераміки і вогнетривів. Шпінель плавиться
конгруентно при 2135 °С. B деяких роботах було встановлене, що саме шпінель є
первинним продуктом твердо фазних реакцій в системі MgO - Al2O3 -
SiO2 при різному співвідношенні початкових оксидів, що пояснюється
найбільшою швидкістю її утворення [1].
Потрійні сполуки в цій системі представлені кордієритом
2MgO·2Al2O3·5SiO2 і сапфірином 4MgO·5Al2O3·2SiO2.
Кордієрит, сполука, що плавиться з розкладом, тобто інконгруентно при
температурі 1540 °С, розкладаючись на рідину і кристали муліту. Кордієрит
відрізняється складним і до кінця не вивченим поліморфізмом, утворюючи декілька
поліморфних форм і проміжних фаз, крім того, для нього характерне утворення
областей однорідності (твердих розчинів).Іноді усі ці різновиди називають
кордієритоподібними фазами. Є дані про існування кордієритоподібних фаз [6].
Розглянемо детально деякі з цих фаз. Перший з представників кордієритової фази
є високотемпературний гексагональний α- кордієрит (індіалітова фаза - по назві структурно
схожого зі штучним α-
кордієритом природним мінералом індіалітом, що має склад кордієриту). α-Кордієрит є неврегульованою фазою, в
структурі якої Al3+, заміщає Si4+ в тетраедричних групах 
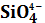 ,
розподілений статистично. α-Кордієрит утворюється при високотемпературній
(1000..1300 ºC) швидкій кристалізації скла складу
кордієриту або близького до нього і розглядається як метастабільна
кордієритоподібна фаза, оскільки при термообробці в широкому інтервалі
температур через серію проміжних сполук перетворюється в β- кордієрит. Наступна фаза це -
низькотемпературний ромбічний β-кордієрит - впорядкований і в широкому інтервалі
температур є стабільною модифікацією, ніж α- кордієрит [7]. Наступна фаза, що лежить в
області метастабільного стану є осумілітова гексагональна фаза (має схожість з
мінералом осумілітом) представляє собою кордієритоподібну метастабільну фазу,
що утворюється при кристалізації скла, в якому міститься дещо більше
кремнезему, чим в кордієриті.
,
розподілений статистично. α-Кордієрит утворюється при високотемпературній
(1000..1300 ºC) швидкій кристалізації скла складу
кордієриту або близького до нього і розглядається як метастабільна
кордієритоподібна фаза, оскільки при термообробці в широкому інтервалі
температур через серію проміжних сполук перетворюється в β- кордієрит. Наступна фаза це -
низькотемпературний ромбічний β-кордієрит - впорядкований і в широкому інтервалі
температур є стабільною модифікацією, ніж α- кордієрит [7]. Наступна фаза, що лежить в
області метастабільного стану є осумілітова гексагональна фаза (має схожість з
мінералом осумілітом) представляє собою кордієритоподібну метастабільну фазу,
що утворюється при кристалізації скла, в якому міститься дещо більше
кремнезему, чим в кордієриті.
Петалітова фаза (у структурному відношенні схожа з мінералом петалітом
Li2O·Al2O3·8Si2O) -
кордієритоподібний метастабільний різновид, що утворюється при кристалізації
скла, багатих оксидами магнію і кремнію.
Розглянемо, ще одну з фаз яка є нестійкою кордієритовою фазою зі
змінним складом від 2: 2: 5 до 1: 1: 3 (MgO : Al2O3 : SiO2),
східна по структурі із сподуменом Li2O·Al2O3·4SiO2
- це µ- кордіерит
Кордієритоподібні фази можуть існувати у вигляді твердих розчинів. За
деякими даними, ізоморфні заміщення в кордієриті можуть відбуватися, наприклад,
за наступними схемами:
2+
+ Si4+ = 2A13+ і 2A13+ + Mg2+ = 2Si4+
результаті таких заміщень можуть виникати кордієритоподібні тверді
розчини з надлишком або недоліком кремнезему або глинозему. Слід зазначити
схильність сполук розглянутої системи до утворення твердих розчинів, які,
наприклад, були виявлені в приватних системах 2MgO·2Al2O3·5SiO2
- MgO·SiO2, MgO·Al2O3 - 2MgO·SiO2,
MgO - 2MgO·SiO2 і т. д. Метастабільні кварцеподібні тверді розчини
із структурою високотемпературного α- кварцу знайдені між SiO2 і MgO·Al2O3
[6].
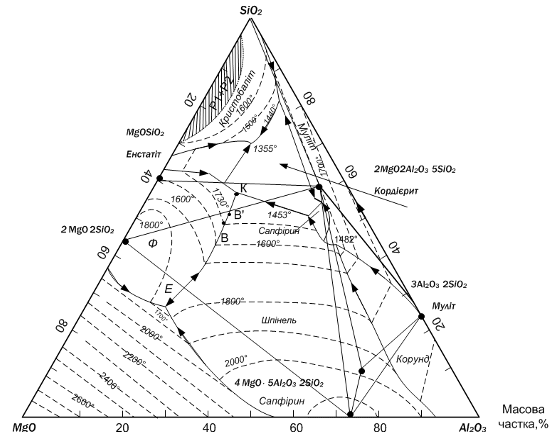
Рисунок 3.1 - Діаграма стану системи MgO - Al2O3
- SiO2
Фазові співвідношення між різними різновидами кордієриту ускладнюються
утворенням проміжних фаз з різною мірою впорядкованості. Температурні області
стабільного або метастабільного існування окремих кордієритоподібних фаз можуть
змінюватися в залежності від їх складу. H. А. Toропов встановив, що
гексагональний α- кордієрит після тривалої витримки при
температурі 1400 ºC переходить в ромбічний β- кордієрит,стійкий до 1440 °С. При 1460 ºC відбувається зворотний перехід β- кордієриту у високотемпературну α-форму. Оскільки цей перехід зворотній, можна
припустити, що α-кордієрит має при високих температурах
область стабільного існування [8].
Другим позначеним на діаграмі стану системи MgO-Al2O3-SiO2
потрійною сполукою є сапфіpин 4MgO·5Al2O3·2SiO2.
Ця сполука плавиться інконгруентно при 1475 °С, розкладаючись на рідину і
шпінель.
Відомо і ще декілька алюмосилікатів магнію, хоча жоден з них не може
при нормальному тиску існувати стабільно у контакті з розплавами цієї системи.
K таким сполукам належить, зокрема, піроп, що зустрічається в природі у вигляді
3MgO·Al2O3·3SiO2, що відноситься до групи
гранатів. Піроп був синтезований при підвищеному тиску - (6 ÷ 12) · 103 МПа і температурі 1500 ±
150 °С [6].
Крім складів для вогнетривів, одержуваних на основі
форстерита, періклаза, шпінелі, корунду і муліту, особливе значення мають
склади, близькі до кордієрити, на основі яких отримують кордієритову кераміку і
сітали. Для промислового виготовлення кордієритової кераміки використовують
природні матеріали: тальк, високоякісні вогнетривкі глини і технічний глинозем.
Температура випалу - 1300-1410 °С. У кордієритовій кераміці міститься близько
80% кордієриту, а також муліт, клиноенстатит, корунд і скло.
3.2 Елементи будови дiаграми стану
Трикутник складу є основою трикомпонентної діаграми (див.
рис.3.2), на сторонах якого вiдкладають вмiст компонентiв який виражається у
масових вiдсотках. Верхiвки трикутника MgO-Al2O3-SiO2
вiдповiдають чистим компонентам, тобто 100% вмiсту того компонента, який стоїть
у даному кутi трикутника, а два iншi кути вiдповiдають нульовому вмiсту цього
компонента [8].
Вiдлiк вмiсту компонента ведеться по сторонах трикутника, які
утворюють кут з обозначенням цього компонента, у напрямi вiд кута з його
нульовим значенням. зотерми температур на дiаграмах зображаються у виглядi
лiнiй рiвних температур-iзотерм, розташованих звичайно через 100 ˚С з
обозначенням температур, що вiдповiдають даннiй iзотермi ( 2400 ˚С, 2200 ˚С,
1900 ˚С ) [7].

Рисунок 3.2 - Діаграма стану системи MgO-Al2O3-SiO2
Точки складiв хiмiчних сполук. Точки складiв сполук, якi є
компонентами, що утворюють дану систему, знаходяться у кутах трикутника
концентрацiй (MgО, SiO2, Al2O3). Точки складiв
подвiйних сполук, які утворені двома будь-якими компонентами системи,
розташовуються на сторонах трикутника концентрацiй Al2O3·MgO2,
2MgO·SiO2, 3Al2O3·SiO2), i нарештi
точки складiв потрiйних сполук, утворених трьома компонентами системи,
знаходяться всередині трикутника концентрацiй (4MgO·5Al2O3·2SiО2,
2MgО·2Al2O3·5SiO2) [5].
У трикомпонентних системах розрiзняють хiмiчнi сполуки:
. Cполуки якi плавляться без розкладання (конгруентно);
. Cполуки якi плавляться з розкладанням (iнконгруентно);
. Cполуки якi розкладаються при нагрiваннi у твердому станi
без утворення розплаву.
Пограничнi кривi i поля первинної кристалiзацiї
(див.рис.3.3).
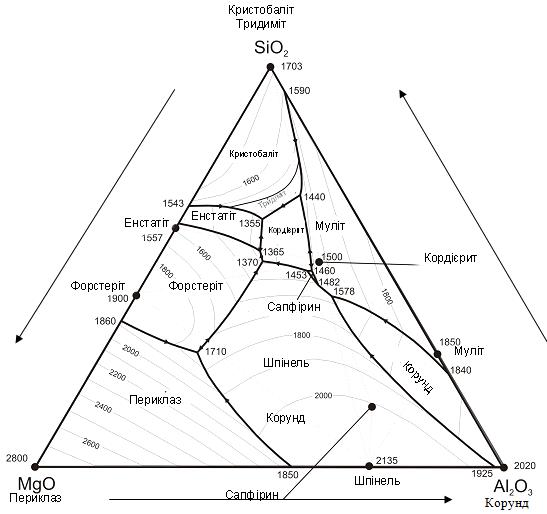
Рисунок 3.3 - діаграма стану системи MgO-Al2O3-SiO2
Усе поле трикутника концентрацiй роздiлено пограничними
кривими (наприклад k-a, a-e, e-n ) на декiлька ділянок, що мають назву, поля
первинної кристалiзацiї (k-a-e-n). Кожнiй хiмiчнiй сполуцi у данiй системi,
вiдповiдає власне визначине поле первинної кристалiзацiї. Пiсля початку
кристалiзацiї у межах любого поля первинної кристалiацiї, у рiвновазi
знаходяться двi фази - рiдина i кристали тiєї сполуки, якiй належить це поле
(поле b-e-f-g є полем первинної кристалiзацiї сполуки) [5].
Розташованi на дiаграмi стану крапки складу даної сполуки і
його поле первинної кристалiзації, визначає характер процесу вiдбуваючогося при
нагрiваннi цієї сполуки:
Якщо точка складу подвiйної чи потрiйної сполуки лежить у власному
полi первинної кристалiзації, то ця сполука плавиться без розкладання, тобто
конгруентно, в нашій системі такому плавлінню відповідає шпінель (MgO×Al2O3)
[5].
Якщо точка складу подвiйної сполуки лежить не у полi його
первинної кристалiзації, а поле примикає к сторонi трикутника на якiй лежить
точка складу цiєї сполуки, то воно плавиться з розкладанням, тобто
iнконгруенто. В даній системі інконгруентно розкладається кордієрит (2MgO×2Al2O3×5SiO2), та
сапфірин (4MgO×5Al2O3×2SiO2).
Якщо точка складу подвiйної сполуки лежить не у полi його
первинної кристалiзації, а останнє розташоване внутрi трикутника концентрацiй
не примикая к сторонi трикутника на якiй лежить точка складу цiєї подвiйної
сполуки, то воно при нагрiваннi розлогається у твердому станi [5].
На пограничних кривих, кожна з яких роздiляє два поля
первиної кристалізації, у рiвновазi знаходяться три фази - рiдина i кристали
двох сполук поля яких роздiляє ця крива, тобто система по правилу фаз у даному
випадку є моноварiантною. На пограничних кривих звичайно вказується напрям
падiння температури. В залежностi вiд характеру процеса, що вiдбувається в
системi при змiнi температури уподовж пограничних кривих, вони роздiляються на
конгруентнi i iнконгруентнi. На конгруентних пограничних кривих вiдбувається
фiзичний процес кристалiзації. Iнкогруентнi є кривими на яких вiдбувається
хiмiчна реакцiя [5].
Потрійні точки. Три прикордонні криві, що сходяться на
діаграмі стану утворюють потрійні точки (точки f,b,e), в яких, якщо
кристалізація не закінчена, в рівновазі знаходяться чотири фази - рідина
составу цієї точки та три кристалічних сполуки, поля первісної кристалізації
яких сходяться в цій точці (в потрійній точці e в рівновазі з рідкою фазою
знаходяться кристали сполук MgО×SiO2, SiO2×Al2O3,
MgО×Al2O3
і 2MgO2×Al2O3×5SiO2. В
залежності від напрямку падіння температури на прикордонних кривих потрійні
точки поділяються на точки евтектики, точки подвійного підйому та точки
подвійного опускання. Точка евтектики являється точкою, яка утворена трьома
прикордонними кривими с падаючою по всім трьом кривим до цієї точки
температурою, точка подвійного підйому утворюється трьома прикордонними
кривими, по двом з яких температура падає до точки, а по одній - від точки,
точка подвійного опускання утворюється, коли по одній прикордонній кривій
температура падає до точки, а по двом іншим прикордонним кривим - від точки. На
діаграмі точками евтектики являються потрійні точки e,a, а точками подвійного
підйому - b,f.
Єднальні прямі та елементарні трикутники. Прямі лінії на
діаграмі стану, які поєднують точки составів індивідуальних хімічних сполук,
які мають суміжні поля первісної кристалізації, називаються з’єднувальними
прямими (прямі MgO×Al2O3 - 3Al2O3×2SiO2, Mg2SiO4
-MgO×Al2O3,
SiO2-MgO×Al2O3). Кожній прикордонній кривій на діаграмі
стану відповідає своя єднальна пряма, яка поєднує состави кристалічних фаз
(сполук), що знаходяться в рівновазі вздовж цієї прикордонної кривої, та,
навпаки, кожній єднальній прямій відповідає своя прикордонна крива [7].
Єднальні прямі розбивають все поле трикутника концентрацій на
елементарні трикутники (дивись рисунок 3.4) , які утворюються єднальними
прямими.

Рисунок 3.4 - Діаграма стану MgO-Al2O3-SiO2
Трикутники:
2O3 - 3Al2O3×2SiO2 - MgO×Al2O3,
3Al2O3×2SiO2 - 2MgO×2Al2O3×5SiO2 -4MgO×5Al2O3×2SiO2, Mg2SiO4
- 2MgO×2Al2O3×5SiO2 - MgO×Al2O3,
Mg2SiO3 -2MgO×2Al2O3×5SiO2 - SiO2,
4MgO×5Al2O3×2SiO2 - 3Al2O3×2SiO2 - MgO×Al2O3.
Елементарними являються тільки ті трикутники, які не вміщують
всередині себе інших єднальних прямих і, відповідно, інших трикутників.
Елементарні трикутники дозволяють визначати кінцеві фази (сполуки)
кристалізації, що виділяються з трьохкомпонентного розплаву любого составу, й
на основі цього - кінцеву точку (температуру) кристалізації [7].
3.3 Визначення вмісту компонентів на основі трикутника
концентрацій
Для визначення вмісту якого-небудь компоненту, наприклад MgO×Al2O3 (рис.3.5),
в трикомпонентному розплаві (або сумарного вмісту компонентів в твердих фазах),
який відповідає даній фігуративній точці М.
Щоб визначити склад кристалічної фази, а також рівноважну
температуру, побудуємо шлях кристалізації. Шлях кристалізації даного розплаву
буде відповідати кривій М - Н - К. далі визначається кількість рідкої фази до
початку спільної кристалізації MgO×Al2O3 та 2MgO×SiO2 у точці Н,
при цьому першим буде кристалізуватися лише шпінель (MgO×Al2O3).
Кількість рідкої фази для точки Н знаходиться за правилом
важеля. Щоб визначити кількість рідкої фази при температурі 1550 °С (точка Д),
при якій у рівновазі з рідкою фазою будуть знаходитися кристали MgO×Al2O3
та 2MgO×SiO2. Для цього необхідно провести пряму, яка
проходить через точки Д та М до перетину зі з’єднувальную прямою MgO×Al2O3 -
2MgO×SiO2
у точці В [8].
.4 Визначення шляху кристалізації розплаву при ліквації
У полі кристалізації кристобаліту є область стабільної
ліквації. Ізотермічний перетин купола метастабільної ліквації при 1000 °С в цій
системі побудовано Б.Г.Варшалом (рис. 3.3) [7].

Рисунок 3.6 - Перетин купола метастабільної ліквації при 1000
°С в системі MgO-Al2O3-SiO2
Кристалізація розплаву починається з виділення кристалів SiO2
склад рідкої фази при цьому змінюється по продовженню прямої a2B. Як
тільки точка складу рідкої фази дійде до лівої гілки бінодальної кривої (точка
т), однорідний розплав розшаровується на дві не змішувані рідини, склад першою
з яких буде відповідати точці т, а склад другої - точки п, тобто точці
протилежного кінця проходить через точку т коноди, що лежить на правій гілки
бінодальної кривої. При подальшій кристалізації компонента SiO2
складу першої рідини буде змінюватися по лівій гілки бінодальной кривій від
точки т в напрямку точки т ', а другої рідини - по правій гілки від точки п до
точки п' [7].
Коли склад другої рідини досягне точки п' (вона знаходиться
як точка перетину правої гілки бінодальной кривої з продовженням прямої а2b),
рівноважна з нею першим рідина, склад якої вкаже протилежний кінець коноди -
точка т', зникне, повністю закристалізується, тобто ліквація припиниться.
Надалі шлях кристалізації однієї рідини,що залишилась піде у відповідності із
загальним правилом визначення первинного шляху кристалізації по прямій п'р [8].
.5 Визначення характеру процесу, що відбувається в точці
евтектики
У точці евтектики при відібранні від системи теплоти при
постійній температурі (система інваріантна), що відповідає цій точці,
відбувається фізичний процес одночасної кристалізації з рідкої фази складу цієї
точки трьох сполук, поля первинної кристалізації яких сходяться в цій точці.
При нагріванні, навпаки, відбувається одночасне плавлення
зазначених сполук. Наприклад, в точці евтектики е1 (див. рис. 3.2)
при охолодженні відбувається спільна кристалізація сполук кордієрит, енстатит і
кристобаліт, поля первинної кристалізації яких сходяться в цій точці, а при
нагріванні кристали зазначених сполук переходять в розплав. Легкоплавка
евтектика е1 з температурою 1355 °С утворена енстатитом, кордієритом
і кремнеземом [8].
Система характеризується великою схильністю до утворення
твердих розчинів. В результаті можуть виникнути чотири види кордіеритових
твердих розчинів: 1) кордієрит пересичений кремнеземом, тобто з надлишком
кремнезему; 2) кордієрит з нестачею кремнезему; 3) кордієрит з надлишком
глинозему; 4) кордієрит з нестачею глинозему [5].
3.6 Шляхи кристалізації розплаву, визначення температури
початку кристалізації розплаву
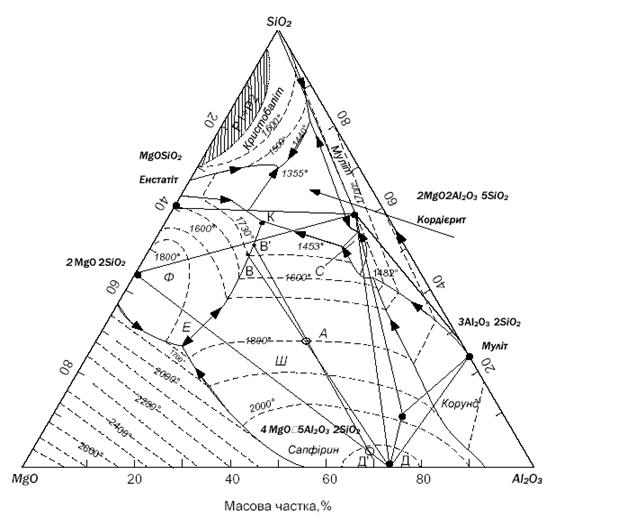
Для того щоб визначити шлях кристалізації розплаву, необхідно
знайти точку заданого составу на діаграмі стану системи MgO-Al2O3-SiO2
- це точка А (рис.3.7).

Рисунок 3.7 - Діаграма стану MgO-Al2O3-SiO2
Точка А попадає у елементарний фазовий трикутник: 2MgO×SiO2 - MgO× Al2O3 -
2MgO×
2Al2O3×5SiO2. Тому кінцевою
точкою кристалізації розплаву А буде потрійна евтектична точка К, у якій
сходяться поля первинної кристалізації сполук 2MgO×SiO2, MgO× Al2O3
та 2MgO× 2Al2O3×5SiO2 [1].
А оскільки точка А лежить у полі первинної кристалізації
шпінелі (MgO× Al2O3) - це відрізок А-В до перетину з
конгруентною прикордонною кривою MgO× Al2O3 - 2MgO×SiO2 в точці В.
Далі шлях кристалізації піде до падіння прикордонної кривої (В-К) і по мірі
просування по ній буде відбуватися спільна кристалізація двох фаз: шпінелі (MgO× Al2O3)
та форстериту (2MgO×SiO2). При досягненні евтектичної точки К залишковий
розплав повністю кристалізується з утворенням трьох фаз: 2MgO×SiO2, MgO× Al2O3
та 2MgO× 2Al2O3×5SiO2 [1].
Шляхи кристалізації в системі відрізняються значною
складністю внаслідок інконгруентного характеру плавлення потрійних сполук.
Найбільший інтерес представляють шляхи кристалізації складів, що лежать в
області кордієриту або поблизу нього, а також в області шпінелі, корунду і
муліту [8].
У полі кордієриту шлях кристалізації йдуть по прямим,
вихідними з точки складу кордієриту. Закінчується кристалізація в евтектичних
точках з температурою 1355 °С, якщо точка заданого складу лежить в фазовому
трикутнику кордієрит-енстатит-тридіміт і з температурою 1365 °С - у разі
фазового трикутника кордієрит-енстатіт-форстерит. Тільки неначна частина
складів цієї області, що належать фазовому трикутнику
кордієрит-форестерит-шпінель закінчує кристалізацію в точці подвійного підйому
з температурою 1373 °С [8].
Склади, що лежать в полі кристалізації муліту або шпінелі
мають більш складні шляхи кристалізації. Прикордонні криві між полями
кристалізації сапфірин-шпінель і муліт-кордієрит інконгруентні, а інваріантна
точка з температурою 1482 °С між полями шпінелі, муліта і сапфірина є точкою
подвійного опускання. Тому шляхи кристалізації розплавів можуть проходити дві
потрійні інваріантні точки і закінчуватися в третій. Так, склад а, який
належить до фазового трикутника сапфірин-муліт-кордієрит, матиме шлях
кристалізації, що проходить через точку подвійного підйому з температурою 1578
°С (шпінель-муліт-корунд), а потім через точку подвійного опускання з
температурою 1482 °С (шпінель-муліт-сапфірін) і закінчується в точці подвійного
підйому з температурою 1460 °С (сапфірін-муліт-кордієрит). У точці подвійного
опускання 1482 °С закінчать кристалізацію лише склади, що лежать в фазовому
трикутнику шпінель-сапфірін-муліт [8].
Склад b лежить в полі кристалізації муллита. Шлях
кристалізації його піде по продовженню лінії муліт - точка b з виділенням
муліта. Далі фазові перетворення підуть за схемою: розплав ® муліт + рідина ® муліт (розчиняється) +
кордієрит (утворюється) + рідина ® кордієрит + рідина ® кордієрит + трідиміт +
рідина (в точці евтектики): кордієрит + тридиміт + протоенстатіт + рідина ® кордієрит + трідіміт +
енстатит. Кристалізація закінчиться в евтектиці при температурі 1355 °С. Таким
чином, кристали муліту на прикордонній кривій розчиняються і шлях кристалізації
покине прикордонну криву в точці їх зникнення [7].
.7 Практичне застосування двокомпонентної діаграми стану
MgO-Al2O3-SiO2 у промисловості
Завдяки знанням в області трикомпонентної діаграми стану
MgO-Al2O3-SiO2 можна фігурувати з
температурами та отримувати різні модифікації кордієриту. Наприклад при 980 °С,
можна отримати метастабільнийтвердий розчин, що позначається як «високий
кварц». Максимальну кількість цього продукту, можно отримати вже через 50 хв.,
а потім відбувається наростання кількості «високого кордиериту».
Система MgO-А12О3-SiO2 має
значення для технології отримання різних вогнетривів (периклазових, шпінелевих,
корундових, форстеритових), спеціальних керамічних виробів (кордієритових,
стеатітових), склокристалічних матеріалів і, зокрема, має особливе значення для
отримання керамічних і склокристалічних матеріалів з виключно низьким і навіть
негативним коефіцієнтом термічного розширення на основі кордієриту.
Вогнетриви виготовлені на цій основі широко використовуються
в металургії при футеровці сталеплавильних агрегатів, тому характеризуються
високою вогнетривкістю, не зазнають модифікаційних перетворень при нагріванні,
мають високу хімічну стійкість до агресивного впливу розплавів металів і
основних шлаків.
4. Практичне застосування діаграм стану, шляхом вирішення
задач
.1 Вирішення задачі по двокомпонентним системам
Задача № 68
Визначити якісний та кількісний фазовій склад при повній
кристалізації суміші, яка містить 60% Na2O та 40% P2O5
[3]
Рішення
Як видно з діаграми стану системи Na2O - P2O5
(рисунок 4.1) при повній кристалізації суміші, яка містить 60% Na2O
та 40% P2O5, система буде являти собою суміш кристалів Na2O×P2O5 та
2Na2O×P2O5.
Кількість рівноважних фаз за діаграмою стану можна
розрахувати аналітичним способом за допомогою рівняння:

де Р1 - кількість кристалів Na2O×P2O5,
%;
Х - вміст Na2O у вихідній суміші, Х = 60%;
х - вміст Na2O у твердій фазі Na2O×P2O5,
дорівнює 50%, що витікає з діаграми (рис. 1.3);
х' - вміст Na2O у твердій фазі 2Na2O×P2O5,
дорівнює 66,6% (рис.1.3);
Р2 - кількість кристалів 2Na2O×P2O5,
%;
Тоді маємо:
 Р1
Р1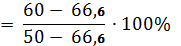
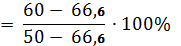 =
40%
=
40%
Р2 = 100 - 40 = 60%
Отже, при повній кристалізації суміші, яка містить 60% Na2O
та 40% P2O5, отримуємо суміш кристалів 40% Na2O×P2O5 та 60% 2Na2O×P2O5.
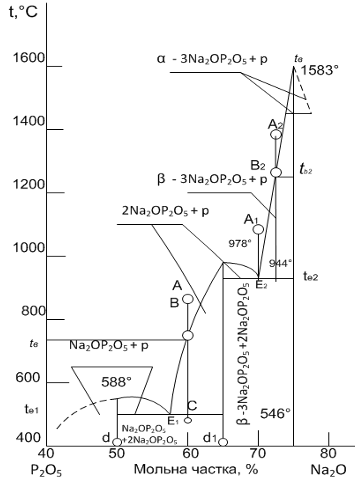
Рисунок 4.1 - Діаграма стану двокомпонентної системи Na2O
- P2O5 .
Завдання №69
Визначити при 1100 °С склад рідини, що не змішується, яка
отримана при плавленні суміші, що містить 60% В2O3 та 40%
ZnO [3]
Рішення
На діаграмі стану системи ZnO-В2O3 (рис.4.2)
знайдемо точку вихідної суміші - це точка а, і від неї підіймемо перпендикуляр
до коноди 1100 °С (точка а').
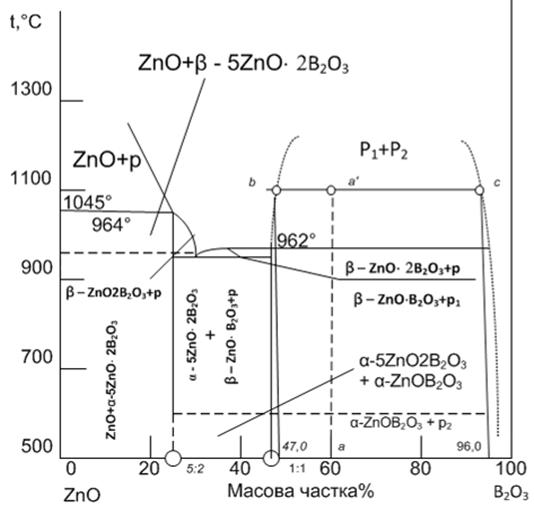
Рисунок 4.2 - Діаграма стану системи ZnO - В2O3
Точки перетину коноди з кривою ліквації (точки в та с)
відповідають складу рідинам, що не змішуються, які утворені в процесі плавлення
вихідної суміші при 1100 °С.
Від точок перетину опустимо перпендикуляри на вісь складу та
знайдемо рідини, що не змішуються:
Р1: 47% В2O3 та 53% ZnO;
Р2: 96% В2O3 та 4% ZnO;
Кількість кожної з рівноважних фаз можна розрахувати по
коноді в - с за допомогою правила важеля:
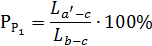
де  - кількість рідкої фази, яка відповідає фігуративній точці в
(Р1).
- кількість рідкої фази, яка відповідає фігуративній точці в
(Р1).
Отже, 
Кількість рідкої фази, яка відповідає фігуративній точці с (Р2):
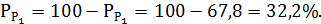
.2 Вирішення задачі по трикомпонентним системам
Завдання №67
Описати шлях кристалізації розплаву, який містить 30% MgO,
40% Al2O3, 30% SiO2. Визначити від якої
температури необхідно загартовувати склад, щоб у продуктах містилось 60% скла
[3]
Рішення
Знайдемо точку заданого складу на діаграмі системи MgO - Al2O3
- SiO2 - це точка А (рис 4.3). Точка А потрапляє у елементарний
фазовий трикутник: 2MgO×SiO2 - MgO×Al2O3 - 2MgO × 2Al2O3
× 5SiO2. Тому
кінцевою точкою кристалізації розплаву А буде потрійна точка К, у якій
сходяться поля первинної кристалізації сполук 2MgO×SiO2, MgO×Al2O3,
2MgO ×
2Al2O3 × 5SiO2.Оскільки точка А лежить
у полі первинної кристалізації шпінелі (MgO×Al2O3),
то шлях кристалізації точки А піде по продовженню прямої, яка з’єднує точку А з
точкою шпінелі (MgO×Al2O3) - це відрізок А-В до перетину з
конгруентною прикордонною кривою 2MgO×SiO2 - MgO×Al2O3 в
точці В.
Далі шлях кристалізації піде по ділянці прикордонної кривої
(В-К) і по мірі просування по ній буде відбуватися спільна кристалізація двох
фаз: шпінелі (MgO×Al2O3) та форстериту (2MgO×SiO2). При
досягненні евтектичної точки К залишковий розплав повністю кристалізується з
утворенням трьох фаз 2MgO×SiO2, MgO×Al2O3,
2MgO ×
2Al2O3 × 5SiO2.
Вміст у продуктах 60% скла можливий у тому випадку, коли у
даній точці шляху кристалізації вміст рідкої фази буде складати 60%.
Спочатку знайдемо кількість рідкої фази до початку спільної
кристалізації MgO×Al2O3 та 2MgO×SiO2 в точці В.
Кількість рідкої фази Р знаходимо за допомогою правила важеля:
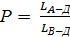 ×100 % =
×100 % = 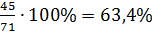
Умові Р = 60 % на прикордонній кривій ВК буде відповідати
точка В', Кількість рідкої фази Р1 знаходимо за допомогою правила важеля:

Рисунок 4.3 - Діаграма стану MgO-Al2O3-SiO2
Точка В' відповідає температурі ~ 1460 °С. Тоді загартування
розплаву, якій містить 30 % МgO, 40 % А12O3, 30 % SіO2,
у продуктах якого містилось би 60 % скла, необхідно починати від температури ~
1460 °С
Завдання № 68
Вихідний розплав, який містить 35 % МgO, 40 % Аl2O3,
25 % SіO2, охолоджений до температури при якій залишається 55 %
рідкої фази. Визначити склад і співвідношення кристалічних фаз, а також
рівноважну температуру, до якої охолоджується розплав [3].
Рішення
Спочатку знаходимо місце положення точки заданого складу (35
% МgO, 40 % Аl2O3, 25 % SіO2, ) - це точка М
на діаграмі стану системи МgO - А12O3 - SiO2
(рис. 4.4).
Щоб визначити склад і співвідношення кристалічних фаз, а
також рівноважну температуру, при якій залишається 55 % рідкої фази, побудуємо
шлях кристалізації вказаного розплаву. Шляху кристалізації даного розплаву буде
відповідати крива М - Н - К.
Спочатку визначимо кількість рідкої фази до початку спільної
кристалізації МgO × А12O3 та 2МgO×SiO2 у точці Н,
при цьому першим буде кристалізуватися шпінель (МgO × А12O3).
Кількість рідкої фази для точки Н знайдемо за правилом важеля:
 ×100 % =
×100 % = 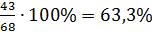
Знайдемо кількість рідкої фази при температурі 1550 °С (точка
Д), при якій у рівновазі з рідкою фазою буде знаходитися кристали МgO×А1203
та 2МgO × SiO2.
Для цього проводимо пряму, яка проходить через точки М та Д
до перетину зі з'єднувальною прямою МgO × А12O3 ×2МgO ×SiO2 в точці В. Тоді знаходимо:
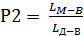 ×100 % =
×100 % = 
Отже 55 % рідкої фази буде знаходиться в інтервалі температур
(1600- 1550) °С. Умові Р = 55 % буде відповідати точка О (рис. 3.5). Для точки
О:
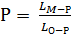 ×100 % =
×100 % = 
З діаграми стану видно, що точки О відповідає температура
1590 °С.

Рисунок 4.4 - Діаграма стану MgO-Al2O3-SiO2
Склади рівноважних кристалічних фаз:
1) шпінель (МgO × А12O3) - 28 %
МgO та 72 % А12O3;
2) форстерит (2МgO × SiO2) - 57 % МgO та 43 %
SiO2.
Вміст кожної з кристалічних фаз розраховуємо по місце
положенню точки Р на з'єднувальній прямій МgO × А12O3
- 2МgO × SiO2:
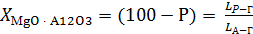 ×100 % = (100-55)×
×100 % = (100-55)× 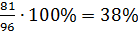
Вміст кристалів форстериту (2МgO × SiO2) при
температурі 1590 °С буде: 100 - 38 - 55 = 7%.
Висновки
На основі аналітичного аналізу
літератури та проведеної роботи по вивченню та ознайомленню з фазовими
діаграмами двокомпонентних систем Na2O - P2O5,
ZnO - B2O3 та трикомпонентної системи MgO - Al2O3
- SiO2 можна зробити наступні висновки:
1. Фізична хімія як наука та її розділ про фазові діаграми
має важливе значення в наш час. Вивчення діаграм стану дає можливість
спостерігати за фазовими перетвореннями, процесами кристалізації, плавлення,
розкладення вихідних компонентів, надає знання відносно того, які сполуки
можуть утворюватися у системі, в яких поліморфних модифікаціях вони
знаходяться, при якій температурі, з яким складом. Саме завдяки цьому можливо
отримувати якісні кінцеві матеріали з гарними заздалегідь заданими
властивостями.
. Вивчення фазових діаграм дає можливість цілеспрямовано
впливати на процеси синтезу, а також обрати оптимальні умови та параметри для
його проведення. Так, наприклад, знаючи, що система, яка має евтектичний склад
плавиться при найнижчій температурі - евтектичній температурі, у порівнянні з
температурами плавлення або кристалізації інших складів даної часної системи,
можна забезпечити економію паливно-енергетичних ресурсів без негативного впливу
на вихідні продукти, проводячи процеси синтезу при пониженій температурі.
. Вивчення діаграми стану Na2O-P2O5
є дуже важливим, оскільки результати досліджень використовуються у
багатьох галузях будівельної промисловості. Головний інтерес обумовлений важливістю
вивчення сполук оксиду натрію та пентаксиду фтору при виготовленні деяких видів
скла спеціального складу - оптичного скла, що використовується при
конструюванні різноманітних оптичних приборів. Діаграма стану Na2O -
P2O5 грає важливу роль у виробництві фосфатного лазерного
скла. Фосфатне скло призначене для виготовлення активних елементів
твердотільних лазерів.
. Дослідження та аналіз діаграми стану двокомпонентної
системи ZnO-B2O3 має дуже велику роль у наш час, оскільки
сучасна промисловість та прогрес виробництва постійно вимагає нових видів
матеріалів з особливими властивостями. Так дана діаграма має суттєве значення у
виробництві оптичного стекла, а саме у виробництві боратного скла.
Боратне скло-найбільш перспективне, так як відрізняється
низькою електропровідністю і малими діелектричними втратами, високою механічною
міцністю, а також термічної і кліматичної стійкістю. Боратне скло має
структуру, відмінну від структури силікатного скла, і здатне витримувати
помірні концентрації катіонів, не збільшуючи електропровідність.
. Система оксид магнію - оксид алюмінію - оксид кремнію має
велике практичне значення. Без силікатних матеріалів - різних видів цементу,
бетону, шлакобетону, кераміки, скла, вогнетривів навряд чи можна уявити собі
наше повсякденне життя. Виробництво саме цих матеріалів пояснює та доводить
важність вивчення діаграми та її практичне використання.
. Таким чином, значення науки хімія силікатів та її внесок у
сучасне виробництво має глобальний характер. Оскільки створення нових видів
матеріалів з наперед заданими особливими властивостями: надміцність,
надпластичність, надпровідність, вогнетривкість неможливе без глибоких знань
про структуру і властивості матеріалів. Всіма цими питаннями займається фізична
хімія силікатів, що і є неспростовним доказом важливості вивчення даної галузі
науки і актуальність даних питань у наш час.
Перелік посилань
1. А.С. Бережной - Многокомпонентные системы окислов.
- К.:Наукова думка, 1970.-535с.
2. В.С. Горшков, В.Г. Савельев, Н.Ф. Федоров -
Физическая химия силикатов и других тугоплавких соединений. - М.:Высшая
школа,1988.-400с.
. Н.М. Бобкова, Л.М. Силич, И.М. Терещенко -
Сборник задач по физической химии силикатов и тугоплавких соединений.-М.:
Университетское, 1990. -176с.
. Торопов Н.А. и др. Диаграммы состояния
силикатных систем. Справочник.- . - М.: Высшая школа, 1969. - 826с.
. А.А. Пащенко - Физическая химия
силикатов.-М.:Высшая школа, 1986.-368с.
. К.К. Стрелов - Теоретические основы
технологии огнеупорных материалов. - М.: Металлургия, 1985.-480с.
. В. Эйтель - Физическая химия силикатов. - М.:
Издательство иностранной литературы, 1962. - 1056с.
. А.С. Бережной, Я.Н. Питак, А.Д. Пономаренко,
Н.П. Соболь - Физико-химические системы тугоплавких, неметаллических и
силикатных материалов: Учеб. пособие - К.: УМК ВО,1992. - 72 с.