Получение бромистого бутила
Получение бромистого бутила
Бромистый бутил, получение которого описано в данной работе,
используется в органическом синтезе.
) для синтеза н-октана:
2CH3CH2CH2CH2Br + 2Na  CH3 (CH2) 6CH3
+
2NaBr
CH3 (CH2) 6CH3
+
2NaBr
2) для получения бутина-1, который в свою очередь
используется как катализатор при получении синтетического каучука (конденсации
ацетилена с формальдегидом): Бромбутан -> Бутен -> Дибромбутан -> Бутин
Свойства
н-бутилового спирта
CH3-CH2-CH2-CH2-OH
Бутиловый спирт (н-бутанол) - представитель одноатомных
спиртов. Бесцветная вязковатая жидкость с характерным запахом сивушного масла.
Смешивается с органическими растворителями.
Применение
Бутанол применяют:
· как растворитель в
лакокрасочной промышленности, в производстве смол и пластификаторов
· модификаторы мочевино- и
меламино-формальдегидных смол.
· для получения
пластификаторов: дибутилфталата, трибутилфосфата.
· для получения
бутилацетата и бутилакрилата и эфиров с гликолями.
· в синтезе многих
органических соединений.
Применение в качестве автомобильного
топлива
Может, но не обязательно должен,
смешиваться с традиционными топливами. Энергия бутанола близка к энергии
бензина. Бутанол может использоваться в топливных элементах, как сырьё для
производства водорода.
В 2007 году в Великобритании начались
продажи биобутанола в качестве добавки к бензину.
Молярная масса 74,12 г/моль
Плотность 0,81 г/см3
Температура плавления -90,2ºС
Растворимость в воде 7,9 г / 100 мл
Показатель преломления 1,399
Способы
получения бутанола
1) Оксосинтез из пропилена в присутствии НСо(СО)4
при 120-160°С и 20-35 МПа:
СН3 - СН = СН2 + СО + Н2
®
СН3СН2СН2СНО + (СН3)2CHCH = O 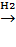 CH3(CH2)3OH + (CH3)2CHCH2OH
CH3(CH2)3OH + (CH3)2CHCH2OH
2) Из пропилена в одну стадию под
давл. 1,0-1,5 МПа (по Реппе):
СН3 - СН = СН2 + 3СО + 2Н2O  CH3(CH2)3OH
+ (CH3)2CHCH2OH + 2CO2
CH3(CH2)3OH
+ (CH3)2CHCH2OH + 2CO2
) Из ацетальдегида через ацетальдоль и крoтоновый альдегид, который
гидрируют на медных, меднохромовых или никелевых катализаторах:
2CH3CHO  CH3CH(OH) CH2CHO
CH3CH(OH) CH2CHO
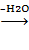 CH3CH = CHCHO
CH3CH = CHCHO 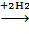 CH3(CH2)3OH
CH3(CH2)3OH
) Ацетоно-бутиловым брожением пищ. сырья; соотношение
образующихся при этом продуктов - ацетон: н-бутанол: этанол = 3:6:1
Свойства
бромистого бутила
Бромистый бутил (СН3СН2СН2СН2Br) - бесцветная вязковатая
жидкость.
Мало растворим в воде, хорошо растворим в этаноле, ацетоне,
эфирах.
Молярная масса 137,02 г./моль
Плотность 1,299 г./см3
Температура плавления -112,4º С
Температура кипения 101,6º С
Показатель преломления 1,4398
Метод
получения
Для получения бромистого бутила характерен
следующий способ получения:
KBr + H2SO4 ® HBr + KHSO43CH2CH2CH2OH
+ HBr ® CH3CH2CH2CH2Br
+ H2O
спирт бутиловый бромид серный
Механизм реакции - нуклеофильное замещение (SN2)
Реактивы:
н-бутиловый спирт…………………………. 11,5 мл (9 г)
Бромистый калий……………………………. 18,5 г
Серная кислота (ρ=1,84)…………………..15 мл
Хлорид кальция
Посуда и оборудование:
Колбонагреватель, круглодонная колба, обратный холодильник,
воронка, приемник, термометр.
Ход синтеза
Собирают установку для синтеза, состоящую из нагревателя,
круглодонной колбы и обратного холодильника. В круглодонную колбу вливают 17,5
мл воды, добавляют бромистый калий и бутиловый спирт, присоединяют обратный
холодильник. В форштос холодильника вставляют воронку и через неё небольшими
порциями (по 2-3 мл) при постоянном помешивании приливают 15 мл
концентрированной серной кислоты. В колбу бросают кипелки и осторожно нагревают
смесь до слабого кипения, кипятят в течение 1 ч. Затем заменяют обратный
холодильник на нисходящий (холодильник Либиха), усиливают нагревание и отгоняют
бромистый бутил в приемник с водой. Перегонку заканчивают, когда маслянистые
капли бромистого бутила не будут опускаться на дно приемника. Содержимое
приемника переносят в делительную воронку, тщательно отделяют нижний слой от
воды, собирая его в сухую колбу. Для удаления следов воды бромистый бутил
«осушают» безводным хлоридом кальция в течение 10 - 15 мин, периодически
встряхивая колбочку. Когда жидкость становится прозрачной, процесс сушки
считают законченным. Бромистый бутил отделяют от твердого осадка хлорида
кальция декантацией (сливанием через край) в перегонную колбу. Прибор для
простой перегонки предварительно тщательно высушивают. Приемник взвешивают.
Медленно перегоняют бромистый бутил, отбирая фракцию, кипящую в пределах 98-103ºС. Определяют объем полученного продукта, измеряют его показатель
преломления. Выход по руководству 12,5 г.
Наблюдения за ходом эксперимента.
По прошествии реакции бромида калия и н-бутанола с серной
кислотой, смесь разделилась на два слоя: верхний масляный слой
светло-коричневого цвета и нижний - прозрачный. Перегонка велась до тех пор,
пока маслянистые капли не перестали капать на дно приемника. При осушении
кусочки хлорида кальция значительно набухли, что свидетельствовало о большом
количестве воды в получаемом продукте. При перегонке продукт стал практически
прозрачным.
Полученный продукт идентифицировали по ИК-спектру.
На основе спектра были сделаны следующие выводы:
· Имеется интенсивная полоса поглощения С-Н
в sp3 - гибридном состоянии в области 2900 см-1,
свидетельствующая о наличии - СН2 - углеводородного радикала
· Имеется полоса поглощения 1250 см-1,
характерная для класса соединений простых эфиров, которые могли присутствовать
в сыром продукте по причине возможной межмолекулярной дегидратации спирта
· Наблюдаем полосу средней интенсивности
1050 см-1, свидетельствующую о наличии именно первичного спирта
· Слабые пики при 500-750 см-1 говорят
о малом содержании брома в полученном продукте
Выход
продукта
CH3CH2CH2CH2OH
+ KBr + H2SO4 ® CH3CH2CH2CH2Br
+ KHSO4 + H2O
n(CH3CH2CH2CH2OH)
= 9/74,12 = 0,12 г./моль
n(KBr) = 18,5/118,9 = 0,16 г./моль
Н-бутанол в недостатке, тогда:
n(CH3CH2CH2CH2OH) = n(CH3CH2CH2CH2Br)
m(CH3CH2CH2CH2Br) = 0,12 * 137,02 = 16,44 г. - теоретический выход продукта (100%)
выход по руководству: 12,5 г, что составляет 76% от теоретического
практический выход: 12 г.
Абсолютная ошибка: (1 - 12/12,5) * 100% = 4%.
Был синтезирован бромистый бутил из н-бутанола, бромида
калия, серной кислоты и произведена идентификация продукта по его ИК-спектру.
Абсолютная ошибка составила 4%.
Библиографический
список
1. Тюкавкина
Н.А. Руководство к лабораторным занятиям по органической химии. М.: Дрофа, 2002
2. Тюкавкина
Н.А. Органическая химия. Основной курс. М.: Дрофа, 2003
. Е.В.
Ермолаева, И.С. Акчурина, Е.С. Ильина Основы синтезов органических соединений:
учеб. пособие Владим. гос. ун-т. - Владимир: Изд-во Владим. гос. ун-та, 2010.
. Рабинович
В.А., Хавин З.Я. Краткий химический справочник. Л.: Химия, 1991