Номенклатура отходов производства магния
Введение
Магний - серебристо-белый блестящий металл, сравнительно мягкий и
пластичный, хороший проводник тепла и электричества. Почти в 5 раз легче меди,
в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния.
Плавится магний при температуре 651 оС, но в обычных условиях расплавить
его довольно трудно: нагретый на воздухе до 550 оС он вспыхивает и мгновенно
сгорает ослепительно ярким пламенем. Полоску магниевой фольги легко поджечь
обыкновенной спичкой, а в атмосфере хлора магний самовозгорается даже при
комнатной температуре. При горении магния выделяется большое количество
ультрафиолетовых лучей и тепла - чтобы нагреть стакан ледяной воды до кипения,
нужно сжечь всего 4 г. магния.
Магний расположен в главной подгрупп второй группы периодической системы
элементов Д.И. Менделеева. Порядковый номер его - 12, атомный вес - 24,312.
Электронная конфигурация атома магния в невозбужденном состоянии 1S22S2P63S2;
валентными являются электроны наружного слоя, в соответствии с этим магний
проявляет валентность II. В тесной связи со строением электронных оболочек
атома магния находится его реакционная способность. Из-за наличия на внешней
оболочке только двух электронов атом магния склонен легко отдавать их для
получения устойчивой восьмиэлектронной конфигурации; поэтому магний в
химическом отношении очень активен.
На воздухе магний окисляется, но образующаяся при этом окисная пленка
предохраняет металл от дальнейшего окисления. Нормальный электронный потенциал
магния в кислой среде равен -2,37в, в щелочной - 2,69в. В разбавленных кислотах
магний растворяется уже на холоде. Во фтористоводородной кислоте не растворим
вследствие образования пленки из труднорастворимого в воде фторида MgF2; в
концентрированной серной кислоте почти не растворим. Магний легко растворяется
при действии растворов солей аммония. Растворы щелочей на него не действуют.
Магний поступает в лаборатории в виде порошка или лент. Если поджечь магниевою
ленту, то она быстро сгорает с ослепительной вспышкой, развивая высокую
температуру. Магниевые вспышки применяют в фотографии, в изготовлении
осветительных ракет. Температура кипения магния 1107 оС, плотность = 1,74
г/см3, радиус атома 1,60 НМ.
1. Описание химико-технологической схемы производства магния
В настоящее время наряду с развитием электролитического способа
совершенствуются силикотермический и карботермический способы получения магния.
На первой стадии развития магниевой промышленности в качестве сырья применяли
хлористые соли карналлит, природные рассолы, хлоромагниевые щёлочи калийной
промышленности.
Основной способ производства магния - электролитический.
Электролитическое получение магния из водных растворов невозможно, так как
электрохимический потенциал магния значительно более отрицательный, чем
потенциал разряда ионов водорода на катоде. Поэтому электролиз магния ведут из
его расплавленных солей.
Mg2+ 2Cl-
К -) А +)
Mg2+ +2e Mg0 2Cl- -2e Cl20
ЭЛЛЕКТРОЛИ3
MgCl2 2Mg + 2Cl2
магний твердый отход хлор
Основная составляющая электролита - хлористый магний МgCl2, а для
снижения температуры плавления электролита и повышения его электропроводности в
него вводят NаСl, СаСl2, КСl и небольшие количества NaF и СаF2.
Основным сырьем для получения магния являются карналлит (МgСl2•КСl•6Н2О),
магнезит (МgСО3), доломит (СаСО3•МgСО3), бишофит (МgСl2•6Н2О). Наибольшее
количество магния получают из карналлита. Обогащение карналлита является первой
стадией его переработки. Сущность процесса обогащения сводится к отделению КСl
и нерастворимых примесей путем перевода в водный раствор МgСl2 и КСl. При
охлаждении полученного раствора в вакуум-кристаллизаторах выпадают кристаллы
искусственного карналлита МgСl2•КСl•6Н2О, которые отделяют фильтрованием.
Карналлит обезвоживают в две стадии. Первую стадию проводят в трубчатых
печах или печах кипящего слоя при 550-600° С. Под действием теплоты нагретых
газов карналлит обезвоживается и после такой обработки содержит 3-4% влаги.
Вторую стадию обезвоживания осуществляют либо плавкой полученного после первой
стадии карналлита в электропечах с последующим отстаиванием окиси магния, либо
хлорированием карналлита в расплавленном состоянии.
Электролитическое получение магния. Для этой цели применяют электролизер,
который изнутри футерован шамотным кирпичом. Анодами служат графитовые
пластины, а катодами - стальные пластины, расположенные по обе стороны анода.
Для электролитического разложения хлористого магния через электролит пропускают
ток под напряжением 2,7-2,8 В. В результате электролитического разложения
хлористого магния образуются ионы хлора, которые движутся к аноду и после
разряда создают пузырьки хлора, выходящие из электролита. Ионы магния движутся
к катоду и после разряда выделяются на поверхности, образуя капельки жидкого
магния.
Магний имеет меньшую плотность, чем электролит, поэтому он всплывает на его
поверхность в катодном пространстве, откуда периодически удаляется с помощью
вакуумного ковша. В процессе электролиза в электролите повышается концентрация
других хлоридов за счет расходования МgСl2. Поэтому периодически часть
отработанного электролита удаляют из ванны и вместо него заливают расплав МgСl2
или карналлита. В результате частичного разложения примесей на дне ванны
образуется шлам, который регулярно удаляют из ванны. Кроме магния при
электролизе получают также Cl2.
Разработан и другой способ получения магния - термический. В этом случае
для восстановления оксида магния при высокой температуре используют кокс или
кремний.
+ C = Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит
CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С
участием доломита протекают реакции:
·MgCO3 = CaO + MgO + 2CO2,
2MgO + 2CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет
получать магний более высокой чистоты. Для получения магния используют не
только минеральное сырье, но и морскую воду.
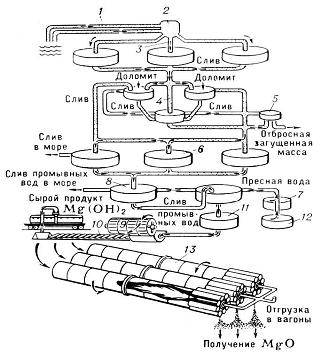
Рис.1
2. Вредные вещества, образующиеся в результате получения
магния:
Cl2
CO2
СО
NaF
CaF2
3. Паспорта загрязнителей
.1 Паспорт ингредиентного загрязнителя
. Наименование загрязнителя: Хлор (Cl2)
. Химическая и структурная формула, химическая активность:
Cl=Cl Cl2
Химически хлор очень активен, непосредственно соединяется почти со всеми
металлами (с некоторыми только в присутствии влаги или при нагревании) и с
неметаллами (кроме углерода, азота, кислорода, инертных газов), образуя
соответствующие хлориды. Вступает в реакцию со многими соединениями, замещает
водород в предельных углеводородах и присоединяется к ненасыщенным соединениям.
. Происхождение: хлор встречается в природе только в виде
соединений. Основную роль в истории хлора в земной коре играет водная миграция.
В виде иона Cl- он
содержится в Мировом океане (1,93%), подземных рассолах и соляных озерах.
Известны также крупные месторождения хлоридов калия и магния и смешанных
хлоридов: сильвин КCl, сильвинит (Nа, К) Cl, карналлит КCl*МgCl2*6Н2О, каинит
КCl*МgSO4*ЗН2О, бишофит МgCl2*6Н2О.
. Применение: одной из важных отраслей химической промышленности
является хлорная промышленность. Основные количества хлора перерабатываются на
месте его производства в хлорсодержащие соединения. Хранят и перевозят хлор в
жидком виде в баллонах, бочках, железнодорожных цистернах или в специально
оборудованных судах. Для индустриальных стран характерно следующее примерное
потребление хлора: на производство хлорсодержащих органических соединений - 60
- 75%; неорганических соединений, содержащих хлор, -10 -20%; на отбелку
целлюлозы и тканей - 5 - 15%; на санитарные нужды и хлорирование воды - 2 - 6%
от общей выработки. Хлор применяется также для хлорирования некоторых руд с
целью извлечения титана, ниобия, циркония и других.
. Характер опасности (воздействие на живые объекты-человек,
животные, растения):
Газообразный хлор и химические соединения, содержащие хлор в активной
форме, опасны для здоровья человека (токсичны). При вдыхании этого газа
возможно острое и хроническое отравления. Клинические формы зависят от
концентрации хлора в воздухе и продолжительности экспозиции. Различают четыре
формы острого отравления хлором: молниеносная, тяжелая, средней тяжести и
легкая. Отдаленные последствия перенесенного острого отравления хлором
проявляются как хронический фарингит, ларингит, трахеит, трахеобронхит,
пневмосклероз, эмфизема легких, бронхо-эктатическая болезнь, легочно-сердечная
недостаточность. Такие же изменения в организме возникают при длительном
пребывании в условиях, когда в воздухе постоянно содержится газообразный хлор в
малых концентрациях (хроническое отравление хлором). Воздействие на
незащищенную кожу хлорсодержащих соединений вызывает хлорные угри, дерматит,
пиодермию.
. Органолептические свойства: Хлор - газ желто-зеленого цвета, с
резким запахом (запах хлорной извести), в 2,5 раза тяжелее воздуха, поэтому при
утечках хлор прежде всего заполняет овраги, подвалы, первые этажи зданий,
стелется по полу.
. Плотность: 3,214 г/л
. Показатели токсичности: (класс опасности): По степени
воздействия на организм человека, хлор относится к высокоопасным веществам. То
есть ко 2 классу опасности. Признаки острого отравления. Горький вкус во рту,
головная боль, головокружение, тошнота, рвота, повышение температуры, судороги.
Если отравление произошло через дыхательные органы, наблюдаются обильное
выделение слюны, насморк, кашель, воспаление слизистых оболочек глаз и даже
помутнение роговицы. Кроме того, хлор обладает местным раздражающим действием -
вызывает на коже покраснение, зуд, точечные кровоизлияния.
. ПДК, ПДС и другие: ПДК в воздухе рабочей зоны 1 мг/м³, максимальная разовая концентрация в
атмосферном воздухе населенных мест 0,1 мг/м³, среднесуточная- 0,03 мг/м³.
. Температура плавления, кипения: температура плавления -101,03
°С, температура кипения -34,10 °С.
. Основные показатели пожарной и взрывопожарной опасности:
Теплоемкость (298К,газ) 34,94 (Дж/моль*К)
Критическая температура 144 °С
Критическое давление 76 атм
. Распространенность: В земной коре хлор самый распространенный
галоген. Хлор очень активен - он непосредственно соединяется почти со всеми
элементами периодической системы. Поэтому в природе он встречается только в
виде соединений в составе минералов: галита NaCI, сильвинита KCl · NaCl,
бишофита MgCl2 · 6H2O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 ·
3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и
океанов. На долю хлора приходится 0,025 % от общего числа атомов земной коры, а
человеческий организм содержит 0,25 % ионов хлора по массе.
. Устойчивость и разлагаемость: Хлор непосредственно реагирует
почти со всеми металлами. На свету или при нагревании активно реагирует (иногда
со взрывом) с водородом по радикальному механизму.
. С кислородом хлор образует оксиды в которых он проявляет степень
окисления от +1 до +7. Хлор очень сильный окислитель. Ароматические соединения
замещают атом выдорода на хлор в присутствии катализаторов.
. Растворимость в воде: При растворении в воде хлор дисмутирует,
образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их
соли:
+ H2O → HCl + HClO
.
. Описание методов определения загрязнителя: Определение
содержания хлор-иона в питьевой воде производят: при содержании хлор-иона от 10
мг/дм3 и выше титрованием азотнокислым серебром в присутствии хромовокислого
калия в качестве индикатора; при содержании хлор-иона до 10 мг/дм3 титрованием
азотнокислой ртутью в присутствии индикатора дифенилкарбазона. С целью
определения токсических веществ в воздухе разработаны экспрессные методы,
позволяющие с достаточной точностью определить непосредственно в обследуемом
производственном помещении концентрацию этих веществ. В основе экспрессных
методов в большинстве случаев лежат быстро протекающие реакции с изменением
цвета реагирующих веществ. Силикагелем, пропитанным индикатором, заполняют
стеклянную трубочку и через трубочку пропускают определенный объем исследуемого
воздуха. О количестве вредного вещества в воздухе судят по длине окрашенного
столбика индикаторной трубки, сравнивая его со шкалой.
. Приборы для измерения: Для отбора проб воздуха пользуются
прибором, именуемым универсальным газоанализатором. Также существует
амперометрический метод определения хлора в воде, основанный на том, что при
восстановлении хлора в электрохимическом процессе возникает ток, величина
которого пропорциональна концентрации хлора в растворе.
. Профилактика: Профилактика отравлений хлором заключается в герметизации
оборудования и коммуникаций на соответствующих производствах, строгом надзоре
за наличием и рациональным размещением дегазаторов, исправностью противогазов,
постоянном контроле за концентрацией хлора в воздухе рабочей зоны. Средствами
индивидуальной защиты работающих являются фильтрующие противогазы, защитные
герметичные очки, резиновые перчатки, специальная обувь. Обязательны
предварительный и периодические медосмотры 1 раз в 24 месяца, леч. -проф.
питание, ежедневный прием витаминов А и С.
. Первая помощь: Первая помощь пострадавшим включает в себя: -
промывание глаз, носа, рта 2% раствором питьевой соды; - закапывание в глаза
вазелинового или оливкового масла, а при болях в глазах - по 2-3 капли 0,5%
раствора дикаина; - наложение глазной мази для профилактики инфекции (0,5%
синтомициновая, 10% сульфациловая) или по 2-3 капли 30% альбуцида, 0,1%
раствора сульфата цинка и 1% раствора борной кислоты - 2 раза в день; -
введение гидрокортизона 125 мг в/м, преднизолона 60 мг в/в или в/м. Необходимо
как можно более раннее лечение и госпитализация пострадавших.
. Средства защиты: Средства индивидуальной защиты, фильтрующие
противогазы, защитные герметичные очки, резиновые перчатки, специальная обувь.
. Количество людей подвергшихся воздействию: У пострадавшего
человека в первую очередь поражаются дыхательные пути, поскольку именно они
становятся первыми на пути проникновения хлора в организм. Большое количество
попавшего в организм хлора может привести к очень быстрому летальному исходу по
причине полной блокировки дыхательной функции. Также причиной смерти может
стать химический ожог лёгких. При более слабой степени отравления у
пострадавшего наблюдается боль в груди, глазные рези, сухое покашливание. По
прошествии нескольких часов может наступить отек лёгких. В некоторых случаях
отравления хлором, даже незначительном на первый взгляд, человек может
погибнуть через несколько дней после самого случая отравления из-за необратимых
изменений, произошедших в организме. Основную группу риска составляют люди,
работающие на производстве, связанном с использованием хлора.
. Другие показатели: Хлор относится к важнейшим биогенным
элементам и входит в состав всех живых организмов. У животных и человека, ионы
хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет
оптимальный радиус для проникновения через мембрану клеток. Именно этим
объясняется его совместное участие с ионами натрия и калия в создании
постоянного осмотического давления и регуляции водно-солевого обмена. Под
воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на
нейроны путем снижения потенциала действия. В желудке, ионы хлора создают
благоприятную среду для действия протеолитических ферментов желудочного сока.
3.2 Паспорт ингредиентного загрязнителя
1. Наименование
загрязнителя: Диоксид углерода (двуокись углерода, углекислый газ, оксид
углерода (IV), диоксид углерода, угольный ангидрид, углекислота́) - CO2, бесцветный газ
<#"731588.files/image002.gif"> <#"731588.files/image003.gif"> <http://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Carbon_monoxide_2D.svg>
При
комнатных температурах CO малоактивен, его химическая активность значительно
повышается при нагревании и в растворах (так, в растворах он восстанавливает
соли Au, Pt, Pd и других до металлов уже при комнатной температуре.
3. Происхождение: Получается совместно с водородом, двуокисью
углерода, азотом, метаном и его гомологами, тяжелыми углеводородами и
сероводородом, газификацией твердых топлив, а также при взаимодействии CO2
с раскаленным углем и при конверсии метана в присутствии различных
катализаторов.
. Характер опасности (воздействие на живые объекты-человек,
животные, растения): Угарный газ очень опасен, так как не имеет запаха и
вызывает отравление и даже смерть. Признаками отравления служат головная боль,
головокружение и потеря сознания. Токсическое действие монооксида углерода
основано на том, что он связывается с гемоглобином крови прочнее, чем кислород
(при этом образуется карбоксигемоглобин), таким образом, блокируя процессы транспортировки
кислорода и клеточного дыхания.
При содержании 0,08% СО во вдыхаемом воздухе человек чувствует головную
боль и удушье. При повышении концентрации СО до 0,32% возникает паралич и
потеря сознания (смерть наступает через 30 минут). При концентрации выше 1,2%
сознание теряется после 2-3 вдохов, человек умирает менее чем через 3 минуты.
Симптомы:
· Потеря сознания, судороги, зрачки расширяются, резкий цианоз
(посинение) слизистых оболочек и кожи лица. Смерть обычно наступает на месте
происшествия в результате остановки дыхания и падения сердечной деятельности.
· При меньшей концентрации окиси углерода появляются головная
боль, стук в висках, головокружение, боли в груди, сухой кашель, слезотечение,
тошнота, рвота.
· Возможны
зрительные и слуховые галлюцинации. Отмечаются покраснение кожных покровов,
карминнокрасная окраска слизистых оболочек, тахикардия
<http://ru.wikipedia.org/wiki/%D0%A2%D0%B0%D1%85%D0%B8%D0%BA%D0%B0%D1%80%D0%B4%D0%B8%D1%8F>,
повышение артериального давления.
· В
дальнейшем развиваются сонливость, возможен двигательный паралич
<http://ru.wikipedia.org/wiki/%D0%9F%D0%B0%D1%80%D0%B0%D0%BB%D0%B8%D1%87>
при сохраненном сознании, затем потеря сознания и коматозное состояние с
выраженными клонико-тоническими судорогами, непроизвольным отхождением мочи и
кала.
· Зрачки
резко расширены с ослабленной реакцией на свет.
· Нарастает
нарушение дыхания, которое становится непрерывным, иногда типа Чейна-Стокса
<http://ru.wikipedia.org/wiki/%D0%94%D1%8B%D1%85%D0%B0%D0%BD%D0%B8%D0%B5_%D0%A7%D0%B5%D0%B9%D0%BD%D0%B0_%E2%80%94_%D0%A1%D1%82%D0%BE%D0%BA%D1%81%D0%B0>.
· При
выходе из коматозного состояния характерно появление резкого двигательного
возбуждения. Возможно повторное развитие комы.
6. Органолептические свойства: Монооксид углерода представляет собой
бесцветный газ без вкуса и запаха. Так называемый «запах угарного газа» на
самом деле представляет собой запах органических примесей.
7. Плотность: 0,00125 (при 0°C) г/см³.
. ПДК, ПДС и другие: Предельно допустимая концентрация монооксида
углерода в воздухе промышленных предприятий составляет 0,02 мг/л. Концентрация
более 0,1 %. В выхлопе бензинового автомобиля допускается до 1,5-3 %.
9. Температура
плавления, кипения: Температура плавления
<http://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0_%D0%BF%D0%BB%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F>
−205 °C .Температура кипения
<http://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0_%D0%BA%D0%B8%D0%BF%D0%B5%D0%BD%D0%B8%D1%8F>
−191,5 °C.
. Основные
показатели пожарной и взрывопожарной опасности: Чрезвычайно огнеопасен. Смеси
газ/воздух взрывоопасны.
11. Распространенность: Различают природные и антропогенные источники
поступления в атмосферу Земли. В естественных условиях, на поверхности Земли,
CO образуется при неполном анаэробном разложении органических соединений и при
сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид
углерода образуется в почве как биологическим путём (выделение живыми организмами),
так и небиологическим. Экспериментально доказано выделение монооксида углерода
за счёт обычных в почвах фенольных соединений, содержащих группы OCH3
или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
12. Растворимость
в воде: Растворимость
<http://ru.wikipedia.org/wiki/%D0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D1%8C>
в воде 0.0026 г/100 мл.
13. Профилактика:
· Работы
осуществлять в хорошо проветриваемых помещениях
· Проверять открытие заслонок при использовании в домах печей и
каминов
· За качество
сжатого воздуха в аквалангах
<http://ru.wikipedia.org/wiki/%D0%90%D0%BA%D0%B2%D0%B0%D0%BB%D0%B0%D0%BD%D0%B3>
отвечает компрессорщик
<http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BC%D0%BF%D1%80%D0%B5%D1%81%D1%81%D0%BE%D1%80>.
Опасно принимать на эту работу никотино
<http://ru.wikipedia.org/wiki/%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD>-зависимых,
страдающих табакокурением
<http://ru.wikipedia.org/wiki/%D0%A2%D0%B0%D0%B1%D0%B0%D0%BA%D0%BE%D0%BA%D1%83%D1%80%D0%B5%D0%BD%D0%B8%D0%B5>
людей. Курить поблизости от компрессора строго запрещается. Компрессор ни в
коем случае не должен стоять рядом с автомобилями и работающими двигателями
внутреннего сгорания.
14. Первая помощь: Лечение: Необходимо немедленно устранить источник
загрязненного воздуха и обеспечить дыхание чистым кислородом под повышенным
парциальным давлением 2,5-3 атм.
· Убрать пострадавшего из помещения с высоким содержанием
угарного газа (заменить дыхательный аппарат).
· При слабом поверхностном дыхании или его остановке начать
искусственное дыхание.
· Способствуют ликвидации последствий отравления: растирание
тела, прикладывание грелки к ногам, кратковременное вдыхание нашатырного
спирта. Больные с тяжёлым отравлением подлежат госпитализации, так как возможны
осложнения со стороны лёгких и нервной системы в более поздние сроки.
· Для
купирования судорог и психомоторного возбуждения можно применять нейролептики,
например аминазин (1-3 мл 2,5% раствора внутримышечно, предварительно разведя в
5 мл 0,5% стерильного раствора новокаина) или хлоралгидрат в клизме.
Противопоказаны: бемегрид, коразол
<http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%B0%D0%B7%D0%BE%D0%BB>,
аналептическая смесь, камфара, кофеин.
· При нарушении дыхания - по 10 мл 2,4% раствора эуфиллина в
вену повторно.
· При резком цианозе (посинении), в 1-й час после отравления
показано внутривенное введение 5% раствора аскорбиновой кислоты (20-30 мл) с
глюкозой. Внутривенное вливание 5% раствора глюкозы (500 мл) с 2% раствором
новокаина (50 мл), 40% раствор глюкозы в вену капельно (200 мл) с 10 единицами
инсулина под кожу.
15. Средства защиты: CO очень слабо поглощается активированным углём
обычных фильтрующих противогазов, поэтому для защиты от него применяется
специальный фильтрующий элемент (он может также подключаться дополнительно к
основному) - гопкалитовый патрон. Гопкалит представляет собой катализатор,
способствующий окислению CO в CO2 при нормальных температурах.
Недостатком использования гопкалита является то, что при его применении
приходится вдыхать нагретый в результате реакции воздух.
16. Другие показатели: Общий баланс продуцирования небиологического CO
и его окисления микроорганизмами зависит от конкретных экологических условий, в
первую очередь от влажности и значения pH. Например, из аридных почв монооксид
углерода выделяется непосредственно в атмосферу, создавая таким образом
локальные максимумы концентрации этого газа. В атмосфере СО является продуктом
цепочек реакций с участием метана и других углеводородов (в первую очередь,
изопрена). Основным антропогенным источником CO в настоящее время служат
выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при
сгорании углеводородного топлива в двигателях внутреннего сгорания при
недостаточных температурах или плохой настройке системы подачи воздуха
(недостаточно кислорода для окисления CO в CO2.
3.4 Паспорт ингредиентного загрязнителя
. Наименование загрязнителя: NaF - фторид натрия.
. Химическая и структурная формула, химическая активность: NaF,
Na - F
. Происхождение: Получается нейтрализацией технической плавиковой
кислоты содой или спеканием плавикового шпата с содой и кремнеземом с
последующим выщелачиванием водой.Или же непосредственным взаимодействием натрия
и фтора, гидроксида или карбоната натрия с плавиковой кислотой.
. Применение: Применяется в металлургии при извлечении алюминия,
бериллия и некоторых других металлов; в стекольном и. керамическом производства
при изготовлении протеиновых клеев; для фторирования питьевой воды; как
антисептик для древесины и инсектицид. Основное применение имеет натрия фторид
в качестве средства для профилактики кариеса зубов. Назначают в виде таблеток
для приема внутрь и в качестве раствора для полосканий.
. Характер опасности (воздействие на живые объекты - человек,
растение) При увеличении концентрации фторид натрия может вызвать острые и
хронические отравления с поражением жизненно важных органов и систем.
. Попадание на кожу и слизистые оболочки может привести к ожогам.
Фторирование воды происходит посредством добавления в нее фторида натрия,
который является крайне токсичным веществом для организма. В зависимости от
концентрации фтор может оказывать как полезное, так и отрицательное воздействие
на организм человека. Оптимальная концентрация фторида - 1 мг/л (или 0,7 мг/л в
жарком климате). В избыточных концентрациях фториды токсичны, так как они могут
ингибировать (подавлять) активность ферментов, убивать живые клетки. При
концентрации фторида в воде свыше 2 мг/л развивается заболевание - флюороз
зубов.
. Органолептические свойства: бесцветные кристаллы кубической
формы.
. Плотность: 2,766 г/см3
. Показатели токсичности: имеет 2 класс опасности
. ПДК, ПДС, и другие: ПДК в воздухе рабочей зоны 0,2 мг/м³, максимальная разовая концентрация в
атмосферном воздухе населенных мест 0,03 мг/м³, среднесуточная- 0,01 мг/м³. ПДК в = 1,5 мг/л ЛД 50
= 280 мг/м3
. Температура плавления, кипения: Т плавл = 996°С Т кип
= 1770°С
. Основные показатели пожарной и взрывопожарной опасности:
Негорюч, невзрывоопасен.
13. Распространенность:
Встречается в природе в виде минерала
<http://www.xumuk.ru/encyklopedia/2623.html> виллиомита
. Устойчивость
и разлагаемость: Растворяется в воде
<http://www.xumuk.ru/encyklopedia/786.html> (41,5 г/л при 20°С),
безводном HF (30,1 г в 100 г при 11°С); DH0 растворения
<http://www.xumuk.ru/encyklopedia/2/3820.html> для бесконечно
разбавленного водного р-ра 0,943 кДж/моль.
. Описание
методов определения загрязнителя: В настоящее время для определения фторидов в
воде используются твердотельные фторид-селективные электроды, изготовленные из
монокристалла LaF3, легированного EuF3, с внутренним
металлическим контактом. Время отклика фторидного ИСЭ составляет менее 0,5 с
при концентрации фторид-ионов, большей 10-3 М, и менее 3 мин в 10-6
М растворах.
. Профилактика:
Необходимо хранить в герметичном сосуде, в помещении с приточно-вытяжной
вентиляцией. Пользоваться СИЗ (респиратор, очки, перчатки).
. Первая
помощь: Первая помощь - свежий воздух, обмывание пораженных участков кожи.
. Другие
показатели: Производные фтора являются сильными инсектицидами. Взаимодействует
с фторидами <http://www.xumuk.ru/encyklopedia/2/4936.html> и
оксифторидами металлов <http://www.xumuk.ru/encyklopedia/2548.html>
III-VIII гр., Be и Mg, образуя фторометаллаты; с HF и его водными р-рами дает
NaHF2
3.5 Паспорт ингредиентного загрязнителя
1. Наименование загрязнителя: Фторид кальция CaF2 (флюорит, плавиковый шпат)
2. Химическая и структурная формула, химическая активность:
F ─ Ca ─ F
3. Происхождение: В промышленности получают из минерала флюорита. В
лаборатории можно получить непосредственным синтезом из элементов или действуя
плавиковой кислотой на гидроксид или карбонат кальция.
4. Применение: Применяется для изготовления стекла различных видов,
для производства цемента, для синтеза различных фторсодержащих соединений, а
также в металлургии в качестве флюса.
. Характер опасности: Влияет на устойчивость организма к
радиационному поражению и является биокатализатором процессов минерализации,
способствуя связыванию тканями фосфата кальция, использующегося с лечебной
целью при рахите.
. Органолептические свойства: CaF2 - минерал, хрупок,
окрашен в различные цвета: желтый, голубой, фиолетовый, иногда
фиолетово-черный; бесцветные кристаллы редки.
. Плотность: 3,18 г/см3.
. Показатели токсичности: Относится ко 2 классу опасности.
. ПДК, ПДС, и другие: ПДК в воздухе рабочей зоны 2,5 мг/м³, максимальная разовая концентрация в
атмосферном воздухе населенных мест 0,2 мг/м³, среднесуточная- 0,03 мг/м³. ПДК в = 10 мг/л
. Температура плавления, кипения: Тпл=1423°С, Ткип=2500oС.
. Основные показатели пожарной и взрывопожарной опасности:
. Распространенность: Чистый кристаллический дифторид кальция -
вещество очень полезное. Это один из главных металлургических флюсов - веществ,
помогающих отделять металлы от пустой породы. В этом качестве фтористый кальций
используют очень давно, и не случайно одно из названий этого минерала -
плавиковый шпат. Плавиковый - от «плавить». Фтористый кальций вследствие своих
уникальных дисперсионных свойств часто используется в сложных оптических
системах, имеющих апохроматическую аберрационную коррекцию (в основном,
объективы для микроскопов и фотолитографических машин).
. Устойчивость и разлагаемость: Растворим в растворах солей
аммония, мало растворим в кислотах. Растворимость (в г/100 г или
характеристика):
ацетон: не растворим вода: 0,0016 (18°C)
14. Описание методов определения загрязнителя: Пирогидролизный метод
основан на разложении фторида кальция парами воды при Т=1330°C в присутствии
катализатора. Выделившаяся фтористоводородная кислота с избытком пара
увлекается в приемник, где титруется гидроксидом натрия. Титриметрический
комплексонометрический метод основан на осаждении ионов фтора в виде
фторхлорида свинца.
15. Приборы для измерения: Ионометрический комплект “МИКОН-2”- это
специализированный набор приборов, оборудования и методического обеспечения для
измерения концентраций ионов в различных продуктах и средах, в том числе, в
водах различной природы, почвах, тепличных грунтах, растительной, мясной
продукции и др.
. Профилактика: Соблюдение правил техники безопасности, ношение
специальной одежды, регулярные медицинские осмотры, включение в пищевой рацион
кальция, витаминов.
. Первая помощь: промывание глаз водой, при ожогах кожи - орошение
70%-ным спиртом; при ингаляционном отравлении - вдыхание кислорода.
18. Средства защиты: Фильтрующие противогазы с коробками марок В
И M ,изолирующие шланговые противогазы.
Защитные очки, специальные рукавицы, перчатки, покрытые латексом.
19. Другие показатели: Иногда в природе встречаются крупные, весом до
20 кг, абсолютно прозрачные кристаллы этой соли. У них другое минералогическое
название - флюорит. Такие кристаллы представляют чрезвычайную ценность для
оптики, потому что они пропускают ультрафиолетовые и инфракрасные лучи намного
лучше, чем стекло, кварц или вода.
) Наименование отходов
Фторид натрия - NaF
) Наименование и реквизиты предприятия - производителя отхода
Производство магния.
) Количество паспортизуемых отходов
мг/кг
)Перечень опасных свойств отходов
Согласно Базельской конвенции перечень опасных свойств отходов содержит
следующие коды:
Таблица 1 - Коды опасных отходов
|
Код
|
Наименование опасных
отходов
|
|
Н 6.1
|
Токсичное (ядовитое)
вещество
|
|
Н 11
|
Токсичное вещество
(вызывающее затяжные или хронические заболевания)
|
) Происхождение отходов
Таблица 2 - Происхождение отходов
|
Перечень и наименование
исходных материалов, из которых образовались отходы
|
Наименование процесса, в
котором образовались отходы
|
Параметр процесса
|
Значение параметра и
единица его измерения
|
|
Карналит. Бишофит
|
Электролиз с введением в
процесс NaF и CaF2
|
Температура
|
612°С
|
6) Состав отходов и токсичность их компонентов
Токсичность фторидов натрия
|
Наим. комп. отходов
|
Концен-трация СNaF, мг/кг
|
Параметры, на основании
которых определен индекс токсичности компонентов отходов
|
Индекс токсичности,КNaF
|
|
|
Наим. и единица измерения
|
Значение
|
Балл токсичности
|
Обозначение документа
|
|
|
NaF
|
26000
|
1. ПДКм.р., мг/м3
|
0,03
|
|
|
5639.91
|
|
|
2. ПДКВ, мг/л
|
1,5
|
4
|
1
|
|
|
|
3. ПДКс.с. или
ОБУВ, мг/м3
|
0,01
|
2
|
|
|
|
|
4. ПДКр.з., мг/м3
|
0,2
|
2
|
1
|
|
|
|
5. Класс опасности в воде
водоема
|
2
|
2
|
|
|
|
|
6. Класс оп. в атмосф.
воздухе
|
2
|
2
|
7
|
|
|
|
7. Класс опасности в
рабочей зоне
|
2
|
2
|
7
|
|
|
|
8. LD50, мг/кг
|
280
|
3
|
7
|
|
Средний арифметический балл токсичности NaF:
XNaF = (4+2+2+2+2+2+3) / 7 = 2.43
Условная нормативная величина NaF:
WNaF = 1.12 · XСr2 O3 + 1.06
Индекс токсичности NaF:
KNaF = CNaF / WNaF
KNaF = 26000 / 4.61 = 5639.91
Общий индекс токсичности отхода определяют по сумме индексов токсичности
всех компонентов отходов:
KS = K1 + K2 + … + Кn
Но так как отходы содержат один токсичный компонент (NaF), то КS =КNaF. Поскольку КS
= 5639.91, то в соответствии с ГОСТом 30774 - 2001 класс токсичности отходов -
второй.
) Рекомендуемый способ переработки отходов
Захоронение твердых отходов, содержащих токсичные вещества 2 - ого класса
опасности следует осуществлять в котлованах. Альтернативным применением отходов
является использование их в качестве добавок при хромировании.
Коды и возможные способы удаления отходов:
D.1
Захоронение в земле
D.12
Захоронение (захоронение контейнера в шахте и т. д.)
D.15
Хранение в ожидании операции
R.8
Регенерация компонентов, катализаторов.
) Пожаро - и взрывоопасность отходов
По мерам противопожарной защиты данные отходы являются негорючими.
) Коррозионная активность отходов
Отходы не коррозионно активны.
) Реакционная способность отходов
Отходы обладают малой реакционной способностью.
) Необходимые меры предосторожности при обращении с отходами
Удаление отходов должно быть проведено так, чтобы ущерб, наносимый
окружающей среде, был минимальным. К основным требованиям относится тщательная
герметизация аппаратуры. Рабочим необходимо находиться в спецодежде.
) Ограничения по транспортированию отходов
Второй класс токсичности отходов помещается в полиэтиленовые мешки.
Транспортировку следует производить в специально оборудованном транспорте.
Загрузка в транспорт, транспортировка, выгрузка и захоронение отходов должны
осуществляться согласно инструкциям. Все работы должны быть механизированы и
гермитизированы. При транспортировке промышленных отходов не допускается
присутствие посторонних лиц.
4.1 Паспорт опасности основных твердых отходов
) Наименование отходов Фторид кальция- CaF2
) Наименование и реквизиты предприятия - производителя отхода
Производство магния. 3) Количество паспортизуемых отходов
мг/кг 4)Перечень опасных свойств отходов
Согласно Базельской конвенции перечень опасных свойств отходов содержит
следующие коды:
Таблица 3 - Коды опасных отходов
|
Код
|
Наименование опасных
отходов
|
|
Н 6.1
|
Токсичное (ядовитое)
вещество
|
|
Н 11
|
Токсичное вещество
(вызывающее затяжные или хронические заболевания)
|
) Происхождение отходов
Таблица 2 - Происхождение отходов
|
Перечень и наименование исходных
материалов, из которых образовались отходы
|
Наименование процесса, в
котором образовались отходы
|
Параметр процесса
|
Значение параметра и
единица его измерения
|
|
Карналит. Бишофит
|
Эл. с введ. в процесс NaF
и CaF2
|
Температура
|
612°С
|
) Состав отходов и токсичность их компонентов
Таблица - Токсичность фторидов натрия
|
Наим. отходов
|
Концен. СNaF, мг/кг
|
Параметры, на основании
которых определен индекс токсичности компонентов отходов
|
Индекс токсин- ности, КNaF
|
|
|
Наименование и единица
измерения
|
Значение
|
Балл ток.
|
Обоз. документа
|
|
|
CaF2
|
17000
|
1. ПДКм.р., мг/м3
|
0,2
|
|
|
5639.91
|
|
|
2. ПДКВ, мг/л
|
10
|
4
|
1
|
|
|
|
3. ПДКс.с. или
ОБУВ, мг/м3
|
0,03
|
2
|
|
|
|
|
4. ПДКр.з., мг/м3
|
2.5
|
1
|
|
|
|
5. Класс опасности в воде
водоема
|
3
|
3
|
|
|
|
|
6. Класс опасности в
атмосферном воздухе
|
2
|
2
|
7
|
|
|
|
7. Класс опасности в
рабочей зоне
|
2
|
2
|
7
|
|
|
|
8. LD50, мг/кг
|
|
|
|
|
Средний арифметический балл токсичности CaF2:
XCaF2 = (4+2+3+3+2+2) / 6 = 2.67
Условная нормативная величина CaF2:
WCaF2
= 1.12 · XCaF2+ 1.06
WCaF2
= 1.12 · 2.67+ 1.06 = 4.05
Индекс токсичности CaF2:
KCaF2
= CCaF2 / WCaF2
KCaF2
= 17000 / 4.05 = 4197.53
Общий индекс токсичности отхода определяют по сумме индексов токсичности
всех компонентов отходов:
KS = K1 + K2 + … + Кn
Но так как отходы содержат один токсичный компонент (CaF2), то КS =КCaF2.
Поскольку КS = 4197.53,
то в соответствии с ГОСТом 30774 - 2001 класс токсичности отходов - второй.
) Рекомендуемый способ переработки отходов
Захоронение твердых отходов, содержащих токсичные вещества 2 - ого класса
опасности следует осуществлять в котлованах. Альтернативным применением отходов
является использование их в качестве добавок при хромировании.
Коды и возможные способы удаления отходов:
D.1
Захоронение в земле
) Пожаро - и взрывоопасность отходов
По мерам противопожарной защиты данные отходы являются негорючими.
) Коррозионная активность отходов
Выводы
При выполнении курсовой работы была определена номенклатура отходов
производства магния, которые являются основной причиной негативного воздействия
данного производства на среду обитания человека. Были составлены паспорта
загрязнителей отходов и паспорт опасности основных твердых отходов, которые
позволяют получить достоверную информацию обязательного характера, необходимую
для принятия решений любого уровня о порядке обращения с отходами в зависимости
от вида и степени их опасности для здоровья и жизни людей, для обеспечения
требований охраны окружающей среды, а также о необходимых и целесообразных
способах их использования и обезвреживания.
В условиях дефицита магния также актуальной является задача более
рационального использования имеющихся ресурсов металла, сокращение потерь его
на всех этапах переработки и использования. Например, более эффективно может
быть использован вторичный магниевый сплав типа МА9С6 для легирования алюминиевых
сплавов взамен первичного металла. Предпочтительнее выглядит и прямое
использование отходов из магниевых сплавов в виде брикетов стружки взамен
чушкового металла, например, для десульфурации или модифицирования чугуна,
производстве модификаторов типа железо-кремний-магний. Использование магния в
аппаратах космической и авиационной техники, автомобилестроении, различных
агрегатах и ответственных приборах предъявляя особые требования к технологии
производства литья из магниевых сплавов. Потребность народного хозяйства в
магнии и магниевых сплавах значительно превышает возможность их производства.
Это ставит перед металлургами, технологами и разработчиками новые проблемы
повышения качества литья, использования лома и стружки, создание безотходных и
малоотходных технологий производства. Обостряются вопросы экологии.
Литература
1. Вредные
вещества в промышленности т 1,2. Справочник/Под ред. В.Н.
Лазарева.-М.:Химия,1976(77).
2. Кирюшкин
А.А., Капитоненко З.В., Петров С.И. Определение номенклатуры отходов промышленного
производства, составление паспортов загрязнителей и опасности отходов:
Методические оказания к курсовой работе. СПб.: СПбГТИ (ТУ), 2003.
3. Справочник
химика,т.2.М.:Химия,1966.
4. ГОСТ
12.1.005-88 ССБТ Общие санитарно-гигиенические требования к воздуху рабочей
зоны.
. ГОСТ
30774-2001 Паспорт опасности отходов.
6. Беспамятнов
Г.П., Кротов Ю.А. Предельно допустимые концентрации химических веществ в
окружающей среде.- Л.:Химия, 1985-528с
ено
н