Кислотно-основное титрование (нейтрализация)
Балтийский
Федеральный Университет им. И.Канта
Реферат
Дисциплина:
аналитическая химия
на тему:
Кислотно-основное титрование (нейтрализация)
Калининград
2011
Содержание
Введение
Кислотно-основное титрование
(нейтрализация)
Заключение
Список использованных источников
Введение
Титриметрический или объемный метод анализа
является одним из методов количественного анализа. В основе этого метода лежит
точное измерение объемов растворов двух веществ, реагирующих между собой.
Количественное определение с помощью титриметрического метода анализа
выполняется довольно быстро, что позволяет проводить несколько параллельных
определений и получать более точное среднее арифметическое.
Итак, титриметрический анализ
(титрование) - методы количественного анализа
<#"731535.files/image001.gif"> или 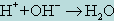
В зависимости от титранта различают
ацидиметрическое и алкалиметрическое титрование. В методе ацидиметрии в
качестве титрантов применяют сильные кислоты. Этим методом определяют сильные и
слабые основания, соли слабых кислот и органических соединений, обладающих
основными свойствами. В методе алкалиметрического титрования в качестве
титрантов применяют сильные основания. Методом алкалиметрии определяют сильные
и слабые кислоты, соли слабых оснований и органических соединений, обладающих
кислыми свойствами.
Основными рабочими растворами в методе
кислотно-основного титрования являются растворы сильных кислот или щелочей.
Чаще всего кислоты HCl и H2SO4 и растворы щелочей NaOH и KOH. Так как эти
вещества не удовлетворяют требованиям, предъявляемым к стандартным веществам,
из них готовят растворы приблизительной концентрации, которые затем
стандартизируют.
В качестве стандартных веществ при установке
точной концентрации кислот используют тетраборат натрия (буру) Na2B4O710H2O или
безводный карбонат натрия Na2CO3. Для установки титра щелочей используют
щавелевую кислоту H2C2O4 · 2H2O, янтарную кислоту H2C4H4O4, бензойную кислоту
C6H5COOH и др.
В реакциях нейтрализации при титровании
происходит постепенное изменение концентрации ионов водорода, а следовательно и
рН раствора. Так как реакция нейтрализации не сопровождается каким-либо внешним
эффектом, точку эквивалентности определяют по изменению окраски индикатора,
который добавляют в титруемый раствор.
Затем по количеству израсходованного рабочего
раствора и его нормальности можно вычислить содержание определяемого соединения
в исследуемом растворе.
Кислотно-основные индикаторы - это довольно
сложные органические вещества, слабые электролиты, обладающие кислотными или
основными свойствами, у которых цвет недиссоциированных молекул отличается от
цвета образуемых ими ионов. Существуют также и индикаторы, которые не являются
ни кислотами, ни основаниями. Наиболее широко используются в анализе: метиловый
оранжевый, фенолфталеин, лакмус, метиловый красный, тимолфталеин, бромтимоловый
синий. Существуют одноцветные (фенолфталеин) и двухцветные (метиловый
оранжевый, лакмус) индикаторы.
Индикаторы, обладающие свойством присоединять
протоны, называют основными индикаторами (IndOH). Такие индикаторы диссоциируют
по схеме
Индикаторы, обладающие свойством отдавать
протоны, называют кислотными индикаторами (HInd). Если упрощенно обозначить
молекулы фенолфталеина через HInd, а анионы его - через Ind-, то можно записать
следующее уравнение:
HInd  H+
+ Ind
H+
+ Ind
Бесцветная - малиновая
Достаточно к раствору, содержащему фенолфталеин,
прибавить немного щелочи, как введенные ОН--ионы станут связывать Н+-ионы с
образованием малодиссоциирующих молекул Н2О. Равновесие диссоциации индикатора
сместится вправо, и накопление анионов Ind - вызовет окрашивание раствора в
малиновый цвет. Наоборот, если к раствору фенолфталеина прилить несколько
капель кислоты, то будет подавляться диссоциация молекул индикатора. Равновесие
сместится влево, и раствор обесцветится.
Для объяснения изменения окраски индикаторов
имеется несколько теорий, например теория Оствальда и хромофорныя теория.
Теория Оствальда была предложена в 1891 г.
Согласно этой теории, каждый рН-индикатор должен диссоциировать как слабая
кислота или слабое основание;кроме того, один из ионов, образующихся при
диссоциации индикатора, должен быть окрашенным, причем его окраска должна быть
другая, чем окраска недиссоциированной молекулы.
Согласно хромофорной теории молекулы
кислотно-основных индикаторов содержат так называемые хромофоры (носители
цветности), т. е. особые группы атомов с сопряженными двойными связями и
неподеленными парами электронов. К хромофорным группам относятся азогруппа ―
N = N―
, нитрозогруппа
―
N = О, нитрогруппа,
хинойдная группировка.

При изменении рН раствора или при диссоциации
хромофоры могут перегруппировываться. Перемена окраски у индикаторов -
результат изменений в их внутреннем строении. У одноцветных индикаторов это
связано с появлением или исчезновением хромофоров. У двухцветных индикаторов
эти изменения обусловлены превращением одних хромофоров в другие, имеющих
различную окраску. Этот процесс называется таутомерией.
Переход из одной таутомерной формы в другую
происходит под действием ионов Н+> и ОН-, поскольку одна из форм индикатора
является слабой органической кислотой или слабым органическим основанием. На
окраску индикаторов влияет также присутствие в соединениях других группировок,
называемых ауксохромами. К ним относятся группы -OH, -NH2, -OCH3, -N(CH3)2 и т.
д. Ауксохромы сами не сообщают окраску индикаторам, но обладают свойством
усиливать действие хромофоров, повышать интенсивность вызываемой ими окраски.
Таким образом, в растворах кислотно-основных
индикаторов одновременно происходят как равновесные процессы, обусловленные
диссоциацией молекул, так и равновесные процессы, связанные с
внутримолекулярной группировкой.
Каждый индикатор характеризуется так называемым
интервалом перехода окраски. Интервалом перехода индикатора называют тот
промежуток между двумя значениями рН, в котором происходит изменение его
окраски. Например, изменение окраски фенолфталеина происходит в интервале рН от
8,0 до 10,0; интервал перехода метилового оранжевого находится в пределах рН от
3,1 до 4,4. Внутри этого интервала окраска его постепенно изменяется из розовой
в желтую. Поэтому при титровании одного и того же раствора, но с разными
индикаторами получаются различные результаты. Многие индикаторы меняют окраску
в точке нейтральности, т.е. не при рН 7,0, а в слабокислой или слабощелочной среде.
Значение рН, лежащее внутри интервала перехода
индикатора, при котором практически заканчивают титрование, называют
показателем титрования, или точкой конца титрования этого индикатора.
Показатель титрования - это значение рН, при котором наиболее ярко изменяется
окраска индикатора. Другими словами, показатель титрования это величина рН, до
которой титруют раствор с данным индикатором.
Свойство молекул различных индикаторов
диссоциировать в нейтральной среде характеризуется константами диссоциации. Например,
у метилового оранжевого  , у фенолфталеина
, у фенолфталеина  .
.
Взаимосвязь между константой диссоциации
индикатора и значением рН, где происходит изменение его окраски, можно вывести
из общих соображений диссоциации индикатора для равновесных концентраций:


титрование индикатор кислота
основание
Для того чтобы погрешность титрования была
наименьшей, надо чтобы изменение окраски индикатора происходило как можно ближе
к точке эквивалентности (т. е. конечная точка титрования как можно больше
соответствовала точке эквивалентности).
Неправильный выбор индикатора может исказить
результат анализа. Чтобы этого не произошло, необходимо в каждом определении
представлять, каким образом происходит изменение рН в процессе титрования, в какой
среде лежит точка эквивалентности, как резко изменяется рН вблизи точки
эквивалентности. Эти процессы описывают кривые титрования.
Кривые титрования - это графическое
представление процесса нейтрализации, изображающее изменение рН титруемого
раствора в зависимости от объема добавленного титранта. Вблизи точки
эквивалентности происходит резкое изменение рН раствора, называемое скачком рН.
Скачок рН зависит от концентрации тируемого раствора и титранта, температуры
раствора. При титровании также необходимо учитывать силу кислот и оснований.
В зависимости от относительной силы кислот и
оснований, участвующих в реакции, различают различные случаи титрования, каждый
из которых описывается собственной кривой титрования. При построении кривых
титрования выделяют следующие основные области расчета рН:
a. расчет рН до начала титрования;
b. в
процессе титрования до точки эквивалентности;. в точке эквивалентности;. после
достижения точки эквивалентности.
Ниже
будут рассмотрены четыре типа построения кривых титрования:
.титрование
сильных кислот сильным основанием;
.
титрование слабых кислот сильным основанием;
.
титрование сильных оснований сильными кислотами;
титрование
слабых оснований сильными кислотами.
1. При титровании сильной кислоты сильным
основанием в точке эквивалентности образуется соль, которая не подвергается
гидролизу, поэтому рН раствора в точке эквивалентности совпадает с рН чистой
воды и равен 7. В этом случае точка нейтральности совпадает с точкой
эквивалентности. Скачок титрования сильной кислоты сильным основанием находится
в пределах от 4,3 до 9,7 рН (при концентрации реагирующих веществ 0,1 моль/л).
Поскольку рН в точке эквивалентности равен 7, то в качестве индикатора можно
использовать лакмус (рН лакмуса равно 7).
Для фиксирования точки эквивалентности в данном
случае могут быть также использованы индикаторы: метиловый оранжевый (рТ = 4) и
фенолфталеин (рТ = 9). При титровании интервалы перехода этих индикаторов
попадают в область скачка рН на кривой титрования. Изменение окраски этих
индикаторов происходит при объемах добавленной щелочи (99,9 мл и 100,1 мл),
очень близких к объему, который соответствует точке эквивалентности
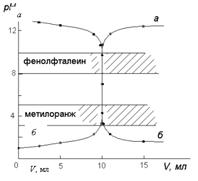
Рис 1. Кривые титрования:
а - кривая титрования 10,0 мл 0,1 М HCl
раствором 0,1 М NaOH;
б - кривая титрования 10,0 мл 0,1 М NaOH
раствором 0,1 М HCl
. При титровании слабой кислоты сильным
основанием вид кривой титрования зависит еще и от константы диссоциации кислоты.
В данном случае точка эквивалентности не совпадает с точкой нейтральности.
Точка эквивалентности смещается в сторону более
высоких значений рН (в щелочную область) из-за гидролиза соли, образующейся в
точке эквивалентности. Скачок титрования уменьшается (7,7 - 10,0) и будет тем
меньше, чем слабее титруемая кислота. При титровании слабой кислоты сильным
основанием из рассмотренных в предыдущем случае индикаторов может быть
использован только фенолфталеин. Кроме того, в данном случае могут быть
использованы и такие индикаторы, как феноловый красный и тимолфталеин.
. При титровании слабого основания сильной
кислотой в точке эквивалентности образуется соль, гидролиз которой протекает по
катиону. Поэтому при титровании раствора аммиака соляной кислотой точка эквивалентности
не совпадает с точкой нейтральности и смещается в кислую область (рН = 5,1). В
этом случае точку эквивалентности можно определить с помощью индикаторов -
метиловый оранжевый, метиловый красный или бромтимоловый синий.
. При титровании слабой кислоты слабым
основанием (и, наоборот) на кривой титрования получается маленький скачок
титрования. Точка эквивалентности приближается к точке нейтральности. Значение
константы равновесия реакции оказывается меньше чем 10 . Поэтому титрование
слабых кислот слабыми основаниями не используют.
Таким образом, с помощью кривых титрования, по
известному скачку титрования и интервалу перехода индикатора, можно подобрать
индикатор, подходящий для данного титрования.
Заключение
Кислотно-основные индикаторы - это сложные
органические вещества, слабые электролиты, обладающие кислотными или основными свойствами,
у которых цвет недиссоциированных молекул отличается от цвета образуемых ими
ионов. Каждый индикатор характеризуется так называемым интервалом перехода
окраски. Интервалом перехода индикатора называют тот промежуток между двумя
значениями рН, в котором происходит изменение его окраски.
Значение рН, лежащее внутри интервала перехода
индикатора, называют показателем титрования, или точкой конца титрования.
Показатель титрования - это значение рН, при котором наиболее ярко изменяется
окраска индикатора.
Для правильного выбора индикатора необходимо
представлять, каким образом происходит изменение рН в процессе титрования, в
какой среде лежит точка эквивалентности, как резко изменяется рН вблизи точки
эквивалентности. Эти процессы описывают кривые титрования. Кривые титрования -
это графическое представление процесса нейтрализации, изображающее изменение рН
титруемого раствора в зависимости от объема добавленного титранта.
В данной работе рассмотрены четыре типа
построения кривых титрования:
.титрование сильных кислот сильным основанием;
. титрование слабых кислот сильным основанием;
. титрование сильных оснований сильными
кислотами;
титрование слабых оснований сильными кислотами.
Список использованных источников
1.
В.П. Зенчик Аналитическая химия. - М.: Медицина, 1971 - 335 с.
.
Е.Н, Калюкова Титриметрические методы анализа: учеб. пособие для студ. нехимич.
специальностей тех. вузов. - Ульяновск: УлГТУ, 2008 - 108 с
.
М.Э. Полеес, И.Н. Душечкина Аналитическая химия. - М.: Медицина, 1987 - 400с.
.
В.Д. Пономарев Аналитическая химия: учебник для фармацевтов и факультетов
мед.ин-тов. - М.: Высшая школа, 1982 - 288 с.
.
Количественный химический анализ URL:
http//kurs.ido.tpu.ru/courses/analyt_chem_1/tema12.htm