|
Показатель
|
Норма
содержания
|
|
Эфирное масло
|
Не менее 0,08%
|
|
Влажность
|
Не более 13%
|
|
Почерневших и
побуревших частей растения
|
Не более 7%
|
|
Кусочков
стеблей и боковых веточек
|
Не более 40%
|
|
Органической
примеси
|
Не более 1%
|
|
Минеральной
примеси
|
Не более 1%
|
|
Содержание частиц,
не проходящих сквозь сито с отверстиями диаметром 7 мм
|
Не более 10%
|
|
Содержание
частиц, проходящих сквозь сито с отверстиями размером 0,5 мм
|
Не более 10%
|
1.6 Характеристика биологически активных веществ
душицы обыкновенной
.6.1 Флавоноиды
Флавоноиды - это наиболее многочисленная группа природных
фенольных соединений, представляют собой производные бензо-γ-пирона. В их основе лежит скелет, состоящий из двух бензольных
колец (А и В), соединенных между собой трехуглеродной цепочкой (пропановый
скелет), т.е. состоящий из С6-С3-С6 углеродных единиц. Они принадлежат к
кислородсодержащим гетероциклическим соединениям [12,13].
Флавоноиды чаще всего представляют собой аморфные или
кристаллические вещества, иногда без запаха или с приятным запахом свежескошенного
сена. Могут иметь горький вкус; температура плавления гликозидов составляет от
100 до 180°С, а агликоны - около 300°.
Гликозиды флавоноидов, а также катехины и лейкоантоцианидины
хорошо растворимы в воде, метаноле, этаноле различной концентрации и нерастворимы
в органических растворителях (ацетон, хлороформ, диэтиловый эфир). Свободные
агликоны, кроме катехинов и лейкоантоцианидинов, практически нерастворимы в
воде, но растворимы в метаноле, этаноле и других органических растворителях.
Все флавоноиды хорошо растворимы в пиридине, диметилформамиде и щелочах.
Оптически активны, способны флуоресцировать в ультрафиолетовом свете, где имеют
характерные УФ-спектры [15,28].
Флавоноиды принимают участие в окислительно-восстановительных
процессах и в процессе фотосинтеза. Совместно с аскорбиновой кислотой участвуют
в энзиматических (ферментативных) процессах окисления и восстановления. В
семенах флавоноиды могут быть ингибиторами прорастания. Растительные пигменты
(антоцианы) - придают яркую окраску цветкам, чем привлекают насекомых и тем
самым способствуют опылению и размножению растений.
Фенольные соединения обуславливают желчегонное,
противовоспалительное, спазмолитическое, противоаллергическое,
сосудорасширяющее, антимикробное действие. Растительные фенолы регулируют
работу желудка и кишечника, относятся к числу наиболее действенных лечебных
средств при язвенной болезни желудка и бронхиальной астме, геморрагическом
синдроме и почечной недостаточности, при болезнях сердца и сосудов, печени и
почек [29].
Фенольные вещества вызывают сужение патологически расширенных
кровеносных сосудов, уплотняют их стенку, уменьшают проницаемость, а значит и
выпотевание жидкости и развитие отеков, ослабляют экссудативную фазу.
Уплотнение биологических мембран (стенок лизосом, клеточных оболочек) уменьшает
выход медиаторов воспаления - гистамина, протеаз.
Капилляроукрепляющее и противовоспалительное действие
флавоноидных препаратов нашло широкое применение при лечении ревматизма,
диабета, гипертонической болезни, токсикозов беременности, нефритов,
бактериальных и вирусных инфекционных заболеваний (в т.ч. скарлатины,
полиомиелита, вирусного гепатита), некоторых кожных заболеваний, обморожений и
ожогов [2].
1.6.2 Кумарины
Кумаринами называется большая группа фенольных соединений, в основе
которых лежит бензо-α-пирон.
В индивидуальном состоянии кумарины представляют собой
аморфные или кристаллические вещества, бесцветные или слегка желтоватые.
Агликоны кумаринов хорошо растворимы в органических растворителях: этиловом
спирте, хлороформе, жирах и жирных маслах; в воде в большинстве случаев
агликоны кумаринов нерастворимы. Кумарины хорошо растворимы в водных растворах
щелочей за счет образования солей оксикоричных кислот. При нагревании до 100° С
возгоняются [1,3].
Кумарины участвуют в регуляции роста растений, являясь
антагонистами ауксинов; поглощают ультрафиолетовые лучи, защищая молодые
растения от чрезмерного солнечного облучения; предохраняют растения от вирусных
заболеваний.
Кумарины характеризуются широким спектром фармакологической
активности: спазмолитическое, капилляроукрепляющее (эскулин, эскулетин),
антикоагуляционное, гемостатическое, фотосенсибилизирующее (псорален,
бергаптен, ксантотоксин), антигрибковое (умбеллиферон, пимпинеллин) [17,26].
Одним из характерных фармакологических свойств производных
кумарина является антикоагулирующее действие, также известны
коронарорасширяющие, β-блокирующие и желчегонные
свойства кумаринов. Многие фурокумарины обладают фотосенсибилизирующей
способностью и спазмолитической активностью. Ряд кумаринов и фурокумаринов
проявляют бактериостатические и антимитозные свойства.
1.6.3 Оксикоричные кислоты (фенолкарбоновые
кислоты)
Оксикоричные кислоты - фенольные
соединения С6-С3-ряда, у которых бензольное кольцо связано с карбоксильной
группой через этиленовую связь.
Оксикоричные кислоты встречаются
практически у всех высших растений. Наиболее широко распространена кофейная
кислота. Она часто образует димеры с алициклическими кислотами - хинной и
шикимовой. Наиболее известны 3-кофеил-хинная кислота (хлорогеновая) и ее
изомеры. Подобные сложные эфиры образуют и др. оксикоричные кислоты. Известны
эфиры оксикоричных кислот с алифатическими кислотами (винной, яблочной,
молочной и др.) и гликозидные формы. Углеводный заместитель в гликозидах
присоединяется через фенольный гидроксил или карбоксильную группу. Известно
много сложных углеводных производных, нередко оксикоричные кислоты входят в
состав белков и полисахаридов [1].
Свободные оксикоричные кислоты
представляют собой чаще бесцветные кристаллические вещества, хорошо растворимые
в этиловом и метиловом спиртах, этилацетате, метилированные производные
растворяются в эфире и хлороформе. Благодаря этиленовой связи оксикоричные
кислоты способны к цис-транс-изомерии. В растениях обычно преобладает трансформа.
Цис- и транс-формы резко отличаются по физиологической активности. Цисформы
оксикоричных кислот стимулируют рост растений, а транс-формы не оказывают
действия или даже подавляют его. Для обнаружения в растениях используют их
свойство флюоресцировать в УФ-свете и реакции, характерные для фенольных
соединений [26].
Биологическая активность большинства
оксикоричных кислот изучена пока недостаточно. Установлено выраженное
желчегонное действие феруловой, кофейной, хлорогеновой кислот и особенно
цинарина (1,4 - дикофеилхинная кислота); п-кумаровой кислоте приписывается
туберкуло-статическое действие, сильными антибактериальными свойствами обладает
кофейная кислота [1,3].
2. Объекты и методы исследования
2.1 Объекты исследования
Объектами исследования служили 3 образца сырья «Душицы
обыкновенной трава» различных производителей:
1. Душицы трава, упак. 50г ЗАО «Здоровье»
2. Душицы, упак. 50 г ОАО «Алтайфарм»
. Душицы трава, упак. 50 г ОАО «Иван-чай»
.2 Методы исследования
.2.1 Макроскопический анализ
Внешние признаки изучали, рассматривая части стеблей,
листьев, цветков невооруженным глазом и с помощью лупы. Цвет определяли на
сухом сырье при дневном освещении; запах - при растирании; вкус - пробуя
кусочек сырья [5].
2.2.2 Методы микроскопических исследований
Микродиагностические признаки сырья устанавливали при
анатомическом исследовании вегетативных органов растений, для чего были
приготовлены плоскостные препараты.
Материал размачивали горячим способом - кипячением в 5%
растворе натрия гидроксида в течение 5 минут, затем сырье промывали водой для
удаления щелочи.
Исследования проводились на микроскопах «Микмед» при
увеличении в 70, 100, 150, 280, 400 и 600 раз на кафедре фармакогнозии и
ботаники НГМУ.
Эфирное масло обнаруживали гистохимической реакцией с использованием
реактива Судан III.
2.2.3 Методы качественного обнаружения
биологически активных веществ
В соответствии с общепринятыми методиками был проведен
сравнительный фитохимический анализ травы душицы обыкновенной на наличие
эфирного масла, полисахаридов, фенолокислот и флавоноидов [7].
Качественные реакции на флавоноиды
Цианидиновая проба. К 1 мл спиртового извлечения добавляли 3
капли концентрированной соляной кислоты и 5-7 мг металлического цинка. Для
ускорения реакции и усиления окраски смесь подогревали 2 -3 минуты на водяной
бане. В присутствии флавоноидов наблюдается оранжевое или розовое окрашивание.
Реакция с раствором основного ацетата свинца. К 0,5 мл
раствора извлечения добавляли 2-3 капли 2% раствора основного ацетата свинца.
Появление аморфного осадка свидетельствует о наличии флавоноидов.
Реакция с алюминия хлоридом. К 0,5 мл раствора спиртового
извлечения добавляли 2-3 капли 5% спиртового раствора алюминия хлорида. В
присутствии флавоноидов появляется желто-зеленое окрашивание.
Качественные реакции на кумарины
Качественные реакции на фенолокислоты
К 1 мл раствора прибавляли 5 капель раствора 10% гидроксида
калия в этиловом спирте и 2-3 капли свежеприготовленного диазореактива
(диазотированная сульфаниловая кислота). В присутствии фенолокислот появляется
красное окрашивание [7].
Качественные реакции на антраценпроизводные
Реакция со щелочью. 0,2г измельченного растительного
материала кипятят в течение 2 минут с 5 мл 10%-ого раствора натрия гидроксида.
После остывания смесь разбавляют 5 мл воды и фильтруют. 3 мл фильтрата помещают
в пробирку, добавляют 3 мл соляной кислоты и 10 мл бензола. Осторожно
перемешивают и после расслоения жидкости сливают бензольный слой, фильтруя его
через небольшой комочек ваты. Фильтрат встряхивают с 3 мл 10%-ого раствора
аммиака.
При наличии антраценпроизводных аммиачный слой принимает
вишнево-красное окрашивание (1,8 - диоксиантрахиноны), пурпурное (1,4 -
диоксиантрахиноны), фиолетовое (1,2 - диоксиантрахиноны) окрашивание [7].
Качественные реакции на сапонины
В одну пробирку приливали 5 мл 0,1 н раствора
хлористоводородной кислоты, в другую - 5 мл 0,1 н раствора гидроксида натрия,
затем добавляли 2 -3 капли извлечения и сильно встряхивали. При наличии
сапонинов появляется стойкая пена.
Качественные реакции на алкалоиды
Общие реакции (реакции осаждения): Для проведения
качественных реакций готовят кислотное извлечение. При добавлении соответствующих
реактивов (Вагнера, Драгендорфа, Марме, раствора танина) через некоторое время
должен появиться осадок. Специфические реакции проводят с индивидуальными
алкалоидами или с очищенной суммой алкалоидов.
Алкалоиды извлекают 1-5% раствором соляной кислоты. Кислотное
извлечение подщелачивают раствором аммиака, затем алкалоиды извлекают
органическим растворителем (хлороформ, дихлорэтан). В качестве специфических
реактивов на алкалоиды используют концентрированную серную и азотную кислоты,
реактив Марки, Фреде и др. [6,7].
2.2.4 Методы исследования количественного
содержания БАВ
Методы получения эфирного масла
Эфирное масло получали методом гидродистилляции [5]. Время
перегонки - 2 часа.
Содержание эфирного масла в объемно-весовых процентах (Х) в
пересчете на абсолютно сухое сырье вычисляли по формуле:
Х = V · 100 · 100 / m · (100 - W), где
- объем эфирного масла в миллилитрах;- масса сырья в
граммах;- потеря в массе при высушивании сырья в процентах.
Определение суммы фенольных соединений методом прямой
спектрофотометрии в водном извлечении
1 г сырья заливали 20 мл воды, нагревали на кипящей водяной
бане 15 мин, охлаждали при комнатной температуре 45 мин, процеживали,
оставшееся сырье отжимали.
В полученном извлечении определяли сумму фенольных соединений
методом прямой спектрофотометрии на СФ-56.
Количественное содержание флавоноидов определяли
спектрофотометрическим методом. Оптическую плотность суммарных извлечений из
сырья замеряли на приборе СФ-56 при длине волны 361 нм (в пересчете на рутин).
Количественное содержание кумаринов определяли
спектрофотометрическим методом. Оптическую плотность суммарных извлечений
измеряли на приборе СФ-56 при длине волны 323 нм (в пересчете на умбеллиферон).
Количественное содержание фенолокислот в сырье определяли
спектрофотометрическим методом. Оптическую плотность суммарных извлечений
замеряли на приборе СФ-56 при длине волны 326 нм (в пересчете на кислоту
хлорогеновую).
Количественное определение дубильных веществ
Около 2 г (точная навеска) измельченного сырья, просеянного
сквозь сито диаметром 3 мм, помещают в коническую колбу вместимостью 500 мл,
заливают 250 мл нагретой до кипения воды и кипятят с обратным холодильником на
электрической плитке с закрытой спиралью в течении 30 мин. Жидкость охлаждают
до комнатной температуры и процеживают около 100 мл в коническую колбу
вместимостью 250 мл через вату. Затем отбирают пипеткой 25 мл полученного
извлечения в другую коническую колбу вместимостью 750 мл, прибавляют 500 мл
воды, 25 мл раствора индигосульфокислоты и титруют при постоянном перемешивании
раствором перманганата калия (0,02 моль/л) до золотисто-желтого окрашивания
[5].
Параллельно проводят контрольный опыт.
мл раствора перманганата калия соответствует 0,004157 г.
дубильных веществ в пересчете на танин.
Содержание дубильных веществ (Х) в процентах в пересчете на
абсолютное сухое сырье вычисляют по формуле:
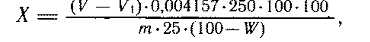
где V - объем раствора перманганата калия (0,02 моль/л),
израсходованного на титрование извлечения, в миллилитрах; V1 - объем раствора
перманганата калия (0,02 моль/л), израсходованного на титрование в контрольном
опыте, в миллилитрах; 0,004157 - количество дубильных веществ, соответствующее
1 мл раствора перманганата калия (0,02 моль/л) в пересчете на танин, в граммах;
m - масса сырья в граммах; W - потеря в массе при высушивании сырья в
процентах; 250 - общий объем извлечения в миллилитрах; 25 - объем извлечения,
взятого на титрования, в миллилитрах.
2.2.5 Товароведческий анализ: методы установления
показателей доброкачественности сырья
Определение числовых показателей проводили по методикам ГФ ХI.
Определение влажности сырья
Точную навеску сырья (1,0), измельченного до частиц размером
3 мм, помещали в предварительно высушенный и взвешенный бюкс и ставили в
нагретый до 105 °С сушильный шкаф. Первое взвешивание проводили через 2 часа
после достижения температурой отметки 105 °С, высушивание проводили до
постоянной массы. Постоянная масса считается достигнутой, если разница между
двумя последующими взвешиваниями после 30 минут высушивания и 30 мин охлаждения
в эксикаторе не превышает 0,01 г. Влажность сырья в процентах вычисляли по
формуле:
Х = (m - m1) · 100 / m, где
- масса сырья до высушивания в граммах;- масса сырья после
высушивания в граммах.
За окончательный результат определения принимали среднее
арифметическое трех параллельных определений.
Определение золы общей
Точную навеску (1,0) измельченного растительного сырья
помещали в предварительно прокаленный и доведенный до постоянной массы
фарфоровый тигель. Тигель нагревали для сгорания сырья при 100 °С, затем
температуру увеличивали до 500 °С. По окончании прокаливания тигель охлаждали в
эксикаторе и взвешивали, прокаливание вели до постоянной массы.
Зольность (в%) вычисляли по формуле:
Х = m1 · 100 · 100 / m · (100 - W), где
m1 - масса сухого остатка в граммах;- масса сырья в граммах;-
потеря в массе при высушивании сырья в процентах.
Ситовой анализ
Для просеивания брали сита с размерами ячеек 7 и 0,5 мм.
Пробу сырья помещали на верхнее сито и просеивали. Затем отдельно взвешивали
сырье, оставшееся на верхнем сите и прошедшее сквозь нижнее сито, и вычисляли
содержание в%, частиц не прошедших сквозь сито с размером ячеек 7 мм и
прошедших сквозь сито с ячейками 0,5 мм.
3. Результаты фармакогностического анализа сырья
«Origani herba»
.1 Анализ маркировки
Был проведен анализ маркировки 3-х образцов сырья аптечного
производства. Исследованы показатели:
Наличие и правильность написания русского и латинского
названия ЛРС;
нормирование влажности;
данные о прохождении радиационного контроля;
срок годности;
описание условий хранения;
состав;
показания к применению ЛРС;
побочные эффекты;
противопоказания.
Результаты исследования приведены в таблице 3.
Таблица 3 Результаты сравнительного анализа маркировки
образцов
|
№ образца /
Показатель
|
Здоровье
|
Алтайфарм
|
Иван-чай
|
|
Русское
название
|
+
|
Душица
|
+
|
|
Латинское
название ЛРС
|
+
|
Origanum
vulgare
|
+
|
+
|
+
|
+
|
|
Лекарственная
форма
|
+
|
-
|
+
|
|
Состав
|
+
|
+
|
+
|
|
Характеристика
|
+
|
-
|
+
|
|
Описание
|
+
|
-
|
+
|
|
Фармакотерапевтическая
группа
|
+
|
-
|
+
|
|
Фармакологическое
действие
|
+
|
-
|
+
|
|
Показания
|
+
|
-
|
+
|
|
Противопоказания
|
+
|
+
|
+
|
|
Способ приема и
дозы
|
+
|
+
|
+
|
|
Побочное
действие
|
+
|
-
|
+
|
|
Форма выпуска
|
+
|
-
|
+
|
|
Условия
хранения
|
+
|
+
|
+
|
|
Срок годности
|
+
|
+
|
+
|
|
Условия отпуска
из аптек
|
+
|
-
|
+
|
|
Серия и
регистрационное удостоверение
|
+
|
-
|
+
|
3.2
Анализ внешних признаков сырья
При анализе внешних признаков сырья было установлено, что
сырье однородное, измельченное, представляет собой смесь листьев, стеблей,
соцветий, а также отдельных цветков, серовато-зеленого цвета с буроватыми вкраплениями,
с сильным ароматным запахом и горьковато-пряным вкусом.
3.3
Микроскопический анализ ЛРС
В результате сравнительного микроскопического анализа
установлено, что все образцы идентичные и подлинные, т.е. по своим признакам
соответствуют требованиям ФС.
В образцах обнаружено:
. клетки эпидермы с извилистыми стенками;
. устьица окружены двумя околоустьичными клетками,
расположенными перпендикулярно устьичной щели (диацитный тип) - рис. 1;
. по жилкам и по краю листья опушены простыми
многоклеточными грубобородавчатыми волосками;
. по всей поверхности имеются мелкие головчатые
волоски, состоящие из короткой одноклеточной ножки и одноклеточной
обратнояйцевидной головки;
3.4 Исследование качественного состава и
количественного содержания БАВ в сырье «Душицы обыкновенной трава»
Исследование качественного состава комплекса БАВ
По результатам проведенного общего фитохимического анализа в
сырье душицы обыкновенной были обнаружены следующие БАВ: эфирное масло,
флавоноиды, кумарины, фенолокислоты, дубильные вещества (табл. 6).
Таблица 6. Результаты общего фитохимического анализа сырья
душицы обыкновенной
|
№ образца /
Группы БАВ
|
1
|
2
|
3
|
|
Эфирное масло
|
+
|
+
|
+
|
|
Флавоноиды
|
+
|
+
|
+
|
|
Дубильные
вещества
|
+
|
+
|
+
|
|
Кумарины
|
+
|
+
|
+
|
|
Фенолокислоты
|
+
|
+
|
+
|
|
Полисахариды
|
+
|
+
|
+
|
|
Антраценпроизводные
|
-
|
-
|
-
|
|
Сапонины
|
-
|
-
|
-
|
|
Алкалоиды
|
-
|
-
|
-
|
3.5 Исследование количественного содержания
комплекса БАВ
.5.1 Анализ количественного содержания эфирных
масел
По требованиям ФС №55 ГФ ХI сырье душицы
обыкновенной стандартизуют по содержанию эфирного масла.
Таблица 7. Содержание эфирного масла в сырье душицы
обыкновенной:
|
№ образца
|
Содержание
эфирного масла, %
|
|
1
|
0,2
|
|
2
|
0
|
|
3
|
0,09
|
|
Требования НД
|
Не менее 0,1%
|
В результате анализа установлено, что эфирное масло
содержится в образцах №1 и 3.
Причем требованиям НД по содержанию эфирного масла
соответствует только образец №1.
Из образца №2 эфирное масло не извлеклось, это может быть
связано с тем, что в образце преобладают стебли, в которых содержится мало
эфирного масла.
3.6 Исследование количественного содержания БАВ в
водных извлечениях из сырья
В домашних условиях потребители фасованного ЛРС готовят чаще
всего, настои по методикам, указанным на упаковке.
Поэтому было проанализировано количественное содержание БАВ в
водных извлечениях из сырья душицы для оценки качества полученного настоя.
3.6.1
Анализ количественного содержания флавоноидов:
Определение содержания суммы флавоноидов в водных извлечениях
из сырья душицы проводилось методом прямой спектрофотометрии в пересчете на
рутин. Установлено, что содержание суммы флавоноидов составляет от 0,94% до
1,43% (табл. 9).
Таблица
9. Содержание суммы флавоноидов в сырье душицы обыкновенной, водное извлечение
|
№ образца
|
Содержание
суммы флавоноидов, в%
|
|
1
|
1,42
|
|
2
|
|
3
|
0,94
|
Максимальное содержание флавоноидов характерно для образцов
№1 и 2 (табл. 9).
3.6.2
Анализ количественного содержания фенолокислот
Количественное содержание суммы фенолокислот в водных
извлечениях из сырья душицы обыкновенной различных производителей было
определено методом прямой спектрофотометрии.
Для расчетов была выбрана преобладающая кислота - хлорогеновая.
Содержание суммы фенолокислот в анализируемых образцах составляет от 0,96% до
1,61% (табл. 10).
Таблица 10. Содержание суммы фенолокислот в сырье душицы
обыкновенной, водное извлечение
|
№ образца
|
Содержание
суммы оксикоричных кислот, в%
|
|
1
|
1,56
|
|
2
|
1,61
|
|
3
|
0,94
|
3.6.3 Анализ количественного содержания кумаринов
Суммарного содержание кумаринов определено методом прямой
спектрофотометрии.
Расчеты проведены в пересчете на преобладающий компонент -
умбеллиферон. Содержание суммы кумаринов в анализируемых образцах составляет от
0,62% до 1,03%.
Содержание суммы кумаринов в сырье душицы обыкновенной,
водное извлечение
|
№ образца
|
Содержание
суммы кумаринов, в%
|
|
1
|
0,99
|
|
2
|
1,03
|
|
3
|
0,62
|
душица сырье фармакогностический аптечный
Максимальное содержание суммы кумаринов характерно для
образца №2, минимальное - для образца сырья №3.
3.6.4
Анализ количественного содержания дубильных веществ
Суммарное содержание дубильных веществ определено методом
перманганатометрического титрования.
Расчеты проведены в пересчете на преобладающий компонент -
танин.
Содержание суммы дубильных веществ в анализируемых образцах
составляет от 10,8% до 19,3%.
Содержание
суммы дубильных веществ в сырье душицы обыкновенной, водное извлечение
|
№ образца
|
Содержание
суммы дубильных веществ, в%
|
|
1
|
19,3
|
|
2
|
10,8
|
|
3
|
17,2
|
Максимальное содержание суммы дубильных веществ характерно
для образца №1, минимальное - для образца сырья №2.
Список
литературы
1. Арзамасцев,
А.П. Фармацевтическая химия - М.: Гэотар-мед, 2004. - 635 с.
2. Барабой,
В.А. Растительные фенолы и здоровье человека. М.: Наука, 1984. С. 34-35, 75-93.
3. Беликов,
В.Г. Фармацевтическая химия - Пятигорск, 2003. - 715 с.
4. Государственный
реестр лекарственных средств, 2012. - Режим доступа:
http://www.drugreg.ru/Bases/default.asp.
. Государственная
Фармакопея СССР. Одиннадцатое издание, вып. 1, М.: Медицина, 1987.
6. Государственная
Фармакопея СССР. Одиннадцатое издание, вып. 2, М.: Медицина, 1987.
. Гринкевич,
Н.И., Софронич, Л.Н. Химический анализ лекарственных растений. М.: Высшая школа,
1983. С. 9 - 133.
. Губанов,
И.А., Киселева, К.В. Иллюстрированный определитель растений Средней России. М.,
Товарищество научных изданий КМК, 2004. Том 3.
. Кондратьева,
Г.К. Методы фармакогностического анализа: Макроскопия и микроскопия (учебное
пособие по фармакогнозии). Владивосток, 2005.
. Котова,
Э.Э., Тихоненко, Н.И. Стандартизация травы душицы по количественному содержанию
флавоноидов. 2011. г.
Харьков.
. Лупинская,
С.М., Орехова, С.В., Васильева, О.Г. Химия растительного сырья. 2010. №3. С. 143-145.
12. Максютина,
Н.П., Литвиненко, В.И., Методы выделения и исследования флавоноидных соединений
// Фенольные соединения и их биологические функции // Материалы 1-го
Всесоюзного симпозиума по фенольным соединениям, состоявшегося 14-17 декабря
1966 г. в Москве, М: «Наука», 1968. С. 7-22.
13. Маргна,
У.В. Взаимосвязь биосинтеза флавоноидов с первичным метаболизмом растений //
Биологическая химия, М., 1990 г., т. 33. С. 9-16, 33-65, 102-105.
14. Машковский,
М.Д. Лекарственные средства. М., 2001. Т. 1,2
. Минаева,
В.Г. Флавоноиды в онтогенезе растений и их практическое использование,
Новосибирск: Наука, 1978. - С. 16-19, 60-62, 70-74.
. Мирович,
Т.А., Коненкина Г.М. Исследования качественного состава эфирного масла душицы
обыкновенной, 2008.с 61-64
17. Муравьева,
Д.А., Самылина, И.А., Яковлев, Г.П. Фармакогнозия. М.: Медицина, 2002. - С.
482-485, 574-578.
. ОСТ
91500.05.001-00. Стандарты качества лекарственных средств. Основные положения.
. Пешкова,
В.А., Мирович, В.М. Флавоноиды Origanum vulgare // Химия природных соединений.
1984. №4. С. 522.
. Соколов,
С.Я., Замотаев, И.П. Справочник по лекарственным растениям, М.: Недра, 1989. -
С. 976.
. Станкявичене,
Н.А., Юкнявичене, Г.К., Маркунас, Г.К. Качественная и количественная
характеристика эфирного масла душицы обыкновенной (Origanum vulgare),
культивируемой в Ботаническом саду АН Литовской ССР // Актуальные вопросы
изучения и использования эфиромасличных растений и эфирных масел. Симферополь,
1980. С. 252-253.
. Туманова,
Е.Л., Кучин, А.В., Пунегов, В.В. Выделение монотерпенов эфирного масла Origanum
vulgare L. методом твердофазной экстракции // Лесохимия и органический синтез.
Сыктывкар, 1998. 57 с.