Современные радиационные технологии в медицине
Реферат
на тему
Современные
радиационные технологии в медицине
Введение
радиационный медицинский диагностика
Жизненный путь
каждого человека в той или иной степени пересекается с областью медицины, но
образ медицинского работника и медицины в целом в последнее время претерпевает
сильные изменения, и происходит это благодаря развитию радиационных технологий
(РТ). Благодаря развитию радиационных технологий медицина приобретает сегодня
совершенно новые черты.
Данная работа
направлена на исследование возможностей современных радиационных технологий в
повышении качества и точности медицинской диагностики.
1. Определение и
разделение радиационных технологий
Радиационные
технологии изучают, разрабатывают и совершенствуют методы, приемы и устройства,
в которых используется ионизирующее излучение. Радиационные методы применяют
при изготовлении или улучшении свойств материалов, предметов потребления,
средств производства и т.п., а также для решения экологических, некоторых
ядерно-технологических и ряда других проблем.
Радиационная
технология подразделяется на радиационно-химическую, радиационно-физическую и
радиационно-биологическую.
Современная
радиационно-химическая технология развивается главным образом в следующих
направлениях:
) Радиационное
модифицирование материалов (преимущественно полимерных);
) Радиационная
полимеризация, в том числе радиационное отверждение и радиационная прививочная
полимеризация;
) Радиационная
деструкция (в основном полимерных материалов);
) Экология
Главным
направлениями радиационно-биологической технологии являются радиационная
стерилизация медицинских изделий и радиационная обработка пищевых продуктов.
К
радиационно-физической технологии относятся радиационное легирование
полупроводников, ионная имплантация, радиационная обработка изделий электронной
техники и т.п.
Однако резкой
границы между рассматриваемыми разделами радиационной технологии не существует.
Общим для этих разделов является радиационное аппаратостроение (конструирование
и строительство источников ионизирующих излучений и радиационных установок).
2. Новый этап
развития радиационных технологий
В настоящее время начинается новый этап развития
радиационных технологий.
Технологическое развитие радиационных технологий
на новом этапе охарактеризуется несколькими принципиальными изменениями, в том
числе комбинированием технологий и внедрением инноваций из смежных сфер.
3. Медицинское
диагностическое оборудование
В зависимости от способа и типа регистрации
излучений все приборы делят на шесть групп:
· медицинские радиометры - для
регистрации относительной радиоактивности в органе или в пробах биологических
сред (радиометрия щитовидной железы, радиометрия гормонов в крови и др.);
· медицинские радиографы - для
регистрации динамики перемещения РФП в организме с представлением информации в
виде кривых (ренография, гепатография, кардиография и др.);
· дозкалибраторы - для измерения
абсолютной величины активности РФП, вводимой пациенту;
· счетчики всего тела - для измерения
общей активности РФП в теле пациента (определение эффективного периода
полураспада нуклида, оценка тканевого этапа йодного обмена и др.)
· скеннеры, профильные скеннеры - для
регистрации распределения РФП в органе или теле больного с представлением
данных в виде рисунка (скеннограм) или кривых (определение участка повышенного
накопления РФП при профильном сканировании);
· сцинтилляционная г -камера,
оснащенная ЭВМ - для регистрации динамики перемещения и распределения РФП с
одновременным получением на дисплее ЭВМ изображения органа и кривых, отражающих
его функцию. По своим функциональным возможностям заменяет радиограф и сканер.
Принципиальная схема устройства всех типов
ядерно-медицинских приборов одинакова и позволяет выделить три части:
. детектор - воспринимающая часть
прибора, обращенная непосредственно к источнику излучения - пациенту, которому
введен РФП. Сцинтилляционный детектор в качестве основных элементов имеет
коллиматор, кристалл йодида натрия (сцинтиллятор), фотоэлектронный умножитель
(ФЭУ). г -кванты РФП, попадая на детектор, вызывают в кристалле образование
световых вспышек (сцинтилляций) низкой интенсивности. Преобразование слабого
светового сигнала в электрический осуществляется ФЭУ;
. электронная схема усиления сигналов от
детектора;
. регистрирующее устройство позволяет
получить информацию на фотобумаге, цифровую или графическую запись на бумаге
или дисплее ЭВМ.
Гамма-камера
Гамма-камера - основной инструмент современной
радионуклидной диагностики. Гамма-камеры предназначены для визуализации и
исследования кинетики радиофармпрепаратов во внутренних органах и
физиологических системах организма пациента с целью ранней диагностики
онкологических, сердечнососудистых и других заболеваний человека. Гамма-камеры
применяются в лабораториях радиоизотопной диагностики городских клинических
больниц, научно-исследовательских медицинских институтов, онкодиспансерах и
других медицинских учреждений.
Помимо диагностических исследований
щитовидной железы, почек, печени и желчного пузыря, головного мозга, легких,
сердца и др., современные гамма-камеры должны обеспечивать сканирование всего
тела пациента (скелета) и компьютерную томографию внутренних органов для
получения трехмерной информации.
Современная гамма-камера содержит
многоканальный коллиматор, кристалл NaI(Tl) с большой площадью поверхности,
световод для оптической связи кристалла с гексагональной матрицей ФЭУ и блока
аналоговых электронных устройств, обеспечивающих определение координат и амплитуд
сигналов. Все указанный компоненты заключены в свинцовый экран достаточной
толщины, чтобы свести к минимуму фон от источников радиации, находящихся вне
поля зрения камеры.
Сцинтилляционные кристаллы.
В большинстве гамма-камер применяются тонкие (толщиной 6 - 12 мм) одиночные
сцинтилляционные кристаллы йодистого натрия, активированного таллием NaI(Tl).
Эти кристаллы большого диаметра (до 50 см) излучаю свет в сине-зелёной области
спектра (вблизи длины волны 415 нм), что согласуется со спектральной характеристикой
стандартных бищелочных ФЭУ. Они характеризуются большим атомным номером и
высокой плотностью, причём их линейный коэффициент поглощения излучения при
энергии 150 кэВ составляет 2,22 см-1. Таким образом в кристалле толщиной около
10 мм поглощается 90% г
-квантов с энергией 150 кэВ. Время высвечивания для кристалла равно 230 нс, что
позволяет достичь скоростей счёта порядка нескольких десятков тысяч отсчётов в
секунду без изменения свойств сцинтиллятора. Кристалл NaI(Tl)
имеет наибольший световой выход из всех наиболее известных неорганических
сцинтилляторов (100) и хорошо пропускает собственное излучение. Несмотря на
гигроскопичность и, следовательно, необходимость герметизации, этот кристалл
практически незаменим при энергиях г
-излучения около 100 кэВ. Разрешение по энергии для тонких кристаллов NaI(Tl)
составляет 10 - 12% при энергии 150 кэВ.
Световод.
Из-за высокого коэффициента преломления кристалла NaI(Tl)
равного 1,85, для оптического сопряжения сцинтиллятора и ФЭУ необходимо
применять световод. Это уменьшает потери света при его прохождении к ФЭУ,
поскольку световоды изготавливают из прозрачной пластмассы с коэффициентом
преломления, близким к 1,85, а его форму тщательно подбирают в соответствии с
конфигурацией фотокатода ФЭУ. Кроме того, применение световода позволяет
уменьшить флуктуации в эффективности съёма света по поверхности сцинтиллятора.
В последнее время вместо световода стали применять микропроцессорную систему
коррекции изображения.
Фотоумножитель. Оптимальной
конфигурацией с точки зрения плотной упаковки фотоумножительных трубок (с
круглым или гексагональным сечением) на поверхности круглого сцинтилляционного
кристалла является гексагональная матрица, состоящая из 7, 19, 37, 61 и т.д.
ФЭУ. Спектральная характеристика фотокатода ФЭУ согласуется со спектром
светового излучения сцинтиллятора путём введения бищелочных материалов (таких,
как SbK2Cs).
Фотоумножительные трубки тщательно подбираются по коэффициенту усиления с тем,
чтобы упростить регулировку ФЭУ для получения однородного распределения
чувствительности по поверхности сцинтиллятора при приложении высокого
напряжения и регулировке усиления ФЭУ
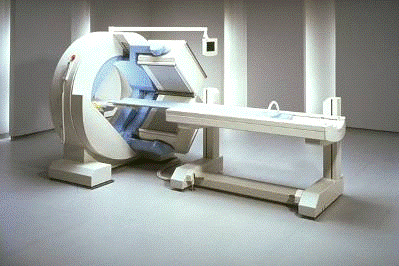
Рис.1 изображение
гамма-камеры
Позитронно-эмиссионная томография (ПЭТ)
Позитронная эмиссия стабилизирует
ядро за счет устранения положительного заряда путем превращения протона в
нейтрон. За счет этого, один элемент превращается в другой, атомное число
последнего на единицу меньше, чем у исходного. Для изотопов, использующихся при
позитронно-эмиссионной томографии, элемент, образующий в результате
позитронного распада является стабильным (не радиоактивным). Все радиоизотопы,
использующиеся в ПЭТ распадаются путем позитронной эмиссии. Позитрон (b+),
испущенный распадающимся ядром, проходит короткое расстояние прежде чем
столкнуться с электроном близлежащего атома.
Позитрон соединяется с электроном
близлежащего атома образуя атом позитрония (В зависимости от взаимного
расположения спинов электрона и позитрона возникают атомы орто- или
парапозитрония. Они живут разное время, но для целей ПЭТ это не существенно,
т.к. распадаются «практически мгновенно». При распаде атома позитрония электрон
и позитрон аннигилируют, преобразуя свою массу два гамма-кванта с энергией 511
КэВ направленных почти на 180 градусов (противоположно) друг от друга. Данные
фотоны с легкостью выходят за пределы тела, в котором находятся и могут
регистрироваться внешними детекторами. Регистрируемые противоположно
направленные гамма-лучи, возникающие в результате раздробления позитрония
называются линией совпадения (каждая линия регистрирует именно те два
гамма-кванта, которые участвовали в акте аннигиляции). Линии совпадения
используются в схеме регистрации для формирования томографических изображений
на позитронном томографе. Эти данные реконструируются с тем, чтобы получить
карту интенсивности радиоактивного распада внутри объекта (реконструкция
пространственного распределения молекулярного зонда). Полученные изображения
анализируются специальными методами с целью выявления аномалий в интенсивности
радиационного поля. Области повышенной (или пониженной) концентрации
позитронного молекулярного зонда свидетельствуют о ненормальном
функционировании органа.
В процессе ПЭТ-исследования
позитрон-эмиттирующий радиоизотоп вводится пациенту внутривенно или путем
ингаляции. После этого, изотоп циркулирует в кровяном русле и достигает,
например ткани головного мозга или сердечной мышцы. Как только происходит
аннигиляция, томограф регистрирует локализацию изотопа и вычисляет его
концентрацию. Линия, которая возникает после аннигиляции, отражает собой
эмиссию двух гамма-лучей, с энергией 511 кэВ направленных приблизительно на 180
градусов (противоположно) друг по отношению к другу. Работа томографа
заключается в том, чтобы регистрировать эти лучи, означающие, что позитронная
аннигиляция произошла где-то на данной линии совпадения.
Когда гамма-лучи с энергией 511 кэВ взаимодействуют
с кристаллами сцинтиллятора сделанными, например из германата висмута они
преобразуются в фотоны света. Процессы конвертации и регистрация происходят
практически мгновенно друг за другом, для того чтобы можно было сравнивать
события сцинтилляции с противоположных детекторов (вдоль большого количества
линий совпадений). Пространственное и временное распределение эмитирующего
позитрон радиоизотопа зависит от того как сканируемый орган реагирует на него
биохимически и физиологически. В данном случае отображаются события позитронной
аннигиляции и происходящие следствие этого эмиссии гамма-лучей. Программное
обеспечение томографа получает данные о событиях совпадения, зарегистрированных
в угловых и линейных положениях, воссоздает пространственно- временную
конфигурацию интенсивности гамма-поля (точнее - дозового поля) вокруг
исследуемого объекта, и выдает информацию в виде изображений (одного или
нескольких, снятых в последовательные моменты времени).
При наличии центров повышенной абсорбции зонда
(очагов поражения) осуществляется локализация таких центров (находятся все три
пространственные координаты очагов), рассчитываются его размеры и форма и
находится концентрация зонда в очаге (в динамических вариантах выдается
зависимость количества зонда в очаге от времени). При наличии нескольких
близкорасположенных очагов, заслоняющих друг друга, предпринимаются специальные
меры по улучшения пространственного разрешения методики.
Использование ПЭТ в клинике накладывает
требования на характеристики и производительность аппаратного обеспечения,
компьютерного оборудования и программного обеспечения цифровой обработки,
которые отличаются от таковых у систем, используемых в исследовательской
деятельности. Разрешающая способность позитронно-эмиссионного томографа должна быть
сбалансирована приемлемым уровнем шума на изображениях и достаточно высокой
пропускной способностью системы. Для большинства используемых сегодня ПЭТ
систем приемлемым является внутреннее разрешение равное приблизительно 6 мм по
всем пространственным направлениям. При таком разрешении после реконструкции
могут быть получены высококачественные изображения с конечным разрешением в
8-10 мм. Такие системы имеют показатель расстояния дискретизации равный 3 мм по
всем пространственным направлениям. Относительно однородное разрешение и
дискретизация делает их пригодными к проведению настоящей трехмерной
визуализации. Это имеет большое значение, к примеру, при проведении
кардиоисследований, где существует необходимость реориентировать данные вдоль
длинной оси. Позитронно-эмиссионная томография (сокращенно ПЭТ) расширила наше
понимание биохимических основ нормальной и патологической работы систем внутри
организма и позволила проводить биохимические исследования пациентам
одновременно с их лечением.
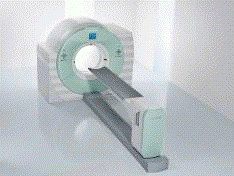
Рис.3 изображение
ПЭТ оборудования
Компьютерная томография (КТ)
Компьютерная томография (КТ) -
это метод послойного исследования внутренней структуры объекта посредством его
многократного просвечивания рентгеновскими лучами в различных пересекающихся
направлениях. С помощью такого исследования можно произвести серию снимков
слоёв тканей тела человека, лежащих на определённой глубине, например, лёгких
или позвоночника, с последующей компьютерной обработкой. Именно компьютерная
обработка изображения позволяет построить не только линейный снимок как на
обычном рентгеновском аппарате, но и объёмную модель органа. Это даёт
возможность диагностировать болезни на ранних стадиях. К примеру, обнаружить
опухоль небольшого размера, которая ещё поддаётся хирургическому лечению.
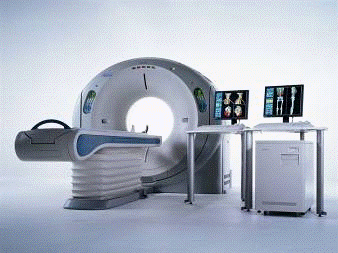
Рис.4 изображения КТ
оборудования
Конвергенция
технологий
Главной
характеристикой нового этапа развития РТ является усиление конвергенции
(взаимопроникновения) технологий, стирание границ между отдельными технологиями
и областями знаний.
Конвергенция с биотехнологиями. Новые средства
доставки изотопов к опухоли, разработанные с использованием современных нано- и
биотехнологий, позволят повысить эффективность радионуклидной терапии и диагностики.
В частности, ведутся клинические испытания новых методов доставки источника
излучения (рения-186) липосомами с поперечным размером 100 нм в опухоль
головного мозга. Из-за малой энергии излучаемых электронов рений не
капсулируют, но низкая энергия частиц позволяет производить практически
точечное облучение, так как глубина проникновения излучения в ткани ничтожно
мала. Благодаря такому подходу опухоль можно подвергать несравненно более
высоким дозам радиации - в двадцать-тридцать раз превышающим сегодняшние
показатели, - не нанося ущерба здоровым тканям мозга. Конвергенция в данном
случае является комплексной (с нано- и биохимическими методами синтеза
относительно радиоустойчивых бионосителей изотопа - липосом);
Конвергенция с технологиями обработки
материалов. Среди наиболее значимых примеров подобной конвергенции -
использование РТ в 3D-печати. Одной из технологий, задействованных в
3D-принтерах, является электронно-лучевое плавление (используется при
производстве цельнометаллических деталей из металлических порошков). С учетом
роста точности доставки дозы в облучаемую мишень и улучшения пространственного
разрешения при диагностике, можно предполагать существенное развитие
соответствующего направления. Косвенное отношение к тренду совмещения различных
технологий в рамках единых комплексов имеет принципиальное изменение подхода к
проектированию заводов, клиник, лабораторий (проектируются не отдельные
установки, а технологические циклы, использующие в качестве фактора тот или
иной вид излучения);
Технологическое
комплексирование (соединение различных методов в рамках одного технологического
комплекса).
В секторе медицинской диагностики пределы
точности определения топографии и метаболизма опухолей и иных патологий по
отдельным системам достигнуты, и последующий рост точности может быть обеспечен
только за счет дополнения и совмещения в одной системе нескольких методов
исследования. Наибольший потенциал лежит в сфере совмещения диагностических РТ
(ПЭТ/КТ, ПЭТ/МРТ, ОФЭКТ/КТ). Исследования по наиболее перспективному
направлению (ПЭТ/МРТ) ведутся с середины первого десятилетия 2000-х годов - в
частности, совместными проектными группами различных корпораций и
исследовательских центров.
Кроме того, в медицинской сфере комплексирование
коснется, в первую очередь, самих процессов терапии и диагностики: в частности,
комплексирование открывает возможности по развитию так называемой тераностики
(совмещения процессов диагностики и терапии, в том числе на уровне одного
фармпрепарата, одновременно являющегося диагностическим и терапевтическим);
Комбинирование РТ-процессов в области
визуализации позволит перейти к оперированию 4D-изображениями, отображающими
как структурные, так и функциональные характеристики исследуемого объекта, в
медицинской диагностике (ПЭТ/МРТ/КТ), системах безопасности (рентген,
нейтронные технологии, магнитные поля регулируемой интенсивности).
Направления в медицине
Терапия. Основное направление, связанное с
повышенной точностью доставки пучка частиц к месту воздействия,- лучевая
терапия с модуляцией интенсивности излучения (IMRT - Intensity modulated
radiotherapy), позволяющая варьировать интенсивность пучка, размер и форму
создаваемого дозового поля в зависимости от локализации, размера и формы
опухоли; данная технология позволяет, с одной стороны, обеспечить равномерное
облучение опухоли (или другой мишени), которая может иметь неправильную форму,
а с другой - минимизировать дозовые нагрузки на окружающие опухоль ткани
(«селективность облучения»), при этом снижается риск последующих осложнений, в
т.ч. онкологических. Яркими примерами систем, использующих комплекс современных
достижений, являются TomoTherapy Hi-Art и Cyberknife CyberKnife VSI (компании Accuray)
или RapidArc
(компании Varian
medical systems);
В сфере медицинской диагностики развитие новых
поколений техники ориентировано на повышение чувствительности систем
регистрации и улучшение качества распознавания образов, обеспечивающих более
высокое пространственное разрешение изображения, снижение дозы облучения
пациентов и повышение скорости проведения процедур. Так, комплексные системы
ПЭТ/КТ, ПЭТ/МРТ, ОФЭКТ/КТ позволяют одновременно визуализировать и
анализировать функциональные и морфологические характеристики тканей и органов.
Кроме того, существенное повышение чувствительности детекторов позволит в
полной мере реализовать потенциал диагностики на клеточном/молекулярном уровне
(molecular imaging);
Развитие в медицине
Расширение зон применения. Новое поколение
оборудования для дистанционной лучевой терапии позволяет вести операции не
только на ранее не операбельных опухолях головного мозга, но и на остальных
органах тела.
Формирование новых направлений в медицине,
связанных с развитием концепции персонализованной медицины (взрывной рост
сложной диагностики и биохимических исследований), превентивной медицины
(необходимость в генетическом анализе с помощью РТ-оборудования), наномедицины.
Лучевая терапия. Совмещение облучения с
диагностикой в режиме реального времени (Image-guided
radiation
therapy). КТ, МРТ или ПЭТ
в этом случае проводится прямо в процессе лучевой терапии, что позволяет
контролировать положение опухоли в тот или иной момент и, соответственно,
обеспечивает высокую точность облучения мишени в каждой процедуре. Лучевая
терапия с модулированной интенсивностью (IMRT Intensity modulated
radiotherapy), обеспечиваемая установками класса
TomoTherapy Hi-Art и
Cyberknife CyberKnife VSI (компании
Accuray) или RapidArc (компании
Varian medical systems). Протонная терапия с применением
компактных ускорителей. Ионная терапия, в т.ч. углеродная. Физические
особенности торможения ионов в веществе позволяют обеспечить большое значение
отношения дозы в зоне опухоли (мишени) к дозе в тканях, находящихся «на пути»
ионного пучка к мишени (оно достигает трех даже в случае формирования
распределенного Брэгговского пика для лечения протяженных новообразований).
Кроме того, рассеяние ионного пучка слабее, чем протонного. Отдельным важным
свойством ионной терапии является фактор скорости: клинические исследования
показывают, что при использовании данной технологии требуется гораздо меньшее
количество процедур по сравнению с традиционными методами лечения, длительность
лечения непродолжительна (появляется возможность амбулаторного лечения).
Нейтронная и нейтрон-захватная терапия, основным преимуществом нейтронной и
нейтрон-захватной терапии является возможность избирательного поражения
опухолей, а также возможность терапии неоперабельных опухолей (глиобластома
мозга). Основным направлением развития РТ-оборудования для нейтрон-захватной и
нейтронной терапии является создание компактных нейтронных источников, в т.ч.
ускорительного типа . Кроме того, в последние десять лет в фармацевтике активно
внедряются новые средства доставки (mAB, пептиды, caged delivery), что делает
возможным создание «адресных» фармпрепаратов на основе бора-10 и,
соответственно, дальнейшее распространение нейтронной и нейтрон-захватной
терапии;
Заключение
На основании рассмотренного
современного состояния радиационных технологий можно сделать выводы, что
радиационные технологии довольно активно внедряются в различные области
медицины, наряду с расширением применения известных процессов, разрабатываются
новые.
Список используемой
литературы
1. А.К.
Пикаев, "Современное состояние радиационной технологии", 1995
. Фонд
«Сколково», Радиационные технологии, 2012
. Научные
публикации