|
Название, торговая марка, лечебное учреждение
|
Минерализация в г/дм3
|
Бальнеологическая разновидность
|
|
Аквадив
|
2,5
|
Хлоридная натриевая
|
|
Берестовская - 1,2,3
|
2,0-6,4
|
Хлоридная кальциево-натриевая
|
|
Берестье
|
1,8-2,0
|
Хлоридная натриевая фторсодержащая
|
|
Брестская, Брестская-5
|
2,6-3,0
|
Хлоридная натриево-кальциевая фторсодержащая
|
|
Василинка
|
3,8
|
Хлоридная натриевая фторсодержащая
|
|
Ганцевчанка
|
3,7-5,2
|
Хлоридная натриевая
|
|
Гомельская-1
|
3,7
|
Хлоридная натриевая
|
|
Дворцовская
|
3,4
|
Хлоридная натриевая фторсодержащая
|
|
Дивичанка
|
2,8
|
Хлоридная кальциево-натриевая
|
|
Дубойская-1
|
4,6
|
Хлоридная натриевая
|
|
Закозельская
|
2,7
|
Хлоридная натриевая
|
|
Ислочь
|
3,9-6,7
|
Хлоридная натриевая
|
|
Ключевая
|
1,0-1,7
|
Хлоридная кальциево-натриевая
|
|
Криничка
|
3,3-3,9
|
Хлоридная натриевая фторсодержащая
|
|
Летцы-2, 3, 4, 5
|
3,8-4,0
|
Хлоридная натриевая
|
|
Нарочанская
|
5,1
|
Хлоридная натриевая фторсодержащая
|
|
Пролеска
|
1,7-3,4
|
Хлоридная натриевая
|
|
Пуша
|
6,1
|
Хлоридная натриевая
|
|
Речицкая - 1, 2
|
3,7-5,8
|
Хлоридная натриевая фторсодержащая
|
|
Свидо - 1, 2, 3
|
2,5-4,5
|
Хлоридная натриевая
|
|
Минская - 2, 3, 4, 5
|
1,4-5,0
|
Хлоридная натриевая
|
|
Льдинка
|
5,6
|
Хлоридная натриево-кальциевая
|
Значительный объем минерального бассейна республики
составляют хлоридные воды и рассолы, они значимо преобладают по сравнению с
сульфатными, хлоридно-сульфатными и сульфатно-хлорными. Железистые воды,
содержащие 20 мг/л железа, сравнительно недавно открыты в зоне Микашевичско-Житковичского
выступа и Припятского прогиба [11].
В зависимости от общей минерализации минеральные питьевые
воды классифицируются на: пресные (минерализация до 1 г на дмі включительно),
слабоминерализованные (минерализация более 1 до 2 г на дмі включительно),
маломинерализованные (минерализация более 2 до 5 г на дмі включительно),
среднеминерализованные (более 5 до 10 г. на дмі включительно),
высокоминерализованные (более 10 до 15 г. на дмі включительно) [7].
Классификация минеральных вод по их применению. В зависимости
от применения воды подразделяют на две группы: для наружного и внутреннего
применения. К питьевым лечебным водам, применяемым по назначению врача, относят
воды с минерализацией от 10 до 15 г./дм3, а при наличии в них
биологически активных компонентов - с минерализацией менее 10 г./дм3[7].
В основу бальнеологической классификации минеральных вод и
рассолов Беларуси положено систематизирование ионно-солевого состава подземных
вод и присущих им лечебных свойств. На территории Беларуси могут быть обнаружены
следующие бальнеологические типы минеральных вод и лечебных рассолы:
. Без специфических компонентов и свойств
. Бромные воды и йодобромные рассолы
. Сульфидные и сероводородные воды и рассолы
. Железистые воды
. Радоновые воды
. Борные воды
. Фторсодержащие
. Селеносодержащие
Минеральные воды и лечебные рассолы без специфических
компонентов состава и свойств. В зависимости от анионного состава
макрокомпонентов выделены три основные группы: гидрокарбонатная, сульфатная и
хлоридная. Кроме того, в гидрогеологическом разрезе территории Беларуси
встречаются группы смешанного состава: хлоридно-гидрокарбонатная,
гидрокарбонатно-хлоридная, хлоридно-сульфатная, сульфатно-хлоридная и другие
[1].
По соотношению катионов преобладают натриевая, кальциево-натриевая,
магниево-кальциево-натриевая, магниево-кальциевая, натриево-магниево-кальциевая
и некоторые другие группы. Бромные и йодобромные минеральные воды и рассолы
включает хлоридную натриевую бромную, хлоридную кальциевую бромную и хлоридную
натриево-кальциевую йодобромную минеральные воды, а также бромные и йодобромные
рассолы. Основным критерием отнесения подземных вод в разряд бромных, йодных
или йодобромных минеральных вод является содержание в них соответственно брома
свыше 25 мг/дмі, йода более 5 мг/дмі, или же концентраций обоих компонентов,
превышающих нижнюю границу лечебного применения. Рассолы с солесодержанием до
100 г./дм3 распространены на западней части Оршанского и
Прибалтийского гидрогеологических бассейнов. Глубина залегания кровли вмещающих
верхнепротезойских или кембрийских пород изменяется от 600 до 1000 и более.
По содержанию фтора в природных водах территория Беларуси
относится к фтородефицитной провинции. В отличие от большинства других
компонентов состава подземных и поверхностных вод для фтора применяется понятие
оптимальной концентрации, что усложняет возможность питьевого использования
фторосодержащих вод. В соответствии со существующим стандартом оптимальныя
концентрация фтора в питьевой пресной или минеральной воде должна быть не более
0,7 мг/дм3. Воды, содержащие в своем составе селен, их ПДК
составляет 0,01 мг/дм3 [1].
1.2
Химический состав природных минеральных вод
Основные закономерности формирования
химического состава природных вод были установлены известным гидрохимиком М.Г.
Валяшко, при этом им были выделены наиболее широко распространенные в литосфере
катиогенные и аниогенные элементы. К катиогенным относятся железо, кальцый,
магний, натрий, калий; к аниогенным - кремний, фосфар, углерод, сера, хлор.
Растворимость различных соединений перечисленных элементов определяет степень
устойчивости их миграционно подвижных форм и способность накапливаться в водных
растворах [2].
В гидрохимии на базе соотношения между
кларками элементов и растворимостью их природных соединений все элементы
делятся на три группы: макро-, мезо-, макрокомпоненты. В зависимости от
соотношения компонентов внутри каждой группы и между группами формируются
различные виды внутренних равновесий природных водных растворов [18].
Макроэлементы, определяют химический тип
воды, её общую минерализацию (сухой остаток) и название по общему химическому
составу. Это Na+ (K+), Ca2+, Mg2+, Cl-, SO42-, HCO3-.
Ион натрия, его кларк в литосфере равен
2,5%, а все соли обладают высокой растворимостью, поэтому миграционные
способности иона натрия весьма большие. Незначительно они ограничиваются тем,
что из растворов натрий-ион выводится реакциями обмена с поглащенными
катионами, а так же тем, что при высокой минерализации вод он может
образовывать ионные пары. Натрий-ион встречается в водах всех диапозонов
концентрации, но особенно характерен для растворов с минерализацией 10 г./л и
более. В природные воды ион натрия поступает за счет растворения залежей солей
рассеянных в породах хлоридов, гидролитического расщепления алюмосиликатов,
реакций катионного обмена [9].
Ион калия, его кларк в литосфере равен
2,54%. С главными анионами природных вод калий, как и натрий, образует
легкорастворимые соединения, однако он значительно менее распространен в
природе. Содержание калий-иона в природных водах обычно составляет около 4-10%
от содержания натрий-иона, максимальная концентрация редко бывает больше 4-5
г./л. Объясняется тем, что калий биологически активен, вследствие чего
энергично извлекается из растворов животными и растительными организмами, а
кроме того, он интенсивнее, чем натрий, поглощается горными породами.
Источником калия в водах является главным образом галогенные отложения,
калиевые полевые шпаты, различные селикатные минералы и горные породы [14].
Ион кальция. Среди щелочных и
щелочноземельных металлов кальций обладает наивысшим кларком (2,96%). Его
хлорид является наиболее растворимой солью. Кальций широко распространен в
различных горных породах. Особенностью иона кальция является то, что он
биологически активен, в результате чего хорошо поглощается живым веществом,
играя заметную роль в его составе, однако после смерти животных и растений
переходит в минеральную форму и вновь поступает в почвы и породы, а из них - в
природные воды. Источником кальция в природных водах служат карбонатные горные
породы, гипсы, ангидриты, кальциевые силикаты, а так же реакции катионного
обмена [13].
Ион магния. По своим свойствам магний
близок к кальцию, его кларк (1,87%), но миграция его в природных водах
протекает совсем иначе. Не смотря на то, что биологическая активность Mg2+ ниже, чем Ca2+, поглащение почвами и
породами слабее, а растворимость сульфатов и карбонатов магния выше, чем
кальция, в химическом составе природных вод магний играет резко подчиненную
роль, почти не встречаются воды в которых магний был бы преобладающим катионом.
Объясняется это тем, что магний:
. участвует в образовании большого
количества вторичных минералов;
. обладает биологической активностью, т.е.
участвует в процессах фотосинтеза, в результате чего он хорошо усваивается
растениями
. имеет высокую ёмкость поглощения,
благодаря чему легко покидает раствор, будучи поглощенным почвами и породами;
. образует ионные пары, комплексные ионы;
. обладая положительной гидратацией, не
накапливается в областях высоких давлений, поэтому миграция его на больших
глубинах затруднена.
Источником магния служат главным образом
доломиты, мергели и коры выветривания основных и ультраосновных пород [20].
Хлорид ион. Не смотря на то, что кларк
хлора составляет всего 0,04% ион хлора имеет исключительно большую миграционную
подвижность, поскольку высокая растворимость солей этого элемента с лихвой
компенсирует недостаток распространенности хлора. В природных водах он хорошо
накапливается. Хлор не образует труднорастворимых соединений с главными
катионами, не адсорбируется почвами и породами, не накапливаются живыми
организмами и не связываются в ионные пары при увеличении концентрации
растворов вплоть до крепких рассолов (ионные пары снижают концентрацию
свободных ионов и не определяются аналитически). Обладают отрицательной
гидратацией. Источником хлора служат отложения галита, коры выветривания
магматических пород, различные виды антропогенных отходов, вулканические
выбросы.
Сульфатный ион. Обладает хорошей
миграционной способностью, так как коллоиды почв и пород его почти не
поглощают, поглощается живым веществом, так как содержит серу, входящую в
состав белка и иных органических соединений и образует слаборастворимые
соединения с кальцием и другими катионами. Главным источником сульфат- иона в
водах служат отложения гипса и ангидрита, а также процессы окисления сульфидов,
самородной серы и H2S. Кроме того он образуется при извержении вулканов и выделяется из
промышленных и бытовых отходов.
Гидрокарбонатный и карбонатный ионы.
Источниками их в природных водах служат различные карбонатные отложения:
известняки, доломиты, мергели, карбонатный цемент осадочных пород, а также коры
выветривания изверженных пород, магматические процессы.
Мезокомпоненты или второстепенные
компоненты, природных вод являются продуктами растворения веществ, которые либо
плохо растворимы, но основной химический элемент их имеет высокий кларк, либо
наоборот. К мезокомпонентам относят железо, кремний, алюминий, фосфор,
некоторые соединения азота [9].
Кремний, это очень распространенный на
нашей планете элемент, его кларк равен 27,6%, встречается обычно в виде
дуоксида, называемого так же кремнекислотой и входящего в состав кварца или
алюмосиликатов и силикатов, на долю которых приходится 87% литосферы.
Железо - самый распространенный после
алюминия метал в земной коре. Основная масса железа заключена в горных породах
в двухвалентной форме, обычно в изомерной смеси с магнием и элементами
семейства железа. Его кларк составляет 4,65%. В природные воды железо поступает
главным образом в результате различных видов окисления сульфидных руд и
химического выветривания ферро- и феррисиликатов. Оно мигрирует в воде в форме
ионов, молекул, коллоидов и взвесей.
Азот, весьма широко распространенный на
нашей планете элемент, кларк которого в атмосфере Земли составляет 76,6%, в
литосфере - 0,04%. Азот в водах может присутствовать в виде растворенного газа
- свободных малекул N2, растворенного газообразного NH3, ионов неорганических
соединений: NH4+, NO2- и NO3-.
Алюминий, будучи широко распространенным
элементом, кларк которого составляет 8,80% алюминий в свободном состоянии в
природе не встречается. Характерной его чертой является постоянная валентность,
а по миграционным способностям он может считаться аналогом окисного железа. Растворимость
минералов и соединений алюминия ничтожно мала; величина pH растворов, при которой
начинается выпадение его гидроксида низка. Основным источником алюминия в водах
являются коры выветривания различных алюмисиликатов, а также продукты
производственной деятельности человека.
К микроэлементам природных вод относятся
те химические элементы, которые встречаются в очень незначительных
концентрациях. Это самая большая группа компонентов химического состава вод ибо
в природе нет абсолютно нерастворимых веществ. Однако весьма малая
распространенность этих элементов, а часто и низкие величины растворимости их
соединений предопределяют столь незначительное их присутствие в водах. Условно
микроэлементы природных водных растворов можно подразделить на 5 групп:
. Типичные катионы - Li+, Rb+, Cs+, Be2+, Sr2+, Ba2+ и др.
. Ионы тяжелых
. Металлов - Cu2+, Ag+, Au+, Pb2+, Ni2+, Co2+ и др.
. Атмосферные комплексообразователи
- Cr, Mo, V, Mn.
. Типичные анионы - Br-, I-, F-, B3-
. Радиоактивные элементы - U, Ra, Rn и др. [9]
Литий. Этот химически активный рассеянный
элемент, кларк которого составляет 6,5 * 10-3% образует множество
соединений с кислородом, галойдами, фосфором, серой и другими элементами, как
правило, достаточно хорошо растворимыми в воде. Источником лития в природных
водах служат кислые изверженные породы.
Медь. Это сравнительно мало
распростваненный в природе элемент, кларк которого равен 4,7 * 10-3%,
встречается в самородном состоянии и в виде кислородных и сульфидных минералов.
Источником меди в водах Земли служат ее естественные минералы (главным образом
сернистые, а так же силикаты, карбонаты, оксиды).
Марганец. Этот элемент достаточно широко
распространен в литосфере, его кларк равен 0,1%. Входит в состав большого числа
минералов, главным образом оксидов, гидроксидов и карбонатов. Источником
марганца могут быть отходы антропогенной деятельности - сточные воды
марганцевых обогатительных фабрик, металлургических заводов, а так же шахтных
вод.
Главными компонентами минеральной воды
являются семь главных ионов: катионы натрия (Na+), кальция (Са2+),
магния (Mg2+) и калия (К+) и анионы хлора (Сl-),
сульфат анионы (SO42-) и гидрокарбонат анионы (НСО3-).
Ионы хлора придают воде солёный вкус, сульфат-анионы, ионы кальция и магния -
горький. Также ионы кальция и магния выполняют немаловажную функцию - этими
ионами определяется коэффициент жесткости воды. Но кроме этих ионов в воде в
разных количествах есть практически все элементы таблицы Менделеева. Наиболее
часто в минеральных водах встречаются такие компоненты, как железо, йод, фтор,
кобальт, медь, молибден, бром, марганец, литий, мышьяк и стронций.
Также помимо минеральных веществ в воде содержатся газы и органические вещества
(остатки). Кислорода в них содержится меньше, чем в обычных водах, но больше
углекислого газа. Кроме атмосферных газов, минеральная подземная вода содержит
газы подземного происхождения например, радон (Rn). Состав и концентрация газов
и органических веществ в воде зависит от различных физических воздействий на
воды и места её происхождения. Некоторые воды содержат в себе
сероводород (H2S) - продукт жизнедеятельности бактерий. Стабилизацию
химического состава минеральных вод обеспечивает углекислый газ (СО2)
[6].
Минеральные воды содержат те же вещества, которые
присутствуют в организме человека, и их целебное действие заключается в
восполнении нарушенного равновесия. Химический состав минеральных вод точно
известен, и его можно воспроизвести в лабораторных условиях, однако добиться
такого лечебного действия, которое оказывают природные минеральные воды,
сформированные благодаря вымыванию химических элементов из геологических пород
в течение длительного периода, пока не удается.
Минеральными лечебными водaми называют воды, содержащие в
повышенных концентрациях различные минеральные компоненты или обладающие
какими-либо специфическими физическими свойствами (повышенная температура,
радиоактивность и др.) и благодаря этому способные оказывать на организм
человека лечебное действие.
В зависимости от химического состава и физических свойств
минеральные воды используют в качестве наружного или внутреннего лечебного
средства. В настоящее время выделяют следующие главнейшие особенности состава
минеральных лечебных вод, которые одновременно являются основой для их оценки,
подразделения и обозначения: газовый состав, степень газонасыщенности, ионный
состав, общая минерализация, содержание биологически-активных микрокомпонентов,
температура, радиоактивность, кислотность-щелочность [10].
В сокращенном виде химический состав минеральной воды
выражается бальнеологической формулой (в гидрогеологии она называется формула
Курлова). Она имеет вид псевдодроби, в числителе которой приводится содержание
анионов, а в знаменателе - содержание катионов в эквивалент-процентах. В
формулу химического состава включаются анионы и катионы с концентрацией 20 и
более эквивалент-процентов, но не менее двух каждого. Перед дробью указывают
газовый состав и общую минерализацию, обозначенную буквой М. Далее отмечается
содержание их выше нормы лечебного применения, затем указывается температура
воды и реакция среды.
В качестве примера приведем формулы химического состава
исследуемых вод.
Минеральная вода «Аквадив»
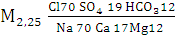 (мі/сут.) (1)
(мі/сут.) (1)
Вода хлоридная натриевая слабопресная.
Минеральная вода «Брестская»
 (мі/сут.) (2)
(мі/сут.) (2)
Вода хлоридная кальциево-натриевая,
слабопрестная.
Минеральная вода «Дарида»
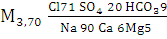 (мі/сут.) (3)
(мі/сут.) (3)
Вода хлоридная натриевая, солёная.
Минеральная вода «Минская - 4»
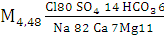 (мі/сут.) (4)
(мі/сут.) (4)
Вода хлоридная натриевая, соленая.
Минеральной воды «Рогачевская»:
 (мі/сут.) (5)
(мі/сут.) (5)
Вода сульфатно-хлоридно кальциево -
натриевая, слабощелочная.
Минеральная вода «Сосны - 1»
 (мі/сут.) (6)
(мі/сут.) (6)
Вода сульфатно - хлоридная магниевая,
соленая.
Минеральная вода «Фрост»
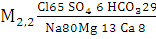 (мі/сут.) (7)
(мі/сут.) (7)
Вода гидрокарбонатно-хлоридная натриевая,
слабопресная.
1.3
Лекарственное значение и больнеологическое использование минеральных вод
История исследования целебных свойств минеральной воды началась
ещё с древних времён. Уже тогда люди лечились минеральными водами, образовывали
водолечебницы. Но даже в те далёкие времена люди не могли и подумать, что все
дело во входящих в воды минеральных компонентов. Каждый компонент минеральной
воды имеет разные и немаловажные воздействия на организм человека. Но действие
минеральной воды на организм также зависит от того, как их применять. Можно
принимать лечебные ванны, но чаще всего воду принимают внутрь.
Принимая ванны, компоненты вод действуют на кожу, возбуждают нервные окончания
и действуют на сердечно-сосдистую, гормонально-ферментативную системы и
механизмы терморегуляции[33].
Питьевые воды раздражают нервные окончания слизистых оболочек
ротовой полости, желудка и двенадцатипёрстной кишки, что изменяет деятельность
пищеварительных желёз. Минеральные воды, содержащие углекислый газ, ионы
гидрокарбоната и хлора, способствуют выделению желудочного сока, если действие
происходит на рецепторы рта и желудка. Действие на рецепторы двенадцатипёрстной
кишки вызывает обратный эффект. Выпитая перед едой минеральная вода стимулирует
выделение желудочного сока, а выпитая за час или больше - тормозит. Минеральные
воды при наружном (ванны, души, ингаляции) и внутреннем (питьё) применении
благотворно воздействуя на нервные окончания и кровеносную систему повышают
реактивность организма, улучшая обменные процессы органов пищеварения,
деятельность желудочно-кишечного тракта и других внутренних органов, убыстряют
выведение вредных компонентов. Одна и та же минеральная вода в виду наличия в
ее составе различных солей, микроэлементов и газов по-разному влияет на
организм человека, оказывая на него благотворное воздействие при различных
заболеваниях. Например, воды, содержащие поваренную соль, т.е. хлориды натрия
благотворно действуют на органы пищеварения; хлориды кальция способствуют
противовоспалительным процессам и положительно влияют на нервную систему;
хлориды магния способствуют расширению кровеносных сосудов.
Сульфатные воды - в основном желчегонные и слабительные.
Присутствие соды в воде понижает кислотность. Однако многие минеральные воды
имеют сложный состав и оказываю на организм человека разнообразное действие.
Например, соляно-щелочные воды представляют собой своеобразное сочетание двух
типов вод, обладающих противоположным физиологическим воздействием. Такие воды
в равной мере полезны при заболевания желудка как с повышенным, так и с
пониженной кислотностью [25].
Терапевтическая активность многих минеральных вод связана с
наличием в их составе микроэлементов - Fe2+, As, Co, I-,
Br-, органических кислот и др. Они входят в состав ряда веществ,
жизненно важных для организма, таких как гемоглобин (Fe2+, Co),
некоторые гормоны (Zn2+), ферменты (Fe2+, Mn, Cu2+
и др.), витамины (Co). Поэтому, например, железистые воды благотворно влияют на
процессы кроветворения так как повышают уровень гемоглобина в крови. Так же
нормализуются функции желудочно-кишечного тракта. По химическому составу
представляют собой хлоридные магниево-кальциево-натриевые воды невысокой
минерализации (4,5 г/дм3), впервые изучены и описаны в зоне
сочленения Припятского прогиба и Микашевичско-Житковичского выступа. Нижний
предел лечебного содержания железа (Fe2++Fe3+) равен 20 мг/дм3. Содержание
двухвалентного железа в миниральной воде 86 мг/дм3, что позволяет
отнести ее к крепким железистым водам. Из других бальнеологически активных
компонентов в воде установлен бром - до 5 мг/дм3.
Йодистые - улучшают работу щитовидной железы и печени.
Бромные воды нормализуют центральную нервную систему. Способствуют устранению
спастических явлений в желудке и кишечнике, путем рефлекторного воздействия
нормализуют функции печени и желчного пузыря, стимулируют работу органов,
участвующих в процессах обмена веществ. Минеральные воды с содержанием брома
выше нижней границы лечебного применения (25 мг/дм3) широко
распространены на территории республики и приурочены в основном к хлоридным
натриевым минеральным водам и рассолам, которые используются в виде ванн в
санаториях и профилакториях «Берестье», «Речицадрев», «Милоград», «Боровка»,
«Васильевка», «Шинник» и других [26].
Бромные воды. При систематическом применении борных вод,
снижают интенсивность окислительных процессов в организме. Обнаружены в Ушацком
районе Витебской области при опробовании гидрогеологических скважин, пробуренных
в ходе государственной геологической съемки. Нижний предел лечебного содержания
ортоборной кислоты - 35 мг/дм3, что даёт основание классифицировать
эти минеральные воды в бальнеологический тип борных вод [1].
Важное бальнеологическое значение имеет газовый состав
минеральных источников. Особенно ценны воды, насыщенные углекислотой,
сероводородом и радоном. Механическое действие минеральных вод связано
с давлением ее массы на тело (ванны, души, купание). Это воздействие можно
усилить растиранием и направлением воды под определенным давлением. Таким
образом, минеральные воды широко используются в народном хозяйстве. В основном
они ценны в бальнеологическом плане, т.к. оказывают на организм человека
лечебное действие всем комплексом растворенных в них веществ. А наличие в них
специфических биологически-активных компонентов (и др.) и особых свойств
определяет часто методы их лечебного использования [25].
Влияние некоторых элементов, содержащихся в природных
минеральных водах на организм человека: Натрий и калий, эти элементы похожи
друг на друга и выполняют похожие функции. Катионы этих элементов помогают
проводить нервные импульсы и активизируют деятельность ферментов. Кальций
содержится в организме человека в виде катионов, известно что ионы кальция входят
в состав костей и зубов и влияют на свёртывание крови. Ионы хлора (Cl-)
способствуют повышению в желудке концентрации соляной кислоты. Поэтому такие
воды прописывают людям с низкой кислотностью в желудке. Гидрокарбонат ионы
благотворно действуют на сердечно-сосудистой систему и желудок. Мышьяк, этот
элемент содержится в водах в составе солей мышьяковистой и ортомышьяковистой
кислот. Воды, содержащие мышьяк обладают специфическими лечебными свойствами.
Их применяют для лечения анемий и при лечениях заболеваний желудочно-кишечного
тракта. Фтор, содержится в составе эмали зубов и предотвращает её от появления
кариеса. При недостатке фтора развивается кариес, а при его избытке начинается
размягчение костной ткани. Фторные воды на территории республики распространены
практически повсеместно. Бром, способствует лечению расстройств нервной
системы. А также заболеваний сосудистой системы. Чем меньше минерализация воды,
тем сильнее воздействие брома на организм. Йод, это вещество необходимо для
нормальной деятельности щитовидной железы, которая вырабатывает гормон
тироксин, влияющий на обмен веществ в организме. Железо, этот элемент входит в
состав гемоглобина крови, поэтому железистые воды применяются при нарушениях
работы кровеносной системы. Сероводород, используется при заболеваниях
сердечнососудистой, нервной и костно-мышечной систем [8].
На поверхность Земли минеральные воды
выходят в виде минеральных источников, а также выводятся из недр по буровым
скважинам. Сооружение, посредством которого обеспечивается вывод минеральных
вод на поверхность, называют каптажем. Он обеспечивает постоянство
физико-химического состава и бальнеологических свойств минеральных вод, ее
устойчивый дебит. Условия забора минеральных вод, их транспортировки и
подготовки к лечебному использованию определяются специальной технологической
схемой эксплуатации месторождения. Для внекурортного использования минеральных
вод, разлитые в бутылки, насыщают углекислым газом до 0,3% по массе (железистые
минеральные воды - до 0,4%) в целях улучшения вкусовых качеств воды и ее
консервации; срок гарантии на минеральные воды в бутылках при правильном
хранении составляет около 1 года [12].
Лечебное действие обусловлено влиянием
всего комплекса их физических свойств и растворенных в них веществ, а также наличием
специфических биологически активных компонентов (мышьяка, углекислого газа,
сероводорода и др.).
В бальнеотерапевтической практике наиболее
широко применяют хлоридные, натриевые, углекислые, сероводородные, радоновые и
другие минеральные воды. На курортах воды применяют наружно (в виде ванн,
купаний в лечебных бассейнах, душей, орошений) и внутрь (питье, ингаляции,
полоскания). В бальнеолечебницах, находящихся в отдалении от месторождений
минеральных вод, ванны, ингаляции, промывания и другие бальнеотерапевтические
процедуры осуществляют с использованием искусственных минеральных вод, которые
готовят из химически чистых солей по аналогии с составом природных минеральных
вод.
При наружном применении (главным образом
ванны) обычно выделяют так называемые период действия и последействия
минеральных вод. Период последействия начинается по выходе из ванны и длится до
5 часов и более. В течение этого времени сохраняется благотворное влияние
процедуры на функции различных органов и систем. В лечебных целях используют
более 400 месторождений минеральных вод. Их эксплуатация и охрана
регламентируются рядом законодательных и нормативных документов, ГОСТ и правил.
В целях так называемой горной и санитарной охраны месторождений минеральных вод
устанавливаются специальные округа, в пределах которых осуществляются
необходимые санитарно-оздоровительные мероприятия и поддерживается определенный
санитарный режим, направленные на сохранение природных факторов. В связи с тем,
что в минеральных вод могут содержаться в повышенных концентрациях вещества,
оказывающие вредное влияние на организм, специальным ГОСТ установлены ПДК этих
веществ. Все минеральные воды, используемые для лечения, должны соответствовать
установленным санитарным требованиям[19].
В целом же следует сказать, что минеральные воды с
успехом применяются в комплексном лечении большинства наиболее распространенных
заболеваний. Использование минеральных вод позволяет активизировать
защитно-адаптационные реакции организма человека, восстановить функциональное
состояние органов пищеварительного тракта, нормализовать деятельность нервной,
эндокринной и иммунной систем, что дает возможность полноценной и деятельной
жизни. Благодаря высокой эффективности, доступности, отсутствию побочных
эффектов, присущих медикаментозной терапии, а также экологической чистоте
использование минеральных вод является необходимым в лечении и профилактике
многих болезней человека [4].
Минеральная вода имеет особое лечебное воздействие на
организм человека. Каждый компонент минеральной воды воздействует на различные
органы человека и способствует улучшению работы органа или его лечению. Поэтому
некоторые воды следует пить только по назначению врача, некоторые воды пить,
соблюдая просто определённые правила, а некоторые использовать только для
лечебных ванн. Для правильного употребления минеральной воды нужно ознакомиться
с её свойствами и областью применения, а главное знать свой организм, чтобы не
навредить своему здоровью, ведь даже у этого целебного напитка есть свои
противопоказания [8].
Благодаря техническим усовершенствованиям, используемым на
заводах по разливу минеральных вод, потери химических элементов практически
исключены, и химический состав, качество минеральной воды в процессе розлива и
транспортировки почти не изменяются. Её насыщают углекислотой, которая
удерживает в растворенном состоянии химические элементы, препятствует развитию
микроорганизмов. В последнее время для этих целей проводится обработка
минеральной воды раствором серебра. Такая вода при правильном хранении (лежачем
положении бутылок в прохладном и темном помещении) сохраняет целебные свойства
неограниченное время [1].
Установлено, что лечебное действие бутылочной минеральной
воды почти не уступает воде, взятой непосредственно из источника. Обычно
минеральную воду пьют три раза в день по 3,3 мл на 1 кг веса в сутки, в течение
24 - 30 дней с последующим перерывом на два-три месяца. Беспорядочный приём
минеральной воды от случая к случаю терапевтического действия не оказывает
[23].
Бальнеологические особенности исследуемых вод
Минеральная вода «Аквадив» по содержанию солей относится к
водам малой минерализации (1,25-3,25 г./дм3). Добывается из минерального
источника прибалтийского артезианского бассейна, богатого целебными хлоридными
натриево-кальциевыми водами с глубины 353 - 366 метров (источник Малиновщина) и
используется в качестве лечебно-столового и питьевого напитка. Рекомендуется
при хронических заболеваниях печени и желчевыводящих путей, болезнях обмена
веществ, для профилактики заболеваний зубов, костных тканей.
Минеральная лечебно-столовая вода «Дарида» является
сульфатно-хлоридной натриевой. Общая минерализация воды составляет 3,6 г/л. эта
жемчужина природы рождается на глубине более 380 метров в результате
растворения минералов, богатых натрием, калием, кальцием, сульфатами,
хлоридами, гидрокарбонатами и массой других микроэлементов.
Рекомендуется при хронических гастритах, хронических колитах и энтероколитах,
хронических заболеваниях печени и желчевыводящих путей,
постхолецистэктомимическом синдроме, хронических панкреатитах, болезнях обмена
веществ (сахарном диабете, подагре, ожирении, мочекислом диатезе, оксалурии,
фосфатурии, хронических заболеваниях мочевыводящих путей, мочекаменной болезни,
заболеваниях полости рта и зубов[34].
«Фрост» являются:
. Натуральная минеральная вода, без искусственной
минерализации, глубина скважины 283 м.
. Добывается в экологически чистом районе Республики Беларусь
- Брестская область, Дрогичинский район, д. Хомск.
. Классический состав, не имеющий противопоказаний: натрий,
калий, магний, кальций, хлориды, сульфаты, гидрокарбонаты.
. Небольшая минерализация: 1,0 - 2,4 г/л.
. Полезные свойства и вкусовые качества воды сохраняются
надолго, даже после открытия бутылки.
. Производится без изменения природного солесодержания.
. Минеральная вода «Фрост» не содержит токсичных для
организма человека химических веществ, безопасна в эпидемиологическом и
радиологическом отношении, по своему составу характерна для артезианских вод
Брестского артезианского бассейна.
. Минеральная вода «Фрост» является продуктом, который
восстанавливает и поддерживает баланс минералов в организме человека и
способствует общему оздоровлению.
Вода минеральная газированная «Фрост» Лечебно-столовая
гидрокарбонатно-хлоридная натриевая фторосодержащая.
Показания по лечебному применению: хронические гастриты с
нормальной, повышенной и пониженной секреторной функциями желудка;
неосложненная язвенная болезнь желудка и двенадцатиперстной кишки; болезни
оперированного желудка по поводу язвенной болезни желудка и двенадцатиперстной
кишки; хронические колиты и энтероколиты; хронические заболевания печени и
желчевыводящих путей; постхолецистэктомический синдром; хронические
панкреатиты; болезни обмена веществ: сахарный диабет, подагра, ожирение,
мочекислый диатез, оксалурия, фосфатурия; хронические заболевания мочевыводящих
путей, мочекаменная болезнь, заболевания полости рта и зубов.
Минеральная вода «Брестская» из собственной скважины глубиной
1280 метров. По химическому составу эта вода аналогична таким видам, как
«Друскининкай» и «Миргородская».
Применяется при хронических гастритах, при язвенной болезни желудка и
12-перстной кишки, при заболеваниях кишечника, печени, желчевыводящих путей и
поджелудочной железы, при болезнях обмена веществ.
Минеральная газированная вода «Минская - 4». Лечебно-столовая
хлоридная натриевая. Минерализация 3,2-4,7 г/дм3.
Рекомендуется в качестве столового напитка и по назначению
врача при хронических гастритах, неосложненной язвенной болезни желудка и
12-перстной кишки, хронических колитов и энтероколитов, хронических заболеваний
мочевыводящих путей, болезнях обмена веществ, хронических заболеваниях печени и
желчевыводящих путей, заболеваниях полости рта и зубов.
Минеральная вода «Рогачевская»
Сульфатно-хлоридно магниевая вода. Хронические гастриты с нормальной,
повышенной и пониженной секреторной функциями желудка: неосложненная язвенная
болезнь желудка и 12-перстной кишки, болезни оперированного желудка по поводу
язвеннной болезни желудка и 12-перстной кишки: хронические колиты и
энтероколиты; хронические заболевания печени и желчевыводящих путей (гепатиты,
холециститы, желчекаменная болезнь), постхолецистэктомический синдром;
хронические панкреатиты; болезни обмена веществ (сахарный диабет, подагра,
ожирение, мочекислый диатез, оксалатурия, фосфатурия); хронические заболевания
мочевыводящих путей, мочекаменная болезнь.
Минеральная вода «Сосны - 1» добывается
из скважины глубиной 382 метра, лечебно-столовая минеральная вода
(минерализация 2,0 - 3,1 г/дм3) рекомендуется для лечебных целей больным
хроническими гастритами с нормальной, повышенной и пониженной секреторной
функцией желудка; хроническими колитами и энтероколитами; хроническими
заболеваниями печени и желчевыводящих путей (гепатиты, холециститы,
желчекаменная болезнь), постхолецистэктомическими синдромами; хроническими
панкреатитами, болезнями обмена веществ.
2.
Методика химического анализа важнейших макрокатионов и анионов в различных
типах природных минерализованных вод
Определение содержания кальция
В коническую колбу емкостью 250 мл пипеткой вносят 25 мл
исследуемой воды, добавляют 75 мл дистиллированной воды и хорошо перемешивают.
К полученому раствору последовательно 2 мл раствора гидроксида натрия с
массовой долей 10%, 1 мл сульфида натрия с массовой долей 2%. После каждого
добавления содержимое колбы перемешивают. Добавляют 10-15 мг мурексида или
флуорексона. Раствор окрашивается в ярко-розовый цвет. Затем титруют 0,01 н
раствором трилона - Б до перехода окраски в лиловую
Содержание кальция вычисляют по формуле:
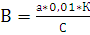 (8)
(8)
Где В-содержание кальция в мг-экв.;
а - количество трилона - Б, пошедшего на титрование;
К - поправка к титру
С - объем исследуемой воды
Содержание магния определяют по разности:
 (9)
(9)
где Д - содержание магния
Определение калия по Пейве
Принцип метода. При взаимодействии калия (в растворе 1,0 н.
Nad) с кобальтнитритом натрия, при концентрации калия больше 16,6 мг/л он
выпадает в осадок (при 20° С) в виде K2Na [Co(N02) 3]. При меньших
концентрациях калия осадок не выпадает. Разбавляя испытуемый раствор, находят
предельную концентрацию, при которой калий в осадок не выпадает, и по ней
определяют его количество в растворе (по таблице)
Ход анализа. 25 мл воды помещают в коническую колбу на
250 мл. В её же приливают 250 мл 1н NaCl и взбалтывают в течении 3 минут. Готовят штатив
с 10 пробирками. А зтем в пробирки наливают по 5, 4, 3, 2, 1,5, 1,25, 1,0, 0,8,
0,6, 0,4 мл раствора и доливают до 5 мл 1 н. раствором хлористого натрия. Мерной
ложечкой прибавляют в каждую пробирку по 0,1г сухого и не дающего осадка с
дистиллированной водой кобальт-нитрита натрия и взбалтывают растворы. Через 30
мин наблюдают на свет за выпадением осадков в пробирках, начиная от наибольшей
концентрации. Отмечают первую пробирку, в которой еще не выпал осадок, т.е. нет
мути. Для определения содержания, пользуются данными приведенными в таблице.
Таблица 4 Содержание K2O, мг/100 мл воды
|
Т
|
Содержание K2O, мг/100 мл воды
|
Номе пробирки и количество, взятого для
определения, пи котором не наблюдается выпадение осадка, мл
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
20
|
20
|
4,0
|
5,0
|
6,7
|
8,0
|
10,0
|
11,1
|
13,3
|
16,7
|
20
|
|
19
|
19
|
3,8
|
4,7
|
6,3
|
7,5
|
9,5
|
10,5
|
12,5
|
15,8
|
19
|
|
18
|
18
|
3,6
|
4,5
|
6,0
|
7,2
|
9,0
|
10,0
|
12,0
|
15,0
|
18
|
Определение гидрокарбонат-анионов
Определение гидрокарбонат-анионов основано на реакции:
НСО3- + Н+ = СО2
+ Н2О
Таким образом, при титровании по фенолфталеину в реакции с
кислотой участвуют анионы ОН- и СО32-, а при
титровании по метиловому оранжевому - ОН-, СО32-
и НСО3-.
При анализе карбонатных природных вод правильность получаемых
результатов зависит от величины потребления кислоты на титрование по
фенолфталеину и метилоранжу. Если титрование в присутствии фенолфталеина обычно
не вызывает трудностей, т.к. происходит изменение окраски от розовой до бесцветной,
то в присутствии метилового оранжевого, при изменении окраски от желтой до
оранжевой, определить момент окончания титрования иногда довольно сложно. Это
может привести к значительной ошибке при определении объема кислоты,
израсходованной на титрование. В этих случаях, для более четкого выявления
момента окончания титрования, определение полезно проводить в присутствии
контрольной пробы, для чего рядом с титруемой пробой помещают такую же порцию
анализируемой воды (во второй склянке), добавляя такое же количество
индикатора.
В результате титрования карбоната и гидрокарбоната, которое
может выполняться как параллельно в разных пробах, так и последовательно в
одной и той же пробе, для расчета значений концентраций необходимо определить
общее количество кислоты в миллилитрах, израсходованной на титрование карбоната
(VK) и гидрокарбоната (VГК). Следует иметь в виду, что
при определении потребления кислоты на титрование по метилоранжу (VМО)
происходит последовательное титрование и карбонатов, и гидрокарбонатов.
По этой причине получаемый объем кислоты VМО
содержит соответствующую долю, обусловленную присутствием в исходной пробе
карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не
характеризует полностью концентрацию гидрокарбонатов в исходной пробе.
Следовательно, при расчете концентраций основных ионных форм, обуславливающих
потребление кислоты, необходимо учесть относительное потребление кислоты при
титровании по фенолфталеину (VФ) и метилоранжу (VМО).
Рассмотрим несколько возможных вариантов, сопоставляя величины VФ и
VМО.
1. VФ = 0. Карбонаты, а также
гидроксо-анионы в пробе отсутствуют, и потребление кислоты при титровании по
метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
2. VФ 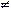 0, причем 2VФ<VМО.
В исходной пробе отсутствуют гидроксо-анионы, но присутствуют и гидрокарбонаты,
и карбонаты, причем доля последних эквивалентно оценивается как VК=2VФ,
а гидрокарбонатов - как VГК = VМО-2VФ.
0, причем 2VФ<VМО.
В исходной пробе отсутствуют гидроксо-анионы, но присутствуют и гидрокарбонаты,
и карбонаты, причем доля последних эквивалентно оценивается как VК=2VФ,
а гидрокарбонатов - как VГК = VМО-2VФ.
. 2VФ = VМО. Гидрокарбонаты в
исходной пробе отсутствуют, и потребление кислоты обусловлено содержанием
практически только карбонатов, которые количественно переходят в
гидрокарбонаты. Именно этим объясняется удвоенное, по сравнению с VФ,
потребление кислоты VМО.
Массовые концентрации анионов (не солей!) рассчитываются на
основании уравнений реакций потребления кислоты карбонатами (СК) и
гидрокарбонатами (СГК) в мг/л по формулам:
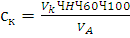 (10)
(10)
 (11)
(11)
где:К и VГК - объем раствора соляной
кислоты, израсходованный на титрование карбоната и гидрокарбоната
соответственно, мл;
Н - точная концентрация титрованного раствора соляной кислоты
(нормальность), моль/л экв.;А - объем пробы воды, взятой для
анализа, мл;
и 61 - эквивалентная масса карбонат- и гидрокарбонат-аниона
соответственно, в соответствующих реакциях;
- коэффициент пересчета единиц измерений.
Определение сульфат-ионов в природных водах
Метод основан на извлечении подвижной серы (сульфатной из
незасоленных раствором 1Н КСl при воды к раствору 1:2,5 с последующим турбидиметрическим
определение её в виде сульфата бария).
Выполнение работы
мл воды переносят в конические колбы на 250 мл и приливают 50
мл 1Н КСl,
перемешивают на мешалке в течении 1 часа. 5-20 мл фильтрата, в зависимости от
содержания SO42-, переносят в мерную колбу на 50 мл. В течении 30 сек.
взбалтывают. Затем фотоколориметрируют на ФЭКе, светофильтр №4, кюветы на 50
мм.
Реактивы
. Приготовление осаждающего реактива: 20г BaCl2*2H2O растворяют в 400 мл
воды, добавляют 10 мл концентрированной HCl, 500 мл глицерина,
доводят дистиллированной водой до 1 л в мерной колбе, хорошо перемешивают.
2.K2SO4
3.KCl 1н. - 74,5 КСL в 1 л H2O
Определение хлоридов
В зависимости от результатов качественного определения
отбирают 100 мл испытуемой воды или меньший ее объем (10-50 мл) и доводят до
100 мл дистиллированной водой. Без разбавления определяются хлориды в
концентрации до 100 мг/л. pН титруемой пробы должен быть в пределах 6-10. Если
вода мутная, ее фильтруют через беззольный фильтр, промытый горячей водой. Если
вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси
алюминия. Для этого к 200 мл пробы добавляют 6 мл суспензии гидроокиси
алюминия, а смесь встряхивают до обесцвечивания жидкости. Отмеренный объем воды
вносят в две конические колбы и прибавляют по 1 мл раствора хромовокислого
калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого
оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При
значительном содержании хлоридов образуется осадок AgCl, мешающий определению.
В этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного
раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу,
пользуясь первой, как контрольной пробой.
Обработка результатов.
Содержание хлор-иона (X), мг/л, вычисляют по формуле
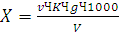 (12)
(12)
где v - количество азотнокислого серебра, израсходованное на
титрование, мл;
К - поправочный коэффициент к титру раствора нитрата серебра;-
количество ионов хлора, соответствующее 1 мл раствора азотнокислого серебра,
мг;- объем пробы, взятый для определения, мл. В таблице №5 и №6 представлены
полученные данные:
Таблица
5. Содержание важнейших анионов в исследуемых образцах
|
№ п/п
|
Название минеральной воды
|
Содержание анионов, мг/л
|
|
|
Cl-
|
SO42-
|
HCO3-
|
|
1
|
Аквадив
|
968
|
965
|
968
|
333
|
330
|
331
|
250
|
250
|
251
|
|
2
|
Брестская
|
1022
|
1024
|
1021
|
3
|
3
|
3
|
93
|
92
|
91
|
|
3
|
Дарида
|
1224
|
1225
|
1225
|
458
|
454
|
456
|
259
|
259
|
258
|
|
4
|
Минская - 4
|
1807
|
1806
|
1807
|
406
|
406
|
407
|
256
|
257
|
256
|
|
5
|
Рогачевская
|
2436
|
2434
|
2438
|
1590
|
1593
|
1590
|
73
|
77
|
76
|
|
6
|
Сосны - 1
|
479
|
474
|
480
|
261
|
268
|
267
|
61
|
59
|
65
|
|
7
|
Фрост
|
683
|
681
|
684
|
90
|
89
|
90
|
555
|
559
|
563
|
Таблица 6. Содержание важнейших катионов в исследуемых
образцах
|
1
|
Аквадив
|
11
|
10
|
10
|
38
|
36
|
37
|
100
|
98
|
96
|
|
2
|
Брестская
|
28
|
23
|
29
|
22
|
26
|
24
|
221
|
223
|
219
|
|
3
|
Дарида
|
130
|
133
|
128
|
12
|
14
|
12
|
33
|
32
|
33
|
|
4
|
Минская - 4
|
209
|
213
|
212
|
80
|
77
|
76
|
30
|
30
|
31
|
|
5
|
Рогачевская
|
28
|
24
|
29
|
200
|
205
|
205
|
720
|
726
|
723
|
|
6
|
Сосны - 1
|
22
|
21
|
21
|
253
|
256
|
252
|
253
|
252
|
258
|
|
7
|
Фрост
|
80
|
77
|
80
|
33
|
39
|
38
|
35
|
38
|
36
|
3.
Методика термодинамического расчёта коэффицентов активности анионов по первому,
второму приближению и модификационному уравнению Девис
Как известно, Дебай и Хюккель внесли большой вклад в теорию
растворов сильных электролитов. В 1023 г. они предположили, что сильные
электролиты в растворах полностью диссоциируют на ионы. Теория Дебая-Гюккеля
поэтому иногда называется «теорией полной диссоциации». Однако в растворах в
отличие от ионных кристаллов солей тепловое движение ионов приводит к тому, что
они не сохраняют фиксированного положения, а располагаются вокруг выбранного
центрального иона в виде шаровой сферы, которая называется ионной атмосферой.
Все ионы, находящиеся в растворе, равноправны, каждый из них окружён ионной
атмосферой и каждый из них может быть центральным.
Теория Дебая-Хюккеля основана на применении двух законов,
характеризующих взаимодействие ионов электролита. Это закон Кулона - сила
притяжения разноименно заряженных частиц и отталкивания одноименно заряженных
частиц обратно пропорциональна квадрату расстояний между ними, и закон
распределения Больцмана, которым выражается противодействие теплового движения
электрическому притяжению и отталкиванию заряженных частиц.
В простейшей формуле выводов Дебая-Хюккеля ионы
рассматриваются как точечные заряды, а их конечными размерами пренебрегают,
тогда предельный закон Дебая-Гюккеля (ПЗДГ) получает следующий вид:
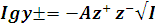 (13)
(13)
где: А - константа, зависящая от диэлектрической постоянной
среды и температуры, для водных растворов при 25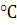 равна «+0,51»;
равна «+0,51»;
z+ и z- - валентность ионов (без учета знаков);
I - ионная сила
Предельный закон Дебая-Хюккеля не принимает во внимание
конечные размеры ионов. Очевидно, что если радиусы всех (гидратированных) ионов
равны «а», то наименьшее расстояние между их центрами равно «2а». Поэтому при
расчёта распределения распределение ионов в ионной атмосфере неправильно
допускать сближения между ними на расстояния, меньше «2а».
Таким образом, ПЗДХ имеет тенденцию переоценивать эффекты
межионного притяжения и отталкивания. Однако он вполне пригоден для получения
приблизительных данных при малых значениях ионной силы не более 0,001 моль/л.
Дебай и Хюккель в своих дальнейших исследованиях учли
конечные размеры ионов и ввели параметр «а», который определили как «среднее
расстояние сближения ионов, положительных или отрицательных». Они вывели
уравнение второго приближения закона, которое имеет вид:
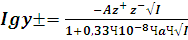 (14)
(14)
где: А - константа, зависящая от диэлектрической постоянной
среды и температуры, для водных растворов при 25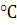 равна «+0,51»;
равна «+0,51»;
z+ и z- - валентность ионов (без учета знаков);
а - размер ионов (3 10-8 - 6
10-8 - 6 10-8)
10-8)
I - ионная сила
Для характеристики поведение электролитов отдельных авторы
записывают вышеприведенные уравнения в различных эмпирических формах. Эти
уравнения полезны при вычислениях коэффициентов активности тех солей, для
которых отсутствует экспериментальные данные.
Уравнения мы называем расширенными уравняем закона Дебая -
Хюккеля (РУДГ). При ионной силе до 0,1 значения f , рассчитанные для
различных электролитов из значений коэффициентов активности отдельных ионов,
хорошо согласуются с экспериментальными данными.
, рассчитанные для
различных электролитов из значений коэффициентов активности отдельных ионов,
хорошо согласуются с экспериментальными данными.
Однако как ни велики достижения теории Дебая-Хюккеля её
приложение ограничивается разбавленными растворами сильных электролитов с
ионами низкой валентности, так как она учитывает лишь эффект
электростатического взаимодействия ионов, не принимая во внимание силы,
действующие между ионами и молекулами растворителя, т.е. сольвацию ионов.
Теория Дебая-Хюккеля не всегда учитывает индивидуальные свойства отдельных
ионов, которые определяются их строением, поляризуемостью, ПЗДХ и РУДХ плохо
работают в области высокой концентрации, имеют место рассогласованность
термодинамического расчёта и результатов эксперимента.
По этой причине Хюккель предложил следующее упавнение для
расчёта среднего коэффициента активности:
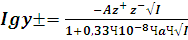 + ВС (15)
+ ВС (15)
Слагаемое ВС было включено для того, чтобы внести поправку на
изменение диэлектрической проницаемости растворителя при добавлении
электролита. Уравнение было широко использовано для вычисления коэффициентов
активности. Такие уравнения, содержащие две эмпирические константы, дают вполне
удовлетворительные результаты для эмпирического при значении ионной силы
порядка единицы.
Девис приводит следующее уравнение:
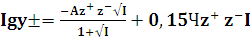 (16)
(16)
где: А - константа, зависящая от диэлектрической постоянной
среды и температуры, для водных растворов при 25 равна «+0,51»;
равна «+0,51»;
z+ и z- - валентность ионов (без учета знаков);
I - ионная сила
Предельный закон показывает, что логарифм коэффициента
активности должен уменьшаться линейно с изменением  . Наклон прямой в
координатах lgf
. Наклон прямой в
координатах lgf -
-  должен зависеть от
валентного типа электролита. Полученные экспериментальные данные прекрасно
согласуется с предсказанными для предельно малых концентраций электролита. Для
более высоких концентрациях предельный закон не выполняется и график в
координатах lgf
должен зависеть от
валентного типа электролита. Полученные экспериментальные данные прекрасно
согласуется с предсказанными для предельно малых концентраций электролита. Для
более высоких концентрациях предельный закон не выполняется и график в
координатах lgf -
-  имеет вид уже не прямой,
а кривой. Полагают, что параметр «а» иона имеет конечное значение, т.е. ион не
является точечным зарядом. Теоретическое значение можно получить из
эксперимента.
имеет вид уже не прямой,
а кривой. Полагают, что параметр «а» иона имеет конечное значение, т.е. ион не
является точечным зарядом. Теоретическое значение можно получить из
эксперимента.
Ионная сила раствора - мера интенсивности
электрического поля, создаваемого ионами в растворе
Так же рассчитана ионная сила по следующей формуле:
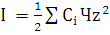 (17)
(17)
Таблица 7 Результаты расчета ионной силы раствора
|
№ п/п
|
Название минеральной воды
|
Ионная сила раствора моль/л
|
|
1
|
Аквадив
|
0,0369
|
|
2
|
Брестская
|
0,0414
|
|
3
|
Дарида
|
0,0555
|
|
4
|
Минская - 4
|
0,0724
|
|
5
|
Рогачевская
|
0,1442
|
|
6
|
Сосны - 1
|
0,545
|
|
7
|
Фрост
|
0,0514
|
Для термодинамического расчёта коэффициентов активности ионов
применяли формулу Девиса которая имеет вид:
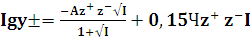 (18)
(18)
где: А - константа, зависящая от диэлектрической постоянной
среды и температуры, для водных растворов при 25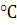 равна «+0,51»;
равна «+0,51»;
z+ и z- - валентность ионов (без учета знаков);
I - ионная сила
Расчетные данные:
Таблица 8 Расчета коэффициента активности
|
Аквадив
|
Брестская
|
Дарида
|
|
ионы
|
Коэффициент активности
|
Ионы
|
Коэффициент активности
|
Ионы
|
Коэффициент активности
|
|
Cl-
|
0,8315
|
Cl-
|
0,8242
|
Cl-
|
0,8049
|
|
SO42-
|
0,4779
|
SO42-
|
0,4614
|
SO42-
|
0,4197
|
|
HCO3-
|
0,8315
|
HCO3-
|
0,8242
|
HCO3-
|
0,8049
|
|
K+
|
0,8315
|
K+
|
0,8242
|
K+
|
0,8049
|
|
Mg2+
|
0,4779
|
Mg2+
|
0,4614
|
Mg2+
|
0,4197
|
|
Ca2+
|
0,8315
|
Ca2+
|
0,8242
|
Ca2+
|
0,4797
|
Таблица 9 Расчета коэффициента активности
|
Минская - 4
|
Рогачевская
|
Сосны - 1
|
Фрост
|
|
ионы
|
Коэффициент активности
|
ионы
|
Коэффициент активности
|
Ионы
|
Коэффициент активности
|
Ионы
|
Коэффициент активности
|
|
Cl-
|
0,7865
|
Cl-
|
0,7366
|
Cl-
|
0,8058
|
Cl-
|
0,8101
|
|
SO42-
|
0,3827
|
SO42-
|
0,2943
|
SO42-
|
0,4217
|
SO42-
|
0,4307
|
|
HCO3-
|
0,7865
|
HCO3-
|
0,7366
|
HCO3-
|
0,8058
|
HCO3-
|
0,8101
|
|
K+
|
0,7865
|
K+
|
0,2943
|
K+
|
0,8058
|
K+
|
0,8101
|
|
Mg2+
|
0,3827
|
Mg2+
|
0,7343
|
Mg2+
|
0,4217
|
Mg2+
|
0,4307
|
|
Ca2+
|
Ca2+
|
0,7343
|
Ca2+
|
0,4217
|
Ca2+
|
0,4307
|
4.
Математическая обработка экспериментальных данных
По результатам экспериментальных данных рассчитывали
следующие показатели:
Среднее значение ряда вариантов:
Х = (х1+х2+х3)/3 (19)
где Х - среднее значение ряда вариант;
х1, х2, х3 - частные
значения вариант;
n - число вариант.
Определение отклонений от среднего значения для каждой
варианты:
d= x-xi (20)
где d - отклонение от среднего значения для каждой варианты;
х - частные значения вариант;
xi - среднее значение
вариант.
Расчёт дисперсии:
Vi= ( )/ (n-1) (21)
)/ (n-1) (21)
где Vi - дисперсия;
d - отклонение от среднего значения для каждой варианты;
n - число вариант.
Определение стандартного отклонения:
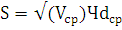 (22)
(22)
Где S - стандартное отклонение;
Vср - среднее значение дисперсии;
dср - среднее значение отклонения от среднего
значения для каждой варианты.
Вычисление доверительного интервала:
 (23)
(23)
Где ea - довеительный интервал;
tа - коэффициент Стьюдента;
S - стандартное отклонение;
n - число вариант.
Определение относительной ошибки измерения:
 (24)
(24)
Где 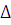 - относительная ошибка измерения;
- относительная ошибка измерения;
еа - точность прямого измерения;
х - среднее значение ряда вариант.
В следующих таблицах представлены данные математической
обработки:
Минеральная вода «Аквадив»
|
Ионы
|
Cl-
|
Ca2+
|
|
Х
|
967
|
98
|
|
D
|
1,00
|
2,0
|
|
Vi
|
3,00
|
4,0
|
|
S
|
1,73
|
2,0
|
|
ea
|
4,3
|
4,9
|
|
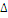
|
0,44
|
5,07
|
Минеральная вода «Брестская»
|
Ионы
|
Cl-
|
Ca2+
|
|
Х
|
1022
|
221
|
|
D
|
1,67
|
0,0
|
|
Vi
|
2,33
|
4,0
|
|
S
|
1,53
|
2,0
|
|
ea
|
3,7
|
4,9
|
|
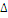
|
0,37
|
2,25
|
Минеральная вода «Дарида»
|
Ионы
|
Cl-
|
Ca2+
|
|
Х
|
1224
|
33
|
|
D
|
0,33
|
0,33
|
|
Vi
|
0,33
|
0,33
|
|
S
|
0,58
|
0,57
|
|
ea
|
1,433
|
1,433
|
|
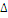
|
0,12
|
4,39
|
Минеральная вода «Минская - 4»
|
Ионы
|
Cl-
|
Ca2+
|
|
Х
|
1806
|
30
|
|
D
|
0,33
|
0,67
|
|
Vi
|
0,33
|
0,33
|
|
S
|
0,58
|
0,57
|
|
ea
|
1,433
|
1,43
|
|
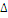
|
0,08
|
4,73
|
Минеральная вода «Рогачевская»
|
Ионы
|
Cl-
|
Ca2+
|
|
Х
|
2436
|
723
|
|
D
|
0
|
3,0
|
|
Vi
|
4,0
|
9,0
|
|
S
|
2,0
|
0,3
|
|
ea
|
4,97
|
7,78
|
|
|
0,20
|
1,03
|
Минеральная вода «Сосны - 1»
|
Ионы
|
Cl-
|
Ca2+
|
|
Х
|
477
|
254
|
|
D
|
2,33
|
3,67
|
|
Vi
|
10,3
|
10,3
|
|
S
|
3,21
|
3,21
|
|
ea
|
7,98
|
7,98
|
|
|
1,67
|
3,14
|
Минеральная вода «Фрост»
|
Ионы
|
Cl-
|
Ca2+
|
|
Х
|
682
|
36
|
|
D
|
0,33
|
1,67
|
|
Vi
|
2,33
|
2,33
|
|
S
|
1,5275
|
1,53
|
|
ea
|
3,79
|
3,79
|
|
|
0,56
|
10,4
|
Заключение
Общепринятой и наиболее часто используемой в Беларуси
является классификация по химическому составу минеральных вод, но есть и другая
трактовка этой классификации - по ионному составу. Также в качестве основных
параметров ранжирования принят комплекс количественных показателей и признаков,
среди которых наиболее значимы общая минерализация, ионный и газовый состав,
содержание терапевтических активных компонентов, радиоактивность, рН,
температура, показания к лечебному применению и другие.
Следует отметить, что в основу
закономерностей формирования химического состава природных вод были выделены
наиболее широко распространенные в литосфере катиогенные и аниогенные элементы.
К катиогенным относятся железо, кальцый, магний, натрий, калий; к аниогенным -
кремний, фосфар, углерод, сера, хлор. Растворимость различных соединений
перечисленных элементов определяет степень устойчивости их миграционно
подвижных форм и способность накапливаться в водных растворах.
В гидрохимии на базе соотношения между
кларками элементов и растворимостью их природных соединений все элементы
делятся на три группы: макро-, мезо-, микрокомпоненты.
К минеральным (лечебным) водам относятся
природные воды, которые могут оказывать на организм человека лечебное действие,
обусловленное либо повышенным содержанием полезных, биологически активных
компонентов ионно-солевого или газового состава, либо общим ионно-солевым
составом воды. Минеральные воды не являются каким-либо определенным генетическим
типом подземных вод. К ним относятся воды весьма различные по условиям
формирования и отличаются по химическому составу. В лечебных целях используют
воды с минерализацией от долей грамма на 1 л до высококонконцентрированных
рассолов, разнообразного ионного, газового и микрокомпонентного состава,
различной температуры.
Так как помимо суммарного количества
растворенных в минеральной воде веществ, при бальнеологической оценке большое
значение имеет состав и содержание в воде компонентов в виде ионов. Для этого
проводят термодинамические расчеты коэффициентов активности ионов, которые
показывают активность каждого иона в минеральной воде (данные приведены в
таблице №8,9).
Список использованных источников:
1 Ясовеев, М.Г. Бальнеологическое использование
минеральных вод / М.Г. Ясовеев, Э.С. Кашицкий, Н.В. Ястребова // Медицинские
новости. - 2006. - №6. - С. 25 - 33
Кудельский, А.В. Минеральные воды Беларуси / А.В.
Кудельский, М.Г. Ясовеев. - Мн.: НИИ НАН Геологических наук. - 1994. - 280 с.
Порошин, В.Д. К вопросам классификации подземных
рассолов по степени общей минерализации // Геохимия. - 1978. - №2. - С. 301 -
306.
Ясовеев, М.Г. Минеральные воды и лечебные пелоиды
Беларуси / М.Г. Ясовеев, И.Ф. Аверченко, Н.В. Мазур. - Мн. - 2005.
Жуковская, И.А. Минеральные воды Беларуси / И.А.
Жуковская // Химия: проблема выкладання. - 2008. - №9. - С. 36 - 41.
Мартынова, М.А. Гидрогеохимия: учебное пособие /
М.А. Мартынова. - Спб.: Изд-во С.-Перербурского университета, 1993. - 224 с.
7 Куликов, Г.В.
Минеральные лечебные воды СССР / Г.В. Куликов, А.В. Жевлаков, С.С. Бондаренко.
- М.: Недра, 1991. - 399 с.
Ясовеев, М.Г. Ресурсы
минеральных вод Беларуси и перспективы их использования/ М.Г Ясовеев //
Полезные ископаемые. - 1997. - №1. - С. 56 65.
Никитенко, П. Формирование
кластера «вода» / П. Никитенко // Наука и инновации. - 2008. - №11. - С. 40 -
44.
Ясовеев, М.Г. Природные
ресурсы / М.Г. Ясовеев, М.С. Капора. - 2000. - №1. - С. 20 - 26.
11 Богомолов, В.А. Рассолы Припятской впадины -
возможный источник извлечения редких и рассеянных элементов / В.А. Богомолов,
А.В. Кудельский, П.Г. Альтшулер. - Мн.: Наука и техника. - 1977. - 243 с.
Гудак, С.П. Минеральные промышленные воды
Республики Беларусь/ С.П. Гудак, Л.И. Шаповал, Г.Л. Фурсиков. - Мн. - 1992. -
64 с.
Кудельский, А.В. Подземные воды Беларуси / А.В.
Кудельский, В.И. Пашкевич, М.Г. Ясовеев. - Мн. - 1998. - 359 с.
Курило, А.К. Ресурсы и качество подземных вод в
Республике Беларусь.: Обзор. информ. / К.А. Курило. - Минск: БЕЛНИЦ «ЭКОЛОГИЯ».
- 2002. - 66 c.
Журавель, Н.А. Гидрогеология / Н.А. Журавель,
А.Н. Пряхин. - Мн.: Высшая школа. - 1988. - 95 с.
Крайнов, С.Р. Основы геохимии подземных вод:
учебное пособие для вузов / С.Р. Крайнов, В.М. Швец. - М.: Недра. - 1980. - 247
с.
Головач, С.В Торговые марки белорусских минеральных
вод / С.В. Головач, Э.С. Кашицкий, М.Г. Ясовеев. - Минск: ОДО «Тропик», 2004. -
96 с.
Ясовеев, М.Г. Подземные воды Беларуси / М.Г.
Ясовеев // Вода. - 2000. - №4. - С. 8.
Кудельский, А.В. Водные ресурсы Беларуси:
состояние, проблемы и перспективы использования / А.В. Кудельский // Новости
НАН Беларуси. - 2007. - №1. - С. 71 - 78
20 Асташкин, Н.Д.
Природные ресурсы БССР / Н.Д. Асташкин. - Мн.: Наука и техника, 1970. - 403 с.
Кудельский, А.В.
Минеральные воды Юго-Восточной Белоруссии / А.В Кудельский, Г.А. Сербин. - Мн.:
Наука и техника, 1990. - 101 с.
Плотникова, Г.Н.
Сульфидные воды / Г.Н. Плотникова // Гидрогеология и геохимия лечебных
минеральных вод. - М.: ЦНИИиФ. - 1981. - С. 5 - 30.
Ясовеев, М.Г. Столовые,
целебные / М.Г. Ясовеев // Беларусская думка. - 2006. - №7. - С. 180 - 187.
24 ГОСТ 13273 - 88 Воды минеральные, питьевые,
лечебные и лечебно-столовые. Технические условия. - М.: Изд-во стандартов. -
1988. - 30 с.
Гудак, С.П. Характеристика и применение
минеральных вод Беларуси / С.П. Гудак, Э.С Кашицкий, М.Г Ясовеев //
Здравохранение. - 2002. - №5. - С. 9 - 11.
26 Ясовеев, М.Г.
Природные факторы оздоровления / М.Г. Ясовеев, Ю.М. Досин, О.В. Крылова. - Мн.:
БГПУ. - 2004. - 98 с.
Никитенко, П.
Формирование кластера «вода» / П. Никитенко // Наука и инновации. - 2008. -
№10. - С. 47 - 51.
28 Жуковская, Н.А. Минеральные воды Беларуси /
И.А. Жуковская // Химия: проблема выкладання. - 2008. - №9. - С. 36 - 41.
Кудельский, А.В. Водные ресурсы Беларуси:
состояние, проблемы и перспективы использования / А.В. Кудельский // Новости
НАН Беларуси. - 2006. - №10. - С. 13 - 14
Кудельский, А.В. Вода, да не та? / А.В Кудельский
// Наука и инвестиции. - 2009. - №4. - С. 6 - 9
Стойкова, Э.П Гидрохимический анализ / Е.Е.
Стойкова, Э.П. Медянцева, Г.А. Евтюгин. - Казань, Казанский (Приволжский)
федеральный университет. - 2010. - 49 с.
Воробьева, Е.В. Большой практикум / Е.В
Воробьева, Т.В. Макаренко // Гомель: ГГУ им. Ф. Скорины. - 2005. - 87c.
Зуев, Е.Т. Питьевая и минеральная вода
(требование мировых и европейских стандартов к качеству и безопасности) / Е.Т.
Зуев.− Протектор. - 2003. - 320 с.
Гледко, Ю.А. Гидрогеология: учеб. пособие / Ю.А.
Гледко. - Минск: Выш. шк., 2012. - 446 с.
Кудельский, А.В. Минеральные воды Беларуси / АН
Беларуси, Ин-т геол. Наук АН Беларуси, 1994. - 280 с.