Полиморфизм по группам крови и их ассоциации с заболеванием вирусным гепатитом 'С' (на примере пациентов КСТ 'Садко')
ДИПЛОМНАЯ РАБОТА
Полиморфизм по группам крови и их ассоциации с заболеванием
вирусным гепатитом «С» (на примере пациентов КСТ «Садко»)
Введение
Актуальность. В настоящее время, учитывая эпидемиологическую
настороженность в отношении парентеральных гепатитов В и С, сохраняющуюся и
растущую угрозу террористических актов, техногенных катастроф, все возрастающую
необходимость и востребованность донорской крови и ее компонентов, в службе
крови все актуальнее становится вопрос повышения вирусной безопасности
гемотрансфузий (Хаитов, Игнатьева 1992; Покровский 2000; Кудрявцева 2000;
Воробьев 2006).
Особая опасность вирусных гепатитов
В и С объясняется частыми
случаями хронизации инфекций. По данным ВОЗ во всем мире насчитывается от 300
до 500 млн. лиц хронически инфицированных вирусными гепатитами.
По результатам исследования
Роспотребнадзора по Нижегородской области, за последние несколько лет уровень
заболеваемости хроническими гепатитами возрос на 1,66 раза.
Парентеральные вирусные гепатиты
характеризуются высокой инфекционностью, так как заражение возможно при
инокуляции небольшого количества крови от больного: 0,1-0,5 мкл. Отсутствие
вакцин для профилактики вирусного гепатита С, с учетом его чрезвычайной
мутабельности, привели в настоящее время к распространению данной инфекции.
(Суздальцев 2003; Аммосов 2004; Воробьев, Донское, Городецкий, 2006).
Повышение качества диагностики
данных заболеваний является первостепенной задачей в службе крови в масштабах
мировой практики. На сегодняшний день расширение возможностей при обследовании
крови, совершенствование молекулярно-генетических технологий при диагностике
социально-значимых инфекций, выявление склонности человека к инфицированию
вирусами гепатитов В и С являются вопросами, требующими тщательного
исследования (Гаврилов 2005; Куандыкова 2005).
Выявление генетической
предрасположенности к гепатитам В и С, изучение отклонений в метаболизме при
гепатитах В и С в зависимости от групповой принадлежности крови человека,
поможет найти индивидуальный подход и оптимальный комплекс профилактических и
лечебно-диагностических мероприятий, что обеспечит его раннюю диагностику.
Целью настоящего исследования является попытка выявления связи между
инфицированием вирусом гепатита С и групповой принадлежностью крови.
Задачи:
1. Изучение
специальной литературы по теме исследования
. Определить
на популяционном уровне характер распределения групп крови в системе АВО и
системе резус у жителей Нижегородского региона.
. Выявить
связь заболевания гепатитом С у пациентов клиники с половой принадлежностью
. Характеризовать
распределение фенотипов эритроцитарных групп крови у носителей маркеров вируса
гепатита С, и попытаться выявить среди них группы повышенного риска.
Новизна. Получен блок новых сведений, раскрывающих возможную взаимосвязь
характера распределения носителей вирусов гепатитов С с групповой
принадлежностью крови.
Практическая значимость.
Показатели частоты заболеваемости пациентов КСТ «Садко»
использованы медицинскими сотрудниками с целью пропаганды здорового образа
жизни.
1. Литературный обзор по
теме исследования
.1 Генетический
полиморфизм по группам крови системы АВО
генетический
полиморфизм вирусный гепатит
Начиная с 50-х годов XX столетия для
определения генетического полиморфизма стал широко применяться метод
электрофореза белков в геле. Изобретателем данного метода считается английский
ученый Оливер Смитис (Oliver Smithies), а датой изобретения 1950 г. В 1969 г. впервые в качестве
денатурирующего агента в гель-электрофорезе белков был использован додецилсульфат
натрия (ДСН). А в 1970 г. Ульрих К. Лэммли (Ulrich K. Laemmli), используя ДСН,
разделил 28 белковых компонентов бактериофага Т4 в полиакриламидном геле
(сокращенно ДСН-ПААГ). С тех пор фамилия швейцарского ученого стала именем
нарицательным, а метод разделения, использованный в его работе стали называть
«гель - электрофорезом по Лэммли».
Наследственная гетерогенность
человечества распространяется на множество антигенных особенностей эритроцитов,
лейкоцитов, белков плазмы, тканевых антигенов и т.д., что является, по
выражению В.П. Эфроимсона (1966), высокосовершенной формой защиты от микробных
паразитов.
Первый генетический полиморфный
признак у человека был выявлен австралийским ученым К. Ландштейнером в 1900 г.
Это была система группы крови АВО. За что в 1930 году он был удостоен
Нобелевской премии. В 1907 году чешский ученый Я. Янский пришёл к выводу о
существовании 4 групп крови (в отличие от 3 групп, открытых К. Ландштейнером)
Он впервые дал точное описание всей системы групп крови в работе «Гематологические
исследования психически больных». (Зотиков, Донсков, Янский, 1974)
Нормальные иммуногенетические
признаки крови людей, представляющие собой определенные сочетания групповых
изоантигенов (агглютиногенов) в эритроцитах с соответствующими им антителами в
плазме. Являются наследственными признаками крови, которые формируются в период
эмбриогенеза и не изменяются в течение жизни человека.
В групповую систему АВ0 входят 2
изоантигена, обозначаемые буквами А и В, и два агглютинина - α (анти-А) и β (анти-В). Их соотношения
образуют 4 группы крови (таблица №1).
Таблица №1. Соотношение между
изоантигенами в эритроцитах и групповыми антителами в плазме в группах крови по
системе АВ0 (Умнова 1989)
|
Группы крови
|
Изоантигены в эритроцитах
|
Групповые антитела в плазме крови
|
|
0αβ(I)
|
Отсутствуют
|
α и
β
|
|
Аβ(II)
|
А
|
β
|
|
Вα(III)
|
В
|
α
|
|
АВ(IV)
|
А и В
|
Отсутствуют
|
Как видно из
таблицы №1, агглютинин α (β) является антителом по отношению к агглютиногену А (В), т.е. он
агглютинирует эритроциты, содержащие соответствующий агглютиноген, поэтому
одноименные антиген и агглютинин (А и α или В и β) не могут содержаться в крови одного и того же лица.
Открытие групповой
системы АВ0 дало возможность понять такие явления, как совместимость и
несовместимость при переливании крови. Люди с группой крови 0αβ(I) являются
универсальными донорами, так как их кровь можно переливать лицам с любой из
четырех указанных групп. Соответственно, лица с группой крови АВ(IV) относятся
к категории универсальных реципиентов, им можно переливать кровь от лиц с любой
из четырех групп крови. Совместимость по группам крови, также учитывается при
трансплантации органов и тканей. Идентификацию соответствующих антигенов
проводят в реакциях агглютинации эритроцитов исследуемых людей (их цельная
кровь), содержащие антитела α либо β.
Установлено, что
синтез каждого эритроцитарного антигена обусловлен действием одного гена.
Антигены наследуются по типу доминирования или кодоминирования. В частности в
системе АВО у человека антигены А и В доминируют над 0, а между собой А и В
наследуются по типу кодоминирования. В связи с этим четыре группы крови имеют
шесть генотипов. Вторая и третья группы могут быть гомозиготными или
гетерозиготными. Локус систем АВО принято обозначать буквой J. Наследование
групп крови подчиняется законам Менделя (таблица №2)
Таблица №2.
Генотипы групп крови системы АВО
|
Группы крови
|
Генотипы
|
|
0αβ(I)
|
J° J°
|
|
Аβ(II)
|
Jᴬ Jᴬ
|
Jᴬ J°
|
|
Вα(III)
|
Jᴮ Jᴮ
|
Jᴮ J°
|
|
АВ(IV)
|
Jᴬ Jᴮ
|
В таблице №3 указаны данные о
возможных фенотипических вариантах потомства, которое может появиться у
родителей с разными сочетаниями генов системы АВО.
Таблица №3. Варианты наследования
групп крови системы AB0
|
Группа крови матери и генотип
|
Группа крови отца и генотип
|
|
0αβ(I) J° J°
|
Аβ(II) Jᴬ J°
|
Аβ(II) Jᴬ Jᴬ
|
Вα(III) Jᴮ J°
|
Вα(III) Jᴮ Jᴮ
|
АВ(IV) Jᴬ Jᴮ
|
|
0αβ(I) J° J°
|
0αβ(I) J° J°
|
0αβ(I)
J° J° Аβ(II) Jᴬ J°
|
Аβ(II) Jᴬ J°
|
0αβ(I)
J° J° Вα(III) Jᴮ J°
|
Вα(III) Jᴮ J°
|
Аβ(II) Jᴬ J° Вα(III) Jᴮ J°
|
|
Аβ(II) Jᴬ J°
|
0αβ(I)
J° J° Аβ(II) Jᴬ J°
|
0αβ(I)
J° J° Аβ(II) Jᴬ J° Аβ(II) Jᴬ Jᴬ (25/50/25)
|
Аβ(II) Jᴬ Jᴬ Аβ(II) Jᴬ J°
|
0αβ(I)
J° J° Аβ(II) Jᴬ J° Вα(III)
Jᴮ J° АВ(IV) Jᴬ J ᴮ
|
АВ(IV) Jᴬ J ᴮ Вα(III) Jᴮ J°
|
Аβ(II) Jᴬ Jᴬ Аβ(II)
Jᴬ J° Вα(III)
Jᴮ J° АВ(IV) Jᴬ Jᴮ
|
|
Аβ(II) Jᴬ Jᴬ
|
Аβ(II) Jᴬ J°
|
Аβ(II) Jᴬ Jᴬ Аβ(II) Jᴬ J°
|
Аβ(II) Jᴬ Jᴬ
|
АВ(IV) Jᴬ J ᴮ Аβ(II) Jᴬ J°
|
АВ(IV) Jᴬ J ᴮ
|
Аβ(II) Jᴬ Jᴬ АВ(IV) Jᴬ Jᴮ
|
|
Вα(III) Jᴮ J°
|
0αβ(I)
J° J° Вα(III) Jᴮ J°
|
0αβ(I)
J° J° Аβ(II) Jᴬ J° Вα(III)
Jᴮ J° АВ(IV) Jᴬ J ᴮ
|
АВ(IV) Jᴬ ᴮ Аβ(II) Jᴬ J°
|
0αβ(I) J° J° Вα(III)
Jᴮ J° Вα(III) Jᴮ Jᴮ 25/50/25
|
Вα(III) Jᴮ Jᴮ Вα(III) Jᴮ J°
|
Аβ(II) Jᴬ J° Вα(III) Jᴮ J° Вα(III) Jᴮ Jᴮ АВ(IV) Jᴬ Jᴮ
|
|
Вα(III) Jᴮ Jᴮ
|
Вα(III) Jᴮ J°
|
АВ(IV) Jᴬ J ᴮ Вα(III) Jᴮ J°
|
АВ(IV) Jᴬ Jᴮ
|
Вα(III) Jᴮ Jᴮ Вα(III) Jᴮ J°
|
Вα(III) Jᴮ Jᴮ
|
АВ(IV) Jᴬ Jᴮ Вα(III) Jᴮ Jᴮ
|
|
АВ(IV) Jᴬ J ᴮ
|
Аβ(II) Jᴬ J° Вα(III) Jᴮ J°
|
Аβ(II) Jᴬ Jᴬ Аβ(II) Jᴬ J° Вα(III) Jᴮ J° АВ(IV) Jᴬ J ᴮ
|
Аβ(II) Jᴬ Jᴬ АВ(IV) Jᴬ Jᴮ
|
Аβ(II) Jᴬ J° Вα(III) Jᴮ J° Вα(III) Jᴮ Jᴮ АВ(IV) Jᴬ J ᴮ
|
АВ(IV) Jᴬ J ᴮ Вα(III) Jᴮ Jᴮ
|
Аβ(II) Jᴬ Jᴬ Вα(III) Jᴮ Jᴮ АВ(IV) Jᴬ Jᴮ 25/25/50
|
Таким образом, генетический
полиморфизм возник в результате мутационных процессов и широко распространен в
человеческих популяциях.
.2 Наследование резус -
фактора крови
Резус-фактор, это одна из 29 систем
групп крови, признаваемых в настоящее время Международным обществом
трансфузиологов (ISBT). После системы ABO она клинически наиболее важна. Это
система аллогенных антигенов крови человека, независимая от факторов,
обусловливающих группы крови (система АВ0) и других генетических маркеров.
Название «резус-фактор» система
антигенов получила в связи с тем, что ее антиген был обнаружен у человека с
помощью сыворотки кролика, иммунизированного эритроцитами обезьяны вида Macacus
rhesus. Резус - фактор в наибольшей степени выражен в эритроцитах и менее четко
представлен в лейкоцитах и тромбоцитах.
В 1939 году доктора Филип Левин и
Руфус Стетсон опубликовали в первом докладе клинические последствия, не
признаваемого резус-фактора в виде гемолитической реакции на переливание крови
и гемолитической желтухи новорождённых в её наиболее тяжёлой форме (Levine,
Stetson, 1939). Было признано, что сыворотка крови описываемой в докладе
женщины, вступила в реакцию агглютинации с красными кровяными тельцами примерно
80% людей известных тогда групп крови, в частности, совпадающими по системе
ABO. Тогда этому не было дано никакого названия, а позже такое стали называть
агглютинин. В 1940 году доктора Карл Ландштейнер и Александр Винер опубликовали
доклад о сыворотке, которая также взаимодействует с примерно 85% различных
эритроцитов человека (Landsteiner, Wiener, 1940).
Насчитывается шесть основных
антигенов резус - фактора. Для их обозначения используют две номенклатуры.
Согласно первой (система Винера), антигены резус - фактора обозначают символами
Rh0, rh', rh», Hr0, hr', hr». Согласно второй (система
Фишера - Рэйса), используют буквенные обозначения: D, С, Е, d, с, е. Нередко пользуются
двумя номенклатурами одновременно. В этом случае символы одного из обозначений
помещают в скобки. Антиген (фактор) Rh0(D) - основной антиген в
резус - факторе, имеющий наибольшее практическое значение. Он содержится в
эритроцитах 85% людей, проживающих в Европе. Антиген Rh0(D) не
является однородным, он включает в себя ряд более мелких субъединиц - RhA,
RhB, RhC, RhD.
Наличие в крови резус - фактора
обусловлено доминантным геном (Rh⁺ или Rh), а отсутствие -
рецессивным (Rh⁻ или rh). Возможные генотипы
резус - положительных людей: RhRh и Rhrh; у резус - отрицательных людей - только один генотип: rhrh.
В повседневной практике переливания
крови, ограничиваются определением у реципиента только антигена Rh0(D).
В тех случаях, когда резус-принадлежность крови реципиента установить не
удается, ему переливают резус-отрицательную кровь (Гаврилов, 1980).
Различия людей по резус - фактору
могут приводить к иммунологически конфликтной беременности (резус - конфликт).
В основе сенсибилизации лежит попадание в организм резус-отрицательной женщины
резус-положительных эритроцитов плода, главным образом через кровеносные сосуды
плаценты. В организме матери образуются резус-антитела, которые, проникая в
кровь плода, вызывают гемолитические процессы (гемолитическая желтуха
новорождённых). Как правило, во время беременности кровь плода не попадает в
кровоток матери. Поэтому во время первой беременности у матери не
вырабатываются антитела к антигену Rh0(D), и ребёнок остаётся
здоровым. Однако, при родах чаще всего происходит смешение крови матери и
ребёнка, отчего мать становится восприимчивой к резус-антигену и образует
против него антитела. Как отмечает А.М. Кулиев (1974), по мнению ряда
исследователей, поступление фетальной крови в организм матери, возможно, лишь в
результате предшествующих абортов, инфарктов, геморрагических очагов в плаценте
при осложненных родах.
Таким образом, группа крови системы
резус - фактор, детерминируемая генетически, в результате чего формируется
несколько разновидностей антигенов, что свидетельствует о широком белковом
полиморфизме в человеческих популяциях.
1.3 Вирусный гепатит С
(некоторые аспекты патогенеза, диагностики и клинического течения)
Вирусный гепатит C представляет серьезную проблему для
Здравоохранения и человечества в целом. Согласно ВОЗ в мире количество людей,
инфицированных вирусом гепатита C, составляет 500 млн, из которых 80% уже имеют хроническую форму заболевания. Так,
например, в Южной Америке по данным за 2005 год, вирусом гепатита C инфицировано примерно 4% населения,
Африке 2-2,2%, Азии-2-3%, США до 3%, Японии 1,2%. В Российской Федерации с 1994
г. до 2000 г. число инфицированных выросло с 3% до 5% (Коршунова, 1999)
Путь к открытию вирусного гепатита С
был достаточно трудным и долгим. После обнаружения Бламбергом антигена вируса
гепатита B, и в 1973 г. С. Файнстоуном, в фекалиях больного, возбудителя
гепатита А, были разработаны методы серологической диагностики инфекции, и во
многих странах внедрен в практику скрининг донорской крови. Однако, у людей
после переливания крови, свободной от антигена ВГВ и ВГА, развивался
посттрансфузионный гепатит. Это указывало на существование еще одного типа
вирусного гепатита, который стали называть non-A, non-B hepatitis, или NANBH
(Дадашева, Мамедов, Михайлов, 2010).
Открытие вируса произошло благодаря
К. Чу и его коллегам, которые в 1989 году при экспериментальном заражении
человекообразных обезьян сыворотками крови, полученными от больных non-A, non-B
hepatitis, позволили предположить его близость к вирусам, относящимся к семейству
Flaviviridae. Этот возбудитель гепатита назвали вирусом гепатита C (Михайлов,
2005). И наконец, идентифицировав вирусспецифический белок, эти исследователи
на его основе почти вслепую создали первую экспериментальную
радиоиммунологическую тест - систему, позволяющую идентифицировать инфекцию
путем выявления антител к этому вирусспецифическому белку.
Таким образом, 1989 год положил
начало новому периоду, ознаменовавшемуся детальным изучением ВГС и вызываемой
им инфекции и разработкой доступных методов ее лабораторной диагностики
(Учайкин, 2002)
Вирус гепатита С систематизирован в
семейство Flaviviridae, род Hepacivirus. Вирион представляет собой небольшой сферической формы вирус,
диаметром 55-65 нм. Геном вируса представлен одноцепочечной +РНК, протяженностью
около 9600 нуклеотидов. Геном имеет одну открытую рамку считывания,
ограниченную с 5'- и 3'-концов некодирующими областями (НКО). Открытая рамка
считывания кодирует полипептид, величина которого варьирует у разных изолятов
вируса от 3008 до 3037 аминокислотных остатков. Этот полипептид расщепляется
вирусными и клеточными сигнальными протеазами на 3 структурных и 6
неструктурных белков.
К каждому из этих белков
вырабатываются антитела, обнаруживаемые в крови больного гепатитом C. Геном ВГC обладает чрезвычайно высокой
гетерогенностью. Известно 10-14 генотипов и более 50 подтипов вируса.
Помимо печеночной репликации вируса
имеет место внепеченочная репликация в тканях лимфоидного и нелимфоидного
происхождения. Размножение вируса в лимфоцитах приводит к нарушению их
иммунологических функций и дает возможности вирусу избегать иммунологического
контроля (Анохина, 2007).
Вирус устойчив к нагреванию до 50°С,
при кипячении сохраняется в течении 2 мин. Инактивируется хлороформом и
ультрафиолетовым облучением. При комнатной температуре выживает на различных
поверхностях, например, в засохшей капле крови сохраняет активность от 16 часов
до 4-х дней (Львов, 2008).
Вирусный гепатит C относится к антропонозным не
трансмиссивным кровяным вирусным инфекциям. Природный резервуар вируса не
известен. Источником возбудителя является человек, больной острым или
хроническим ВГС и основное значение имеют лица с отсутствием яркой клинической
симптоматики. Пути заражения гепатитом С - парентеральный и вертикальный. К
парентеральному относятся искусственные и естественные пути, в 10% случаев путь
передачи инфекции неизвестен. (Макарик, Романова, 2001) К естественным
относятся заражение половым путем. Искусственный путь передачи связан с любым
повреждением кожных и слизистых покровов нестерильными инструментами. (Лобзин,
Казанцев, 1991) Парентеральное введение наркотиков считается причиной появления
примерно половины всех инфекций вирусом ГС. Риску подвергаются лица, имеющие
беспорядочные половые контакты - в частности гомосексуалисты, люди, находящиеся
на гемодиализе, так же при посещении стоматологических учреждений, салонов
пирсинга и акупунктур, при маникюрных и педикюрных манипуляциях. Подвержены
риску и медицинские работники, работающие с кровью и патологоанатомы. РНК
вируса у инфицированных обнаруживается как в крови, так и в сперме и слюне.
Однако, концентрация вируса в этих жидкостях очень мала, в крови составляет
приблизительно 100 вирионов на мл.
Введение одноразовых шприцов, игл,
катетеров, проверка донорской крови и специальная обработка препаратов крови -
безусловный прогресс в борьбе с ВГС. В последние годы зарегистрировано, что
доля полового пути в структуре передачи вируса ГС значительно возросла и имеет
некоторые закономерности. При гетеросексуальных контактах с ВГС положительным
риск заражения составляет примерно 10 - 15%. (Балаян, Михайлов, 1999)
Гомосексуалисты - мужчины заражаются, приблизительно 95 - 99%. Риск передачи
HCV от матерей, инфицированных только этим вирусом, составляет в среднем
4,5-5,0% и расценивается как низкий. Степень риска резко возрастает при наличии
у матери коинфекции ВИЧ/HCV.
В патогенезе инфекции большую роль
играют свойства вируса, от которых зависит течение и исход гепатита С. Большую
роль играет генотип вируса. Считается, что лица, имеющие генотип 1в, болеют
тяжелее и труднее поддаются противовирусной терапии. Склонность к чрезвычайной
изменчивости вируса в течение инфекции у одного и того же человека
обусловливает неэффективность гуморального и клеточного иммунного ответа, то
есть вирус успешно ускользает от иммунной защиты хозяина. Вирус имеет много
генотипов, 6 из которых встречаются чаще всего и считаются основными.
Клиническое течение может быть
острым или хроническим, при котором выделяют латентную фазу и фазу реактивации,
стертым и очень редко, чаще всего при сочетании с гепатитом В-фульминантным.
Клиническая манифестация с выраженными проявлениями наблюдается у 10-15%
больных. Из которых 48 - 75% инфицированных переходят в хроническую форму или у
25-52% наступает спонтанное излечение. Субклиническое течение наблюдается у
85-90%, у которых, как правило, процесс приобретает хроническую форму, или же
из них 10-15% могут спонтанно излечиться (Львов, 2008)
Острый ГС протекает в легкой форме
обычно в течение 6-8 недель с медленным появлением в крови специфических
антител и чаще острая форма ГС остается нераспознанной. Латентная форма течения
клинически почти не проявляется и длительное время, до 20 лет, может быть не
выявлена. У больных может быть небольшая слабость, вялость, нерезкое ухудшение аппетита,
иногда тяжесть в правом подреберье. Умеренно увеличены печень и селезенка. он
долгое время сидит в клетках печени и размножается, при этом, клинически никак
не проявляясь, то есть у подавляющего большинства больных гепатитом C заболевание протекает без желтухи с
незначительными признаками интоксикации (Коршунова, 1999).
Клиническая картина хронической ВГC - инфекции характеризуется не
только признаками патологии печени, но и разнообразными внепеченочными
поражениями, которые обычно более выражены, чем «печеночные» симптомы, и имеют
место у 40 - 45% больных ГС. ВГС - это генерализованная инфекция, с вовлечением
в процесс не только печени, но и многих других органов и тканей. В таблице №4
перечислены возможные, наиболее часто встречающиеся внепеченочные проявления
хронического ВГС.
Таблица №4. Внепеченочные проявления
хронического ВГС (Соринсон, 1999)
|
Эндокринные
|
Гипертиреоз Сахарный диабет
|
|
Поражение глаз
|
Язвы роговицы Увеит
|
|
Нейромышечные и суставные
|
Синдром Гийена-Барре Артриты, артралгии
|
|
Почечные
|
Гломерулонефрит
|
|
Аутоиммунные
|
Аутоиммунный гепатит 1 и 2 типа Дерматомиозит
|
Итак в подавляющем большинстве
случаев острого гепатита С иммунной системе не удается элиминировать вирус. До
сих пор нет ясного представления, почему это происходит. Однако иммунная
система может оказывать существенное влияние на ВГC-инфекцию. В 15% случаев
острого гепатита С она эффективно уничтожает вирус, а у хронически
ВГC-инфицированных обеспечивает умеренное ограничение инфекции в течение почти
20 лет. К основным факторам иммунитета, обеспечивающим элиминацию вируса,
относят: высокий титр нейтрализующих антител, интенсивный и направленный против
многих вирусных антигенов и высокие уровни IFN-индуцируемых белков.
Предполагают, что именно такой ответ в первые месяцы острого гепатита С
обеспечивает успех при элиминации вируса. Возможно, ослабление какого-либо
звена антивирусных иммунных механизмов, позволяет вирусу развернуть набор своих
средств воздействия на иммунную систему. Длительная ВГC-персистенция может
привести к развитию В-клеточных лимфопролиферативаных нарушений, таких как
смешанная криоглобулинемия, злокачественная не-Ходжкинская лимфома и появление
органоспецифических и неспецифических аутоантител. Таким образом, хроническую
ВГC-инфекцию следует рассматривать как мультисистемное заболевание.
Несмотря на
многочисленные попытки создания лабораторных образцов вакцин против ВГC, ни
одна из них не является успешной. Можно надеяться, что будут найдены
нейтрализующие антигенные детерминанты с широкой перекрестной иммунореактивностью,
которые станут объектами конструирования вакцины.
1.4 Ассоциации групп
крови с гемотрансмиссивными вирусными инфекциями
В настоящее время, учитывая
постоянное увеличение количества ВИЧ-инфицированных среди населения всего мира,
а также эпидемиологическую настороженность в отношении парентеральных гепатитов
В и С, возрастающую необходимость и востребованность донорской крови и ее
компонентов, актуальным становится вопрос повышения вирусной безопасности
гемотрансфузий (Хаитов, Игнатьева 1992; Кудрявцева 2000; Покровский 2000;
Воробьев, 2006).
Широкое распространение получили
микст-инфекции вирусов иммунодефицита человека и гепатита С в связи с общими
путями передачи. Распространенность вируса гепатита С среди ВИЧ-инфицированных
варьирует от 33 до 59% (Jaeckel, 2001; Boctor, 2003; Kamal, 2004). В связи с
этим актуален вопрос улучшения диагностики трансмиссивных вирусных инфекций,
расширения спектра исследуемых параметров (Нетесова, 2000; Меньшиков, 2002).
На сегодняшний день
совершенствование молекулярно-генетических технологий при диагностике
социально-значимых инфекций, выявление склонности человека к инфицированию
вирусами иммунодефицита человека, гепатитов В и С являются вопросами,
требующими научного подхода (Гаврилов, 2005; Куандыкова, 2005).
Изучение отклонений в метаболизме у
вирусоносителей и больных гепатитами В и С в зависимости от групповой
принадлежности крови поможет найти оптимальный комплекс профилактических и
диагностических мероприятий, обеспечит индивидуальный подход в лечении.
Из истории этой проблемы известно,
что вскоре после открытия групп крови системы АВО были высказаны предположения
об ассоциациях этих антигенов с определенными заболеваниями (Штерн, 1965;
Фогель, Мотульски, 1989). Особенно активно проводились исследования в 20-е гг.
прошлого столетия. Некоторые авторы считали, что почти все широко
распространенные болезни ассоциируют с группами крови. В последующие годы,
из-за относительно малого материала и большого количества противоречий, многие
специалисты разочаровались в этой гипотезе, и долгое время считалось, что
группы крови не ассоциируют с заболеваниями.
Открытие Rh - конфликта матери и
плода впервые продемонстрировало возможность ассоциации групп крови с
заболеваниями.
По результатам диссертационного
исследования (Карсалян, 2007) на популяционном уровне, изучив карты 30 560
здоровых доноров, получен спектр распределения групп крови по системе ABO у
клинически здоровых жителей региона (таблица №5). По резус-фактору определено
следующее соотношение, не зависящее от пола: Rh «+» - 85%, Rh «-» -15%.
Таблица №5. Спектр распределения
групп крови у 30 560 здоровых доноров
|
Пол
|
Группы крови
|
|
0αβ(I)
|
Аβ(II)
|
Вα(III)
|
АВ(IV)
|
|
мужской
|
32,9%
|
34,3%
|
22,9%
|
9,9%
|
|
женский
|
33,3%
|
34,1%
|
23,4%
|
9,2%
|
Также проведены анализы выявления
вирусов иммунодефицита человека, гепатитов В и С среди 32 908 доноров и их
распределение в зависимости от групповой принадлежности крови и резус - фактора
(таблица №6).
Таблица №6. Распределение по группам
крови системы ABO здоровых доноров и носителей вирусных инфекций (%)
|
Обследованный контингент
|
Группы крови
|
|
0αβ(I)
|
Аβ(II)
|
Вα(III)
|
АВ(IV)
|
|
Здоровые мужчины
|
32,9
|
34,3
|
22,9
|
9,9
|
|
Здоровые женщины
|
33,3
|
34,1
|
23,4
|
9,2
|
|
Вирусоносители ВИЧ-инфекции
|
40,3
|
24,7
|
26,8
|
8,2
|
|
Вирусоносители гепатита В
|
31,1
|
40,4
|
18,4
|
10,1
|
|
Вирусоносители гепатита С
|
32,1
|
36,0
|
23,6
|
8,3
|
|
ВИЧ+гепатит С
|
36,9
|
21,9
|
31,3
|
9,9
|
Одинаковое с донорами распределение
инфицированных вирусными гепатитами В и С по резус-фактору: Rh «+», Rh «-» -
8,5:1,5%. При вирусе иммунодефицита человека соотношение - 9:1.
Скрининговое исследование по
выявлению ВИЧ-инфицированных до-наций проводилось в два этапа: первичное, а
затем пробы, оказавшиеся дважды серопозитивными в иммуноферментном анализе,
проходили подтверждение на наличие антител к вирусу иммунодефицита человека или
антигена с помощью метода иммунного блота. Антитела к белкам ВИЧ-инфекции
обнаружены у 160 лиц.
Инфицированных вирусом гепатита В с
положительной реакцией на HBsAg оказалось 322 человека. Серопозитивных по
суммарным антителам к вирусу гепатита С были 1 479 человек. Одновременно
оценивался факт возможного микст-инфицирования доноров. Серопозитивных по двум
инфекциям (ВИЧ-инфекция и гепатит С) было 38 человек.
С помощью метода полимеразной цепной
реакции обнаружены лица, находящиеся в стадии серонегативного «окна», т.е. в
стадии отсутствия или недостаточного количества патогена для выявления методом
иммуноферментного анализа: с ВИЧ-инфекцией обнаружен 1 человек, с вирусом
гепатита С - 34 человека.
Установлено, что среди
ВИЧ-инфицированных преобладают лица с 0αβ(I) группой крови - 40,3%; среди носителей вирусов гепатита В со Аβ(II) - 40,4%; гепатита С
также со Аβ(II) - 36,0%; сочетание носительства ВИЧ-инфекции и гепатита С
обнаружено у лиц с 0αβ(I) группой крови - 36,9%.
Таким образом, использование генамплификационых
методов в серонегативную фазу по ИФА позволило дополнить список вирусоносителей
гепатитов В, С и ВИЧ-инфекции. Обнаруженную связь вирусной инфекции с групповой
принадлежностью крови по системе ABO можно объяснить обсуждаемым в литературе
явлением «антигенной мимикрии», при которой детерминанты вирусов похожи на
детерминанты, определяющие групповую принадлежность крови (Кузнецов; 2000).
Всего обследовано 32 908 человек:
здоровые доноры обоего пола - 30560, из них 200 человек составили контрольную
группу; вирусоносители -1 915, в том числе: ВИЧ-инфекции - 76 человек; вируса
гепатита В - 322 человека; вируса гепатита С - 1 479 человек; ВИЧ-инфекция +
гепатит С - 38 человек; больные гепатитом - 433 человека: гепатитом В - 185
человек; гепатитом С - 248 человек. Всего обследованы 100 893 донации.
Исследования проводились на кафедре
фундаментальной и клинической биохимии с лабораторной диагностикой (зав.
кафедрой - заслуженный деятель науки РФ, доктор медицинских наук, профессор
Ф.Н. Гильмиярова) ГОУ ВПО «СамГМУ Россздрава» и в Самарской областной станции
переливания крови (главный врач - кандидат медицинских наук А.И. Косов).
Для выявления инфицированных ВИЧ -
инфекцией и гепатитами В и С использовали гетерогенный метод иммуноферментного
анализа (ELISA) (Приказ МЗ РФ №364 от 14 сентября 2001 г.).
Данным методом проводились первичный
скрининг; повторный скрининг; подтверждающий тест для гепатитов В и С; иммунный
блотинг для ВИЧ-инфекции.
Обнаружение антител к вирусу
иммунодефицита человека - 1 и вирусу иммунодефицита человека - 2 и ВИЧ -
антигена в крови производилось с помощью тест-систем «ДЖЕНСКРИН ПЛЮС ВИЧ АГ-АТ»
(«BIO-RAD», Франция); определение анти-ВИЧ антител - методом иммунного
блотинга. HBsAg определяли при помощи тест-систем «ИФЛ-HBsAg/M» (НПО «Диагностические
системы», Россия) и тест-систем «ВектогепВ-НВя-антиген / авто» («Вектор-Бест»,
Россия), «ИФА-HBsAg-подтверждающий тест» и «Вектогеп
B-HBs-антиген-подтверждающий тест-стрип». Суммарные антитела к вирусу гепатита
С (anti-HCV IgM и IgG) определяли при помощи тест-системы «ИФА-АНТИ-HCV» (НПО
«Диагностические системы») и «РекомбиБест анти-ВГС/авто» («Вектор-Бест»,
Россия), «ИФА-AHTH-HCV-CnEKTP-GM» и «РекомбиБест анти-ВГС подтверждающий тест»
тех же производителей.
Данные исследования выполнены на
спектрофотометрах: Sunrise (фирма «Тесап», Швейцария) и Sanofi (фирма «Bio-rad»
PR 1100, Франция), автоматизированном ИФА анализаторе Genesis RMP 150 («Тесап»,
Швейцария).
Качественная полимеразная цепная
реакция использовалась для выявления лиц, находящихся в стадии серонегативного
«окна». РНК вируса иммунодефицита человека определяли при помощи тест-систем
«АмплиСенс РНК-ВИЧ/ВКО-48» и РНК вируса гепатита С - «АмплиСенс РНК-ВГС/ВКО-48»
производства ЦНИИ Эпидемиологии МЗ РФ на автоматизированной станции Genesis RSP
150 («Тесап», Швейцария). Для амплификации использовали амплификаторы 2720
Thermal Cycler и GeneAmp PCR System 9700 («Applied Biosystems», США). Детекция
продуктов амплификации проводилась с помощью гибридизационного ферментного
анализа.
Правильность результатов
иммуноферментного анализа и полимеразной цепной реакции подтверждена участием в
Федеральной программе контроля качества (2006 г.).
2. Материал и методика
исследования
Материалом для настоящей дипломной
работы послужили данные, полученные в клинико - диагностической лаборатории КСТ
«Садко» г. Нижний Новгород. В исследовании участвовали пациенты Нижегородской
области в возрасте от 9 до 84 лет.
Сбор материала для данного
исследования проводился с января по ноябрь 2013 года. Всего, в этот период,
изучено 1000 медицинских карт, из которых получены следующие данные:
. Пол
. Возраст
. Группа крови
. Резус - фактор
. Наличие или отсутствие
вируса гепатита «С»
Полученные первичные данные были
подвергнуты биометрической обработке (Лакин, 1980, Смиряев, Кильчевский, 2007).
При определении генных частот и
частот генотипов по группе крови системы АВО была использована формула Харди -
Вайнберга для трехаллельной системы (Инге - Вечтомов, 1989). Так как ген,
определяющий группу крови, имеет три аллельных состояния, формула имеет
следующий вид:
p + q + r = 1
p - частота встречаемости гена Iᴬ;
q - частота встречаемости гена Iᴮ;
r - частота встречаемости гена Iᴼ, при этом
p IА + q IВ + r IО = 1, из чего следует:
p²IAIA + q²IBIB + r²IOIO + 2pIArIO
+ 2qIBrIO + 2pIAqIB
= 1
Для определения генных частот по
группе крови системы резус и генных частот пола пациентов была использована та
же формула, но для двухаллельной системы. Формула имеет следующий вид:
p Rh⁺ + q Rh⁻ = 1, где
p - частота встречаемости доминантного гена Rh⁺,
q - частота встречаемости рецессивного гена Rh⁻, из чего мы получаем
следующую формулу:
p² Rh⁺ Rh⁺ + 2 p Rh⁺q Rh⁻ + q² Rh⁻ Rh⁻ = 1
Представим аллели гена, определяющие
пол пациента как:
мужcкой ген - Y
женский ген - X, тогда:
p Y + q X = 1, где
p - частота встречаемости доминантного гена Y,
q - частота встречаемости рецессивного гена X, из чего мы получаем
следующую формулу:
p² YY + 2 pY qX + q² XX = 1
3. Результаты
исследования и их обсуждение
.1
Популяционно-генетический анализ встречаемости групп крови систем АВО и Rh среди пациентов КСТ
«Садко»
На популяционном уровне, изучив
карты 1000 пациентов (жителей региона) нами получен спектр распределения групп
крови по системе ABO, представленный в таблице №7.
Таблица №7. Соотношение частот групп
крови системы АВО среди пациентов
|
Группа крови
|
Частота встречаемости
|
|
количество
|
процент (%)
|
|
0αβ(I)
|
314
|
31,4%
|
|
Аβ(II)
|
366
|
36,6%
|
|
Вα(III)
|
220
|
22,0%
|
|
АВ(IV)
|
100
|
10,0%
|
Как видно из таблицы, 0αβ(I) и Аβ(II) группы представлены
практически в равных соотношениях. Обе эти группы доминируют над Вα(III) и АВ(IV) группами.
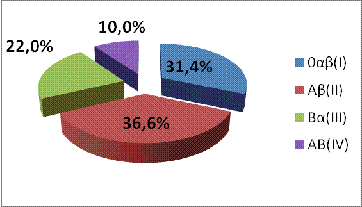
Рис. 2. Частотное
распределение групп крови системы АВО в популяции населения Нижегородской
области
На рисунке №2 показано наглядное
превалирование среди Нижегородцев с 0αβ(I) и Аβ(II) группами крови, что согласуется с частотным распределением
групп среди популяций населения Европы и мира в целом.
Изучение частотного распределения
групп крови системы резус (Rh) в исследуемой выборке нижегородцев позволило установить
соотношения групп, представленные в таблице №8.
Таблица №8. Соотношение частот групп
крови системы резус (Rh) среди пациентов клиники
|
Резус - фактор
|
Частота встречаемости
|
|
количество
|
процент (%)
|
|
Rh (+)
|
804
|
80,4%
|
|
Rh (-)
|
196
|
19,6%
|
Как показывает таблица, по резус -
фактору определено следующее соотношение, не зависящее от пола: Rh(+) - 80,4%, Rh(-) - 19,6%
3.2 Распространенность
заболеваний вирусным гепатитом С среди населения популяции нижегородцев на
примере пациентов КСТ «Садко»
Распространенность заболеваний
вирусным гепатитом С изучалась на примере разновозрастных пациентов клиники
современных технологий «Садко», расположенной в г. Н. Новгород. Все пациенты
являются жителями Нижегородской области. Идентификация у пациентов ВГС
проходила двумя методами:
метод полимеразной цепной реакции
(ПЦР)
метод иммуноферментного анализа
(ИФА)
Результаты обработки первичных
данных представлены в таблице №9.
Таблица №9. Соотношение частоты
инфицирования вирусом гепатита С в зависимости от группы крови системы АВО
пациентов КСТ «Садко»
|
Обследованный контингент
|
Частота встречаемости
|
|
количество
|
процент (%)
|
|
Инфицированные с 0αβ(I) группой крови
|
21
|
28,4%
|
|
Инфицированные с Аβ(II) группой крови
|
38
|
51,3%
|
|
Инфицированные с Вα(III) группой крови
|
13
|
17,5%
|
|
Инфицированные с АВ(IV) группой крови
|
2
|
2,8%
|
Как видно из таблицы, наиболее
часто, заболеваемость вирусом гепатита С встречается у пациентов со второй
группой крови.
По мнению Эфроимсона (1966), данные,
собранные в каком-либо одном или немногих источниках, мало когда говорят о
какой-либо связи, так как частота групп крови может отличаться среди городского
и сельского населения, сравнении областей и более глобально - стран.
Вирусный гепатит C представляет серьезную проблему
здравоохранению и находится в центре внимания ВОЗ, в связи с тем, что из года в
год происходит безудержный рост инфицированности. Стоит вопрос об обследовании
групп риска, что может способствовать раннему выявлению инфекции.
.3 Изучение зависимости
развития заболевания вирусным гепатитом С от групп крови системы АВО
Проблема взаимосвязи частоты
заболеваний с группами крови существует уже с 1953 года. На протяжении 12 лет
до 1965 года были собраны сведения о связи групп крови с различными
заболеваниями.
Первые исследования ассоциаций между
группой крови системы АВО и различными заболеваниями были проведены в 20- е
годы в институте экспериментальной биологии под руководством сотрудника Н.К.
Кольцовой. В ряде случаев была выявлена взаимосвязь между группой крови и
риском развития некоторых заболеваний.
В таблице №10 показано соотношение
групп крови здоровых и инфицированных пациентов.
Таблица №10. Соотношение частот
групп крови системы АВО среди здоровых и инфицированных ВГС пациентов КСТ
«Садко»
|
Группа крови
|
Здоровые пациенты
|
Инфицированные пациенты
|
|
количество
|
процент (%)
|
количество
|
процент(%)
|
|
0αβ(I)
|
293
|
31,7%
|
21
|
28,4%
|
|
Аβ(II)
|
328
|
35,4%
|
38
|
51,3%
|
|
Вα(III)
|
207
|
22,3%
|
13
|
17,5%
|
|
АВ(IV)
|
98
|
10,6%
|
2
|
2,8%
Согласно таблице №10 частота каждой
группы крови в исследуемой популяции составляет:
|
здоровые пациенты
|
инфицированные пациенты
|
|
0αβ(I) =
0,317 Аβ(II) = 0,354 Вα(III)
= 0,223 АВ(IV) = 0,106
|
0αβ(I) =
0,284 Аβ(II) = 0,513 Вα(III)
= 0,175 АВ(IV) = 0,280
|
|
так как все персоны первой группы крови являются гомозиготными
то, I (O) ⇒ IᴼIᴼ ⇒ r2
IᴼIᴼ
|
|
r2 IᴼIᴼ = 0,317 r Iᴼ = 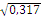 = 0,563 = 0,563
|
r2 IᴼIᴼ = 0,284 r Iᴼ = 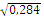 =
0,533 =
0,533
|
|
суммарная частота первой и второй групп крови составила:
|
|
p²IAIA + r²IOIO + 2pIArIO
= 0,354 + 0,317 = 0,671 или (pIA + rIO)² = 0,671
|
p²IAIA + r²IOIO + 2pIArIO
= 0,513 + 0,284 = 0,797 или (pIA + rIO)² = 0,797
|
|
суммарная частота аллелей I(0) и I(A) равна:
|
|
(pIA + rIO) = 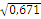 = 0,819 частота rIO = 0,563, тогда pIA =
0,671 - 0,563 = 0,108 = 0,819 частота rIO = 0,563, тогда pIA =
0,671 - 0,563 = 0,108
|
(pIA + rIO) =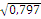 = 0,893 частота rIO = 0,533, тогда pIA =
0,797 - 0,533 = 0,264 = 0,893 частота rIO = 0,533, тогда pIA =
0,797 - 0,533 = 0,264
|
|
так как p IА + q IВ + r IО = 1, то величина q IВ будет равна:
|
|
q IВ = 1 - (p IА + r IО) = = 1 - (0,108 +
0,563) = 0,329
|
q IВ = 1 - (p IА + r IО) = = 1 - (0,264 +
0,533) = 0,203
|
|
таким образом, частоты аллелей в исследуемой популяционной
группе составили:
|
|
здоровые пациенты
|
инфицированные пациенты
|
|
p IА = 0,108 q IВ = 0,329 r IО = 0,563
|
p IА = 0,264 q IВ = 0,203 r IО = 0,533
|
|
отсюда генотипическая структура обследованных имеет следующий
вид:
|
|
0,012 IAIA
+ 0,108IBIB + 0,317IOIO
+ + 0,122IAIO + 0,37IBIO
+ 0,071IAIB = 1
|
0,07IAIA
+ 0,041IBIB + 0,284IOIO
+ + 0,282IAIO + 0,216IBIO
+ 0,107IAIB = 1
|
Вывод: группы здоровых и
инфицированных пациентов характеризуются разной степенью полиморфизма по
физиологическим признакам.
В таблице №11 показано соотношение
групп крови системы резус здоровых и инфицированных пациентов.
Таблица №11. Соотношение частот
групп крови системы резус среди здоровых и инфицированных ВГС пациентов КСТ
«Садко»
|
Резус-фактор
|
Здоровые пациенты
|
Инфицированные пациенты
|
|
количество
|
процент (%)
|
количество
|
процент (%)
|
|
Rh (+)
|
742
|
80,2%
|
62
|
83,8%
|
|
Rh (-)
|
184
|
19,8%
|
12
|
16,2%
|
Согласно таблице №11 частота каждой
группы крови системы резус в исследуемой популяции составляет:
|
здоровые пациенты
|
инфицированные пациенты
|
|
Rh (+) = 0,802 Rh (-) = 0,198
|
Rh (+) = 0,838 Rh
(-) = 0,162
|
|
так как все персоны резус - отрицательной группы крови
определяются гомозиготным состоянием гена то, Rh (-) ⇒ Rh¯ Rh¯ ⇒ q² Rh¯ Rh¯
|
|
q²
Rh¯ Rh¯ = 0,198 q Rh¯ =  = 0,445 = 0,445
|
q²
Rh¯ Rh¯ = 0,162 q Rh¯ = 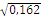 = 0,402 = 0,402
|
|
так как p Rh⁺ + q Rh⁻ = 1, то величина p Rh⁺ будет равна:
|
|
p Rh⁺ = 1 - q Rh⁻ = = 1 - 0,445 = 0,555
|
p Rh⁺ = 1 - q Rh⁻ = = 1 - 0,402 = 0,598
|
|
таким образом, частоты аллелей в исследуемой популяционной
группе составили:
|
|
здоровые пациенты
|
инфицированные пациенты
|
|
p Rh⁺ = 0,555 q Rh¯ = 0,455
|
p Rh⁺ = 0,598 q Rh¯ = 0,402
|
|
отсюда генотипическая структура обследованных имеет следующий
вид:
|
|
0,308 Rh⁺ Rh⁺ + 0,494 Rh⁺ Rh⁻ + + 0,198 Rh⁻ Rh⁻ = 1
|
0,358 Rh⁺ Rh⁺ + 0,48 Rh⁺ Rh⁻ + + 0,162 Rh⁻ Rh⁻ = 1
|
Вывод: группы здоровых и
инфицированных пациентов характеризуются разной степенью полиморфизма по
физиологическим признакам.
В таблице №12 показано соотношение
мужского и женского пола здоровых и инфицированных пациентов.
Таблица №12. Соотношение частот
встречаемости мужского и женского пола среди здоровых и инфицированных ВГС
пациентов клиники
|
Пол
|
Здоровые пациенты
|
Инфицированные пациенты
|
|
количество
|
процент (%)
|
количество
|
процент (%)
|
|
мужской
|
522
|
56,4%
|
46
|
62,1%
|
|
женский
|
404
|
43,6%
|
28
|
37,9%
|
Согласно таблице №12 частота
мужского и женского пола в исследуемой популяции составляет:
|
здоровые пациенты
|
инфицированные пациенты
|
|
p Y = 0,564 q X
= 0,436
|
p Y = 0,621 q X
= 0,379
|
|
так как все персоны женского пола являются гомозиготными, то
частота аллеля равна:
|
|
q ²XX = 0,436 q X =  =
0,66 =
0,66
|
q ²XX = 0,379 q X = 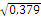 =
0,62 =
0,62
|
|
так как p Y + q X = 1, то величина p Y будет равна:
|
|
p Y = 1 - q X = = 1 - 0,66 = 0,34
|
p Y = 1 - q X = = 1 - 0,62 = 0,38
|
|
таким образом, частоты аллелей в исследуемой популяционной
группе составили:
|
|
здоровые пациенты
|
инфицированные пациенты
|
|
p Y = 0,34 q X
= 0,66
|
p Y = 0,38 q X
= 0,62
|
|
отсюда генотипическая структура обследованных имеет следующий
вид:
|
|
0,116 YY + 0,449YX + 0,435 XX = 1
|
0,145 YY + 0,471YX + 0,384 XX = 1
|
Вывод: группы здоровых и
инфицированных пациентов характеризуются разной степенью полиморфизма по
физиологическим признакам.
Наряду с корреляционным и
регрессивным анализом при изучении причинно - следственных отношений между
явлениями особенно ценным оказался метод дисперсионного анализа, предложенный
Фишером в 1925 году. Метод основан на разложении общей дисперсии
статистического комплекса на составляющие компоненты, сравнивая которые, друг с
другом посредством F - критерия, можно определить долю общей вариации изучаемого
(результативного) признака (Лакин, 1980).
Результаты наблюдений, подлежащие
дисперсионному анализу, группируются с учетом подразделений каждого
регулируемого фактора, воздействующего на признак. Если регулируемый фактор
оказывает влияние на признак, то оно непременно скажется на величине групповых
средних, которые будут существенно отличаться друг от друга.
Нулевая гипотеза (Но)
сводится к предположению, что генеральные межгрупповые средние равны и
дисперсии групп межгрупповые генеральные дисперсии не различаются.
Таблица №13
|
ВГС
|
Частота аллелей гена I
|
|
p IА
|
q IВ
|
r IО
|
|
наличие ВГС
|
0,264
|
0,203
|
0,533
|
|
отсутствие ВГС
|
0,108
|
0,329
|
0,563
|
Из таблицы №13 видно, что результаты
опыта варьируются, как по вариантам, так и по частоте аллелей. Чтобы
установить, случайны или не случайны различия между средними групп, подвергнем
эти данные дисперсионному анализу.
Дисперсионный анализ выявления
ассоциаций групп крови системы АВО с заболеванием вирусом гепатита С.
Таблица №14. Таблица расчета
вспомогательных величин
|
Частота аллелей гена I
|
Градации фактора А
|
Суммы
|
|
инфицированные
|
здоровые
|
|
|
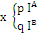
|
0,264
|
0,108
|
a
= 2
|
|
0,203
|
0,329
|
|
|
n
|
2
|
2
|
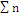 =N = 4 =N = 4
|
|
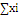
|
0,467
|
0,437
|
0,904
|
|
( ) ² ) ²
|
0,218
|
0,191
|
-
|
|
( ) ²/n ) ²/n
|
0,11
|
0,1
|
0,21
|
|
 ² ²
|
0,111
|
0,12
|
0,231
|
y = 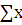 ² - ² -  = 0,231 - = 0,231 -  = 0,027 = 0,027
DA =  - - 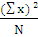 = 0,21
- 0,204 = 0,006z = Dy - DA = 0,027
- 0,006 = 0,021 = 0,21
- 0,204 = 0,006z = Dy - DA = 0,027
- 0,006 = 0,021
Результаты дисперсионного анализа
сводим в таблицу №15
Таблица №15
|
Вариация
|
Числа степеней свободы (k)
|
Суммы квадратов (D)
|
Средние квадраты (s²)
|
Дисперсионное отношение (Fф)
|
|
Межгрупповая
|
kA = a - 1= 2 - 1 = 1
|
DA = 0,006
|
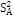 = =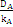 = = = 0,006 = 0,006
|
Fф= = = =1,75 =1,75
|
|
Внутригрупповая
|
kz = N - a = 4 - 2 = 2
|
Dz = 0,021
|
 = =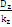 = = =0,0105 =0,0105
|
-
|
|
Общая
|
ky = N - 1 = 4 - 1 = 3
|
Dy = 0,027
|
 = =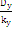 = = = 0,009 = 0,009
|
-
|
Так как дисперсионное отношение F = 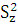 | | 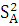 -
величина случайная, его необходимо сравнить с табличным (стандартным) значением
(Fst) критерия Фишера для принятого уровня значимости (a) и чисел степеней свободы kA и kz. -
величина случайная, его необходимо сравнить с табличным (стандартным) значением
(Fst) критерия Фишера для принятого уровня значимости (a) и чисел степеней свободы kA и kz.
Нулевая гипотеза опровергается, и
эффективность действия фактора А на результатный признак признается
статистически достоверной, если Fф ⩾ Fst. В противном случае
нулевая гипотеза сохраняется.
Сравнив дисперсионное отношение с
табличным значением мы получили: Fst = 200, из чего следует, что: Fф ˂ Fst
Вывод: исходя из наших расчетов,
достоверной связи между группой крови системы АВО и заболеванием вирусным ГС
нет.
Выводы
1. На популяционном уровне
получен спектр распределения групп крови по системе ABO у жителей
Нижегородского региона: среди пациентов 0αβ(I) - 31,4%; Аβ(II) - 36,6%; Вα(III) - 22,0%; АВ(IV) - 10,0%. По резус-фактору определено следующее
соотношение, не зависящее от пола: Rh (+) - 80,4%; Rh (-) - 19,6%.
. При анализе 1000
медицинских карт, установлено: инфицированных вирусом гепатита С - 74 (7,4%)
человек.
. Установлено, что среди
инфицированных ВГС преобладают лица со Аβ(II) группой крови - 51,3%.
. Инфицированием ВГС больше
подвержены лица с положительным резус - фактором - 83,8%.
. Установлено, что среди
инфицированных ВГЧ преобладают лица мужского пола - 62,1%.
. Достоверной связи между
группой крови системы АВО и заболеванием вирусным ГС не выявлено.
Заключение
Вирусный гепатит C представляет серьезную проблему для
здравоохранения и находится в центре внимания ВОЗ, в связи с тем, что из года в
год происходит безудержный рост инфицированности. Так как вирусный гепатит C в большинстве случаев протекает
субклинически, стоит вопрос об обследовании групп риска, что может
способствовать раннему выявлению инфекции.
В связи с чем, тема изучения
ассоциаций заболеваний вирусным ГС с группами крови системы АВО является
актуальной в связи с ростом инфекции.
В процессе выполнения дипломной
работы был осуществлен популяционно - генетический анализ встречаемости групп
крови системы АВО и системы резус среди пациентов клиники, проживающих в
Нижегородской области. Анализ показал, что исследованная группа пациентов, в
большинстве, имеет 0αβ(I) и Аβ(II) группы крови, с преимущественным преобладанием резус - положительной
(Rh+) группы.
Так же в работе был проведен
дисперсионный анализ, результат которого сводится к предположению, что
генеральные межгрупповые средние равны и дисперсии не различаются. Иными
словами, нулевая гипотеза исходит из того, что никакого систематического
действия регулируемых факторов на результативный признак не существует и
наблюдаемые между групповыми средними различия случайны.
И поскольку вопрос о
вакцинопрофилактике находится в состоянии разработки, на первый план выступает
неспецифическая профилактика - это санитарно - просветительная работа, особенно
с молодежью, чтобы подрастающие знали о возможных путях передачи вируса, также
играет важную роль комплексная программа борьбы с наркоманией. Знание правил
предупреждения от заражения обязательно для каждого человека.
Таким образом, можно сказать, что
цель и задачи данной работы достигнуты.
Список литературы
1. Аммосов А.Д. Гепатит В. - Новосибирск: Кольцово, 1998. 154 с.
2. Анохина Я.С. Инфекционные болезни. Полный справочник. -
М., 2007. - С. 444-449.
. Балаян М.С., Михайлов М.И. Вирусные гепатиты //
Энциклопедический словарь. М., 1999. - С. 113-115.
. Воробьев П.А., Донсков С.И., Городецкий. Очерки по
производственной и клинической трансфузиологии / Под редакцией А.И. Воробьева -
М.: «Ньюдиамед». - 2006. - с. 632.
. Гаврилов А.О. Лямина Е.В., Рипях B., Лунева О.И. Сифилис
и ВИЧ-инфекция у доноров крови и населения Подольского региона Московской
области // Вестник службы крови России. - 2005. - №1. - С. 19-21.
. Гаврилов О.К. «Пособие по трансфузиологии», 1980. 160 с.
. Дадашева А.Э., Мамедов М.К., Михайлов М.И. К 20-летию
идентификации вируса гепатита С // Журнал микробиологии, эпидемиологии и
иммунобиологии. - 2010. - №5. - С. 120-124.
. Дадашева А.Э., Михайлов М.И., Мамедов М.К. Аспекты
клинического значения иммунокомпpометации лиц из групп с высоким риском
паpентеpального инфицирования вирусами гепатитов В и С // Биомедицина. 2010.
№1. С. 16-19.
. Елисеев Ю.Ю. Инфекционные болезни. - М., 2008. - С. 440-446.
. Зотиков Е.А., Донсков С.И., Я. Янский. «Проблемы
гематологии и переливания крови», 1974, №7.
. Инге-Вечтомов С.Г. Генетика с основами селекции., М.: В.
шк., 1989.591 с.
. Карсалян Л.С.; Гемотрансмиссивные вирусные инфекции:
выявляемость, специфика метаболизма, связь с групповой принадлежностью крови -
автореф. дисс. д. м. н. - 2007 - 35 с.
. Коршунова Г.С. Эпидемическая ситуация по вирусным
гепатитам В, С, D в Российской Федерации // Гепатит В, С, D - проблемы диагностики, лечения и
профилактики. - М., 1999. - С. 111-112.
. Куандыкова Р.Ж. Сейдинов Ш.М., Сагатбаева H.A., Батыршаев
М.К. Безопасность гемотрансфузионной терапии // Вестник службы крови России. -
2005. - №1. - С. 26-27.
. Лакин Г.Ф. Биометрия: Учеб. пособие для биологич. спец.
вузов. - 3-е изд., перераб. и доп. - М.: Высш. школа, 1980. - 293 с.
. Ли Ч. Введение в популяционную генетику, пер. с англ. к.
б. н. Е.А. Салменковой и Е.Я. Тетушкина под ред. Ю.П. Алтухова, Л.А.
Животовекого - М.: Мир. 1978. 556 с.
. Лобзин Ю.В., Казанцев А.Г. Справочник по инфекционным
болезням. - С. - Петербург. - 1991. - С. 344-354.
. Львов Д.К. Медицинская вирусология. - М., 2008. - С. 234, 483-488.
. Львов Д.К., Самохвалов Е.И. Закономерности
распространения вируса гепатита C в России // Вопросы вирусологии. - 1999. - №4. - С. 157-161.
. Макарик Т.В., Романова Е.А. Вирусный гепатит С: новое в
эпидемиологии и методах диагностики // Гематология и трансфузиология. - 2001. -
№3. - С. 86-91.
. Маркеры ВГВ в сыворотках доноров городской больницы №2 г.
Тобольска / И.Г. Нетесова, О.Н. Гришаева, Г.А. Питомец и др. // Новости
«Вектор-Бест». - 1999. - №14. - С.З.
. Меньшиков В.В. Клиническая лабораторная аналитика в пяти
томах. М.: Агат-Мед, 2002. - 860 с.
. Михайлов М.И. От вируса гепатита С до ТТV и далее // Вирусные гепатиты.
Достижения и перспективы. - 2005. - №2. - С. 11-15.
. Нетесова И.Г. с соавт. (1999).
. Под ред. М.А. Умновой, «Групповые системы крови человека
и гемотрансфузионные осложнения», М. 1989
. Покровский В.В., Богословская Е.В., Шипулина О.А.,
Деткова Н.В.
Развитие лабораторной диагностики ВИЧ-инфекции // Клиническая
лабораторная диагностика. - 2000. - №9. - С. 12
. Самохвалов Е.И., и др. Особенности перинатальной передачи ВГС
// Вопросы вирусологии. - 2009. - №1. - С. 12-15.
28. Соринсон С.Н. Вирусные гепатиты в клинической практике. С. - Петербург. - 1999. - С. 183-188.
. Суздальцев А.А, Юрченко Н.Г., Рощупкин В.И. Вирусные
гепатиты: Методическое пособие. - Самара: СамГМУ, 2003. - 44 с.
. Учайкин В.Ф. Руководство по инфекционным болезням. - М.,
ГЭОТАР-МЕД, 2002. - С. 140-142.
. Фогель Ф., Мотульски А., Генетика человека: В 3- х т. Т.
1; пер. с англ. - М.; Мир - 1989 - 312 с.
. Хаитов P.M., Игнатьева Г.А. СПИД. - М.: Народная академия
культуры и общечеловеческих ценностей, 1992. - 352 с.
33. Boctor F.N., Ali N.M., Mohandas K., Uehlinger J. Absence
of D-alloimmunization in AIDS patients receiving D-mismatched RBCs //
Transfusion. - 2003. - Vol. 43. - №2. - P. 173-176.
. Jaeckel E. Treatment of acute hepatitis C with interferon
alfa-2b // N. Engl. J. Med. -2001. - Vol. 345. - P. 1452-1457.
. Kamal S.M. Pegylated Interferon a Therapy of Acute
Hepatitis C: Relation to Hepatitis C Virus - Specific T Cell Response Kinetics
// Hepatology. - 2004. - Vol. 39. - P. 1721-1731.
. Levine P, Stetson RE (1939). «An unusual case of
intragroup agglutination». JAMA 113: 126-7.
. Landsteiner K, Wiener AS (1940). «An agglutinable factor
in human blood recognized by immune sera for rhesus blood». Proc Soc Exp Biol Med 43: 223-4.
Похожие работы на - Полиморфизм по группам крови и их ассоциации с заболеванием вирусным гепатитом 'С' (на примере пациентов КСТ 'Садко')
|