Определение активности НАД(Ф)-зависимых дегидрогеназ нейтрофилов крови людей, больных панкреонекрозом
Введение
Деструктивный панкреатит традиционно считается
одной из самых сложных проблем в хирурги и из-за высокой летальности, которая
составляет 25-80%. В 40%-70% случаев у больных с панкреонекрозом происходит
инфицирование очагов деструкции. На фоне возникших гнойных осложнений
летальность в 2-3 раза выше, чем при стерильном панкреонекрозе и составляет
70%-85%. Летальность в ранние сроки развития панкреонекроза в основном связана
с развитием тяжелой интоксикации, гемодинамических нарушений и, как результат,
острой полиорганной недостаточности, определяемых как «триада смерти» при
панкреонекрозе
Цель работы - определение активности
НАД(Ф)-зависимых дегидрогеназ нейтрофилов крови людей, больных панкреонекрозом.
[1].
Исходя из цели, были определены следующие задачи:
. Проанализировать литературу по изучаемому
вопросу
. Провести сравнительный анализ активности
НАД(Ф)-зависимых дегидрогеназ нейтрофилов у здоровых людей и больных
панкреонекрозом
. Оценить состояние метаболизма нейтрофилов в
динамике лечения панкреонекроза
1. Обзор литературы
Панкреонекроз - одно из самых тяжелых
заболеваний среди всех патологий органов брюшной полости. Как правило,
панкреонекроз развивается вследствие панкреатита. При этом заболевании
нарушаются механизмы защиты, поджелудочная железа начинает сама себя
переваривать, и происходит омертвение (некроз) ее отдельных участков. [1].
1.1 Этиология панкреонекроза
Чаще всего причинами некроза поджелудочной
железы выступают злоупотребление алкогольными напитками и желчно-каменная
болезнь, приводящая к рефлюксу ферментов в поджелудочной железе. Чуть менее
часто к возникновению данной болезни приводят переедание и злоупотребление
жирной и жареной пищи.
Кроме перечисленных причин к появлению симптомов
панкреонекроза приводят: переизбыток витаминов Е и А, тяжёлые инфекционные и
вирусные заболевания, перенесённые ранее операции на поджелудочной, повреждение
протоков железы при проведении ретроградной панкреотографии, травмы
панкреатического ацинуса, тяжёлые и частые отравления, проблемы со свёртываемостью
крови внутри сосудов, характерные диссеминированному синдрому, а также проблемы
с микроциркуляцией при шоковом состоянии.
1.2 Патогенез панкреонекроза
Панкреонекроз развивается в три этапа. Первый
этап - фаза токсемии. При токсемии в крови больного появляются бактериальные
токсины, хотя самих микробов, выделяющих токсины, может в крови и не быть.
Поджелудочная железа во время этой фазы усиленно продуцирует ферменты. Второй
этап - образование абсцесса в самой железе и (или) окружающих ее органах. На
третьем этапе панкреонекроза начинаются гнойные изменения в ткани железы и
окружающей ее забрюшинной клетчатке. Прогноз болезни зависит от того, насколько
серьезно поражена поджелудочная железа, и быстро ли начато лечение.
Острый панкреатит (ОП) является одним из
распространенных хирургических заболеваний, летальность при котором в настоящее
время колеблется от 18 до 80%. Диагностика ОП сложна, особенно при
деструктивных его формах, при которых отсутствуют четкие лабораторные критерии
его проявления. Поэтому предельно важным становится быстрое использование
эффективных методов диагностической визуализации. В этой связи, применение УЗИ
и СКТ имеют первостепенное значение для постановки правильного диагноза и
выбора тактики лечения. Цель исследования - сравнить диагностические
возможности ультразвукового исследования и спиральной компьютерной томографии в
диагностике острого панкреатита и его осложнений.
Проведен анализ результатов обследования
клинико-лабораторных показателей, данных УЗИ и СКТ 48 пациентов ОП в возрасте
от 16 до 68 лет. Большинство обследованных (41 человек) составили лица в
возрасте до 50 лет. Мужчин было 37 (78%), женщин - 11 (22%). Инструментальное
обследование (УЗИ и СКТ) проводили при поступлении, в 1, на 2, 3, 5, 7, 10, 15
сутки заболевания. УЗИ проводили на аппаратах ”Acuson 128 XP”, ”Aloca 2000”
(Япония). При проведении УЗИ у больных с острым панкреатитом оценивались
размер, однородность структуры, контур, изменение эхогенности, наличие и
скопление жидкости вокруг и в тканях ПЖ. Спиральную компьютерную томографию
проводили на спиральном компьютерном томографе Siemens Somatom AR. Star
(Германия). Перед исследованием за 30-40 мин. желудочно-кишечный тракт
контрастировали 3% раствором водорастворимого контрастного вещества (ультравист
370), после чего проводили нативное сканирование с толщиной среза 10 мм и шагом
спирали 15 мм. На основе собственного опыта обследования пациентов с острым
панкреатитом зоны интереса выбирались от места деления левого нижнего - до
левого бронха до входа в малый таз. Это позволяет оценить состояние базальных
сегментов легких и выявить жидкость в плевральных полостях. Так, у всех больных
с панкреонекрозом, подтвержденным лабораторными исследованиями, был обнаружен
выпот в левой плевральной полости, у 2 (4%) выявлена деструкция в нижней доле
левого легкого, у 29 (61%) воспалительная инфильтрация легочной ткани нижней
доли левого легкого. Состояние органов грудной клетки позволило объективно
оценивать динамику развивающегося патологического процесса. [2, 3, 4, 5, 6,
7,8]
1.3 Лечение панкреонекроза
Обычно больные панкреонекрозом поступают в
больницу в фазе токсемии. Если в крови и моче больного повышен уровень амилазы,
с помощью медикаментов блокируется работа железы (панкреатическая секреция).
Обычно для этого внутриартериально вводится препарат 5-фторурацил.
Для того чтобы уменьшить панкреатическую
секрецию, снижают кислотность желудочного сока. Для этого используются,
например, циметидин и атропин.
Необходимо восстановить нарушенный отток секрета
поджелудочной железы. Для этого проводится специальное оперативное
вмешательство - эндоскопическая папиллосфинктеротомия (рассечение сфинктера
сосочка), после которого снижается уровень ферментов в крови и моче, и
самочувствие больного улучшается.
При панкреонекрозе проводят также детоксикацию,
или выведение из организма излишка ферментов и цитотоксинов. Это достигается с
помощью форсированного диуреза - внутривенного или внутриартериального введения
специальных препаратов, которые вызывают обильное и частое выделение мочи.
Длительность форсированного диуреза может достигать недели. Если у больного
панкреонекрозом в брюшной полости обнаруживают жидкость с примесью крови,
назначается лапароскопический диализ. Он проводится с помощью дренажей, через
которые откачивается жидкость и вводится раствор, состоящий из новокаина,
хлорида натрия и антибиотиков. Как только жидкость, оттекающая из брюшной
полости, становится прозрачной, а уровень амилазы в ней снижается, процедуру
прекращают. В случаях нарастающей интоксикации и при остром, панкреатите,
осложненном желтухой, проводят гемоодсорбцию, или очищение крови. Для того
чтобы избежать гнойных осложнений, больным панкреонекрозом назначают
антибактериальные препараты и антисептики, а также средства, улучшающие работу
иммунной системы. [9, 10, 11, 12]
1.4 Нейтрофилы
Нейтрофильные сегментоядерные лейкоциты -
преобладающая популяция белых клеток крови. В крови человека содержится 2,0-7,5
х 10^9 кл./л, что составляет 50-70% от общего числа лейкоцитов крови; также в
крови присутствует некоторое количество (0,04-0,З х 10^9 кл./л, т.е. 1-6%)
палочкоядерных форм нейтрофилов, не завершивших созревание. Ядро таких клеток
не сегментировано, хотя и имеет уплотненную структуру хроматина [20].
1.4.1 Жизненный цикл
В норме нейтрофилы человека вырабатываются
исключительно в костном мозге. Нейтрофилы происходят от полипотентной стволовой
клетки. Миелобласт - это первая распознаваемая клетка-предшественник, за
которой следует промиелоцит. Последний эволюционирует, когда образуются
классические лизосомные гранулы, называемые первичными, или азурофильными.
Первичная гранула содержит гидролазу, эластазу, миелопероксидазу и катионные
белки. Пролимфоцит делится с образованием миелоцита-клетки, ответственной за
синтез специфических, или вторичных, гранул, содержащих такие уникальные
вещества, как лактоферрин, белки, связывающие витамин Biz и, вероятно, цитохром
b, гистаминазу и рецепторы для некоторых хемоаттрактантов и факторов
(промоторы), усиливающих адгезию. Вторичные гранулы не содержат кислые гидролазы
и поэтому не относятся к классическим лизосомам. Они легко высвобождаются во
внеклеточное пространство и их мобилизация, вероятно, важна для модуляции
воспаления. На последних стадиях созревания деление клеток не происходит, но
клетка через стадию метамиелоцита переходит в стадию нейтрофила с ядром в форме
колбаски. Как только последний созревает, ядро приобретает сегментарную
конфигурацию.
При тяжело протекающих острых бактериальных
инфекциях в цитоплазме нейтрофилов становятся четко видны гранулы, получившие
название токсических грануляций. Они представляют собой незрелые или аномально
окрашивающиеся азурофильные гранулы. При инфекции обнаруживаются и
цитоплазматические включения, так называемые тельца Доэля, по-видимому,
представляющие собой фрагменты эндоплазматического ретикулума. При острых
бактериальных инфекциях часто выявляют крупные нейтрофильные вакуоли,
образованные в процессе пиноцитоза (интернализация) мембраны.
В кровотоке присутствует только 1-2% общего
числа зрелых нейтрофилов в организме (остальные представлены в тканях,
преимущественно в костном мозгу). Срок их пребывания в циркуляции составляет
7-10 ч. После кратковременной циркуляции нейтрофилы покидают кровоток и
мигрируют в ткани. Примерно 30% нейтрофилов, выходящих из кровотока, мигрируют
в печень и костный мозг; около 20% - в легкие (точнее в их микроциркуляторное
русло); около 15% - в селезенку. Через 3-5 суток пребывания в тканях нейтрофилы
подвергаются спонтанному апоптозу, т.е. запрограммированной гибели, и их
фагоцитируют резидентные макрофаги, что предотвращает нанесение ущерба
окружающим клеткам. В настоящее время допускается возможность превращения
небольшой фракции тканевых нейтрофилов в долгоживущую форму и даже их
дифференцировки в макрофаги. В целом функция тканевых нейтрофилов остается
невыясненной [20].
1.4.2 Морфология
Диаметр нейтрофилов составляет 9-12мкм. Им
свойственна уникальная морфология: ядро сегментированное (обычно состоит из 3
сегментов) с плотно упакованным хроматином; цитоплазма содержит нейтральные (по
данным окрашивания) гранулы, что и определяет название этих клеток. Особенности
хроматиновой структуры ядра (недоступность промоторных участков для
дифференцировочных факторов) значительно ограничивает экспрессию генов и синтез
макромолекул нейтрофилами de novo. Тем не менее, вопреки ранее существовавшим
представлениям, нейтрофилы сохраняют способность к биосинтезу, хотя и в
ограниченном масштабе. [13, 14, 15, 16]
1.4.3 Функции
Наибольшее своеобразие свойственно гранулам
нейтрофилов, представляющим разновидность лизосом. Различают 4 разновидности
гранул этих клеток: азурофильные (первичные), специфические (вторичные),
желатиназные (третичные) и секреторные везикулы. Специфические гранулы содержат
ферменты, проявляющие свою активность при нейтральных и слабощелочных значениях
рН: лактоферрин, щелочную фосфатазу, лизоцим, а также белок BPI, связывающий
витамин В12. Маркерами этой разновидности гранул служат лактоферрин и
мембранная молекула CD66. В специфических гранулах содержится большое
количество фермента NADPH-оксидазы, катализирующего кислородный взрыв и
образование активных форм кислорода - главных факторов бактерицидности
фагоцитов. Азурофильные гранулы содержат широкий набор гидролаз и других
ферментов, активных при кислых значениях рН: миелопероксидазу, а-фукозидазу,
5'-нуклеотидазу, β-галактозидазу,
арилсульфатазу, а-маннозидазу, N-ацетилглюкозаминидазу, β-глюкуронидазу,
кислую глицерофосфатазу, лизоцим (мурамилидазу), нейтральные протеазы
(серпроцидины) - катепсин G, эластазу, коллагеназу, азурацидин, а также
дефензины, кателицидины, лактоферрин, гранулофизин, кислые глюкозаминогликаны и
другие вещества. Маркерами азурофильных гранул служат фермент миелопероксидаза
и мембранная молекула CD63. Желатиназные (третичные) гранулы в соответствии с
названием содержат желатиназу. Наконец, четвертый тип гранул - секреторные
везикулы - содержат щелочную фосфатазу.
При стимуляции нейтрофилов в первую очередь
происходит высвобождение содержимого секреторных пузырьков. Преодолевать
базальные мембраны нейтрофилам позволяет секрет желатиназных гранул.
Специфические, а затем азурофильные гранулы сливаются с фагосомами в процессе
фагоцитоза (через 30 с и 1-3 мин после поглощения частицы соответственно).
Комплекс бактерицидных факторов, присутствующих в гранулах, обеспечивает
разрушение многих микроорганизмов. Наиболее эффективно содержимое гранул
повреждает стрептококки, стафилококки и грибы (включая кандиды). Содержимое
гранул, особенно азурофильных, может секретироваться в результате дегрануляции.
После дегрануляции восстановления гранул не происходит. Наряду с
моноцитами/макрофагами нейтрофилы рассматривают как основные фагоцитирующие
клетки. При этом нейтрофилы мигрируют из крови в очаг воспаления значительно
быстрее моноцитов. Скорость мобилизации нейтрофилов дополняется их способностью
развивать метаболические процессы («кислородный взрыв») в течение секунд. Все
это делает нейтрофилы оптимально приспособленными для осуществления ранних
этапов иммунной защиты в рамках острой воспалительной реакции.
1.4.4 Метаболизм
Под метаболизмом понимают постоянно происходящий
в клетках живых организмов обмен веществ и энергии. В различных процессах
метаболизма из простых веществ при участии ферментов синтезируются
высокомолекулярные соединения, в свою очередь сложные молекулы расщепляются на
более простые. Реакции биологического синтеза называются анаболическими (греч.
anabole подъем), а их совокупность в клетке - анаболизмом, или пластическим
обменом (греч. plastos вылепленный, созданный). Совокупность реакций
расщепления сложных молекул на более простые носит название катаболизма (греч.
katabole разрушение), или энергетического обмена. Примерами таких реакций
является расщепление липидов, полисахаридов, белков и нуклеиновых кислот в
лизосомах, а также простых углеводов и жирных кислот в митохондриях. В
результате процессов катаболизма высвобождается энергия. Существенная ее часть
запасается в виде высокоэнергетичных химических связей АТФ.
Пластический и энергетический обмены неразрывно
взаимосвязаны. Процессы расщепления осуществляют энергетическое обеспечение
процессов синтеза, а также поставляют необходимые для синтеза строительные
вещества. Процессы метаболизма происходят в соответствии с генетической
программой клетки, реализуя ее наследственную информацию[17].
Энергетический обмен в клетке. Синтез АТФ
происходит главным образом в митохондриях и обеспечивается в основном энергией,
выделяющейся при расщеплении глюкозы, но могут использоваться и другие простые
органические соединения - сахара, жирные кислоты и аминокислоты.[18]
Гликолиз - это последовательность ферментативных
реакций, приводящих к превращению глюкозы в пируват с одновременным
образованием АТФ. На первой, предварительной стадии в лизосомах происходит
образование простых органических молекул путем расщепления ди- и полисахаридов.
Выделяющееся при этом небольшое количество энергии рассеивается в виде тепла.
Второй этап гликолиза происходит в цитоплазме без участия кислорода и
называется анаэробным гликолизом. Анаэробный гликолиз представляет собой
сложный многоступенчатый процесс из десяти последовательных реакций. Каждая
реакция катализируется специальным ферментом. В итоге глюкоза расщепляется до
пировиноградной кислоты: С6Н12О6(глюкоза) + 2Н3РО4 + 2АДФ → 2С3Н4О3(ПВК)
+ 2АТФ + 2Н2О пировиноградная кислота восстанавливаются в молочную кислоту
С3Н6О3. Аэробный гликолиз. При наличии достаточного количества кислорода
дальнейший процесс расщепления ПВК происходит уже не в цитоплазме, а в
митохондриях, и включает несколько десятков последовательных реакций, каждая из
которых обслуживается своим комплексом ферментов. Молекулы ПВК под действием
ферментов (и кофермента НАД - никотинамидадениндинуклеотида) поэтапно
окисляются сначала до уксусной кислоты, а затем, в цикле Кребса, до углекислого
газа и воды (медленное горение). В процессе окисления образуются сложные
молекулярные соединения с присоединенными к ним атомами водорода.
Молекулы-переносчики подхватывают и перемещают электроны этих атомов по длинной
цепи ферментов от одного к другому. На каждом шаге электроны вступают в окислительно-восстановительные
реакции и отдают свою энергию, которая идет на перемещение протонов на внешнюю
сторону внутренней мембраны митохондрии. Таким образом, кислородное расщепление
резко увеличивает эффективность энергетического обмена и играет основную роль в
аккумулировании энергии.
Цикл трикарбоновых кислот был открыт биохимиком
Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания
пирувата, главным источником которого является гликолитическое превращение
углеводов. Таким образом, цикл Кребса - общий конечный путь окисления
ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе
катаболизма большая часть органических молекул, играющих роль «клеточного
топлива»: углеводов, жирных кислот и аминокислот. Образовавшийся в результате
окислительного декарбоксилированияпирувата в митохондриях ацетил-КоА вступает в
цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми
последовательных реакций [18].
2. Материалы и методы
.1 Биолюминесцентный метод
определения активности НАД(Ф)-зависимых дегидрогеназ в нейтрофилах
панкреонекроз нейтрофил кровь
лактатдегидрогеназа
Биолюминесцентное определение активности
НАД(Ф)-зависимых дегидрогеназ проводится по ранее разработанным методикам
(Савченко А.А., Сунцова Л.Н., 1989; Савченко А.А., 1991).Суспензию выделенных
нейтрофилов, содержащую клетки в концентрации 1,0 млн/мл, разрушают путем
заморозки-разморозки осмотического лизиса с добавлением дистиллированной воды
(1:5 по объему) и 1,0-2,0 мМдитиотреитола.
Определение активности НАД(Ф)-зависимых
дегидрогеназ в лимфоцитах и нейтрофилах проводили биолюминесцентным методом.
Данным методом определялась активность Г6ФДГ, глицерол-3-фосфатдегидрогеназы
(Г3ФДГ), лактатдегидрогеназы (ЛДГ), малатдегидрогеназы (МДГ), НАДФ-зависимой
малатдегидрогеназы (НАДФМДГ), НАДФ-зависимой глутаматдегидрогеназы (НАДФГДГ),
НАД-зависимой глутаматдегидрогеназы (НАДГДГ), НАД-зависимой
изоцитратдегидрогеназы (НАДИЦДГ), НАДФ-зависимой изоцитратдегидрогенаы
(НАДФИЦДГ), ГР.
Биолюминесцентное определение активности
дегидрогеназ нейтрофилов проводится по самостоятельно разработанной методике. В
150 мкл инкубационной смеси, содержащей соответствующий субстрат и кофактор,
вносили 50 мкл суспензии разрушенных нейтрофилов. Необходимо отметить, что в инкубационную
смесь для определения активности НАДФИЦДГ и НАДИЦДГ дополнительно добавляли АДФ
в концентрациях 2,15 и 1,3 мМ соответственно. В среду инкубации для определения
уровней НАДНГДГ и НАДФНГДГ дополнительно вносили NH4Cl в концентрации 5,0 мМ, а
для определения ГР - ЭДТА в концентрации 0,5 мМ.
Таблица 1 - Концентрация субстратов, кофакторов
и показатели рН среды для определения активности НАД(Ф)-зависимых дегидрогеназ
в лимфоцитах биолюминесцентным методом
|
Фермент
|
Субстрат
- мМ
|
Кофактор
- мМ
|
рН
буфера
|
|
Г6ФДГ
|
Г6Ф
- 1,5
|
НАДФ
- 0,025
|
9,8
|
|
Г3ФДГ
|
Г3Ф
- 0,5
|
НАД
- 0,35
|
9,8
|
|
ЛДГ
|
Лактат
- 2,0
|
НАД
- 0,50
|
9,0
|
|
МДГ
|
Малат
- 2,0
|
НАД
- 2,50
|
9,8
|
|
НАДФМДГ
|
Малат
- 7,5
|
НАДФ
- 0,375
|
9,8
|
|
НАДФГДГ
|
НАДФ
- 1,65
|
9,8
|
|
НАДГДГ
|
Глутамат
- 8,7
|
НАД
- 8,10
|
9,8
|
|
НАДИЦДГ
|
Изоцитрат
- 5,0
|
НАД
- 5,0
|
7,8
|
|
НАДФИЦДГ
|
Изоцитрат
- 1,375
|
НАДФ
- 0,075
|
7,4
|
|
НАДНЛДГ
|
Пируват
- 0,25
|
НАДН
- 0,005
|
7,0
|
|
НАДНМДГ
|
Оксалоацетат
- 0,5
|
НАДН
- 0,005
|
7,0
|
|
ГР
|
GSH
- 0,5
|
НАДФН
- 0,0025
|
7,4
|
|
НАДФНГДГ
|
Оксоглутарат
- 100
|
НАДФН
- 0,0025
|
7,4
|
|
НАДНГДГ
|
Оксоглутарат
- 100
|
НАДН
- 0,0025
|
7,0
|
Примечание: среды с рН 9,0 и 9,8 готовили на
Трис-HCl буфере; с рН 7,0, 7,4 и 7,8 - на К+,Na+-фосфатном буфере.
После инкубации при 37°°С в течение
30 минут к 200 мкл инкубационной смеси добавляли 50 мкл флавинмононуклеотида
(ФМН) в концентрации 1,5´10-5М, 50
мкл 0,0005% миристинового альдегида и 10 мкл ферментативной системы
НАД(Ф)Н:ФМНоксидоредуктаза-люцифераза (все реактивы биолюминесцентной системы
разведены в 0,1 М К+,Na+-фосфатном буфере с рН 7,0). После смешивания
биолюминесцентных реактивов и инкубационной пробы, были проведены измерения с
помощью биолюминометра CL3606М (СКТБ “Наука”, Красноярск). Ферментативная
система НАД(Ф)Н: ФМНоксидоредуктаза-люцифераза изготовлена из очищенных
методами ионообменной хроматографии и гель-фильтрации люциферазы из
Photobacterium leiognathi и оксидоредуктазы из Vibrio fischeri в Институте
биофизики СО РАН г.Красноярска (Тюлькова Н.А., Антонова Э.В., 1991).
Учитывая, что в клетках имеется
определенное количество субстратов для течения различных метаболических
реакций, в том числе и катализируемых исследуемыми ферментами, нами
определялись показатели, условно названные “субстратный фон ферментов”.
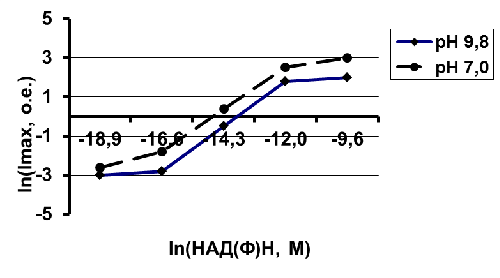
Рис. 1 - Интенсивность
биолюминесценции НАД(Ф)Н: ФМН оксидоредуктазы-люциферазы в зависимости от
концентрации НАД(Ф)Н и рН буфера
Определение производили в тех же
условиях, что и для вышеперечисленных дегидрогеназ, но в инкубационную смесь
вместо соответствующего субстрата вносили буфер. В результате измерения
свечения на биолюминометре получаются относительные значения активности
исследуемых ферментов. Чтобы получить абсолютные значения активности необходимо
построить график зависимости интенсивности биолюминесценции от концентрации
НАД(Ф)Н (калибровочный график). Для этого 200 мкл стандартного раствора НАД(Ф)Н
в диапазоне 10-9 - 10-4 М вносили в кюветы биолюминометра, содержащие
биолюминесцентные реактивы в концентрациях указанных выше, после чего
производилось измерение интенсивности биолюминесценции. В связи с широким
диапазоном рН буферов, используемых для определения дегидрогеназной активности,
а также рН-зависимостью биолюминесценции ферментативной системы (Тюлькова Н.А.,
Антонова Э.В., 1991), калибровочные графики строились для каждого рН буфера.

где D[C] - разница
концентраций НАД(Ф)Н в пробах “фермент” и “фон фермента”;- объем пробы в
миллилитрах; Т - время инкубации.
Активность НАД(Ф)-зависимых дегидрогеназ
выражали в ферментативных единицах на 104 клеток, где 1 Е=1 мкмоль/мин (Березов
Т.Т., Коровкин Б.Ф., 1998). В связи с широким диапазоном рН буферов,
используемых для определения дегидрогеназной активности, а также
рН-зависимостью биолюминесценции ферментативной системы (Строев В.А., 1986),
калибровочные графики строились для каждого рН буфера.
2.2 Статистические методы
исследования
По результатам исследования в пакете электронных
таблиц MS Excel 2010 была сформирована база данных, на основе которой с помощью
пакета прикладных программ и Statistica 8,0 производился статистический анализ.
Выборку описывали с помощью подсчета медианы (Me) и интерквартильного размаха в
виде 25 и 75 процентилей (С25 и С75). Достоверность различий между показателями
контрольной и опытных групп оценивали по непараметрическому критерию
Mann-Whitney. Результаты статистической обработки сведены в таблицах и
использованы в рисунках. [6, 14].
3. Результаты и обсуждение
Состояние метаболизма нейтрофилов при
панкреонекрозе имеет значительные особенности (рис.1-2): в период 4- 7 дней лечения
повышены уровни активности НАДФГДГ (p=0,043) и МДГ (рис.2) при снижении уровня
активности ЛДГ (рис.1) в нейтрофилах больных сравнению с группой контроля. В
период 10-14 дней лечения наблюдалось увеличение активности МДГ (рис.2), НАДГДГ
(p=0,021) и НАДИДГ (p=0,004) нейтрофилов больных панкреонекрозом. В период
20-24 дней лечения в нейтрофилах больных панкреонекрозом повышены уровни
активности НАДГДГ (p=0,03) при снижении уровня активности ЛДГ (рис.1).

Рис. 2 - Активность ЛДГ нейтрофилов крови
здоровых людей и больных панкреонекрозом в динамике лечения
Рис. 3 - Активность МДГ нейтрофилов крови
здоровых людей и больных панкреонекрозом в динамике лечения
В настоящее время не вызывает сомнений, что в
основе функциональных проявлений нейтрофилов лежат их метаболические реакции.
Особенно высокой информативностью для исследования метаболизма нейтрофилов
обладают окислительно-восстановительные ферменты. Это связано с тем, что,
являясь основными переносчиками электронов в клетке, они осуществляют ключевые
реакции клеточного метаболизма, и координируют сопряжённые метаболические пути.
Лактатдегидрогеназа - фермент, принимающий
участие в реакциях гликолиза. Лактатдегидрогеназа катализирует превращение
лактата в пируват, при этом образуется НАДН+. Малатдегидрогеназа - ключевой
фермент цикла трикарбоновых кислот, катализирующий
окислительно-восстановительную реакцию превращения малата в оксалоацетат.
Коферментом этой реакции является НАД. Глутаматдегидрогеназа- фермент,
катализирующий взаимопревращение L-глутаминовой и 2-оксоглутаровой кислот.
Различают глутаматдегидрогеназы специфичные к НАД, НАД и НАДФ или только к
НАДФ. Изоцитратдегидрогеназа катализирует дегидрогенирование изоцитрата с образованием
оксалосукцината и затем декарбоксилирование оксалосукцината с образованием
альфа-кетоглутарата
Одна из них, НАД+-зависимая, найдена только в
митохондриях. Две другие формы фермента являются НАДФ+-зависимыми , причем одна
из них также находится в митохондриях, а другая в цитозоле. Окисление
изоцитрата, связанное с работой дыхательной цепи, осуществляется почти
исключительно NAD+-зависимым ферментом. Таким образом метаболизм нейтрофилов
при панкреонекрозе характеризуется ингибированием анаэробного гликолиза при
активации цикла Кребса в период с 4 по 24 сутки после поступления в стационар.
Заключение
. Проанализировали литературу по изучаемому
вопросу.
. Провели сравнительный анализ активности
НАД(Ф)-зависимых дегидрогеназ нейтрофилов здоровых людей и больных
панкреонекрозом.
. Метаболизм нейтрофилов при панкреонекрозе
характеризуется ингибированием анаэробного гликолиза при активации цикла Кребса
в период с 4 по 24 сутки после поступления в стационар.
Список литературы
1.
Абакумов М.М., Булава Г.В., Боровкова Н.В., Хватов В.Б. Клиническая оценка
параметров иммунитета у хирургических больных с синдромом системного
воспалительного ответа // Хирургия. - 2007. - № 8. - С. 24-28.Ю.А. Мазинг -
Клиническая морфология нейтрофильных гранулоцитов. - Л.: - 1988. - С. 102 -
137.
.
Биссет Р. Дифференциальный диагноз при абдоминальном ультразвуковом
исследовании: перевод с англ. / под ред. С.И. Пиманова / Р. Биссет, А. Хан. -
М.: Мед. лит., 2001. - 272 с.
.
Ранняя диагностика и алгоритм хирургической тактики при остром деструктивном
панкреатите. Ю.Г. Шапкин, С.Ю. Берёзкина, В.П. Токарев. 2007.
.
Андреев А.В. Лучевые методы исследования в диагностике острого панкреатита
(обзор литературы) / А.В. Андреев, А.Г. Приходько, И.И. Щербина // Мед.
визуализация. - 2003. - №3. - С. 19-25.
.
Лучевая диагностика острого панкреатита / А.В. Араблинский [и др.]// Мед.
визуализация. - 2000. - С. 2-14.
.
Медицинская энзимология. Т.Н. Попова Т.И. Рахманова С.С. Попов.
Издательско-полиграфический центр Воронежского государственного университета.
2008.
.
Белобородова Н.В., Дмитриева И.Б., Черневская Е.А. Сепсис-индуцирован- ный
иммунопаралич: патогенез, диагностика и возможные пути коррекции // Анестезиол.
реаниматол. - 2008. - № 6. - С. 42-48.
.
Применение малоинвазивных технологий в комплексном лечении больных
панкреонекрозом В.Н. Эктов, О.Е. Минаков.
.
Данилов М.В. Хирургия поджелудочной железы / М.В. Данилов, В.Д. Федоров. - М.:
Медицина, 1995.
.
Савельев, В.С. Роль прогнозирования течения панкреонекроза в выборе лечебной
тактики / В.А. Кубышкин, Г.Б. Казанцев // Хирургия. 2000. - №9. - С. 72-79.
.
Зубарев, А.В. Ультразвуковой мониторинг лечения острого панкреатита./ А.В.
Зубарев, Н.П. Агафонов, И.В. Каленова // Мед. визуализация. 2000. №4. - С.
21-24.
.
И.Г. Герасимов, Д.Ю. Игнатов - Особенности активации нейтрофилов invitro. //
Цитология. - 2004. - Т. 46. - № 12. - С. 155 - 158.
.
В.Е. Пигаревский - Клиническая морфология нейтрофильных гранулоцитов. Л.: -
1988. - С. 87 - 101.
.
Тарусов Б.Н., Поливода А.Н., Журавлев А.И., Секамова Е.Н. (1962) цитология, 4,
696.
.
Первова О.В., Винник Ю.С., Черданцев Д.В., Титова Н.М. Возможности
антигипоксантной терапии цитофлавином при лечении деструктивного панкреатита//
Сибирское медицинское обозрение.- 2012. Т. 75.- № 3.- С. 23.
.
Сравнительная оценка возможностей ультразвукового исследования и спиральной
компьютерной томографии в диагностике острого панкреатита и его осложнений.
В.И. Белоконев, И.П. Королюк, А.Е. Юдин - 2007.
.
Стерильный панкреонекроз - антибактериальная профилактика и терапия. В.П.
саганов, В.Е. Хитрихеев, Е.Н. Цыбиков, Б.Г. Гармаев. 2010.
.
Ярилин A.A. Основы иммунологии: учебник. М.: ГЭОТАР-Медиа. 2010.752 с.