|
река
|
Место отбора пробы воды
|
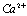 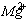  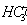 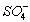  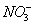 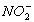 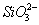 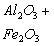
|
|
|
|
|
|
|
|
|
|
|
Днепр
|
г. Запорожье
|
51,9
|
15,0
|
8,6
|
188,0
|
29,67
|
15,84
|
2,4
|
0,2
|
4,0
|
4,4
|
Дано:
C(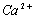 )= 51,9 мг/кг = 2,595 мг∙экв/л;
)= 51,9 мг/кг = 2,595 мг∙экв/л;
С(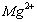 )= 15,0 мг/кг = 1,24 мг∙экв/л(
)= 15,0 мг/кг = 1,24 мг∙экв/л(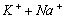 ) = 8,6 мг/кг = 0,24 мг∙экв/л;(
) = 8,6 мг/кг = 0,24 мг∙экв/л;( ) =188 мг/кг = 3,08 мг∙экв/л;(
) =188 мг/кг = 3,08 мг∙экв/л;(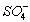 ) =29,67 мг/кг = 0,62 мг∙экв/л;(
) =29,67 мг/кг = 0,62 мг∙экв/л;( ) =15,84 мг/кг = 0,44 мг∙экв/л;(
) =15,84 мг/кг = 0,44 мг∙экв/л;(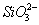 ) = 4,0 мг/кг = 0,05 мг∙экв/л;(
) = 4,0 мг/кг = 0,05 мг∙экв/л;( ) =4,4 мг/кг = 0,165 мг∙экв/л;
) =4,4 мг/кг = 0,165 мг∙экв/л;
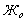 -?
-?
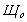 -?
-?
Решение:
Чтобы
определить эквивалентную концентрацию раствора 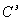 в
в  , необходимо найти объемную концентрацию растворенного
вещества и разделить ее на эквивалентную массу:
, необходимо найти объемную концентрацию растворенного
вещества и разделить ее на эквивалентную массу:
 ,
,
где z - химическая валентность иона.
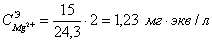
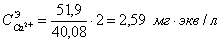
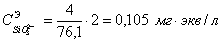

В
воде присутствуют анионы  и
и 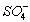 , значит
нужно определить бикарбонатную щелочность и силикатную:
, значит
нужно определить бикарбонатную щелочность и силикатную:
 ;
;
Так
как 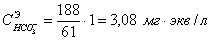 , то
, то
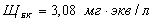
Силикатная
щелочь:
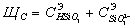
Так
как 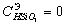 , то
, то
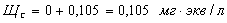 .
.
Далее
определяем общую щелочность воды.
Щелочность
воды выражается количеством затраченной на титрирование кислоты с индикатором -
метилоранж (следовательно, будет обуславливаться не только ионами 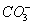 ,
,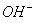 ,
,  , но и любыми другими, реагирующими с кислотами, в том
числе и с гуматами) и определяется по следующей формуле:
, но и любыми другими, реагирующими с кислотами, в том
числе и с гуматами) и определяется по следующей формуле:

Так
как у нас 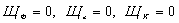 , то остается:
, то остается:
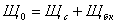
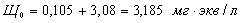
В
водах первой группы различают жесткость общую, карбонатную  , и некарбонатную (
, и некарбонатную ( ), а
также кальциевую (
), а
также кальциевую (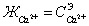 ), и магниевую (
), и магниевую (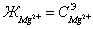 ), между
которыми существует следующая зависимость:
), между
которыми существует следующая зависимость:
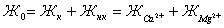
Так
как  , а
, а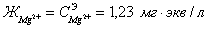 , то
, то
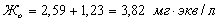
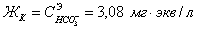
Тогда
можно найти  :
:
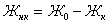
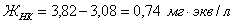
Ответ:
Щелочность
обусловлена присутствием ионов: 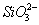 ,
,  и составляет:
и составляет:


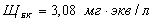
Жесткость
обусловлена присутствием ионов 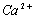 ,
,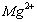 и
составила:
и
составила:
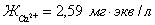
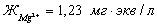
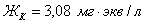
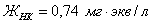
Задача
№ 2
Определить,
будет ли образовываться шлам при подогреве до  и
и 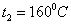 . Химический состав примесей воды принять в
соответствии с задачей № 1. Для определения величины произведения растворимости
следует таблицу 3.2 (1).
. Химический состав примесей воды принять в
соответствии с задачей № 1. Для определения величины произведения растворимости
следует таблицу 3.2 (1).
В
соответствии с химическим составом пробы воды приведенной в задаче № 1 задаемся
веществами, которые могут образовывать нерастворимый осадок при заданных
температурах:  и °
и °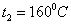
Поскольку
в воде присутствуют ионы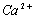 ,
,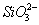 ,
,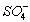 предполагаем, что возможно образование нерастворимых
соединений представленных в виде:
предполагаем, что возможно образование нерастворимых
соединений представленных в виде:
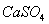 (гипса)
(гипса)
 (силикат
кальция)
(силикат
кальция)
Запишем
уравнения гидролиза данных соединений:
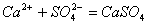

Определим
молярные концентрации представленных ионов:

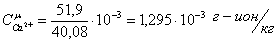
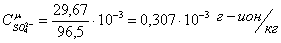

Определяем
ионную силу раствора:


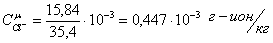
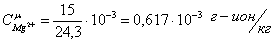

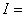 0,5(
0,5( +
+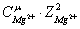 +
+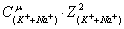 +
+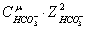
+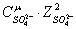 +
+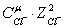 +
+ )
)
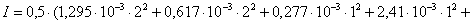
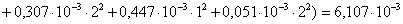
Определяем
коэффициент активности:
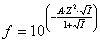
где
А - поправочный коэффициент, зависящий от температуры раствора, t,°С:
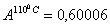
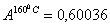
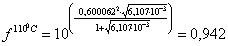

Так
как валентности ионов одинаковы, то коэффициент активности равен для всех ионов
при одной и той же температуре. По таблице 3,2 (1) при заданных температурах  и °
и °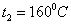 для
каждого из веществ определяем значение величины произведения растворимости.
для
каждого из веществ определяем значение величины произведения растворимости.

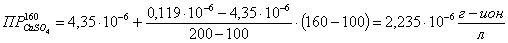
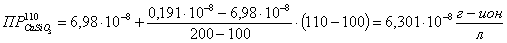
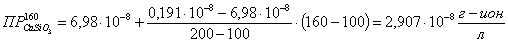
Определяем
ионное произведение:
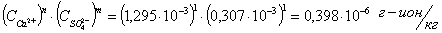
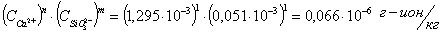
где
n и m - стехиометрические числа n=1; m=1.
Определяем
активную концентрацию ионов.
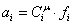
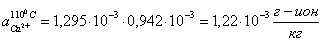

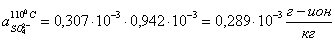
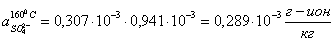


Для
соединений 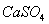 ,
,  производим
расчет произведений активных концентраций:
производим
расчет произведений активных концентраций:

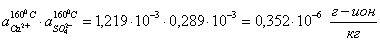
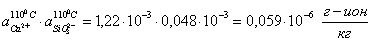

вода шлам щелочность гидролиз
Проверяем
условие возможности образования шлама.


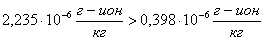 шлама
нет
шлама
нет
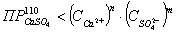
 шлама
нет
шлама
нет
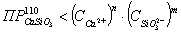
 шлам
есть
шлам
есть
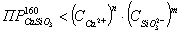
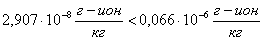 шлам
есть
шлам
есть
Раствор
насыщен, что указывает на образование растворимых соединений.
Проверяем
еще одно условие образование шлама:
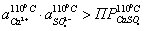
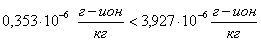 шлама
нет
шлама
нет
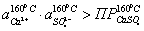
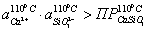
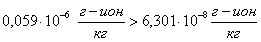 шлама
есть
шлама
есть

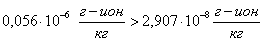 шлама
есть
шлама
есть
Ответ: При подогреве до 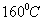 выпадает
в осадок
выпадает
в осадок .
.
Задача
№ 3
Контрольные
вопросы:
.
Как связан гидроксильный показатель pOH с показателем водорода pH?
Ответ.
Когда
концентрация обоих видов ионов в растворе одинаковы - раствор нейтрален. При
добавлении кислоты или основания концентрация уменьшается одних и увеличивается
у других.+pOH=14 , при t=25°С в чистой воде.
3.
Почему для борьбы с отложениями в барабанных котлах низкого давления не
применяется трилонирование, а в котлах высокого давления - щелочение?
Трилонирование
питательной воды может предусматриваться для предотвращения накипеобразования
любого вида. Оно может заменять фосфатирование, как наиболее эффективный метод.
Однако широкое его применение ограничивается высокой стоимостью трилона Б. Суть
метода заключается в том, что трилон Б - двухзамещенная натриевая соль
этилендиаминтетрауксусной кислоты (ЭДТА), образует растворимые комплексные
соединения с кальцием, магнием, железом, медью и другими накипеобразователями.
Для полного связывания жесткости и продуктов коррозии расход трилона Б на 1
мг-экв жесткости составляет 168 мг, на 1 мг Fe - 6 мг, на 1 мг Cu - 2,67 мг.
Для
котлов давлением 4 МПа (40 атм) трилонирование применяется в целях
эксплуатационной химической очистки котла "на ходу". В этом случае
трилонирование осуществляется перед остановкой котла на ремонт в течение 10 -
15 суток.
Раствор
трилона Б должен вводиться в каждый котел (раздельно в чистый и солевой
отсеки).
В
котлах высокого давления вредное влияние на надежность его работы и на качество
пара оказывает содержание в воде соединений кремниевой кислоты H2SiO3, вынос
которых паром пропорционален содержанию SiО3 в воде. При давлении в котле
больше 7 МПа кремниевая кислота приобретает способность растворяться в паре,
причем с повышением давления эта способность резко возрастает. Поэтому для
котлов высокого давления целесообразно использовать трилонирование.
Для
котлов при давлении менее 10 МПа применяются упрощенные методы очистки воды,
такие как щелочение.
В
процессе сушки, за 2-3 суток до ее окончания, производят щелочение и промывку
котла. Эти операции выполняют с целью удаления с внутренних поверхностей котла
грязи, ржавчины, масла и т. д. Для щелочения применяют кальцинированную соду
(Na3СО3) или каустическую соду (NaOH). Если слой ржавчины в котлах большой, то
дополнительно вводят тринатрийфосфат (Na3PO412 Н2О) или увеличивают дозу соды.
Расход
реагентов для щелочения составляет: каустической соды - 5-7 кг/м куб,
кальцинированной соды - 4-6 кг/м куб и тринатрийфосфата - 10-12 кг/м куб на 1 м
куб воды. Реагенты вводят в котел через штуцер одного из предохранительных
клапанов. Приготавливают их в пропорции 1 л на 5 л воды в растворном бачке
емкостью 0,5 м(3), установленном на верхнем барабане котла. Соду вводят сразу в
расчетном количестве, тринатрийфосфат (в случае его применения) вводят частями:
50% вместе с содой, остальные 50% в процессе щелочения. Перед вводом реагентов
уровень воды в котле должен быть самым низким, а в процессе щелочения - самым
высоким, что контролируется с помощью водоуказательного стекла. Щелочение
практически производится в течение 2-2,5 суток, в зависимости от степени
загрязнения внутренней поверхности котла. После щелочения котел опробуют на
паровую плотность.
Какие
анионы являются обменными при анионировании?
Анионирование
воды производится с целью обмена содержащихся в них анионов на обменные ионы. В
качестве обменных анионов используют такие, которые с катионом водорода
образует воду или свободную углекислоту, удалённую из воды путём декарбонизации
или термической деаэрации. К таким относятся:  .
.
Какие
технические мероприятия используют для ускорения коагуляции?
Метод
коагуляции играет важную роль в процессе водоочистки и предназначена для
удаления взвешенных коллоидных частиц, способных придавать воде мутность и
неприятный вкус. Для коагуляции используют специальные химические реагенты -
коагулянты, которые в определенных дозах добавляют в неочищенную воду. Под
действием коагулянтов коллоидные частицы, находящиеся в дисперсном состоянии,
моментально объединяются в хлопья, легко удаляемые при осаждении и фильтрации.
Метод коагуляции основан на нейтрализации отрицательного заряда, окружающего
коллоидные частицы, положительно заряженными коагулянтами. Это позволяет
нейтрализованным частицам сталкиваться между собой и образовывать агломераты. В
качестве коагулянтов принято использовать сульфат алюминия, хлорид
трёхвалентного железа, сульфат двухвалентного железа и другие. Выбор коагулянта
и его доза устанавливается экспериментально для каждого источника воды. В
настоящее время разработаны и широко используются коагуляционные установки. В
установке такого типа имеется растворный бак, в котором в чистой водопроводной
воде разводят порошкообразный коагулянт. Приготовленный раствор коагулянта с
помощью насоса-дозатора подают в смесительную камеру, где происходит реакция
взаимодействия коллоидных частиц с реагентами, продолжающаяся около тридцати
минут. Для ускорения процесса коагуляции камеру хлопьеобразования оборудуют
лопастной мешалкой или устройством барботажа. По истечении времени реакции,
воду с помощью насоса перекачивают в специальную емкость для отстаивания.
Чистая вода забирается через устройство в верхней части отстойника -
водосборный карман. Хлопья, которые оседают в конусообразные части отстойника,
периодически удаляются с помощью электрозадвижки.
Сократить объем используемого оборудования и расход реагентов позволяет
так называемая контактная коагуляция. Она реализуется при введении раствора
коагулянта перед механическим фильтром, на котором происходит процесс роста
хлопьев и их осаждение.
Список использованных источников
1. Водоподготовка: Программа, задания и методические указания
/ В.К. Елсуков, Е.А. Паршин, Е.В. Тартыкова.- Братск: ГОУ ВПО «БрГТУ»,
2004.-20с.
2. Копылов А.С.,Лавыгин В.М.,Очков В.Ф. /
Водоподготовка в энергетике: Учебное пособие для вузов. - М.: Издательство МЭИ,
2003.-309(11) с.: ил.
. Белан Ф. И. /Водоподготовка: Учебник для техникумов.
- 3-е изд., перераб. - М.: Энергия, 1979, - 208 с., ил.
. Лапотышкина Н.П., Сазонов Р.П.,/ Водоподготовка и
вводно-химический режим тепловых сетей. - М.: Энергоиздат, 1982. - 200 с., ил.