|
Биотип
|
Лизис фагум
|
Потреб. в СО 2
|
Продукция
|
Рост на средах
с красками*
|
Агглютинация
|
|
|
Раб. разведен
фага
|
103
от раб. разв фага
|
|
|
|
Моноспецифич.
Сыворотками
|
Антисыворот.
шероховат. форм.
|
|
|
|
|
|
|
Основ. фуксин
|
Тионин
|
|
|
|
|
|
|
|
|
II
|
III
|
I
|
II
|
III
|
А
|
М
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
|
Br. melitensis
|
1
|
-
|
-
|
-
|
-
|
+
|
+
|
-
|
+
|
+
|
-
|
+
|
-
|
|
2
|
-
|
-
|
-
|
-
|
+
|
+
|
-
|
+
|
+
|
+
|
-
|
-
|
|
3
|
-
|
-
|
-
|
-
|
+
|
+
|
-
|
+
|
+
|
+
|
+
|
-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br. abortus
|
1
|
+
|
+
|
++
|
+
|
+
|
+
|
-
|
-
|
-
|
+
|
-
|
-
|
Длительная персистенция L - форм бруцелл,
способность их к реверсии определяют длительное течение болезни, возможность
рецидивов, а заражение L - формами определяет формирование первично-латентной формы L-бруцеллезного
инфекционного процесса. Действительно, Т.А. Макарова (1975) обнаружила L - формы бруцелл через 19
лет после начала болезни. Однако многие стороны проблемы L - форм бруцелл требуют
дальнейшего изучения.
В отношении антигенной структуры бруцелл единого мнения пока
нет. G.
Wilson и A. Miles (1932) первыми
установили, что имеются два поверхностно-оболоченных антигена: антиген А (B. abortus) и антиген М (B. melitensis). В дальнейшем было
установлено, что B. melitensis больше содержит антиген М (отношение антигенов М к А равно
20:1), а B.
abortus больше содержат антиген
А (соотношение М:А равно 1:20). По содержанию поверхностно-оболоченных
антигенов B.
suis занимают промежуточное
положение. Помимо комплексного поверхностно-оболоченного антигена, бруцеллы
имеют общий j-антиген.
Наряду с поверхностными антигенами у всех штаммов
зарегистрированных четыре безусловно патогенных для человека бруцелл (B. melitensis, B. abortus, B. suis, В. Ovis) имеется глубинный О -
антиген бруцелл. В чистом виде О-антиген получить можно, лишь иммунизируя
животных штаммами бруцелл, утративших поверхностно-оболочечный комплексный
антиген, состоящий из М- и А - антигена. П.А. Триленко (1976) обозначает этот
комплексный антиген объединенным названием S. К утратившим
комплексный S-антиген
относятся бруцеллы в МБФ-форме. Так как применяемые серологические реакции
построены на выявлении поверхностно-оболочечного S-антигена, то заражение
бруцеллами, относящимися к МБФ - форме, не позволяет выявить
противобруцеллезные антитела с помощью РА, РСК и РПГА.
Однако вопрос об антигенной структуре бруцелл остается
открытым и по настоящий день. Исследуя методом преципитации в геле экстракты
типичных штаммов бруцелл, Н.Г. Шин (1964), J. Parnas (1963) выявили 6 линий
преципитации. R.
Diaz A. и Ghordi (1966) методом
иммуноэлектрофореза выявили 24 антигеных компонента. Но серодиагностическое
значение авторы придают только шести компонентам. R. Diaz и соавт. (1968) методом
иммуноэлектрофореза выявили наличие у B. melitensis липополисахаридобелковых комплексов. По мнению
исследователей, эти комплексы являются специфическими поверхностными
антигенами, типичными для S-форм бруцелл.
В силу чрезвычайной пластичности бруцеллы под воздействием
неблагоприятных физических, химических факторов, антибиотиков, бактериофагов
могут менять свои морфологические, культуральные, тинкториальные свойства,
антигенную структуру, вирулентность. Возникновение неспособных к агглютинации
форм является наиболее ярким примером изменчивости бруцелл.
Вирулентность и патогенность бруцелл определяются их видовой
принадлежностью. Из всех видов бруцелл основную роль в заражении людей играют B. melitensis, B. abortus, B. suis.
Бруцеллы довольно устойчивы и жизнеспособны во в внешней
среде. В жидких культурах при температуре 60 °С они гибнут через 30 мин, 80 -
90 °С - через 5 минут, при кипячении - моментально. В сухой среде температура
90 - 95 °С убивает бруцеллы через час.
Бруцеллы чувствительны к тетрациклину (0,5-2 мкг/мл),
левомицетину (1-10 мкг/мл), стрептомицину (1-4 мкг/мл), эритромицину (5-10
мкг/мл).
В водопроводной воде концентрация 100 бруцелл в 1 мл
сохраняется до 76 дней, в сыром молоке они живут до 40 дней, в брынзе,
приготовленной из сырого овечьего молока, - до 60 дней, в масле, в сливках,
простокваше - в течение всего периода их пищевой ценности. В сыром мясе больных
животных бруцеллы сохраняются до 3 месяцев, в засоленном - до 30 дней, в шерсти
- до 3-4 мес. Особую опасность представляют каракулевые смушки, так как их
часто снимают с мертворожденных и абортированных плодов.
Бруцеллы очень чувствительны ко всем дезинфицирующим
средствам. В условиях эксперимента 0,2 - 1% раствор хлорной извести, 0,5%
лизола, 0,2% формалина, 0,1% хлорамина, 2% карболовая кислота и 1% раствор
креолина убивают бруцеллы за несколько минут. Однако в естественных условиях
эти сроки удлиняются. В почве бруцеллы гибнут при воздействии 5% хлорной
извести в течение 50 мин, свежегашеной извести - 6 ч [цит. 10].
В случае выявления бруцеллеза в хозяйстве можно наблюдать
активное распространение его в стаде, но распространение его трудно поддается
расшифровке, т. к. он может протекать в виде бурных клинических проявлений (аборты)
и совершенно теометрально противоположном направлении (скрытно, незаметно, без
особых клинических проявлений, продолжается годами [11].
Бруцеллез как антропоозоноз является наиболее значимой
социально-экономической проблемой в нашей республике.
По уровню заболеваемости бруцеллезом людей и животных
Казахстан на протяжении многих лет занимает первое место среди стран бывшего
союза и СНГ.
Нозоареалы бруцеллеза по своему состоянию могут быть
неодинаковыми, что обусловлены в хозяйственно - экономическими,
природно-географическими условиями и бытовыми условиями населения и уровнем
проводимых специальных ветеринарных мероприятий.
Поэтому деятельность ветеринарной службы должна быть
направлена на повышение эффективности мероприятий по борьбе с бруцеллезом животных,
как основного источника заражения людей. Вывод о целесообразности проделанной
работы может быть сделан на основании ее эффективности, мерилом которой будут
количественные и качественные изменения основных направлений эпизоотического
процесса в соответствии с проводимыми мерами борьбы и их результатом.
Основные сведения необходимые для диагностики и организации
мер борьбы с бруцеллезом получают в результате проведения эпизоотологического
анализа.
Целью эпизоотологического исследования и анализа при бруцеллезе
животных является изучение характера, уровня и динамики эпизоотического
процесса происходящего на определенной территории (пункт, хозяйство, район,
область, республика) в определенный отрезок времени (полугодие, год, несколько
лет и т.д.)
Проводя эпизоотологическое исследование и анализ,
эпизоотологии ставят перед собой следующие задачи:
Выявить закономерности эпизоотического процесса и его
особенности при бруцеллезе животных в конкретных условиях.
Правильно понять его закономерности, вскрыть их причины.
Изучить эффективность проводимых в предыдущие годы
профилактических и оздоровительных мероприятий.
Составить план мероприятий с учетом эпизоотологических
особенностей течения эпизоотического процесса при бруцеллезе в условиях
хозяйств, района, области и республики.
Изучение этих вопросов поможет в правильной организации мер
борьбы, выборе основного звена мероприятий, направленных на решение задач
снижения заболеваемости и очагов инфекции и полного оздоровления от бруцеллеза
животных в определенных нозоареалах.
На основании эпизоотологического анализа и прогноза по
хозяйствам, районам и областям представляется возможным научно-обоснованное
эпизоотологическое районирование и планирование мероприятий.
При заболевании животных бруцеллезом, распространенность его
может достигнуть значительных размеров, вплоть до инфицирования всего
поголовья. При этом мужские особи менее чувствительны к названной инфекции, у
молодняка менее проявляются позитивные показания при серологическом
исследовании в стадах, где содержатся стельные животные клиническое проявление
- аборты, в стадах, где нет стельных клинические проявления трудно наблюдать,
такое стадо таит в себе особую опасность, т. к. животное также активно
распространяет инфекцию, а определение его требует времени, которое может
оказать губительное действие на стадо. Этот период можно назвать
предэпизоотическим, когда стадо незаметно переходит в период эпизоотии. В
Республике в последние годы участились случаи проявления инфекционного процесса
в «благополучных стадах».
В связи с этим период выявления, подтверждения пагубно
сказываются на благополучии стада. Во время периода выяснения может заразиться
20 - 60% животных.
Кроме того, у некоторых заразившихся беременных коров, овец
серологическая реакция проявляется спустя некоторое время после аборта.
Бруцеллез крупного рогатого скота, заражал людей мясо -
молочной продукцией, представляет серьезную угрозу для экономики хозяйства,
связанные с потерей продуктивности, недополучением приплода, проведением
оздоровительных мероприятий.
Течение бруцеллеза может быть самым невероятным даже среди
животных одной породы при идентичных условиях содержания.
Весьма часто при проявлении бруцеллеза среди животных одного
стада, у части коров наблюдается клиника (аборты), у другой группы протекает
бессимптомно, а третья часть не заражается. В результате из заразившихся часть
абортирует, другие переболевают в легкой форме с поражением в основном
лимфатических узлов и органов (печень, селезенка). Бруцеллез у таких животных
можно выявить при серологическом, аллергическом, бактериологическом
исследовании. И то, часто наступлению абортов предшествует серологическая
реакция в низком титре, у некоторой группы животных серологическая реакция
отсутствует перед абортом.
Причиной вспышки бруцеллезом может быть ввод инфицированного
животного в благополучное стадо, местность. При этом источником инфекции могут
быть не только половозрелые животные, но и телята, у которых в основном нет
проявлений иммунобиологических реакций.
Следующей причиной могут быть телочки, полученные от больных
коров или «переболевшие», которые могут проявить признаки заболевания перед
отелами.
Весьма частое заражение животных происходит при совместной
пастьбе, водопое, при скармливании сена скошенного, где паслись больные
животные, обрата не прошедшего соответствующую обработку, использование навоза
в качестве удобрения, полученного из неблагополучной местности.
Также возможны заражения животных находящихся недалеко от
рынков, трасс.
Таким образом, при выяснении причины внедрения бруцеллеза в
благополучную местность, стадо, необходимо обращать на все возможные источники
инфекции, иметь в виду, что возможны любые проявления ее от активного (аборты)
до пассивного (бессимптомные).
В борьбе с бруцеллезной инфекцией большое значение имеет
своевременная диагностика заболевания. Как было сказано выше неподдающаяся
установленной для многих бактериальных болезней течение инфекции не подходит
бруцеллезу и поэтому постановка диагноза весьма затруднительна.
Поэтому перспективно постоянно совершенствовать средства
диагностики и методы их применения.
Обстоятельно доказано, что успех борьбы во многом может
зависеть от искусственного влияния на иммунную систему [12 - 18].
Это величайшее открытие в науке значительно улучшает понятие
о инфекции и борьбе с этой коварной болезнью.
В настоящее время предложено некоторое количество вакцинных
препаратов как из живых штаммов, так и из инактивированных. Важно отметить, что
в настоящее время предпочтение отдается неживым вакцинам. Это связано с их
стабильностью, достаточно высокой иммуногенностью, безвредностью, безопасностью
для окружающей среды.
Весьма актуально для науки и практики разработка лечебно -
профилактических препаратов с помощью которых можно снизить остроту течения
болезни, сократить сроки оздоровления неблагополучных хозяйств, излечить в
случае необходимости животных от этой болезни.
.2 Диагностика бруцеллеза
Диагностика бруцеллеза имеет ведущее значение в борьбе с нею.
Своевременное выявление реагирующих животных - залог успеха при сохранении благополучия
и оздоровлении неблагополучных хозяйств. У большинства животных бруцеллез
протекает часто без клинических проявлений и поэтому выявить в таких случаях
проще методом серологической, бактериологической диагностики.
При заболевании животных бруцеллезом изменяется реактивность
организма, что приводит организм к образованию антител и развитию
аллергического состояния, т.е. в результате этого происходит специфический
ответ иммунной системы (гуморальной, клеточной).
Поэтому при диагностике бруцеллеза необходимо учитывать
проявление иммунобиологических реакций на различных стадиях инфекционного
процесса, т. к. при этом происходят активизации различных антител в крови
(агглютининов, преципитинов, комплементсвязывающих веществ и т.д.), а также
аллергического состояния организма.
Так как проявление различных иммунобиологических реакций на
различных стадиях инфекционного процесса не постоянны, результатом которого
является неполное выявление реагирующих животных даже при комплексном
исследовании. В связи, с чем исследование животных надо проводить многократно.
Разработке диагностики и методов их применения посвящено
множество работ, но до сих пор не изыскан совершенный метод диагностики и
диагностикум.
.3 Аллергический метод
Метод аллергической пробы впервые был предложен Burnet (1922) для диагностики
бруцеллеза у людей. Предложенный им аллерген «мелитин» представляет собой
фильтрат трехнедельной бульонной культуры B. melitensis. [19].
Для диагностики бруцеллеза животных А.Н. Пашковский (1932)
впервые предложил корпускулярный аллерген «абортин». Этот препарат представлял
собой убитую нагреванием бульонную культуру B. Abortus, выпаренную до 0,1
первоначального объема. Абортин Пашковского, по заключению автора и отзывам
других исследователей, в опытах на крупном рогатом скоте давал
удовлетворительные результаты как при внутрикожной, так и при глазной пробе
[20].
С несомненным успехом был испытан, а затем применен на
практике абортин С.Н. Вышелесского (1934), который готовили в виде суспензии в
физиологическом растворе убитой нагреванием агаровой культуры бруцелл,
содержащей 2 х109 микробных тел. По отзывам С.Н. Вышелесского, Е.С.
Орлова, М.Е. Авакумово, Д.К. Бессонова (1935), Е.К. Волик и Г.М. Базылева
(1935), И.А. Каркадиновской (1936), М.И. Штуцера и Н.Ф. Федотова (1936), П.Н.
Жованик, Б.Г. Петренко и А.М. Говорова (1937, 1940), В.В. Павловского (1940),
Е.С. Орлова (1940) и многих других, этот препарат при внутрикожной пробе давал
хорошие результаты, как на крупном, так и на мелком рогатом скоте. Недостатком
его было то, что он обладал сенсибилизирующими свойствами. Кроме того, после
внутрикожной инъекции абортина Вышелесского, как, впрочем, и после других
подобных аллергенов, у животных наблюдалось появление агглютининов, которые
могли сохраняться до 3 месяцев [21].
В 1937 г. для аллергической диагностики бруцеллеза у мелкого
рогатого скота П.Ф. Здрадовский предложил аллерген в виде экстракта из
размолотых клеток бруцелл. Этот препарат получил название бруцеллизат. Он
оказался высокоактивным и был принят для применения в широкой практике. После
внутрикожной инъекции этого препарата также наблюдалось кратковременное
появление у некоторых животных специфических агглютининов.
Ввиду большой важности проблемы поиски более совершенного
аллергена для аллергической диагностики бруцеллеза у животных не прекращались.
В 1939 году Д.А. Цуверкалов и В.М. Красов предложили аллерген в виде продукта
кислотного гидролиза микробной массы бруцелл и дали ему название
«бруцеллогидролизат ВИЭВ». Этот препарат также был принят для диагностики
бруцеллеза у мелкого рогатого скота и свиней. Он выгодно отличался от других
аллергенов тем, что не обуславливал появления серопозитивности.
Н.П. Жованик (1940) применил для диагностики бруцеллеза у
крупного рогатого скота изготовленный им бруцеллин - шутель-экстракт убитой
нагреванием отмытой взвеси из агаровой культуры нескольких штаммов B. abortus. В опыте на 150 коровах,
реагировавших положительно на бруцеллез в РА, при первом исследовании на
бруцеллин реагировали положительно 69,3% и сомнительно - 17,3% животных, а при
повторном исследовании, проведенном через 25-30 дней после первого, реагировали
положительно 90% и сомнительно - 9% животных.
Проявление аллергической реакции на введение антигена
(аллергена) связано с иммунной реакцией клеточного типа, формирование которого
происходит тимус зависимыми или Т-лимфоцитами [22,23].
В 1968 г. Е.С. Орлов и А.Н. Касьянов предложили новый
бруцеллезный аллерген - бруцеллин ВИЭВ, изготавливаемый из неагглютиногенного
штамма B.
abortus.
Бруцеллин ВИЭВ в исследованиях авторов показал высокую
специфичность и активность при диагностике бруцеллеза у овец и коз путем
пальпебральной пробы и у свиней путем внутрикожной пробы, что было подтверждено
производственной проверкой, проведенной в различных республиках страны на 115
тыс. овец и коз в 236 стадах, благополучных и неблагополучных по бруцеллезу.
Авторы отметили также, что пальпебральная проба с применением бруцеллина ВИЭВ
может быть использована для исследования на бруцеллез северных оленей.
Бруцеллин ВИЭВ, как и бруцеллогидролизат ВИЭВ, совершенно лишен
сенсибилизирующих свойств. Широкое применение бруцеллина ВИЭВ в практике
получило положительную оценку со стороны ветеринарных специалистов (Е.М.
Борисов, В.С. Дуранов, И.И. Брудков, 1970; Ф.Г. Муфтеев, И.Ф. Коновалов, А.Ф.
Ашаткин, В.П. Юрейчук, В.В. Гуськов, 1972, и другие) [24].
Аллергическое состояние у больных бруцеллезом животных
возникает позже, чем появляются специфические антитела в сыворотке крови, но
может сохраняться очень долго. По данным П.П. Самойлова (1952), аллергическая
реакция на бруцеллез у экспериментально зараженных бруцеллезом овец проявляется
на 15-30-й день, но может выпадать у 16,7% животных на срок до одного месяца, у
16,7% - до двух-трех месяцев, а у 6,6% - даже до шести-девяти месяцев. Отрицательной
аллергическая реакция становится у большинства искусственно инфицированных овец
через 16 месяцев.
Аллергические реакции, как и серологические, у больных
бруцеллезом животных могут выпадать под влиянием истощения, интеркурентных
инфекций, поражения чесоткой и других факторов, вызывающих состояние анергии.
Н.П. Ивановым был разработан оригинальный способ получения
аллергена при помощи ультразвукового дезинтегратора УЗДН - 2 [25].
В.Б. Теном был изыскан более упрощенный вариант получения
бруцеллезного аллергена.
В процессе иммуногенеза количество Т-лимфоцитов коррелирует с
выраженностью аллергических реакций, в то время как В-лимфоциты являются
источником проявления антителообразования [26].
Активизацию иммунологической реактивности во время беременности
наблюдал А.К. Бронников.
Несмотря на то, в специальной литературе имеется значительное
количество сообщений по изысканию методов приготовления бруцеллезного
аллергена, способов введения и необходимости его применения, перспективность
разработки и применения его в зависимости от вида животного все еще
актуально[27].
1.4 Серологический метод (РА)
Серология (лат. serum - сыворотка крови, logos - учение) - наука об
иммунных свойствах сыворотки крови и факторах их обуславливающих.
Основной серологической диагностикой бруцеллеза и других
инфекционных болезней является взаимосвязь между антигеном и антителом, которая
заключается в обнаружении специфических антител в сыворотки крови животных.
Наиболее распространенными и показательными серологическими
методами диагностики все еще являются РА (реакция агглютинации) в пробирках,
пластине, РСК (реакция связывания комплемента), РБП (пластинчатая реакция
агглютинации с Роз - Бенгал антигеном или другим красителем), КР (кольцевая
реакция с молоком), ИФА (иммуноферментный анализ) и др. [28].
Реакция агглютинации (от лат. agglutinatio - склеивание) называется
склеивание и выпадение в осадок микробных, кровяных или иных клеток под
воздействием специфического антигена или антитела.
Впервые склеивание бактерий и скучивание их в комочки под
действием сыворотки крови иммунизированного животного описали в 1890 г. M. Charrin и H. Roger. Однако этот феномен как
специфическое явление, относящееся к реакциям иммунитета, оценен лишь после
исследований M.
Gruber и Н. Durcham (1896).
Реакцию агглютинации в качестве диагностического теста при
брюшном тифе у людей применил F. Widal (1896) и метод был назван его именем.
Механизм агглютинации. По современным данным агглютинация -
результат взаимодействия антигена (клетки) с многовалентными (два и более)
антителами. Для выпадения образовавшегося комплекса в осадок, т.е. визуального
проявления реакции, необходимо наличие электролита, хотя взаимодействие
антигена с антителом и образование их комплекса могут происходить в
безэлектролитной среде. Антиген, участвующий в реакции агглютинации, принято
называть агглютиногеном, антитело - агглютинином, а образовавшийся комплекс
антиген - антитело - агглютинатом. Эти термины условны, т.к. одни и те же
антитела могут быть агглютинирующими, преципитирующими, комплементсвязывающими.
Что касается антигена, то для применения его в реакции агглютинации требуется
определенные условия. Во-первых, он должен быть корпускулярным в виде суспензии
клеток или других дисперсных элементов, во-вторых, в электролитной среде должен
образовывать устойчивую взвесь и не давать самоагглютинацию. Некоторые
микроорганизмы в кислой среде могут вызывать самоагглютинацию.
Характер агглютината и скорость его образования зависят от
свойств антигена. Безжгутиковые бактерии под действием специфических антител
агглютинируются медленно в течение 18 - 24 ч, образуя мелкозернистые комочки,
тогда как бактерии со жгутиками агглютинируются сравнительно быстро в течение 2
- 4 ч в виде крупных рыхлых комочков. Когда бактерии скучиваются друг с другом
через свои жгутики посредством антител, получается очень нежный Н - агглютинат
(нем. Hauch - дыхание, нежный
налет). Образование мелкозернистых агглютинатов в результате склеивания
непосредственно самих клеточных стенок было названо О - агглютинацией (нем. Ohne Hauch - без дыхания).
Антигены, обусловливающие эти реакции, обозначены соответственно жгутиковый Н -
и соматический О - антиген.
Отмытый центрифугированием агглютинат при суспендировании в
дистиллированной воде распадается, приобретая вид первоначальной клеточной
взвеси до реакции. При этом антитела, не освобождаются, что подтверждает
правильность выводов о двухфазности агглютинации. В первой фазе адсорбируются
агглютинины на поверхности клеток, без внешних изменений. Вторая фаза наступает
только в присутствии электролитов и сопровождается образованием видимого
агглютината. J.
Bordet (1920) считал, что
главную роль в процессе агглютинации играют электролиты, а антитела лишь
повышают чувствительность клеток к агглютинирующему действию.
По известной теории «решетки» агглютинат образуется
вследствии связывания разных клеток активными центрами двухвалентных антител.
Хотя эта теория согласуется с современными данными, она не объясняет факты,
подтверждающие двухфазность формирования агглютината. Анализ всех фактов с
учетом современных данных позволяет предположить, что благодаря сегментной
подвижности иммуноглобулиновых доменов активные центры многовалентных антител в
безэлектролитной среде располагаются близко друг от друга и могут связываться
лишь с близлежащими антигенными рецепторами на одной клетке. При определенной
ионной силе раствора молекула иммуноглобулина приобретает такую информацию, при
которой два активных центра будут располагаться достаточно далеко друг от
друга, что позволяет связываться с антигенными детерминантами двух разных
клеток. Благодаря этому происходит скучивание клеток с образованием крупного
агрегата. Агглютинат в дистиллированной воде распадается из-за непрерывного
обратимого процесса образования и диссоциации комплексов антиген - антитело.
Любая клетка, используемая в агглютинации, имеет
многочисленные антигенные детерминанты, а освобождение связи между ними и
активными центрами антител происходит не одномоментно: только в безсолевой
среде из-за наступивших конформационных изменений в молекуле антител они
перестают служить мостиками между различными клетками. Следовательно, не
антитела помогают электролитам осуществить агглютинацию, как предполагал J. Bordet, а наоборот, электролиты
придают молекулам антител соответствующую конформацию [29].
Активные центры антител благодаря сегментной гибкости в
шарнирных участках молекул иммуноглобулинов удаляются друг от друга на
достаточное расстояние, что обеспечивает связывание разных клеток с антигенными
детерминантами.
Роль среды (электролитов, коллоидов) не ограничивается
конформационными изменениями в молекуле антител. В определенной среде из-за
уменьшения электростатических сил отталкивания клетки сближаются друг с другом,
что также способствует агглютинации. Это подтверждается и некоторыми
экспериментальными данными. Установили, что объем одного и того же количества
эритроцитов неодинаков в различной среде, например, его меньше в растворе
декстрана, чем в физиологическом растворе хлорида натрия. Растворы декстрана,
желатина и другие коллоиды, а также гипертонические растворы солей усиливают
агглютинацию. На этом основана агглютинация в концентрированном растворе
хлорида натрия, сернокислого амония, сернокислых солей цинка, свинца и кадмия,
а также агглютинация в коллоидной среде: в плазме крови, желатине, гепарине,
гуммиарабике, декстране, пектине для усиления агглютинации применил
сывороточный альбумин и этот метод ошибочно назвал конглютинацией, полагая, что
реакции способствует особый фактор типа конглютинина, находящийся в сыворотке
крови. [30].
Прозона. Известно парадоксальное явление, заключающееся в
том, что с некоторыми иммунными сыворотками, как правило, с высокоактивными, в
малых разведениях отсутствует агглютинация при наличии ее в более высоких
разведениях. Это явление получило название феномен прозоны.
В ветеринарных лабораториях сыворотку крови животных изучают
в разведениях, соответствующих минимальным диагностическим титрам. Массовые
исследования проводятся лишь с одним, как правило, наименьшим разведением. При
этом из-за прозоны существует риск у явно больных животных результат считать
отрицательным.
Анализируя возможные механизмы явления прозоны, Л.А. Зильбер
(1958) указывал, что исчерпывающего объяснения ему нет. Успехи современной
иммунологии, достигнутые в области изучения природы антигенов и структуры
антител, также не внесли ничего существенного в решение этого вопроса.
Возможной причиной прозоны некоторые исследователи считают
присутствие в сыворотке крови неполных антител или их более высокий авидитет к
антигену по сравнению с полными антителами.
Мы исследовали связь феномена прозоны с наличием в сыворотке
крови неполных антител. Опыт проводили на 1140 сыворотках крупного рогатого
скота, больного бруцеллезом. Уровень агглютининов (полных антител) определяли в
реакции агглютинации, о содержании неполных антител судили по разнице титров
сывороток в реакции Кумбаса и РА.
Титры антител в реакции Кумбаса во всех случаях превышали
титры в РА на 3 - 5 двукратных разведений. Из исследованных проб только 39
(3,1%) давали прозону в РА в начальных разведениях 1:20 - 1:160.
В пробирках, где установлена прозона, во всех случаях
получены резко положительные результаты в реакции Кумбаса. Соотношение титров
агглютининов и неполных антител в сыворотках с прозоной не отличались от такого
показателя сывороток, не давших прозону.
В 34 сыворотках с прозоной в реакции агглютинации определяли
авидность антител по отношению к бруцеллезному антигену для РА. Показателем
этого свойства служила степень истощения антител в результате контактирования
0.1 мл сыворотки с 1 млрд. бруцелл. Разница логарифмов титров полных антител до
и после истощения составляла 1,98 ± 0,54. Следовательно, последние оказались
более авидными. Однако разница между показателями авидности полных и неполных
антител была статистически недостоверной (р >0,1).
Известно, что агглютинины в сыворотках крови крупного
рогатого скота после нагревания при 70 °С ведут себя как неполные антитела. Мы
исследовали блокирующее действие 79 бруцеллезных сывороток, обработанных
указанным способом. Все они до инактивации имели титры в РА 1:800 - 1:6400 и не
давали прозону. С нагретыми сыворотками РА ставили в двух рядах. В один из них
вносили по 0,05 мл высокоактивной агглютинирующей сыворотки в разведении 1:20,
другой служил контролем и в нем во всех случаях агглютинации не было. В опытных
пробирках иногда также наблюдали отсутствие реакции в первых пробирках с малыми
разведениями сывороток. Такой блокирующий эффект давала 21 из 76 сывороток.
Таким образом, феномен прозоны нельзя объяснить только содержанием
в сыворотке неполных антител или их более высоким авидитетом, хотя значение
этих факторов отрицать тоже нельзя. Видимо, для появления прозоны необходимы
некоторые физико-химические изменения белков сыворотки крови, о чем
свидетельствует более частое блокирование антигена сыворотками,
инактивированными при 70 °С [31].
РА для диагностики бруцеллеза людей предложили 1887 г., Райт
и Симплом;
Коз в 1905 г. Заммит; крупного рогатого скота в 1909 г.
Кристенд.
РА оценивают в международных единицах (МЕ).
Положительной реакция считается при склеивании антиген +
антитело на 50% (2 креста) у крупного рогатого скота при разведении сыворотки
1:100 и выше. Многие авторы отмечали ее диагностическую ценность, считают, что
она высокоспецифична, проста в постановке и позволяет выявлять бруцеллезных
животных на ранних стадиях развития инфекционного процесса.
Некоторые ученые отмечают, что недостатком его является
невысокая выявляющая способность, другие сходятся во мнении, что РА по
чувствительности уступает РСК.
При искусственном заражении животных агглютинины в основном
обнаруживались на 14-30 день. [32].
С целью повышения активности специфической агглютинабельности
РА Н.П. Иванов предлагает тщательно отмывать убитые бруцеллы, от других
антигенных комплексов.
Многие исследователи определили, что повышение концентрации NaCl в растворе повышает
диагностическую активность РА.
Ряд исследователей считают, что при постановке реакции
сыворотка не должна быть гемолизированной, т.е. должен быть свободным от
взвешенных частиц.
Некоторые исследователи считают, что РА несмотря на высокую
чувствительность, специфичность может давать ложные результаты.
Таким образом, разработка антигена для РА все еще является
важной задачей [33].
.5 Пластинчатая реакция агглютинации (РБП)
Gard - test (РБП) продолжена Р. Nicoletti в 1967 г., принцип
реакции состоит в том, что присходит взаимодействие антигена с антителом, это
является основой многих реакций и по своей сущности весьма подобен РА за
исключением того, что этот антиген окрашен Rose Bengal, но краситель можно
заменить другим кислотоустойчевым красителем (РН - 3,65) и применяется он как
экспресс - метод, диагностическую ценность которого отмечают многие
исследователи [34].
Также высокую чувствительность и специфичность РБП отмечают и
другие исследователи.
В постсоветском пространстве РБП - тест начали применять с
1978 года [35].
Основой высокой активности названного теста является РН среды
(РН - 3,65) в этих условиях создаются условия для проявления активности IgG, участвующего в реакции
связывания комплемента.
При этом высокую активность и специфичность многие ученые
объясняют этому способствует кислая среда антигена. [36].
Несмотря на положительные отзывы, ряд исследований отмечают
недостаточную диагностическую ценность РБП - теста другие отмечают достаточно -
высокую диагностическую ценность [37].
Некоторые ученые утверждают, что позитивные показания РБП -
теста совпадают с выделением культуры.
Предложенный для практики тест показал высокую
диагностическую активность в условиях производства, но противоречивые
высказывания исследователей требуют углубленных исследований как при
совершенствовании теста, так и при применении его при различных эпизоотических
ситуациях по бруцеллезу животных [38].
.6 Химиотерапия
Термин «химиотерапевтические средства» связан с ранними
этапами развития микробиологии, когда противомикробные препараты получали
химическим путем. Несмотря на колоссальное разнообразие химиотерапевтических
препаратов их можно объединить в несколько основных групп - в зависимости от
происхождения, структуры и механизма действия. Для терапии инфекционных
болезней, вызываемых микробами, вирусами и многоклеточными паразитами применяют
разные препараты. Именно в таком порядке их и уместно рассматривать.
Из группы антимикробных химиотерапевтических препаратов
наибольшее значение в основном антибиотики, аминогликозиды, сульфаниламиды,
фторхинелы и др. [39,40].
Отрицательная эпизоотологическая ситуация по бруцеллезу
сельскохозяйственных животных создавшаяся в республике требует от научных и
практических ветеринарных специалистов срочных неотлагательных мер направленных
на купирование инфекционного процесса. При этом наиболее перспективным
направлением является антибиотикотерапия. Известно, что не ко всем антибиотикам
чувствительны патогенные микроорганизмы, и поэтому перед применением их надо
обязательно проверить на чувствительность микроорганизмов (бруцелл) к ним.
Однако при проведении работ мы должны учитывать следующие
факторы: действие антибиотиков в основном кратковременное; одни из них обладают
бактериостатическим действием; другие - бактерицидным; одни организмы в
основном проживают внутри клетки; другие - внеклеточные.
Многие исследователи пытались при помощи антибиотиков
бороться с возбудителем бруцеллеза, получали положительный эффект: другие -
нет. Это связано с тем, что возбудитель живет внутри клетки, при длительном
персистировании находит такие места обитания, куда затруднен доступ фагоцитов
лимфоцитов и других влияний, могущих отрицательно сказаться на их
жизнедеятельности. Поэтому кроме веществ пролангирующих действие препарата,
необходимо, подбирать вещество усиливающие работу иммунной системы. Работая
в этом направлении важно подобрать препараты активизирующие действие иммунной
системы (иммуностимуляторы). Насколько правильно будет подобран комплекс
препаратов, настолько эффективно будет происходить борьба, борьба за здоровье
организма, за купирование инфекционного процесса и снижение риска
распространения ее среди других животных [41,42].
При подборе иммуностимуляторов необходимо подбирать такие
стимуляторы, которые заставили работать иммунную систему, даже при высоком
иммунодефиците.
К антибиотикам тетрациклинового ряда чувствительны хламидии,
микоплазмы, грам-положительные, грам-отрицательные кокки и многие другие
микроорганизмы, в том числе бруцеллы [43].
Доксициклин эффективен при борьбе со стрептококками,
стафилококками, гонококками возбудителями хламидиоза, туляремии, бруцеллеза и
др.
В настоящее время многие ученые пришли к выводу, что наиболее
перспективным антибиотиком в борьбе с бруцеллезом является антибиотики
тетрациклинового ряда или в сочетании их со стрептомицином [44].
Но несмотря на высокую перспективность весьма важным является
его высокая стоимость. Поэтому изыскание препаратов, сочетанного применения их,
снижающих себестоимость профилактической дозы, архиважно для ветеринарной
практики.
Важнейшей задачей научных работников является
совершенствование способов и путей купирования развития инфекционного процесса,
снижение риска миграции возбудителя во внешнюю среду, в организм здорового
животного и человека. Как было сказано выше, работы в этом направлении ведутся,
но не достаточно активно. Поэтому изыскание перспективных препаратов, снижающих
риск угрозы распространения инфекции, защищающих организм животных от внедрения
ее в организм - перспективное направление.
.7 Мероприятия против бруцеллеза крупного
рогатого скота
Со времени открытия возбудителя бруцеллеза прошло много
времени. Ученые обстоятельно изучили бруцеллез животных, людей и пришли к
выводу, что это серьезная проблема для сельского хозяйства и складывается она с
огромных экономических потерь, также это проблема для государства. Это связано
с тем, что государство, имея неблагополучные по бруцеллезу хозяйства не может
свободно вести торговлю в другие государства продукцию животноводства. Кроме
того, известно, что у больных людей происходят самые разнообразные
климатические проявления, связанные с поражением опорно-двигательной,
мочеполовой, сердечнососудистой, желудочно-кишечной, центрально-нервной систем.
В связи с этим у людей нарушаются зрительная, слуховые функции, появляются
проблемы с центральной нервной системой (до инфарктов, инсультов и др.),
желудочно-кишечной (до язв желудка, нарушения функции печени и др.),
мочеполовой-системой (до нарушения детородной функций) и многое другое.
Клинически бруцеллез у крупного рогатого скота проявляется в
виде абортов у стельных животных и в редких случаях нарушением в виде
опорно-двигательной системы (артриты и др.), орхитов у мужских особей.
До настоящего времени борьба с бруцеллезом складывалась в
основном из выявления возбудителя, прерывание путей передачи и профилактика
восприимчивых животных.
В КХ «Нур» Бурлинского района был разработан «Комплексный
план по профилактике и борьбе бруцеллезом сельскохозяйственных животных на
2006-2012 годы по Бурлинскому району».
План по профилактике и борьбе с бруцеллезом
сельскохозяйственных животных при полном выполнении указанных мероприятий
достаточно эффективный, но сложность его выполнения приводит тому, что в
основном в области усугубляется эпизоотическая ситуация по бруцеллезу крупного
рогатого скота.
В связи с этим многие ученые предлагают свои (разработанные
или) меры борьбы с нею [45].
Современное время борьба с бруцеллезом животных стала сложнее
по причине того, что на смену крупным специализированным по выращиванию одного
вида хозяйствам пришли в основном, мелкие фермерские хозяйства, что затрудняет
соблюдение таких норм, как движение животных с учетом пола, возраста, даже
вида. Усложняют прогнозированию эпизоотической ситуации в районе, регионе,
бесконтрольная миграция животных связанная с куплей, продажей, создание новых
сельхозформирований, распадом их.
Поэтому важным является изменение тактики борьбы с
бруцеллезом в зависимости от создавшейся ситуации [46].
2. Краткая характеристика хозяйства
.1 Характеристика хозяйства
КХ «Нур» создано в январе 1996 года в зимовке Каракемир,
Успеновского сельского округа, Бурлинского района, Западно-Казахстанской
области.
КХ «Нур» находится в 68 км от г. Аксай в первой зерно-животноводческой
зоне, которая является наиболее влагообеспеченным районом области. Для этой
зоны характерна почвозащитная система земледелия на неполивных землях с
выращиванием зерновых культур. Земельная площадь хозяйства составляет 344 га,
из них 322 га, то есть практически вся территория агрофирмы «Нур» используются
под сельскохозяйственные угодья.
По климатическим данным территория хозяйства относится к зоне
засушливых степей, которые характеризуются большими амплитудами колебаний
температуры в течение года и недостаточным количеством осадков.
Среднегодовая температура составляет +4,30С, зима
начинается в ноябре месяце и окончательно устанавливается в первой половине
декабря. Наиболее жаркими месяцами являются июнь, июль, август (+30, +350С).
Максимальная относительная влажность воздуха в ноябре-марте составляет 82-90%.
Осенние ранние заморозки возможны в октябре, а последние
морозы в конце марта. Среднегодовые количество осадков составляет 181,8 мм,
весной преобладают господствующие ветра юго-восточного направления. Иногда
ветры достигают, скорости 34 м/сек, что вызывает сильное испарение влаги.
Основное землепользование хозяйства пригодно для
использование под орошение. Подача воды возможно только механическим путем.
Пахотные массивы по рельефу пригодны для обработки сельскохозяйственными
машинами в любом направлении. В хозяйстве преобладающими являются
темно-каштановые почвы. В поймах и понижениях по реке Чаган имеются луговые и
луго-болотистые почвы, формирование которых тесно связано с условиями близкого
стояния грунтовых вод.
Водообеспеченность территории хозяйства хорошая, за счет
простирания по ней реки Урал. Вода в реке пресная и пригодна для питьевых и
хозяйственных нужд. Грунтовые воды залегают в глубине 6-8 метров.
Природные условия зоны благоприятны для развития молочного
животноводства. Отрастание естественных и многолетних трав позволяет проводить
выпас скота с середины мая по октябрь.
КХ «Нур» занимается мясо - молочным животноводством и
производством зерна, разводит крупный рогатый скот казахской белоголовой и
чёрно-пёстрой породы. Общее поголовье крупного рогатого скота в хозяйстве 1425
голов. Структура стада:
быки-производители -5 голов;
коровы -620 голов;
нетели -120 голов;
тёлки 2010 г. рождения -180 голов;
бычки и кастраты 2005 г. рождения -55 голов;
тёлки 2011 г. рождения -230 голов;
бычки 2011 г. рождения -215 голов.
В зимний период применяется стойлово-привязное содержание
взрослого скота и боксово-беспривязное содержание молодняка. В летний период
применяется пастбищно-лагерное содержание. Содержание коров в помещении
привязное, привязь цепная с одновременным обвязыванием 25 коров. Стойла в
коровниках между отдельными животными не разделяются. Раздача кормов
производится мобильными кормораздатчиками, доение осуществляется в молокопровод,
поение из бесклапанных автопоилок, установленных над кормушками, навозоудаление
транспортёром. Рацион для молочных коров состоит из сена кострового - 6 кг,
силоса кукурузного - 25 кг, дерти овсяной - 1 кг, соли поваренной - 90г. Поение
вволю из автопоилок. Культурные пастбища для молочных коров и телят размещаются
на ровных и низинных участках, для нетелей и всех групп мясного скота на более
высоких, склоновых участках. На культурных пастбищах высевают различные
бобово-злаковые травосмеси, в состав которых в различных сочетаниях входят:
клевер красный, костёр безостый, тимофеевка луговая, овсянница луговая,
люцерна, житняк гребневидный. Природные кормовые угодья расположены на
солонцовых и засолённых землях. При их обработке получают по 33,6 ц/га сена суданской
травы, 39,3 ц - сорго, 16,7 ц - донника, 21,9 ц - житняка. Естественный
травостой без обработки почвы даёт лишь 4,4-5,8 ц/га сена.
При использовании пастбищ в хозяйстве применяется
загонно-порционный выпас животных. При выпасе количество животных в стаде
составляет: дойные коровы 250-300 голов, молодняк старше 6 мес. 500-1000 голов,
молодняк старше года, на откорме 400-450 голов.
Выпас начинают весной при высоте трав 10-12 см
(подтравливание). При пастбищной спелости трав (высота 25-30 см) скот в загоне
пасут 1,5-2 дня и переводят в другой загон и т.д. Возвращают стадо в первый
загон для повторного стравливания отросшей травы через 22-25 дней, что
обеспечивает 3-4 стравливания за сезон. После каждого стравливания несъеденные
остатки подкашивают, а затем проводят подкормку пастбища азотно-калийными
удобрениями.
Для производства молока и воспроизводства стада используется
следующая схема: молочные коровы содержатся в молочном цехе, где производится и
искусственное осеменение. Стельные коровы и нетели за 2 недели до отёла
переводятся в родильное отделение. Новорожденные телята на сутки остаются с
матерью, затем до 10-ти дневного возраста выращиваются в профилактории. Потом
их переводят в телятник, где формируют группы по 10-15 голов. С 6 месячного
возраста телят разделяют по полу, бычков кастрируют и ставят на откорм, тёлочек
бонитируют, лучшие идут на воспроизводство стада, остальные ставятся на откорм.
3. Материал и методы исследования
Дипломная работа выполнялась в филиале «Западно-Кахастанской
НИВС», Западно-Казахстанском областном филиале на ПХВ «РВЛ» КВК и Н МСХ РК, в
КХ «Нур» Бурлинского района.
Методы исследований эпизоотической ситуации по бруцеллезу
крупного рогатого скота проводили в соответствии с данными, изложенными в
руководстве по общей эпизоотологий [47].
Серологические реакции (РА, РСК, РБП), бактериологические и
биологические исследования проводили в соответствие «Наставлением по
диагностике бруцеллеза животных» №11-1/54, утвержденным Комитетом ветеринарии
МСХ РК от 3 февраля 1999 года [48].
Идентификацию и дифференциацию видов и биотипов бруцелл
проводили по методике и схеме ФАО /ВОЗ, утвержденной Подкомитетом по таксономии
бруцелл Международного комитета экспортов (1986) и в соответствии с работой Alton et al [49].
Приготовление питательных средств осуществляли по ГОСТ
20730-75.
Аллергическую пробу проводили путем введения аллергенов
внутрикожно в дозе 0,2 см3 в среднюю треть шеи. Учет реакции
проводили через 48 часов после введения препарат.
Отбор проб для бактериологического исследования, проверку
активности, стерильности комплемента, гемолитической сыворотки, методы
постановки РА, РСК, РБП, аллергической пробы проводили согласно ГОСТ 25385-82
(СТСЭВ 2703-80), утвержденным Постановлением Государственного Комитета СССР по
стандартам.
Концентрацию микробных клеток бруцелл определяли по стандарту
мутности ГНИИСиК им. Л.Ф. Тарасевича.
Чувствительность бруцелл к антибиотикам определяли методом
серийных разведений.
Определение минимальной инфицирующей дозы бруцелл для морских
свинок проводили согласно описанию.
Проверку препаратов на стерильность проводили в соответствии
с ГОСТом 28085-89 (ст СЭВ 6280-88) [№ГОСТ].
Проверку безвредности, реактогенности, абортогенности,
активности биопрепаратов проводили согласно методом описанным [50].
Изучение реактогенности проводили в соответствии методике
описанной [51].
Индекс инфицированности зараженных животных определяли по
формуле:
а х
100
Х =
------------, где
б х с
Х - индекс инфицированности;
а - число выделенных культур;
б - количество животных в опыте;
с - количество органов, лимфатических узлов взятых для посева
от каждого животного.
Статистическую обработку цифровых материалов проводили по
методике описанной [52].
4. Результаты собственных исследований
.1 Анализ эпизоотической ситуации по бруцеллезу
крупного рогатого скота в разрезе районов Западно-Казахстанской области
По данным биологического отдела Западно-Казахстанской
областной территориальной инспекции Комитета ветеринарного контроля и надзора
МСХ РК в 2006-2012 годах в Западно-Казахстанской области исследовано
на бруцеллез 4156804 голов КРС, соответственно выявлено 102663
(2,4%) голов больного бруцеллезом скота.
Таблица 2. Динамика заболеваемости бруцеллезом крупного
рогатого скота в Западно-Кахастанской области в 2006-2012 годах
|
№
|
Районы
|
Заболеваемость
КРС бруцеллезом, в%
|
|
|
г о д ы
|
|
|
2006
|
2007
|
2008
|
2009
|
2010
|
2011
|
2012
|
|
1
|
Акжаикский
|
0,6
|
0,8
|
1,07
|
6,5
|
4,8
|
3,9
|
1,6
|
|
2
|
Бокейординский
|
1,8
|
1,2
|
2
|
7,7
|
7
|
5,1
|
2,7
|
|
3
|
Бурлинский
|
0,35
|
0,1
|
0,4
|
2
|
1,4
|
1
|
0,3
|
|
4
|
Жанакалинский
|
0,9
|
0,7
|
1,2
|
11,3
|
9,7
|
5,1
|
1,6
|
|
5
|
Жанибекский
|
0,08
|
0,07
|
0,06
|
15,2
|
7,7
|
6,6
|
1,7
|
|
6
|
Зеленовский
|
0,2
|
0,9
|
0,9
|
1,1
|
0,8
|
0,3
|
0,3
|
|
7
|
Казталовский
|
1
|
1,1
|
7
|
7,4
|
3,6
|
2,0
|
|
8
|
Каратюбинский
|
0,7
|
0,9
|
1,9
|
5,4
|
3,3
|
2
|
0,7
|
|
9
|
Сырымский
|
1,2
|
1,3
|
1,7
|
7,6
|
3,9
|
3
|
0,8
|
|
10
|
Таскалинский
|
0,05
|
0,02
|
0,1
|
0,7
|
0,5
|
0,8
|
0,6
|
|
11
|
Теректинский
|
0,5
|
1
|
1,5
|
1,7
|
1,4
|
1
|
0,8
|
|
12
|
Чингирлауский
|
0,3
|
0,2
|
0,4
|
4,4
|
3,7
|
2,2
|
0,8
|
|
13
|
Уральск
|
0,2
|
0,5
|
0,3
|
0,5
|
0,2
|
0,05
|
0,2
|
|
Итого
|
0,8
|
0,8
|
1,1
|
5,7
|
4,1
|
3,2
|
1,3
|
Данные табл. 2 свидетельствуют о том, что за 2006-2012 годы
показатель заболеваемости характеризовалось периодами подъема и спада. При этом
период снижения заболеваемости бруцеллезом крупного рогатого скота по сравнению
с 2009-2011 годам отмечено в 2012 году. В последующие годы отмечается
неравномерный подъем уровня заболеваемости, пик подъема которой достигла за
2009 год, это связано с тем, что начиная с 2009 года по всей стране все
поголовье крупного рогатого скота исследовались на бруцеллез с помощью метода
ИФА (иммуноферментный анализ). За весь период наблюдения отмечалась значительная
заболеваемость в Жанибекском (15,2%), Жанакалинском (11,3%), Бокейординском
(7,7%), и Сырымском (7,6%) районах. Эти показатели соответственно на
9,5; 5,6; 2,0 и 1,9%, чем средний показатель по области (5,7%).
На рис. 1 приведены сравнительные данные заболеваемости
бруцеллезом всего поголовья крупного рогатого скота, коров и телок перед
случкой за 2006-2012 годы.
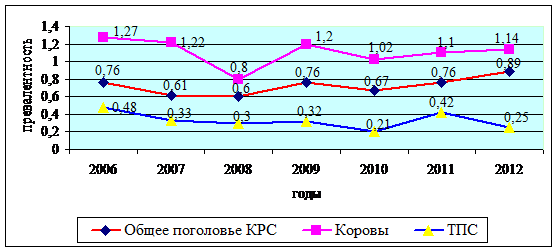
Рис.-1. Заболеваемость бруцеллезом коров и телок в
Западно-Казахстанской области за 2006-2012 гг.
Из рис. 1 видно, что удельный вес больного бруцеллезом
маточного поголовья по сравнению с другими половозрастными группами выше. При
этом следует отметить, что наивысший уровень заболеваемости среди коров
наблюдался в 2006 году (1,27%) с последующим снижением в 2008 году до 0,8% или
в 1,59 раза. В 2009 году заболеваемость коров бруцеллезом вновь возросло до
1,2% с незначительным и неравномерным снижением ее в последующие годы. Далее
следует отметить, что наименьший уровень заболеваемости наблюдается среди телок
случного возраста, которая также характеризуется периодами неравномерного спада
и подъема, что подтверждается данными рис. 2. При этом наиболее интенсивный
спад уровня заболеваемости среди телок случного возраста наблюдался в 2010 и
2012 годы, а пик подъема - 2006 и 2008 гг.
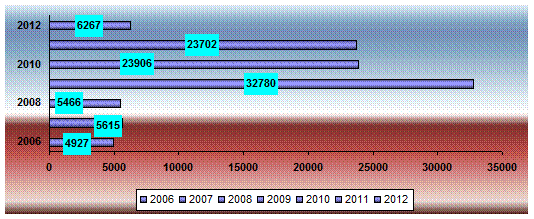
Рис.-2. Динамика выявляемой КРС больного бруцеллезом в Западно-Казахстанской
области
Анализ данных, приведенных в рис. 2 показывает, что начиная с
2007 года в области наблюдается увеличение число реагирующих на бруцеллез
крупного рогатого скота. Так, за 2009, 2010 и 2011 годы выявляемости больного
бруцеллезом животных по сравнению с 2006 годом увеличилась в 6,6, 4,8 и 4,8
раза соответственно и это так же можно обьяснить в связи с применением метода
ИФА при серологическом исследовании на бруцеллез.
Следующим этапом наших исследований было определение
показателя неблагополучия, как показателя развития эпизоотического процесса.
Результаты исследований приведены на рис. 3.
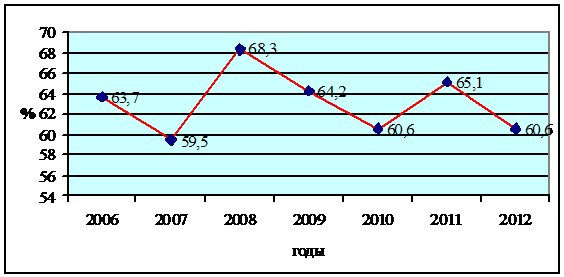
Рис.-3. Показатель неблагополучие по бруцеллезу крупного
рогатого скота в Западно-Казахстанской области за 2002-2008 гг.
Анализируя данные, приведенных на рис. 3 установили, что по
показателям неблагополучия при бруцеллезе крупного рогатого скота большинство
сельские округа входят в зону с максимальным распространением бруцеллеза. При
этом показатель неблагополучия в среднем составила 63,3%, хотя наблюдается
незначительное снижение напряженности в 2012 году на 2,7%.
При определении экстенсивного показателя уровень
распространения бруцеллеза по области или статуса территорий сельских округов в
соответствии «Ветеринарно-санитарным и санитарно-эпидемиологическим правилам по
профилактике и борьбе с заразными болезнями, общими для человека и животных
(бруцеллез)», утвержденным приказом Министра сельского хозяйства №632 от
05.11.2004 г. получены нижеследующие данные (рис. 4):

Рис.-4. Распределения территории на классы согласно статуса по
бруцеллезу
По итогам анализа данных за 2006-2012 годы по области следует
отметить, что только 21,8-30,8% сельских округов относится к чистой зоне. Из
числа оставшихся округов относится: к классу А -24,5%, к классу С - 24,0% и к
классу В - 51,5%. Эти данные показывают, что в хозяйствах области отмечается
широкое распространение бруцеллеза среди крупного рогатого скота.
За изучаемый период отмечено осложнение эпизоотического
состояния в некоторых хозяйствах области. Примером, которого является КХ «Нур»
Бурлинскского района, где подтверждается факт повсеместного распространения
данного заболевания.
Согласно проведенного нами анализа в КХ «Нур» Бурлинскского
района за период с 2006 по 2008 годы при плановых диагностических исследованиях
КРС на бруцеллез не были зарегистрированы больные животные. В апреле месяце
2012 года по данным ЗКО областного филиала на ПХВ «РВЛ» КВК и Н МСХРК из 470
голов в 52 (11,1%) случаях зарегистрирован реагирующих на бруцеллез животных. В
последующих исследованиях, проведенного в филиале «Западно-Казахстанская
научно-исследовательская ветеринарная станция ТОО «КазНИВИ» в период с мая по
август месяца, количество больных бруцеллезом составило 149 голов, и уровень
заболеваемости достигла до 10,9%. Причиной распространения данного заболевания
в этом хозяйстве явились следующие факторы:
в 2008-2011 годы не проведены работы по механической очистке
и санации животноводческих помещений и их прилагающей территории;
отсутствие на территории ферм ветеринарных защитных объектов
(ветсанпропускник, дезбаръеров, ограждения и т.д.);
доступ бродячих собак и скота частного владельца на
территории ферм;
не соблюдения сроков прохождения медицинского обследования
работниками хозяйства;
отсутствие искусственного осеменения коров и телок.
в зимнее - стойловый период 2011 года наблюдались 10-15
случаев аборта. Об этом не был осведомлен госветинспектор сельского округа и
соответственно абортированный плод не был отправлен в лабораторию для
исключения бруцеллеза. Абортировавшие коровы не были изолированы от основного
стада. Вследствие чего, вышеперечисленные факторы и явились причиной
возникновения и распространения бруцеллеза среди скотопоголовья КХ «Нур».
Таким образом, приведенные выше данные показывают, что
бруцеллез крупного рогатого скота получил широкое распространение в
агроформированиях области и мероприятия проводимые в хозяйствах области
согласно комплексного плана по профилактике и борьбе с бруцеллезом и
туберкулезом сельскохозяйственных животных на 2006-2012 годы ощутимых
результатов не дали. В результате чего произошел рост заболеваемости крупного
рогатого скота в отдельных районах от 0,8 до 5,7% при среднеобластном
показателе 5,7%. Поэтому необходимо разрабатывать более перспективные меры
борьбы, в которых были бы включены препараты, высокой диагностической и
профилактической активностью.
4.2 Выявление путей передачи возбудителей
бруцеллеза в животноводстве Западно-Казахстанской области, а также источников
бруцеллеза людей
Известная реструктуризация в аграрном секторе
способствовала развитию многоукладных форм хозяйствования на селе. Вместо
крупных специализированных хозяйств появились многочисленные средние и мелкие
хозяйствующие субъекты. Изменилось соотношение поголовья животных в частном
секторе, которое на сегодняшний день составляет более 80%.
Причем технология ведения животноводства в
индивидуальном секторе и мелких фермерских хозяйствах, начиная от содержания,
кормления и заканчивая воспроизводством далека от совершенства, как в
зоотехническом плане, так и в особенности в ветеринарно-санитарном отношении.
Разработанная ранее система противобруцеллезных
мероприятий включающая систематическое диагностическое исследование с
последующим изъятием и организованным убоем больных, санацию окружающей среды и
специфическую защиту восприимчивых животных в настоящее время практически не
осуществима, что послужило причиной обострению как эпизоотической так и
эпидимиологической ситуации. В последние годы отмечается тенденция роста
заболевания людей бруцеллезом.
Заболеваемость людей бруцеллезом важный и
единственный показатель неблагополучия эпизоотической ситуации. В качестве
основных причин и факторов способствующих возникновению и распостранения
бруцеллеза на территории ЗКО можно назвать следующие:
§ Отсутствие учета,
повышенная миграция животных, ограниченность материальных средств при
диагностических исследованиях не позволяют до конца выявить источник инфекций;
§ Недоработки в механизме
изъятия и организованного убоя выявленных больных животных способствуют
сохранению и передачи возбудителя;
Обеспеченность сельских округов ветсанобъектами
(убойными пунктами, скотомогильниками и др.) не превышает 10-15%
§ Совместное содержание и
выпас разных видов и половозрастных групп животных также способствуют передачи
возбудителя при вольной случке и межвидовой миграции.
§ Профессиональная
неграмотность владельцев животных и потребителей животноводческой продукции о
бруцеллезе. Вновь приобретаемые животные без консультации с ветспециалистом,
преварительного карантинирования вводятся в стадо животных. Молочная продукция
без соотвествующих документов и ВСЭ реализуется в неустановленных местах. В
период окотной компании для ухода за животными привлекаются дети, кормящие
матери и др.
4.2 Аллергическая диагностика бруцеллеза крупного
рогатого скота
Изготовление аллергена для диагностики бруцеллеза
животных
В настоящее время весьма важно на вооружении иметь мобильные
препараты при помощи, которых можно было бы многократно (вплоть до
ежемесячного), без особых трудовых затрат, проводить диагностические
исследования с целью выявления инфицированных животных. При этом перспективно,
если при помощи этих препаратов можно было бы проводить провоцирование
латентные формы бруцеллеза тем самым довыявлять инфицированных, на месте
отмечать реагирующих животных и в кратчайшие сроки изолировать их из стада, где
находятся условно здоровые животные. Кроме того, необходимо отметить, что
применения таких препаратов (аллергены) для прижизненной аллергической
диагностики бруцеллеза животных выгодно отличаются от антигенов используемые
для постановки серологических реакций и позволяет исключить трудоемких
процессов связанных с взятием крови в специально подготовленные посуды
(пробирки, контейнера, вакутейнеры), постановкой затратоемких серологических
реакции (необходима специальная посуда, реактивы, приборы, возможно
аппаратура). Так же следует отметить, что аллергически метод диагностики
является более безопасной для исполнителей при работе в условиях неблагополучия
и в экологическом плане.
Поэтому, перед нами были поставлены задачи изыскания более
оптимального варианта приготовления высокочувствительного аллергена с
использованием авирулентного шт. B. abortus 19.
Это решение было принято по причине того, что он является
наиболее безопасным штаммом, который характеризуется следующими признаками:
Происхождение штамм B. abortus 19. Данный штамм получен 1923 г. в США из молока
коровы. Идентифицирован по определителю бактерий Берджи, М. (1997, т. 1, С.
81-82). Сравнен с типовым штаммом коллекционный №В - 0027 В. Abortus 54 (эталонный). Штамм
получен путем отбора колоний в S - форме. Штамм при серологической типизации с S-бруцеллезной и
моноспецифической антиабортусной сыворотками дает позитивные реакции, а с
моноспецифической антимелитензисной и R - бруцеллезной сыворотками негативную реакцию.
Биотехнологические характеристики: штамм типовой,
слабовирулентный, используется для приготовления вакцинных и диагностических
препаратов. Хорошо растет в агаре Д, эритрит агаре, МПА, МППГГА, не растет на
средах с добавлением пенициллина в дозе 2,5-5 тыс. ед/мл среды.
Растет на среде с добавлением фуксина (1:50000) и не растет
на среде с тионином (1:25000 и 1:50000). Проба с трипафлавином (1:500) и
реакция термоагглютинации отрицательные.
Морфолого - культуральные свойства: хорошо растёт на эритрит
- агаре, Т°+37-38 °С, 48 час в термостате; овоиды, длина 0,4-2,5 мкм, ширина
0,4-0,6 мкм; очертания концов округлые, грамотрицательные, кислотонеустойчив,
неподвижные, тип клеточной стенки липополисахарид, специализированные клетки не
образует, колоний плотные, гладкие, поверхность блестящая, S - форма.
Физиолого - биохимические свойства: хемоорганотроф, аэроб,
тип катаболизма - дыхание, внутриклеточный паразит, чувствителен к пенициллину
2,5-5 ЕД/мл среды, рост стимулируется добавлением крови и сыворотки; источник
углерода - глюкоза, глицерин, источник серы - цистин, обладает уреазной,
оксидазной, каталазной активностью, образует Н2S, желатин не разжижает,
индол не образует, не лизирует эритроциты, не образует ацетилметилкарбинол,
выявляются иммунохимическими методами - РА, РСК, ИФА, ПЦР, слабопатогенен для
животных.
Культуру B. abortus 19, содержащий в своём составе S-формы бруцелл выращивали
на твердой питательной среде в течении 3 суток с последующим их смывом 0,5%-ный
физиологическим раствором, полученную бактериальную массу фильтровали через
тройной марлевый фильтр, затем взвесь бруцелл стерильной дистиллированной водой
доводили до концентрации 100 млрд микробных клеток в 1,0 см³. Далее полученную суспензию автоклавировали при 1 атм. в течении
30 мин. и оставляли при комнатной температуре на 2-3 сут., затем фильтровали
через стерильные фильтры, полученный фильтрат разводили в 10 раз 0,85%-ный
физиологическим раствором, в качестве консерванта использовали формалин 37 -
38%, который добавляли в количестве 0,2 см³ в 100 см³ фильтрата и использовали его в качестве целевого продукта.
Определение стерильности аллергена проводили путем высева на
эритрит - агаре и мясо - пептонном бульоне. В результате проведенных
исследований высевы оставались в течении 10 дней (период наблюдения)
стерильными, что свидетельствуют об отсутствии бактериальной загрязнённости
аллергена.
При испытании безвредности из общей пробы аллергена
стерильной пипеткой взяли 3-4 см³ и ввели подкожно по 0,5
см³ 5 белым мышам массой 18-20 г. в области паха. При этом аллерген
не вызывал воспалительных реакций на месте введения, общее состояние животных
были нормальные, случаи их заболевания и гибели в течении 10 дней не
отмечались, что свидетельствует о безвредности испытуемого аллергена.
Определение специфичности предлагаемого аллергена проводили
на 10 здоровых морских свинках массой 350-400 г., путем внутрикожного введения
его в дозе 0,1 см³ в депилированный участок
на боковой поверхности туловища.
Одновременно на симметричном участке другой стороны туловища
вводили по 0,1 см³ противопоставляемого
аллергена (известного аллергена). Учет реакции проводили через 24-48 часов.
Оба аллергена не вызвали воспалительной реакции у опытных
животных в течении 48 часов, что свидетельствовало о специфичности аллергенов.
Определение активности проводили на 10 сенсибилизированных
морских свинках массой 350-400 г., сенсибилизированных путем подкожного
введения двухсуточной агаровой культуры B. abortus 19 в дозе 1 млрд.
микробных клеток по оптическому стандарту мутности ГНИИСК им. Л.А. Тарасевича.
Через 25-30 суток после прививки на морских свинках проводили определение
активности аллергена. Животные с этой целю использовались в опытах не более 6
месяцев с интервалом между испытаниями не менее 25 суток. Предлагаемый и
противопоставленный противобруцеллезные аллергены вводили 10 морским свинкам
внутрикожно в депиллированные участки в дозе 0,1 см³ в разные стороны туловища. Иглу вводили в складку кожи морской
свинки, зажатую между большим и указательным пальцами, параллельно поверхности
кожи с таким расчетом, чтобы иглы были не менее 3 мм погружено в кожу. Затем
складку кожи отпускали и нажимом на поршень вводили точно 0,1 см³ препарата. На месте инъекции образовалась припухлость величиной с
маленькую горошину. С целью предупреждения вытекания аллергена иглу после
введения задерживали на 2-3 секунды в коже и затем извлекали. Для введения
аллергенов применяли маркированные вместимостью 1 см³ шприцы, не пропускающие раствор под поршень или иглу. Каждый
аллерген вводили отдельным шприцем, в том числе иглой. Интенсивность реакций
проверяли через 48 час. После введения аллергенов, измеряя два взаимно
перпендикулярных диаметра отеков, образующихся в месте введения, и вычисляли
среднее значение, которое и является показателем интенсивности реакции. При
этом на месте введения аллергенов у морских свинок появлялись воспалительные
реакции в виде различной отечной припухлости различного размера и гиперемии
кожи. Следует отметить, что реакция на предлагаемый и противопоставленный
аллерген была идентичными, размеры, которых в среднем составляли соответственно
4,5+ 0,25 и 4,4 + 0,21 мм, что свидетельствует об их достаточной
активности (таблица 3).
Для определения специфичности и чувствительности
предлагаемого аллергена в различных по эпизоотологической характеристике
агроформированиях (благополучный, условно благополучный) исследовали
сельскохозяйственных животных на бруцеллёз. Работа проводилась на территории
Успеновского сельского округа Бурлинского района (КХ «Асем»; КХ «Еркешбай»; КХ
«Нур»; ТОО «Бумакол»). Бруцеллезные аллергены вводили крупному рогатому скоту
внутрикожно в среднюю треть шеи безыгольным инъектором БИ - 7М.
Учет и оценку реакции у животных на внутрикожное введение
аллергена учитывали через 48 часов путем осмотра и пальпации складки кожи на
месте введения препарата в сравнении со складкой кожи из нормального участка
тела.
При этом через 48 часов у больных бруцеллезом животных на
месте введения аллергена появлялась воспалительная реакция в виде плотного
отека с ярко выраженным контуром и достаточной плотной консистенцией, обычно
хорошо видимого при визуальном осмотре. У здоровых животных местная
аллергическая реакция не возникала.
Оценку реакции проводили по схеме:
Положительная реакция - утолщение кожной складки против
физиологической нормы на 10 мм и более;
Сомнительная реакция - утолщение кожной складки против
физиологической нормы от 4 мм и более;
Отрицательная реакция - отсутствие каких-либо признаков на
введение аллергена.
Полученные данные отражены в таблице 4.
Таблица 3. Результаты испытания аллергена на активность
|
№ п/п
|
Сроки
постановки аллергопробы, сенсибилизированным морским свинкам, в сут.
|
|
25
|
50
|
90
|
120
|
150
|
180
|
|
аллергены
|
|
Испытуем.
|
Против. постав.
|
Испытуем.
|
Против. постав.
|
Испытуем.
|
Против. постав.
|
Испытуем.
|
Против. постав.
|
Испытуем.
|
Против. постав.
|
Испытуем.
|
Против. постав.
|
|
Утолщение
кожной складки в мм.
|
|
1
|
3,0
|
3,0
|
4,2
|
4,2
|
4,6
|
4,5
|
5,2
|
4,9
|
5,0
|
5,0
|
4,2
|
4,2
|
|
2
|
3,5
|
3,6
|
4,5
|
4,5
|
4,5
|
4,5
|
5,1
|
4,9
|
5,1
|
5,2
|
4,7
|
4,6
|
|
3
|
4,2
|
4,0
|
4,4
|
4,5
|
4,8
|
4,9
|
4,9
|
5,2
|
5,2
|
5,2
|
4,6
|
4,6
|
|
4
|
4,0
|
3,9
|
4,6
|
4,3
|
5,0
|
4,9
|
5,2
|
5,3
|
5,3
|
5,4
|
4,3
|
4,2
|
|
5
|
3,7
|
3,7
|
4,2
|
4,4
|
5,0
|
5,1
|
5,4
|
5,1
|
5,2
|
5,1
|
4,5
|
4,5
|
|
6
|
4,3
|
4,2
|
4,4
|
4,5
|
4,8
|
4,8
|
4,9
|
5,4
|
5,5
|
5,4
|
4,3
|
4,3
|
|
7
|
4,0
|
4,1
|
4,5
|
4,2
|
4,6
|
4,9
|
5,0
|
5,1
|
5,3
|
5,2
|
4,0
|
4,0
|
|
8
|
3,7
|
3,6
|
4,0
|
4,0
|
4,7
|
4,7
|
4,9
|
5,0
|
5,1
|
5,0
|
4,0
|
3,9
|
|
9
|
3,5
|
3,5
|
4,2
|
4,3
|
4,9
|
4,9
|
4,9
|
5,1
|
5,1
|
5,2
|
4,3
|
4,2
|
|
10
|
3,2
|
3,2
|
4,2
|
4,2
|
4,5
|
4,6
|
5,0
|
5,0
|
5,0
|
5,1
|
4,4
|
4,4
|
|
М±m
|
3,71
|
3,68
|
4,32
|
4,31
|
4,74
|
4,78
|
5,05
|
5,1
|
5,18
|
5,18
|
4,33
|
4,29
|
Таблица 4. Результаты сравнительных исследований животных на
бруцеллез предлагаемым и противопоставленным аллергеном
|
№ п/п
|
Вид животных
|
Эпизоотологическая
характеристика
|
Количество
|
Результаты
исследований аллергенами:
|
|
|
|
|
положительно
|
сомнительно
|
отрицательно
|
|
|
|
|
предлагаемый
|
противопоставленный
|
предлагаемый
|
противопоставленный
|
предлагаемый
|
противопоставленный
|
|
1
|
крупный рогатый
скот
|
благополучный
по бруцеллезу гурт
|
10
|
|
|
|
|
|
|
|
2
|
крупный рогатый
скот
|
благополучный
по бруцеллезу гурт
|
45
|
|
|
|
|
|
|
|
3
|
крупный рогатый
скот
|
благополучный
по бруцеллезу гурт
|
27
|
|
|
|
|
|
|
|
4
|
мелкий рогатый
скот
|
благополучная
по бруцеллезу отара
|
120
|
|
|
|
|
|
|
|
5
|
крупный рогатый
скот
|
неблагополучный
по бруцеллезу гурт
|
98
|
6
|
5
|
|
1
|
92
|
93
|
|
6
|
крупный рогатый
скот
|
неблагополучный
по бруцеллезу гурт
|
44
|
4
|
4
|
|
|
40
|
40
|
|
7
|
мелкий рогатый
скот
|
неблагополучная
по бруцеллезу отара
|
187
|
13
|
11
|
|
2
|
174
|
176
|
|
Всего:
|
23
|
20
|
|
3
|
306
|
309
|
Как видно из таблицы 4, при аллергическом исследовании
крупного и мелкого рогатого скота, находящиеся в благополучных по бруцеллёзу
хозяйствах, получены отрицательные результаты, что свидетельствуют о
специфичности аллергена.
При исследовании животных разных видов из неблагополучного по
бруцеллёзу хозяйств предлагаемым аллергеном на 4 (21,1%) положительных
результатов получено больше, чем противопоставленным аллергеном.
Сомнительных результатов с предлагаемым аллергеном не было,
тогда, как с известным аллергеном они отмечены у 4 (21,1%) животных.
Эти данные свидетельствуют о специфичности и большей
чувствительности предлагаемого аллергена.
Использование предлагаемого аллергена позволит быстро и
эффективно выявить заражённых бруцеллезом животных, тем самым ускорить сроки
оздоровления неблагополучных по бруцеллёзу хозяйств.
Новизну на способ изготовления аллергена для диагностики
бруцеллеза сельскохозяйственных животных Комитет по правам интеллектуальной
собственности Министерства юстиции Республики Казахстан подтвердил выдачей
инновационного патента за №19907, зарегистрированный в Государственном реестре
изобретений Республики Казахстан 28.05.2011 года.
.3 Результаты изучения аллергической реакции при
бруцеллезе крупного рогатого скота
До сих пор в ветеринарной практике не нашло признания
аллергическая диагностика бруцеллёза животных особенно в хозяйствах, содержащих
большое количество животных или наоборот (малое количество).
Первостепенное значение при мониторинге эпизоотической
ситуации, проведение диагностических исследований, оздоровительных мероприятий
принадлежит средствам диагностическим. Среди них особое место можно отвести
аллергической диагностике. Это связано с высокой их специфичностью,
активностью, показательностью, простотой постановки и меньшими физическими,
экономическими затратами.
Аллергическая реакция у инфицированных животных может
проявляться на внутрикожное введение, конъюнктивальное, внутривенное введение.
Нами было поставлено изучить значение аллергической реакции
на внутрикожное введение.
В этой связи перед нами были поставлены следующие задачи:
изучить безвредность, сенсибилизирующие свойства, активность;
изыскать оптимальное место введения препарата;
определить влияние сезонности на проявление аллергической
реакции в западно-Казахстанской области у крупного рогатого скота.
Также эффективность аллергена для диагностики бруцеллёза
животных при оздоровлении неблагополучных хозяйств.
Разработанный аллерген при проверке на стерильности,
безвредности на 10 белых мышах показал себя как стерильный безвредный препарат.
При проверке аллергена на сенсибилизирующие свойства в опыте
было использовано 10 голов коров из благополучного стада КХ «Нур» Бурлинского
района. Животным, испытуемый аллерген вводили подкожно в области средней треть
шеи в дозе 1,0 см3 трехкратно с интервалом между введениями 25-30
дней. Через каждые 25-30 дней после первичного, а также же последующих
введениях у животных брали кровь и исследовали по классическим серологическим
тестам (РБП, РА, РСК).
Таблица 5. Результаты испытания сенсибилизирующих свойств
аллергена в опытах на крупном рогатом скоте «КХ «Нур»
|
№ п/п
|
Идентиф. №
|
РБП
|
РА
|
РСК
|
|
|
Исследовано
после введения аллергена, через дней
|
|
|
30
|
60
|
90
|
30
|
60
|
90
|
30
|
60
|
90
|
|
1
|
0516
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
2
|
07072
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
3
|
07075
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
4
|
05013
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
5
|
05999
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
6
|
09116
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
7
|
07165
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
8
|
07241
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
9
|
05514
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
10
|
00898
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
Из данной таблицы 5 видно, что во всех сроках исследований
сывороток крови опытных животных получены негативные серологические показания.
Полученные результаты показывают, что испытуемый препарат не
обладает сенсибилизирующими свойствами.
Таким образом, проверка сенсибилизирующих свойств аллергена
показало, что испытуемый аллерген не обладает сенсибилизирующей активностью, на
трехкратное введение его с интервалом 25-30 дней не наблюдается проявления
иммунологических реакции (РБП, РА, РСК).
Согласно данным многих исследователей было определено, что
активность препарата зависит от штамма, из которого приготовлен аллерген.
Несмотря на это нами в качестве материала для изготовления аллергена был
использован авирулентный штамм B. abortus 19. Причиной этому послужило то, что названный штамм достаточно
изучен, относится к производственному штамму (готовят вакцину, диагностикумы).
Далее нами решено было изыскать оптимальное место введения
аллергена. Для этого определено три следующих места:
подхвостовую складку (внутрикожно);
пальпебральную пробу (подкожно);
среднюю треть шеи (внутрикожно).
При проведении исследования (одному животному препарат
вводился в 3 точки) было определено, что при введении в подхвостовую складку
потребовалось на 50 животных времени в среднем 60 минут, пальпебральная проба
заняла в среднем 50 минут на 50 животных, а в среднюю треть шеи вся манипуляция
на 50 коров заняла 15 минут (препарат вводился при помощи безыгольного инъектора
«Овод»).
Необходимо отметить, что хронометраж проводился без учета
времени на загон животных в раскол, фиксация животных.
Согласно полученным данным определено, что оптимальным местом
введения аллергена является средняя треть шеи, так при этом не было
необходимости фиксировать животных, и времени на проведение одной манипуляции
ушло 18 секунд, тогда как при введении в подхвостовую складку 1,2 мин,
пальпебрально- 1 минута.
Таким образом, оптимальным местом введения препарата является
средняя треть шеи.
Далее нами определялось качество (показательность) реакции.
При чистке реакции определено, что наиболее показательная реакция была в
средней трети шеи, нежели пальпебрально и в подхвостовую складку.
При наблюдении места введения было определено, что у всех
животных наблюдался болезненный отек, который в основном при неспецифической
реакции рассасывается в течении 12-15 часов, а к 24-25 часам угасает на 100%,
специфическая реакция максимума достигает к 48 часам, и просматриваются в виде
четко очерченных круглых, овальных отеков. Важно отметить, что реакции были
настолько показательны, что в основном кутиметром затруднительно было
пользоваться, так как у многих животных толщина кожной складки была более 15
мм, а диаметр отека был равен 4,5 см, а часто превосходил 10 см.
Согласно полученным данным мы пришли к заключению, что
показатели реакции при туберкулинизации менее выражены, чем показатели реакции
при бруцеллезе и поэтому при оценке результатов реакции при бруцеллезе могут
быть подразделены следующим образом:
толщина складки до 4 мм - отрицательная (−)
толщина складки от 4 до 10 мм - сомнительная реакция (±),
толщина складки от 10 до 12 мм - положительная реакция (+),
толщина складки от 12 до 14 мм - положительная (+ +),
толщина складки более 17 мм - положительная (+ + + +).
Животных, показавших сомнительные результаты, через 20 дней
необходимо переисследовать, в случае повтора показаний их считать
положительными.
Список литературы
1.
Вершилова П.А. Бруцеллез. - М.: Медгиз, 1961. -414 с.
.
Юсковец М.К. Бруцеллез сельскохозяйственных животных. - М., 1960. - 496 с.
.
Студенцов К.П. Бруцеллез животных. - Алма-Ата: Кайнар, 1975. - 238 с.
4. Kadostits О.М., Gay С.С., Blood D.С., Hinchcliff К.W. А. Textbook of the
diseases of cattle, cheep, pigs, goats and horses. 9th Ed. W.В. Saunders // Veterinary
medicine. - 2000. - р. 868.
. Garcia Carrillo С. Animal and human brucellosis in the Americas. Paris // OIE
Publication. - 1990. - р. 287.
. РеменцоваюМ.М. Бруцеллез диких животных. - Алма-Ата. 1962. - 272 с.
.
Амиреев С.А. Пораженность работников отгонного животноводства токсоплазмозом и
бруцеллезом. - В кн.: Бруцеллез в Казахстане. - Алма-Ата, 1970 - С. 24-28.
.
Павловский Е.Н., Галузо И.Г. 0 природной очаговости бруцеллеза. // Вестник АМН
CCCP. 1949 - №5 - С. 15-20.
.
Ременцова М.М. Распространение некоторых антропозоонозов и пути их изучения в
Казахстане // Антропозоонозы в Казахстане. - 1975. - С. 3-13.
.
Белозеров Е.С. Бруцеллез. - Ленинград, «Медицина». - 1985. - С. 6-11.
.
Хоч А.А. Бруцеллез животных в Якутии / PАС ХН. Сиб. отделение, Науч.-произв.
об-ние.
.
Красиков А.П. Новые механизмы искусственной регуляции паразито - хозяинных
отношений при бруцеллезе животных: автореф. дис… докт. вет. наук.: -
Новосибирск. 1996. - 42 с.
. Ramon G., Chassigneux, Richou R. et Gerbeaux С. // С.R. Acad. Sci., 1952. -
V. 235. - Р. 111.
14.
Тен В.Б., Абуталип А., Мустафин М.К. Изучение иммуностимуляторов для создания
неживой противобруцеллезной вакцины // Актуальные проблемы болезней животных в
современных условиях // Мат. междунар. науч-практич. конф. - Душанбе. 2003. -
С. 76-77.
.
Белобаб В.И., Калашников К.А., Тен В.Б. Влияние некоторых стимуляторов на
иммуногенность бруцеллезных препаратов и на морфоструктурные изменения органов
// Меры борьбы с инфекционными и незаразными болезнями сельскохозяйственных
животных в Казахстане. - Алма-Ата, 1985. - С. 10-16.
.
Игнатов П.Е., Блинов Н.И., Кирш Ю.З. Действие иммуностимуляторов в условиях in
vito и in vivo // Проблемы ветеринарной иммунологии: Тр. ВИЭВ. - 1983. - Т. 57.
- С. 74-77.
.
Игнатов П.Е., Блинов Н.И. Сравнительное изучение иммуностимуляторов различного
происхождения // Ветеринария. - 1983. - №9. - С. 30-31.
.
Драновская Е.А., Игнатов П.Е., Изучение синтетических полимеров в качестве
стимуляторов и пролонгаторов // ЖМЭИ. - 1982. - №3. - С. 63-73.
.
Жованик П.Н. Бруцеллез. - Издательство «Урожай». - Киев. - 1975. - С. 107-110.
.
Пашковский А.Н. Реакция аллергии как метод диагностики аборта Банги крупного
рогатого скота // Радяньска ветеринария. - 1932. - С. 13-14.
.
Вышелесский С.Н. Аллергическая реакция в диагностике бруцеллеза домашних
животных // Советская ветеринария. - 1934. - №4. - С. 37-41.
.
Адо А.Д. Общая аллергология. - М., 1970. - 350 с.
.
Касьянов А.Н. Аллергическая и серологическая диагностика и профилактика
бруцеллеза животных: дис… докт. вет. наук. М., 1987. - 345 с.
.
Усманова Ф.И., Сафронов Н.В., Бельченко В.Б., Гаврилова А.Н. Результаты
производственного испытания бруцеллина ВИЭВ. // Сельское хозяйство Казахстана,
1967. - С. 12.
.
Иванов Н.П, Чубуков А.А. Изыскание и испытание аллергенов для диагностики
заболевания вызываемого В. ovis // Труды КазНИВИ. - Алма - Ата, 1983. - С.
80-83.
.
Сафронов Н.В., Студенцов К.П., Белобаб В.И. Изменчивость бруцелл в иммуном
организме // Матер. республ. Семинара-совещания вет. специалистов. Меры борьбы
с туберкулезом и бруцеллезом в Казахстане. - Алма-Ата, 1973. - С. 71-73.
.
Бронников А.К. Влияние беременности на показатели серологической реакции при
бруцеллезе у коров // Болезни животных и их профилактика. - 1987. - С. 18-22.
.
Нуратинов Р.А., Ургуев К.Р., Юсупов О.Ю., Нажалов М.И. Серологическая
диагностика бруцеллеза КРС // Ветеринария. - 1993. - №11. - С. 55-56.
29. Bordet J. // Ann. Inst. Pasteur. - 1899. - V. 13. - Р. 225.
30.
Тен В.Б. Методологические основы изготовления и совершенствования
профилактических противобруцеллезных препаратов и диагностических средств:
Автореф…. докт. вет. наук. - Алматы, 1996. - 45 с.
.
Сайдулдин Т.С. Основы серологии. - Алма-Ата: Ғылым, 1992. - С. 157 -
160.
.
Вышелесский С.Н. Научные предпосылки и практические возможности борьбы с
бруцеллезом // Бруцеллез сельхоз. животных, 1940. - С. 51.
бруцелла
животное антибиотик скот