Изучение сезонного биоритма бациллярно-кокковой трансформации бактерии Helicobacter pylori
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ РАБОТА НА ПОЛУЧЕНИЕ СТЕПЕНИ БАКАЛАВРА
Тема
ИЗУЧЕНИЕ
СЕЗОННОГО БИОРИТМА БАЦИЛЛЯРНО-КОККОВОЙ ТРАНСФОРМАЦИИ БАКТЕРИИ HELICOBACTER PYLORI
Реферат
Бакалаврская квалификационная работа 49 с., 20 рис., 5 табл., 57 источников.
HELICOBACTER PYLORI,
ИММУНОЦИТОХИМИЯ, БАЦИЛЛЯРНО-КОККОВАЯ ТРАНСФОРМАЦИЯ, ЯЗВЕННАЯ БОЛЕЗНЬ, СЕЗОННЫЙ
БИОРИТМ.
Объектом исследования
Цель бакалаврской работы - изучение особенностей сезонного колебания
показателя "степень обсемененности СОЖ кокковыми формами" и изучение
сезонного биоритма бациллярно-кокковой трансформации H.pylori в
антральном отделе желудка.
В ходе исследования были собраны данные, необходимые для анализа
бациллярно-кокковой трансформации H.pylori в антральном отделе желудка,
доказана адекватность применяемой полуколичественной шкалы оценки степени
обсемененности слизистой оболочки желудка кокковыми формами H.pylori, методом
жидкостной иммуноцитохимии было проведено контрольное исследование кокковых
форм Н.pylori в антральном отделе желудка.
В результате исследования были получены данные, свидетельствующие о
сезонном колебательном характере бациллярно-кокковой трансформации бактерии Helicobacter pylori.
Содержание
Введение
1. Аналитический
обзор
1.1 История
исследований
.2 Морфология
и метаболизм Helicobacter pylori
.3 Патогенность
H. pylori
.4 Механизм
развития воспалительных заболеваний
.5 Бациллярно-кокковая
трансформация H. pylori
1.5.1 Кокковые
формы H. pylori
.5.2 Механизмы
возникновения кокковых форм из бациллярных
1.6 Иммуноцитохимический
метод диагностики
.7 Сезонность
инфекционных заболеваний
.8 Сезонность
H.pylori-ассоциированных заболеваний
2. Цели и
задачи работы
. Экспериментальная
часть
3.1 Характеристика
исходных данных
3.3.1 Результаты
жидкостной иммуноцитохимии
.3.2 Количественная
и полуколичественная оценка степени обсемененности СОЖ кокковыми формами
.3.3 Сезонный
биоритм активности бациллярно-кокковой трансформации Н.pylori в
слизистой оболочке желудка
Выводы
Список
литературы
Введение
elicobacter pylori - это короткая, граммотрицательная,
извитая, микроаэрофильная бактерия, инфицирование которой может привести к
развитию хронического гастрита, язвенной болезни желудка и двенадцатиперстной
кишки, желудочной лимфомы и аденокарциномы [1-3]. В организме хозяина H.pylori
в основном присутствует в спиральной форме, но может трансформироваться в
латентную кокковую форму под воздействием стрессовых условий. Некоторые
исследователи считают, что такая форма является морфологическим проявлением
дегенерации и гибели клетки. Однако большинство авторов склоняются к тому, что
кокковые формы жизнеспособны, но некультивируемы, хотя сохраняют клеточную
структуру и поддерживают метаболизм и экспрессию белков. Кокковые формы H.pylori
переносят более широкий диапазон рН, в большей степени, чем спиралевидные
формы устойчивы к неблагоприятным факторам и антибиотикам и при этом не
утрачивают вирулентность. Превращение спиралевидных форм H.pylori в
кокковые в слизистой оболочке желудка (СОЖ), так же как и в культуральной
среде, возможно, обусловлено накоплением токсических продуктов
жизнедеятельности H.pylori .
Внутрижелудочная бактериальная инфекция H.pylori является одним из
основных этиологических факторов кислотозависимых заболеваний, к которым в
первую очередь относится язвенная болезнь (ЯБ). Таким образом, если признавать
прямую связь между инфицированием желудка H.pylori и ЯБ, то и сезонные
обострения ЯБ могут быть связаны с активностью бактериальных клеток,
инфицирующих СОЖ. Учитывая, что бактериальные клетки H.pylori проявляют
бациллярно-кокковый диморфизм (т.е. присутствуют в СОЖ в спиралевидных и
кокковых формах), то бациллярно-кокковая трансформация (переход спиралевидных
форм в кокковые и наоборот) может рассматриваться как проявление активности
жизнедеятельности этого микроба в СОЖ.
Идентифицировать кокковые формы H.pylori методом прямой
бактериоскопии возможно, если применять иммуноцитохимический метод (ИЦХ), в
котором используются антитела, специфичные к антигенам клеточной стенки H.pylori.
В мазках из СОЖ, окрашенных на H.pylori ИЦХ методом, можно определять
процент встречаемости спиралевидных вегетативных форм, переходных U-форм и кокковых форм бактериальных
клеток H.pylori. В лаборатории цитологических исследований ВЦЕРМ имени
А.М. Никифорова МЧС России на протяжении 8 лет проводились широкомасштабные ИЦХ
исследования H.pylori в СОЖ, причем, ежемесячно этим методом
исследовалось в среднем 55 человек. Таким образом, целью данного дипломного
проекта было создание базы данных, необходимой для установления сезонной
зависимости показателя "степень обсемененности СОЖ кокковыми
формами", и изучение сезонного биоритма бациллярно-кокковой трансформации H.pylori
в антральном отделе желудка.
Следует отметить, что архив препаратов, в которых определена частота
встречаемости кокковых форм, был получен из прямых мазков-отпечатков
гастробиоптатов, в которых наряду с клетками покрово-ямочного эпителия,
лимфоидными элементами и лейкоцитами, и, собственно, бактериальными клетками H.pylori,
могли присутствовать бактерии-кокки, не относящиеся к H.pylori. Такая
кокковая флора в присутствии эндогенного биотина и пероксидазы, продуцируемой
лейкоцитами, а так же в результате опсонизации бактерий вполне могла
окрашиваться хромогеном ДАБ и на неспецифицеском фоне овыглядеть идентично
кокковым формам H.pylori. В настоящее время стандартом в ИЦХ методе
является пробоподготовка клеточного материала (в том числе должны
рассматриваться и бактериальные клетки) технологией жидкостной цитологии (ЖЦ).
ЖЦ предусматривает получение отмытого от неспецифического фона материала в виде
клеточной суспензии, с последующим цитоцентрифугированием на предметное стекло.
В полученных монослойных мазках-цитоцентрифугатах проводят ИЦХ исследование,
которое исключает неспецифическое окрашивание.
Целью нашего исследования стало проведение контрольных ИЦХ исследование
гастробиоптатов методом ЖЦ на предмет присутствия в них истинных кокковых форм,
а так же определение их частоты встречаемости (%) от всех бактериальных клеток H.pylori.
После установления соответствия данных ИЦХ, включающих ЖЦ-пробоподготовку
и данных, полученных с препаратов прямым методом, мы использовали базу архива
для установления сезонного цикла показателя "степень обсемененности
кокковыми формами".
1.
Аналитический обзор
.1 История
исследований
В 1982 году Австралийские врачи Барри Маршалл и Робин Уоррен исследовали
гастробиоптаты больных желудочными воспалениями, язвой желудка и
двенадцатиперстной кишки. Они обнаружили, что почти у всех больных присутствует
неизвестный прежде вид бактерии, который в дальнейшем был назван H.pylori
(потому что основное место обитания бактерии - пилорический отдел желудка).
Маршаллу удалось его культивировать, а так же показать, что даже пациенты с
язвенной болезнью могут быть вылечены путем уничтожения этих бактерий. Правда,
это открытие получило признание только после эксперимента Маршалла над самим
собой: он сознательно выпил содержимое чашки Петри с культурой бактерии H.pylori,
после чего у него развился гастрит. Затем он излечил себя с помощью 14-дневного
курса лечения солями висмута и метронидазола [4]
г первооткрыватели бактерии были удостоены Нобелевской премии по
физиологии и медицине "за открытие бактерии Helicobacter pylori и
ее роли в развитии гастрита и язвы желудка".
.2
Морфология и метаболизм Helicobacter pylori
Бактерия Helicobacter pylori весьма успешно приспособилась к жизни
в экстремальных условиях человеческого желудка. Она грамотрицательная, что уже
подразумевает мощную непроницаемую клеточную стенку. Она способна жить в
микроаэрофильных условиях. Имеет 4-7 жгутиков, которые позволяют ей крайне
быстро двигаться в вязкой среде и таким образом спасаться от агрессивной среды
желудка в толстом слое слизи, защищающий от этой среды сам желудок. Обладает
способностью формировать биоплёнки, способствующие невосприимчивости бактерии к
антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина.
[5]
Так же она продуцирует множество ферментов, обеспечивающих ей необходимый
уровень метаболизма: уреазу, каталазу, муциназу, оксидазу, гемолизин, щелочную
фосфатазу, гамма-глутамилтрансферазу, алкогольдегидрогеназу,
глюкосульфосфатазу, протеазу, фосфолипазу, белок - ингибитор секреции соляной
кислоты, многочисленные адгезины (к цитоскелету, клеточной мембране, ламинину,
холестеролу), цитотоксины белковой природы и др. [6-8]
Не смотря на такое метаболическое разнообразие, H.pylori не
способна окислять углеводы. Поэтому метаболизм ее поддерживается за счет
энергии, освобождающейся при утилизации трикарбоновых кислот или/и аминокислот.
В том числе, H.pylori содержит гидрогеназу, которая может использоваться
для получения энергии путём окисления молекулярного водорода, продуцируемого
другими кишечными бактериями. [9]
.3
Патогенность H. pylori
Многочисленными исследованиями доказана патогенность H. pylori, в
частности, способность их инициировать воспаление гастродуоденальной слизистой
оболочки, хотя, в зависимости от обстоятельств она может вести себя так же, как
комменсал и даже как симбионт [13]. Показано, что многие люди, инфицированные H.pylori,
остаются бессимптомными носителями [14]. Патогенность данных бактерий
обеспечивается их высокой подвижностью, выделением токсинов, способностью к
адгезии, способностью активировать медиаторы воспаления, наличием фактора
вирулентности [15].
Важно отметить, что более 40 генов патогенности (вирулентности) H.pylori
расположены не дискретно, а собраны в одном из сегментов нуклеотида, названном
"островком патогенности" [16]. Его маркером считается критический
иммунодоминантный белок - CagA с молекулярной массой 120-140 кДа, кодируемый
геном cagA (от "cytotoxin associated gene A") [17]. Он, с помощью
систем секреции типа III и IV, гены которых так же находится в этой области,
транспортируется внутрь клеток и нарушает нормальное функционирование
цитоскелета [18]. "Островок патогенности" ответствен за образование
основных факторов вирулентности, включая О-боковые цепи ЛПС, сходные или
идентичные с антигеном Lewis, а также систем секреции типа III и IV [19].
Отметим попутно, что "островки патогенности" присущи также
вирулентным штаммам многих других грамотрицательных, а также грамположительных
бактерий и часто отличаются по содержанию Г+Ц от нуклеотидного состава основных
хромосом [20].
H.pylori в настоящее время подразделяют на четыре серотипа, в зависимости от
выработки микроорганизмами цитотоксина VacA и цитоксинассоциированнного белка CagA: тип I (CagA+, VacA+), тип Ia (CagA+, VacA-), тип Ib (CagA-, VacA+), тип II (CagA-, VacA-) [21].
Вообще геном H.pylori крайне нестабилен, каждый инфицированный
индивид является носителем уникального штамма.
В отличие от многих других бактерий, в изолятах Н. pylori идентичные
аллели генов встречаются очень редко. И, хотя клиническая картина заболеваний
зависит от факторов вирулентности, не обнаружено тесной связи между генотипом
(комбинации различных аллелей) и заболеванием пищевого тракта. [22]
Рассмотрим по отдельности факторы, имеющие непосредственное отношение к
развитию заболеваний у людей:
Цитотоксин А (VacA)
Этот полипептид с молекулярной массой 55 кДа, вызывает вакуолизацию
клеток эпителия путем образования пор в цитоплазматической мембране. Интересной
особенностью VacA является утрата им токсичности при обработке формальдегидом
при сохранении антигенности, т.е. превращение в анатоксин. [23]
Ica A
Не меньшее значение принадлежит продукту гена iceA, образование которого
индуцируется при контакте микроба с эпителиальными клетками. [23]. По данным
некоторых авторов, iceA вызывает лимфоцитарную инфильтрацию и эпителиальные
повреждения [24], по мнению других, iceA ассоциируется с нейтрофильной активностью,
атрофией и интерстициальной метаплазией. Однако функция продукта гена iceA,
пока не выяснена. В то же время предполагается, что с цитотоксичностью может
быть связан один из поверхностных белков H.pylori, который реагирует с
плазминогеном и одновременно с ингибитором-2 плазмина и макроглобулином-2. В
итоге происходит превращение плазминогена в плазмин, обладающий высокой
протеолитической активностью [21, 24].
Уреаза
Более 15 % белкового синтеза микроорганизма приходится на уреазу. Этот
фермент крайне важен для жизни бактерии: он расщепляет мочевину и за счет
аммиака нейтрализует Н+- ионы, защищая H.pylori от действия соляной
кислоты [25]. В отличие от других патогенных бактерий (кишечная палочка,
протей, клебсиеллы, провиденций и морганеллы), уреаза H.pylori
располагается не только в ее цитоплазме, но и на поверхности клеток [26]. Это
происходит в результате автолиза части клеток и адсорбции фермента на
поверхности выживших бактерий. Наличие внеклеточной уреазы имеет большое
значение для приживления H.pylori [25]. Будучи сильным антигеном фермент
связывает антитела, которые могли бы повредить H.pylori, и комплекс
уреаза-антитело удаляется с поверхности клеток (после этого свободная уреаза
вновь появляется на поверхности клеток).
Уреаза H. pylori действует как токсин, поскольку ионы аммония,
образующиеся при гидролизе мочевины, повреждают эпителий. Уреаза усиливает
воспалительные реакции, за счет активации моноцитов и нейтрофилов, стимуляции
секреции цитокинов, образования радикалов кислорода и окиси азота; кроме того,
большая субъединица уреазы (UreB) действует как аттрактант для лейкоцитов [27]
Адгезины
Для успешной реализации своего патогенного потенциала, бактерии
необходимо иметь способность к адгезии к клеткам и элементам соединительной
ткани. Выявлено несколько адгезинов, определяющих выбор хозяина и
взаимодействующих с эпителиальными клетками [21]. В качестве рецепторов H.pylori
использует остатки сиаловых кислот и сульфогруппы гликопротеинов, гликолипидов,
фосфолипидов и остатки фукозы Люис-подобных антигенов. Показана также
способность микроба прилипать к белкам соединительной ткани, в частности к
коллагену, ламинину и витронектину.
Помимо уреазы и адгезинов, к числу факторов, которые предохра-няют H.pylori
от действия защитных сил организма и химиотерапевтических средств, относится
способность микроба к инвазии эпителиальных клеток. Можно предположить, что
вхождение H.pylori в эпителиальные клетки индуцируется самим микробом,
подобно тому, как это происходит в случае других видов бактерий [28]
Липополисахарид
Интересной особенностью является то, что липополисахарид (ЛПС) H.
pylori имеет в боковых цепях эпитопы, структурно сходные с эпитопами
Lewis-антигенов крови (Le), причем штаммы H. pylori могут
экспрессировать как Lex,, так и Ley или оба антигена. Эти антигены найдены
также в слизистой оболочке желудка и на поверхности лейкоцитов (CD15=Leх). При H.pylori-инфекции
за счет ЛПС возбудителя образуются антитела к Lewis -антигенам, причем, эти
антитела могут реагировать с аналогичными эпитопами тканей хозяина [29]. При
этом происходит фиксация комплемента иммунными комплексами, что вызывает
повреждение тканей [37, 38,39]. С другой стороны, наличие у H.pylori
эпитопов, присущих также Lewis - антигенам крови, является выражением
антигенной мимикрии микроба, в результате чего он не распознается организмом
как "чужой" [27]
Антимикробные пептиды
Малоизвестным фактом является антибактериальная активность самой H.pylori.
Эта активность была обнаружена при исследовании сырых лизатов бактерий и
прослежена до цекропин-подобного пептида, происходящего от N-концевой части рибосомального
протеина L1 (RpL1). Это короткая амфифильная альфа-спираль, содержащая
большое количество положительно-заряженных аминокислот. На данный момент
химически синтезирован и запатентован наиболее сильных из всех своих собратьев
пептид H.pylori (2-20), который обладает антибактериальной активностью в
отношении многих грамм-положительных и грамм-отрицательных бактерий, а так же
дрожжей C. albicans. Механизм действия еще не до конца изучен, но считается,
что благодаря обилию положительных остатков АК он обладает сродством к
отрицательно-заряженным группам фосфолипидов и вызывает образование поры,
ведущей к разрушению бактериальной мембраны. Интересно, что он не только не
токсичен для эукариотических клеток, но и обладает противосполительным
действием. [10-12]
Хотя активность in vivo не достаточно изучена, авторы
предполагают, что в желудке H.pylori может высвобождать антимикробные
пептиды путем так называемого "дружественного лизиса" с целью остановить
рост быстрорастущих микроорганизмов. Возможно, H.pylori важна для
поддержания нормального баланса микрофлоры человека. [12]
.4
Механизм развития воспалительных заболеваний
Итак, H.pylori попадает в организм человека фекально-оральным или
орально-оральным путем и начинает там жить. Часто заражение происходит еще в
детстве, наибольший процент инфицированности (до 75%) приходится на детей до 10
лет [30].
Механизм развития H.pylori-зависимых заболеваний пищевого тракта
изучен недостаточно, но ясно, что для укоренения в организме большое значение
имеют подвижность микроба, хемотаксис (основной хемоаттрактант - мочевина),
наличие адгезина, ацидотолерантность и уреаза, которую имеют все штаммы,
независимо от вирулентности или происхождения, которая участвует в активации
фагоцитов [31]. Все эти факторы, вместе с некоторыми саg-белками, вызывают
воспалительную реакцию слизистых оболочек. H. pylori стимулирует также
образование гастрина, что, в свою очередь, усиливает продукцию соляной кислоты
обкладочными клетками слизистой желудка. На все это наслаивается действие
цитотоксина VacA, который вызывает вакуолизацию
клеток эпителия, а возможно и плазмина, гидролизующего белки, в частности,
фибронектин. В результате возникают гастриты, изъязвление слизистой, лимфома
желудка (MALToMa), рак желудка. Показано, что более 2/3 случаев язвенной
болезни, лимфомы слизистой оболочки желудка и рака дистального отдела желудка,
связаны с инфекцией H.pylori.[32,33].
Обсеменение слизистой оболочки желудка HP сопровождается развитием
поверхностного антрального гастрита и дуоденита и ведет к повышению уровня
гастрина и снижению уровня соматостатина с последующим усилением секреции
соляной кислоты. Избыточное количество соляной кислоты, попадая в просвет
двенадцатиперстной кишки, в условиях относительного дефицита панкреатических
бикарбонатов способствует прогрессированию дуоденита и, кроме того,
обусловливает появление в двенадцатиперстной кишке участков желудочной
метаплазии (перестройки эпителия дуоденальной слизистой оболочки по желудочному
типу), которые быстро заселяются HP. В дальнейшем при неблагоприятном течении,
особенно при наличии дополнительных этиологических факторов (наследственная
предрасположенность, 0(1) группа крови, курение, нервно-психические стрессы,
алиментарные погрешности, прием ульцерогенных лекарственных препаратов и др.),
в участках метаплазированной слизистой оболочки желудка формируется язвенный
дефект. [31]
1.5
Бациллярно-кокковая трансформация H.pylori
Особый интерес представляет способность H.pylori превращаться из
спиралевидной в кокковую форму. Впервые это было обнаружено при попытках
культивирования выделенных от H.pylori-обсемененных больных
спиралевидных форм. Большинство исследователей считают, что кокковые формы -
приспособительная реакция бактерии к неблагоприятным условиям. При
исследованиях H.pylori в культуральной среде, переход спиралевидных форм
H.pylori в кокковые связывают с повышением рН и накоплением токсических
продуктов жизнедеятельности [34]. Но вопрос о трансформации H.pylori,
особенно в естественных условиях, все еще не до конца раскрыт.
.5.1
Кокковые формы H.pylori
Тот факт, что кокковые формы H.pylori не культивируется in vitro,
привел некоторых авторов к предположению, что они являются дегенерирующими или
мертвыми формами бактерии. Но в тоже время ряд исследований доказывает, что они
могут сохранять метаболическую активность, хотя и в меньшей степени, чем
активные пролифирирующиее клетки.
Было убедительно показано, что кокковые формы H. pylori сохраняют
клеточные структуры, свойственные спиралевидным формам H.pylori, но
некоторые из антигенов (CagA и porin) в ходе трансформации спиралей в кокки
исчезали. Поэтому кокковые формы H.pylori могут рассматриваться как
вполне жизнеспособные и представлять собой одну из стадий биологического цикла H.pylori
[38].
Часто в условиях in vitro кокки HP встречаются в двух формах, -
дегенеративные и истинные. По ультраструктурным признакам выделяют HP кокки
типа А (дегенеративные) и типа В (истинные). Тип А характеризуется
нерегулярными поверхностными и внутрицитоплазматическими структурами, которые
плотно смыкались друг с другом. Тип B имеет гладкую поверхность с нитями
(флагеллами), намотанными вокруг его собственного тела, а также строго
перепончатые структуры. [39] Тип А часто можно наблюдать у пациентов, прошедших
эрадикацию.
Кокковые формы типа В сохраняют способность синтезировать белки после 100
дневной инкубации в фосфатном буфере или в дистиллированной воде при 4С [40], а
так же при культивировании в анаэробных условиях в течение 7 дней [41].
Показана способность истинных кокковых форм к адгезии и инвазии эпителиальных
клеток [42]. Дольше всего кокковые формы сохраняются в изотонической среде при
температуре ниже 150С, тогда как при t=370C они быстро
теряют жизнеспособность. [43]
Ранние стадии кокковых форм сохраняют жгутики и подвижность, аналогичную
спиральным формам, а также полярную мембрану, ассоциированную с базальным
комплексом жгутиков. Эксперименты на гнотобионтах показали что неподвижные или
малоподвижные штаммы H.pylori менее вирулентны, чем подвижные штаммы.
Лишь небольшое количество кокковых форм H.pylori обладает полным набором
жгутиков и сохраняет метаболическую активность, обеспечивающую их подвижность,
сравнимую к таковой у спиралевидных форм.
Содержание уреазы в кокковых формах H.pylori снижено на 40 % по
сравнению со спиралевидными формами. Несмотря на то, что при трансформации в
кокковые формы H.pylori возможна утрата уреазной активности, в них
посредством полимеразной цепной реакции продолжают выявляться гены, кодирующие
уреазу (белок 26-kDa). [43]
Вирулентность кокковых форм HP была показана в эксперименте с заражением
мышей. Три штамма H. pylori, изолированных из гастробиоптатов пациентов
с язвами, были конвертированы из спиралевидных форм в кокковые формы, путем
перенесения и выдерживания в стерильной воде. Одну группу мышей линии BALB/c
заражали кокками HP, а другую заражали спиралевидными формами путем
внутрижелудочного введения. Хеликобактериоз в СОЖ у инфицированных мышей
подтверждали гистологическим и уреазным методами. На 21-й и на 28-й день после
прививки в обеих экспериментальных группах путем электронной микроскопии в СОЖ
зараженных мышей были выявлены спирали, бациллы и кокки. Гистологическое
исследование показало повреждение клеток эпителия СОЖ, появление язв и эрозий.
СОЖ была повреждена в большей степени у мышей, инфицированных кокками H.
pylori. Подобных результатов не было получено в контрольной группе
животных, которым внутрижелудочно вводили стерильную воду. Представленные
экспериментальные данные указывают на патогенность кокковых форм HP, т.е. на их
способность колонизировать СОЖ и вызывать гастриты. Также, очевидно, что
кокковые формы хеликобактера могут трансформироваться обратно в спиралевидные
формы. [44] Предполагается, что при фекально-оральном пути, который
рассматривается как основной путь распространения H.pylori, заражение
происходит именно через его кокковые формы [43].
Имеются предварительные данные, указывающие на то, что именно в период
трансформации спиралевидных форм H.pylori в кокковые наблюдается
максимальная активизация продукции ими активных форм кислорода. Различные
конформационные типы неспиралевидных форм H.pylori обладают
особенностями метаболизма, направленными на повышение устойчивости
микроорганизма к различным экзогенным, в том числе и к терапевтическим
воздействиям. [43]
В слизистой оболочке желудка встречаются и спиральные, и кокковые формы H.pylori,
причем в разных соотношениях. Первый вариант H.pylori - обсемененности
СОЖ - кокко-бациллярный (сочетанным). Он характеризуется тем, что в одном
биоптате одновременно присутствуют и спиралевидные и кокковые формы H.pylori.
Второй вариант H.pylori - обсемененности СОЖ - бациллярный. При этом
варианте в биоптате присутствуют только спиралевидные формы H.pylori. И,
наконец, в третьем варианте H.pylori - обсемененности СОЖ, в
гастробиоптатах обнаруживаются только кокковые формы H.pylori.
Важно отметить, что и у пациентов после эрадикации в биоптатах слизистой
оболочки желудка кокковые формы H.pylori могут преобладать над
спиралевидными, в большинстве случаев в биоптатах из антрального отдела желудка
[46].
Таким образом, имеющиеся литературные данные указывают на то, что наряду
с дегенерирующими бактериальными клетками H.pylori, которые имеют свои
морфологические особенности и внешне выглядят как кокки, существуют и истинные
- жизнеспособные кокковые формы H.pylori, которые имеют свои
морфологические критерии и способны трансформироваться обратно в спиралевидные
формы. К тому же, они выдерживают больший диапазон рН, способны сохраняться
анаэробных условиях и в холодной воде, а так же более устойчивы к антибиотикам.
1.5.2
Механизмы возникновения кокковых форм из бациллярных
1. Установлено, что в условиях in vitro, Helicobacter pylori трансформируется из бациллярной
(спиралевидной формы) в кокковую через промежуточное звено - U-форму. [35]. Начальная стадия
трансформации в кокковую форму сопровождается конденсацией протоплазматического
матрикса и увеличением перипластического пространства на одном из полюсов
бактериальной клетки (обычно на полюсе, противоположном базальному комплексу
жгутиков). Увеличение объема перипластического пространства приводит к
растяжению клеточной стенки и оттеснению протоплазматического матрикса на
периферию с образованием С-образных или U-образных форм. Эти формы являются
промежуточным звеном между спиралевидными и кокковыми формами бактерий.
Полностью сформировавшиеся кокковые формы сохраняют основную схему строения
бактериальной клетки, и характеризуются четко выраженной клеточной стенкой,
перипластическим пространством и цитоплазматической мембраной.

Рисунок 1 - Ультраструктура перехода из бациллярной формы в кокковую.
Ультратонкие срезы 2-дневной культуры H.pylori (A), показано инициирование перехода от
бактериальной в кокковую форму с образованием плотного периплазматического
материала (стрелка) (масштаб 400 нм) на 3 день (B) показано накопление плотного материала в периплазматическом
пространстве (стрелка) (масштаб 400 нм), на 4 день (С), показана изогнутая
внутрь бактериальная форме, которая представляет собой промежуточный шаг между
бациллярной и кокковой формами (масштаб 400 нм); в день 5 (D), показано изменение в цилиндре
протоплазмы (масштаб 400 нм) и на 7 день (E), полный вид кокковой формы (масштаб 400 нм) [35]
Вполне вероятно, что такой сценарий трансформации справедлив и для
условий in vivo, так как методом иммуноцитохимического анализа в
мазках-отпечатках гастробиоптатов U-формы часто встречаются одновременно с кокковыми.
Рисунок 2 - Бактериальные клетки спиралевидных и кокковых форм,
диплококковой формы и U-формы
Helicobacter pylori, выявленные
иммуноцитохимическим методом. Мазок-отпечаток биоптата слизистой оболочки
желудка. Увеличение 1000х.
. Как уже упоминалось, наряду с жизнеспособными кокковыми формами,
представляющими собой плотные гладкие структуры, встречаются и дегенеративные
формы, характеризующиеся нерегулярными поверхностными и
внутрицитоплазматическими структурами. Возникновение таких форм, по-видимому,
связано непосредственно с гибелью бактериальных клеток.
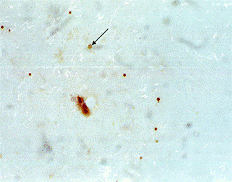
Рисунок 3 - Бактериальная кокковая клетка Helicobacter pylori дегенеративной
формы (отмечена стрелкой), выявленная иммуноцитохимическим методом в биоптате
слизистой оболочки желудка у пациента через месяц после эрадикации.
Увеличение 1000 х.
3. В ряде случаев, иммуноцитохимическим окрашиванием в препаратах из СОЖ
обнаруживались события (см. рисунки 5-7), объяснение которым стало возможным
дать только после выхода в январе 2013года статьи Specht M. и соавторов "Localization of FtsZ in Helicobacter pylori and Consequences for Cell Division" [36]. Эта статья посвящена
изучению процесса деления клетки H.pylori путем визуализации Z-кольца - кольца
сжатия, которое формируется в области сайта деления клетки. Главной структурной
и функциональной единицей кольца является нуклеотидсвязывающий белок FtsZ,
способный к полимеризации-деполимеризации. С помощью зеленого флуоресцентного
белка, связывающего FtsZ, было показано, что деление H.pylori в 50%
случаев происходит ассиметрично, размеры дочерних клеток сильно отличаются.
Результаты подтверждены электронно-сканирующей микроскопией.

Рисунок 4 - Покадровая микроскопия комплекса FtsZ-GFP. Белые треугольники
обозначают полярные очаги FtsZ; желтые треугольники обозначают кольца Z.
Спиральные метки отмечены белыми звездочками. Цифры указывают время в минутах.
FM, мембранные пятно FM4-64. Нижняя панель показывает наложение комплекса
FtsZ-GFP (зеленый) на мембрану FM4-64 (красный).
Дифференциальный интерференционный контраст. Масштаб - 2 мкм [36]
Таким образом, путь клеточного деления H.pylori сильно отличается
от E. coli и B. subtilis. Так же авторы изучили локализацию
жгутиков в дочерних клетках и пришли к заключению, что большие и малые клетки
не различимы с точки зрения получения жгутиков, они всегда наблюдаются на обоих
полюсах клетки, даже непосредственно перед ее делением. Причины, вызывающие
ассиметричное расположение Z-кольца,
неизвестны. Авторы не исключают, что асимметрия вызвана неравномерным ростом
частей клетки, но предполагают возможность существования неких специфических
факторов асимметрии, происхождение которых еще предстоит выяснить. [36]
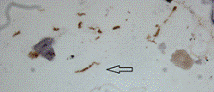
Рисунок 5 - Бактериальные клетки спиралевидных форм Helicobacter pylori, выявленные иммуноцитохимическим методом, в
биоптате слизистой оболочки желудка. Стрелкой отмечена клетка, предположительно
находящаяся в процессе неравномерного деления. Увеличение 1000х.
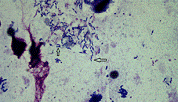
Рисунок 6 - Бактериальные клетки Helicobacter pylori в слизистой оболочке желудка.
Окраска азур 2 - эозином по Романовскому. Стрелкой отмечена клетка,
предположительно находящаяся в процессе неравномерного деления. Увеличение
1000х.
Рисунок 7 - Бактериальные клетки спиралевидных форм Helicobacter pylori, выявленные иммуноцитохимическим методом, в
биоптате слизистой оболочки желудка. Стрелкой отмечена клетка, предположительно
находящаяся в процессе неравномерного деления. Увеличение 1000х.
Возможно, что в результате дробления большой спиральной бактериальной
клетки может получиться спираль поменьше ("большой брат") и кокк
("маленький брат").
.6
Иммуноцитохимический метод диагностики
.6.1
Авидин-биотиновый метод
Принцип иммууноцитохимического метода схож с иммуноферментным анализом. В
частности, авидин-биотиновый метод основан на высокой аффинности авидина или
стрептавидина к биотину (константа диссоциации 10-19М). Авидин - это
гликопротеин с молекулярной массой 68 кД, имеющий высокое сродство к биотину -
витамину с малой молекулярной массой. Высокая чувствительность
авидин-биотинового метода обусловлена химической структурой авидина, имеющего
четыре участка для связи с биотином. Однако из-за молекулярной ориентации
биотин-связывающих участков, на самом деле связывается не менее 4 молекул
биотина. Метод включает следующие основные этапы инкубации: с немечеными
первыми (специфичными) антителами; со вторыми биотинилированными антителами; с
комплексом авидина с биотинилированной пероксидазой, с последующим проявлением
пероксидазы хрена субстратом диаминобензидином [47].
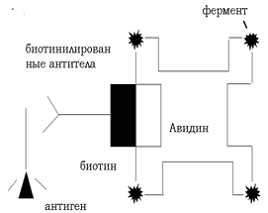
Рисунок 8 - Авидин - биотиновый метод
Таким образом, принцип иммуноцитохимического метода основан на высоко
специфическом связывании антител, которые в дальнейшем можно визуализировать
путем химической реакции, с антигенами клеточной стенки H.pylori. В
результате проведенной иммуноцитохимической реакции только те бактериальные
клетки, в том числе и кокки, которые имеют антигены, специфичные для H.pylori,
будут иметь характерное окрашивание.
Иммуноцитохимическое выявление различных форм H. рylori (спиралевидных и
кокковых) достаточно редко применяется в медицинской практике, ввиду своей
дороговизны и трудности пробоподготовки. При этом он имеет неоспоримую ценность
при контроле эффективности эрадикации, потому что при окраске цитологических
мазков рутинными методами, невозможно отличить кокковые формы Н. pylori от кокков других видов [48].
.6.2 Метод жидкостной иммуноцитохимии
В последнее время активно развивается метод жидкостной цитологии (ЖЦ).
Суть метода заключается в том, что клеточный материал не переносится сразу на
стекло, а смывается в подготовленный стабилизирующий раствор и отправляется в
лабораторию. В условиях лаборатории при помощи специального оборудования
происходит приготовление стандартного цитологического препарата из присланной
суспензии клеток. В силу распределения материала на предметном стекле в виде
монослоя снижается количество ложноотрицательных результатов цитологического
исследования.
На материале слизистой оболочки желудка метод был впервые применен для
диагностики доброкачественных и злокачественных поражений желудка в
исследовании Никитиной Л.В. и соавторов "Иммуноцитохимические исследования
и жидкостная цитология в диагностике поражений желудка", опубликованном в
2012 году. [49]
В доступной литературе мы не встретили данных о применении метода ЖЦ для
бактериальных суспензий. Тем не менее, в препаратах ИЦХ из прямых мазков-отпечатков
может присутствовать посторонняя кокковая флора, которая в присутствии
эндогенного биотина и пероксидазы, продуцируемой лейкоцитами, а так же в
результате опсонизации вполне может окрашиваться хромогеном ДАБ и на
неспецифическом фоне выглядеть идентично кокковым формам H.pylori.
ЖЦ предусматривает получение отмытого от неспецифического фона материала
в виде клеточной суспензии, с последующим цитоцентрифугированием на предметное
стекло. В полученных монослойных мазках-цитоцентрифугатах проводят ИЦХ
исследование, которое исключает неспецифическое окрашивание.
.7
Сезонность инфекционных заболеваний
Сезонные колебания болезней и смертей среди людей и животных известны уже
многие века. Еще Гиппократ отмечал, что "осенью болезни бывают самые
острые и самые смертельные; весна, напротив, самое здоровое время и менее всего
несет смертности". В те времена сезонным изменением погоды объясняли
многие болезни, такие как туберкулез, астма, фурункулы, язвы. Сезонные циклы
инфекционных заболеваний можно отнести к изменениям в метеорологических
условиях и светового периода, распространенности и вирулентности возбудителя,
поведению самого человека и сезонным изменениям его иммунитета. Выявление
факторов, играющих решающую роль в устойчивости человека к инфекционным заболеваниям
в течение части года, может иметь большое значение для лечения и профилактики
этих болезней.
Давно известны и математически описаны регулярные вспышки различных
инфекционных заболеваний, сезонность которых сохраняется даже после искоренения
крупных эпидемий (корь, менингит, пиелонефрит). Вспышки таких заболеваний
приходятся на разные сезоны, но для каждого возбудителя их сроки и
характеристики удивительно последовательны из года в год. Наблюдается так же
удивительная согласованность времени наступления вспышек заболеваний в
различных географических районах для, например, ротовируса, гриппа,
полиомиелита. Интересно так же, что регулярные и предсказуемые картины сезонных
вспышек доминируют в эпидемиологии исключительно человеческих патогенов.
Чаще всего периодичность вспышек инфекционных заболеваний объясняют
изменениями в условиях окружающей среды. Замечены корреляции между
эпидемиологическими циклами и циклами температур, влажности, осадков и ветра.
Правда, не всегда таким корреляциям находят подходящее биологическое
обоснование.
Либо объяснение находится, но корреляция наблюдается не всегда. Например,
в одних областях (Орегон) пик менингококковой инфекции наблюдается во время
сезона дождей, а в других - во время сезона сухих ветров (Африка южнее Сахары).
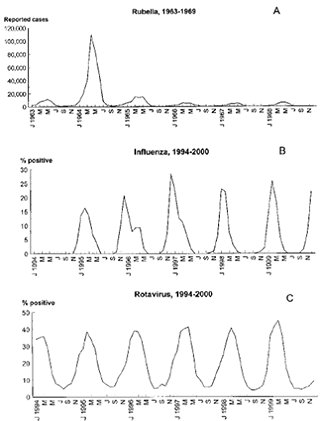
Рисунок 9 - Сезонное изменение в возникновении трех человеческих
патогенов в США: A - краснуха, B - вирус гриппа, C - ротавирус [50]
Но бывают и достаточно ясные случаи. Например, риновирус активно
реплицируется при низких температурах, а зимой в носу как раз около 34С или
даже меньше. Распространение пиелонефрита летом связывают с мухами, которые
являются его переносчиками и отсутствуют в холодное время года.
Так же регулярные изменения полиомиелита, кори и других сезонных
заболеваний связывают с изменениями поведения самого носителя - человека.
Например, очевидно, что купание в течение летнего сезона способствует
распространению инфекций. [50]
Регулярные ежегодные изменения могут быть связаны с восприимчивостью
человеческого организма к конкретным возбудителям. Сейчас активно исследуются
сезонные изменения в иммунной функции. Например, уровень клеток, участвующих в
клеточном иммунитете (Т-киллеры, которые осуществляют лизис поврежденных клеток
собственного организма), понижен зимой, а лимфоцитов, ответственных за
производство антител (В-клетки и Т-хэлперы), наоборот, повышен. Хотя общий
уровень лимфоцитов при этом остается постоянным.
Неизвестны природные сигналы, которые побуждают к сезонным изменениям
человеческий иммунитет. Возможно, большую роль в этом играет температура
воздуха и фотопериод. Так же возможно, что сезонные различия в гуморальном
иммунитете являются приспособительной реакцией к сезонным изменениям
бактериальных и вирусных патогенов. [51]
В общем, единой теории сезонности инфекционных заболеваний не существует,
и, возможно, она и не может существовать: слишком много факторов и слишком
много противоречий.
.8
Сезонность H.pylori-ассоциированных заболеваний
Язвенная болезнь является ярким примером сезонности, обострения ее
приходятся в разных регионах на осень, зиму или весну. Несмотря на
многочисленные исследования, до сих пор не понятны причины сезонности
обострений язвенной болезни. Виноваты могут быть и климатические изменения, и
человеческое поведение, и имунные… Хотя многие гастроэнтерологи считают ЯБ
системным заболеванием, в развитии которого учувствуют и психосоматические и
психосоциальные механизмы, значительные исследования четко установили, что H.pylori,
является серьезной причиной язвенной болезни.
Язвенная болезнь желудочно-двенадцатиперстного тракта - это дефект
слизистой оболочки в результате повреждения эпителиальных клеток, вызванный
едкими веществами - кислотой и пепсином. [52]
В таблице 1 представлены данные о большинстве длительных исследованиях
сезонного ритма язвенной болезни
Таблица 1 Сезонные колебания в возникновении ЯБДПК и связанных с ней
осложнений в ряде стран и континентов [52]
|
Заболевание
|
Авторы
|
Выборка
|
Временной период
|
Пик
|
|
Язвенная болезнь
|
|
|
|
|
|
Scholtyssek et al, 1986 (Germany)
|
1091
|
1973 - 1983
|
ноябрь
|
|
Sonnenberg et al
1992 (U.S.A.)
|
неизвестно
|
недоступно
|
январь-март, октябрь
|
|
Savarino et al, 1996
(Italy)
|
319
|
1987 - 1992
|
ноябрь-декабрь январь-март
|
|
кровотечение
|
|
|
|
|
|
Marbella et al,
1988 (U.S.A.)
|
285
|
1974 - 1976
|
январь-февраль, июль-
август ноябрь-декабрь
|
|
Tishchenko et al, 1990
(Russia)
|
390
|
недоступно
|
январь, сентябрь, окрябрь
|
|
Shih et al, 1993 (Taiwan)
|
2,889
|
1987 - 1992
|
январь-февраль
|
|
Thomopoulos et al, 1997
(Greece)
|
1,992
|
1991 - 1996
|
апрель октябрь
|
|
Tsai et al, 1998 (Taiwan)
|
10,331
|
1989 - 1996
|
ноябрь-март
|
|
Rodrìguez
et al, 1999 (Mexico)
|
275
|
1991 - 1997
|
май, июнь, ноябрь
|
|
Nomura et al, 2001 (Japan)
|
441
|
1996 - 1999
|
осень и зима
|
|
Lopez-Cepero et
al, 2005 (Spain)
|
499
|
1998 - 2001
|
не выявлено
|
|
Перфорация
|
|
|
|
|
|
Adler et al, 1984
(Australia)
|
1,187
|
1971 - 1981
|
ноябрь-январь
|
|
Christensen et al, 1988
(Denmark)
|
296
|
1975 - 1984
|
август-сентябрь
|
|
Bendahan et al, 1992
(Israel)
|
540
|
1977 - 1986
|
ноябрь-февраль
|
|
Csendes et al, 1995 (Chile)
|
неизвестно
|
1980,1985,1990
|
осень
|
|
Yen et al, 1996 (Taiwan)
|
1,787
|
1991 - 1992
|
февраль-март
|
|
Svanes et al, 1998 (Norway)
|
1,480
|
1935 - 1990
|
май-июль, декабрь-январь
|
|
Wysocki et al, 1999
(Poland)
|
неизвестно
|
1991 - 1995
|
май-июль, сентябрь-окрябрь
|
|
Janik & hwirot, 2000
(Poland)
|
441
|
1977 - 1996
|
не выявлено
|
|
Budzynski et al, 2000
(Poland)
|
220
|
1993 - 1997
|
не выявлено
|
|
Liu et al, 2003 (China)
|
24,252
|
1992 - 1997
|
зима и весна
|
|
Kocer et al, 2006 (Turkey)
|
269
|
2001 - 2004
|
зима
|
В чем причина возникновения пиков? Часто находят корреляцию с изменением
различных метеоусловий (рисунок 2). Так, в Тайване, выявили обратно
пропорциональную зависимость частоты обращений от влажности воздуха и
температуры среди пожилых людей (старше 65 лет). Интересно, что вне зависимости
от типа климата (субтропический, как в Тайване и Израиле, или умеренный, как в
Норвегии), почти всегда выделяются пики во время зимы. Авторы Тайваньской
статьи предполагают, что это может быть связано с изменением уровня мелатонина,
вызванного фотопериодизмом, а не со стрессом от "суровых зим" [53].

Рисунок 10 - Время ежемесячных госпитализаций с диагнозом ЯБ и средние
уровни метеорологических величин [54]
Так же авторы предполагают связь зимнего пика с увеличением интенсивности
курения в осенне-зимние месяцы, а небольшого пика заболеваемости летом среди
подростков - со стрессом, который обычно сопутствует вступительным экзаменами.
Существует еще множество факторов, потенциально прямо или косвенно
участвующих в рецидивах язвенной болезни: это и курение, и респираторные
заболевания, и прием нестероидных противовоспалительных средств, а так же
различные метеорологические условия и изменения иммунной функции. Существуют
некоторые предварительные данные о наличии циркадных ритмов рН желудка,
пищеварительных ферментов, репликации клеток слизистой оболочки и
кровоснабжения. [52]
Сезонность инфекции H.pylori является еще одним возможным фактором,
который может повлиять на язвенную болезнь. Немецкие исследователи в 1999 году
обнаружили годичный ритм распространенности H.pylori, параллельный ритму
язвенной болезни. Правда, выборка в этом исследовании достаточно маленькая -
1076человек. Тем не менее, было достоверно обнаружено, что пик
распространенности H.pylori приходится на декабрь (59,9%), май (55,6%),
февраль (46,7%), сентябрь (45,7%) и октябрь (43,4 %). Распространенность H.pylori
в другие месяцы года была менее чем 35% (р <.001). В целом, пик частоты
язвенной болезни наблюдался осенью, как и в большинстве докладов на эту тему
[55].

Рисунок 11 - Сравнение годичного распределения НР-положительных и
НР-отрицательных анализов для каждого месяца (открытые столбцы - отрицательный
анализ, темные столбцы - положительный) [55]
В тоже время, Savarino и соавт.
[54] не нашли никакой разницы в процентах H.pylori-инфицированных язвенников между
сезонами или параллели между ежегодными колебаниями кислотности желудочного
сока и H.pylori-инфекции.
Весьма интересно исследование 2011 года об эффективности эрадикации H.pylori
в зависимости от времени года. Исследование проводилось среди 512 пациентов,
прошедших эрадикацию стандартной тройной терапией, с диагнозом язва
двенадцатиперстной кишки функциональная диспепсия. Данные исследования
представлены в таблице 2.
Таблица 2 Успешность эрадикации в различные времена года [56]
|
Сезон
|
Успешность эрадикации, %
|
|
весна
|
65,7
|
|
лето
|
79,5
|
|
осень
|
65,4
|
|
зима
|
82,9
|
Наилучшие результаты эрадикации были в декабре - 83,8%, наихудшие в
сентябре - 54,1%.
Регрессионный анализ показал, что сезоны влияют на темпы ликвидации
самостоятельно (г = 0,009).
Авторы сделали вывод, что успех первой линии эрадикационной терапии
(стандартная тройная терапия) претерпевает сезонные изменения. Причинами для
этого могут быть сезонные изменения в популяции бактерий (плотность/патогенетических
факторов/резистентность к противомикробным препаратам), иммунитет хозяина или
экологические факторы (климат, питание) [56].
Таким образом, данные представленного обзора указывают на патогенность
НР, особенно их кокковых форм в развитии кислотозависимых заболеваний и роли
кокковых форм в распространении НР-инфекции. Очевидна выраженная сезонность
НР-ассоциированных заболеваний, и, следовательно, сезонные обострения ЯБ могут
быть связаны с активностью бактериальных клеток, инфицирующих СОЖ. Учитывая, что
бактериальные клетки H.pylori проявляют бациллярно-кокковый диморфизм
(т.е. присутствуют в СОЖ в спиралевидных и кокковых формах), то
бациллярно-кокковая трансформация (переход спиралевидных форм в кокковые и
наоборот) может рассматриваться как проявление активности жизнедеятельности
этого микроба в СОЖ.
2. Цели и
задачи работы
бактерия кокковый бациллярный воспалительный
Цель:
Изучить особенности сезонного колебания показателя "степень
обсемененности СОЖ кокковыми формами", и изучение сезонного биоритма
бациллярно-кокковой трансформации H.pylori в антральном отделе желудка.
Задачи:
1. Создать базу данных эндоскопических диагнозов и результатов
иммуноцитохимических анализов, пригодную для последующей аналитической
обработки.
. Определить характер распределения пациентов по показателю "частота
встречаемости кокковых форм в СОЖ".
. Провести контрольное ИЦХ исследование гастробиоптатов методом ЖЦ на
предмет присутствия в них истинных кокковых форм, а так же определить частоту
их встречаемости среди всех бактериальных клеток H.pylori .
. Изучить и представить графически сезонные колебания показателя
"степень обсемененности СОЖ кокковыми формами".
3.
Экспериментальная часть
.1
Характеристика исходных данных
На протяжении 8 лет, с 2002 по 2009 год, в клинике МЧС проводилось
большое количество исследований мазков-отпечатков, полученные при
эндоскопическом обследовании из биоптатов антрального отдела СОЖ. Основным
методом исследования был иммуноцитохимический (см. п. 1.7), который позволил
оценить соотношение кокковых и бациллярных форм H.pylori в антральном
отделе желудка для порядка 5000 пациентов.
В качестве первичных антител использовались поликлональные кроличьи
антитела против термостабильных антигенов клеточной стенки H.pylori. Они
дают четкую окраску бактериальной клетки, в отличие от моноклональных антител,
при использовании которых не удалось добиться необходимой четкости. Возможно,
это связано с неравномерным распределением специфического антигена на
поверхности клетки.
После проведенной иммуноцитохимической реакции в цитологических мазках
бактериальные клетки H.pylori (спиралевидные и кокковые формы)
окрашивались диаминобензидиномм в цвета от темно-коричневого до насыщенного
черного.
3.1.1 Полуколичественная оценка степени обсемененности СОЖ
кокковыми формами
Полуколичественная оценка результатов иммуноцитохимических исследований
мазков-отпечатков гастробиоптатов осуществлялась на основании предварительно
разработанной системы, включающей четыре условные градации:
"0" Кокковые формы H.pylori не выявлены (кокковые формы
не встречаются ни в одном из просмотренных полей зрения).
"1" Встречаются единичные кокковые формы (соответствует
наблюдению, когда бактериальная клетка-кокк обнаруживается не реже, чем в одном
из пяти полей зрения).
"2" Присутствуют кокковые H.pylori (если в каждом
просмотренном поле зрения встречаются кокки H.pylori и количество их не
превышает 10% от всех наблюдаемых форм H.pylori (спиралевидных и
кокковых).
"3" Кокковые формы H.pylori обнаруживаются в значительном
количестве, (кокки обнаруживаются практически во всех полях зрения и доля их
превышает 10% от всех форм H.pylori (спиралевидных и кокковых)).
Детального представления в количественной шкале по степени обсемененности
СОЖ кокками до настоящего времени не существует. Для того, чтобы иметь полное
представление о численности (% содержании) кокковых форм в СОЖ необходимо
определить процент встречаемости кокковых форм в больших группах пациентов. А
так же определить характер распределения пациентов по показателю "процент
встречаемости кокковых форм в СОЖ". Для практического использования
полуколичественной шкалы необходимо сопоставления одних и тех же пациентов,
которые были одновременно оценены по полуколичественной шкале и по
количественной шкале, которая подразумевает распределение пациентов по признаку
"частота встречаемости кокковых форм в СОЖ".
Проведение такого исследования с выяснением характера распределения
пациентов по признаку ""частота встречаемости кокковых форм в
СОЖ" крайне необходимо для окончательного выяснения вопроса о том, в каком
количестве резерв кокковых форм H.pylori присутствует в антральном
отделе желудка.
3.2 Методы исследования и обработки экспериментальных данных.
.2.1 Обработка данных эндоскопических исследований и ИЦХ.
Данные журналов клинических исследований отделения эндоскопии, методом
мануального перелистывания с использованием системы естественного визуального
контроля и портативной компьютерной техники, были сведены в таблицы Microsoft Exel 2010. Для установления сезонного биоритма нет
необходимости учитывать пол и возраст пациента, так как корреляции между этими
параметрами и свойствами H.pylori в пищевом тракте не отмечено [54].
Поэтому при составлении базы данных учитывались только данные эндоскопического
и иммуноцитохимического исследования и дата проведения обследования.
Эндоскопические диагнозы были разбиты на 4 группы в зависимости от степени
воспаления СОЖ:
1. Хронические состояния: хронический гастрит, хронический
диффузный гастрит, поверхностный диффузный гастрит, хронический антральный гастрит,
очаговый гастрит, поверхностный гастрит, хронический дуоденит, хронический
бульбит, культи желудка, полипы желудка и пищевода, хронический атрофический
диффузный гастрит, зарубцевавшаяся язва, рубцевая деформация ЛДПК,
2. Уже не хронические, но еще и не эрозивные: катаральный бульбит, очаговый
бульбит, поверхностный бульбит, рефлюкс-эзофагит, катаральный эзофагит, острый
эзофагит, пищевод Баррета, ГЭРБ, хронический рефлюкс-гастрит, хронические
эрозии.
3. Эрозивные состояния: эрозии желудка, эрозивный бульбит, эрозивный
гастрит, эрозивный дуоденит, эрозивный эзофагит, эрозии 12-перстной кишки,
острые эрозии желдка, острые эрозии 12-перстной кишки.
4. Язвенные состояния: язва желудка, язва 12-перстной кишки, язва ЛДПК,
язва пилорического канала, язвы пищевода, острые язвы, рубцующиеся язвы.
В случае наличия нескольких эндоскопических диагнозов, группу выбирали по
диагнозу, соответствующему большей степени воспаления (например, диагноз
"эрозивный антральный гастрит, острые язвы антрального отдела" относится
к 4 группе).
Впоследствии было введено понятие "кокковый индекс" - отношение
числа пациентов, у которых было обнаружено значительное количество кокковых
форм в СОЖ (по системе это "2" или "3"), к общему числу
инфицированных H.pylori.
Графики и диаграммы сезонного изменения степени обсемененности СОЖ
кокковыми формами H.pylori строились по данным исключительно 1 группы
диагнозов. Это объясняется необходимостью рассмотреть динамику
бациллярно-кокковой трансформации в условиях, максимально приближенных к
естественным условиям жизни популяции, т.е. как минимум неотягощённых стрессом,
связанным с иммунным ответом больного, сопряженного с высокой степенью
воспаления в слизистой.
3.2.2 Методы статистической обработки
Достоверность различий данных определялась с помощью критерия Фишера
(угловое преобразование Фишера). Этот критерий оценивает достоверность различий
между процентными долями двух выборок, в которых зарегистрирован интересующий
нас эффект. Суть углового преобразования Фишера состоит в переводе процентных
долей в величины центрального угла, который измеряется в радианах. Большей
процентной доле будет соответствовать больший угол φ,
а меньшей доле - меньший
угол, но соотношения здесь не линейные:

где P - процентная доля, выраженная в долях единицы, Где p и q -
процентные доли выборок, в которых зарегестрирован интересующий эффект, М и N -
объемы выборок [57]
При увеличении расхождения между углами φ1 и φ2 и увеличения численности выборок
значение критерия возрастает. Чем больше величина φэмп, тем более вероятно, что различия
достоверны. Критическое значение φэмп для уровня значимости 0,05 равно
1,64. То есть, если φэмп = 1,64: если φэмп < 1,64, то характеристики
сравниваемых выборок совпадают на уровне значимости 0,05; а если φэмп > 1,64, то достоверность различий
характеристик сравниваемых выборок составляет 95%.
3.2.3 Метод жидкостной иммуноцитохимии
Все гастробиоптаты СОЖ, полученные при выполнении
фиброэзофагогастродуоденоскопии с прицельной многократной биопсией, помещались
в одну пробирку со стерильным фосфатным буфером. Пробирку с содержимым
интенсивно встряхивали несколько раз, а гастробиоптаты вынимали,
гомогенизировали и помещали в другую пробирку с 2,5 мл свежего буфера.
Полученную суспензию подвергали центрифугированию на роторной центрифуге в
течение 10 минут со скоростью 1600 об/минуту, затем из надосадочной жидкости
готовили концентрированные монослойные цитологические препараты с
использованием цитоцентрифуги CytoFuge2. Для этого надосадочную жидкость в объеме 200 мкл помещали в
фильтр-концентратор и центрифугировали в течение 10 на скорости 1600 об/минуту.
Полученные монослойные цитологические препараты фиксировали смесью спирт:
ацетон в соотношении 1:1 и затем окрашивали иммуноцитохимическим методом в
авидин-биотиновом варианте, который включал следующие этапы:
· промывку в двух сменах трис- NаСL - буфера по 5 минут;
· блокировку эндогенной пероксидазы в 3% растворе перекиси
водорода на метаноле в холодильнике при + 4ºС в течение 30 минут;
· промывку в двух сменах трис-NaCL - буфера по 5 минут,
· инкубацию с нормальной сывороткой - 30 минут;
· инкубацию с первыми кроличьими поликлональными антителами к
антигенам клеточной стенки H.pylori (DAKO) в течение одного часа при комнатной температуре;
· промывку в двух сменах трис-NaCL - буфера по 5 минут;
· инкубацию со вторыми антикроличьми мышиными антителами (DAKO) 30 минут во влажной камере;
· промывку в двух сменах трис-NaCL - буфера по 5 минут;
· инкубацию с авидин-биотиновым (DAKO) комплексом 30 минут;
· промывку в двух сменах трис-NaCL - буфера по 5 минут;
· проявление пероксидазы диаминобензидином (DAKO) (под
контролем микроскопа);
· промывку дистиллированной воде 5 минут;
· докрашивание гематоксилином Майера 1 минуту.
.3 Результаты исследований, их анализ и обсуждение
.3.1
Результаты жидкостной иммуноцитохимии
Технологией жидкостной цитологии было обработано и окрашено
иммуноцитохимическим методом 8 гастробиоптатов из антрального отдела желудка.
Ввиду того, что у нас не стояло задачей количественное определение НР в СОЖ
пациента, а лишь установление достоверности присутствия некоторого количества
кокковых форм, все гастробиоптаты обрабатывались одновременно. В результате
было получено 24 препаратов: 16 из гомогенизированных гастробиоптатов и 8 из
смыва с гастробиоптатов. Во всех препаратах были выявлены бактериальные клетки,
имеющие специфическое для H.pylori окрашивание.
После проведенной иммуноцитохимической реакции в препаратах,
приготовленных из гомогенизированных гастробиоптатов, бактериальные клетки H.pylori
(спиралевидные и кокковые формы) окрашивались диаминобензидином в цвета от
темно-коричневого до насыщенного черного.
Размеры спиралевидных форм бактериальных клеток НР варьировали от 3-5 мкм
в длину и составляли около 0.5 мкм в поперечнике. Нередко наблюдались
спиралевидные формы, соединенные между собой последовательно образуя цепочку.
Кокковые формы НР имели размеры от 0.5 до 1мкм в диаметре, идеально
округлую форму и окрашивались равномерно с несколько большей интенсивностью,
чем спиралевидные формы НР.
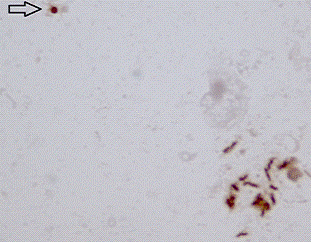
Рисунок 13 - Бактериальные клетки Helicobacter pylori, выявленные иммуноцитохимическим методом, в
препарате, приготовленном из гомогенизированного биоптата слизистой оболочки
желудка методой ЖЦ. Стрелкой обозначена кокковая форма НР. Увеличение 1000х.

Рисунок 14 - Кокковая форма Helicobacter pylori, выявленная иммуноцитохимическим методом, в
препарате, приготовленном из гомогенизированного биоптата слизистой оболочки
желудка методой ЖЦ. Увеличение 1000х.
А в препаратах суспензий клетки выглядели менее четко, были заметно менее
спиральными (рисунки 15-16). Возможно, это связано с изменениями в структуре
пептидогликана, отвечающего за форму бактерии, при достаточно длительном
контакте с фосфатным буфером.
Рисунок 15 - Бактериальные клетки Helicobacter pylori, выявленные иммуноцитохимическим методом, в
препарате, приготовленном из смыва с биоптата слизистой оболочки желудка
методом ЖЦ. Увеличение 1000х.

Рисунок 16 - Кокковая форма Helicobacter pylori, выявленная иммуноцитохимическим методом, в
препарате, приготовленном из смыва с биоптата слизистой оболочки желудка
методом ЖЦ. Увеличение 1000х.
Тем не менее,
можно утверждать, что нам удалось выявить истинные кокковые формы НР и что
частоты их встречаемости в цитоцентрифугатах после ЖЦ совпадают с частотами
встречаемости кокковых форм в прямых цитологических препаратах -
мазках-отпечатках СОЖ (3-5%).
3.3.2
Количественная и полуколичественная оценка степени обсемененности СОЖ кокковыми
формами
В рамках данного дипломного проекта был выполнен анализ данных о
пациентах, поступивших в клинику в 2008 году с диагнозом хронический HP-ассоциированный гастрит. Было
установлено процентное содержание кокковых форм в 220 препаратах, полученных из
антрального отдела желудка и окрашенных иммуноцитохимическим методом. В
результате получены гистограммы, характеризующие частоту встречаемости кокковых
и У-форм в СОЖ по количественной и полуколичественной шкале.
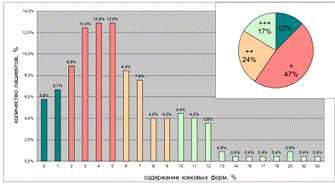
Рисунок 17 - Распределение H.pylori-инфицированных пациентов с
диагнозом хронический гастрит по признаку "частота встречаемости кокковых
форм в СОЖ". На круговой диаграмме изображено полуколичественное
распределение пациентов по степени обсемененности СОЖ кокковыми формами НР
На рисунке 17 представлено распределение 220 пациентов с диагнозом
"хронический гастрит" по показателю "частота встречаемости
кокковых форм НР в СОЖ". Из представленной гистограммы видно, что
существует один модальный класс, соответствующий содержанию кокковых форм
5-10%.
Отметим, что для оценки степени обсемененности СОЖ кокковыми формами НР
была предложена, опубликована и используется по настоящее время полуколичественная
шкала, содержащаяся в разделе 3.1.1.
В гистограмме (рисунок 17), мы попытались с помощью цветовой маркировки
выделить пациентов, которые в случае их оценки по полуколичественной шкале
соответствовали градациям:
|
Количество кокковых форм среди
100 клеток H.pylori во всех полях зрения, шт
|
Заключение
|
|
0-1
|
Кокковые формы H.pylori
отсутствуют (к -)
|
|
2-5
|
Встречаются единичные
кокковые H.pylori (к +)
|
|
6-9
|
присутствуют кокковые
H.pylori (к ++)
|
|
>10
|
Присутствуют в значительном
количестве (к +++)
|
Очевидно, что представленная гистограмма, которую можно рассматривать как
количественную шкалу, вполне соответствует ранее принятой полуколичественной.
Однако, мы считаем, что в дальнейшем для количественной оценки
бациллярно-кокковой трансформации H.pylori необходимо к кокковым формам
причислять и U-формы, так как очевидно, что они являются неотъемлемой частью
трансформации из спиральных форм в кокковые. Поэтому, если мы будем проводить
анализ сезонных колебаний активности бациллярно-кокковой трансформации НР в
СОЖ, то для точной ее оценки необходимо рассмотреть аналогичные распределения
для пациентов, где показателем активности бациллярно-кокковой трансформации
была бы частота встречаемости не только кокковых форм, но и добавленная к ним
частота встречаемости переходных U-форм.
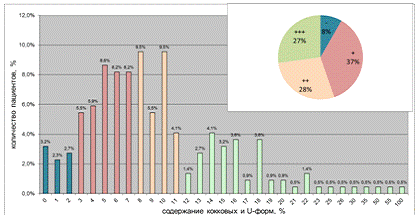
Рисунок 18 - Распределение H.pylori-инфицированных пациентов с
диагнозом хронический гастрит по признаку "частота встречаемости кокковых
и U-форм в СОЖ".
На круговой диаграмме изображено полуколичественное распределение
пациентов по степени обсемененности СОЖ кокковыми и U-формами НР. Из рисунка 18, отражающего распределение H.pylori-инфицированных
пациентов с диагнозом хронический гастрит по признаку "частота
встречаемости кокковых и U-форм
в СОЖ" видно, что характер распределения ассиметричный, двухвершинный, с
асимметрией вправо и что среди НР-инфицированных существует модальный класс,
соответствующих содержанию кокковых форм 5-8% и субмодальный класс - 12-22%. Мы
так же можем утверждать, что практически все пациенты из этого класса (кокки + U-формы > 11%) соответствуют
пациентам с максимальной полуколичественной оценкой "к +++". Поэтому
именно по показателю "к +++" мы провели анализ сезонных колебаний
бациллярно-кокковой трансофрмации. Учитывая, что в этом распределении
учитывались так же и U-формы
НР, которые не учитывались ранее, этот класс соответствует содержанию кокковых
форм больше 10%. В базе данных за 2002-2009 годы среди H.pylori-инфиццированных
пациентов с хроническим гастритом доли пациентов, относящихся к каждому классу,
распределены следующим образом:
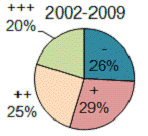
Рисунок 12 - Полуколичественное распределение пациентов по степени
обсемененности СОЖ кокковыми формами НР за 2002-2009 годы.
.3.3
Сезонный биоритм активности бациллярно-кокковой трансформации Н.pylori в слизистой оболочке желудка
Для выявления сезонного биоритма бациллярно-кокковой трансформации НР в
СОЖ мы использовали частоту встречаемости пациентов с хроническим гастритом,
оцененных по полуколичественной шкале как кокки +++, ежемесячно на протяжении 8
лет.
В исследование вошли только те пациенты (N=2145), которые имели эндоскопический диагноз хронический
гастрит с поддтвержденным хеликобактерилеозом, и которых оказалось подавляющее
большинство из всех обследованных НР-инфицированных пациентов.
Таблица 4 Данные иммуноцитохимических исследований, соответствующих
степени обсемененности СОЖ кокковыми формами к +++, %
|
|
2002
|
2003
|
2004
|
2005
|
2006
|
2007
|
2008
|
2009
|
|
янв
|
|
34%
|
30%
|
19%
|
13%
|
22%
|
6%
|
|
фев
|
0%
|
20%
|
9%
|
15%
|
16%
|
11%
|
26%
|
32%
|
|
мар
|
8%
|
14%
|
48%
|
9%
|
0%
|
14%
|
28%
|
42%
|
|
апр
|
10%
|
24%
|
21%
|
7%
|
12%
|
20%
|
42%
|
0%
|
|
май
|
33%
|
62%
|
17%
|
0%
|
29%
|
21%
|
16%
|
20%
|
|
июн
|
43%
|
47%
|
4%
|
5%
|
17%
|
12%
|
19%
|
33%
|
|
июл
|
65%
|
44%
|
5%
|
8%
|
3%
|
0%
|
9%
|
0%
|
|
авг
|
70%
|
67%
|
28%
|
8%
|
14%
|
19%
|
28%
|
13%
|
|
сен
|
75%
|
33%
|
4%
|
12%
|
13%
|
6%
|
41%
|
24%
|
|
окт
|
57%
|
17%
|
15%
|
47%
|
27%
|
14%
|
28%
|
29%
|
|
ноя
|
71%
|
12%
|
17%
|
32%
|
18%
|
16%
|
11%
|
17%
|
|
дек
|
67%
|
0%
|
10%
|
26%
|
10%
|
20%
|
23%
|
17%
|
Графическое изображение, иллюстрирующее приведенные выше табличные
данные, представлено на рисунке 13.
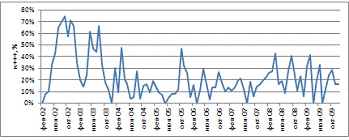
Рисунок 19 - Помесячное распределение данных иммуноцитохимических
исследований, соответствующих степени обсемененности СОЖ кокковыми формами к
+++ (%) в 2002-2009 годах
Из данного рисунка видно, что характер распределения данных имеет
очевидный периодический колебательный характер, с резкими подъемами осенью и
падениями в середине лета (июль).
Для установления достоверности сезонного биоритма, данные за 2002 год
были исключены, так как в то время полуколичественная система определения H.pylori
в ИЦХ окрашенном мазке еще отрабатывалась и стабилизировалась, и именно это
могло дать столь отличные от всех остальных лет данные. 2009 год был так же
исключен в связи со сменой исследователя, проводившего прямые
бактериоскопические ИЦХ исследования, для исключения субъективного фактора на
оценку полуколичественной шкалы степени обсемененности СОЖ бактериальными
клетками.
Очевидная минимальная активность бациллярно-кокковой трансформации
ежегодно наблюдалась в июле. На этот факт указывают графики с периодом в год,
представленные на рисунке 14.
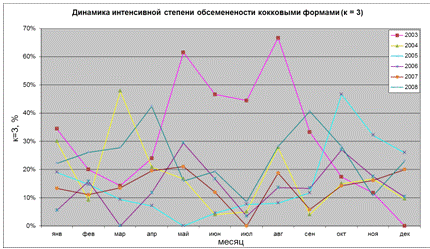
Рисунок 20 - Динамика интенсивной обсемененности СОЖ кокковыми формами H.pylori
(кокки = 3, %)
Видно, что в практически во все годы наблюдается снижение активности
бациллярно-кокковой трансформации в июле месяце. Отметим, что минимальная,
практически нулевая, бациллярно-кокковая активность наблюдалась в течение 5 лет
(за исключением 2003 года, который характеризовался вообще максимальной
амплитудой колебания этого показателя).
Проведенный статистический анализ по критерию Фишера выявил
высокодостоверные (достоверность 95%) различия по показателю "частота
встречаемости значительного количества кокковых форм в СОЖ (к +++)", у
пациентов, обследованных в июле с пациентами, обследованными в октябре и ноябре
(значения эмпирического критерия Фишера >1,64 минимум за 4 года из 6).
Таблица 5 Сравнение данных пациентов, обследованных в июле с данными
пациентов, обследованных в остальные месяцы, по статистическому критерию
Фишера. Красным выделены данные за месяцы, удовлетворяющие условию
"достоверность различия по статистическому критерию Фишера 95% минимум в 4
из 5 лет"
|
месяц
|
хр НР
|
k=3
|
p3
|
месяц
|
всего
|
k=3
|
p3
|
φэмп, к=3
|
дост, к=3
|
|
июл.03
|
9
|
4
|
44,4%
|
сен.03
|
9
|
3
|
33,3%
|
0,484713
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
сен.04
|
25
|
1
|
4,0%
|
0,161037
|
5
|
|
июл.05
|
26
|
2
|
7,7%
|
сен.05
|
17
|
2
|
11,8%
|
0,442896
|
5
|
|
июл.06
|
29
|
1
|
3,4%
|
сен.06
|
15
|
2
|
13,3%
|
1,176033
|
5
|
|
июл.07
|
17
|
0
|
0,0%
|
сен.07
|
34
|
2
|
5,9%
|
1,649442
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
сен.08
|
32
|
13
|
40,6%
|
3,221528
|
95
|
|
июл.03
|
9
|
4
|
44,4%
|
окт.03
|
23
|
4
|
17,4%
|
1,523755
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
окт.04
|
20
|
3
|
15,0%
|
1,089
|
5
|
|
июл.05
|
26
|
2
|
7,7%
|
окт.05
|
30
|
14
|
46,7%
|
3,515677
|
95
|
|
июл.06
|
29
|
1
|
3,4%
|
окт.06
|
37
|
10
|
27,0%
|
2,902488
|
95
|
|
июл.07
|
17
|
0
|
0,0%
|
окт.07
|
35
|
5
|
14,3%
|
2,622206
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
окт.08
|
39
|
11
|
28,2%
|
2,257026
|
95
|
|
июл.03
|
9
|
4
|
44,4%
|
ноя.03
|
17
|
2
|
12%
|
1,841791
|
95
|
|
июл.04
|
20
|
1
|
5,0%
|
ноя.04
|
24
|
4
|
17%
|
1,288266
|
5
|
|
июл.05
|
26
|
2
|
7,7%
|
ноя.05
|
28
|
9
|
32%
|
2,362819
|
95
|
|
июл.06
|
29
|
1
|
3,4%
|
ноя.06
|
57
|
10
|
18%
|
2,151779
|
95
|
|
июл.07
|
17
|
0
|
0,0%
|
ноя.07
|
31
|
5
|
16%
|
2,738751
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
ноя.08
|
28
|
3
|
11%
|
0,286738
|
5
|
|
июл.03
|
9
|
4
|
44,4%
|
дек.03
|
20
|
0
|
0%
|
3,636035
|
95
|
|
июл.04
|
20
|
1
|
5,0%
|
дек.04
|
21
|
2
|
10%
|
0,56468
|
5
|
|
июл.05
|
26
|
2
|
7,7%
|
дек.05
|
27
|
7
|
26%
|
1,842931
|
95
|
|
июл.06
|
29
|
1
|
3,4%
|
дек.06
|
68
|
7
|
10%
|
1,261054
|
5
|
|
июл.07
|
17
|
0
|
0,0%
|
дек.07
|
20
|
4
|
2,810973
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
дек.08
|
26
|
6
|
23%
|
1,575626
|
5
|
|
июл.03
|
9
|
4
|
44,4%
|
янв.03
|
29
|
10
|
34%
|
0,535199
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
янв.04
|
20
|
6
|
30%
|
2,239692
|
95
|
|
июл.05
|
26
|
2
|
7,7%
|
янв.05
|
21
|
4
|
19%
|
1,162928
|
5
|
|
июл.06
|
29
|
1
|
3,4%
|
янв.06
|
18
|
1
|
6%
|
0,341005
|
5
|
|
июл.07
|
17
|
0
|
0,0%
|
янв.07
|
30
|
4
|
13%
|
2,462614
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
янв.08
|
27
|
6
|
22%
|
1,512915
|
5
|
|
июл.03
|
9
|
4
|
44,4%
|
фев.03
|
15
|
3
|
20%
|
1,262128
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
фев.04
|
22
|
2
|
9%
|
0,522817
|
5
|
|
июл.05
|
26
|
2
|
7,7%
|
фев.05
|
34
|
5
|
15%
|
0,863865
|
5
|
|
июл.06
|
29
|
1
|
3,4%
|
фев.06
|
19
|
3
|
16%
|
1,503353
|
5
|
|
июл.07
|
17
|
0
|
0,0%
|
фев.07
|
36
|
4
|
11%
|
2,309608
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
фев.08
|
46
|
12
|
26%
|
2,130529
|
95
|
|
июл.03
|
9
|
4
|
44,4%
|
мар.03
|
14
|
2
|
14%
|
1,601562
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
мар.04
|
23
|
11
|
48%
|
3,520213
|
95
|
|
июл.05
|
26
|
2
|
7,7%
|
мар.05
|
32
|
3
|
9%
|
0,228379
|
5
|
|
июл.06
|
29
|
1
|
3,4%
|
мар.06
|
15
|
0
|
0%
|
1,174566
|
5
|
|
июл.07
|
17
|
0
|
0,0%
|
мар.07
|
37
|
5
|
14%
|
2,569498
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
мар.08
|
36
|
10
|
28%
|
2,17372
|
95
|
|
июл.03
|
9
|
4
|
44,4%
|
апр.03
|
25
|
6
|
24%
|
1,12034
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
апр.04
|
24
|
5
|
21%
|
1,641348
|
95
|
|
июл.05
|
26
|
2
|
7,7%
|
апр.05
|
28
|
2
|
7%
|
0,076997
|
5
|
|
июл.06
|
29
|
1
|
3,4%
|
апр.06
|
17
|
2
|
12%
|
1,069377
|
5
|
|
июл.07
|
17
|
0
|
0,0%
|
апр.07
|
46
|
9
|
20%
|
3,228562
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
апр.08
|
33
|
14
|
42%
|
3,397825
|
95
|
|
июл.03
|
9
|
4
|
44,4%
|
май.03
|
13
|
8
|
62%
|
0,793787
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
май.04
|
18
|
3
|
17%
|
1,200524
|
5
|
|
июл.05
|
26
|
2
|
7,7%
|
май.05
|
16
|
0
|
0%
|
1,768937
|
95
|
|
июл.06
|
29
|
1
|
3,4%
|
май.06
|
17
|
5
|
29%
|
2,530105
|
95
|
|
июл.07
|
17
|
0
|
0,0%
|
май.07
|
19
|
4
|
21%
|
2,855661
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
май.08
|
25
|
4
|
16%
|
0,873701
|
5
|
|
июл.03
|
9
|
4
|
44,4%
|
июн.03
|
15
|
7
|
47%
|
0,105837
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
июн.04
|
25
|
1
|
4%
|
0,161037
|
5
|
|
июл.05
|
26
|
2
|
7,7%
|
июн.05
|
22
|
1
|
5%
|
0,456949
|
5
|
|
июл.06
|
29
|
1
|
3,4%
|
июн.06
|
18
|
3
|
17%
|
5
|
|
июл.07
|
17
|
0
|
0,0%
|
июн.07
|
25
|
3
|
12%
|
2,250536
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
июн.08
|
31
|
6
|
19%
|
1,28457
|
5
|
|
июл.03
|
9
|
4
|
44,4%
|
авг.03
|
3
|
2
|
67%
|
0,676767
|
5
|
|
июл.04
|
20
|
1
|
5,0%
|
авг.04
|
18
|
5
|
28%
|
2,029023
|
95
|
|
июл.05
|
26
|
2
|
7,7%
|
авг.05
|
37
|
3
|
8%
|
0,060241
|
5
|
|
июл.06
|
29
|
1
|
3,4%
|
авг.06
|
22
|
3
|
14%
|
1,354278
|
5
|
|
июл.07
|
17
|
0
|
0,0%
|
авг.07
|
16
|
3
|
19%
|
2,57142
|
95
|
|
июл.08
|
35
|
3
|
8,6%
|
авг.08
|
39
|
11
|
28%
|
2,257026
|
95
|
Таким образом, представленные в разделе 3.3.3 данные указывают на
сезонный колебательный характер бациллярно-кокковой трансформации, минимальная
активность которой приходится на середину лета (июль).
4 Выводы
по работе
. В когорте пациентов с хроническим гастритом (без выраженных клинических
проявлений) выявлен субмодальный класс пациентов с активной бациллярно-кокковой
трансформацией, соответствующей значительной степени обсемененности кокковыми
формами НР (к +++).
. Методами жидкостной цитологии и ИЦХ окрашивания определено присутствие
переходных У форм и кокковых форм НР при абсолютном преобладании спиралевидных
вегетативных форм в СОЖ антрального отдела. Частоты встречаемости кокковых форм
НР в цитоцентрифугатах после ЖЦ совпадают с частотами встречаемости кокковых
форм в прямых цитологических препаратах - мазках-отпечатках СОЖ.
. Выявлен сезонный колебательный характер бациллярно-кокковой
трансформации НР, главной отличительной особенностью которого является снижение
степени обсемененности кокковыми формами НР в середине лета.
Практические рекомендации: с учетом выраженной сезонной активности
бациллярно-кокковой трансформации НР и повышенной резистентности кокковых форм
НР к антихеликобактерной антибиотикотерапии, курсы эрадикационной терапии
рекомендовано проводить в летний период. Данная рекомендация может быть дана
для пациентов с рецидивирующими НР-ассоциированными кислотозависимыми
заболеваниями, находящихся на плановом лечении.
Список
литературы
1. Chumpitaz,
C.J. Isolation of helicobacter pylori in dental plaque in patients with
gastritis at "Angamos" clinic / C.J. Chumpitaz, M.J. Gutierraz, A.R.
Cordova, M.M. Sanchez, V.N. Vasquez, M.C. Rivadeira, B. Del Carpio, M.L.
Solano, C.L. Marocho, C.F. Pareja, R.A. Huaman, B.E. Valencia // Review
gastroenterology Peru. - 2006. - Vol. 26. - N 4. - P.373-376.
. Dubois,
A. Intracellular Helicobacter pylori and Gastric Carcinogenesis: An
"Old" Frontier Worth Revisiting // Gastroenterology. - 2011. - Т.
132. - № 3. - С. 1177-1180.
3. Бардахчьян,
Э.А. Роль Helicobacter pylori при развитии экстрагастродуоденальных заболеваний
/ Э.А. Бардахчьян С.Ю. Ломов, Н.Г. Харланова, Н.В. Камнева // Экспериментальная
и клиническая гастроэнтерология, 2005, №3, с. 20-27.
4. Barry,
J. Marshall Autobiography // Nobel Foundation - 2005
. Stark,
R. M. Biofilm formation by Helicobacter pylori. // Letters in applied microbiology.
- 1999. - Т. 28. - № 2. - С. 121-126.
6. Аруин,
Л.И. Helicobacter (campylobacter) pylori в этиологии и патогенезе гастрита и язвенной болезни
// Арх. патологии. - 1990. - N 10.
- С.3-8.
. Жебрун,
А.Б. Антигенность и связывание сывороточных белков клетками и экстрактами
клеток Х. пилори // Акт.пробл.инф.патол., Ч. 1. Спб. - 1993. - с. 25.
8. Sidebothman,
R.L. Hypothesis: Helicobacter pylori, urease, mucus, and gastric ulcer //
Lancet. - 2010. - Vol.27, - P.193-195.
. Olson,
J. W. Molecular hydrogen as an energy source for Helicobacter pylori. //
Science. - 2011. - Т. 298. - № 5599. - С. 1788-1790
. Putsep,
K.Antibacterial peptide from H. pylori.// Nature - 1999, 398:671-672.
. Satin,
B. The neutrophil-activating protein (HP-NAP) of Helicobacter pylori is a
protective antigenand a major virulence factor.// J. Exp. Med.- 2000,
191:1467-1476.
. Bylund,
J. Proinflammatory activity of a cecropin-like antibacterial peptide from
Helicobacter pylori.//Antimicrob. Agents Chemother - 2001, 45:1700-1704.
. Blaser,
M.J. Parasitism of "slow" bacterium Helicobacter pylori leads to
altered gastric gomeostasis and neoplasia. //J. Clin.Invest. -1994. -Vol. 94 -
P.4-8.
. Rauws,
E.A.J. Cure of duodenal ulcer associated with eradication of Helicobacter
pylori // Lancet. - 1990. -Vol. 335, №8700 - P.1233-1235.
15. Довгаль,
С.Г. Методы лабораторной диагностики хеликобактериоза // Акт.пробл.инф.патол.,
Ч. 1. Спб. - 1993. - с. 21.
16. Covacc,
A. The cag pathogenicity island of Helicobacter pylori: origin, molecular
biology and relevance to virulence In.// Pathogenesis and Host Response in
Helicobacter pylori Infections Ed. By A. P. Moran C. A. O'Morain.-Galway.:
National University of Irland.-1997.-P. 88-100
. Ikenoue,
T. Determination of Helicobacter pylori Virulence by Simpl Gene Analisis of the
cag Pathogenicity Island // Clin. Diag. Lab. Immunol. -2001. - Vol. 8.№ 1. - Р. 181 - 186.
. Suerbaum,
S. Helicobacter pylori Infection // New Engl. J. Med. - 2002. - Vol. 347, № 15.
- P. 1175 - 1186.
. Covacci,
A. // Pathogenesis and Host Response in Helicobacter pylori Infections
/A.P.Moran, C.A.O’Morain. ~ Galway, 2007. - P. 88 -100.
. Mecsas,
J. // Island Emerg. Infect. Dis. - 1996.-V. 2.-P. 271.
21. Макаренко,
Е.В. Клиническое значение факторов патогенности Helicobacter pylori // Рос.
журн. гастроэнтерол., гепатол., колопроктол. - 2005. - Т. 15. № 3. - С. 22-27
22. Peek,
R.M.J. Adherence to gastric epithelial cell induces expression of a
Helicobacter pylori gene, iceA, that is associated with clinical outcom //
Proc. Amer. Ass. Cancer Res. - 1998. - Vol. 110. - P. 531 - 544.
. Louw,
J.A. The Relationship Between Helicobacter pylori Infection, the Virulence
Genotypes of the Infecting Strain and Gastric Cancer in the African Setting //
Helicobacter. - 2001. - Vol. 6, № 4. - P. 268 - 273
. Sidebothman,
R.L. Hypothesis: Helicobacter pylori, urease, mucus, and gastric ulcer //
Lancet. - 1990. - Vol.27, - P.193-195. (Atherton J.C. et al., 1995).
. Atherton,
J.C. Mosaicism in vacuolisating cytotoxin alleles of Helicobacter pylori . Association
of specific vacA types with cytotoxin production and peptic ulceration //
J.Biol. Chem. - 1995. - Vol. 270. - P. 17771 - 17777.
26. Исаков,
В.А. Хеликобактериоз - Медпрактика-М - 2003. - 411с.
27. Guruge,
J.L. Epithelial attachment alters the outcome of Helicobacter pylori infection
// Proc.Nalt.Acad.Sci.USA. - 2010 - Vol. 95, №7 - P.
. Negrini,
R. Autoantibidies to gastric mucosa in Helicobacter pylori infection //
Helicobacter. - 1997 . - Vol. 2, suppl 1. - P. 13 - 16
29. Покровский,
В.И.//Журн. микро-биол. - 1995. -№3.-С. 32-36.
. Домарадский,
И.В. Helicobacter pylori и его роль в патологии. // Журнал микробиол.. - 2000.
- № 4, Приложение. - С. 113 - 117.
. Лаптев,а
Е.С. Хеликобактерная инфицированность и структура гастродуоденальной слизистой
оболочки у больных дуоденальными язвами с различными вариантами клинического
течения. - Автореф. дисс. канд. мед. наук. - СПб, 1999. - 25 с.
32. Uemura,
N. Helicobacter pylori infection and the development of gastric cancer.//N.
Engl.J. Med. - 2001 - Vol. 345 - P.784-789.
. Catrenich,
C.E. Characterization of the morphologic conversion of Helicobacter pylori from
bacillary to coccoid forms.//Scand J Gastroenterol -1991 - Vol. 181,suppl 1 -
Р.58-64
. Benaissa,
M. Changes in Helicobacter pylori ultrastructure and antigens during conversion
from the bacillary to the coccoid form.//Infect. Immun. - 1996 - Vol.64, № 6
-Р. 2331-5
. Specht,
M. Localization of FtsZ in Helicobacter pylori and consequences for cell
division.//J Bacteriol - 2013 - 195(7):1411-20
. Bumann
D. , Habibi H., Kan B., Lack of Stage-Specific Proteins in Coccoid Helicobacter
pylori Cells// Infection and Immunity. - 2004 - Vol. 72, №. 11 - Р. 6738-6742
. Saito
N, Konishi K, Kato M, Coccoid formation as a mechanism of species-preservation
in Helicobacter pylori: an ultrastructural study//Hokkaido Igaku Zasshi - 2008,
Sep83(5):291-5.
. Roe
IH, Son SH, Oh HT, Choi J, Shin JH, Lee JH, Hah YC.Changes in the evolution of
the antigenic profiles and morphology during coccoid conversion of Helicobacter
pylori.// Korean J Intern Med - 1999 - Vol. 14, №1 - Р.9-14
. Saito
N., Konishi K., Sato F., Kato M., Takeda H., Sugiyama T., Asaka M.Plural
Transformation-Processes from Spiral to Coccoid Helicobacter pylori and its
Viability // J. Infect. - 2003 - Vol. 46, №1 - P.49-55
. Mizoguchi,
H. Evidence for viability of coccoid forms of Helicobacter pylori.//J
Gastroenterol - 1999 - Vol.34 Suppl 11 - P.32-6
. Saito
N, Konishi K., Sato F Coccoid Helicobacter pylori Can Directly Adhere and
Invade in Agminated Formation to Human Gastric Epithelial Cells// Advances in
Microbiology - Vol. 2 No. 2 - 2012, 112-116
. Mizogushi,
H. /Diversity in protein synthesis and viability of Helicobacter pylori coccoid
forms in response to various stimuli. //Infect Immun. -1998. -v.66. -p.5555-60.
43. Хомерики,
С.Г. Роль кокковых форм Helicobacter pylori в патогенетических механизмах и
персистенции хеликобактерной инфекции // Рос. журнал гастроэнтерол., гепатол.,
колопроктол., 2011. - T. XI. - № 2. - Прилож. № 13. - С. 99.
44. She,
F.F. Virulence of water-induced coccoid Helicobacter pylori and its
experimental infection in mice. //World J. Gastroenterol. - 2003 - Vol. 9, № 3
- Р.516-20
. Brenciaglia,
M.I. Helicobacter pylori: cultivability and antibiotic susceptibility of
coccoid forms. //Int. J. Antimicrob Agents - 2000 - Vol.13, № 4 - Р.237-41
46. Эллиниди,
В.Н. Практическая иммуногистохимия (Методические рекомендации) - СПб.: ВЦЭРМ
МЧС России, 2010, - стр. 36
47. Jakic-Razumovic,
J. Histopathological features of gastritis before and after treatment for
Helicobacter pylori.//Croat Med J - 2000 - Vol. 41, №2 - P. 159-62
48. Никитина,
Л.В. Иммуноцитохимические исследования и жидкостная цитология в диагностике
поражений желудка // WWW.MEDLINE.RU, ТОМ 13, ОНКОЛОГИЯ - Москва - 2012
49. Dowell,
S.F. Seasonal Variation in Host Susceptibility and Cycles of Certain Infectious
Diseases// Emerg Infect Dis. 2001 May-Jun;7(3):369-74.
. Nelson,
R. J. Seasonal patterns of stress, immune function & disease/ R. J. Nelson,
G. E. Demas, S. L. Klein & L. J. Kriegsfeld; Cambridge University Press -
2002, 291
. Sudha
Xirasagar, J. Role of Meteorological Factors in Duodenal Ulcer Seasonality//
Study Gen Intern Med - 2009 October; 22(10): 1439-1446.
. Roberto
Manfredini, Seasonal pattern of peptic ulcer hospitalizations: analysis of the
hospital discharge data of the Emilia-Romagna region of Italy // BMC
Gastroenterology - Italy, 2010, 10:37
. Savarino,
V Are duodenal ulcer seasonal fluctuations paralleled by seasonal changes in
24-hour gastric acidity and Helicobacter pilori infection?//J Clin
Gastroenterol - 1996, 22(3):178-181.)
. Raschka
C, Schorr W, Koch HJ, Is there seasonal periodicity in the prevalence of
Helicobacter pylori? // Chronobiol Int - 2009, 16(6):811-819.
55. G Buzás, Á. Seasonal variation of
Helicobacter Pylori eradication rates with standard triple therapies: A 11-year
retrospective study (2000-2010) // G Buzás,
Á Premecz, I Barta, J Józan, J Nagy, É Szilágyi // Z Gastroenterol - Budapest
- 2011; 49 - A8
56. Новиков,
Д.А.Статистические методы в медико-биологическом эксперименте (типовые случаи)
// Новиков Д.А., Новочадов В.В. // ВолГМУ - Волгоград, 2005 - с 60 - 63