Изучение возможности применения метода амплитудного анализа лазерного излучения для изучения плотности микробных популяций и закономерностей их роста в различных условиях
Изучение возможности применения
метода амплитудного анализа лазерного излучения для изучения плотности
микробных популяций и закономерностей их роста в различных условиях
Цейтлин В.А.,
Бахир А.Н.
Изучены зависимости светорассеяния популяций Staphilococcus aureus и Esherichia coli в питательном бульоне с
различными добавками и физиологическом растворе. Обнаружены заметные различия в
закономерностях, показывающие зависимость светорассеяния от состояния клеточной
стенки и цитоплазмы. Для клеточной суспензии в питательном бульоне показана
возможность использования светорассеяния для количественного анализа плотности
популяции и оценки кинетических параметров роста.
Измерение плотности популяции и параметры роста всегда
представляют интерес во многих исследованиях. Популяции микроорганизмов удобны
краткостью жизненного цикла, но часто оценка плотности популяций представляет
большую проблему. Предложено много методов решения от простого подсчета клеток
в поле видимости до использования продуктов метаболизма и различных связанных с
обменом веществ параметров [1,2]. Полезным может быть использование
физико-химических методов в силу их универсальности, интегральности и быстроты
получения результатов. Микроорганизмы по размерам близки к типичным коллоидным
системам и перспективным представляется использование методов их исследования.
Важным свойством, отличающим коллоидные системы от истинных растворов, является
светорассеяние, которое зависит от размерного распределения дисперсных частиц и
от оптических свойств материала их составляющего.
Целью исследований была оценка возможностей метода
светорассеяния в изучении микробных популяций. Использовалась установка для
регистрации светорассеяния в виде амплитудного анализа лазерного излучения [3].
Основа метода состоит в зависимости номера регистрирующего канала на который
приходит максимум от плотности суспензии и размеров составляющих частиц,
установлен рост номера максимума с увеличением размера и увеличением количества
рассеивающих частиц в единице объема системы. Для стационарной популяции можно
постулировать неизменность размерного распределения клеток и зависимость
рассеяния только от плотности микробной взвеси.
Для получения стандартных плотностей микробных взвесей
использовался стандарт мутности на 109 клеток и создавались
разведения десятичным логарифмом плотности равным: в пятом - 4, четвертом - 5,
третьем - 6, втором - 7, первом - 8 и, соответственно, в нулевом - 9. Растворы
использовались для построения калибровочного графика плотность популяции - номер
канала, по которому в дальнейшем определялись плотности популяций для
кинетических исследований.
Взвеси микробных клеток готовились на основе физиологического
раствора и питательного бульона ГРМ, для изучения влияния добавок в бульон
добавлялись хлорид натрия и глюкоза: к 9 мл исходного бульона добавляется 1 мл
насыщенного раствора соли (36 г в 100 г воды) или 1 мл раствора глюкозы (10 г в
100 мл воды). Расчет показывает около 3% по соли и 1% по глюкозе, таким
образом, следует ожидать очень заметного смещения осмотических равновесий.
Для описания роста популяций использовалась общая модель
Ферхюльста-Пирла

с линеаризацией для определения параметров

светорассеяние популяция лазерное излучение
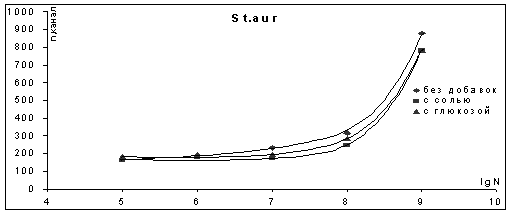
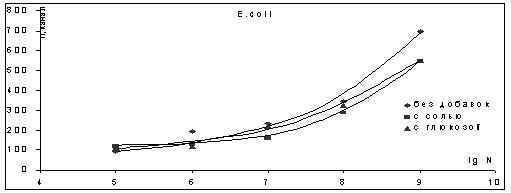
Рисунок 1. Калибровочные кривые
Обработанные по этой форме данные использовались для
построения графика в координатах (v/N) - N, для получения зависимости между плотностью популяции и
номером канала использовалась стандартная операция пакета Excel Microsoft Office подбора уравнения
нелинейного тренда для набора точек, а для получения численных значений
констант уравнения Ферхюльста-Пирла - линейногоДля сравнения данных и решения
вопроса переносимости данных в физиологическом растворе для оценки роста в
питательном бульоне были построены калибровочные графики для взвесей в бульоне
и физрастворе. В результате собственных исследований установлено, что имеется
различие очевидное графиков для обеих микробных популяций (рис.1). Причинами
могут быть процессы роста в бульоне и невозможность их в физрастворе, с этим
будут связаны различия в состояниях клеточных мембран и цитоплазмы. Для E. coli соотношение зависимостей
в физрастворе и бульоне отлично от S. aureus., объяснить это можно из-за большей
подверженности клеточных мембран кишечной палочки осмотическим воздействиям
[1]. Очевидна большая применимость метода для низших разведений, для нулевого -
второго разведений изменение плотности клеточной взвеси в десять раз приводит к
заметному сдвигу в номере канала, а для третьего - пятого сдвиги находятся на
грани ошибки метода. Для оценки ожидаемого вида кривой с учетом всех влияний
можно провести среднюю аппроксимирующую линию. Большие различия зависимостей
светорассеяния в бульоне и в физрастворе указывают на невозможность
использования результатов в физрастворе для других растворов и необходимость
построения калибровочных кривых для каждого раствора конкретно с обязательным
учетом возможных процессов роста.
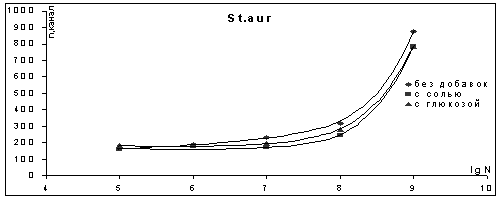
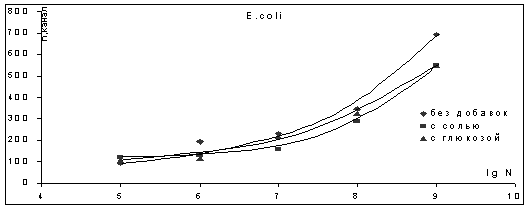
Рисунок 2. Калибровочные кривые
Обработанные по этой форме данные использовались для
построения графика в координатах (v/N) - N, для получения зависимости между плотностью популяции и
номером канала использовалась стандартная операция пакета Excel Microsoft Office подбора уравнения
нелинейного тренда для набора точек, а для получения численных значений
констант уравнения Ферхюльста - Пирла - линейногоДля сравнения данных и решения
вопроса переносимости данных в физиологическом растворе для оценки роста в
питательном бульоне были построены калибровочные графики для взвесей в бульоне
и физрастворе. В результате собственных исследований установлено, что имеется
различие очевидное графиков для обеих микробных популяций (рис.1). Причинами
могут быть процессы роста в бульоне и невозможность их в физрастворе, с этим
будут связаны различия в состояниях клеточных мембран и цитоплазмы.
Для E. coli соотношение зависимостей в физрастворе и бульоне отлично от S. aureus., объяснить это можно
из-за большей подверженности клеточных мембран кишечной палочки осмотическим
воздействиям [1].
Очевидна большая применимость метода для низших разведений,
для нулевого - второго разведений изменение плотности клеточной взвеси в десять
раз приводит к заметному сдвигу в номере канала, а для третьего - пятого сдвиги
находятся на грани ошибки метода. Для оценки ожидаемого вида кривой с учетом
всех влияний можно провести среднюю аппроксимирующую линию. Большие различия
зависимостей светорассеяния в бульоне и в физрастворе указывают на
невозможность использования результатов в физрастворе для других растворов и
необходимость построения калибровочных кривых для каждого раствора конкретно с обязательным
учетом возможных процессов роста.


Рисунок 2. Зависимость положения максимума для взвесей:
А- S. aur; B- E.coli. - аппроксимирующая кривая.
Для оценки возможности применения метода амплитудного анализа
для изучения процессов роста была исследована зависимость светорассеяния
взвесей S.
aureus и E. coli во втором разведении в
исходном бульоне и бульоне с добавками соли и глюкозы. Были получены следующие
результаты (рис.2). Зависимости максимумов каналов и плотности популяций от
времени приведены в таблицах 1 (стафилококк) и 2 (кишечная палочка). С помощью
калибровочных кривых были оценены плотности популяций и кинетические параметры.
Таблица №1
|
t, мин.
|
n, канал
|
lg N
|
N
|
(DN/Dt) /N
|
Уравнение
|
|
без добавок
|
|
0
|
245
|
7,873
|
7,47×107
|
-
|
dN/dt= (0,056-2×10-10N) N
|
|
15
|
271
|
8,104
|
1,27×108
|
0,0274
|
|
|
30
|
288
|
8,257
|
1,81×108
|
0,0199
|
|
|
45
|
294
|
8,312
|
2,05×108
|
0,0079
|
|
|
60
|
299
|
8,358
|
2,28×108
|
0,0067
|
|
|
с добавкой соли
|
|
0
|
160
|
7,524
|
3,34×107
|
-
|
dN/dt=
(0,048-10-9N) N
|
|
15
|
170
|
3,73×107
|
0,0069
|
|
|
30
|
175
|
7,595
|
3,94×107
|
0,0035
|
|
|
45
|
179
|
7,614
|
4,11×107
|
0,0028
|
|
|
60
|
181
|
7,623
|
4, 20×107
|
0,0014
|
|
|
с добавкой
глюкозы
|
|
0
|
213
|
6,0975
|
1,25×106
|
-
|
dN/dt= (0,063-4×10-10N) N
|
|
15
|
230
|
7,211
|
1,63×107
|
0,0615
|
|
|
30
|
239
|
7,613
|
4,10×107
|
0,0403
|
|
|
45
|
248
|
7,886
|
7,69×107
|
0,0311
|
|
|
60
|
262
|
8,053
|
1,13×108
|
0,0212
|
|
Результаты линеаризации данных показывают изменение обеих
констант в уравнении, но наблюдается большее изменение под влиянием добавок
постоянной роста в уравнении Ферхюльста - Пирла по сравнению с константой
угнетения. Наблюдается закономерный рост константы роста в ряду "бульон с
солью" - "чистый бульон" - "бульон с глюкозой" для
обеих популяций.
Таблица №2
|
t, мин.
|
n, канал
|
lg N
|
N
|
(DN/Dt) /N
|
Уравнение
|
|
без добавок
|
|
0
|
257
|
8,053
|
1,13×108
|
-
|
dN/dt= (0,039-2×10-11N) N
|
|
15
|
268
|
8,378
|
2,39×108
|
0,0351
|
|
|
30
|
278
|
8,663
|
4,60×107
|
0,0321
|
|
|
45
|
8,884
|
7,65×108
|
0,0266
|
|
|
60
|
292
|
9,045
|
1,10×109
|
0,0207
|
|
|
с добавкой соли
|
|
0
|
160
|
6,463
|
2,90×106
|
-
|
dN/dt= (0,028-2×10-9N) N
|
|
15
|
167
|
6,617
|
4,14×106
|
0,0199
|
|
|
30
|
173
|
6,749
|
5,61×106
|
0,0174
|
|
|
45
|
177
|
6,836
|
6,85×106
|
0,0121
|
|
|
60
|
181
|
6,923
|
8,37×106
|
0,0121
|
|
|
с добавкой
глюкозы
|
|
0
|
213
|
7,114
|
1,30×107
|
|
dN/dt= (0,045-9×10-10N) N
|
|
15
|
230
|
7,330
|
2,14×107
|
0,0261
|
|
|
30
|
242
|
7,478
|
3,01×107
|
0,0193
|
|
|
45
|
249
|
7,563
|
3,66×107
|
0,0119
|
|
|
60
|
254
|
7,624
|
4,21×107
|
0,0086
|
|
Видно, что в случае бульона с добавкой соли резко возрастает
константа угнетения и ее рост начинает оказывать преобладающее влияние на рост
популяции.
Результаты исследования позволяют утверждать перспективность
применения метода светорассеяния для исследования процессов роста и оценки
плотности микробных популяций при высоких плотностях клеточных взвесей, когда
другие методы дают наивысшую вероятность ошибок измерений.
Список
литературы
1.
Перт Дж. Основы культивирования микроорганизмов и клеток. - М.: Мир, 1978. -
332с.
.
Дикий И.Л. и др. Микробиология: Руководство к лабораторным занятиям. - К.: ИД
"Профессионал", 2004. - 594 с.
.
Овчинников А.И. Фотометр на базе гамма - спектрометра. - Физическое образование
в вузах. - 2004. - Т.10, №4. - с.68 - 74.