Содержание нитратов в поверхностных водах города Архангельска и Архангельской области
Содержание
Введение
Глава 1. Обзор литературы
.1 Вода питьевая, ее качество
.2 Общая характеристика
нитратов
.3 Нахождение нитратов в
природе, их место в круговороте азота
.4 Использование нитратов в
народном хозяйстве. Природные и антропогенные источники их поступления в
окружающую среду
.5 Метаболизм нитратов в
организме человека
Глава 2. Методика определения NO3 -
.1 Потенциометрия
.2 Электроды
.2.1 Классификация электродов
.2.2 Электроды сравнения
.2.3 Ионоселективные электроды
.3 Проблема выбора электродов
Глава 3. Экспериментальная часть
.1 Цели и задачи эксперимента
.2 Объекты исследования
.3 Отбор и хранение проб
.4 Определение нитратов
ионометрическим методом
.4.1 Аппаратура, материалы и
реактивы
.4.2 Приготовление растворов
.4.3 Подготовка электродов к работе
.4.4 Проведение анализа
.4.5 Построение градуировочного
графика
.5 Результаты исследования и их
обсуждения
.6 Выводы
Заключение
Список использованной литературы
Приложения
Введение
Загрязнение окружающей среды в настоящее время
является общемировой проблемой. Качество среды жизни и состояние здоровья
человека, его трудоспособность и продолжительность жизни определяются в первую
очередь качеством атмосферного воздуха, питьевой воды и потребляемой пищи.
Охрана здоровья человека становится актуальной задачей современности. В
результате антропогенной деятельности человечество все больше отдаляет себя от
природы и условий, которые способствовали формированию в процессе эволюции
адаптационных механизмов организма. Человек становится заложником технического
прогресса, испытывая давление иных, созданных им самим условий. Вода -
ценнейший природный ресурс. Она играет исключительную роль в процессахобмена
веществ, составляющих основу жизни. На сегодняшний день необходима оценка
качества водывследствие возросшейза последние десятилетия деятельности
промышленных предприятий, которые направляют свои сбросы в реки и океаны,
интенсивного развития сельского хозяйства и др. Существует много показателей
оценки качества воды. К одним из основных и наиболее опасных загрязнителей
водных источников относятся нитраты, определение которых имеет немаловажную
роль в предупреждении неблагоприятного воздействия их на здоровье людей.
Поэтому целью настоящего исследования является определение концентрации
нитратов в пробах воды поверхностных источников различных районов г.
Архангельска и Архангельской области.
Для достижения поставленной цели необходимо
решить следующие задачи:
. Проанализировать литературу по данному вопросу
. Подобрать и отработать наиболее оптимальную
методику определения содержания NO3- в воде
. Отобрать образцы воды из различных источников
г. Архангельска и Архангельской области
. Провести химический эксперимент
.Проанализировать полученные результаты
Глава 1. Обзор литературы
.1 Вода питьевая, ее качество
Вода - главное и наиболее распространенное
химическое соединение на нашей планете. После воздуха, она второй по значению
компонент, необходимый для человеческой жизни. Насколько важна вода
свидетельствует тот факт, что ее содержание в различных органах составляет 70 -
90%. С возрастом количество воды в организме меняется. Трехмесячный плод
содержит 90% воды, новорожденный 80%, взрослый человек - 70%. Вода присутствует
во всех тканях нашего организма, хотя распределена неравномерно:
· Мозг содержит - 75 %
· Сердце - 75%
· Легкие - 85%
· Печень - 86%
· Почки - 83%
· Мышцы - 75%
· Кровь - 83%.
Вода выполняет важнейшие функции в нашем
организме. Она необходима для поддержания всех обменных процессов, принимает
участие в усвоении питательных веществ клетками, обеспечивает нормальную работу
внутренних органов, является теплоносителем и терморегулятором.
Сегодня, как никогда, нашему организму очень
важно получать чистую воду со сбалансированным минеральным составом.
Кроме того, вода - это регулятор климатических
условий на Земле, стабилизирующий температуру на ее поверхности, и участник
практически всех технологических процессов промышленного и
сельхозпроизводства.Она покрывает 71% площади земного шара и составляет1/800
часть объема суши или 1370 м3. Основная масса воды сосредоточена в
морях и океанах - 94-98%, в полярных льдах содержится около 1,2% воды и совсем
малая доля - менее 0,5%, в пресных водах рек, озер и болот. Соотношения эти
постоянны, хотя в природе, не переставая, идет круговорот воды. Вода -
единственное химическое соединение, которое в природе может находиться в
жидком, твердом и газообразном состояниях одновременно. Чистая вода -
прозрачная, бесцветная жидкость без запаха и вкуса. Многие ее физические
свойства и их изменения имеют аномальный характер. Основными причинами
аномальных свойств воды являются полярность ее молекул и образование объемной
системы водородносвязанных структур. Они делают воду весьма реакционным
соединением с уникально хорошей растворяющей способностью по отношению к полярным
и ионогенным веществам, при этом в воде растворяются все природные соединения.
Вода не бывает абсолютно чистой. Природная вода
содержит многочисленные растворенные вещества - соли, кислоты, щелочи, газы
(углекислый газ, азот, кислород, сероводород), продукты отходов промышленных
предприятий и нерастворимые частицы минерального и органического происхождения.
Наиболее чистой природной водой является
дождевая; однако и она содержит до 50 мг/л различных растворенных примесей.
Основным потребителем воды является население ( 81 %). Россия обладает одним из
самых высоких водных потенциалов в мире - на каждого жителя России приходится
свыше 30000м3/год воды. Однако в настоящее время из-за загрязнения и
засорения около 70 % рек и озер России утратили свои качества как источника
питьевого водоснабжения, в результате около половины населения потребляют
загрязненную недоброкачественную воду.
Питьевая вода - это вода, которая используется
для питьевых целей и хозяйственно-бытовых нужд населения, а также вода, используемая
для нужд пищевой промышленности и ряда производств химической промышленности.
Большое значение имеет удовлетворение
потребностей населения в питьевой воде в местах его проживания через
централизованные (приоритетно) или нецентрализованные системы питьевого
водоснабжения.
Источниками централизованного водоснабжения
служат поверхностные воды, доля которых в общем объеме водозабора составляет 68
%, а подземные воды - 32 %. Практически все поверхностные источники
водоснабжения в последние годы подвергаются воздействию вредных антропогенных
загрязнений. Качество воды в большинстве из них не отвечает нормативным
требованиям. Многолетние наблюдения за динамикой качества поверхностных вод
выявили тенденцию к росту их загрязненности. Поэтому в настоящее время очень
важное значение имеет оценка качества воды.
Понятие качества воды включает в себя
совокупность показателей состава и свойств воды, определяющих пригодность ее
для конкретных видов водопользования и водопотребления.
Вода считается чистой, если ее состав и свойства
ни по одному из показателей не выходят за пределы установленных нормативов, а
содержание вредных веществ не превышает предельно-допустимых концентраций
(ПДК). Особые требования предъявляют к питьевой воде: она должна обладать
хорошими органолептическими свойствами, быть безопасной в эпидемиологическом
отношении, иметь безвредный химический состав.
Состав воды оценивают с помощью физических,
химических, санитарно -бактериологических показателей.
К физическим показателям относят содержание взвешенных
частиц, цветность, запах и привкус. Химический состав воды характеризуется
ионным составом, жесткостью, щелочностью, окисляемостью, активной концентрацией
водородных ионов (рН), сухим остатком, общим солесодержанием, содержанием
растворенного кислорода, свободной углекислоты, сероводорода, активного хлора.
Санитарно-бактериологическим показателем
качества воды являются коли-титр и коли-индекс, а также общее число
содержащихся в воде бактерий.
В соответствии с требованиями глобальной системы
мониторинга состояния окружающей среды нитраты и нитриты входят в программы
обязательных наблюдений за составом питьевой воды.
.2 Общая характеристика нитратов
Нитраты - это соли и эфиры азотной кислоты HNO3.
Соли - кристаллы; удобрения, протравы при крашении, компоненты взрывчатых
веществ. Нитраты аммония, щелочных и щёлочноземельных металлов часто называют
селитрами. При неправильном использовании нитратов в качестве удобрений они
накапливаются в сельскохозяйственных продуктах в чрезмерных количествах, что может
привести к отравлению людей и животных. Эфиры - бесцветные или светло-жёлтые,
приятно пахнущие жидкости; эфиры, содержащие несколько групп ONO2,
например, нитроглицерин, применяются в качестве взрывчатых веществ и
лекарственных препаратов.
.3 Нахождение нитратов в природе, их место в
круговороте азота
Неорганические соединения азота не встречаются в
природе в больших количествах, если не считать натриевую селитру, образующую
мощные пласты на побережье Тихого океана и Чили. Почва содержит незначительное
количество азота, преимущественно в виде солей азотной кислоты.
Природные нитраты встречаются в виде
солеобразных масс, выцветов, корочек, налетов. Все селитры хорошо растворяются
в воде, обладают охлаждающим вкусом. Значительные месторождения находятся в
Чили (провинция Тарапка и Антофагаста), где природные нитраты ассоциируют с
галогенидами, сульфатами, селенатами и некоторыми иодатами. В этих
месторождениях калийная и натриевая селитры составляют основную часть запасов.
Щелочные нитраты часто формируются при
взаимодействии азотистых органических веществ и щелочных солей. Например,
налеты натриевой и калиевой селитры в полостях и трещинах пород или высыпки. На
современном этапе природные нитраты добываются в ограниченном количестве;
главную массу азотных соединений получают химическим путем.
Круговорот азота - биогеохимический
цикл
<#"720077.files/image001.gif">mМ + рP Эта зависимость описывается
уравнением Нернста <#"720077.files/image002.gif">
нитрат азот определение
ионометрический
где Т - абсолютная. температура; F -
постоянная Фарадея <#"720077.files/image004.gif">
Используется в широком диапазоне рН
- от значений, соответствующим концентрированным кислотам, до значений,
соответствующим концентрированным щелочам
<#"720077.files/image005.gif">,
где р - барометрическое давление
<#"720077.files/image006.gif"> Hg2Cl2, а
соответствующее уравнение Нернста имеет вид:
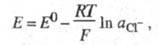
где E0 - стандартный
потенциал <#"720077.files/image008.gif">AgHal + е
(Hal - галоген <#"720077.files/image009.gif">
Удобны при работе с
электрохимическими ячейками без жидкостного мостика, применимы как в водных,
так и во многих неводных средах, устойчивы при повышенных температурах. В
области температур 0-95 °С потенциал хлорсеребряного электрода
<#"720077.files/image010.gif">
Удобен при работе в щелочных
растворах, т. к. при этом легко реализовать цепи без жидкостного соединения.
Хингидронный электрод
<#"720077.files/image011.gif">
Рис.1.
Зависимость электродной функции от температуры: Сх - концентрация
ионов X, pXi = - lg(Cx) - в изопотенциальной точке, Ei
- потенциал электрода в изопотенциальной точке.
С
увеличением температуры увеличивается наклон (крутизна St)
электродной характеристики.
Концентрация
анализируемых ионов, при которой потенциал электрода не зависит от температуры,
называется изопотенциальной точкой. Значения концентрации раствора и потенциала
электрода в этой точке называют координатами изопотенциальной точки (pXi
и Ei).
Для
стеклянных электродов (рН и pNa) координаты изопотенциальной точки нормируется
(указывается изготовителем), а для прочих измерительных электродов обычно нет.
Современные измерительные приборы позволяют автоматически учитывать
температурные изменения электродной характеристики (термокомпенсация), для
этого в прибор должны быть введены координаты изопотенциальной точки и текущая
температура. Последняя может вводиться либо вручную, либо посредством
термодатчика, подключенного к прибору. Если есть варианты, то рекомендуется
выбирать электрод, имеющий изопотенциальную точку, лежащую вблизи средней
концентрации анализируемых растворов. Это позволит снизить погрешность измерений,
связанную с изменением температуры раствора.
Очень
внимательно следует отнестись к вопросу присутствия мешающих ионов и веществ,
агрессивных к материалам электрода в анализируем растворе. Если они есть, то их
удаление потребует специальной методики, а проведение непрерывных измерений
будет, скорее всего, невозможным.
Потенциометрический
анализ распространяется только на вещества, находящиеся в ионном состоянии,
т.е. основной объект исследований это растворы (обычно водные), однако при этом
растворы могут содержать взвеси твердых частиц, эмульсии, быть гелеобразными и
т.д. Твердые материалы также могут быть исследованы этим методом при наличии
специальной методики (растворение, экстрагирование и т.д.). Для исследования
некоторых материалов может потребоваться электрод с определенной формой
чувствительной мембраны, например конической для анализа гелей или вязких
веществ.
Глава
3. Экспериментальная часть
.1
Цели и задачи эксперимента
Целью
настоящего исследования явилось определение концентрации нитратов в пробах воды
поверхностных источников различных районов г. Архангельска и Архангельской
области.
Основная задача - проведение сравнительной
оценки полученных результатов между собой и с ПДК.
.2 Объекты исследования
Объектом исследования явились образцы воды из
поверхностных водоемов различных районов г. Архангельска и Архангельской
области.
В Центральном и Соломбальском районах г.
Архангельска вода отбиралась в Северной Двине , в г. Северодвинске были
отобраны пробы морской воды на побережье Белого моря (о. Ягры),в г. Новодвинске
взяты образцы воды в области дачных кооперативов (СНТ-Двина).Также была
исследована вода в р.Пинега ( Пинежский район) и образец водопроводной воды г.
Архангельска. Указанноерайонирование было проведено в связи с высокой техногенной
и антропогенной нагрузкой в данных регионах (рис.1).
.3 Отбор и хранение проб
Пробы были отобраны в начале осени (в сентябре).
Хранение проб осуществлялось в полиэтиленовой и стеклянной посуде с плотно
закрывающейся пробкой. Нитраты являются биохимически нестойким компонентом,
поэтому анализ был проведен в день отбора пробы. При охлаждении до 3 - 5 °C
допускается хранение проб в течение 3 сут. Более длительное хранение возможно
при замораживании пробы.
.4 Определение нитратов ионометрическим методом
.4.1 Аппаратура,материалы и реактивы
Оборудование и реактивы:
· ионометр
· ионоселективный нитратный электрод
· хлорсеребряный электрод сравнения
· весы технические и аналитические
· конические колбы 250 мл
· мерный цилиндр 100 мл
· химические стаканы 50 мл
· фильтровальная бумага
· мерная колба 1 л
· пипетки 5мл и 10 мл
· нитрат калия
· водный раствор K2SO4c
концентрацией (1/2 K2SO4)
1 моль/дм3
· водный раствор NaOH
с концентрацией 0,1 моль/дм3
· водный раствор (NH4)S2O3
массовой долей 8%
· водный раствор ZnSO4
массовой долей 8%
.4.2 Приготовление растворов
) Приготовление раствора KNO3:
навеску нитрата калия массой 10,1 г растворяют в дистиллированной воде в мерной
колбе вместимостью 1 л , доводят содержимое колбы водой до метки. Получают
раствор нитрата калия молярной концентрацией 10-1 моль/л (pNO3=1)
) Методом последовательного разбавления из
полученного раствора готовят серию стандартных растворов нитрата калия
концентрацией 10-2,10-3,10-4 и 10-5
моль/л (pNO3
равны соответственно 2, 3, 4 и 5) (Табл.1).
3.4.3 Подготовка электродов к работе
Перед началом работы мембрану ионоселективного
электрода вымачивают в течение 24 часов в растворе нитрата калия концентрацией
0,1 моль/л. Вспомогательный хлорсеребряный электрод хранят в воде.
3.4.4 Проведение анализа
Погрузив электроды в стаканы, в каждом растворе
регистрируют ЭДС элемента, составленного из нитратселективного и
хлорсеребряного электродов. Перед началом измерений электроды промывают
несколько раз дистиллированной водой. Измерения выполняют, переходя от
разбавленных растворов к концентрированным. Между измерениями электроды
достают, ополаскивают дистиллированной водой, высушивают фильтровальной бумагой
и снова погружают в следующий исследуемый раствор. Полученные данные
представлены в таблице 2.
3.4.5 Построение градуировочного графика
По результатам определения ЭДС серии стандартных
растворов строят градуировочный график в линейном масштабе. По оси абсцисс
откладывают значения концентрации стандартных растворов, а по оси ординат -
соответствующие им показания прибора (мВ) (рис.2). По градуировочному графику
определяют значения рNO3 анализируемых растворов (Табл.3). Полученные данные
были обработаны статистически методом Стьюдента (Табл.4).Концентрация нитратов
в поверхностных водах г. Архангельска и Архангельской области представлена в
виде диаграммы (рис.3) и в табл. 5.
3.5 Результаты исследования и их обсуждения
При исследовании образцов воды г. Архангельска и
Архангельской области мы установили, что:
) Наибольшую концентрацию нитратов имеет образец
морской воды о. Ягры (39,00±2,50*10-5 моль/л). В морской воде и
океанических осадках азот находится в виде органических соединений (белков,
пептидов, аминокислот, нуклеиновых кислот), минеральных соединений (NH3,
NO3-,
NO2-),
растворенных газов (N2, N2O). Органические формы азота
преобладают над неорганическими. Трансформация азота осуществляется в
результате жизнедеятельности донных бактерий. Количество бактерий, населяющих
донные осадки,
на три-четыре порядка величин больше, чем в придонном слое воды. В процессе
жизнедеятельности бактерии выделяют ферменты, которые ускоряют разложение
органических веществ (белков и полисахаридов) до низкомолекулярных соединений,
которые служат одним из важных источников питания для многих гетеротрофных
бентосных организмов. Также после отмирания организмов и разрушения клеток
процессы аммонификации переводят амминный азот в аммиак, а затем в
окислительной среде морской воды начинается последовательная реакция окисления
аммонийного азота до нитритов и далее до нитратов. Таким образом, нитраты являются
необходимыми для морского фитопланктона биогенными соединениями. Их отсутствие
приводит к угнетению водорослей, снижению интенсивности процесса фотосинтеза.
Содержание нитратов в водах Мирового океана колеблется в широких пределах - от
0 до 500-600 мкг/л и выше. Воды, богатые нитратами, отличаются высокой
продуктивностью. Та
2) Речная вода по сравнению с морской имеет
меньшее содержание нитратов (примерно в 10 раз), и их концентрация вверх по
течению Северной Двины увеличивается от Соломбальского округа(1,16±0,06*10-5
моль/л) к Центру(3,84±0,68*10-5 моль/л) и вновь понижается в водах
г. Новодвинска (1,37±0,31*10-5;1,65±0,42*10-5 моль/л), то
есть наиболее загрязненным является устьевой участок. Устьевая область
испытывает особую антропогенную нагрузку от источников загрязнения, расположенных
вдоль ее притоков и непосредственно в устьевой части, в том числе это
целлюлозно-бумажные комбинаты (Архангельский, Соломбальский ЦБК). Повышенная
концентрация NO3- в Центре
связана с высоким уровнем транспортной нагрузки. Можно предположить, что
основными источникамим загрязнения бассейна Северной Двины являются сброс
недостаточно очищенных сточных вод предприятиями целлюлозно-бумажной
промышленности, коммунального хозяйства, сброс ливневых и дренажных вод и
аварийные ситуации.
3) Р. Пинега имеет отдельный водозабор. Пробы
воды, отобранные в Пинежском районе, отличаются более высокой концентрацией NO3-
(4,33±0,17*10-5
моль/л) по сравнению с пробами воды из Северной Двины (Архангельск), что
может быть связано с развитым сельским хозяйством в районах нашей области, и,
как следствие, внесением в почву азотных удобрений.
) В водопроводной воде г. Архангельска
содержание нитратов сравнимо с содержанием нитратов в Северной
Двине.(2,14±0,48*10-5 моль/л).
) Результаты нашего исследования сравнивались со
значениями, полученными методами высокоэффективной жидкостной хроматографии в
лаборатории центра коллективного пользования научным оборудованием «Арктика»
Северного (Арктического) Федерального Университета имени М.В. Ломоносова при
финансовой поддержке Министерства образования и науки РФ. Установлено, что
содержание нитратов в пробах находится ниже уровня определения прибора.
)Все полученные концентрации не превышают
ПДК=72,6*10-5 моль/л.
3.6 Выводы
На основании полученных результатов можно
сделать следующие выводы:
Ø Наибольшая концентрация нитратов
зарегистрирована в образце морской воды о. Ягры, что, возможно, объясняется
жизнедеятельностью донных бактерий и водорослей, содержащихся в большом количестве
в море.
Ø Вниз по течению реки наблюдается
тенденция снижения уровня нитратов, что связано с уменьшением промышленной и
антропогенной нагрузки.
Ø Все полученные данные не превышают
ПДК по содержанию нитратов.
Заключение
Защите окружающей среды от возрастающей
антропогенной нагрузки в настоящее время уделяется все большее внимание во всем
мире. Развитие промышленности, в том числе и химической, увеличение добычи
ископаемого сырья, расширение использования транспорта сопровождается
поступлением в окружающую среду больших количеств различных загрязняющих
веществ.
Сильное загрязнение окружающей среды (воды,
воздуха, почвы) приводит к возникновению неблагоприятных последствий: нарушению
нормальной жизнедеятельности биосферы, изменению климата, исчезновению многих
видов растений и животных, ухудшению здоровья населения. Поэтому мы планируем
дальнейшие исследования проб воздуха на содержание NO3- оксидов
азота в центре г. Архангельска.
Список использованной литературы
1.
Агроэкология. Черников В. А. М.: Колос, 2000. - 536 с.
.
Алексеев В. Н. Курс качественного химического полумикроанализа. М: «Химия»,
1973. - 584 с.
.
Ахметов Н. С. Общая и неорганическая химия: Учебник для вузов. - М.: Высш.
школа, 1981. - 679 с.
.
ГОСТ 4192 - 82. Вода питьевая. Методы определения минеральных азотсодержащих
веществ.
.
Коробкин В. И., Передельский Л. В. Экология. Изд. 4-е, доп. и переработ. -
Ростов н/Д: изд-во «Феникс», 2003. - 576 с.
.
Новиков Ю. В. Экология, окружающая среда и человек: Учеб.пособие для вузов, а
также учащихся средних школ и колледжей. - М.: ФАИР - ПРЕСС, 1999. - 320 с.
.
Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов /
Ю. А. Ершов, В. А. Попков, А. С. Берменд и др.; Под ред. Ю. А. Ершова. - 5-е
изд., стер., - М.: Высш. шк., 2005. - 560 с.
.
Основы аналитической химии. Практическое руководство: Учеб.пособие для вузов /
В. И. Фадеева, Т. Н. Шеховцева, В. М. Иванов и др.; Под ред. Ю. А. Золотова. -
М.: Высш. шк. 2001. - 463 с.
10.
#"720077.files/image012.jpg">
Рис.2 Калибровочный график
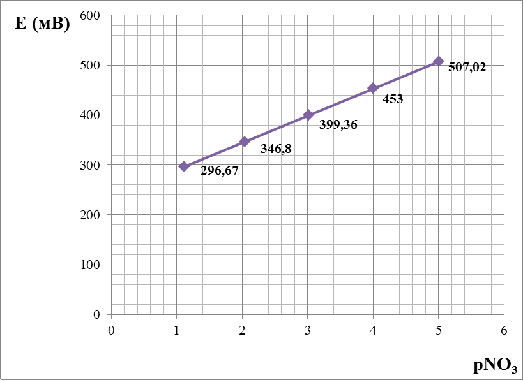
Рис.3 Концентрация нитратов в поверхностных
водах г. Архангельска и Архангельской области

Таблица 1. Экспериментальные данные построения
калибровочного графика
|
№
р-ра сравнения
|
CNO3-, моль/л
|
pNO3¯
|
Еизм
|
Ерасч=
a+b∙pNO3¯
|
Ерасч
|
|
1
|
0,1
|
1,12
|
295,1
|
а
= 235,9857 b = 54,1860 r
= 0,9993
|
296,67
|
|
2
|
0,01
|
2,045
|
345,7
|
|
346,80
|
|
3
|
0,001
|
3,015
|
402,5
|
|
399,36
|
|
4
|
0,0001
|
4,005
|
456,3
|
|
453,00
|
|
5
|
0,00001
|
5,0016
|
503,3
|
|
507,02
|
Таблица 2. Результаты измерения ЭДС отобранных
проб.
|
№
п/п.
|
Расположение
п/п
|
E изм. №1
|
E изм. №2
|
E изм. №3
|
|
1
|
Соломбала
|
503,6
|
503,8
|
495,3
|
|
2
|
СНТ-Двина
(канава)
|
501,5
|
500,2
|
495,5
|
|
3
|
СНТ-Двина
(болото)
|
496,1
|
496,4
|
490,7
|
|
4
|
Водопроводная
Вода
|
487,3
|
488,7
|
494,0
|
|
5
|
474,5
|
474,6
|
477,6
|
|
6
|
Пинежский
Район
|
472,4
|
472,5
|
491,8
|
|
7
|
Ягры
|
421,4
|
421,6
|
414,3
|
Таблица 3. Результаты потенциометрического
определения содержания нитрат - ионов в отобранных пробах.
|
№
ПП
|
№
выборки
|
E изм.
|
pNO3
|
СNO3
*10-5 моль/л; рассчит.
|
СNO3*10-5
моль/л; средн.
|
|
1
|
1
|
503,6
|
4,9388
|
1,16
|
1,155
|
|
2
|
503,8
|
4,9425
|
1,15
|
|
|
2
|
1
|
501,5
|
4,90005
|
1,27
|
1,37
|
|
2
|
500,2
|
4,8761
|
1,34
|
|
|
3
|
497,5
|
4,8262
|
1,51
|
|
|
3
|
1
|
496,1
|
4,80
|
1,59
|
1,65
|
|
2
|
496,4
|
4,81
|
1,56
|
|
|
3
|
492,7
|
4,73
|
1,87
|
|
|
4
|
1
|
487,3
|
4,64
|
2,30
|
2,14
|
|
2
|
488,7
|
4,66
|
2,20
|
|
|
3
|
492,0
|
1,92
|
|
|
5
|
1
|
472,4
|
4,363
|
4,3525
|
4,33
|
|
2
|
472,5
|
4,363
|
4,3151
|
|
|
6
|
1
|
474,5
|
4,4018
|
4,0
|
3,84
|
|
2
|
474,6
|
4,4036
|
3,99
|
|
|
3
|
477,6
|
4,4589
|
3,52
|
|
|
7
|
1
|
421,4
|
3,421
|
39,20
|
39,0
|
|
2
|
421,6
|
3,4255
|
38,80
|
|
Таблица 5. Статистическая обработка результатов
исследования (в единицах измерения моль/л).
|
№
п/п
|
|
S
|
S
|
Sx
|
E
|
с
|
|
1
|
1,155·10-5
|
5
· 10-15
|
7,07
· 10-8
|
5,01
· 10-8
|
6,36
· 10-7
|
(1,16±
0,06) · 10-5
|
|
2
|
1,37
· 10-5
|
1,525·
10-12
|
1,235·10-6
|
7,13
· 10-7
|
3,1·
10-6
|
(1,37
± 0,31) · 10-5
|
|
3
|
1,65
· 10-5
|
2,925·
10-12
|
1,71·
10-6
|
9,87
· 10-7
|
4,20
· 10-6
|
(1,65
± 0,42) · 10-5
|
|
4
|
2,14
·10-5
|
3,753·
10-12
|
1,93
· 10-6
|
1,11
· 10-6
|
4,80
· 10-6
|
|
5
|
4,33
· 10-5
|
3,5138·10-14
|
1,8745·10-7
|
1,3257·10-7
|
1,68
· 10-6
|
(4,33
± 0,17) · 10-5
|
|
6
|
3,84
· 10-5
|
7,525
· 10-12
|
2,74
· 10-6
|
1,584
· 10-6
|
6,816·10-6
|
(3,84
± 0,68) · 10-5
|
|
7
|
39,0
· 10-5
|
8,0
· 10-12
|
2,83
· 10-6
|
1,99·
10-6
|
2,5
· 10-5
|
(39,0
± 2,50) · 10-5
|
Табл.5 Концентрация нитратов в поверхностных
водах г.Архангельска и Архангельской области
|
№
|
Проба
|
Концентрация,моль/л*10-5
|
|
1
|
Соломбала
|
1,16±0,06
|
|
2
|
СНТ-Двина
(канава)
|
1,37±0,31
|
|
3
|
СНТ-Двина
(болото)
|
1,65±0,42
|
|
4
|
Водопроводная
вода
|
2,14±0,48
|
|
5
|
Центр
|
3,84±0,68
|
|
6
|
Пинежский
район
|
4,33±0,17
|
|
7
|
Ягры
|
39,00±2,50
|