Динамика сетки водородных связей в воде и аморфном льде
Министерство образования и науки РФ
Федеральное государственное
автономное образовательное
учреждение высшего профессионального
образования
«Казанский (Приволжский) федеральный
университет»
ИНСТИТУТ ФИЗИКИ
КАФЕДРА ВЫЧИСЛИТЕЛЬНОЙ ФИЗИКИ И
МОДЕЛИРОВАНИЯ ФИЗИЧЕСКИХ ПРОЦЕССОВ
Специальность: «050100.68
Педагогическое образование»
Тема:
Динамика сетки водородных связей в
воде и аморфном льде
Работа
завершена:
“___”_____________
2013 г. __________________ Р.Р. Садыкова
Работа
допущена к защите:
Научный руководитель
к.ф.-м.н.,
доцент
“___”_____________
2013 г. __________________ Р.М.Хуснутдинов
Заведующий
кафедрой
к.ф.-м.н.,
доцент
“___”_____________
2013 г. __________________ А.В.Мокшин
Казань 2013
Содержание
ВВЕДЕНИЕ
ГЛАВА I. ФАЗОВАЯ ДИАГРАММА И АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ
§1.1 О воде.
§ 1.2 Водородная связь в воде. Критерий водородной связи
§ 1.3 Аномальные свойства воды
§ 1.4 Кристаллические льды
§ 1.5 Аморфные льды
ГЛАВА II.ЭЛЕКТРОКРИСТАЛЛИЗАЦИЯ ВОДЫ
§2.1 Понятие о электролизе и электролитах
§2.2 Электрокристаллизация и ее закономерности
§2.3 Динамика сетки водородных связей при
электрокристаллизации воды
Результаты
ЗАКЛЮЧЕНИЕ ПО III ГЛАВЕ
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Введение
Вода является одной из самых распространенных соединений в Природе.
Несмотря на простоту ее химической структуры многие свойства этой жидкости и
механизмы протекания ее физических процессов далеки от полного понимания. Вода
обладает широким спектром аномальных свойств, проявляющихся в
термодинамических, структурных, транспортных и др. характеристиках системы.
Отчасти это может быть объяснено наличием, так называемой сетки водородных
связей в воде. Водородные связи во многом определяют поведение воды и являются
главной причиной существенного ее отличия от других жидкостей. Природа этих
сильных анизотропных межмолекулярных взаимодействий способствуют проявлению
специфических термодинамических и структурных свойств воды, а так же
динамического поведения уникального по сравнению с другими веществами.
Свойствами жидкой воды, которыми обусловленные такие важные процессы, как
растворение различных веществ и транспорт протонов, является результатом
движения воды в постоянно меняющейся структуре сетки водородных связей. Одними
из методов, с помощью которого можно выполнить качественные и количественные
оценки динамики сетки водородных связей являются методы компьютерного
моделирования. В последнее время предложены различные критерии, позволяющие
рассчитывать и анализировать водородные связи на основе данных моделирования
молекулярной динамики.
Цель: исследовать динамику сетки водородных связей в воде методом
молекулярной динамики
Задачи:
• выполнить компьютерное моделирование молекулярной динамики воды
для температурной области от 200 до 400К при давлении 1.0 атм и аморфного льда
для температурной области при этом же давлении;
• выполнить компьютерное моделирование молекулярной динамики воды
для давления от 1.0 атм. до 10000 атм. При постоянной температуре 277К;
• рассчитать радиальную функцию распределения молекул воды в
зависимости от давления;
• выполнить литературный обзор критериев водородной связи для
воды;
• с помощью геометрического критерия водородной связи исследовать
температурную зависимость количества водородных связей приходящихся на одну
молекулу;
• рассчитать параметры порядка;
• показать, что наличие графеновых стенок существенно изменяет
фазовую диаграмму воды
• обнаружить, что вода, заключенная между графеновыми слоями
переходит в кубический лед Ic.
• Показать, что при электрокристаллизации воды существенно
изменяется динамика сетки водородных связей.
ГЛАВА I. ФАЗОВАЯ ДИАГРАММА И АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ
§1.1 О воде
Вода (оксид водорода) - химическое вещество в виде прозрачной жидкости,
не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях).
Химическая формула: Н2O.
В твёрдом состоянии называется льдом, снегом или инеем, а газообразном -
водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озера,
реки, льды).
Является хорошим сильнополярным растворителем. В природных условиях
всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в
химическом строении живых организмов, в формировании климата и погоды.
Вода
- это самое обычное и самое распространенное вещество. Однако с научной точки
зрения это самая необычная, самая загадочная жидкость. Пожалуй, только жидкий
гелий может соперничать с ней. Но необычные свойства жидкого гелия (такие, как
сверхтекучесть) проявляются при очень низких температурах (вблизи абсолютного
нуля) и обусловлены специфическими квантовыми законами. Поэтому жидкий гелий -
это экзотическое вещество. Вода же в нашем сознании является прообразом всех
жидкостей, и тем более удивительно, когда мы называем ее самой необычной. Но в
чем же заключается необычность воды? Дело в том, что трудно назвать какое-либо
ее свойство, которое не было бы аномальным, то есть ее поведение (в зависимости
от изменения температуры, давления и других факторов) существенно отличается от
такового у подавляющего большинства других жидкостей, у которых это поведение
похоже и может быть объяснено из самых общих физических принципов. К таким
обычным, нормальным жидкостям относятся, например, расплавленные металлы
<#"704599.files/image001.gif">
Рис.1.2.1. Образование ВС связи.
Водородная связь (ВС) сильнее вандерваальсова взаимодействия, но слабее
ковалентной
В компьютерном эксперименте пару молекул считают связанной водородной
связью, если они удовлетворяют некоторым заранее сформулированным условиям -
критериям образования ВС. Один из простейших энергетических критериев
водородной связи, позволяющий идентифицировать ее в рамках численного
эксперимента, был предложен в 1972 году Стиллинжером и Рахманом [1]. Согласно
данному определению, две молекулы являются связанными водородной связью, если
энергия взаимодействия между молекулами 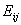 меньше некоторого порогового
значения
меньше некоторого порогового
значения 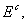 т.е.
т.е.
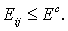 (1)
(1)
Другой критерий водородной связи основывается на геометрических
параметрах, учитывающих углы и расстояния между атомами. Существуют различные
модификации геометрического критерия водородной связи [2-5]:
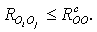


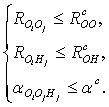
водородный связь вода лед
Согласно определению (2), водородная связь существует, если расстояние
между атомами кислорода в соседних молекулах меньше или равно значению 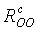 . В определении (3) расстояние между
атомами кислорода и водорода в молекулярных парах ограничивается пороговым
расстоянием
. В определении (3) расстояние между
атомами кислорода и водорода в молекулярных парах ограничивается пороговым
расстоянием 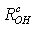 . Параметр
. Параметр 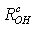 определяет максимальное значение длины водородной связи.
Пороговые значения
определяет максимальное значение длины водородной связи.
Пороговые значения  и
и 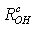 обычно определяются из парциальных радиальных функций
распределений частиц,
обычно определяются из парциальных радиальных функций
распределений частиц,  и
и 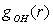 , соответственно. Двухпараметрический геометрический критерий
водородной связи (4) накладывает дополнительное условие на ориентацию
взаимодействующих молекул. Параметр
, соответственно. Двухпараметрический геометрический критерий
водородной связи (4) накладывает дополнительное условие на ориентацию
взаимодействующих молекул. Параметр 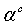 представляет допустимое отклонение
водородной связи от линейности. Обычно оно имеет значение порядка 30о.
Критерий, определяемый системой неравенств (5) включает условия (2) и (4).
Недавно был введен модифицированный энергетический критерий водородной связи,
определяемый следующими условиями:
представляет допустимое отклонение
водородной связи от линейности. Обычно оно имеет значение порядка 30о.
Критерий, определяемый системой неравенств (5) включает условия (2) и (4).
Недавно был введен модифицированный энергетический критерий водородной связи,
определяемый следующими условиями:
 (6)
(6)
Данный критерий фактически объединяет условия энергетического критерия
Стиллинжера-Рахмана (1) и геометрического критерия (4).
§ 1.3 Аномальные свойства воды
Физические аномалии
Вода в нормальных атмосферных условиях сохраняет жидкое агрегатное
состояние, тогда как аналогичные водородные соединения являются газами. Это
объясняется особыми характеристиками слагающих молекулы атомов и присутствием
связей между ними. Из-за большой разности электроотрицательностей атомов
водорода и кислорода электронные облака сильно смещены в сторону кислорода. По
этой причине молекула воды является активным диполем, где кислородная сторона
отрицательна, а водородная положительна. В результате молекулы воды
притягиваются своими противоположными полюсами, и образуют полярные связи, на
разрыв которых требуется много энергии. В составе каждой молекулы ион водорода
(протон) не имеет внутренних электронных слоев и обладает малыми размерами, в
результате чего он может проникать в электронную оболочку отрицательно
поляризованного атома кислорода соседней молекулы, образуя водородную связь с
другой молекулой.
Каждая молекула связана с четырьмя другими посредством водородных связей
- две из них образует атом кислорода и две атомы водорода. Комбинация этих
связей между молекулами воды - полярной и водородной и определяет очень высокую
температуру её кипения и удельную теплоты парообразования. В результате этих
связей в водной среде возникает давление в 15-20 тыс. атмосфер, которое и
объясняет причину трудносжимаемости воды, так при увеличении атмосферного
давления на 1 бар, вода сжимается на 0,00005 доли её начального объёма.

Рис.1.3.1 Аномалии точки кипения и замерзания воды по сравнению с другими
соединениями.
Структуры воды и льда между собой очень похожи. В воде, как и во льду,
молекулы стараются расположиться в определённом порядке образовать структуру,
однако тепловое движение этому препятствует. При температуре перехода в твёрдое
состояние тепловое движение молекул более не препятствует образованию
структуры, и молекулы воды упорядочиваются, в процессе этого объёмы пустот
между молекулами увеличиваются, и общая плотность воды падает, что и объясняет
причину меньшей плотности воды в фазе льда. При испарении, напротив, рвутся все
связи. Разрыв связей требует много энергии, отчего у воды самая большая
удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы
нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии.
Благодаря этому свойству вода нередко используется как теплоноситель. Однако
удельная теплоёмкость воды, в отличие от других веществ непостоянна: при
нагреве от 0 до 35°С её удельная теплоёмкость падает, в то время как у других
веществ она постоянна при изменении температуры [5].
Вода обладает также высоким поверхностным натяжением среди жидкостей,
уступая в этом только ртути. Относительно высокая вязкость воды обусловлена
тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ.
Каждая молекула растворяемого вещества окружается молекулами воды, причём
положительно заряженные участки молекулы растворяемого вещества притягивают
атомы кислорода, а отрицательно заряженные - атомы водорода. Поскольку молекула
воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого
вещества.
Это свойство воды используется живыми существами. В живой клетке и в
межклеточном пространстве вступают во взаимодействие растворы различных веществ
в воде. Вода необходима для жизни всех без исключения одноклеточных и
многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако
она сильно поглощает инфракрасное излучение, и поэтому водяной пар является
основным естественным парниковым газом, отвечающим более чем за 60 %
парникового эффекта. Благодаря большому дипольному моменту молекул, вода также
поглощает микроволновое излучение, на чём основан принцип действия
микроволновой печи.
В атмосфере нашей планеты вода находится в виде капель малого размера, в
облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в
виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая
водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода
является важнейшим веществом всех живых организмов на Земле. Предположительно,
зарождение жизни на Земле произошло в водной среде.
На это особое свойство воды впервые обратил внимание еще Г. Галилей. При
переходе любой жидкости (кроме галлия и висмута) в твердое состояние молекулы
располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее.

Рис.1.3.2. Зависимость удельного объема льда и воды от температуры
Любой жидкости, но не воды. Вода и здесь представляет собой исключение.
При охлаждении вода сначала ведет себя, как и другие жидкости: постепенно
уплотняясь, она уменьшает свой объем. Такое явление можно наблюдать до +4°С
(точнее до +3,98°С).
Именно при температуре +3,98°С вода имеет наибольшую плотность и
наименьший объем. Дальнейшее охлаждение воды постепенно приводит уже не к
уменьшению, а к увеличению объема. Плавность этого процесса вдруг прерывается и
при 0°С происходит резкий скачок увеличения объема почти на 10%! В это
мгновение вода превращается в лед [6].
Уникальная особенность поведения воды при охлаждении и образовании льда
играет исключительно важную роль в природе и жизни. Именно эта особенность воды
предохраняет от сплошного промерзания в зимний период все водоемы земли - реки,
озера, моря и тем самым спасает жизнь.
В отличие от пресной воды морская вода при охлаждении ведет себя иначе.
Замерзает она не при 0°С, а при минус 1,8-2,1°С - в зависимости от концентрации
растворенных в ней солей. Имеет максимальную плотность не при + 4°С, а при
-3,5°С. Таким образом она превращается в лед, не достигая наибольшей плотности.
Если вертикальное перемешивание в пресных водоемах прекращается при охлаждении
всей массы воды до +4°С, то в морской воде вертикальная циркуляция происходит
даже при температуре ниже 0°С. Процесс обмена между верхними и нижними слоями
идет непрерывно, создавая благоприятные условия для развития животных и
растительных организмов.
Особенно благоприятной средой для обитателей морей и океанов являются
талые воды, образующиеся при таянии ледников и айсбергов. В безбрежных
просторах океанов плавающие горы-айсберги в основном скрыты под водой, однако
могут представлять серьезную опасность для судоходства. Трагедией века была
названа гибель "Титаника", которая произошла в результате
столкновения суперлайнера с огромным айсбергом 14 апреля 1912 года.
Все термодинамические свойства воды заметно или резко отличаются от
других веществ.
Вода чрезвычайно распространённое вещество в космосе, однако из-за
высокого внутри жидкостного давления вода не может существовать в жидком
состоянии в условиях вакуума космоса, отчего она представлена только в виде
пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса
человеком и возможности возникновения жизни на других планетах, является вопрос
о наличии воды за пределами Земли в достаточно большой концентрации. Известно,
что некоторые кометы более чем на 50 % состоят из водяного льда. Не стоит,
впрочем, забывать, что не любая водная среда пригодна для жизни - в частности,
аккумуляторная батарея содержит 25 % раствор серной кислоты в воде (но жизнь в
нем, очевидно, маловероятна, тем более, её возникновение).
Вода широко распространена в Солнечной системе, она есть почти везде,
даже в атмосфере Венеры присутствует небольшое количество водяного пара.
Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера
и Сатурна: Энцеладе, Тефии, Европе, Ганимеде и др. Вода присутствует в составе
всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые
объекты имеют в своём составе воду.
Жидкая вода, предположительно, имеется под поверхностью некоторых
спутников планет, наиболее вероятно, на Европе - спутнике Юпитера.
Вода играет уникальную роль как вещество, определяющее возможность
существования и саму жизнь всех существ на Земле. Она выполняет роль
универсального растворителя, в котором происходят основные биохимические
процессы живых организмов. Уникальность воды состоит в том, что она достаточно
хорошо растворяет как органические, так и неорганические вещества, обеспечивая
высокую скорость протекания химических реакций и в то же время - достаточную
сложность образующихся комплексных соединений. Благодаря водородной связи, вода
остаётся жидкой в широком диапазоне температур, причем именно в том, который
широко представлен на планете Земля в настоящее время.
Аномалия теплоёмкости. Она заключается в следующем: При нагревании любого
вещества теплоемкость неизменно повышается. Для любого вещества, но не воды.
Вода - исключение, она и здесь не упускает возможности быть оригинальной: с
повышением температуры изменение теплоемкости воды аномально; от 0 до 37°С она
понижается и только от 37 до 100°С теплоемкость все время растет [7-9].

Рис.1.3.3. Температурная зависимость воды от удельной теплоёмкости
В пределах температур, близких к 37°С, теплоемкость воды минимальна.
Именно эти температуры - область температур человеческого тела, область нашей
жизни. Физика воды в области температур 35-41°С (пределы возможных, нормально
протекающих физиологических процессов в организме человека) констатирует
вероятность достижения уникального состояния воды, когда массы
квазикристаллической и объемной воды равны друг другу и способность одной
структуры переходить в другую - вариабельность - максимальная. Это
замечательное свойство воды предопределяет равную вероятность течения обратимых
и необратимых биохимических реакций в организме человека и обеспечивает
"легкое управление" ими.
Другая общеизвестная исключительная способность воды растворять любые
вещества. И здесь вода демонстрирует необычные для жидкости аномалии, и в
первую очередь аномалии диэлектрической постоянной воды. Это связано с тем, что
ее диэлектрическая постоянная (или диэлектрическая проницаемость) очень велика
и составляет 81, в то время как для других жидкостей она не превышает 10. В
соответствии с законом Кулона сила взаимодействия двух заряженных частиц в воде
будет в 81 раз меньше, чем, например, в воздухе, где эта характеристика равна
единице. В этом случае прочность внутримолекулярных связей уменьшается в 81 раз
и под действием теплового движения молекулы диссоциируют с образованием ионов.
Необходимо отметить, что из-за исключительной способности растворять другие
вещества вода никогда не бывает идеально чистой.
Аномальные свойства воды, определяющие, в том числе, и наличие жизни на
Земле - её переменная плотность, высокая теплоемкость и большое поверхностное
натяжение, объясняются двумя типами структур, в которые самоорганизуются
молекулы жидкости, уверены авторы нового исследования.
Ученым давно были известны 66 необъяснимых свойств воды, отличающих её от
большинства других химических веществ, встречающихся в жидком состоянии. Так, в
отличие от всех известных жидкостей, плотность которых монотонно увеличивается
с понижением температуры, плотность воды максимальна при 4 градусах Цельсия, а
при дальнейшем понижении температуры вновь начинает убывать. Это уникальное
свойство воды делает возможной жизнь в реках и озерах - в противном случае эти
относительно мелкие водоемы неизбежно промерзали бы до дна в зимний период и
были бы лишены всех живых организмов, за исключением, может быть, простейших
бактерий экстремофилов.
Объяснить эти свойства на основании лишь строения и химических параметров
молекул воды ученые до последнего времени не могли. Секрет крылся в структуре,
в которую самоорганизуются молекулы жидкой воды. Он долгое время оставался
неразгаданным, так как изучить эту структуру теми же методами, что применяются
для изучения строения твердых тел, практически невозможно.
Команда Андерса Нильсона (Anders Nilsson), ведущего специалиста
Стенфордского центра синхротронного излучения (Stanford Synchrotron Radiation
Lightsource), сумела преодолеть эти трудности благодаря новейшим методам
изучения строения жидкостей с использованием мощного рентгеновского излучения,
получаемого с помощью больших ускорителей элементарных частиц, называемых
синхротронами. Один из использованных в работе синхротронов находится в Японии,
а второй в США.
Ученые выяснили, что существовавшие до сих пор представления о
молекулярной структуре воды были неверными - оказалось, что её молекулы
формируют не одну структуру, а одновременно два типа структур, сосуществующих в
жидкости вне зависимости от температуры. Один тип структуры формируется в виде
сгустков примерно по 100 молекул, структура которых напоминает структуру льда.
Второй тип структуры, окружающей сгустки, гораздо менее упорядочен.
Увеличение температуры вплоть до точки кипения воды приводит к некоторому
искажению структуры сгустков и уменьшению их количества и доминированию
разупорядоченной структуры.
§ 1.4 Кристаллические льды
Лёд - кристаллическая форма воды, обладающая по последним данным
четырнадцатью структурными модификациями. Среди них имеются и кристаллические
(природный лед) и аморфные (кубический лед) и метастабильные модификации,
различающиеся друг от друга взаимным расположением и физическими свойствами
молекул воды, связанные водородными связями, формирующими кристаллическую
решетку льда.

Рис.1.4.1. Кристаллическая структура льда.
Все они кроме привычного нам природного льда Ih, кристаллизующего в
гексагональной решетке, образуются в условиях экзотических - при очень низких
температурах сухого льда и жидкого азота и высоких давлениях в тысячи атмосфер,
когда углы водородных связей в молекуле воды изменяются и образуются
кристаллические системы, отличные от гексагональной. Такие условия напоминают
космические и не встречаются на Земле.
В природе лёд представлен главным образом, одной кристаллической
разновидностью, кристаллизующейся в гексагональной решётке, напоминающей
структуру алмаза, где каждая молекула воды окружена четырьмя ближайшими к ней
молекулами, находящимися на одинаковых расстояниях от нее, равных 2,76 ангстрем
и размещенных в вершинах правильного тетраэдра . В связи с низким
координационным числом структура льда является сетчатой, что влияет на его
невысокую плотность, составляющая 0,931 г/см3.
Самое необычное свойство льда - это удивительное многообразие внешних
проявлений. При одной и той же кристаллической структуре он может выглядеть
совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев
пушистого снега, плотной блестящей корки льда или гигантских ледниковых масс.
Лёд встречается в природе в виде материкового, плавающего и подземного льда, а
также в виде снега и инея. Он распространён во всех областях обитания человека.
Собираясь в больших количествах, снег и лед формируют особые структуры с
принципиально иными, чем у отдельных кристаллов или снежинок, свойствами.
Природный лед сформирован в основном льдом осадочно-метаморфического
происхождения, образовавшийся из твердых атмосферных осадков в результате
последующего уплотнения и перекристаллизации. Характерная особенность
природного льда - зернистость и полосчатость. Зернистость обусловлена
процессами рекристаллизации; каждое зерно ледникового льда представляет собой
кристалл неправильной формы, тесно примыкающий к другим кристаллам в ледяной
толще таким образом, что выступы одного кристалла плотно входят в углубления
другого. Такой лед получил название поликристаллического. В нем каждый кристалл
льда представляет собой слой тончайших листочков, налегающих друг на друга в
базисной плоскости, перпендикулярной к направлению оптической оси кристалла.
Общие запасы льда на Земле составляют согласно расчетам около 30 млн. км3
(табл. 1). Больше всего льда сосредоточено в Антарктиде, где толщина его слоя
достигает 4 км. Также имеются данные о наличии льда на планетах Солнечной
системы и в кометах. Лед имеет столь большое значение для климата нашей планеты
и обитания на ней живых существ, что ученые обозначили для льда особую среду -
криосферу, границы которой простираются высоко в атмосферу и глубоко в земную
кору.
Табл. 1. Количество, распространение и время жизни льда.
|
Вид льда
|
Масса
|
Площадь распространения
|
Средняя концентрация, г/см2
|
Скорость прироста массы,
г/год
|
Среднее время жизни, год
|
|
г
|
%
|
млн. км2
|
%
|
|
|
|
|
Ледники
|
2.4·1022
|
98.95
|
16.1
|
10.9 суши
|
1.48·105
|
2.5·1018
|
9580
|
|
Подземный лёд
|
2·1020
|
0.83
|
21
|
14.1 суши
|
9.52·103
|
6·1018
|
30-75
|
|
Морской лёд
|
0.14
|
26
|
7.2 океана
|
1.34·102
|
3.3·1019
|
1.05
|
|
Снежный покров
|
1.0·1019
|
0.04
|
72.4
|
14.2 Земли
|
14.5
|
2·1019
|
0.3-0.5
|
|
Айсберги
|
7.6·1018
|
0.03
|
63.5
|
18.7 океана
|
14.3
|
1.9·1018
|
4.07
|
|
Атмосферный лёд
|
1.7·1018
|
0.01
|
510.1
|
100 Земли
|
3.3·10-1
|
3.9·1020
|
4·10-3
|
Кристаллы льда неповторимы по своей форме и пропорциям. Любой растущий
природный кристалл, включая кристалл льда, всегда стремится создать идеальную
правильную кристаллическую решетку, поскольку это выгодно с точки зрения
минимума его внутренней энергии. Любые примеси, как известно, искажают форму
кристалла, поэтому при кристаллизации воды в первую очередь в решётку
встраиваются молекулы воды, а посторонние атомы и молекулы примесей вытесняются
в жидкость. И только когда примесям деваться уже некуда, кристалл льда начинает
встраивать их в свою структуру или оставляет в виде полых капсул с
концентрированной незамерзающей жидкостью - рассолом. Поэтому морской лёд
пресный и даже самые грязные водоемы покрываются прозрачным и чистым льдом. При
плавлении льда он вытесняет примеси в рассол. В планетарном масштабе феномен
замерзания и таяния воды, наряду с испарением и конденсацией воды, играет роль
гигантского очистительного процесса, в котором вода на Земле постоянно очищает
сама себя.
Табл. 2. Некоторые физические свойства льда I.
|
Свойство
|
Значение
|
Примечание
|
|
Теплоемкость, кал/(г·°C)
Теплота таяния, кал/г Теплота парообразования, кал/г
|
0.51 (0 °C) 79.69 677
|
Сильно уменьшается с
понижением температуры
|
|
Коэффициент термического
расширения, 1/°C
|
9.1·10-5 (0 °C)
|
Поликристаллический лёд
|
|
Теплопроводность,
кал/(см·сек·°C)
|
4.99·10 -3
|
Поликристаллический лёд
|
|
Показатель преломления:
|
1.309 (-3 °C)
|
Поликристаллический лёд
|
|
Удельная электрическая
проводимость, ом-1·см-1
|
10-9 (0 °C)
|
Кажущаяся энергия активации
11 ккал/моль
|
|
Поверхностная
электропроводность, ом-1
|
10-10 (-11°C)
|
Кажущаяся энергия активации
32 ккал/моль
|
|
Модуль упругости Юнга,
дин/см2
|
9·1010 (-5 °C)
|
Поликристаллический лёд
|
|
Сопротивление, МН/м2 :
раздавливанию разрыву срезу
|
2.5 1.11 0.57
|
Поликристаллический лёд
Поликристаллический лёд Поликристаллический лёд
|
|
Динамическая вязкость, пуаз
|
1014
|
Поликристаллический лёд
|
|
Энергия активации при
деформировании и механической релаксации, ккал/моль
|
11.44-21.3
|
Линейно растет на 0.0361
ккал/(моль·°C) от 0 до 273.16 К
|
В связи с широким распространением льда на Земле, отличие физических
свойств льда (табл. 2) от свойств других веществ играет важную роль во многих
природных процессах. Лёд обладает многими другими полезными для поддержания
жизни свойствами и аномалиями - аномалиями плотности, давления, объема,
теплопроводности. Если бы не было водородных связей, сцепляющих молекулы воды в
кристалл, лед плавился бы при -90 °С. Но этого не происходит из-за наличия
водородных связей между молекулами воды. Вследствие меньшей, чем у воды,
плотности лёд образует на поверхности воды плавучий покров, предохраняющий реки
и водоёмы от донного замерзания, поскольку его теплопроводность намного меньше,
чем воды. При этом наименьшая плотность и объем наблюдается при +3,98 °С .
Дальнейшее охлаждение воды до 0 0С постепенно приводит не к
уменьшению, а к увеличению ее объема почти на 10%, когда вода превращается в
лед. Такое поведение воды свидетельствует об одновременном существовании в воде
двух равновесных фаз - жидкой и квазикристаллической по аналогии с
квазикристаллами, кристаллическая решетка которых имеет не только периодическое
строение, но и обладает осями симметрии разных порядков, существование которых
ранее противоречило представлениям кристаллографов. Эта теория, впервые
выдвинутая известным отечественным физиком-теоретиком Я. И. Френкелем, основана
на предположении, что часть молекул жидкости образует квазикристаллическую
структуру, тогда как остальные молекулы являются газоподобными, свободно
движущимися по объему. Распределение молекул в малой окрестности любой
фиксированной молекулы воды имеет определенную упорядоченность, несколько
напоминающую кристаллическую, хотя и более рыхлую . По этой причине структуру
воды иногда называют квазикристаллической или кристаллоподобной, т. е.
обладающей симметрией и наличием упорядоченности во взаимном расположении
атомов или молекул.
Другое свойство состоит в том, что скорость течения льда прямо
пропорциональна энергии активации и обратно пропорциональна абсолютной температуре,
так что с понижением температуры лёд приближается по своим свойствам к
абсолютно твёрдому телу. В среднем при близкой к таянию температуре текучесть
льда в 106 раз выше, чем у горных пород . Благодаря своей текучести
лёд не накопляется в одном месте, а в виде ледников постоянно перемещается.
Зависимость между скоростью течения и напряжением у поликристаллического льда
гиперболическая; при приближённом описании её степенным уравнением показатель
степени увеличивается по мере роста напряжения.
Видимый свет льдом практически не поглощается, поскольку световые лучи
проходят кристалл льда насквозь, но задерживает ультрафиолетовое излучение и
большую часть инфракрасного излучения Солнца. В этих областях спектра лёд
выглядит абсолютно чёрным, поскольку коэффициент поглощения света в этих
областях спектра очень велик. В отличие от кристаллов льда, белый свет,
падающий на снег, не поглощается, а многократно преломляется в ледяных
кристаллах и отражается от их граней. Поэтому снег выглядит белым.
Вследствие очень высокой отражательной способности льда (0,45) и снега
(до 0,95) покрытая ими площадь - в среднем за год около 72 млн. км2
в высоких и средних широтах обоих полушарий - получает солнечного тепла на 65%
меньше нормы и является мощным источником охлаждения земной поверхности, чем в
значительной мере обусловлена современная широтная климатическая зональность.
Летом в полярных областях солнечная радиация больше, чем в экваториальном
поясе, тем не менее, температура остаётся низкой, т. к. значительная часть поглощаемого
тепла затрачивается на таяние льда, имеющего очень высокую теплоту таяния.
Самое удивительное в структуре льда заключается в том, что молекулы воды
при низких температурах и высоких давлениях внутри углеродных нанотрубок могут
кристаллизоваться в форме двойной спирали, напоминающей молекулы ДНК. Это было
доказано недавними компьютерными экспериментами американских учёных под
руководством Сяо Чэн Цзэна из Университете штата Небраска (США). Чтобы вода
сформировала спираль в моделируемом эксперименте она помещалась в нанотрубки
диаметром от 1,35 до 1,90 нм под высоким давлением, варьирующимися от 10 до
40000 атмосфер и задавалась температура -23 °C . Ожидалось увидеть, что вода во
всех случаях образует тонкую трубчатую структуру. Однако, модель показала, что
при диаметре нанотрубки в 1,35 нм и внешнем давлении 40000 атмосфер водородные
связи в структуре льда искривились, что привело к образованию спирали с двойной
стенкой - внутренней и внешней. Внутренняя стенка в этих условиях оказалась
скрученной в четверо спиралью, а внешняя стенка состояла из четырёх двойных
спиралей, похожих на молекулу ДНК . Данный факт может служить подтверждением
связи структуры жизненно-важной молекулы ДНК со структурой самой воды и что
вода служила матрицей для синтеза молекул ДНК.
Где l-расстояние
между электродами; g - площадь сечения столбика электролита.
Величина "и" есть электропроводность
столбика электролита длиной 1 см и сечением 1 см2. Однако эта
величина не пригодна для сравнения электропроводности разных электролитов, так
как зависит от концентрации раствора. Для этой цели пользуются
электропроводностью электролита, приведенной к 1 г экв/л или 1 г
экв/л или 1 г 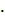 моль/л называемой эквивалентной λ
или молярной Λ:
моль/л называемой эквивалентной λ
или молярной Λ:
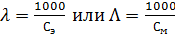 (16)
(16)
где Сэ и См - концентрации соли,
кислоты или основания
С помощью этих величин легко вычислить степень
диссоциации электролита α- полный или частичный распад веществ, входящих в
раствор.
Соотношение между количеством прошедшего через раствор
электричества во время электролиза и количеством прореагировавших веществ на
электродах определяется законами Фарадея, которые составляют основу
гальваностегии. Первый закон гласит о том, что между количеством прошедшего
через электролит электричества Q и количеством прореагировавшего в
электрохимической реакции вещества или количества выделившихся на электродах
продуктов реакции Δm существует зависимость:
Δm = qQ =
qIt,
где q - коэффициент пропорциональности; I - сила тока;
t - время.
При I = 1А и t = 1 с Δm = q. Коэффициент q называют
электрохимическим эквивалентом или количеством вещества, выделившегося на
электродах, при прохождении через систему 1 Кл электричества.
Второй закон говорит о том, что при прохождении через
электролиты одного и того же количества электричества массы прореагировавших
веществ на электродах прямо пропорциональны их химическим эквивалентам:
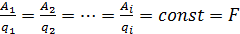 (17)
(17)
где F - константа Фарадея. Ее значение, например, для
серебра равно 96 500 Кл.
Следовательно, для превращения 1 г•экв любого вещества
необходимо пропустить через электролит 96 500 Кл электричества.
Для определения влияния побочных электрических реакций
применяется понятие выхода по току, которое выражается уравнением:
 (18)
(18)
где mп - практически прореагировавшее
количество вещества; mт - теоретически подсчитанное количество
вещества, которое должно было прореагировать в соответствии с законом Фарадея:
Qт- количество прошедшего электричества, вычисленное по закону
Фарадея; Qп - практически израсходованное количество электричества.
Толщину покрытия, продолжительность электролиза и
плотность тока вычисляют по формуле
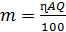 (19)
(19)
где A - электрохимический эквивалент; η
- выход по току.
Так как масса m= Vρ (где V- объем выделившегося металла; ρ
- плотность металла), a
V= gd, где g - общая площадь гальванопокрытия; d - его толщина, толщину (в мкм)
находят по формуле
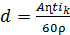 (20)
(20)
По этой же формуле можно определить катодную плотность
тока (вА/дм2) и t (в мин).
(вА/дм2) и t (в мин).
Во время электродных реакций, вызываемых электрическим
током, электроны на аноде освобождаются, а на катоде связываются. Вследствие
этого на аноде происходят электрохимические реакции окисления, а на катоде -
восстановления.
При погружении металла в электролит, содержащий ионы
данного металла, на границе фаз металл - электролит возникает разность
потенциалов, называемая электродным потенциалом. Этот потенциал обусловлен
зарядами ионов, которые имеются как в электролите, так и в металле.
При отсутствии внешнего электрического поля переход
ионов из металла в электролит и обратно быстро достигается равновесие ионов и
устанавливается постоянный потенциал (гальвани-потенциал). Абсолютное значение
гальвани-потенциала любого электрода определяется относительно другого,
вспомогательного электрода, например относительно нормального водородного
электрода, гальвани-потенциал которого условно обозначен 0,0000 В (при
активности водородных ионов 1 и давлении газа 1 кгс/см2). Электродный потенциал
зависит от температуры, валентности и концентрации (или активности) ионов
металла в электролите.
При переходе ионов на электрод изменяется свободная
энергия системы металл-электролит ΔF. Эта энергия определяется осмотической
работой, получаемой при переходе иона от активного состояния а0 к состоянию
активности а:
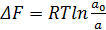 (21)
(21)
где R - газовая постоянная; Т- абсолютная температура.
Значение ΔF можно приравнять к максимальной электрической работе
при постоянном объеме -ΔF=zFφ (где z - валентность иона; F -
константа Фарадея). Тогда получим
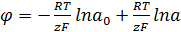 (21)
(21)
При R = 8,31 Дж. F = 96 500 Кл, Т=298 К это уравнение примет следующий
вид:
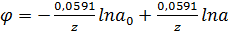 (22)
(22)
Первый член правой стороны уравнения состоит из постоянных величин, и его
можно обозначить константой φ0, тогда
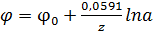 (23)
(23)
Эта формула называется уравнением Нерста и выражает потенциал любого металла,
погруженного в раствор своих ионов, активность которых равна а (при а = 1 φ
= φ0). Величину φ0 называют нормальным, или стандартным, потенциалом
электрода.
При динамическом равновесии между металлом и
электролитом основные ионы, определяющие потенциал электрода, с одинаковой
скоростью переходят к электроду и от него, поэтому скорость анодного и
катодного процессов равна iк = iа = i0, где i0
- ток обмена, характеризующий скорость процессов на электроде при равновесном
значении электродного потенциала, т. е. при отсутствии внешнего тока.
Ток обмена зависит от вида, состава и концентрации
электролита. При поляризации электрода (пропускание внешнего тока, например
плотностью i) его потенциал приобретает значение φi, отличное от потенциала φе (без тока). Отклонение электродного потенциала от
него равновесного значения называется перенапряжением η
= φi-φе.
Анодная поляризация электрода (i> 0) вызывает
положительное перенапряжение, а катодная (i < 0) - отрицательное. Если при
отсутствии внешнего тока одновременно происходит несколько электродных реакций,
например ионизация и осаждение металла (Me -> Zē -><- Mez+
), ионизация и разряд ионов водорода (Н2-2ē -><- 2Н+),
тогда образуется средний, так называемый компромиссный электродный потенциал φкп.
При анодной и катодной поляризации электрода
аналогично равновесному изменяется и компромиссный потенциал. В этом случае
отклонение электродного потенциала от значений равновесных потенциалов
приводимых реакций называется не перенапряжением, а поляризацией η=φп-φкп, где φп - потенциал поляризации. Поляризация, как и
перенапряжение, есть функция плотности тока i. Если при одновременном течении
нескольких электродных реакций ток обмена одной реакции значительно выше тока
обмена другой, то компромиссный потенциал приближается к равновесному
потенциалу более быстрой электродной реакции.
Простая катодная реакция может быть расчленена на
следующие четыре последовательные ступени, или процесса.
Миграция ионов из массы раствора к внешней границе
диффузионного слоя под действием электрического поля.
Скорость этого процесса [число грамм-ионов (г ион), проходящих ежесекундно через 1
см2 площади сечения электролита]
ион), проходящих ежесекундно через 1
см2 площади сечения электролита]
 (24)
(24)
где ni - число переносов ионов.
Скорость перехода разряжающихся ионов (в г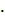 ион/л) через каждый сантиметр сечения
раствора под действием электрического поля и градиента активности ионов
(миграция плюс диффузия) выражается уравнением
ион/л) через каждый сантиметр сечения
раствора под действием электрического поля и градиента активности ионов
(миграция плюс диффузия) выражается уравнением
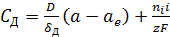 (25)
(25)
где D - коэффициент диффузии ионов; δд - толщина диффузионного слоя, см; а, ае -
активность ионов в массе раствора и в контакте металла с электролитом.
Когда другие ступени электродной реакции происходят быстро, переход
разряжающихся ионов через диффузионный слой может тормозить общую
электрохимическую реакцию. Такое торможение называют диффузионным
перенапряжением и вычисляют по формуле
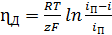 (26)
(26)
- плотность применяемого для электролиза тока; iп - предельный
ток, при котором скорость разряда ионов равна скорости их притока к поверхности
катода путем диффузии и миграции.
Среднюю толщину диффузионного слоя принимают равной 0,05 см. Тогда
предельный ток в неперемешиваемых электролитах (при 20 °С) определяют по
приближенной формуле iп= 0,025za1, где a1 -
активность разряжающихся ионов в растворе, которая для приближенных расчетов
может быть заменена их концентрацией Сi.
Переход ионов через двойной электрический слой под действием потенциала
разряда, градиент которого является наиболее высоким в данном слое.
Имея в виду, что почти весь спад электрического потенциала происходит в
двойном электрическом слое, и принимая, что толщина этого слоя равна нескольким
атомам, нетрудно подсчитать, что градиент потенциала в нем достигает десятков
миллионов вольт на сантиметр. Поэтому в двойном электродном слое происходит
взаимодействие вещества с электричеством (в сущности только эта ступень и
является настоящей электрохимической реакцией).
В анодном процессе к двойному электрическому слою
поступают нейтральные или слабозаряженные атомы металла, а выходят из него в
диффузионный слой полностью сформировавшиеся ионы, имеющие ближайшую гидратную
оболочку. В катодном процессе, наоборот, к двойному электрическому слою
подходят из диффузионного Пространства гидратированные ионы и полностью
освобождаются от этой оболочки или комплексообразующих лигандов. Поэтому
переход ионов через двойной электрический слой часто затрудняет электродную
реакцию, обусловливает ее скорость и вызывает так называемое переходное
перенапряжение ηп, являющееся также функцией плотности тока. Его
определяют для анодного и катодного процессов:
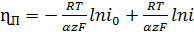 (для анодного)
(для анодного)
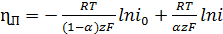 (для катодного) (26)
(для катодного) (26)
В обоих случаях уравнения имеют форму эмпирического уравнения Тафеля:
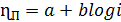 (27)
(27)
где а и b - константы, определяемые опытным путем.
Если скорость электродной реакции обусловлена только скоростью перехода
ионов через двойной электрический слой, то, отложив значения ηп по одной оси координат, а log i - по другой, получают
прямую Тафеля, по наклону которой определяют константу b. Для анодного процесса
b=2,303RT/αzF, а для катодного 2,303/RT(1-α)zF. Из этих равенств вычисляют
произведение αz, а с учетом валентности переходящих ионов и коэффициент
переноса а. Если прямую Тафеля провести до ее пересечения с осью координат при
ηп=0, то можно получить значение тока
обмена. Уравнения переходного перенапряжения для обоих процессов выведены без
учета дзета-потенциала, образующегося в диффузионном слое. Хотя во многих
случаях он является незначительной величиной по сравнению с общим электродным
потенциалом φ, его исключение иногда может привести к значительным
погрешностям определения значений а и i0.
Электронейтрализация ионов и освобождение их от гидратированной воды и
адсорбция на катоде с последующим вступлением в кристаллическую решетку
составляет только часть процесса электрокристаллизации. Другую часть составляет
образование двух- или трехмерных зародышей кристаллизации, вокруг которых
происходит рост кристаллов металла. Поэтому процесс электрокристаллизации также
оказывает влияние на потенциал электрода и на скорость катодной реакции и
характеризуется величиной, называемой перенапряжением кристаллизации ηк.
В случае образования двухмерных зародышей перенапряжение кристаллизации
определяют по уравнению
 (27)
(27)
где А и В - константы; ηк< 0.
Следовательно, с повышением перенапряжения кристаллизации число
двухмерных зародышей увеличивается, а зернистость электроосадков уменьшается.
Для определения перенапряжения кристаллизации при образовании трехмерных
зародышей применяют уравнение
 (28)
(28)
Кроме указанных перенапряжений существует реакционное, или химическое
перенапряжение, которое вызвано замедлением отдельных этапов катодной реакции.
Например,
[Cd(CN)4]2- +2ē -> Cd + 4CN-.
Эта реакция состоит из трех отдельных реакций:
[Cd(CN)4]2- -> Cd(CN)2 +
2CN-;(CN)2 + 2ē -> Cd +
(CN)22-;
Вторая реакция является электрохимической и при определенных условиях
может явиться тормозом общей электродной реакции и сместить электродный
потенциал. Реакционное перенапряжение ηr в значительной степени зависит от изменения
концентрации участвующих в химической реакции веществ, которые являются
составной частью механизма общего катодного процесса, и связано с диффузионными
явлениями. Поэтому значение ηr часто объединяют с диффузионным перенапряжением и
называют концентрационным перенапряжением ηс = ηд + ηr.
Таким образом, перенапряжение электродной реакции состоит из следующих
перенапряжений отдельных ее ступеней:
η=ηп+ηк+ηс.
§2.2 Электрокристаллизация и ее закономерности
Последней стадией катодной реакции при электроосаждении любого металла
является адсорбция его атомов на поверхности катода с последующим внедрением их
в кристаллическую решетку гальваноосадков. Эту стадию принято называть
электрокристаллизацией. Электрокристаллизация, электроосаждение, кристаллизация
металлов и сплавов на катоде при электролизе растворов и расплавов
соответствующих солей. Рост кристаллов при электрокристаллизации металлов имеет
много общего с кристаллизацией из пара или раствора, фактором, определяющим
пересыщение при электрокристаллизации, является перенапряжение, возникающее на
электроде в ходе электрохимической реакции. В зависимости от величины
перенапряжения рост кристаллов может происходить путём спирально-слоевого роста
на винтовых дислокациях, образования и разрастания двумерных зародышей
(особенно на бездислокационных кристаллах) и при достаточно высоких
пересыщениях - путём образования трёхмерных зародышей или нормального роста
кристаллов.
Возможность изменения перенапряжения на катоде в широких пределах
позволяет при электрокристаллизации получать слои металлов с сильно
различающимися свойствами. Так, в зависимости от условий образования осадков
плотность дислокаций в них может изменяться от 106 до 1012см-2,
соответственно изменяются и такие свойства, как электропроводность, твёрдость,
пластичность. Высокие плотности дислокаций были обнаружены в осадках меди,
никеля, железа, хрома, платины, серебра и др. Особенно сильное влияние на
структуру осадков металлов, полученных методом электрокристаллизации, оказывает
адсорбция поверхностно-активных веществ и включение примесей
электрокристаллизации лежит в основе электрометаллургии, рафинирования
металлов, гальванотехники. Ее следует расчленять на два этапа:
) образование на определенных местах катодной поверхности кристаллических
зародышей или центров кристаллизации;
) их рост до кристаллитов, размеры которых в гальвано-осадках в основном
определяются условиями катодной реакции.
Допустим, что вследствие флюктуации адсорбированных атомов осаждаемого
металла на грани ABCD любого
кристалла на катоде кратковременно образовались два кристаллических зародыша:
маленький К1 и значительно больше К2. Для сохранения этих
зародышей и их дальнейшего спонтанного роста необходима определенная энергия,
которая может быть выражена потенциалом поляризации катода или перенапряжением.
Зависимость потенциала зародыша φ от его размеров h можно описать уравнениями,
аналогичными уравнению Томпсона - Гиббса для давления паров маленьких капель
жидкости:
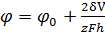 (29)
(29)
где φ∞ - электродный потенциал бесконечно большого кристалла осаждаемого
металла: δ - удельная поверхностная энергия зародыша в контакте с
раствором; V - молекулярный объем металла; z - заряд ионов металла; h - размер зародыша,
имеющего сферирическую полигональную форму.
При свободной электрокристаллизации новые адсорбирующиеся атомы а
электроосаждаемого металла могут с одинаковой степенью вероятности
диффундировать в двухмерном пространстве как к зародышу К1, так и к
зародышу К2, вступая в кристаллические решетки. Однако
кристаллические зародыши легче всего образуются на углах и ребрах растущих
кристаллов, так как на этих местах отмечается наибольшее сгущение линий
электрического поля. Поэтому степень заполнения разных граней кристаллов
атомами или ионами металла неодинакова, и энергия образования кристаллических
зародышей, или перенапряжение электрокристаллизации является функцией индексов
граней.
Наиболее медленно растут грани (III) кристаллов, состоящих из кубических гранецентрированных
решеток и грани (0001) кристаллов с гексагональными плотно упакованными
решетками. Рост тонких слоев кристаллов происходит при последовательном
образовании слоев металла примерно 10-5 - 10-4 см толщины
на соответствующих гранях. Однако электрокристаллизация и кристаллизация
гальванических покрытий зависят от вида покрытия, условий электролиза (состав
электролита, плотность тока, температура и др.) металла и шероховатости
поверхности подложки. Так, серебро осаждается слоями со скоростью 0,0004
мм/мин, медь со скоростью ~0,0002 мм/мин, олово - 0,0008 мм/мин. При этом рост
кристаллов происходит только на определенных активных участках с последующим
распространением по грани.
По степени трудности восстановления ионов на катоде металлы условно можно
разделить на три группы. К первой группе относятся металлы, восстанавливающиеся
с низким перенапряжением (олово, кадмий, цинк, медь, серебро и др.). Выделение
таких металлов происходит в основном на активных участках катода без заметной
химической поляризации.
Металлы, восстанавливающиеся с высоким перенапряжением (Fe, Co, Ni, Cr,
Mn и др.) склонны к пассивированию. Существование на катоде такой пленки
вследствие адсорбции чужеродных частиц повышает перенапряжение и позволяет
осаждать такие металлы из некоторых их солей. При этом покрытия не отличаются
высокой чистотой и содержат примеси в виде окиси, гидроокиси, водорода и др.
К третьей группе относятся металлы, которые пока не удается получать из
водных электролитов (молибден, вольфрам, ниобий, титан, тантал, магний и др.).
Для этих металлов характерна повышенная реакционная способность по отношению к
среде и образование поверхностных соединений. Они выделяются на катоде в виде
тонкого слоя окиси или гидроокиси.
§2.3 Динамика сетки водородных связей при
электрокристаллизации воды
В последние годы исследование свойств воды в конфайнменте (воды,
заключенной в цилиндрических порах или между тонкими пленками и пластинами)
привлекает особое внимание ученых из-за ее важности для понимания многих
биологических и геологических процессов, таких как: процессы, происходящие в
мембранах и клетках; транспортные процессы в порах; капиллярные явления;
динамические процессы при высоких давлениях, осуществляемые в недрах спутников
таких планет Солнечной системы, как Юпитер, Сатурн, Уран и Нептун [20].
Установлено, что заключение воды между тонкими пленками (пластинами) или в
пределах цилиндрических пор [21], а также применение внешнего давления [22,23],
электрических полей [24-26], приводит к перестройке сетки водородных связей и
при определенных условиях происходит фазовый переход между различными
агрегатными состояниями воды. Особое место здесь занимает явление
кристаллизации, составляющее основу многих природных и технологических
процессов. Так, например, глобальные природные и климатические изменения
связаны с процессами электрокристаллизации водяных капель в атмосфере Земли.
Процесс электрокристаллизации, пожалуй, в моделировании является одним из
основных при исследовании фазовых переходов в молекулярных системах. Так,
кристаллизация переохлажденной воды индуцируемая внешним электрическим полем
была изучена в работе [27]. Результаты исследования структурных трансформаций в
водяных каплях при наличии внешних электрических полей были представлены в
статье [28]. В работе [29] было изучено влияние электрических полей на
диэлектрические свойства воды, расположенной между двумя пластинами серебра.
Недавно в работе [24] была представлена фазовая диаграмма для воды, находящейся
под действием внешнего электрического поля. Несмотря, на большое количество
теоретических и молекулярно-динамических исследований в этом направлении,
вопросы, связанные с динамикой сетки водородных связей при
электрокристаллизации воды остаются невыясненными до сих пор. В данной работе с
помощью метода неравновесной молекулярной динамики исследуется межмолекулярная
динамика в процессе структурного упорядочения в воде, заключенной между
замороженными углеродными слоями.
Детали моделирования
Моделирование было выполнено в NpT-ансамбле при температуре T=280 K и электрическом поле с
напряженностью E=0.0÷2.0
В/Å
для области значений
давления p=0.0÷10.0
ГПа. Система состояла из
5742 атомов, из которых 576 атомов углерода, приходящихся на один графеновый
слой, и 1530 молекул воды. Взаимодействие между молекулами воды осуществлялось
с помощью модифицированного SPC/E потенциала с гибкими валентными
связями [30]. Взаимодействие между атомами углерода и молекулами воды
осуществлялось на основе электростатического потенциала и слабого
Ван-дер-Ваальсова взаимодействия [31]. Для учета последнего использовался
потенциал Леннарда-Джонса, параметры которого (глубина потенциальной ямы и
среднее межатомарное расстояние) определялись правилами смешения
Бертло-Лоренца. Для упрощения задачи и ускорения молекулярно-динамических
расчетов была рассмотрена система с так называемыми «замороженными стенками», в
которой взаимодействия между атомами углерода в графеновом слое не учитывались.
Во избежание поверхностных и конечно-размерных эффектов использовались
периодические граничные условия, наложенные по всем направлениям.
Интегрирование уравнений движения было выполнено на основе алгоритма Верле в
скоростной форме с временным шагом 0.5 фс. Однородное стационарное
электростатическое поле было приложено перпендикулярно графеновым слоям вдоль
оси z.
Результаты и выводы
На рис. 3.3.1. представлены мгновенные конфигурации системы при различных
термодинамических условиях. В качестве начальной конфигурации водной подсистемы
был взят кристаллический лед с гексагональной структурой при температуре T=0.0 K и внешнем давлении p=0.0 Па (см. рис. 3.3.1.а). Нагревание и плавление льда осуществлялось с
помощью термостата Берендсена в течение 50000 временных шагов. На рис. 3.3.1.б
и 3.3.1.в показаны мгновенные конфигурации системы при температуре T=280K и давлениях p=0.0
Па и p=1.0 ГПа, соответственно.


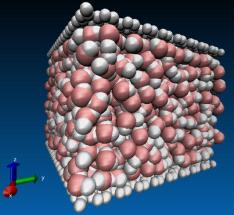
Рис. 3.3.1. Динамика сетки водородных связей при
электрокристаллизации воды.
Исследование
равновесных структурных свойств воды было выполнено на основе анализа
парциальных компонент радиальной функции распределения частиц 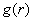 [32]:
[32]:
 , (30)
, (30)
где
 - концентрация атомов, компоненты
- концентрация атомов, компоненты 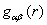 определяются соотношениями
определяются соотношениями
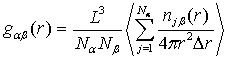 ,
,  . (31)
. (31)
Здесь
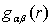 - вероятность расположения атома в диапазоне от r до
r+Δr,
L - длина ребра моделируемой ячейки. Nα и Nβ число атомов типа α и β
соответственно. Величина njβ(r) определяет число β-частиц в сферическом слое толщиной Δr на расстоянии r от j-ой частицы.
- вероятность расположения атома в диапазоне от r до
r+Δr,
L - длина ребра моделируемой ячейки. Nα и Nβ число атомов типа α и β
соответственно. Величина njβ(r) определяет число β-частиц в сферическом слое толщиной Δr на расстоянии r от j-ой частицы.

Рис.
3.3.2. Динамика сетки водородных связей при электрокристаллизации воды.
На
рис. 3.3.2. представлены парциальные составляющие радиальной функции
распределения атомов для широкой области значений давления p=0.0÷1.0 ГПа при температуре T=280 K в отсутствии внешнего
электрического поля. Из анализа графиков видно, что с увеличением давления
поведение радиальных функций распределений претерпевает ряд существенных
изменений: в функции  наблюдается увеличение интенсивности первого пика и
расщепление второго на два подпика. Данные особенности указывают на процессы
стеклования в воде и переход системы из жидкого состояния в аморфную фазу
[33,34], в то время как, в отсутствии графеновых стенок вода при таких
давлениях лишь переходит в состояние с высокой плотностью [22,23]. В функции
распределения для атомов углерода и кислорода с увеличением давления
наблюдается лишь появление дополнительных пиков, что указывает на возникновение
некоторой упорядоченности молекул воды в приграничном слое вблизи графеновых
стенок.
наблюдается увеличение интенсивности первого пика и
расщепление второго на два подпика. Данные особенности указывают на процессы
стеклования в воде и переход системы из жидкого состояния в аморфную фазу
[33,34], в то время как, в отсутствии графеновых стенок вода при таких
давлениях лишь переходит в состояние с высокой плотностью [22,23]. В функции
распределения для атомов углерода и кислорода с увеличением давления
наблюдается лишь появление дополнительных пиков, что указывает на возникновение
некоторой упорядоченности молекул воды в приграничном слое вблизи графеновых
стенок.
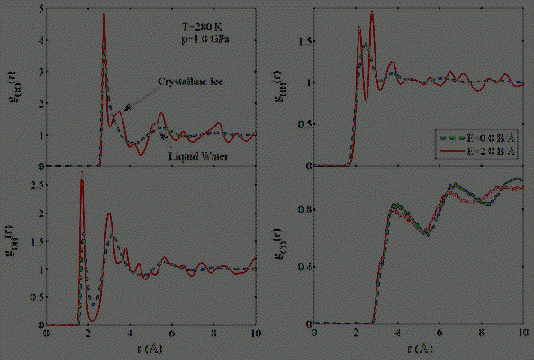
Рис.
3.3.3. Динамика сетки водородных связей при электрокристаллизации воды.
Для
дальнейшего анализа процессов локального упорядочения мы приложили на систему
внешнее стационарное электрическое поле. Значение напряженности
электростатического поля изменялось в диапазоне E=0.0÷2.0 В/Å. На
рис. 3.3.3. представлены парциальные составляющие радиальной функции
распределения атомов для исследуемой системы при температуре T=280
K и давлении p=1.0 ГПа при отсутствии и
наличии внешнего электростатического поля напряженностью E=2.0
В/Å.
Из рисунка видно, что наличие внешнего
электрического поля приводит к заметным изменениям в структуре парциальных
компонент радиальной функции распределения атомов. А именно, изменение
интенсивности и появление дополнительных пиков на больших расстояниях, что
свойственно кристаллическим телам [20]. Таким образом, наложение внешнего стационарного
электрического поля приводит к кристаллизации воды при температуре выше
температуры фазового перехода. На сегодняшний день установлено, что фазовая
диаграмма воды содержит по крайней мере 15 различных модификаций
кристаллических структур [23]. Для определения к какому типу кристаллического
льда относится полученная система, нами был выполнен расчет параметра
глобального ориентационного порядка Q6 [35]:
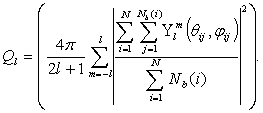 (32)
(32)
Здесь Ylm(θij,φij) - сферические гармоники, θij - полярный угол, φij - азимутальный угол. Nb -
число частиц соседствующих с i-той частицей. Под ближайшим окружением будем
понимать лишь те частицы, которые располагаются внутри сферы радиусом,
соответствующему первому минимуму в радиальной функции распределения. Для
различных атомарных кристаллических структур значение параметра Q6 принимает различные величины (так, например, для
простой кубической решетки Q6=0.3536, для ГЦК-решетки Q6=0.5745, для гексагональной плотноупакованной
структуры Q6=0.4848 [35]). Для воды и аморфного льда значение
параметра Q6 принимает величину, близкую к нулю, для кубического и
гексагонального льда принимает значение Q6=0.51 и 0.44, соответственно.
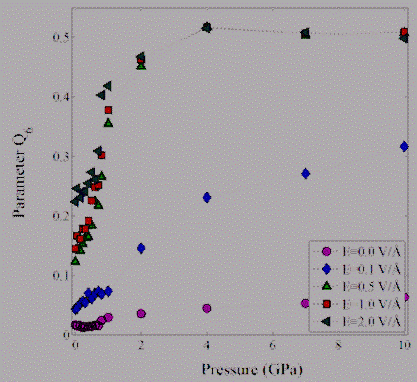
Рис. 3.3.4. Динамика сетки водородных связей при электрокристаллизации
воды.
На рис. 3.3.4 представлена зависимость параметра ориентационного порядка
от давления для воды, заключенной между графеновыми слоями. Из рисунка видно,
что с увеличением внешнего электрического поля при давлении p=4.0 ГПа значение глобального
параметра порядка Q6 принимает величину близкой к 0.51,
что указывает на кристаллизацию воды в лед с кубической структурой [20], в то
время как, при отсутствии электрического поля система остается в
неупорядоченном состоянии на временном масштабе моделирования. Полученные
результаты хорошо согласуются с результатами работ [24-26] по
электрокристаллизации чистой воды.
Для определения степени влияния электростатического поля на
межмолекулярную динамику воды мы выполнили анализ временной эволюции сетки
водородных связей (ВС). В рамках компьютерного моделирования для идентификации
молекул, связанных водородной связью используют специальные критерии ВС.
Принципиально они делятся на два типа: энергетические и геометрические [36]. В
первом случае молекулы считаются связанными ВС, если их суммарная потенциальная
энергия меньше некоторого порогового значения. В случае геометрического
критерия учитываются расстояния и углы между молекулами:
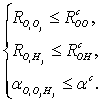 (32)
(32)
Пороговые
значения расстояний, как правило, подбирают исходя из первых минимумов
соответствующих парциальных радиальных функций распределений; значение 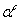 обычно не превышает 30о [36]. Основной
характеристикой, с помощью которой можно оценить динамическое поведение сетки
ВС, является ее среднее время жизни (существования). Детальное обсуждение о
распределении времени жизни ВС в компьютерных моделях воды можно найти в работе
[37].
обычно не превышает 30о [36]. Основной
характеристикой, с помощью которой можно оценить динамическое поведение сетки
ВС, является ее среднее время жизни (существования). Детальное обсуждение о
распределении времени жизни ВС в компьютерных моделях воды можно найти в работе
[37].
В
молекулярно-динамических исследованиях обычно различают два типа времени жизни
водородной связи [37] - непрерывное и мерцающее. Непрерывное время жизни длится
до первого нарушения в данном димере выбранного критерия водородной связи. Если
данная связь разорвалась, а потом восстановилась, то она рассматривается как новая
вне зависимости от периода разрыва. Мерцающее время жизни водородной связи
длится до тех пор, пока один из участников ВС не найдет себе партнера для
образования новой связи. В этом случае промежуточные нарушения критерия
существования связи не учитываются вне зависимости от их длительности. В данной
работе для исследования динамики водородных связей рассматривалось лишь
непрерывное время жизни ВС. Методика определения среднего времени существования
ВС представлена во вставке к рис. 3.3.5.
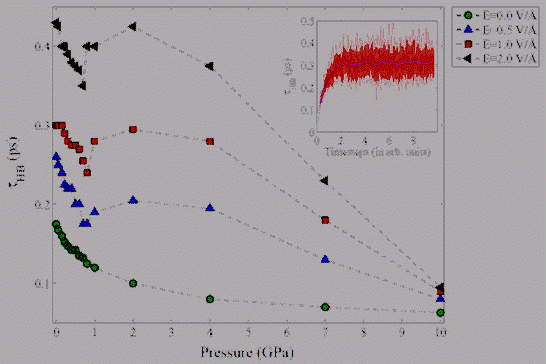
Рис.
3.3.5. Динамика сетки водородных связей при электрокристаллизации воды.
Усреднение
проводилось по временным итерациям и по 100 независимым выборкам. На рис.
3.3.5. изображена зависимость непрерывного времени жизни ВС  от давления при различных значениях напряженности
электрического поля. Из рисунка видно, что в отсутствии внешнего
электростатического поля зависимость
от давления при различных значениях напряженности
электрического поля. Из рисунка видно, что в отсутствии внешнего
электростатического поля зависимость  от
давления имеет вид монотонно-спадающей функции, в то время как при наложении
электрического поля приводит к сингулярному поведению при давлении p=1.0
ГПа. Такое поведение времени существования ВС обусловлено фазовым переходом при
электрокристаллизации воды. Также из рисунка видно, что дальнейшее увеличение
давления вне зависимости от величины приложенного электрического поля приводит
к заметному уменьшению среднего времени жизни ВС. Отчасти это обуславливается
возможным ограничением в использовании геометрического критерия ВС при
сверхвысоких давлениях. К сожалению, прямых экспериментальных методов
определения времени жизни водородных связей пока не существует, поэтому вопросы
связанные с определением границ применимости различных критериев водородных
связей остаются открытыми.
от
давления имеет вид монотонно-спадающей функции, в то время как при наложении
электрического поля приводит к сингулярному поведению при давлении p=1.0
ГПа. Такое поведение времени существования ВС обусловлено фазовым переходом при
электрокристаллизации воды. Также из рисунка видно, что дальнейшее увеличение
давления вне зависимости от величины приложенного электрического поля приводит
к заметному уменьшению среднего времени жизни ВС. Отчасти это обуславливается
возможным ограничением в использовании геометрического критерия ВС при
сверхвысоких давлениях. К сожалению, прямых экспериментальных методов
определения времени жизни водородных связей пока не существует, поэтому вопросы
связанные с определением границ применимости различных критериев водородных
связей остаются открытыми.
ЗАКЛЮЧЕНИЕ
ПО ГЛАВЕ III
В
работе представлены результаты компьютерного моделирования молекулярной
динамики воды под давлением, заключенной между замороженными графеновыми
плоскостями. На основе анализа структурных характеристик было установлено, что
замороженные графеновые стенки существенно изменяют фазовую диаграмму воды.
На
основе выполненного исследования можно сделать следующие выводы:
Ø Установлено, что увеличение давления, оказываемого на
систему, приводит к процессу стеклования воды.
Ø При температуре T=280 K и давлении p=1.0 ГПа вода из жидкого состояния переходит в аморфное
состояние.
Ø В работе показано, что увеличение давления при внешнем
электрическом поле ускоряет кристаллизацию воды.
Ø Показано, что при электрокристаллизации воды существенно
изменяется динамика сетка водородных связей.
Литература
[1]
F.H. Stillinger, A. Rahman, J. Chem. Phys. 57, 1281 (1972).
[2]
A. Luzar, D. Chandler, J. Chem. Phys. 98, 8160 (1993).
[3]
A. Kalinichev, J. Bass, Chem. Phys. Lett. 231, 301 (1994).
[4]
E. B. Moore, V. Moliner, J. Chem. Phys. 130, 244505 (2009).
[5] Белая
М.Л., Левадный В.Г. Молекулярная структура воды. М.: Знание 1987. - 46 с.
[6] Бернал
Дж. Д. Геометрия построек из молекул воды. Успехи химии, 1956, т. 25, с.
643-660.
[7] Бульенков
Н.А. О возможной роли гидратации как ведущего интеграционного фактора в
организации биосистем на разных уровнях их иерархии. Биофизика, 1991, т.36,
в.2, с.181-243.
[8] Зацепина
Т.Н. Свойства и структура воды. М.: изд-во МГУ, 1974, - 280 с.
[9] Аберухин
Ю.И. Структурные модели жидкости. М.: Наука. 1981 - 185 с.
[10]
Chaplin, Martin. Amorphous Ice and Glassy Water. Water Structure and Science
(2008).
[11]
J.L.F. Abascal, C. Vega, J. Chem. Phys. 123, 234505 (2005).
[12]
H.L. Pi, J.L. Aragones, C. Vega, E.G. Noya, J.L.F. Abascal, M.A. Gonzalez and
C. McBride, Mol. Phys. 107, 365 (2009).
[13]
J.P. Ryckaert, G. Ciccotti, and H. J. C. Berendsen, J. Comput. Phys. 23, 327 (1977).
[15]
R.M. Khusnutdinoff, A.V. Mokshin, Bull. Russ. Acad. Sci. Phys. 74, 640 (2010).
[16]
H.R. Wendt and F.F. Abraham, Phys. Rev. Lett.41, 1244 (1978).
[17]
J. Martı, J. Chem. Phys. 110, 6876
(1999).
[18]
P. Ren, J.W. Ponder, J. Phys. Chem. B 107, 5933(2003).
[19]Садыкова
Р.Р. Динамика сетки водородных связей, Всероссийская конференция «Необратимые
процессы в природе и технике», Москва, МГТУ им. Баумана, 2013 .
[20]
Желиговская Е.А., Маленков Г.Г. // Успехи химии. 2006. Т.75. С. 64.
[21]
Koga K., Zeng X.C., Tanaka H. // Phys. Rev. Lett. 1997. V. 79. P. 5262.
[22]
Khusnutdinoff R.M., Mokshin A.V. // J. Non-Cryst. Solids. 2011. V. 357. P 1677.
[23]
Khusnutdinoff R.M., Mokshin A.V. // Physica A. 2012 V. 391. P. 2842.
[24]
Aragones J.L., MacDowell L.G., Siepmann J.I., Vega C. // Phys. Rev. Lett. 2011.
V. 107. P. 155702.
[25]
Yan J.Y., Patey G.N. // J. Phys. Chem. Lett. 2011. V. 2. P. 2555.
[26]
Svishchev I.M., Kusalik P.G. // J. Ann. Chem. Soc. 1996. V. 118. P. 649.
[27]
Braslavsky I., Lipson S.G. // Appl. Phys. Lett. 1998. V. 72. P. 264.
[28]
Vegiri A., Shevkunov S.V. // J. Chem. Phys. 2001. V. 115. P. 4175.
[29]
Yeh I.C., Berkowitz M.L. // J. Chem. Phys. 1999. V. 111. P. 3155.
[30]
Zhang X., Liu Q., Zhu A. // Fluid Phase Equil. 2007. V. 262. P. 210.
[31]
Werder T., Walther J.H., Jaffe R.L., Halicioglu T., Koumoutsakos P. // J. Phys.
Chem. B. 2003. V. 107. P. 1345.
[32] Мокшин
А.В., Юльметьев Р.М., Хуснутдинов Р.М., Хангги П. // Химиче-ская физика. 2007.
Т. 26. С. 5.
[33]Саркисов
Г.Н. // УФН. 2002. Т. 172. С. 647.
[34]Мокшин
А.В., Юльметьев Р.М., Хуснутдинов Р.М., Хангги П. // Физика твердого тела. 2006. Т. 48. С. 1662.
[35]Steinhardt
P.J., Nelson D.R., Ronchetti M. // Phys. Rev. B. 1983. V. 28. P. 2.
[36]
Swiatla-Wojcik D. // Chem. Phys. 2007. V. 342. P.
260.
[37]Волошин
В.П., Наберухин Ю.И. // Журн. структур. химии. 2009. Т. 50. С. 84.